UNIVERSITA’ DEGLI STUDI DI CATANIA
Scuola Interuniversitaria Siciliana per la
specializzazione all’insegnamento nelle scuole secondarie
═════════════════════════════════════
Costa Pietro
&
Aranzulla Massimo
La temperatura
come grandezza di stato e
la calorimetria
TESINA
Corso di
Fondamenti di Fisica I
Prof. V. Bellini
══════════════════════════════════════════════════
ANNO ACCADEMICO 2006 – 2007
Prerequisiti
¾ Concetto di gas ideale e leggi dei gas
¾ Gas reale
¾ Energia cinetica
Questa tesina è stata pensata come una possibile lezione rivolta a studenti del
primo biennio di un istituto tecnico/linguistico o scientifico sperimentale.
Bibliografia
Si è anche pensato di inserire in tal punto la bibliografia per dar modo allo
studente di poter avere sempre sotto controllo i libri/materiali utilizzati per un
eventuale riscontro oltre che per un auspicabile approfondimento sempre utile
nell’intenzione di appropriarsi dell’argomento “termodinamica” da ogni possibile
angolazione e punto di vista.
1. D. Halliday, R. Resnick, K.S. Krane, Fisica 1, Casa Editrice Ambrosiana
2. D.U. Roller, R. Blum, Termodinamica, Vol. 1, Ed. Zanichelli
3. M.W. Zemanski, Calore e Termodinamica, Ed. Zanichelli
4. U. Amaldi, L’Amaldi, Introduzione alla Fisica , Ed. Zanichelli
5. Nobel P., Fisica, Ed. Ferraro
6. Rosati S., Fisica Generale, Ed Casa Ambrosiana
7. Einstein A.,Infeld L., L'evoluzione della fisica, Boringhieri
8. AA.VV.Storia della scienza, Nuova Scienza Laterza (1969)
9. Nuove proposte didattiche sullo studio della termodinamica, Prof. Graziella
Bucci e Prof. Silvana von Arx (Istituto Tecnico Industriale di Pozzuoli)
2
INDICE
1. Scelta didattica
2. Termometria
2.1. Cenni storici
2.2. Cenni di studio di un sistema termodinamico
2.3. La temperatura e il calore
2.4.
2.5.
.
.
.
.
Equilibrio termico, Principio zero della Termodinamica
La Dilatazione termica
a) La Dilatazione lineare di un solido
b) La Dilatazione volumica dei solidi e (c) dei liquidi
d) Il comportamento anomalo dell’acqua
2.6.
2.7.
2.8.
e) La Dilatazione dei gas
Esempi ed esercizi sulla dilatazione termica
Criteri termometrici
Misura della temperatura
Scale termometriche
2.9.
Caratteristiche dei termometri
2.10. Il punto triplo dell’acqua, lo zero assoluto e il Kelvin
2.11. Termometri a gas a volume costante
2.12. Termometri
Appendice
3. Calorimetria
3.1.
3.2.
Il calore e la storia
Il calore è una forma di energia
3.3.
3.4.
Temperatura di equilibrio
Il calore specifico
3.5. Come si misura il calore specifico?
3.5.1. Il calorimetro di Regnault
3.5.2. Il calorimetro di Bunsen
3.5.3. Il calorimetro di Lavoiser-Laplace
3.6. Calore specifico e dipendenza dalla temperatura
3.7.
Passaggi di fase e calore latente
3
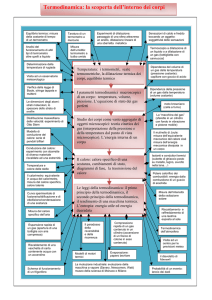
1. Scelta Didattica
Il lavoro che viene presentato è un esempio di unità didattica in cui sono
utilizzate diverse tecniche didattiche (teoria classica, manipolazione sperimentale,
approccio storico–epistemologico), che facilitano il processo di insegnamento apprendimento, focalizzando l'attenzione sui concetti chiave della termodinamica.
La scelta didattica è per tutte quelle attività che diano spazio ai vari modi di
comprensione e permettano il superamento delle dissonanze tra pre-concezioni e
modelli di scienza accreditata.
Particolare importanza viene attribuita all'attività sperimentale, intesa come
struttura portante di ogni formalizzazione.
Dopo un momento in cui l'allievo deve riequilibrare le conoscenze pregresse
con i suoi nuovi saperi, si innesca un processo creativo: l'allievo non solo sarà capace
di proporre nuove situazioni problematiche e ipotizzarne le soluzioni ma anche,
impadronitosi del modello formale, di utilizzarlo in altre situazioni. Questa creatività
favorisce anche la condivisione e lo scambio delle modalità conoscitive tra i soggetti
del gruppo, accomunati dalla stessa età scolare, dal livello di sviluppo delle strutture
cognitive e soprattutto da relazioni affettive e dalla voglia di gioco.
Tutta questa fase didattica è sostenuta da una prospettiva storica che ha,
secondo me, la valenza insostituibile di mostrare, nel vivo, la complessità
dell'evoluzione delle idee della fisica e di far riconoscere all'allievo il proprio
processo evolutivo di conoscenza in quello storico del genere umano.
Dopo un momento iniziale di discussione esplorativa sulla situazione
problematica proposta, necessario oltretutto per mettere in evidenza le preconcezioni
individuali, segue una parte teorico-pratica in cui sono enumerate le possibili
applicazioni (i vari termometri e calorimetri) che conducono alla teoria sulla
termodinamica ed infine una leggera riflessione finale, nella quale si consente una
rilettura ed una reinterpretazione del fenomeno studiato.
4
2. Termometria
2.1. Cenni storici
La nascita della termodinamica, così come oggi la si intende, si può far risalire
alla prima metà del secolo XIX. In realtà la termodinamica affonda le sue radici
nell'antichità e soprattutto nelle ricerche, intorno al calore, che hanno tenuto occupati
filosofi e fisici.
Lo studio di alcuni fenomeni legati al calore risale all’epoca degli antichi greci
che ne interpretavano il “passaggio” da un corpo ad un altro come una manifestazione
dovuta all’agitazione del moto molecolare.
Questa teoria, benché vicina alla realtà, fu però quasi soffocata da quella del
calorico sul finire del 1600.
Sentiamo cosa dice Einstein al proposito:
"Prendiamo due corpi, uno caldo e l'altro freddo o più esattamente, uno a
temperatura più elevata dell'altro. Poniamoli a contatto, tenendoli al riparo da ogni
influenza esteriore. Presto o tardi avranno entrambi la stessa temperatura. Ma in che
modo ciò si produce? Viene spontaneo di figurarsi il "flusso" di calore da un corpo ad
un altro, come il flusso dell'acqua da un livello superiore ad uno inferiore........Così
concepito il calore ci appare come una sostanza, al pari della massa in meccanica. La
quantità di calore può variare o no, come danaro che venga speso o rimanga in
cassaforte. Finché la cassaforte rimane chiusa a chiave il danaro ripostovi non varia,
così come non variano né la massa né il calore in un corpo isolato. Il thermos ideale è
analoga ad una cassaforte chiusa........
Tuttavia il calore non è certamente una sostanza nello stesso senso della massa.
La massa si può determinare per mezzo di bilance. Ma il calore? Un pezzo di ferro
pesa forse più quando è rovente, di quando è ghiaccio? L'esperienza prova che no.
Ammesso dunque che il calore sia una sostanza, questa dovrà essere imponderabile.
5
Il calore sostanza, che ricevette il nome di "calorico", è la nostra prima
conoscenza in seno a tutta una famiglia di sostanze imponderabili........"
Veniva così postulata l’esistenza in ciascun corpo di questo fluido invisibile, il
calorico appunto, che non poteva essere né creato né distrutto ma si limitava a
scorrere dai corpi a temperatura più elevata a quelli a temperatura inferiore; godeva
quindi della proprietà di essere imponderabile, diffuso in tutta la materia e capace di
penetrare nei corpi e combinarsi con essi.
La teoria del calorico fu in grado di spiegare in modo soddisfacente molti
processi, ma l’idea che il calorico fosse una sostanza il cui ammontare rimaneva
costante non resse fino in fondo alla falsificazione sperimentale.
Sempre da Einstein:
"Prove capaci di decidere sulla vita o la morte di una teoria si presentano
spesso nella storia della fisica e si chiamano esperimenti cruciali. La determinazione
dei calori specifici di due corpi della stessa specie, aventi temperature uguali,
prodotte rispettivamente da frizione e da flusso di calore (da una sorgente) è
l'esempio tipico di un esperimento cruciale". Tale esperimento fu eseguito da
Benjamin Thompson, conte di Rumford, ed inferse un colpo mortale alla teoria della
"sostanza calore" e solo nella seconda metà del XIX secolo si sviluppò il concetto
meccanico moderno del calore con gli esperimenti fatti da James Joule.
2.2. Cenni di studio di un sistema termodinamico
Secondo i principi dettati dal Metodo Scientifico Sperimentale di Galileo,
adottato come il metodo migliore per studiare i fenomeni naturali, per la soluzione di
qualunque problema reale si deve necessariamente cominciare con l’astrazione del
problema, separando una regione di spazio limitata, ovvero una quantità di materia
finita, da tutto ciò che la circonda per ricondurre il problema stesso all’essenziale.
Questa parte che viene (idealmente) isolata e su cui si concentra l’attenzione viene
detta sistema.
6
La parte di materia che intendiamo studiare è quindi detta sistema
termodinamico ed è separata mediante una superficie chiusa, detta confine, dal resto
dello spazio, detto ambiente circostante. Il sistema interagisce con l’ambiente. Il
confine del sistema può essere fisso o mobile, può consentire il passaggio di massa.
In questo caso il sistema termodinamico è detto aperto, mentre se il confine non
lascia passare massa il sistema è detto chiuso. Considereremo sistemi chiusi. Un
sistema è detto isolato se tra il sistema e l’ambiente non avvengono scambi nè di
energia nè di materia (termicamente e meccanicamente isolato).
Per descrivere il sistema termodinamico così definito, si possono utilizzare due
punti di vista, quello macroscopico e quello microscopico.
La descrizione macroscopica fa uso di poche coordinate (volume, massa,
temperatura, pressione) che non implicano alcuna ipotesi sulla struttura della materia;
sono inoltre percepite dai nostri sensi e possono essere misurate direttamente.
Per dare invece una descrizione microscopica di un sistema, occorre fare delle
ipotesi sulla struttura della materia, precisare il valore di grandezze che spesso non
possono essere misurate (ma non saranno oggetto di studio della tesina).
I sistemi di cui si occupa la termodinamica sono sistemi che si trovano in stati
di equilibrio.
Si dice che un sistema è in uno stato di equilibrio termodinamico, se si
verificano contemporaneamente i tre seguenti tipi di equilibrio:
equilibrio meccanico, cioè non esistono forze non equilibrate né all’interno del
sistema né agenti dall’esterno sul sistema;
equilibrio chimico, cioè non si verificano reazioni chimiche né spostamenti di
materia (soluzioni, diffusioni) all’interno del sistema;
equilibrio termico, cioè tutte le parti del sistema, che possono scambiare calore
tra loro, hanno la stessa temperatura che è anche la temperatura dell’ambiente esterno
se le pareti del contenitore permettono scambi di calore tra il sistema e l’esterno.
In particolare due corpi si trovano in equilibrio termico quando le loro
temperature sono uguali.
7
2.3. La temperatura e il calore
I termini caldo, freddo, calore, temperatura appartengono al linguaggio
comune; però molto spesso gli ultimi due vengono usati in modo non corretto.
Se tocchiamo una sbarra di ferro che sia stata lungamente esposta al Sole,
avvertiamo una sensazone detta caldo. È corretto dire che la temperatura della mano
è inferiore a quella del ferro e che la mano, sottraendo calore al ferro, si riscalda.
Se invece tocchiamo un pezzo di ghiaccio, avvertiamo una sensazione di freddo.
È corretto dire che la temperatura della mano è superiore a quella del ghiaccio e che
la mano, cedendo calore al ghiaccio, ne scioglie una parte e si raffredda.
Le sensazioni di caldo e di freddo sono soggettive e relative. Quante volte
l'acqua del rubinetto ci è sembrata calda dopo essere stati fuori a fare a pallate con la
neve, mentre ci è sembrata fredda in estate? E ancora: è pensabile che un eschimese e
un congolese si trovino d'accordo nel dire che a Roma fa caldo?
Capita di sentir dire che un corpo ha molto calore, volendo con ciò significare
che, se si tocca il corpo, si avverte una sensazione di caldo. Ciò è errato, mentre è
giusto dire che il corpo ha una elevata temperatura.
I concetti di temperatura e di calore sono diversi tra loro, anche se sono legati
da determinate relazioni che vedremo in seguito.
La temperatura, con una immagine presa a prestito dalla meccanica dei fluidi,
viene anche detta livello termico. Infatti la temperatura di un corpo può anche essere
considerata come la misura della sua attitudine a cedere o ad assorbire calore (che è
8
solo una forma di energia)(Energia Termica), così come il livello di un liquido dice
se parte di esso può passare spontaneamente in un altro recipiente, oppure se altro
liquido (a livello più alto) può aggiungersi spontaneamente al primo.
2.4. Equilibrio termico, Principio zero della Termodinamica
Come abbiamo da poco affermato, la sensazione di caldo e di freddo che
avvertiamo con i nostri sensi tattili è soggettiva: toccando un pezzo di ferro si ha una
sensazione di freddo, mentre un pezzo di legno nello stesso ambiente ci sembra più
caldo. Anche se questo modo è stato ed è il primo e più immediato strumento per
poter classificare la temperatura di un corpo, esso è troppo grossolano e, dato che è
soggettivo, poco veritiero ed obiettivo.
Realizziamo un esperimento: disponiamo tre
recipienti sul banco come in figura.
Il primo contiene acqua fredda, il secondo
acqua tiepida ed il terzo acqua calda; immergiamo
la mano sinistra nell'acqua fredda e la destra in
quella calda e dopo qualche minuto immettiamo le
due mani contemporaneamente nell'acqua tiepida.
Quali sensazioni proverà sulle due mani?
Anche questa volta sembra che i nostri sensi ci ingannino: la temperatura della
bacinella centrale è certamente la stessa!
Il nostro giudizio sulla temperatura di un corpo può essere piuttosto errato e
inoltre si potrà giudicare solo su un piccolo intervallo di temperature.
È quindi ovvio che ci occorre, per valutare obiettivamente una temperatura,
una misura oggettiva e preferibilmente numerica, quello che definiamo termometro.
Ripetiamo allora l'esperienza immergendo tre termometri nelle bacinelle.
Dopo circa due minuti recuperiamo i due sensori posti rispettivamente
nell'acqua calda e fredda ed immergiamoli nell'acqua tiepida.
9
Registriamo per pochi minuti la temperatura e tracciamo poi un grafico (t, T)
dove si evidenzia che le temperature delle due bacinelle “esterne” convergono, dopo
un tempo sufficientemente lungo, verso la stessa temperatura della bacinella“tiepida”.
In realtà però i nostri sensi ci ingannano ma non troppo; essi ci danno
un'informazione ulteriore rispetto al sensore: essi ci dicono, infatti, che la mano
destra si sta raffreddando mentre la sinistra si sta riscaldando; rendono conto, cioè,
della diversa interazione tra le mani e l'acqua.
Le mani raggiungono la stessa temperatura dell'acqua tiepida mentre il calore
fluisce dalla mano destra all'acqua e dall'acqua alla mano sinistra.
Anche le mani quindi “convergono”, dopo un tempo sufficientemente lungo,
verso la temperatura della bacinella “tiepida”, dando così la stessa sensazione
termica.
Possiamo dimostrare la medesima “sensazione” con un altro esperimento.
Sia A un oggetto che al tatto sembra freddo e B un altro che sembra caldo:
poniamo questi due oggetti a contatto, si avrà un flusso di calore. Dopo un tempo
relativamente lungo sia A che B daranno origine alla stessa sensazione termica.
Si dirà allora che sia A che B sono in equilibrio termico tra loro.
Quindi, dati due sistemi A e B, per verificare se essi sono in equilibrio termico,
si pongono a contatto e si osservano le eventuali variazioni nel tempo delle grandezze
macroscopiche dei sistemi. Se ciò non si verifica, si può concludere che i due sistemi
erano già in equilibrio.
10
Quando un corpo caldo viene messo a contatto con un corpo freddo, del calore
fluisce dal corpo caldo verso quello freddo, aumentando la sua energia, sino a
raggiungere l’equilibrio termico.
Si può generalizzare il concetto di equilibrio termico per corpi che non si
trovino a diretto contatto. Per provare se due sistemi lontani sono in equilibrio
termico, è opportuno utilizzare un terzo sistema C. Ponendo C a contatto prima con A
e poi con B, è possibile determinare se A e B sono in equilibrio termico, senza porli
direttamente a contatto.
Tale proprietà può essere generalizzata con un postulato, detto
Principio zero della Termodinamica:
«se due sistemi A e B sono ciascuno in equilibrio termico con un terzo sistema C,
allora A e B sono in equilibrio termico tra loro».
O molto più semplicemente: “due corpi messi a contatto tra loro tendono a
raggiungere la stessa temperatura (equilibrio termico)”.
Quando due sistemi sono in equilibrio termico, si dice che essi hanno la stessa
temperatura; è proprio questa grandezza che ha lo stesso valore in due sistemi
all’equilibrio termico.
11
Nell’applicazione del Principio zero della Termodinamica si identifica il
sistema C con un termometro; se esso, in equilibrio termico separatamente con i
sistemi A e B indica la stessa temperatura per i due sistemi, si può affermare che A e
B sono in equilibrio termico tra loro e pertanto devono avere la stessa temperatura.
Riformuliamo quindi il Principio zero della Termodinamica in tal modo:
«esiste una grandezza scalare, chiamata temperatura, che caratterizza tutti i sistemi
termodinamici in equilibrio. Due sistemi sono in equilibrio termico tra loro se e solo
se le temperature hanno lo stesso valore».
Il Principio zero definisce quindi la temperatura come quella grandezza
macroscopica di un sistema che è uguale a quella di ogni sistema in equilibrio
termico con esso. Tale principio permette di costruire ed usare termometri per la
misura delle temperature; infatti, da esso si deduce che un termometro ed un sistema
termodinamico in equilibrio termico con esso hanno la stessa temperatura.
2.5. Dilatazione termica
Gli effetti più comuni che accompagnano una variazione di temperatura sono la
variazione di dimensioni e i cambiamenti di stato dei materiali. Tralasciamo questi
ultimi per concentrarci sulla variazione di dimensioni: può essere lineare e/o cubica,
secondo che l’alterazione sia più evidente in una dimensione lineare o “nello spazio”.
Il volume di un corpo può essere variato, anche mantenendo costante la
pressione esterna, se il corpo viene avvicinato ad una fiamma o, più in generale, se
viene messo a contatto con un altro corpo più caldo o più freddo del precedente.
Un
esempio
è
dato
dall’anello
di
Gravesande costituito da una sferetta metallica e
da un anello attraverso cui dovrebbe passare la
sfera.
12
La sferetta della fig. a, se è a temperatura ambiente, passa agevolmente
attraverso il foro praticato nel telaietto metallico. Se invece viene preventivamente
riscaldata alla fiamma del gas, si osserva che non passa più (fig. b).
L'esperienza dice quindi che il volume di un corpo varia al variare della
temperatura. Generalmente esso aumenta se aumenta la temperatura; però vi sono
delle eccezioni, tra le quali è ben nota quella dell'acqua, la quale infatti, passando da
0°C a 4°C, diminuisce di volume anziché aumentare.
Il fenomeno considerato prende il nome di dilatazione termica e si verifica per
tutti i corpi, con variazioni (positive o negative) di volume più o meno apprezzabili.
a) Dilatazione lineare dei solidi
Se consideriamo corpi di forma allungata, la dilatazione termica è sensibile
soprattutto nel senso della lunghezza, mentre risulta trascurabile nelle altre due
direzioni. In questo caso si parla di dilatazione lineare.
Le variazioni di lunghezza originate da variazioni di temperatura si possono
osservare con il dilatometro. Una barra sottile, fatta del materiale che si vuole
esaminare è collegata a un indice mobile.
Riscaldando la barra, questa si allunga e spinge l'indice su una scala graduata;
possiamo così misurare l’allungamento della sbarra in funzione della temperatura.
Esperienze eseguite con diversi materiali mostrano che per tutti i solidi
l’allungamento termico avviene secondo una stessa legge:
Legge della dilatazione lineare:
Un'asta di una determinata sostanza, sottoposta
a variazioni di temperatura, subisce variazioni di lunghezza direttamente
proporzionali alla lunghezza iniziale e alle variazioni di temperatura.
13
L'espressione matematica di tale legge è la seguente:
l-l o =
λ
l o ( t-t 0 )
(*)
La costante di proporzionalità λ è detta coefficiente lineare; il suo valore
dipende della natura della sostanza ed esprime la variazione di lunghezza che subisce
un 'asta lunga 1 m quando la temperatura varia di 1 °C.
Il calcolo della lunghezza finale lt ; è molto semplice; infatti, se l0 è la
lunghezza dell'asta a 0°C e lt , quella a t°C, risultando t - t0 = t, la relazione (*) può
anche essere scritta nel modo seguente:
l t = l o (1+
λ
t)
Se disegnamo il grafico di questa legge in un
piano lunghezza-temperatura, si ottiene una retta.
Poiché la pendenza di una retta non cambia da punto
a punto, rimane costante il rapporto tra la variazione
di lunghezza e la corrispondente variazione di
temperatura; ciò vuol dire che l’allungamento della
sbarra è direttamente proporzionale.
Le dilatazioni lineari non sono affatto trascurabili.
Si noti, per esempio, che tra un’asta e l'altra dei
binari ferroviari vengo lasciati dei piccoli spazi vuoti,
proprio per consentire la dilatazione termica.
TABELLA Coefficienti di dilatazione lineare
Sostanza
Gomma
Piombo
Stagno
Alluminio
Argento
Rame
λ
-6
80·10
29·10-6
27·10-6
23·10-6
19·10-6
17·10-6
Sostanza
Oro
Nichel
Ferro
Platino
Vetro
Porcellana
λ
14·10-6
13·10-6
12·10-6
9·10-6
8 ·10-6
3·10-6
14
b) Dilatazione cubica dei solidi
Se un corpo è omogeneo e isotropo, cioè se le sue proprietà sono le stesse in
tutte le direzioni, le variazioni di volume conseguenti a variazioni di temperatura
sono espresse da una relazione analoga a quella della dilatazione lineare.
Dato V0 il volume di un corpo a 0°C e V, quello a t°C, vale la relazione:
V t = V o (1+ k t )
(#)
La costante k, detta coefficiente di dilatazione cubica, esprime la variazione di
volume che subisce un corpo di 1 m3 quando la temperatura varia di 1°C.
Il valore di k è, con buona approssimazione, uguale al triplo del valore di per
λ
la stessa sostanza, cioè:
k = 3λ
Per esempio, per il ferro il coefficiente di dilatazione lineare è λ = 12·10-6K-1 e
il coefficiente di dilatazione volumica è k = 36 ·10-6 K-1.
( La spiegazione del motivo per cui k = 3 λ , è rimandata in appendice per
eventuale approfondimento, qui evitato per motivi di continuità logica ).
c) Dilatazione dei liquidi
Per i liquidi vale la stessa legge valida per i solidi (#), ma con un valore di k
che, come mostra la tabella sottostante, è da 10 a 100 volte maggiore di quello
relativo ai solidi. Per esempio, il coefficiente di dilatazione volumica dell'olio d'oliva,
k = 0,72 ·10-3 K-1, è quasi 30 volte maggiore di quello del vetro. Ciò spiega perché
una damigiana d'olio, se riempita troppo, nelle giornate calde può traboccare.
La determinazione sperimentale della dilatazione termica di un liquido richiede
una particolare attenzione, dato che, se si vuole riscaldare il liquido, si deve riscaldare
anche il recipiente che lo contiene, il quale subisce una certa dilatazione.
TABELLA Coefficienti di dilatazione cubica di alcuni liquidi
Sostanza
k
Sostanza
-5
Glicerina 52·10
Petrolio
-5
Mercurio 18·10
Olio d'oliva
-4
Alcool et. 11 ·10
Acqua
k
9·10-4
7·10-4
5·10-4
15
d) Il comportamento anomalo dell'acqua.
L'acqua si comporta in modo diverso dagli altri liquidi.
Da 0°C (quando il ghiaccio si scioglie) a 4 °C il suo volume, invece di aumentare, diminuisce. Dopo i 4 °C il volume aumenta in modo regolare.
Questo comportamento anomalo spiega perche d'inverno i laghi gelano in
superfìcie, mentre al di sotto l'acqua rimane liquida. Cosi i pesci riescono a
sopravvivere anche in climi molto rigidi.
Quando la temperatura esterna si abbassa, l'acqua più calda che si trova in
superficie comincia a raffreddarsi.
In questo modo la temperatura media dell'acqua diminuisce e il processo
continua fino a quando tutta l'acqua raggiunge la temperatura di 4 °C.
Per l’aria fredda, la temperatura dello strato in superfìcie continua a diminuire.
Poiché l'acqua da 4 °C a 0 °C, invece di concentrarsi, si dilata si crea nei laghi
uno strato di ghiaccio che protegge la vita della fauna acquatica.
16
e) Dilatazione dei gas (termometri a pressione costante)
Anche i gas, se sono mantenuti ad una pressione costante, aumentano di
volume seguendo la stessa legge sperimentale di dilatazione dei solidi e dei liquidi
(#):
V t = V o (1+ k t )
con V0 il volume di una determinata quantità di gas a 0°C e Vt quello a t°C.
Per controllare la pressione si può mettere il gas in un recipiente chiuso da un
pistone mobile su cui sono appoggiate delle masse (senza aggiungerle o toglierle per
mantenere tutto costante). Riscaldando il gas a pressione costante si osserva che il
pistone sale in modo da seguire la legge espressa dalla’equazione (#).
Questa legge è anche una forma della prima legge di Gay-Lussac e vale per
tutti i gas a condizione che siano rarefatti (a bassa densità) (l’argomento delle leggi
sui gas perfetti è stato già discusso e quindi non lo riprenderemo).
Così come per i solidi e i liquidi il coefficiente di dilatazione varia secondo la
sostanza ma l’esperienza mostra che, al tendere della pressione a zero, k è uguale per
tutti i gas e vale k = 1 / (273.15 °C).
Questa importante proprietà viene utilizzata nei termometri a gas (lo vedremo a
breve nel paragrafo 2.10). Le indicazioni fornite da termometri diverse sono sempre
le stesse e non dipendono dal gas usato.
. Esercizio – Esempio sulla dilatazione termica
Ponti e viadotti autostradali sono divisi in settori, detti “campate”.
Supponiamo che, tra estate e inverno, si registri una variazione max di temperatura di
60°C. La campata in cemento, nel giorno più freddo dell’anno, è lunga l0 = 80 m.
Qual è il suo allungamento massimo, dovuto alla dilatazione termica, in estate?
Dati: l - l0 = ?; l0= 80 m;
( t-t 0 )= 60°C;
Soluzione: l - l0 = λ l o ( t-t 0 ) = (1,4 ·10
-5
λ = 1,4 ·10
-5
1/°C ;
1/°C) · (80m) · (60°C)= 0,067 m
cioè si verifica un allungamento di circa 7 cm (ecco perché
come accorgimenti sono pressenti degli “spazi”, dei giunti tra
una campata e l’altra).
17
. Esempi reali sulla dilatazione
Gli ingegneri che progettano ponti metallici devono tener conto del fenomeno
della dilatazione termica dei materiali; per esempio un ponte metallico lungo 200
metri, che si trova in una località in cui la temperatura passa da -30 °C in inverno a
+40 °C in estate, subisce nel corso delle stagioni un allungamento di 15cm. Per
evitare che le strutture si deformino, molti ponti metallici non sono fissati
rigidamente alle estremità. Sono invece posti su speciali rulli (resistenti alla pressione
e agli sbalzi termici) in modo da poter scorrere quando la loro lunghezza varia.
Le sezioni sopraelevate degli oleodotti sono disposti a zig-zag per permettere la
dilatazione dei tubi provocate dagli sbalzi termici… l’Alaska Pipeline, lungo poco
più dell’Italia attraversa tre catene di montagne e centinaia tra fiumi e ruscelli
passando da temperature molto basse ad alte nel giro di pochi mesi. Inoltre oltre
all’escursione termica ambientale c’è anche quella dovuta al greggio che vi scorre, la
cui temperatura va dal gelo dei terreni circostanti e dei corsi d’acqua fino a 65°-70°C
e ciò causa ulteriore dilatazione sui tubi. Un oleodotto diritto si deformerebbe, non
avendo la flessibilità necessaria per assorbire tali variazioni, invece una struttura a
zig-zag permette una grande mobilità per cui i segmenti possono muoversi e
cambiare in continuazione secondo la temperatura senza disagi o “catastrofici” effetti.
Con lo stesso metodo sono costruiti gasdotti e acquedotti con i dovuti
accorgimenti per il materiale trasportato.
Un esperimento simpatico sugli effetti della dilatazione lo si può effettuare su
un contenitore che non riusciamo ad aprire; per svitare il coperchio metallico, lo si
pone sotto un getto d’acqua calda per farlo dilatare leggermente e cosi svitare il
barattolo senza eccessivi sforzi.
Infine i binari, le autostrade o i cavalcavia sono costruiti in “campate” cioè
divisi in settori con spazi tra loro proprio per evitare il sovrapporsi della loro struttura
e conseguente deformazione.
18
2.6. Criteri termometrici: termoscopi.
Per il momento limitandoci alle variazioni di volume dei liquidi, vediamo come
si realizza un dispositivo con il quale sia possibile confrontare le temperature, cioè un
termoscopio.
Il termoscopio è un recipiente chiuso da un tappo forato in cui è infìlato un
tubicino trasparente; dentro vi è dell'olio o mercurio. Il mercurio è un'ottima sostanza
termometrica, perché è molto sensibile alle variazioni di temperatura, dilatandosi e
contraendosi in modo abbastanza facilmente misurabile. In certi casi è però
preferibile usare alcool etilico o olio, che solidificano più difficilmente del mercurio.
Se immergiamo il bulbo in un vaso contenente acqua calda, l'acqua cede calore
al mercurio, il quale aumenta di volume e sale nel cannello, stabilizzandosi dopo un
certo tempo su un livello h1. Lo stabilizzarsi del livello indica che acqua e mercurio
hanno raggiunto l’equilibrio termico, cioè la stessa temperatura.
Se togliamo il termoscopio dall'acqua calda e lo mettiamo in frigorifero (non
però nel congelatore, altrimenti si rischia la solidificazione) o in una vaschetta a
temperatura diversa (consideriamola inferiore), il mercurio cede calore all'ambiente e
il suo volume si contrae, finché, raggiunto l'equilibrio termico con l'ambiente, si
stabilizza su un livello h2 (che in questo caso avrà un altezza minore di h1).
Il confronto tra temperature si può ricondurre al confronto tra livelli del
mercurio nel cannello del termoscopio
Se il livello dell'olio è più alto che nel primo esperimento, diciamo che la
temperatura della seconda vaschetta è maggiore di quella della prima (vedi figura).
Per sapere di quanto una temperatura è maggiore dell'altra, dobbiamo
introdurre una scala graduata, cioè tarare il termoscopio.
19
2.7. Misura della temperatura
L'esperienza sopra descritta suggerisce come operare per la misurazione degli
intervalli di temperatura.
Infatti è possibile trasformare il termoscopio in termometro: basta scegliere dei
punti termici ben definiti e attribuire a ciascuno di essi un determinato valore.
I punti termici fissi normalmente usati sono il punto di fusione e quello di
ebollizione dell'acqua distillata a pressione atmosferica normale, pari a 1,01 * 105 Pa.
La loro determinazione è molto semplice: si immerge il bulbo in un vaso con del
ghiaccio fondente, si attende che il livello del mercurio si stabilizzi e, in
corrispondenza di esso, si segna sull'esterno del cannello una tacca di riferimento.
Si toglie il bulbo dal ghiaccio fondente e lo si mette sopra ai vapori dell'acqua
bollente. Il mercurio sale nel cannello e si stabilizza su un certo livello, in
corrispondenza del quale si fa un altro segno.
per convenzione stabiliamo la corrispondenza:
0° C
(0 gradi Celsius)
Æ
100°C (100 gradi Celsius) Æ
temperatura del ghiaccio fondente.
temperatura dell'acqua bollente.
2.8. Scale Termometriche
La scala Celsius è ottenuta dividendo in cento parti uguali il segmento
delimitato dai due livelli segnati in precedenza, infatti il Grado Celsius (°C) è un
intervallo di temperatura pari alla centesima parte della differenza tra la temperatura
dei vapori dell'acqua bollente e quella del ghiaccio fondente (a pressione atmosferica
normale). È questa la scala termometrica più usata. La scala termometrica può essere
estesa anche alle temperature negative e a quelle maggiori di 100 °C.
20
Scala Rèaumur - In corrispondenza del livello minimo (a 0°C) si segna il
valore zero e in corrispondenza del livello massimo il valore 80. L'intervallo viene
diviso in 80 parli uguali, ognuna delle quali è un grado Rèaumur (°R).
Scala Fahrenheit - attribuisce i valori 32 e 212 alle temperature corrispondenti
ai due punti fissi già definiti; L'intervallo viene diviso in 180 parti uguali, ognuna
delle quali è un grado Fahrenheit ( °F ).
Ad una stessa temperatura corrispondono diversi valori nelle scale; indicando con
C, R ed F tali valori, si hanno le seguenti uguaglianze che permettono
l’immediata conversione da una scala all’altra:
C
R ( F − 32 )
=
=
100 80
180
Scala Kelvin (o scala assoluta) - Le suddivisioni hanno la stessa ampiezza della
scala Celsius. Lo zero della scala Kelvin corrisponde a circa - 273 °C (esattamente
-273.16 °C); è questo lo zero assoluto. È quindi chiaro che, per giungere il punto
minimo (lo 0°C), si devono risalire circa 273 divisioni della scala, per cui a tale punto
corrisponde il valore 273.16 K. Al punto massimo corrisponde il valore 373.16 K.
Quindi è chiaro che K = °C + 273,16 o °C = K - 273,16 (vedi figura).
Il K è l'unità di misura delle temperature nel sistema S.I.
21
2.9. Il punto triplo dell’acqua, lo zero assoluto e il Kelvin
Per tarare facilmente in un laboratorio un termometro sono stati scelti due punti
fissi che si possono fisicamente riprodurre in modo estremamente semplice: il punto
di fusione e quello di ebollizione dell'acqua distillata a pressione atmosferica normale.
In realtà però per ottenere una misura campione internazionale a cui tutti i
termometri devono indicare la stessa temperatura è stato adottato per convenzione un
unico punto fisso: il punto triplo dell’acqua. Rappresenta lo stato termico in cui
coesistono in equilibrio la fase solida (ghiaccio), liquida (acqua) e gassosa (vapore).
Un tale stato può essere ottenuto solo ad una pressione ben definita ed è unico:
la pressione del vapore acqueo al punto triplo è di 4,58 mmHg.
Il punto triplo dell’acqua NON coincide col punto fisso del ghiaccio fondente
perché questo si realizza sotto la pressione atmosferica (1 atm di aria).
Per raggiungere il punto triplo si usa un recipiente
chiuso a forma di U, con acqua distillata, da cui è stata
aspirata tutta l’aria; con una miscela frigorifera si fa
formare uno strato di ghiaccio entro il recipiente e si
pone un termometro nella cavità, a contatto del
recipiente: il sistema così è alla temperatura del punto
triplo dell’acqua finchè
le tre fasi solida, liquida e
aeriforme coesistono in equilibrio.
La temperatura a tale punto campione per convenzione è stata fissata in 273,16
gradi kelvin (Ttr = 273.16 K); successivamente il nome kelvin ha sostituito il grado
kelvin e l’unita di temperatura internazionale termodinamica è stata così definita:
il kelvin (K) è l’unità fondamentale di temperatura nel sistema S.I., basata
sulla scala assoluta, che coincide con la scala delle temperature del gas ideale ed è
la frazione 1/273.16 della temperatura del punto triplo dell’acqua.
La temperatura assoluta è una scala naturale: infatti, gli esperimenti mostrano
che non è possibile raffreddare un corpo alla temperatura 0K (lo zero assoluto).
22
Partendo dalla 1a legge di Gay–Lussac, già discussa per i gas perfetti, :
Infatti, il rapporto generico tra due temperature, misurate con lo stesso
termometro è dato dal rapporto fra i corrispondenti valori delle proprietà X (proprietà
su cui si vuole basare una scala di temperature):
T(X1) X1
=
T (X 2 ) X 2
tale rapporto se si considera come una delle due temperature, quella del punto triplo,
diviene:
T ( X ) = (273.16 K )
X
X tr
(*)
equazione che è valida per tutti i termometri e per tutte le proprietà, secondo la
particolare scala termometrica scelta; infatti nel caso di un termometro a colonna
liquida, X sarà la Lunghezza/altezza della colonna e la formula (*) sarà la (1); per un
gas a pressione costante, X corrisponderà al Volume del gas e viceversa (per un gas a
volume costante, X sarà la Pressione)(2 e 3); nel caso di un termometro a resistenza
elettrica, la proprietà equivale a R (resistenza) e cosi via…
T ( X ) = (273.16 K )
L
(1);
Ltr
T (V ) = (273.16 K )
V
(2);
Vtr
T ( P) = ( 273.16 K )
P
(3)…
Ptr
Ovviamente per facilitare la calibrazione degli strumenti scientifici ed
industriali è stata adottata una scala internazionale di temperature che coinvolgono
termometri ad hoc per determinate temperature, anche se per valori standard
(compresi tra 3K e ~25000K) si utilizza come campione un termometro a gas a
volume costante.
23
2.10. Termometri a gas a volume costante
Consideriamo le proprietà di un termometro a gas a volume costante: se il
volume del gas è mantenuto costante, la pressione dipende solo dalla temperatura e
cresce linearmente con essa (PV=nRT) . Quindi, il termometro a gas a volume
costante usa come proprietà termometrica la pressione di un gas a volume costante.
Esso consiste di un bulbo di vetro collegato, tramite un
bulbo capillare, ad un manometro a mercurio. Il bulbo contenente
il gas è immerso nell’ambiente del quale si vuole misurare la
temperatura T; alzando o abbassando il recipiente R, si fa
coincidere il livello del mercurio nel ramo sinistro della U con un
riferimento fissato, per mantenere costante il volume del gas.
La differenza tra la pressione p del gas sul ramo sinistro
del tubo e la pressione atmosferica p0 sul ramo destro è misurata
dall’altezza h della colonna di mercurio:
p = p0 – ρgh
dove ρ è la densità del mercurio nel manometro.
Indicando quindi con p la pressione assoluta alla temperatura del bagno, allora
si trova la temperatura (per V costante): T(p) = (273.16 K) p/ptr
Il termometro a gas a volume costante è considerato come strumento campione
per il fatto che, per il suo funzionamento, non si deve ricorrere a nessuna proprietà
specifica del materiale utilizzato: con qualunque gas si ottiene il medesimo risultato.
Infatti, eseguendo una serie di misure con termometri contenenti diversi tipi di
gas e a pressioni diverse, si osserva che quando la pressione iniziale p0 del gas tende
a zero, la temperatura tende a un valore indipendente da particolare tipo di gas
impiegato.
24
2.11. Caratteristiche dei termometri
Prontezza
Un termometro è pronto se, messo in un certo ambiente, ne segna rapidamente
la temperatura. Una tale caratteristica si realizza con bulbi molto piccoli, in modo che
il liquido termometrico impieghi poco tempo o un tempo ragionevolmente breve a
mettersi in equilibrio termico con l'ambiente in cui trova.
Sensibilità
La sensibilità di misura di un termometro è la più piccola variazione di
temperatura che lo strumento è in grado di misurare. In pratica corrisponde al più
piccolo intervallo di scala. Un termometro è sensibile se sulla sua scala si possono
leggere frazioni anche molto piccole della temperatura.
E’ evidente che prontezza e sensibilità non sono attuabili in uno stesso termometro.
Precisione
La precisione è misurata dalla differenza tra la temperatura indicata e la
temperatura effettiva. In genere i termometri di media e di grande qualità sono
assoggettati a una taratura individuale per tracciare una scala più accurata possibile,
ma tale condizione non si mantiene nel tempo, soprattutto per deformazioni di altre
parti componenti. I termometri di precisione necessitano di frequenti controlli.
Termometri a massima e a minima
In certi casi, per esempio in meteorologia e in medicina, può essere utile
conoscere i valori massimi e minimi raggiunti dalla temperatura.
A tale scopo si usano dei termometri nei quali un
indice, posto dentro un cannello, si arresta in corrispondenza
della più bassa temperatura raggiunta (termometri a minima),
o di quella più alta (termometri a massima).
Il termometro clinico è un termometro a massima, nel
quale il liquido si arresta al più alto livello raggiunto; infatti,
dopo misurata la febbre, è necessario scaricarlo agitandolo
fortemente.
a) Termometro a 3 scale (°R , °C e K);
b) Termometro a massima e minima
25
2.12. Tabella riassuntiva delle caratteristiche dei termometri:
Riassumiamo le principali tipologie di termometri menzionati nei paragrafi; di
alcuni non è possibile studiarne i comportamenti perché non sono argomento del
corso, quali i termometri elettrici o paramagnetici che sfruttano caratteristiche proprie
dei materiali di composizione al passare della corrente elettrica o del campo
magnetico al variare della temperatura o altri.
I termometri a dilatazione sono basati, come nel caso del termoscopio a
mercurio, sulla dilatazione termica di sostanze aeriformi, liquide e solide. Il
termometro a lamina bimetallica, infatti, utilizza la deformazione che una lamina
bimetallica subisce al variare della temperatura per effetto della diversa dilatazione
dei due metalli che costituiscono la lamina. Idem per i termometri a solido, costituiti
da due strisce di metalli diversi, con diversi λ , saldati fra loro a formare una spirale,
collegata ad un indice rotante che segna la variazione di temperatura.
Tipi di
Termometri
Termometri a
dilatazione
Sottotipi
Elementi costituenti
a gas
a lamina
bimetallica
aeriformi
Invar - ottone e
leghe di nichel
differenti liquidi
a mercurio
meteorologia
a alcole
a toluene
a pentano
a gallio
due metalli con
differenti coeff. di
dilatazione termica
diff. leghe-metalli
a liquido
a solido
a resistenza
Termometri
elettrici
a termocoppia
termistore
carbone amorfo
diff. leghe-metalli
rame-costantana
platino-platino e
rodio
ferro-costantana
tungsteno-tungsteno
e rodio oppure
iridio-iridio rutenio
semiconduttore
T Min [°C]
T Max [°C]
Dipende dalla sostanza
∆T
-
-170
+450
-
-180
-39
-10
-100
-100
-200
+40
+650
+300/600
+40
+40
+100
+20
+1700
-
-50
+500
-
-200
+1000
0,5°C
1°K
-200
-200
2°K
+2000
+400
10-7 K
-
-
~ +1500
-
0
+800
-
-
+2000
-
0,1°K
+2000
10-4 °C
26
Atri tipi di termometri: termometri speciali
clinico
a mercurio
paramagnetico
nitrato di cerio e magnesio
a risonanza
nucleare
vari tipi di sali
clorato di potassio
pirometro
ottico
a radiazione
totale
non solo nella
finestra del visibile
a radiazione
parziale
solo nella finestra
del visibile
+35
~ 0°K
+42
1°K
4×10-3 K
300°K
0.05°K
0.02°K
> 10°K
15°K
~ 1000°C
1500
0,1°C
~1,1%
3000
~10%
Appendice
Derivazione della legge della dilatazione volumica (k = 3 λ )
Consideriamo un parallelepipedo omogeneo i cui spigoli, a 0°C, si misurano in
a0, b0 e c 0. In tali condizioni, il volume del parallelepipedo è uguale arodotto dei lati
V0= a0 b0 c0 . Alla temperatura t la lunghezza del primo spigolo (per esempio la
lunghezza), diviene per la legge di dilatazione lineare at = a o (1+ λ t ) dove λ è il
coefficiente di dilatazione lineare del materiale di cui il parallelepipedo è composto.
Formule analoghe valgono anche per b e c, le lunghezze degli altri due spigoli.
Ora siamo in grado di calcolare il volume Vt del parallelelpipedo alla temperatura t :
Vt= a b c= a o (1+ λ t ) · b o (1+ λ t ) · c o (1+ λ t )= a0 b0 c0 (1+ λ t ) 3
Si riconosce subito che il prodotto a0 b0 c0 è il volume V0 del
parallelepipedo a temperatura 0°C. Sviluppando il cubo del binomio, si ottiene :
Vt= V0 [1+3 λ t+3( λ t) 2 +( λ t) 3 ]
Questa formula può essere semplificata. In effetti, in tutte le situazioni pratiche
il valore λ t è molto molto piccolo (rispetto a 1 a cui va sommato). Ciò significa che i
due termini ( λ t) 2 +( λ t) 3 sono ancora più piccolie, quindi, possono essere
trascurati.
In conclusione, la legge che descrive (con la precisione richiesta)
la dilatazione di un solido è:
Vt= V0 (1+k t)
che si riduce alla forma
Vt= V0 (1+3 λ t) ponendo k=3 λ .
27