Processi ossido-riduttivi chimici ed elettrochimici
Le reazioni ossidoriduttive comportano la variazione dello stato di ossidazione di almeno un
elemento in seguito alla conversione dei reagenti nei prodotti di reazione, e comportano il
trasferimento di elettroni da una sostanza riducente, Rid2, a una ossidante, Oss1:
a Oss1 + b Rid2 ⇄ c Rid1 + d Oss2
Una reazione redox decorre per via chimica quando gli elettroni vengono trasferiti direttamente
dal riducente all’ossidante:
MnO4- + 5 Fe2+ + 8 H3O+ = Mn2+ + 5 Fe3+ + 12 H2O
Una reazione redox ha la caratteristica di poter avvenire anche mantenendo i reagenti fisicamente
separati, purché un conduttore metallico trasporti gli elettroni dal riducente all’ossidante.
Semireazione di riduzione:
a Oss1 + n e- ⇄ c Rid1
Semireazione di ossidazione:
b Rid2
REAZIONE GLOBALE:
a Oss1 + b Rid2
⇄ d Oss2 + n e⇄ c Rid1 + d Oss2
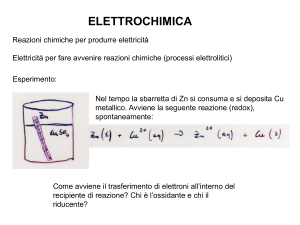
La cella Daniell a zinco-rame
Per esempio la reazione: Zn(s) + CuSO4 = ZnSO4 + Cu(s)
può essere condotta in un dispositivo elettrochimico in cui le due coppie redox Zn/Zn2+
e Cu/Cu2+ vengono tenute separate in due semielementi o semicelle
Celle galvaniche
Quando la conduzione elettronica ed elettrolitica sono operanti, si osserva un flusso di elettroni nella
direzione che va dall’elettrodo a Zn(s)/Zn2+ (nel quale avviene l’ossidazione: ANODO)
all’elettrodo a Cu(s)/Cu2+ (nel quale avviene la riduzione: CATODO)
Questo dispositivo elettrochimico è un elemento galvanico o cella galvanica, o semplicemente pila.
La differenza di potenziale esistente tra i due elettrodi di una cella galvanica ne costituisce la
forza elettromotrice, FEM o Efem, e viene misurata in volt
FEM = Ecatodo – Eanodo = E+ - EIl passaggio di corrente elettrica che si instaura tra i due elettrodi di una pila comporta
l’erogazione di una quantità di energia elettrica (wel ) che è data dal prodotto della forza
elettromotrice per la quantità di elettricità fluita:
wel = q · Efem = q · (E+ -E-) = n·F·(E+ -E-)
in cui il prodotto nF rappresenta le moli di elettroni fluite (1 mole di elettroni corrisponde a
96485 C, ossia un faraday di elettricità (simbolo F).
n è il numero di elettroni scambiati nella reazione redox
Cella rame -argento
In una cella voltaica il comportamento da anodo o da catodo di un particolare elettrodo dipende
da qual è l’altro elettrodo della cella
Per esempio l’elettrodo a Cu(0)/Cu(II), che funzionava da catodo quando era accoppiato
all’elettrodi a Zn(0)/Zn(II), funzione da anodo quando è accoppiato con l’elettrodo a Ag(0)/Ag(I)
Cu(s) + Ag+(aq) → Cu2+(aq) + Ag(s)
Il rame agisce da riducente nei confronti
dello ione Ag+
Nella cella Daniell era lo zinco che agiva
da riducente nei confronti di Cu2+
Equazione di Nerst
Per una generica semireazione:
a Oss + n e- ⇄ b Rid
Il potenziale di elettrodo di una semicella formata da una coppia Oss-Rid, EOss/Rid,
nella quale la specie ridotta è il prodotto della semireazione (come scritto sopra),
prende il nome di potenziale di riduzione (o potenziale redox).
Esso è definito dall’equazione:
E Oss/Rid = E°Oss/Rid + RT/nF • ln(aOss )a / (aRid)b = E° + 0,059/n log(aOss)a/(aRid)b
Il termine E°Oss/Rid rappresenta il potenziale di riduzione della coppia ossido-riduttiva
quando tutte le specie coinvolte nella semireazione hanno attività unitaria e viene chiamato
potenziale standard di riduzione o potenziale standard
L’attività di un gas è funzione della sua pressione parziale. Se questa non è molto alta,
l’attività del gas coincide numericamente con la pressione parziale
I solidi puri hanno attività unitaria.
L’attività di un soluto coincide con la concentrazione molare se la soluzione è diluita
Elettrodo standard ad idrogeno
Il valore del potenziale di riduzione di un
elettrodo è definito in una scala il cui
valore zero è convenzionalmente
assegnato al potenziale di riduzione di un
elettrodo di riferimento.
Per convenzione internazionale
all’elettrodo standard ad idrogeno viene
arbitrariamente assegnato un potenziale
esatto di zero volt a qualsiasi temperatura
E’ formato da una lamina di platino
spugnoso immersa in una soluzione di
ioni idrogeno ad attività unitaria e lambita
da idrogeno gassoso, fatto gorgogliare
nella soluzione alla pressione di 1 atm
La reazione chimica che avviene reversibilmente è:
2 H3O+ + 2 e- ⇄ H2(g) + 2 H2O
La cella zinco-elettrodo standard ad idrogeno
Nella pila formata dall’accoppiamento di un elettrodo di Zn immerso in una soluzione
1 M di ioni Zn2+, accoppiato con l’elettrodo standard a idrogeno, si osserva la
spontanea ossidazione dello zinco e la riduzione di H3O+ (ovvero l’elettrodo standard
a H agisce da catodo):
Zn(s) + 2 H3O+ → Zn2+ + H2 (g) + 2 H2O
E fem = E+ - E- = 0, 763 V = E°(H3O+/H2) - E°(Zn2+/Zn(s))
E° (Zn2+/Zn) = - 0,763 V
La cella rame –elettrodo standard ad idrogeno
In questa cella, l’elettrodo standard a idrogeno funziona come anodo e quindi
l’idrogeno si ossida:
H2(g) + 2 H2O + Cu2+
→
2 H3O+ + Cu(s)
E fem = E+ - E- = 0, 337 V = E°(Cu2+/Cu) – E°(H3O+/H2)
E° (Cu2+/Cu) = + 0,337 V
Potenziali standard (a 25 °C)
La serie elettrochimica
Le semireazioni definite da ciascuna coppia ossido-riduttiva sono sistemate in ordine
crescente dei valori dei loro potenziali standard di riduzione. Questa sequenza è nota
come serie elettrochimica
Quanto più elevata è la posizione della specie al primo membro di un’equazione riportata
nella tabella dei potenziali redox, tanto maggiore è il suo potere ossidante.
F2 è l’ossidante più forte che si conosca
Quanto più basso è il potenziale standard, tanto maggiore è il potere riducente della
specie ridotta che figura al secondo membro dell’equazione riportata nella tabella dei
potenziali standard.
Il litio metallico è il riducente più forte che si conosca
Relazione fra E° di una pila e costante di equilibrio
Una reazione di cella che in condizioni standard è spontanea (cioè la costante di
equilibrio, K >1) deve avere E°>0
E° è positivo quando E°catodo> E° anodo
nFE° = RT ln K
Bilanciare la reazione:
log(K) = nE°/0,0592 a 25 °C
S4O62- + Cr2+ ⇄ Cr3+ + S2O32-
e calcolare la sua costante di equilibrio sapendo che:
S4O62- + 2e- ⇄ 2 S2O32- E° = 0,17 V
Cr3+ + e- ⇄ Cr2+ E° = - 0,50 V
La reazione di cella è:
S4O62- + 2 Cr2+ ⇄ 2 Cr3+ + 2S2O32-
E°cella = E°catodo – E°anodo = 0,17 V – (- 0,50 V) = 0,67 V
log (K) = 2(0,67)/0,0592 = 22,6
K = 1022,6 = 4·1022
Previsione sul decorso delle reazioni redox
Quando due coppie redox, aventi potenziali di riduzione differenti, sono poste in una
stessa soluzione, la specie ossidata della coppia con potenziale di riduzione più alto
agisce da ossidante sulla specie ridotta dell’altra coppia.
Si consideri la reazione:
a Oss1 + b Rid2
E le semireazioni che la costituiscono: :
a Oss1 + n eb Rid2
⇄ c Rid1 + d Oss2
⇄ c Rid1
⇄ d Oss2 + n e-
La reazione avviene spontaneamente da sinistra a destra se il potenziale di riduzione della
coppia Oss1/Rid 1 è maggiore di quello della coppia Oss2/Rid2
Per esempio, la reazione (in condizioni standard):
2Cl-(aq) + Br2(l) → 2 Br- + Cl2 (aq)
non avviene spontaneamente come scritta perché Br2 è un ossidante più debole di Cl2.
Essendo E°(Cl2/Cl- = + 1,36 V) maggiore di E°(Br2/Br = + 1,08), la reazione che avviene
spontaneamente è:
Cl2 + 2Br- → Br2 + 2Cl-
Celle a concentrazione
Si può costruire una pila anche usando due elettrodi costituiti da una stessa coppia
redox, purché siano differenti le concentrazioni nelle due semicelle delle specie
chimiche coinvolte nella semireazione
La semicella in cui c’è la concentrazione di Cu2+ più grande funzionerà da catodo
Efem = E+ - E- = 0,0592/2 log (C1/C2) = 0,030 V
Schema di cella a combustibile idrogeno/ossigeno
Celle a combustibile
Le celle a combustibile usate nelle navette spaziali sono unità indipendenti. Ognuna misura
14x15x45” e pesa 260 libbre e sono alimentate da H2 e O2 provenienti da serbatoi criogenici
Ogni cella a combustibile può fornire 12 kW continuamente.
L’acqua prodotta può essere usata per bere
Celle a combustibile
Le celle a combustibile sono celle voltaiche nelle quali i reagenti sono forniti
continuamente alla cella ed i prodotti sono continuamente rimossi
L’idrogeno (il combustibile) viene fornito al compartimento anodico. L’ossigeno viene
alimentato nel comportamento catodico.
L’ossigeno viene ridotto al catodo, costituito da grafite porosa impregnata con Pt
finemente suddiviso che funziona da catalizzatore:
4 OH-
Reazione catodica: O2 + 2 H2O + 4e
Gli ioni OH- migrano all’anodo attraverso l’elettrolita, costituito da una soluzione
acquosa di una base (KOH)
Anche l’anodo è costituito da grafite porosa, che contiene una piccola quantità di
catalizzatore (Pt, Ag o CoO).
Reazione anodica: H2 + 2 OH-
• La reazione complessiva è:
2 H2O + 2 e
2H2 + O2
2 H2O
Il rendimento delle celle a combustibile nella conversione di energia è il 60-70% del valore massimo teorico
La conduzione elettrica
La corrente elettrica è un trasferimento di carica
La carica elettrica può essere trasportata attraverso i metalli (conduttori di I specie:
conduzione metallica e implica un flusso di elettroni) oppure gli elettroliti liquidi puri
(elettroliti fusi) o le soluzioni contenenti elettroliti: conduzione ionica o elettrolitica e
implica movimento di ioni
Il movimento di ioni attraverso una soluzione costituisce una corrente elettrica: gli
ioni positivi migrano verso l’elettrodo negativo, mentre gli ioni negativi migrano
verso l’elettrodo positivo
Elettrolita è una sostanza le cui soluzioni acquose conducono l’elettricità
Celle elettrolitiche
•
Nelle celle elettrolitiche l’energia elettrica fornita da una sorgente esterna fa
avvenire delle reazioni chimiche non spontanee
Gli elettrodi sono superfici solide sulle quali avvengono semireazioni di
ossidazione o riduzione. Il catodo è definito l’elettrodo sul quale avviene la
riduzione. All’anodo avviene la ossidazione
Elettrolisi di NaCl in soluzione acquosa
•
Applicando un voltaggio sufficientemente alto agli elettrodi avvengono le seguenti
trasformazioni:ad un elettrodo si sviluppa idrogeno, all’altro elettrodo si sviluppa cloro
Reazione globale: 2 H2O + 2 NaCl → 2 NaOH + H2 + Cl2
2 H2O + 2 Cl- → 2 OH- + H2 + Cl2
Elettrolisi del solfato di sodio in soluzione acquosa
•
Al catodo si sviluppa idrogeno, all’anodo si sviluppa ossigeno
L’elettrolisi di una soluzione acquosa di Na2SO4 produce H2 al catodo e O2 all’anodo
In presenza dell’indicatore blu di bromotimolo la soluzione assume una colorazione blu
in ambiente basico e giallo in ambiente acido
Legge di Faraday (1791-1867)
La quantità di sostanza che subisce ossidazione o riduzione a ciascun elettrodo durante
l’elettrolisi è direttamente proporzionale alla quantità di elettricità che passa attraverso la cella
Una unità di elettricità è chiamata faraday: 1 faraday è la quantità di elettricità che
corrisponde all’acquisto o alla perdita (e quindi al passaggio) di 6,022x1023 elettroni
(1 mole di elettroni)
Una unità elettrica più piccola è il coulomb (C)
1 coulomb è definito come la quantità di carica che passa per un determinato
punto quando 1 ampere (A) di corrente elettrica fluisce per 1 secondo
1 A = 1 C/s
1 faraday 6,022x1023 e = 96485 C