http://www.hackmed.org
[email protected]
1
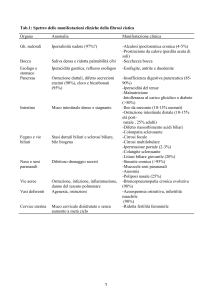
Approccio al paziente con malattia epatica
La valutazione di pochi semplici aspetti deve aiutare il clinico a orientarsi sulle diverse possibili affezioni
(epatocellulari o colestatiche) e sulla gravità del danno.
Anamnesi: un dolore importante riferito all’ipocondrio SX e disturbi digestivi pregressi orienta verso una
patologia delle vie biliari, mentre un disturbo vago e persistente, mal definito suggerisce una malattia
epatocellulare o infiltrativa associate ad epatomegalia che distende la glissoniana. Altri dati importanti sono
la presenza di prurito, ittero, anoressia e febbre, tendenza al facile sanguinamento e confusione mentale.
Da tenere in considerazione anche la presenza in famiglia di casi analoghi o l’esposizione nel lavoro ad
agenti ritenuti epatotossici come il cloruro di vinile, il berillio e il tetracloruro di carbonio, e l’eventuale
abuso di alcool, il contatto intimo (leggi: sessuale) con persone itteriche che possono aver trasmesso
un’epatite virale.
Per quanto riguarda l’insorgenza, un esordio acuto, con nausea, vomito, anoressia e avversione per il fumo di
sigaretta fa propendere per un’epatite virale; l’insorgenza graduale di ittero, al limite accompagnato da urine
scure e feci acoliche suggerisce una colestasi, in particolare se c’è febbre è probabile una colangite, se c’è
calo ponderale un carcinoma della testa del pancreas.
L’aumento della circonferenza addominale è indice di ascite, che può essere la prima subdola manifestazione
di una cirrosi in fase avanzata o di una neoplasia.
Es. obiettivo: si ricerca la presenza (sub)ittero a livello sclerale, il pallore anemico delle mucose (Æ emolisi,
cirrosi, neoplasie, quest’ultima possibilità soprattutto se è presente cachessia degli arti). L’esame della cute
permette di rilevare ecchimosi dovute a deficit di protrombina o a porpora trombocitopenica.
In corso di colestasi cronica i pz. presentano lesioni da grattamento, ippocratismo digitale e xantomi palmari
e tendinei.
Un colorito grigio ardesia di tutto il corpo invece è altamente indicativo di emocromatosi.
Confusione mentale, scadimento dell’intelletto e asterixis invece sono indicative di encefalopatia portosistemica.
L’esame obiettivo del fegato può evidenziare una diminuzione del volume dell’organo (cirrosi o necrosi
epatocitaria massiva) o un’epatomegalia (fegato da stasi, steatosi, epatite alcolica neoplasie) con margine
acuto +- dolorante e regolare.
La presenza di una colecisti distesa (segno di Courvoisier-Terrier) è indice di ittero ostruttivo, mentre il
segno di Murphy di una colecistite/colelitiasi.
Una splenomegalia, caput medusae con ronzio venoso e murmure vascolare a livello dei noduli epatici
rigeneranti si associano tipicamente a cirrosi (avanzata).
Test di funzionalità epatica
⇒ Bilirubina: le determinazioni spettrofotometriche sono in grado di misurare distintamente sia la frazione
diretta (coniugata-idrosolubile) che quella indiretta (liposolubile). Le [] normali di bilirubina totale sono
< 1mg/dl ,con meno di 0.25 mg/dl della forma a reazione di Van Den Bergh indiretta. Se aumenta solo la
forma indiretta c’è un’insufficienza assoluta (come in alcune alterazioni ereditarie – S. di Gilbert, DubinJohnes, Chrigler-Najar) o relativa (ittero emolitico) dei processi di coniugazione, mentre un aumento di
pari livello sia della forma diretta che indiretta indica una compromissione della capacità di secrezione
della bilirubina nella bile. E’ possibile misurare anche la bilirubinuria, che compare precocemente anche
prima dell’evidenza clinica di ittero.
⇒ Enzimi sierici: sono usati per differenziare un’alterazione parenchimale da un’ostruzione delle vie
biliari. Nessuno degli enzimi dosati comunque ha una sensibilità o specificità del 100%, inoltre possono
muoversi anche in corso di stati morbosi extraepatici.
♦ Aminotrasferasi (transaminasi): Ast, Alt, (SGot, SGpt) sono stati proposti come indici di danno
epatocellulare. L’Alt è l’enzima + epatospecifico ed è quasi esclusivamente citosolico, mentre l’Ast è
contenuto in diversi altri tessuti ed è sia citosolico che mitocondriale. I loro valori aumentano in quasi
tutte le epatopatie, ma soprattutto in condizioni che causano un’estesa necrosi epatocellulare, come le
epatiti virali acute, tossiche e il collasso circolatorio prolungato. N.B.: elevati valori indicano
sicuramente un danno cellulare in atto ma non sono correlati alla gravità di una lesione sottostante; ad
es. il loro valore può essere normale o addirittura diminuito nelle epatiti croniche, nella cirrosi w nelle
metastasi epatiche, quando la massa epatica sia notevolmente ridotta. In genere l’aumento dei livelli di
Ast e Alt va di pari passo, con poche eccezioni: nell’epatite alcolica il rapporto Ast/Alt può essere > di
2 a causa del danno mitocondriale indotto dall’alcool e della diminuzione del contenuto di Alt in
http://www.hackmed.org
[email protected]
2
conseguenza del deficit del cofattore piridossina 5P. Nelle donne in gravidanza con steatosi questo
rapporto è ancora >1 mentre in tutte le altre condizioni è <1.
♦ Fosfatasi alcalina: di questo enzima esistono diverse isoforme, ossea, placentare, linfocitaria,
intestinale ed epatica. In assenza di interessamento di uno degli organi succitati, un suo aumento
dipende da alterazioni a livello delle vie biliari e dipende da un’aumentata sintesi dell’enzima piuttosto
che da rigurgito dovuto all’ostruzione. Un aumento leggero c’è in tutte le patologie epatiche, essendo +
marcato negli stati morbosi infiltrativi ma aumenti anche di 10 volte si riscontrano solo nella colestasi
(intra- o extra-epatica). In particolare, i valori si innalzano, anche se di meno quando l’ostruzione
biliare è incompleta o interessa un solo dotto, condizioni in cui la bilirubina è normale. Per valori
elevati vanno cercati anche malattie ossee (Paget osseo, metastasi, osteomalacia).
♦ 5’ – nucleotidasi: sebbene abbia una distribuzione tessutale diffusa, è un considerato un marcatore di
malattia epatobiliare, utile soprattutto per confermare l’origine epatica di elevati livelli di ALP in
bambini, donne in gravidanza e pz con concomitante malattia ossea.
♦ Gamma Glutammil Trasferasi: è diffusamente presente nel sistema epatobiliare e i suoi livelli sono
+- correlati a quelli di ALP, rispetto alla quale però ha > sensibilità e < specificità (può dipendere da
malattie cardiache, pancreatiche, renali, polmonari oltre al diabete e l’alcolismo.
⇒ Proteine sieriche: Contrariamente agli enzimi sierici, la loro concentrazione diminuisce frequentemente
nel corso delle epatopatie perché riflette le capacita sintetiche dell’organo piuttosto che un danno
cellulare. Quindi in generale non sono indici precoci o sensibili di un’epatopatia, vista l’emivita +- lunga
e la notevole riserva funzionale d’organo; sono di scarsa utilità per fare DD e inoltre una loro
diminuzione non è detto che dipende solo dal fegato.
♦ Globuline aumentate : ipergammaglobulinemia policlonale in corso di cirrosi, incremento di IgA in
epatite acuta (in particolare epatite alcolica),IgM in corso CBP
http://www.hackmed.org
[email protected]
3
Epatiti croniche
Patologia infiammatoria del fegato che si manifesta istologicamente con la presenza di necrosi ed
infiltrato infiammatorio e clinicamente con il rialzo per almeno 6 mesi delle transaminasi (non esiste
una soglia).
Oppure persistenza di indagini di laboratorio con epatite acuta subclinica, cioè diagnosi casuale in corso di
indagini di laboratorio.
Il problema epatite cronica è alle nostre latitudini di grande rilievo a causa della prevalenza dell’HCV, che
nel nostro Paese infetta 4 milioni di persone.
Per questo virus, fino al 1990, non esisteva nemmeno la possibilità di un vaccino.
L’epatite virale HCV porta regolarmente la cronicizzazione, spesso la cirrosi, e abbastanza frequente è
l’evoluzione a carcinoma epatico.
Dal punto di vista clinico la definizione di epatite cronica è una elevazione delle GOT e GPT per oltre 6
mesi.
Classificazione
La vecchia classificazione di Attiva, Lobulare e Persistente (vedi) è stata oggi sostituita da una
classificazione clinica basata sulla somma di una stadiazione e di una gradazione, e da una classificazione
eziologica.
Stadiazione e gradazione vengono individuate tramite la biopsia epatica che diventa quindi l’indagine
strumentale fondamentale per la diagnosi.
Epatite (A) , (B+C)
A = agente eziologico
• Autoimmune
• Virale cronica
o B
o C
o B + Delta
o Altri virus (E,F,G)
• Da farmaci
• Criptogenetica
• Ibrida (autoimmune + PBC; autoimmune +PSC)
B = grading
Il grading classifica il danno epatico osservato alla biopsia sulla base del grado di lesione (necrosi) e di
infiammazione (infiltrato)
• Entità della infiltrazione periportale: fra lo spazio portale e gli epatociti esiste una lamina di
tessuto connettivale detta lamina limitante. Quando l’infiltrato infiammatorio supera questa lamina,
il reperto istologico corrisponde ad una forma di epatite più grave. (cosiddetta “necrosi piecemall”)
• Entità della necrosi periportale: durante i processi infiammatori necrotici del fegato, la necrosi che
colpisce gli spazi periportali si evolve secondo una progressione nota:
o Necrosi che unisce due strutture vascolari
o Necrosi che unisce due spazi portali
o Necrosi che unisce lo spazio portale con la vena centrolobulare
• Entità della infiammazione lobulare e della fibrosi
• Entità della necrosi lobulare
Assegnando un punteggio ad ognuno di questi 4 item, si ottiene una gradazione definita indice di attività
istologica (vedi)
Il grading definisce il grado di attività della malattia, indicando con questo cioè la rapidità di
progressione della malattia verso la degenerazione epatica e la cirrosi. In genere maggiore è il numero di
linfociti nel reperto bioptico, maggiore è il grado della malattia.
Grado 1 lieve: flogosi portale
Grado 2 minima: flogosi portale + piecemail necrosis (flogosi lobulare scarsa)
Grado 3 moderata: flogosi lobulare + piecemail necrosis
Grado 4 grave: necrosi a ponte
C = staging
http://www.hackmed.org
[email protected]
4
Lo staging indica lo stadio della progressione della malattia, ossia la sua evoluzione indipendentemente
dalla rapidità con cui questo si è raggiunto e dal fatto che la malattia stia attualmente progredendo o no. In
genere c’è corrispondenza fra un grado avanzato e uno stadio avanzato.
Il grading e lo staging differiscono poichè mentre il grado di severità può variare nel tempo l’evoluzione è
generalmente progressiva.
Il livello di progressione della malattia è basato sull’entità della fibrosi:
stadio 0 = assenza di fibrosi
stadio 1 = fibrosi portale
stadio 2 = fibrosi periportale (raramente fibrosi a ponte = porto-biliare)
stadio 3 = fibrosi periportale + fibrosi a ponte (porto-portale e porto-centrale)
stadio 4 = cirrosi = fibrosi + noduli di rigenerazione con formazione di lobuli che mancano di vena
centrolobulare o con vena centrolobulare eccentrica, il sovvertimento dell’architettura del lobulo determina
scarsa funzionalità
In base alla somma dei punteggi di grading e staging l’epatite viene classificata in:
• lieve
• minima
• Moderata
• Severa
Questa classificazione è molto importante ai fini della diagnosi.
NB: l’epatite cronica viene indicata come attiva in base al numero di linfociti e PMN (in realtà può evolvere
in cirrosi)
Anatomia patologica
L’epatite cronica persistente, la meno grave, è caratterizzata da un infiltrato di cellule mononucleate che
rimane all’interno degli spazi limitanti periportali e assenza di cirrosi.
Questo tipo di epatite è soprattutto autoimmune, o rappresenta uno stadio precoce di una cronica virale.
Di solito, a meno che sia virale, non progredisce ad altri stadi.
Oggi si classifica come una minima con fibrosi assente.
L’epatite cronica lobulare indica infiammazione portale entro la lamina limitante, ma anche necrosi focale
nel lobulo epatico.
E’ molto simile all’epatite cronica persistente, anche nella scarsa tendenza all’evoluzione, con in più una
componente lobulare.
E’ un grado lieve o moderato, con fibrosi assente.
L’epatite cronica attiva è una forma caratterizzata da danni sostanziali al parenchima che tende ad evolvere
verso la cirrosi.
Può derivare sia da una epatite acuta sia da una acuta persistente sia da una epatite subclinica diagnosticata
con la sola positività delle indagini di laboratorio.
È caratterizzata dalla piecemail necrosis che si estende al di la della lamina limitante seguita quindi dalla
necrosi a ponte che determina collasso della trama reticolinica e sostituzione con tessuto fibroso che
comporta in genere l’evoluzione verso la cirrosi.
È presente infiltrato portale e periportale, nell’epatite cronica C l’infiltrato può determinare la formazione di
follicoli linfatici simili a centri germinativi.
A livello del lobulo epatico è presente un grado variabile di degenerazione, necrosi e rigenerazione.
È presente stasi biliare negli epatociti e nei canalicoli biliari, si possono formare nella forma grave le
cosiddette rosette: epatociti disposti in modo radiale intorno ad un canalicolo biliare vuoto e dilatato in modo
simile ad una ghiandola.
Si verifica iperplasia e ipertrofia delle cellule del Kupfler contenenti lipofuscina e pigmento biliare.
È importante per la diagnosi che nel prelievo bioptico sia compreso lo spazio portale.
E’ difficile classificare la cronica attiva secondo i criteri moderni, ma comunque appena evolve diventa
subito una epatite severa con fibrosi grave.
P.S. l’epatite portale cioè la flogosi dello spazio portale è una lesione comune a tutte le forme di epatite.
Clinica
I pazienti con epatite cronica possono essere completamente asintomatici o possono presentare segni e
sintomi tipici dell’insufficienza epatica:
• Anoressia 63% a causa del processo infiammatorio
• Astenia 67%
• Ittero 48-98%
http://www.hackmed.org
[email protected]
5
• Epatosplenomegalia 50%
• Spider nevi 53% telangectasie arteriose causate dall’iperestrogenismo
• Dolore addominale 12-40%
• Acne 21%
• Rash 9%
• Encefalopatia 0-9%
• Ascite – edemi 9-27%
• Varici esofagee 27%
• Irsutismo 6-25%
• Cushing5% soprattutto in epatite autoimmune
• Atrofia testicolare
• Ginecomastia
• ipotricosi
diagnosi
indagini di laboratorio
Il danno epatico di norma provoca dei movimenti enzimatici.
Questi possono essere provocati e dagli epatociti, e dalle cellule delle vie biliari.
Nel primo caso, saranno GOT e GPT ad essere alterati, mentre nel secondo saranno ALP e gammaGT.
Entrambe le transaminasi mostrano un incremento.
Generalmente il livello sierico della ALT è superiore a quello della AST, tuttavia è caratteristica l’inversione
del rapporto nelle forme particolarmente aggressive ad evoluzione verso la cirrosi.
Altri indici importanti di funzionalità epatica sono il tasso di albumina sierica e il PT.
Questi infatti sono parametri che riguardano due sostanze prodotte dagli epatociti.
In particolare il PT è più affidabile, perché la protrombina ha una emivita di poche ore, e quindi la sua
funzionalità è direttamente correlata alla produzione epatica.
Importante è la diagnosi differenziale con altre malattie epatiche quali:
• Morbo di Wilson
• Colangite sclerosante primitiva
• Deficit di α1-antitripsina
• Emocromatosi
• PSC
epatite cronica autoimmune
è una malattia ad eziologia ancora sconosciuta che riconosce come patogenesi la reazione immunitaria
dell’organismo rivolta verso particolari strutture della cellula epatica.
Malattia non frequente, caratterizzata da continua necrosi epatocellulare e infiammazione di solito con
fibrosi, che tende a progredire verso la cirrosi e l’insufficienza epatica, a volte anche in modo molto rapido,
essendo responsabile della morte del 40% dei pazienti nei primi 6 mesi di malattia.
L’epatite autoimmune come altre malattie immunitari ha una maggiore prevalenza nel sesso femminile
eziopatogenesi
Non c’è certezza che tutte le epatiti di questo tipo siano dovute alla attività immunitaria, ma molti dati
sembrano indicarlo. In particolare:
• Tutte le lesioni epatiche sono sostenute da cloni di T4 e T8 attivati, e da plasmacellule.
• E’ frequente il riscontro di autoanticorpi circolanti nei pazienti e di altre malattie autoimmuni, sia nei
malati che nei loro familiari.
• Spesso questi pazienti hanno aplotipo HLA DR3 e DR4
• Questo tipo di epatite risponde alla terapia immunosoppressiva.
Gli anticorpi diretti contro strutture autologhe che si ritrovano con maggior frequenza, e che hanno una
rilevanza diagnostica, sono in genere di tre tipi:
• ANA (antinucleo)
• ASMA (anti muscolatura liscia)
• anti LKM (microsomi epatici)
• anti SLA (antigene solubile epatico) diretto contro le citocheratine citoplasmatiche
• Altre proteine della membrana epatocitaria
http://www.hackmed.org
[email protected]
6
Un ruolo patogenetico importante è anche dovuto all’immunità cellulomediata, soprattutto per la genesi delle
artralgie, vasculiti cutanee e glomerulonefriti da immunocomplessi.
Clinica
Sebbene possa assomigliare ad una epatite acuta virale per il suo esordio improvviso, in genere la malattia è
caratterizzata da un procedere con fasi alterne di remissione e riacutizzazione.
In genere le condizioni meglio caratterizzate sono quelle di un gruppo di pazienti donne di mezza età (30-40
anni), in cui la frequenza di epatite è 4 volte quella dei maschi. Queste donne hanno un alto ed importante
titolo di Ab ANA, ed una estesa serie di manifestazioni autoimmuni extraepatiche , come:
• Rash
• Artriti e artralgie
• Colite ulcerosa
• Pseudo-pericardite
• GN cronica
• Diabete mellito
• Miocarditi
• Tiroiditi
• Cirrosi epatica, indici di epatite e relative complicanze.
In molte di queste pazienti ALP, globuline, bilirubina sono nella norma e le GOT e GPT sono solo
moderatamente aumentate. Invece il PT è spesso alterato, soprattutto nelle fasi avanzate della malattia.
Esistono 4 forme cliniche di epatite autoimmuni:
Tipo 1
Tipo 2a
Autoanticorpi tipici
ANA, ASMA, p- LKM1, anti p450,
ANCA
anti citosol epatico
Antigeni
?
p450 IID6
Overlapping con HCV 11%
Paziente
70%F,
di
mezza
età,
con
caratteristiche lupoidi
Tipo 2b
LKM1, anti p450
Tipo 3
anti SLA
p450 IID6
Citoscheletro
44-86%
0%
Di solito bambini, 90%F,
caratteristiche simili
nell’area
mediterranea, una a quelle del gruppo
forma associata ad 1
HCV che invece
interessa pazienti di
età più avanzata
La prognosi della malattia è variabile ma l’evoluzione è inevitabilmente verso la cirrosi.
LKM2 sono associati a epatite da farmaci
LKM3 sono associati a epatite D
Diagnosi
È fondamentalmente una diagnosi di esclusione
I criteri diagnostici si dividono in criteri di certezza e di probabilità
Criteri di certezza
• Assenza di markers di infezioni virali
• Assenza di fattori di rischio di contagio per via parenterale
• No assunzione di alcool o farmaci
• IgG >= 1,5 x valori normali
• ANA, SMA, anti-LKM: titolo almeno 1:80
• GOT, GPT aumentate di 4-6 volte
• Necrosi periportale
• Assenza di lesioni biliari, granulomi, siderosi, depositi di rame. In questi casi è invece probabile una
sindrome da overlapping. Queste purtroppo sono molto comuni e confondono la diagnosi.
• HLAB8, DR3, DR4
Criteri di probabilità
• Aumenti più contenuti di IgG, autoanticorpi
• Anticorpi anti SLA, ASGP-R (asialoglicoproteine – Recettore)
• HLA B8DR3/DR4 (criterio necessario)
http://www.hackmed.org
[email protected]
7
• Sesso F
Terapia
La terapia è basata sui glucocorticoidi, che migliorano la sopravvivenza dei pazienti, il quadro clinico e
biochimico, ma non sembra possano intervenire con efficacia nella prevenzione della cirrosi.
E’ importantissimo stabilire se la malattia è o no ad impronta virale, a causa del fatto che il trattamento con
glucocorticoidi abbassa le difese immunitarie, e il trattamento della patologia virale con INF aggrava
enormemente la patologia immunitaria.
Nella malattia di tipo II-b, con elevata sovrapposizione di HCV, la terapia è molto difficile.
Prednisone (metabolita epatico del prednisolone): 30-40 mg la settimana per circa due mesi, in seguito
scalare di circa 5-10 mg a settimana). Spesso viene dato in combinazione con azatioprina, che riduce le
complicanze della terapia steroidea.
Il trapianto di fegato rappresenta una valida opsione terapeutica in caso di malattia di grado avanzato già
evoluta in cirrosi.
Epatite acuta
Per epatite si intende una malattia infiammatoria a carico del fegato.
Le cause sono molteplici:
1. infezioni
• virus epatotropi
• TBC
• Mononucleosi
• CMV
• Amebe
• Malaria
• Candidosi
• Stafilococchi
• tifo
2. farmaci
3. autoimmunità
4. tossici
in base al tipo di risposta immune si ha un differente quadro clinico:
• se la risposta immunitaria è intensa determina una rapida eliminazione del virus e grave danno
epatocitario anche se limitato nel tempo (epatite acuta grave)
• se la risposta è estremamente intensa si ha necrosi massiva con epatite fulminante
• se la risposta è meno intensa si ha eliminazione lenta del virus e minore distruzione epatocitaria
(epatite acuta lieve prolungata)
• se la risposta è scarsa il sistema immune non elimina il virus e si ha epatite cronica
• se la risposta è assente si ha il mantenimento della viremia e del virus a livello epatico con lo stato
di portatore sano
Epatiti Virali
Se non viene specificato oltre il termine epatite virale viene riservato alle infezioni epatiche dovute a virus
epatotropi che hanno cioè una particolare affinità per il fegato.
L’epatite virale è una malattia causata da diversi virus non correlati immunologicamente:
• 1970 HBV
• 1976 HAV
• 1977 HDV
• 1983 HEV
• 1988 HCV
• anni ’90 HGV
l’epatite può essere causata anche da altri virus epatici minori che cioè non hanno un trpismo specifico per il
fegato: CMV, EBV, HSV, Coxsackie, Parotite, Rosolia.
Questi virus nell’ambito di una malattia di base possono determinare una epatite di variabile gravità.
http://www.hackmed.org
[email protected]
8
Rappresentano circa l’1.5% di tutte le epatiti.
EPATITE A
è detta anche acuta benigna in quanto ha una andamento in genere autolimitante.
L’epatite A è presente in tutto il mondo ed è endemica in paesi con bassi standard igienico-sanitari.
In Italia con il miglioramento delle condizioni socio-economiche si è avuta una riduzione dell’incidenza e
della prevalenza.
La minore circolazione del virus comporta anche però un aumento della popolazione adulta suscettibile.
L’HAV è un virus a RNA appartenente ai Picornavirus.
È molto resistente nell’ambiente esterno: calore (55° per 30’), etere (10% a 4° per 20 ore), PH 3 per 3 ore a
T° ambiente).
Sopravvive per giorni-settimane nei mitili, acqua, suolo, sedimento marino.
Può essere coltivato in vitro su colture cellulari (espianti di fegato, rene fetale), in vivo si replica nel
Marmoset.
Il virione possiede 4 proteine strutturali maggiori (VP1-VP4) che formano il capside, sono noti 4 genotipi, il
sierotipo è unico.
HAV determina la formazione di 2 tipi di anticorpi:
• anti-HAV IgM comparsa precoce, durata 2-6 mesi
• anti-HAV IgG comparsa più tardiva, persistono per tutta la vita
in Italia circa l’85% degli individui possiede le IgG, nella maggioranza dei casi l’infezione ha un andamento
subclinico.
La trasmissione avviene per via orofecale: dall’intestino il virus tramite il circolo portale raggiunge il fegato
dove si replica attivamente e determina necrosi degli epatociti (azione citopatica diretta), quindi viene
eliminato con la bile e passa nelle feci (circa 10 giorni prima dell’inizio della sintomatologia).
La presenza nelle feci si ha:
• 2-3 settimane prima dell’inizio dell’ittero
• 1 settimana dopo
il danno epatico è più di tipo immunologico (distruzione degli epatociti infetti da parte dell’ICM) che
citopatico tanto che il virus è eliminato prima dell’ittero.
La viremia è breve (la presenza di virus nel sangue si ha alla fine del periodo di incubazione ed all’inizio
della malattia) perciò è rara la trasmissione tramite trasfusione.
Il serbatoio dell’infezione è rappresentato dall’uomo infetto e la trasmissione avviene per contatto diretto o
tramite cibi e bevande:
• mitili (frutti di mare) contaminati
• acque contaminate
• balneazione in acque contaminate (vitale 2 settimane in acqua di mare, 1 mese in acqua di
fiume)
• verdure crude mal lavate (concimate con liquami)
• viaggi in paesi ad alta endemia
clinica
il periodo di incubazione è di 15-60 giorni, in media 30 giorni.
L’epatite A è essenzialmente di tipo acuto, non tende a cronicizzare con guarigione completa in 1 mese.
Non esistono portatori cronici.
Rarissimamente da origine ad epatite fulminante (soggetti > 50 anni, soggetti con epatopatia cronica).
L’epatite A nella maggior parte dei casi decorre asintomatica e l’80-90% degli individui possiede anticorpi
protettivi per esservi venuto a contatto.
L’epatite acuta decorre attraverso diverse fasi:
• fase preitterica (2-15 giorni): malessere generale, anorresia, nausea, vomito, disgusto per il
fumo e cefalea
• fase itterica: ittero sclerale e cutaneo, urine ipercromiche, feci ipocoliche, prurito, dolenzia al
quadrante superiore destro dell’addome
La risoluzione avviene in 3-4 settimane, non c’è mai la cronicizzazione ma si può avere la possibilità di
forme a decorso protratto (3-4 mesi).
il fegato è aumentato di volume e spesso dolorabile alla palpazione (20% dei casi epatomegalia).
http://www.hackmed.org
[email protected]
9
La superinfezione da HAV in pazienti con epatite B anche se cirrotici non determina nessuna modificazione
del quadro clinico, mentre nei pazienti con epatite C non cirrotici si verifica una elevata incidenza di forme
fulminanti (>40%) con un alto tasso di letalità (35%).
Il meccanismo patogenetico è sconosciuto, forse un fenomeno autoimmunitario con necrosi epatocitaria
massiva.
Nei pazienti con epatite C è fortemente raccomandata la vaccinazione anti-HAV.
diagnosi
Le indagini di laboratorio evidenziano incremento delle transaminasi (GOT e GPT), iperbilirubinemia sia
diretta che indiretta, incremento di γ-GT e PA, può essere presente anche riduzione del PT.
La diagnosi basa sull’isolamento del virus dal sangue o dalle feci e su test sierologici:
• IgM compaiono all’inizio della fase acuta e scompaiono entro 6-12 mesi
• IgG compaiono poco più tardi e durano per tutta la vita, sono protettive ed indicano infezione
pregressa (compaiono quando finisce l’eliminazione fecale)
Terapia e profilassi
Il trattamento è sintomatico di supporto.
La profilassi generale viene fatta tramite la riduzione della contaminazione fecale delle acque e dei cibi.
La profilassi specifica passiva è indicata in conviventi con pazienti con epatite A, soggetti che si rechino in
aree ad alta endemia e si basa su Ig specifiche (2 ml se > 50 Kg) che se somministrate entro 10 giorni
dall’esposizione prevengono l’epatite nell’80% dei casi e somministrate durante la fase acuta ne riducono la
sintomatologia senza condizionare l’immunizzazione.
È disponibile un vaccino con virus inattivato (coltivato su cellule diploidi umane e inattivato con formalina
e adsorbito ad AIOH) con efficacia del 100%.
Le categorie alle quali è raccomandata la vaccinazione sono:
• Forze armate: militari in missione di pace in zone ad elevata endemia
• Viaggiatori diretti in zone ad elevata endemia (Asia, Africa, paesi del Mediterraneo meridionale,
centro e sud america)
• Operatori ecologici, in particolare addetti al trattamento e smaltimento di acque reflue e rifiuti
• Pazienti con epatite C
Viene fatto uno screening pre-vaccinale nei nati prima del 1960.
EPATITE B
L’HBV è un virus a DNA mantellato di 42 nm appartenente agli Hepadnavirus.
È strettamente specie-specifico: uomo e primati superiori (scoiattolo, marmotta, anitra di Pechino!).
La coltura in vitro su linee cellulari di epatocarcinoma è difficoltosa.
Il genoma è costituito da un DNA circolare parzialmente a doppia elica.
Produce 4 proteine principali codificate da 4 geni sovrapposti (S,C,P,X).
La replicazione avviene solo nel fegato, ma il virus si trova anche in altri parenchimi.
Ha una DNA- polimerasi endogena, in grado di agire anche da RNA polimerasi, e da transcriptasi inversa.
Quindi a partire da un intermedio RNA-, la DNA-pol del virus sintetizza una copia di DNA+, con un
meccanismo identico a quello dei retrovirus.
Dopo vari cicli di replicazione (infezione cronica) il DNA presente nel nucleo può integrarsi nel genoma
epatocitario determinando l’espressione dei geni virali.
Ciò sembrerebbe essere alla base della correlazione tra epatite B e CEC.
Le proteine virali invece vengono codificate sull’intermedio RNA-.
Il periodo di incubazione è di 1-6 mesi (mediamente 6-8 settimane).
Nel periodo iniziale dell’infezione si ha presenza in circolo di virioni insieme ad un eccesso di particelle di
HbsAg, HbeAg, DNA e DNA polimerasi.
La viremia si ha durante il periodo terminale dell’incubazione e durante la malattia.
I principali marcatori di infezione da HBV sono:
• HBS - Ag, prodotto del gene S, corrispondente alle proteine di superficie del virione, compare
durante l’insorgenza dei sintomi e scompare prima della produzione degli anticorpi specifici
(HbsAb) dando origine al cosiddetto periodo di latenza, nei portatori sani e nell’epatite cronica non
si ha scomparsa di HbsAg ne comparsa di HbsAb.
• HBC – Ag, prodotto del gene C, corrisponde invece al core nucleo capsidico del virione, non si isola
mai nel siero, ma solo in coltura su biopsia epatica, in quanto rimane contenuto dentro l’epatocita o
si trova associato alle proteine di superficie
http://www.hackmed.org
•
[email protected]
10
HBE – Ag, antigene non corpuscolato del core, proteina solubile prodotta dal gene C, ma con un sito
trascrizionale diverso. E’ in pratica la forma solubile del gene C, gli HbeAg hanno elevati livelli
durante il periodo di incubazione che dura 1-3 mesi, sono indice di attiva replicazione virale e di
infettività e anche di probabile progressione verso l’epatite cronica
• HBV DNA e HBV DNA-polimerasi sono gli indici più sensibili di replicazione virale e quindi di
alta contagiosità, la loro comparsa coincide con quella dell’HBeAg
Gli anticorpi contro il virus sono rappresentati da:
• HbsAb hanno funzione protettiva e la loro comparsa indica guarigione completa ed
immunità che dura per tutta la vita
• HbeAb compaiono più precocemente rispetto agli HbsAb (non c’è periodo di latenza), la
loro presenza indica cessazione della replica virale e quindi scarsa o nulla trasmissività,
non hanno funzione protettiva ma predittiva in quanto indicano prognosi positiva.
Nell’epatite cronica non si ha scomparsa di HbeAb ne scomparsa di HbeAg
• HbcAg sono i primi a comparire sotto forma di IgM che indicano infezione recente
(compaiono subito prima dell’insorgenza dei sintomi e contemporaneamente all’incremento
delle transaminasi e scompaiono entro 6-12 mesi) e permangono per tutta a vita sotto forma
di IgG che indicano guarigione ed immunità. la loro comparsa ha un importanza dal punto di
vista diagnostico in quanto tra la scomparsa dell’HbsAg e la comparsa dell’HbsAb trascorre
un periodo definito finestra immunologica in cui l’unica prova dell’infezione è la presenza
dell’HbcAb. Anche l’HbcAb non è un anticorpo protettivo
La penetrazione intracellulare avviene per endocitosi, quindi il virus si libera del rivestimento e il genoma
raggiunge il nucleo.
Una polimerasi tessutale e virus-specifica opera il completamento del DNA ad elica singola, quindi una
topoisomerasi cellulare converte il DNA circolare aperto in DNA chiuso.
La RNA-polimerasi dell’ospite trascrive un elica del DNA circolare in RNA pregenomico che funziona sia
da m-RNA che da modello per la trascriptasi inversa.
La trascriptasi inversa quindi sintetizza la prima catena del DNA su modello dell’RNA e la seconda catena
su modello della prima catena.
Gli Hepadnavirus ed i retrovirus infatti sono filologicamente correlati.
Delle molecole di DNA neosintetizzati alcune danno origine al virione maturo e gemmeno all’esterno mentre
altre rimangono nel nucleo.
Dopo vari cicli di questo tipo (infezione cronica) il DNA provirale può integrarsi nel genoma cellulare e
questo starebbe alla base della correlazione tra epatite B e carcinoma epatocellulare.
L’HBV essendo dotato di mantello ha una buona resistenza nell’ambiente, rimane infatti vivo ed infettante
per 24 ore.
Esso viene eliminato nel soggetto infetto tramite i liquidi biologici.
La trasmissione avviene tramite i liquidi biologici infetti:
• Sangue
• Sperma, secreti cervico vaginali (trasmissione sessuale)
• Saliva (?)
• Latte materno
• Bile (no feci)
• Versamenti (liquido ascitico)
La trasmissione quindi si verifica tramite:
• Trasfusione di sangue ed emoderivati
• Scambio di siringhe tra TD e per via e.v.
• Rapporti sessuali
• Trasmissione verticale: via transplacentare e durante il passaggio nel canale del parto
• Scambio di oggetti da toilette
La principale vie di trasmissione dell’epatite B è mediante inoculazione di sangue infetto o emoderivati,
per questo motivo è anche chiamata epatite da siero.
La trasmissione per via parenterale può essere distinta in:
• Via parenterale classica: trasfusione di sangue o derivati, uso di aghi, siringhe, strumenti
chirurgici contaminati, trapianto di organi infetti
http://www.hackmed.org
•
[email protected]
11
Via parenterale inapparente: penetrazione del virus attraverso microlesioni della cute o delle
mucose
9 lesioni di mucosa orale o faringea (cure odontoiatriche)
9 rapporti sessuali (sia omosessuali che eterosessuali)
9 uso promiscuo di articoli da toilette (spazzolino da denti, rasoio, pettine, forbicina unghie)
9 via materno-fetale non verticale (allattamento)
9 graffi, morsi
il principale serbatoio dell’infezione sono i portatori cronici ed i pazienti con epatite acuta.
Il virus non è citolitico perciò il danno epatico è mediato dalla risposta immunitaria e dall’infiammazione
dovuta all’espressione di antigeni virali sulla superficie degli epatociti o all’immunità umorale (Ab
neutralizzanti).
I linfociti T CD8+ operano la distruzione degli epatociti infetti tramite il riconoscimento di degli Ag di
membrana.
A livello epatico sono presenti i cosiddetti corpuscoli di Mallory intracitoplasmatici dovuti all’aggregazione
delle particelle virali.
Nel 1989 è stato identificato un virus del tutto identico all’HBV classico tranne che per una mutazione
puntiforme della regione pre-core che rende il virus incapace di produrre l’HbeAg (variante italiana precoce).
Tale virus è associato ad una grave forma di epatite cronica HbsAg +,anti-Hbe +, HBV-DNA + ed a forme
fulminanti.
Le mutazioni gnomiche avvengono sotto la pressione immunitaria dell’ospite e i virus mutati incapaci di
produrre l’Hbe-Ag riescono ad eludere la risposta immunitaria dell’ospite all’infezione, si selezionano e
diventano la popolazione predominante.
clinica
L’infezione acuta da HBV può manifestarsi come:
• 70-80% infezione asintomatica
• 20-30% epatite acuta
• 0.1-1% epatite acuta fulminante con mortalità del 70-80%
l’evoluzione dell’epatite acuta e della forma asintomatica è:
• 90-95% guarigione
• 5-10% infezione cronica (l’infezione neonatale comporta invece cronicizzazione del 90-100% incaso di
madre HbeAg + e del 25% in caso di madre HbeAg -)
1. cronica attiva che evolve verso la guarigione anche se tardiva
2. cronica persistente che evolve verso la cirrosi epatica
3. portatore sano (con o senza malattia subclinica ?)
la cronicizzazione avviene quando la risposta immune non è in grado di eliminare tutto il virus e ciò spiega il
fatto che le forme fulminanti che sono associate ad una risposta estremamente forte non vanno incontro a
cronicizzazione.
Il periodo di incubazione è di 2-6 mesi.
La infezione acuta può dare luogo a diverse forme cliniche:
9 epatite classica itterica
9 epatite anitterica
9 epatite colestasica
9 epatite asintomatica
9 epatite fulminante
la forma classica itterica decorre attraverso 3 fasi:
1. periodo preitterico
malessere generale, astenia, anorresia, disgusto per il fumo, artro-mialgie, cefalea, febbre (50% dei casi),
nausea, vomito, dispepsia, (manifestazioni immunologiche: artrite, orticaria, rash maculo papulare) con
aumento delle transaminasi e riduzione del PT.
2. periodo itterico
ittero, scomparsa di febbre (un ittero febbrile non è mai una epatite acuta), prurito, urine ipercromiche
(marsala), feci ipocoliche, epatomegalia dolorabile (consistenza +- ridotta, la riduzione è un indice
prognostico favorevole), splenomegalia (20-50%) dei casi, aumento di transaminasi, iperbilirubinemia diretta
e indiretta, riduzione del PT e normale numero di leucociti e formula
3. convalescenza
http://www.hackmed.org
[email protected]
12
dopo 1-2 mesi, aumento di diuresi, ricolorazione delle feci, riduzione dell’ittero, astenia e ripresa
dell’appetito.
La forma fulminante (atrofia giallo-acuta) è caratterizzata da sonnolenza, inversione del ritmo circadiano,
encefalopatia epatica, aumento delle transaminasi (anche della forma mitocondriale della GOT che indica
necrosi epatica) che poi improvvisamente calano per esaurimento funzionale, riduzione delle colinesterasi,
globuli bianchi normali-aumentati, fegato ridotto di volume e consistenza.
epatite B cronica
dopo una fase iniziale ad alti livelli di replicazione il virus in cui si osservano in circolo i marcatori di
replicazione virale (HbeAg, DNA e DNA polimerasi) si integra nel genoma dell’epatocita, l’ HbcAg
scompare negli epatociti ed il danno necrotico infiammatorio diminuisce fino a scomparire del tutto.
Non sono più dimostrabili in circolo i marcatori di replicazione virale quali HbeAg, DNA e DNA polimerasi
mentre l’HbsAg continua ad essere presente.
Portatore cronico
È asintomatico e presenta nel siero la presenza di HbsAg senza altri marcatori di infezione.
Non vi è presenza di HbsAb perciò il soggetto ha la capacità di trasmettere la malattia.
Inoltre questi soggetti hanno una aumentata probabilità di andare incontro al CEC.
Diagnosi
Interpretazione dei marker di infezione da HBV:
HBs Ag HBe Ag Anti-HBc Anti-HBc Anti HBe AntiIgM
IgG
HbS
+
+/Periodo di incubazione
+
+
+
+/Epatite acuta Prima fase
+
+
Epatite acuta Periodo finestra
+
+
+
Epatite acuta Fase terminale
-/+
+
+
+
Guarigione iniziale
+
+
+
guarigione
+
+
Immunità d pregressa infezione
+
Pregressa infezione
con perdita di anti-HBs
+
+
+
Infezione cronica
+
+
Infezione cronica
+
+
+
Infezione cronica
+
Immunità dopo vaccinazione
la condizione di infezione è data dalla presenza dell’HbsAg, possono poi essere presenti diversi quadri
sierologici:
A. HbeAg+ DNA polimerasi + indica la presenza di virus replicante ed attivo e si associa a prognosi
peggiore
B. HbeAb+ DNA polimerasi – DNA – indica che non c’è attività virale ma solo presenza di memoria
immunologica
C. Con agente δ + V°
D. Con agente δ - V°
La condizione A+C indica la situazione in assoluto peggiore.
È importante valutare gli anti-Hbc per valutare se l’infezione è acuta o cronica:
9 Infezione acuta: presenza di IgM anti-Hbc ed eventualmente anche IgG
9 Infezione cronica: assenza di IgM e presenza di IgG
La presenza soltanto di anti-Hbc indica che il paziente è in via di guarigione.
Terapia
Lo scopo della terapia di una epatite cronica è diveso a seconda dell’età del paziente e del grado e dello
stadio dell’epatopatia.
In un paziente giovane con attività lieve-moderata e lieve fibrosi, l’obiettivo primario è l’eradicazione
dell’infezione, mentre in un paziente anziano, con attività severa e fibrosi moderata, l’obiettivo è quello di
ridurre la replicazione virale e quindi la componente necrotico infiammatoria rallentando così l’evoluzione a
cirrosi.
Il monitoraggio della terapia va fatto tramite i marcatori di replicazione virale e le biopsie epatiche.
http://www.hackmed.org
[email protected]
13
La terapia si fa con IFNα al dosaggio di 5-6 MU giornaliere e 9-10 MU a giorni alterni per 6-12 mesi.
Circa il 30% dei pazienti ottiene la soppressione duratura della replicazione virale.
Ll’azione del farmaco consiste nel potenziamento dell’attività citotossica linfocitaria che determina necrosi
delle cellule epatiche infettate (per questo motivo durante il trattamento si verifica incremento delle
transaminasi).
La sua azione è favorita dalla presenza di un buona risposta immunitaria dell’ospite.
Il monitoraggio della terapia viene fatto tramite:
9 HbeAg e HBV-DNA come indici di replicazione virale
9 Transaminasi
9 Anti-Hbc IgM e anti-Hbe come marcatori della risposta immune
Gli obiettivi a breve termine della terapia con INF sono la negativizzazione di Hbe-Ag e HBV-DNA ,
comparsa di anti-Hbe, normalizzazione delle transaminasi e progressiva negativizzazione di anti-Hbc IgM.
Le recidive dopo la sieroconversione sono molto rare (1-2%).
Complicanze: sintomi flu-like, insufficienza midollare, labilità emotiva e tiroidite autoimmune irreversibile,
+ altri sintomi collaterali quali rash cutaneo, alopecia, diarrea e formicolio alle estremità.
Nei portatori asintomatici la terapia peggiora la malattia e aumenta l’entità del danno epatico mentre nelle
forme croniche terminali l’unica opzione valida è il trapianto di fegato.
L’uso di INF va valutato anche nei pazienti con cirrosi dove può comportare rischi di insufficienza epatica.
In caso di epatite cronica HbeAg negativa da virus difettivo, nel 50% dei casi si ha risposta ma spesso si
verificano recidive.
Recentemente è stato trovato un nuovo farmaco antivirale la lamivudina che ha dimostrato risposta anche
nei pazienti che non rispondono all’INF.
Profilassi
Immunoprofilassi attivo-passiva
In caso di presunto contagio per esposizione accidentale transcutanea, puntura da ago o altro strumento
contaminato, presunta esposizione per via parenterale in apparente va fatto un controllo di HbsAg ed antiHbs, quindi l’inoculo massimo 48 ore dopo l’esposizione di 0.06 ml/Kg di IgB (Ig specifiche anti-epatite B)
o 2 fiale da 5 ml di Ig normali.
Le Ig durano per 15 giorni perciò visto che il periodo di incubazione è più lungo va fatta la somministrazione
contemporanea in altra sede della 1° dose di vaccino.
Nei neonati da madre HbsAg positiva vanno date 0.5 ml IgB entro le prime 24 ore dalla nascita e 1° dose di
vaccino entro 5-7 giorni dalla nascita.
vaccino
Il vaccino è costituito da HbsAbg ottenuti tramite la tecnica del DNA ricombinante che dura per 5-6 anni
dopo di che viene fatto un richiamo.
Il vaccino si basa su 3 somministrazioni a distanza di 1 mese e 6 mesi.
La vaccinazione va fatta in caso di negatività dei marker e normalità delle transaminasi.
L’indicazione al vaccino è per: addetti al settore sanitario, neonati da madre hbsAg positiva, politrasfusi o
trapiantati, ritardati mentali istituzionalizzati, emodializzati, conviventi di portatori di HbsAg,
tossicodipendenti, omosessuali, bisessuali, operatori ecologici, prostitute, bambini o studenti in classe con
portatori di HbsAg, tutti i soggetti esposti accidentalmente.
EPATITE D
l’HDV o agente δ è una particella virale difettiva a RNA- di 35 nm, che necessita della contemporanea
infezione epatica da parte del virus B per esplicare la sua capacità infettiva.
Infatti un virione D è costituito da un core di derivazione dall’HDV e un mantello che presenta gli Ag di
superficie di HBV.
Le modalità di trasmissione sono le stesse dell’epatite B.
Il 20% dei pazienti infetti da HBV presenta anche infezione da HDV.
Si può avere una coinfezione ad opera di HBV e HDV o una superinfezione di HDV in soggetti già infetti
da HBV (anche portatori sani).
La coinfezione si manifesta come una epatite acuta a decorso simile a quella da HBV mentre la
superinfezione in pazienti con epatite cronica da HBV si manifesta con epatite acuta grave fino alla necrosi
epatica acuta o cronicizzare ad epatite cronica B-D che è una forma severa con evoluzione in corrosi.la
diagnosi differenziale tra coinfezione e superinfezione viene fatta tramite l’IgM anti-Hbc:
9 Coinfezione: epatite D + infezione acuta da HBV (positività di IgM anti-Hbc)
http://www.hackmed.org
[email protected]
14
9 Superinfezione: epatite D + infezione cronica da HBV (negatività di IgM anti-Hbc)
La diagnosi viene fatta tramite la ricerca dell’HDV-Ag e HDV-RNA nel sangue o in biopsia epatica o
tramite la ricerca di IgM anti-HDV e IgG anti-HDV.
L’HDV-RNA è dosabile nel siero e nel fegato poco prima e all’inizio della malattia acuta sintomatica.
L’IgM anti-HDV è l’indicatore della recente infezione con l’HDV ma la sua comparsa è tardiva e di breve
durata.
In caso di epatite D che insorge come superinfezione l’anti-HDV permane più a lungo (?).
Il vaccino anti-epatite B protegge anche dall’epatite D.
Un aspetto sierologico particolare è la presenza di Ab anti-LKM (Liver-Kidney Microsomes), denominati anti LKM3 per distinguerli da quelli dell’epatite autoimmune.
Terapia
l’IFNα può produrre remissioni durature e prolungata riduzione della replicazione virale ma sono necessarie
dosi molto alte e a lungo: 5 MU al giorno per 12 mesi.
Dopo la sospensione della terapia però si osserva spesso ripresa della replicazione virale.
I parametri utilizzabili per il monitoraggio della terapia sono: HDV-RNA, anti-HDV IgM e HbsAg.
EPATITE C
Il virus C è un virus simile ai flavivirus, a RNA- a singola elica, mantellato.
È molto resistente all’ambiente esterno (evidenziato da materiale essiccato a T° ambiente per 48 ore)
inattivato da formalina, cloroformio e calore secco a 60°.
Essendo un RNA-virus è molto instabile geneticamente (la RNA-polimerasi è meno fedele) e si hanno quindi
frequenti mutazioni che lo fanno sfuggire al controllo immunitario, l’infezione produce anticorpi in parte
neutralizzanti (e questo ne limita la diffusione ai familiari), ma questi sono di breve durata, e non sono
protettivi né nei confronti di una seconda infezione da parte dello stesso sierotipo, e né da parte di altri virus.
L’elevato tasso di mutazione è inoltre il motivo per cui si ha una così elevata cronicizzazione e perchè è
impossibile ottenere un vaccino.
L’HCV possiede una notevole eterogeneità nelle regioni E2/NS1, E2/NS2 che codificano per le proteine
dell’envepope che determinano la formazione di diversi genotipi.
Le regioni C, NS3, NS4 e NS5 sono invece regioni conservate in tutti genotipi e le proteine da essi codificate
sono utilizzate nei test diagnositici.
Si conoscono 6 sierotipi di virus C: 1a, 1b, 1c, 2a, 2b, 2c (1a/b e 2a/b sono quelli presenti in Italia poichè
presentano una maggiore resistenza ai farmaci).
I diversi genotipi hanno una diversa distribuzione geografica, si ha inoltre la possibilità di infezioni miste o
di reinfezioni da parte di ceppi diversi.
L’HCV ha diffusione ubiquitaria, è responsabile dell’80-90% delle epatiti post-trasfusionali non A-non B e
del 50-70% delle epatiti sporadiche NANB.
In Italia l’incidenza è di 30.000-50.000 l’anno.
Il tipo 1 appare essere più resistente all’interferone.
La trasmissione avviene per via parenterale classica ed in apparente e per via sessuale (meno frequente
dell’epatite B).
Il contagio non comporta necessariamente infezione poichè insieme al virus possono essere trasmessi anche
gli anticorpi.
clinica
Il periodo di incubazione è di 1-6 mesi, più breve se la trasmissione è da emoderivati.
Il virus non è citolitico pertanto le lesioni epatiche sono il risultato della risposta immune e
dell’infiammazione.
L’epatite C acuta si presenta generalmente in forme paucisintomatiche anitteriche con caratteristico
andamento bi-polifasico delle transaminasi:
• 95% asintomatica
• 5% sintomi simil-influenzali
l’esito può essere:
• 85% epatite cronica che può rimanere stabile (80%) o degenerare in cirrosi (20%)
che predispone all’insorgenza del carcinoma epatocellulare (ogni anno 4-6% dei
soggetti con cirrosi)
• 15% guarigione
• epatite fulminante
L’HCV è considerato un virus cancerogeno a tutti gli effetti ed è la prima causa di epatocarcinoma.
http://www.hackmed.org
[email protected]
15
Probabilmente produce delle sostanze transattivanti la trascrizione genica.
Un segno clinico caratteristico dell’epatite C è l’aumento episodico delle transaminasi alternato a periodi di
normalità o quasi.
Si possono avere manifestazioni da IC e la crioglobulinemia mista.
Diagnosi
Si basa sulla ricerca tramite ELISA e poi immunoblotting come test di conferma degli anti-HCV (contro
regioni conservate di tutti i genotipi) che sono anticorpi non protettivi.
L’infezione acuta viene documentata dalla sieroconversione talvolta tardiva 1-3 mesi e ciò spiega
l’impossibilità di uno screening sicuro dei donatori di sangue, poichè in questo periodo l’unico marcatore è
l’RNA che può essere quantificato esclusivamente tramite PCR che non viene eseguita di routine.
Vi è un alta prevalenza di sieropositività per anti-HCV in pazienti con epatocarcinoma.
Gli anti-HCV scompaiono in 2-3 anni la loro scomparsa non indica quindi guarigione.
Gli anticorpi durano fino ad 1 anno dalla guarigione.viene fatta inoltre ricerca dell’HCV-RNA a livello
sierico tramite PCR sia qualitativa che quantitativa.
L’HCV-RNA può essere ricercato anche nella saliva, nel liquido seminale e nelle urine la cui concentrazione
è direttamente proporzionale a quella plasmatica.
È importante anche la genotipizzazione (perchè i genotipi hanno una diversa risposta alla terapia).
La presenza in circolo di anti-HCV può essere indice di risposta immune ma non necessariamente di attività
della malattia, mentre la presenza di RNA è indice dell’attività della malattia.
- Presenza di Ab anti-HCV: infezione/infettività
- Presenza di HCV-RNA: sicura infettività
Diagnosi di epatite acuta = HCV Ab
Diagnosi di epatite cronica (o portatore cronico?) = HCV Ab + RNA
Diagnosi di guarigione = scomparsa di HCV-RNA e ALT normale
Un aspetto interessante è a volte la presenza di Ab anti-LKM1 analoghi a quelli dell’epatite autoimmune,
diretti contro una seq di 33 amminoacidi del P450 IID6 forse per una parziale omologia con la poliproteina
dell’HCV.
La progressione può essere + rapida in individui geneticamente predisposti, con alti livelli di HCV-RNA nel
sangue o con epatopatie concomitanti o deficit di α1 – antitripsina.
terapia
IFNα2b 3 milioni di unità per via sottocutanea 3 volte alla settimana per 6 mesi.
I parametri per il monitoraggio della terapia sono l’HCV-RNA e le transaminasi.
Questo regime produce una normalizzazione delle transaminasi nel 50% dei pazienti nel corso del
trattamento, in molti pazienti si riesce ad ottenere anche la soppressione della replicazione virale
documentata dalla negativizzazione dell’HCV-RNA.
Tuttavia dopo la sospensione della terapia soltanto il 15% dei pazienti mantiene la risposta.
La negativizzazione dei livelli di HCV-RNA non esclude la possibilità di recidiva.
Al contrario dell’epatite B, nella C una risposta favorevole non si accompagna a un movimento delle
transaminasi.
Tuttavia la risposta prolungata si riduce al 25% dei soggetti o anche meno.
La persistenza di negatività di HCV-RNA per 6 mesi e transaminasi normali in genere esclude la possibilità
di riattivazione della malattia.
I pz che recidivano rispondono comunque a un secondo ciclo di terapia, tranne quelli che hanno un aumento
delle transaminasi, forse per la comparsa di Ab anti-IFN.
Alcuni studi clinici su piccolo campione indicano una > efficacia dell’IFN se somministrato insieme un
analogo nucleosidico come la ribavirina che è un antivirale.
La terapia non è applicata ai pz con malattia lieve o asintomatica e nemmeno a quelli con cirrosi
scompensata (Æ trapianto), con qualche rara eccezione se è presente crioglobulinemia sintomatica.
EPATITE E
È una epatite acuta di tipo epidemico detta indiana.
Simile all’HAV, è un virus a RNA+ a singola elica, di 32 nm, a trasmissione orofecale, presente in Asia,
Africa e America centrale.
Per molte caratteristiche appartiene agli alfavirus, ma è sierologicamente diverso da ogni altro.
Numerose epidemie sono state osservate nel subcontinente indiano, in Asia centrale e sud-oritentale, in nord
Africa, in numerosi paesi dell’URSS e del Nord America.
http://www.hackmed.org
[email protected]
16
Nei paesi industrializzati sono stati evidenziati soltanto casi sporadici in viaggiatori provenienti da zone
endemiche.
Casi sporadici sono stati associati al consumo di frutti di mare e ci sono stati casi secondari tra i contatti ed il
personale ospedaliero.
La prevalenza nella popolazione generale è del 3%.
Costituisce il 10% di epatiti NANB sono epatiti E.
La trasmissione dell’epatite E si verifica per via orofecale tramite acqua contaminata.
Le epidemie sono frequenti durante la stagione delle piogge, sono favorite dal sovraffollamento e dalle
carenze igieniche.
L’epatite E è clinicamente simile all’epatite A e si associa a gastroenterite.
Il periodo di incubazione è di 2-9 settimane (mediamente 6 settimane).
Si ha quindi una fase preitterica con dolore all’ipocondrio dx, nausea, vomito e febbre, quindi si ha la fase
itterica in cui può comparire prurito.
Nel 50% dei casi assume una impronta colestasica.
L’epatite E non cronicizza.
Una caratteristica fondamentale è l’alta incidenza di forme fulminanti (1-12%) ed una quadro molto grave in
gravidanza specialmente nel 3° trimestre con una letalità del 40%, probabilmente dovuta ad un danno
tossico pre problemi di tipo ormonale.
È stata osservata in associazione con la malattia un alta frequenza di CID.
La diagnosi viene fatta tramite la ricerca di Ab anti-HEV: in fase acuta sono presenti sia IgM che IgG
mentre in convalescenza sono presenti IgG che perdurano per tutta la vita.
EPATITE G
Flavivirus a RNA da 9,4 Kbp con trasmissione parenterale scoperto nel 1960.
Piuttosto raro, sebbene identificabile solo con la PCR, sembra che non sia in grado di dare una infezione
clinicamente evidente se non in associazione con l’HCV.
EPATITE NON A NON B
È la categoria diagnostica di esclusione che resta quando i test sierologici per tutti gli altri virus epatotropi
rimangono negativi.
In passato, prima dell’introduzione di test sierologici specifici, l’HCV era l’agente responsabile di una
significativa porzione di questo gruppo.
Per i restanti casi NANB è possibile l’esistenza di un altro agente detto virus mind: piccolo virus,
cloroformio-resistente, senza mantello.
In condizioni normali, nessuno dei virus epatotropi sembra in grado di dare un effetto citopatico diretto:
soprattutto per l’HBV.
Si propende perciò verso la teoria del danno immuno-mediato.
In effetti la presenza di un infiltrato infiammatorio di T attorno alle aree di necrosi, e la tendenza alla
cronicizzazione soprattutto in pazienti con disordini immunitari sembrano confermare questa teoria.
Si ritiene che gli antigeni ai quali i T siano più reattivi sono quelli del capside virale (HBC e HBE Antigene).
Dall’altra parte, la presenza di un quadro clinico diverso a seconda del tipo di virus, l’enorme aggravamento
della clinica dell’epatite B nella infezione delta, la possibilità, nei pazienti HBV+, di danno al fegato
trapiantato durante la terapia immunosoppressiva post-trapianto indicano che la partecipazione diretta del
virus al danno non è trascurabile.
Nei bambini nati da madre infetta, l’infezione si protrae per tutta la vita in modo praticamente asintomatico,
cosa che depone per una tolleranza.
Anatomia patologica
Il fegato appare aumentato di volume con distensione della glissoniana.
Il colorito è variabile dal rosso scuro al giallo-verdastro a seconda della fase della malattia e dell’intensità
dell’ittero.
In caso di epatite fulminante il volume appare ridotto fino ad 1/3 con un peso di 500 g.
La glissoniana appare raggrinzita.
Il fegato appare di forma normale e consistenza ridotta (molle).
Alla superficie di taglio è presente il tipico aspetto a carta geografica dovuto all’alternanza di aree di
parenchima normale rilevate ed aree di parenchima necrotico depresse e scure (la necrosi determina il
collasso della trama reticolinica e quindi il parenchima si affloscia).
Possono essere presenti diversi tipi di alterazioni necrotico-degenerative:
http://www.hackmed.org
•
[email protected]
17
degenerazione balloniforme: è caratterizzata dal rigonfiamento osmotico dell’epatocita (per
accumulo di acqua e dalla dilatazione del RE) che appare di forma rotondeggiante, con
citoplasma pallido e granuloso con bile o trombi biliari (materiale biliare ritenuto) e può essere
seguita dalla lisi cellulare
• necrosi acidofila a singola cellula: si formano dei corpi acidofili detti corpi di Cuncilman
rotondeggianti e irregolari che derivano dagli epatociti che con il processo di apoptosi hanno
espulso il nucleo (picnosi) e sono circondati da macrofagi *
• necrosi focale o spot necrosis: coinvolge piccoli gruppi di epatociti circondati da linfociti e
macrofagi
• necrosi confluente: interessa un maggior numero di epatociti fino ad una porzione di acino, la
trama reticolinica collassa determinando alterazione dell’architettura epatica
• necrosi a ponte: necrosi confluente dallo spazio portale verso la vena centrolobulare nella zona
3 dell’acino o da uno spazio portale ad un altro (necrosi periportale) nella zona 1, o nel
complesso da una vena centrolobulare ad un’altra
• piecemeal necrosis o necrosi parcellare: necrosi degli epatociti con graduale erosione
parenchimale all’interfaccia tra parenchima e connettivo cioè alla periferia del lobulo (nella
lamina limitante) caratterizzata da infiltrato infiammatorio
• necrosi panacinare: che coinvolge tutto l’acino
• necrosi multiacinare: che coinvolge più acini
* la necrosi acidofila è la tipica necrosi tossica o mediata immunologicamente mentre la necrosi ischemica è
di tipo coagulativo.
Epatite acuta classica
La necrosi è soprattutto focale confluente con formazione di corpi di Cuncilman, degenerazione balloniforme
e collasso della trama reticolinica della zona 3 con disarrangiamento delle lamine epatocitarie.
È presente colestasi cioè ristagno di bile sia nei canalicoli biliari (per compressione da parte delle cellule
rigonfie) che all’interno degli epatociti.
I fenomeni necrotici sono più evidenti nella zona 3 dell’acino e talvolta anche nella zona 1 (periportale).
È presente infiltrato linfocitario con linfociti, plasmacellule e macrofagi e poi anche PMN ed eosinofili.
Le cellule di Kupfler e le cellule perisinusoidali vanno incontro a ipertrofia e iperplasia e risultano piene di
pigmenti lipofuscinici e residui della fagocitosi di detriti cellulari.
Epatite acuta con necrosi a ponte
È una forma più grave caratterizzata dagli stessi reperti dell’epatite acuta classica + la necrosi a ponte.
La diagnosi differenziale con l’epatite cronica viene fatta tramite colorazioni speciali per le fibre elastiche.
Le zone distrutte sono sostituite da aree cicatriziali.
Epatite acuta con necrosi panacinare
È presente necrosi panacinare e multiacinare.
Al posto del parenchima è presente lo stroma collassato e si ha proliferazione di strutture simili ai canalicoli
biliari a livello dello spazio portale.
Epatite acuta con necrosi periportale
È caratterizzata da necrosi nella zona 1 o periportale a livello della lamina limitante con infiammazione sia
portale che periportale.
La colestasi è talvolta notevole.
Portatore sano
È asintomatico con assenza di danno epatico.
Gli epatociti però presentano l’aspetto a vetro smerigliato per la presenza del virus all’interno del
citoplasma (citoplasma granuloso) che è svelabile anche attraverso l’immunoistochimica.
Portatore sano con malattia epatica cronica
Può essere sintomatico o asintomatico e presenta danno epatico.
Clinica
Possiamo distinguere:
• periodo di latenza
• fase preitterica
dura circa 1 settimana.
È caratterizzata da febbre intermittente, dolori addominali lievi al fianco destro dovuti alla distensione della
glissoniana, talvolta spontanei o dopo compressione.
http://www.hackmed.org
[email protected]
18
È presente astenia, anorresia, nausea e vomito.
Inoltre si ha leucopenia.
La fase preitterica è più frequente nell’epatite A e meno evidente nell’epatite B e C.
Circa il 10% dei pazienti con epatite acuta, in genere i pazienti con epatite B sviluppano una malattia da siero
caratterizzata da febbre, rash cutanei artralgie dovute agli ICC.
• fase itterica
al 7-8° giorno scompare la febbre e compare l’ittero.
La fase itterica è comune negli adulti (ma non nei bambini) con epatite A mentre è presente nel 50% dei
pazienti con epatite B e in una piccola percentuale dei pazienti con epatite C.
Sono presenti sintomi e valori di laboratorio indicativi di ittero epatico prevalentemente da bilirubina
coniugata.
Il fegato è lievemente aumentato di volume e moderatamente molle alla palpazione.
I sintomi sistemici si attenuano.
• Fase della convalescenza
Dopo qualche settimana o mese i sintomi sistemici e l’ittero spariscono.
Epatiti croniche da farmaci
La suscettibilità del fegato al danno mediato da farmaci è la conseguenza del suo ruolo primario nel
metabolismo delle sostanze esogene compresi molti farmaci, la cui lipofilia non consente una adeguata
eliminazione attraverso il rene.
Queste sostanze infatti a livello dell’epatocita vengono trasformate in composti idrosolubili più facilmente
eliminabili attraverso la bile o le urine.
La biotrasformazione avviene a livello del reticolo endoplasmatico liscio (sistema microsomale) in 2 tappe:
• Reazione di fase I o bioattivazione in cui si producono metaboliti attivi che sono poi detossificati
tramite
• Reazione di fase II o di coniugazione
Il principale sistema enzimatico delle reazioni di fase I è rappresentato dal citocromo P-450 che presenta
una notevole eterogeneità individuale e ciò è responsabile della diversa suscettibilità individuale su base
genetica ai farmaci.
Il danno epatico può essere distinto in:
• Diretto
• Immunomediato quando è associato ad ipersensibilità immunologica (il farmaco funge da aptene o
genera dei neoantigeni a livello degli epatociti)
Le sostanze tossiche che possono dare un danno epatico diretto e prolungato sono moltissime. Per questo
motivo, ogni paziente che arriva con ittero ed interessamento epatico deve essere attentamente valutato con
anamnesi (anamnesi farmacologica) e screening vari sulla possibilità di un contatto professionale, medico o
ambientale con le seguenti categorie di composti:
• Sostanze di provenienza industriale: tetracloruro di carbonio, fosforo giallo, tricloroetilene.
• Octapeptidi biciclici: avvelenamento epatico da funghi (amanita e galerina)
• Vari farmaci comuni: paracetamolo, metildopa, isoniazide, sodio valproato, alotano, fenitoina,
clorpromazina (psicofarmaco) amiodarone, eritromicina, contraeccettivi orali, steroidi anabolizzanti,
trimetoprim.
Le sostanze tossiche elencate agiscono spesso come tossina diretta o come effetto dei metaboliti epatici
prodotti in loco.
Gli effetti sul fegato sono dose-dipendenti e sono prevedibili sulla base alla durata dell’esposizione. Questo
non vale nel caso di reazioni idiosincrasiche a farmaci, quando l’effetto è imprevedibile e indipendente
dalla dose. Tali reazioni sono giustificate sulla base di una reattività immunologica e anche sulla personale
capacità metabolizzante del DMES, del P-450 e sulla capacità detossificante dei sistemi microsomiali.
Vengono di seguiti descritti i meccanismi di azione di alcuni dei composti più importanti.
Paracetamolo: Danno epatico diretto, necrosi centrolobulare. Dose letale a 25g, danno epatico clinicamente
manifesto a 10-15g. Dopo 4-12 ore dall’ingestione si verificano nausea, vomito, diarrea e shock, che
successivamente si attenuano e compaiono i segni di tossicità epatica. Le transaminasi possono arrivare a
http://www.hackmed.org
[email protected]
19
10.000. Il danno è sostenuto da un metabolita tossico prodotto dal P-450, che è inattivato tramite
coniugazione con i glutatione. Quando è in eccesso, si lega covalentemente a molte molecole intracellulari.
Alotano: Reazione idiosincrasica a questo composto usato prevalentemente nella pratica anestetica, e
strutturalmente simile al cloroformio. Abbastanza rara. Succede per lo più nelle donne, e si manifesta dopo
7-10 giorni con febbre, leucocitosi ed ittero. C’è necrosi epatica massiva come per l’epatite virale.
Metildopa: Lievi reazioni con modeste alterazioni della funzionalità epatica nell’1-5% dei pazienti in
terapia, che di solito scompaiono da soli senza bisogno di sospendere la terapia. A volte però c’è necrosi a
ponte simile all’epatite virale, che di solito si risolve alla sospensione della terapia.
Isoniazide: Questo farmaco antitubercolare produce nel 10% dei pazienti un innalzamento delle transaminasi
a valori di solito inferiori alle 200 unità. Nei soggetti più anziani, c’è però la possibilità di un danno più
grave, simile all’epatite virale, che ha una mortalità del 10%. Questa tossicità diretta viene potenziata
dall’alcool e dall’assunzione della rifampicina.
Eritromicina: L’effetto più importante è la reazione colestatica, per altro rara, che si ha nelle prime 2-3
settimane di trattamento. La malattia ricorda una colica biliare acuta, e alla biopsia si osserva infiltrato
periportale che provoca la stasi. E’ una reazione idiosincrasica infiammatoria.
Altri composti che danno la reazione colestatica sono i contraccettivi orali, alcuni antibiotici e gli steroidi
anabolizzanti.
NB: la presenza di shunt portocavali in corso di ipertensione portale sottrae una certa quantità di farmaci alla
metabolizzazione epatica e pertanto ne altera la biodisponibiità e l’emivita potendo portare ad effetti tossici
anche a dosi terapeutiche.
Clinica
Il danno epatico da farmaci può manifestarsi in forma acuta o cronica.
Le forme acute si manifestano come epatite acuta citotossica con necrosi epatocellulare o come epatite acuta
ad impronta colestasica.
Le forme croniche si manifestano come epatite cronica attiva, fibrosi o cirrosi.
Il danno epatico inoltre si può manifestare anche prevalentemente come lesione a carico delle strutture
vascolari (malattia veno-occlusiva, sindrome di Budd-Chiari).
Terapia
Si basa fondamentalmente sulla sospensione del farmaco.
CIRROSI EPATICA
Malattia diffusa del fegato ad andamento cronico progressivo irreversibile.
È caratterizzata da un completo sovvertimento della normale architettura epatica per la necrosi con
successiva formazione di noduli di rigenerazione (che mancano della normale architettura lobulare) in un
tessuto cicatriziale di tipo fibrotico.
Dal punto di vista morfologico la cirrosi è fondamentalmente caratterizzata dalla presenza di noduli
rigenerativi distribuiti uniformemente sulla superficie dell’organo i quali sono circondati da setti fibrosi.
Anche se la fibrosi epatica non è sinonimo di cirrosi essa rappresenta un importante elemento morfologico
della malattia essendo la conseguenza diretta della necrosi epatocitaria indipendentemente della patogenesi
della malattia.
I 2 criteri istologici fondamentali per fare diagnosi di cirrosi sono rappresentati dalla presenza di fibrosi e
noduli di rigenerazione.
• Presenza di noduli senza fibrosi = iperplasia nodulare
• Presenza di setti fibrosi in assenza di noduli = fibrosi epatica
http://www.hackmed.org
[email protected]
20
La fibrosi a livello degli spazi interlobulari determina il sovvertimento dell’architettura vascolare epatica
determinando ipertensione portale.
Questi aspetti sono la conseguenza della necrosi epatocitaria, del collasso del reticolo di sostegno con
successiva deposizione di tessuto fibrotico, del sovvertimento del letto sinusoidale e della rigenerazione del
parenchima residuo.
In base alla dimensione dei noduli si possono distinguere 2 forme di cirrosi:
• Micronodulare con noduli < 3 cm
• Macronodulare con noduli >3 cm
• Mista (micro-macronodulare)
Talvolta l’aspetto micronodulare è presente solo nelle prime fasi della malattia con successiva evoluzione
nella forma macronodulare.
La cirrosi alcolica è tipicamente micronodulare mentre la cirrosi postnecrotica è tipicamente macronodulare.
In base al peso del fegato la cirrosi si può inoltre distinguere in:
• Ipotrofica con fegato < 1.5 kg
• Ipertrofica con fegato > 1.5 kg
La reale incidenza della cirrosi è difficile da quantificare poiché circa il 40% delle cirrosi rimane
asintomatico e viene diagnosticato casualmente incorso di esami di routine o addirittura all’autopsia.
La storia naturale della malattia e piuttosto lunga ed è influenzata dall’iterazione tra l’agente eziologico ed i
fattori dell’ospite.
Eziopatogenesi
Le cause più frequenti di cirrosi epatica sono rappresentate da:
1) Epatopatia alcolica (60%)
2) Infezioni da virus B (9%) e C (28%)
3) Farmaci o tossici
4) Epatite autoimmune
5) Malattie congenite del metabolismo (emocromatosi, morbo di Wilson, deficit di α1-antitripsina)
6) Ostruzione biliare (cirrosi biliare primitiva o secondaria e colangite sclerosante primitiva)
7) Scompenso cardiaco (cirrosi cardiaca)
La cosiddetta cirrosi criptogenetica ha patogenesi del tutto sconosciuta ed è probabilmente da correlare ad
un insieme di fattori sia individuali che ambientali.
Nel caso della cirrosi secondaria ad epatite virale l’evoluzione e la storia naturale della malattia è correlata a
fattori legati all’ospite (risposta immunitaria) e fattori legati all’infezione (viremia, genotipo del virus).
Importanti per la diagnosi eziologica della malattia sono i test di laboratorio che possono evidenziare la
presenza di marcatori virali o di alterazioni di enzimi o alterazioni metaboliche specifiche di una determinata
malattia primaria (ex. Incremento di AST, γGT e IgA nella cirrosi alcolica).
Anatomia Patologica
L’aspetto macroscopico è variabile:
• peso normale aumentato o diminuito
• superficie in fase iniziale normale o finemente granulare poi diventa bernoccoluta
• consistenza inizialmente variabile (dipende dalla malattia di base) in fase avanzata aumentata
• superficie di taglio nodulare
• colore: giallo se la cirrosi insorge su fegato steatosica (in fase avanzata bruno), verde in caso di
cirrosi biliare, bruno in caso di cirrosi emocromatosica
Nel fegato normale il collagene di tipo I e III sono presenti negli spazi portali mentre il collagene di tipo IV
forma una fitta trama reticolinica tra gli epatociti composta da tralci delicati a livello dello spazio di Disse.
Nella cirrosi il collagene di tipo I e III si deposita in tutte le porzioni dei lobuli e si ha il sovvertimento della
trama reticolinica.
Gli epatociti necrotici vengono sostituiti da tralci fibrosi delicati (porto-portali, porto-centrali o
centrocentrali) o a bande grossolane.
Nonostante che gli epatociti siano in grado di sintetizzare collagene la fonte principale di questo sembrano
essere le cellule di Ito che si trasformano in miofibroblasti su stimolazione delle citochine infiammatorie o
delle tossine.
Inizialmente si verifica un danno funzionale dovuto alla contrazione dei miofibroblasti che determina
vasocostrizione dei sinusoidi con conseguente incremento delle resistenze epatiche e successivamente si ha
un danno anatomico.
http://www.hackmed.org
[email protected]
21
La collagenizzazione dello spazio di Disse è accompagnata dalla perdita delle fenestrature delle cellule
endoteliali sinusoidali che determina riduzione degli scambi.
Il danno vascolare è particolarmente grave nella cirrosi postnecrotica di origine virale dove il danno è a
livello dello spazio di Disse (piecemail necrosis).
La fibrosi inoltre determina disorganizzazione della struttura vascolare con formazione di interconnessioni
anomale tra arterie e vene a livello lobulare che sta alla base della genesi dell’ipertensione portale.
La fibrosi nella cirrosi alcolica inizia dalla vena centrolobulare mentre nella cirrosi postnecrotica di
origine virale inizia dallo spazio portale.
La fibrosi può determinare lo spostamento in sede eccentrica della vena centrolobulare.
La rigenerazione degli epatociti per iperplasia sta alla base della formazione dei noduli di rigenerazione che
possono essere di dimensioni variabili: molto piccoli, piccoli, grandi.
I noduli di rigenerazione sono privi della vena centrolobulare.
Quando è presente infiltrazione linfomonocitaria spiccata dello spazio portale la cirrosi è detta attiva ed è
associata ad una evoluzione più rapida.
Clinica
Le manifestazioni cliniche della malattia sono causate dall’insufficienza epatica e dall’ipertensione
portale.
Nella forma latente della malattia molto spesso il riscontro è del tutto casuale incorso di esami di routine o
per la presenza di altri sintomi.
La cosiddetta cirrosi epatica plantanica è quella che viene scoperta casualmente in corso di autopsia poichè
è completamente asintomatica.
La cirrosi dal punto di vista clinico può essere classificata in:
• Non complicata che può essere asintomatica
• Complicata che è sintomatica e può essere
1. compensata
2. scompensata
L’evoluzione della malattia può essere lenta nel tempo e la prognosi è imprevedibile in quanto le condizioni
del paziente possono precipitare in seguito ad eventi clinici intercorrenti.
Il quadro clinico della cirrosi avanzata ed in fase di scompenso è piuttosto peculiare, le condizioni generali
appaiono compromesse e precarie essendo molto spesso complicate da eventi emorragici del tratto
gastroenterico.
Anoressia
Astenia
Ittero
Epatospenomengalia
Spider-nevi (telangectasie)
Eritema palmare
Dolorabilità epatica e dolore addominale
Acne
Rash
Encefalopatia
Ascite o edemi
Varici esofagee
Irsutismo
Artriti
Manifestazioni cushingoidi
Laboratorio
Si ha alterazione degli indici di funzionalità epatica che evidenziano una compromissione dell’attività
biosintetica epatica:
transaminasi sieriche (ALT e AST) sono in genere solo modestamente alterate (in caso di aumento
a
significativo delle transaminasi parliamo di cirrosi attiva)
γ−GT sono elevate soprattutto in corso di cirrosi alcolica, cirrosi biliare o di epatocarcinoma essendo
a
un indice sensibile della colestasi presente in queste forme
fosfatasi alcalina risultano elevate nel 70% dei pazienti con cirrosi soprattutto nei casi ad impronta
a
colestatica oppure in corso di cirrosi biliare o di epatocarcinoma
http://www.hackmed.org
[email protected]
22
Albumina indice della capacità protidosintetica epatica è in genere ridotto soprattutto nei pazienti che
presentano edemi e ascite
Ipergammaglobulinemia policlonale (le IgA sono aumentate incorso di cirrosi alcolica, le IgG
a
incorso di cirrosi autoimmune e le IgM in corso di cirrosi biliare primitiva)
Tempo di protrombina è aumentato
a
Fattori della coagulazione (in particolare fattore V e VII) sono ridotti
a
Leucopiastrinopenia secondaria all’ipersplenismo dovuto all’ipertensione portale
a
Anemia di tipo macrocitico in corso di cirrosi alcolica per deficit di folati e di vitamina B12 o anemia
a
Fe carenziale secondaria al sanguinamento cronico delle vie digerenti
Diagnosi
Si basa fondamentalmente sulla biopsia epatica.
Il riscontro di steatosi sarà suggestivo per la patogenesi alcolica della cirrosi mentre il riscontro di epatociti a
vetro smerigliato e di inclusioni virali (corpi di Mallory) saranno tipici per la patogenesi virale.
La biopsia epatica è fondamentale per la diagnosi differenziale con la colangite sclerosante primitiva.
La valutazione dei sinusoidi epatici permette una di diagnosticare la cirrosi cardiaca.
La biopsia epatica è fondamentale per la diagnosi differenziale con l’epatocarcinoma.
La finalità della diagnostica per immagini nello studio della cirrosi non è l’effettuazione della diagnosi ma il
monitoraggio dell’evoluzione della patologia (in particolare l’ipertensione portale) e l’individuazione
precoce dell’epatocarcinoma.
L’ecografia consente di rilevare:
9 Alterazioni volumetriche
9 Alterazioni morfostrutturali: ecostruttura disomogenea, margini irregolari
9 Alterazioni vascolari: vasi portali intraepatici e vene sovraepatiche compresse e dislocate,
ricanalizzazione delle vene ombelicali, trombosi portale
9 Eventuali lesioni nodulari che nel sospetto di epatocarcinoma vanno sottoposte a biopsia
Nelle forme micronodulari l’ecografia può risultare normale.
L’eco-doppler consente uno studio dell’ipertensione portale.
La TC con m.d.c. consente una migliore valutazione dei circoli porto-sistemici soprattutto retroperitoneali e
lo studio della vascolarizzazione di un nodulo epatico sospetto (d.d. epatocarcinoma e nodulo di
rigenerazione).
Alla RM i noduli di rigenerazione appaiono iperintensi perchè si verifica acculo di ferro che è
paramagnetico.
L’arteriografia ha come unica indicazione lo studio della vascolarizzazione di una massa sospetta e la
valutazione delle sue possibilità terapeutiche con la possibilità di chemioembolizzazione.
Consente inoltre di identificare eventuali shunt porto-sistemici.
Terapia
Il trattamento di elezione per la cirrosi epatica è il trapianto di fegato.
Il trattamento medico si basa su misure dietetiche volte a ridurre le alterazioni metaboliche come un aumento
dell’apporto proteico e una riduzione dell’apporto di sale.
La terapia in generale è quella delle specifiche complicanze presenti.
a
Epatopatia e Cirrosi Alcolica
Esiste una stretta correlazione tra alcol ed epatopatia (in genere cirrosi).
La cirrosi alcolica detta anche di Laennec-Morgagni, è la forma + diffusa nel Nord America e in molte aree
dell’Europa.
Eziologia
Alcuni fattori predispongono o possono contribuire allo sviluppo della malattia:
Caratteristiche dei bevitori : esiste una estreme variabilità tra quantità di alcol assunto e sviluppo
della malattia, in genere si considera pericoloso un consumo di alcol superiore a 60g/die nell’uomo e
40g/die nella donna, è molto importante anche la durata dell’abuso alcolico calcolata di circa 10-15
anni per l’insorgenza di cirrosi alcolica, inoltre il danno epatico non dipende dal tipo di bevanda
alcolica consumata ma unicamente della quantità di alcol in essa contenuta. Il tempo di latenza è
inversamente proporzionale al consumo.
A parità di introito alcolico non tutti i soggetti sviluppano danno epatico, ne nella stessa entità, ne nel
medesimo tempo.
http://www.hackmed.org
[email protected]
23
Pertanto altri fattori sia genetici che esogeni possono condizionare la suscettibilità all’insorgenza di
epatopatie alcol-correlate.
Sesso : il sesso femminile è più sensibile al danno epatico da alcol per un ridotto volume di
distribuzione rispetto all’uomo e per una minore capacità di metabolismo dell’etanolo, ciò è dimostrato
dal riscontro di livelli di alcolemia più alti rispetto all’uomo dopo assunzione di una analoga dose do
alcol inoltre la donna sviluppa un danno cronico evolvente in cirrosi anche dopo la sospensione
dell’alcol
Fattori genetici : la differente capacità di metabolizzazione ed eliminazione dell’alcol dipende dal
polimirfismo genetico dei 2 sistemi enzimatici deputati al metabolismo dell’alcol : MEOS (microsomal
enzyme oxidative system) e ADH (acetaldeide deidrogenasi)
Fattori nutrizionali: la malnutrizione promuove gli effetti tossici dell’alcol tramite la deplezione degli
aminoacidi e degli enzimi epatici e soprattutto di vitamine antiossidanti.
Fattori immunologici, sintesi di collageno e rigenerazione epatocellulare
Virus epatici che rinforzano il danno epatico
Farmaci
Eziopatogenesi
L’alcol etilico è contenuto in tutte le bevande alcoliche in una concentrazione che varia dal 4-7% per la birra
al 12-13% nel vino fino ad oltre il 60% nei superalcolici.
Un individuo sano può metabolizzare fino a 160-180 g/die di alcol anche se tale quantità può essere superata
per un fenomeno di induzione da parte dell’alcol stesso sulle sue vie metaboliche.
Un grammo di alcol produce circa 7 calorie perciò il suo consumo limita l’apporto nutrizionale di altre
sostanze in particolare di proteine.
Dopo l’ingestione una piccola percentuale di alcol viene direttamente metabolizzata a livello della mucosa
gastrica ad opera dell’acetaldeide deidrogenasi ivi presente, il resto viene rapidamente assorbito a livello
gastrico (25%) e successivamente a livello intestinale e quindi passa in circolo.
L’assorbimento è rapido tanto che entro 5-10 minuti ne può essere dimostrata la presenza nel sangue e la
concentrazione plasmatica massima viene raggiunta entro 30-90 minuti.
La capacità di assorbimento dipende dalla modalità di assunzione in quanto se l’alcol è assunto a stomaco
vuoto viene più facilmente assorbito: è stato calcolato che l’alcolemia massima si realizza in 40 minuti a
stomaco pieno e in 5-10 minuti a stomaco vuoto.
In piccola parte 2-10% viene eliminato tramite polmoni, urine e sudore mentre per la maggior parte viene
catabolizzati a livello epatico.
La capacità di metabolismo epatico è alla base della tolleranza all’alcol e dipende da fattori genetici ed
anche dal sesso visto che le donne hanno una minore capacità di metabolizzazione.
L’ossidazione dell’alcol ad acetaldeide avviene in condizioni normali principalmente ad opera dell’alcol
deidrogenasi (ADH) enzima situato nel citosol dell’epatocita, in via alternativa avviene a livello del MEOS
sistema microsomale che è maggiormente rappresentato nella zona 3 dell’acino.
Quest’ultimo possiede uno specifico citocromo denominato P-450E1 che può essere indotto dall’etanolo
stesso diventando in caso di abuso cronico di alcol il sistema predominante di metabolizzazione dell’etanolo.
Sia l’alcol deidrogenasi che il MEOS producono acetaldeide che viene quindi trasformata dall’acetaldeide
deidrogenasi in acetato che viene quindi convertito in acetil-CoA.
Durante l’ossidazione con l’alcol deidrogenasi si ha la formazione di NADH dal NAD e durante
l’ossidazione con il MEOS si formano radicali dell’ossigeno potenzialmente lesivi.
L’acetaldeide è una molecola estremamente reattiva capace di legarsi ai fosfolipidi e ai gruppi sulfidrilici
degli aminoacidi.
Inoltre l’acetaldeide può indurre la depolimerizzazione delle proteine di membrana determinando la
formazione di neoantigeni e quindi di anticorpi.
Essa inoltre è in grado di legarsi alla tubulina determinando alterazione del citoscheletro e formazione dei
cosiddetti corpi di Mallory = aggregati eosinofili di acetaldeide e proteine dell’apparato citoscheletrico.
L’aumento della concentrazione delle proteine del citoplasma legate all’acetaldeide determina un incremento
dell’acqua intracellulare con rigonfiamento cellulare che provoca l’epatomegalia tipica dell’epatite alcolica
in fase florida.
L’acetaldeide è a sua volta degradata dall’acetaldeide deidrogenasi e dalla xantina ossidasi, enzimi in grado
di produrre radicali liberi.
http://www.hackmed.org
[email protected]
24
I radicali liberi a loro volta determinano perossidazione lipidica e ossidazione delle proteine con perdita
della loro capacità di essere escrete, l’accumulo di proteine ossidate non secrete all’interno dell’epatocita è
responsabile del rigonfiamento cellulare.
Una caratteristica tipica dell’epatopatia alcolica è rappresentata dalle alterazioni a carico dei mitocondri
che sono di tipo sia funzionale che strutturale.
L’alterazione è determinata dall’ossidazione di lipidi e proteine e determina un disaccoppiamento tra
ossidazione e fosforilazione.
L’aumento del rapporto NADH/NAD dovuto all’incremento dell’attività ossidativa determina profonde
alterazioni metaboliche:
P Riduzione della gluconeogenesi
P Aumento dell’acido lattico (lattosi)
P Aumento della produzione di corpi chetonici (chetosi) per accumulo di acetil-CoA
P Aumento della liposintesi per conversione dell’acetil-CoA in acidi grassi
P Riduzione dell’escrezione di acido urico (iperuricemia)
P Riduzione dell’ossidazione degli acidi grassi che si accumulano in vacuoli
L’accumulo di lipidi all’interno del citoplasma dipende da:
1. accumulo di grassi di origine alimentare
2. trasporto di acidi grassi dal tessuto adiposo
3. neosintesi epatica
4. riduzione della ossidazione degli acidi grassi
5. alterazione dei meccanismi di trasporto ed escrezione dei lipidi a causa delle alterazioni del
citoscheletro
si ritiene che la fibrosi indotta da alcol sia dovuta alla trasformazione delle cellule di Ito a causa
dell’accumulo di etanolo al loro interno in fibroblasti capaci di sintetizzare fibre collagene.
La progressione del danno epatico anche dopo sospensione di alcol è stata messa in relazione a fenomeni
immunologici: il legame dell’acetaldeide alle proteine di membrana determina la formazione di neoantigeni
in grado di stimolare la produzione di anticorpi.
La presenza di IC sulle membrane epatocitarie sarebbe responsabile dell’attivazione di PMN e complemento
e della citotossicità cellulare anticorpo-dipendente.
etanolo
ADH
NAD-NADH
MEOS
NADP-NADPH
acetaldeide
Blocco del ciclo
di Krebs
acetato
Accumulo piruvato
Accumulo di acetil-CoA
lattato
Aumento lattacidemia
Aumento acidi grassi
Acidosi renale
Aumento trigliceridi
Sintesi di corpi
chetonici
http://www.hackmed.org
[email protected]
25
Aumento uricemia
gotta
Steatosi
epatica
iperlipidemia
Il danno epatico si instaura per gradi successivi
• Epatomegalia (imbibizione idrica degli epatociti)
• Steatonecrosi
Fino a questo livello è possibile la
• Epatite alcolica
regressione sospendendo l’assunzione
-Lieve
alcolica
-Moderata
-Severa
• Fibrosi senza noduli / iperplasia nodulare (noduli piccoli senza setti fibrosi)
• Cirrosi micronodulare < 3mm
• Epatocarcinoma
Queste lesioni in genere sono focali cioè possono coesistere, essendo in alcune parti più gravi ed in altre di
meno, perciò è sempre indicata la biopsia multipla.
Steatosi epatica
È la lesione più comune per lo più asintomatica e reversibile.
Il fegato appare aumentato di volume, di consistenza molle, superficie liscia, colorito giallastro e superficie
di taglio untuosa.
All’interno degli epatociti si accumulano piccole gocciole lipidiche (steatosi microvescicolare) che
successivamente aumentano di dimensioni formando degli ampi spazi vescicolari che comprimono e
dislocano il nucleo alla periferia (cirrosi macrovescicolare).
Tale fenomeno coivolge inizialmente la porzione centrolobulare (zona 3 che è quella meno perfusa in cui il
metabolismo è quindi maggiormente anaerobio e in cui è maggiormente rappresentato il MEOS) e
successivamente coinvolge l’intero acino.
Finché non compare la fibrosi la cirrosi è completamente reversibile con la cessazione dell’assunzione di
alcol.
La fibrosi inizia dalla regione centrolobulare.
Il paziente si presenta generalmente asintomatico ed i test biochimici si presentano solo lievemente alterati,
la sospensione dell’alcol porta ad una progressiva risoluzione del quadro clinico con scomparsa degli
accumuli lipidici.
Epatite alcolica
È caratterizzata dalla presenza di necrosi epatocitaria e flogosi che può essere reversibile con la sospensione
dell’alcol se il danno è lieve ma se la necrosi è maggiore e compare fibrosi diventa irreversibile con
progressione verso la cirrosi.
La necrosi coinvolge soprattutto le regioni centrolobulari ed è circondata da infiltrato PMN (satellitosi).
Caratteristica è la formazione dei corpi di Mallory rappresentati da aggregati citoplasmatici di citocheratina
e proteine che appaiono come inclusioni citoplasmatiche eosinofile.
Sono presenti anche nella cirrosi biliare, nel morbo di Wilson e nell’epatocarcinoma.
È presente fibrosi pericellulare (intorno a singole cellule o a gruppi di cellule) perisinusoidale e perivenulare
fino all’obliterazione della vena centrolobulare.
Talvolta si hanno fenomeni di necrosi confluente e raramente fenomeni veno-occlusivi dovuti all’occlusione
o al restringimento della vena centrolobulare per fibrosi che determina ipertensione portale in assenza di
cirrosi.
In alcuni casi si può avere colestasi intraepatica.
Il quadro clinico è più grave e progredisce verso l’insufficienza epatica e gli esami biochimici rivelano una
alterazione della funzionalità epatica, la prognosi è peggiore della steatosi e nella maggior parte dei casi si ha
progressione verso la cirrosi (la mortalità e dell’80% a causa delle alterazioni metaboliche).
Cirrosi alcolica
Può originare da una epatite alcolica o in assenza di questa.
http://www.hackmed.org
[email protected]
26
é del tutto sintomatica nel 10% dei pazienti ed è riscontrabile in associazione all’epatite alcolica, nella
maggior parte dei casi è di tipo micronodulare e poi tende a diventare mista.
Macroscopicamente il fegato appare inizialmente aumentato di volume (poiché evolve a partire dalla
steatosi) di consistenza normale, con superficie liscia, di colorito giallastro e superficie di taglio untuosa.
Successivamente il volume si riduce a causa della maggiore fibrosi e della riduzione del tessuto adiposo (?) il
colorito diventa brunastro (perché viene meno il colorito giallastro della steatosi e ricompare il colorito bruno
degli epatociti) e si ha un tipico stridore al taglio.
In fase avanzata il volume è notevolmente ridotto, la superficie è bernoccoluta nodulare e irregolare, la
glissoniana è ispessita e raggrinzita a causa della retrazione del parenchima, la consistenza è dura, la
superficie di taglio appare nodulare e brunastra e sono visibili noduli di variabili dimensioni e tralci fibrosi
grigiastri più o meno spessi.
Microscopicamente sono presenti inizialmente stralci fibrosi sottili e poi si ha fibrosi marcata e grossolana.
La fibrosi coinvolge sia la vena centrolobulare che lo spazio portale che appaiono sommersi da tessuto
sclerotico ed in contiguità tra di loro per la scomparsa del parenchima.
Nel tessuto sclerotico è presente infiltrato linfoide con proliferazione dei dotti biliari.
Inizialmente l’attività rigenerativa del parenchima intrappolato dai tralci fibrosi porta alla formazione di
piccoli noduli di rigenerazione mentre con il passare del tempo la nodularità diventa più prominente.
Si ha rigenerazione epatocellulare insufficiente: le lamine epatocitarie sono più spesse, con mancanza di
orientamento radiale, i sinusoidi sono alterati e deformati e mancano i rapporti con la vena centrolobulare e
lo spazio portale.
Vi è inoltre sovvertimento della trama reticolare.
Il quadro clinico ed i test di laboratorio sono quelli corrispondenti ai diversi stadi propri della cirrosi.
Caratteri distintivi della cirrosi alcolica sono rappresentati da:
• Setti fibrosi dagli spazi portali alla vena centrolobulare e tra uno spazio portale e l’altro
• Coesistenza di necrosi epatocitaria e steatosi
• Presenza di corpi di Mallory
Abuso di alcol
steatosi
Epatite alcolica
acuta
Quadro
subclinico
C I R R O S I
Clinica
La steatosi epatica di norma non si associa a nessuna evidenza clinica di malattia, se non una modesta
epatomegalia talora associata a dolenzia.
Ben diversa e variabile l’epatite alcolica, dove il quadro va dall’asintomaticità fino all’insufficienza epatica
letale.
Il quadro tipico è anoressia, nausea, vomito, malessere, calo ponderale, disturbi addominali e ittero, con
febbre elevata nella metà dei casi.
Nei casi gravi possono essere anche presenti i segni delle complicazioni della cirrosi, ascite, edema,
encefalopatia e sanguinamento.
Anche questi casi estremi tendono a migliorare e addirittura a regredire completamente con l’astensione
dall’alcool, ma lo fanno con estrema lentezza, e possono aversi crisi di insufficienza epatica perfino fatali.
http://www.hackmed.org
[email protected]
27
La cirrosi alcolica invece può anche silente, almeno nel 10-40% dei casi.
Più spesso l’esordio dei sintomi è insidioso e si manifesta di solito entro 10 anni dall’inizio dell’abuso
cronico.
A differenza delle altre manifestazioni della malattia alcolica, la cirrosi non ha niente di specifico, se non una
moderata tendenza a migliorare con l’astinenza dall’alcool, che però non porta mai alla regressione.
Il quadro clinico di insufficienza epatica si accompagna anche a sintomi che derivano dall’intossicazione
alcolica cronica.
L’etanolo provoca un effetto tossico diretto o indiretto su diversi apparati:
• Cardiovascolare: basse dosi di alcol hanno un effetto protettivo sull’aterosclerosi per l’effetto
antiossidanti con aumento di HDL e riduzione di LDL mentre l’abuso cronico determina ipertensione,
cardiomiopatia dilatativa (per carenza di timina ed effetto diretto dell’etanolo), aritmie
• Gastroenterico: aumento della secrezione acida + effetto lesivo sulla mucosa Æ gastrite cronica ed
esofagite. Alterazioni pancreatiche che portano facilmente alla pancreatite. Alterazioni a livello
intestinale che determinano diarrea e sindrome da malassorbimento.
• Urogenitale: aumento dell’incidenza di calcoli.
• Endocrino: aumento della secrezione di ormoni steroidei, ipofisari e inibizione del metabolismo degli
steoidi Æ ginecomastia ed atrofia testicolare, aumento del grado di inattivazione del testosterone per
induzione degli enzimi microsomiali epatici.
• Fegato: steatosi da inibizione del metabolismo ossidativo Æ epatite alcolica Æ cirrosi epatica Æ
ipertensione portale. Il deficit dietetico dell’alcolista è prodotto dalla diminuzione dell’assunzione di
cibo in quanto le sue esigenze caloriche sono tutte soddisfatte dall’assunzione di etanolo, ma non quelle
vitaminiche e proteiche. In particolare il deficit di tiamina provoca degenerazione nervosa e anemia
megaloblastica.
• Metabolismo: aumento HDL e diminuzione aggregazione piastrinica (effetti protettivi nelle malattie
cardiovascolari). Non si sa se questi effetti siano significativi perché molto dipendono dalla dieta che il
paziente segue.
• Emopioiesi: l’alcol ha effetto mielotossico determinando anomalie di piastrine e leucociti e anemia a
cui contribuisce anche il deficit di tiamina e di Fe in caso di emorragie GI
• Sviluppo fetale: sindrome fetale da alcool (FAS), che è una serie di malformazioni e deficit
neurologici o fisici, dal lieve ritardo mentale fino alle anomalie cardiache, prodotte nel feto dalla
presenza di abuso di alcool nella madre. La sindrome completa è rara, ma spesso si ha una alterazione di
sviluppo mentale nel feto. Per questo sono sufficienti anche occasionali eccessi alcolici durante la
gravidanza.
• Alterazioni neurologiche: la più frequente anomalia è la polineuropatia periferica distale simmetrica
che si manifesta con parestesie a livello di mani e piedi, alterazioni degenerative del SNC determinano
invece atassia e disturbi della deambulazione, raramente si verifica la sindrome di Wernicke-Korsakoff
caratterizzata da paralisi dei muscoli esterni dell’occhio, atassia ed alterazioni dello stato mentale che
possono portare fino al coma ed alla morte (è dovuta a deficit di tiamina), l’alcol può anche produrre
alterazione dell’acuità visiva, altre alterazioni sono tremori, disartria, amnesia e demenza progressiva
L’uso cronico di alcol può dare luogo a dipendenza fisica che si manifesta in caso di astensione dall’alcol
con la cosiddetta sindrome da astinenza che non va confusa con le manifestazione di encefalopatia,
caratterizzata da:
• Disturbi neurovegetativi: sudorazione, nausea, vomito, diarrea, febbre, cardiopalmo
• Disturbi dell’umore
• Tremori
• Turbe del sonno
• Allucinazioni
• Confusione mentale
• Agitazione psicomotoria
• Convulsioni più o meno generalizzate
Diagnosi
Specifica è l’anemia macrocitica, da carenza di B12, più raramente ipocromica da carenza di Fe++ e
secondaria alla malnutrizione, ma anche alla diretta soppressione della funzionalità midollare da parte
dell’alcool.
In alcuni soggetti è stata descritta anche acantocitosi, dovuta all’ipercolesterolemia.
http://www.hackmed.org
[email protected]
28
Un dato importante è il rapporto GOT/GPT (AST/ALT) che è > 2.
Si verifica inoltre un aumento delle γ-GT.
Questo rapporto, che è inverso rispetto a quanto si verifica nell’epatite virale, è legato alla inibizione diretta
dell’alcool nella sintesi della ALT, che può essere rimossa con la somministrazione di PLP.
Infatti l’ALT è presente esclusivamente nel citosol l’AST è presente in 2 forme c-AST citosolica (20%) e
m-AST mitocondriale (80%) che è quella che viene maggiormente liberata in quanto il danno alcolico è
essenzialmente mitocondriale.
In caso di steatosi all’ecografia si verifica un incremento dell’ecogenicità parenchimale diffusa (fegato
brillante: echi parenchimali di piccole dimensioni ed elevata intensità che determinano attenuazione del
fascio ultrasonoro in profondità).
Alla TC vi è invece una ipodensità diffusa del parenchima.
terapia
Esiste una formula per calcolare un indice prognostico discriminante che indichi o no l’impiego di
glucocorticoidi nella terapia:
4,6 X (PT - tempo normale) + bilirubina sierica in um/l / 17 Æ se >32 la prognosi è sfavorevole.
A differenza della cirrosi da qualsiasi altra causa, quella alcolica richiede un trattamento con dieta
iperproteica, per controbilanciare gli effetti della malnutrizione e della dispersione proteica con la
paracentesi.
Farmaci particolari come i diuretici devono essere somministrati con cautela, a causa del ridotto metabolismo
epatico.
In particolare, sedativi, che possono essere utili nel trattamento di un alcolista e delle crisi di astinenza hanno
questo tipo di problema.
STEATOEPATITE NON ALCOLICA
è una sindrome caratterizzata sul piano istologico da steatosi necrosi ed infiammazione con fibrosi a
prevalente localizzazione a livello centrolobulare, non associata al consumo di alcol.
Si ritiene che siano i fenomeni di perossidazione lipidica che si hanno in corso di steatosi che innescano la
necrosi e la flogosi.
L’aumento del deposito di lipidi a livello epatico può dipendere da:
• aumentato introito di grassi con la dieta
• alterazioni geniche del metabolismo intraepatico dei lipidi
• alterata regolazione del metabolismo lipidico a causa di possibili variazioni endocrino-metaboliche
(iperinsulinemia e/o insulino-resistenza)
l’accumulo di trigliceridi ed acidi grassi all’interno dell’epatocita superiore alle capacità della cellula di
metabolizzarli conduce alla ridotta ossidazione degli acidi grassi e all’attivazione del metabolismo dei
perossisomi con aumentata produzione di specie reattive dell’ossigeno (ROS).
I ROS determinano un danno lipoperossidativo delle membrane intracellulari e degli organuli intracellulari
compresi i mitocondri con conseguente riduzione della capacità cellulare a metabolizzare gli acidi grassi con
conseguente aggravamento della steatosi.
Altre cause di steatosi diverse dall’alcol sono rappresentate da:
• tetracicline
• gravidanza
• estrogeni
• corticosteroidi
• obesità
• diabete
• nutrizione parenterale totale
Cirrosi postnecrotica
La cirrosi postnecrotica è una categoria particolare di cirrosi raggruppate insieme per il loro aspetto prima
che per la causa eziologica.
In effetti si tratta della cirrosi conseguente a massiccia necrosi diffusa e confluente di cellule epatiche
(piecemail necrosis e necrosi a ponte), con collasso stromale a cui segue la formazione di bande di tessuto
connettivo che formano cicatrici ampie ed irregolari con formazione di noduli di dimensioni molto variabili.
http://www.hackmed.org
[email protected]
29
Moltissime condizioni possono portare alla cirrosi secondaria alla necrosi epatica, fra cui:
• epatiti virali croniche
• epatite fulminante
• altri agenti infettivi come CMV e Brucella
• farmaci o tossici
• S. di Budd-Chiari
• malattie e deficit metabolici (come il deficit di alfa1AT, il morbo di Wilson, l’emocromatosi)
In circa il 10% dei casi di cirrosi, poi, la causa della necrosi estesa rimane ignota (cirrosi postnecrotica
criptogenetica).
Il fegato appare ridotto di peso e volume, deformato da cicatrici irregolari, colorito rosso-bruno (normale),
aspetto macronudulare con noduli fino a 5 cm (aspetto a bulletta di scarpa).
Microscopicamente sono presenti cicatrici e noduli di rigenerazione, aree di necrosi, distorsione del reticolo,
steatosi (?).
L’aspetto macronodulare è dovuto al fatto che il collasso non è mai omogeneo essendo maggiore in alcune
aree rispetto ad altre.
Se è presente anche infiltrato infiammatorio parliamo di cirrosi attiva e progressiva.
In genere il lobo sinistro è atrofico e fibrotico, perché tutti i processi tossici o virali sono in genere più
gravi a livello di tale lobo.
La spiegazione sta nel fatto che esso è irrorato dal sangue proveniente dalla mesenterica superiore (visto che
il sangue della lienale e della mesenterica non si mescola completamente nella vena porta) che drena
l’intestino tenue, luogo di massimo assorbimento di tossici e virus.
CIRROSI BILIARE
È una forma di cirrosi in genere di tipo micronodulare che si ha in seguito a infiammazione e distruzione dei
dotti biliari che si associa a fibrosi ed infiammazione dello spazio portale.
I quadri clinici che si associano alla presenza di cirrosi biliare sono:
1 cirrosi biliare primitiva
2 cirrosi biliare secondaria
3 colangite sclerosante primitiva
anatomia patologica
macroscopicamente il fegato appare di volume normale o lievemente aumentato nelle fasi iniziali mentre
nelle fasi tardive si ha una riduzione di volume.
Il colorito è verde scuro a causa della colestasi.
La superficie è finemente nodulare o carta smerigliata.
Istologicamente si osserva una fibrosi delicata dello spazio portale, lesione e rigenerazione dei dotti biliari,
tappi di bile condensata all’interno degli epatociti che ne determinano la necrosi, trombi biliari e laghi biliari.
È presente anche un infiltrato infiammatorio ricco di macrofagi che fagocitano i detriti necrotici degli
epatociti.
In caso di colangite è presente anche un infiltrato infiammatorio costituito da PMN.
Tipica è la degenerazione piumosa degli epatociti (detta anche schiumosa).
Vi possono essere anche accumuli di rame e corpi di Mallory.
clinica
elementi clinici comuni a queste forme sono:
• incremento della ALP
• ittero
• feci acoliche e urine ipercromiche
• epatosplenomegalia (anche se in fase tardiva si osserva riduzione di volume del fegato compatibile
con la cirrosi)
• ipertensione portale (poco frequente)
• sindrome da malassorbimento
Cirrosi biliare primitiva
Viene più propriamente definita colangite cronica non suppurativa poichè solo nella fase tardiva si associa
a cirrosi (nelle fasi più precoci manca la rigenerazione nodulare che è uno dei 2 criteri istologici di cirrosi).
http://www.hackmed.org
[email protected]
30
È una malattia ad eziologia sconosciuta la cui patogenesi sembra dovuta ad alterazione dei meccanismi di
immunoregolazione che ha come risultato finale l’aggressione immunologica del sistema biliare con danno
irreversibile.
Vengono colpite le vie biliari intraepatiche di piccolo e medio calibro.
E’ causata dall’infiammazione ostruttiva dei dotti biliari intraepatici, che porta ad un ristagno di bile negli
spazi porto-biliari, distruzione del parenchima epatico e fibrosi progressiva.
Clinicamente si manifesta con una colestasi cronica ingravescente.
Colpisce prevalentemente donne in età media (40-60 anni) ed il sintomo più caratteristico è un persistente
prurito cutaneo “sine materia” resistente agli antistaminici.
Eziopatogenesi
La malattia ha causa non del tutto nota, anche se frequenti osservazioni, soprattutto la sua frequente
associazione con la CREST, suggeriscono una immunogenesi.
In effetti ci sono almeno altri tre elementi che depongono a favore di questa teoria:
• Presenza di anticorpi anti mitocondrio (AMA)
• Immunocomplessi e crioglobuline della classe IgM
• Abnorme espressione di MHC II
• Presenza di granulomi a livello dei dotti biliari
Molte inoltre sono le associazioni con malattie autoimmuni. Nel 60-70% dei casi infatti si accompagna a:
• S. di Sjogren
• Sclerodermia
• Tiroidite
• Acidosi tubulare renale
• Artropatia da Immunocomplessi
• Epatite cronica autoimmune (sindrome da overlapping)
E’ praticamente un attacco immune dei linfociti ai dotti biliari più piccoli.
Un elemento di interesse è la presenza di notevoli quantità di rame nel parenchima epatico in misura quasi
uguale a quella che si rinviene nel morbo di Wilson.
La ritensione di rame nel fegato sarebbe secondaria alla sua alterata escrezione biliare e potrebbe essere un
fattore aggravante o perpetuante il danno tessutale.
Anatomia patologica
Sul piano istopatologico sono stati distinti 4 stadi evolutivi:
1. stadio della lesione florida dei dotti biliari : degenerazione e necrosi dell’epitelio dei dotti
biliari interlobari e settali che appaiono circondati da granulomi (colangite granulomatosa)
2. stadio della proliferazione duttulare : infiltrati infiammatori a livello degli spazi portali, i
duttuli colpiti continuano a ridursi di numero mentre compaiono numerosi duttuli biliari atipici
3. stadio della fibrosi : comparsa dei setti fibrosi
4. stadio della cirrosi : compaiono noduli di rigenerazione che in associazione con i setti fibrosi
che li circondano costituiscono i 2 criteri istologici per la diagnosi di cirrosi
la CBP comunque è una malattia focale e variabile e pertanto spesso gli stadi si sovrappongono perciò è
possibile reperire nella stessa biopsia contemporaneamente più stadi.
Si possono distinguere 2 forme:
• RBS forma tardiva in cui prevalgono gli stadi tardivi
• LBS forma precoce in cui prevalgono gli stadi precoci
Clinica
La maggior parte dei pazienti è e resta asintomatica, oppure presenta moderati segni di elevazione della ALP,
in corso di esami di laboratorio di screening.
Nella maggior parte di essi questa malattia resta del tutto asintomatica e non va incontro a ulteriore
evoluzione.
Quelli che sono sintomatici presentano invece un quadro caratteristico:
il sintomo iniziale più frequente è un prurito “sine materia” , prima intermittente, più intenso di notte e
frequentemente localizzato a livello del perineo che diventa poi persistente e tende a generalizzarsi.
È resistente a tutti i trattamenti antipruriginosi antistaminici inclusi.
Successivamente si instaura un subittero o un ittero franco.
Le alterazioni dei parametri di laboratorio sono fondamentalmente dovuti alla colestasi:
• Bilirubina 2x soprattutto diretta
http://www.hackmed.org
[email protected]
31
• Modesta epatomegalia
• ALP 4x
• AST 2x
• Ipergammaglobulinemia con aumento soprattutto delle IgM
• iperlipidemia
• Albumina nella norma
• AMA >1:40
All’esame obiettivo possono essere presenti alterazioni tipiche della colestasi quali xantomi e xantelasmi
causate dall’iperlipidemia.
Frequenti sono gli episodi di dolori ossei e fratture anche spontanee per l’osteoporosi evolutiva concomitante
(osteodistrofia epatica) causate da alterazione del metabolismo della vitamina D.
La diagnosi differenziale con la colangite sclerosante è possibile sulla base delle seguenti considerazioni:
• La malattia colpisce dotti gradi e medi, ed è visibile alla retrograda
• Colpisce per lo più maschi in giovane età, ed è associata alla colite ulcerosa
• Acidi biliari elevati
• Negatività AMA
• AST, ALT normali
diagnosi
La diagnosi si basa su questi concetti di laboratoristica in quanto spesso accade che la malattia risulta
invisibile alla retrograda, perché interessa solo i dotti più piccoli che sono intraepatici o comunque
inaccessibili alla colangiografia.
Alla ERCP l’aspetto tipico è quello di albero spoglio, poichè il mezzo di contrasto non riesce a penetrare
nei dotti di piccole dimensioni che sono alterati.
È fondamentale il riscontro di positività degli AMA che permette di fare diagnosi differenziale tra CBP ed
ostruzione biliare da calcolo o neoplasia in cui si ha titolo negativo.
terapia
Non esiste ancora una terapia specifica, in quanto i glucocorticoidi peggiorano il quadro osseo, e il successo
dell’azatioprina rimane limitato.
Il trattamento rimane quindi sintomatico, specie per il prurito.
Cirrosi biliare secondaria
Deriva dalla ostruzione prolungata delle vie biliari extraepatiche.
Nei bambini le 2 cause principali sono rappresentate dall’atresia congenita delle vie biliari mentre nell’adulto
sono:
z Stenosi del coledoco
z Coledocolitiasi
z Carcinomi dell’albero biliare o della testa del pancreas
z Compressione estrinseca da parte di masse addominali o linfonodi dell’ilo epatico ingranditi
z Atresia delle vie biliari
z Stenosi postchirurgiche
Inizialmente l’ostruzione della vie biliari determina un incremento di pressione a livello delle vie biliari
intraepatiche (colestasi) che determina delle alterazioni morfologiche reversibili con la rimozione
dell’ostacolo.
Tuttavia la mancata rimozione dell’ostacolo e quindi la sua persistenza determina delle alterazioni di tipo
fibrotico che conducono alla cirrosi che non è più reversibile.
La patogenesi della fibrosi si basa fondamentalmente su 2 meccanismi:
• L’occlusione totale delle vie biliari determina un incremento della pressione a monte dell’ostruzione
con ristagno di bile che si ispessisce formando degli stampi che danneggiano le vie biliari
determinando quindi infiammazione cronica e conseguente fibrosi
• L’ostruzione subtotale determina anche essa stasi che favorisce la soprainfezione da parte di germi
quali E.C. enterococchi e gram – (colangite ascendente) che determina flogosi con infiltrato in questo
caso prevalentemente costituito da PMN e conseguente fibrosi
Anatomia patologica
Il fegato appare aumentato di volume la superficie è granulare con colorito verde scuro.
A livello del parenchima c’è dapprima necrosi centrolobulare, poi periportale.
http://www.hackmed.org
[email protected]
32
In seguito i dotti biliari portali e i dottuli proliferano, finché si sviluppa una colangite, che può anche essere
complicata da infezione.
Lo stravaso di bile produce alla fine aree dette “laghi biliari”, da dove inizia la degenerazione dello stroma e
la fibrosi.
Quando a questi processi si accompagna la rigenerazione nodulare del parenchima danneggiato, si ha la
cirrosi biliare.
In genere questo processo avviene molto tardivamente, richiede 3-12 mesi, e durante questo periodo è
possibile la reversione se si rimuove la causa di ostacolo.
clinica
La sintomatologia rimane tipica, come nella cirrosi biliare primitiva: ittero e prurito sono i sintomi
dominanti, si può avere steatorrea, dolori ossei dovuti all’osteoporosi-osteomalacia.
All’esame obiettivo possono essere presenti lesioni cutanee da grattamento e xantomi e xantelasmi.
La febbre e il dolore dell’ipocondrio di dx, con Murphy positivo, si ha nelle forme con contemporanea
colangite.
L’ascite e le altre manifestazioni di ipertensione portale si hanno solo nelle fasi avanzate della malattia.
diagnosi
I dati di laboratorio sono tipici del quadro di colestasi:
z aumento della ALP
z iperbilirubinemia di tipo coniugato (diretto)
z aumento degli acidi biliari
quando la malattia è complicata da colangite, si trovano una discreta leucocitosi.
Di solito la ERCP è in grado di identificare con successo la causa dell’ostacolo (a volte di rimuoverla con
una papillectomia); in altre circostanze l’ago-biopsia epatica è utile per documentare il processo patologico
in atto a livello del fegato e lo sviluppo della cirrosi.
terapia
La prognosi dipende dalla causa dell’ostruzione biliare e dalla possibilità o meno di risolverla.
La terapia rimane essenzialmente la rimozione dell’ostacolo, per via endoscopica o chirurgica.
Quando questo non risulta possibile, allora la malattia procede fino agli stadi terminali della cirrosi.
colangite sclerosante primitiva
È una malattia colestasica cronica ad eziologia sconosciuta che colpisce le vie biliari sia intraepatiche che
extraepatiche tramite un processo infiammatorio cronico di tipo fibrosante (malattia infiammatoria
cronica di tipo fibrosante).
Come conseguenza si sviluppa una progressiva obliterazione dei dotti biliari che determina la comparsa di
cirrosi biliare secondaria.
Al quadro iniziale di colestasi subentra quindi quello di insufficienza epatica.
La CSP presenta una prevalenza per il sesso maschile con età media compresa tra i 30 ed i 45 anni.
In circa il 50-70% dei casi si associa ad una IBD generalmente la Colite Ulcerosa che in genere ne precede
l’insorgenza.
Eziopatogenesi
È sconosciuta, ma si ritiene che sia di tipo immunologico sostenuta da meccanismi autoimmunitari, a causa
di numerose osservazioni:
z associazione con IBD
z presenza intorno ai dotti biliari colpiti di un infiltrato linfomonocitario
z presenza nel 65% dei pazienti di p-ANCA
si ritiene che siano implicati Ab anti-epitelio duttulare che spesso si associano anche ad Ab anti-epitelio del
colon, il che spiega la frequente associazione con la RCU.
In ogni caso la fibrosi a livello periduttulare determina il restringimento segmentario delle vie biliari con
ostruzione.
Tra una stenosi e l’altra i dotti si dilatano e si infiammano e la flogosi cronica determina a lungo andare la
fibrosi e quindi la cirrosi secondaria.
clinica
l’esordio della CSP è di solito subdolo con sintomi tipici della colestasi quali prurito, subittero e
epatomegalia.
L’evoluzione è verso la cirrosi secondaria e successivamente l’insufficienza epatica.
http://www.hackmed.org
[email protected]
33
Anatomia patologica
La biopsia epatica stabilisce il coinvolgimento duttale ed il grado di lesione parenchimale e quindi in
definitiva la stadiazione della CSP:
1. flogosi linfomonocitaria della triade portale
2. stadio periportale: flogosi linfomonocitaria invasiva con fibrosi negli spazi portali, sviluppo di
piecemeal necrosis e proliferazione dei duttuli biliari
3. stadio settale (patognomonico) colangite fibrosa obliterante (progressiva estensione della fibrosi
periduttulare “a bulbo di cipolla” per cui segmenti dei dotti biliari interlobulari e settali vengono
sostituiti da cordoni solidi di tessuto connettivo)
4. cirrosi biliare secondaria: comparsa di noduli di rigenerazione
NB. La lesione patognomonica è rappresentata dalla colangite fibrosa obliterante importante per la diagnosi
differenziale con la CBP in cui si una colangite granulomatosa.
Diagnosi
Sono presenti gli indici di colestasi:
z aumento di ALP
z aumento di γGT
z iperbilirubinemia di tipo diretto
z incremento degli acidi biliari sierici
z aumento delle transaminasi soprattutto ALT
z negatività degli AMA
z presenza di p-ANCA in 65%
la diagnosi strumentale si basa su:
z ERCP : caratteristico aspetto a corona di rosario caratterizzato dall’alternanza di segmenti dilatati e
segmenti stenotici, nell’85% dei casi si ha interessamento delle vie biliari sia intra che extra epatiche
mentre nel 15% solo intraepatiche
z Colangio-RM aspetto analogo a quello della ERCP
z Biopsia epatica fondamentale per la stadiazione
Terapia
Non esiste una terapia specifica della malattia in quanto questa non risponde alla terapia immunosoppressiva.
Il trattamento di elezione è il trapianto di fegato anche in considerazione dell’associazione con il
colangiocarcinoma.
La terapia chirurgica ha carattere palliativo.
Può essere fatta una derivazione bilio-digestiva o una dilatazione per via percutanea transpeatica.
In caso di stenosi a carico della via biliare principale può essere posizionata una protesi per via endoscopica.
In genere le protesi vengono lasciate in situ per diversi mesi e sostituite nel momento in cui si verificano
fenomeni di colangite da stasi dovuta all’usura della protesi o alla sua ostruzione.
Cirrosi secondaria a malattie sistemiche da accumulo
Malattia di wilson
Si tratta di una patologia ereditaria del metabolismo correlata alla mutazione di due geni ATP7B, che
determina un insufficiente escrezione epatica di rame, che si accumula specialmente nel fegato e nel
nucleo lenticolare dell’ipotalamo (degenerazione epato-lenticolare).
Malattia autosomica recessiva, con M=F, incidenza di circa 1/30 mila pazienti, diffusa in ogni gruppo etnico,
età media di insorgenza 15-30 anni. La frequenza degli eterozigoti è di circa 1/90
Eziopatogenesi
Il rame totale corporeo è 50-150 mg.
A differenza dell’emocromatosi, l’assorbimento della molecola di rame è perfettamente normale la si ha una
diminuzione dell’escrezione biliare di rame.
Il rame viene assorbito a livello di stomaco e duodeno e trasportato al fegato associato all’albumina dove a
livello degli epatociti si dissocia e viene incorporato in una α2− globulina la ceruloplasmina che viene
escreta nel plasma.
La ceruloplasmina senescente viene fagocitata dagli epatociti dove e degradata nei lisosomi ed il rame viene
eliminato con la bile.
http://www.hackmed.org
[email protected]
34
La principale via di escrezione del rame è quindi la bile mentre l’escrezione urinaria è trascurabile.
Nel morbo di Wilson si ha una mobilitazione difettiva del rame dai lisosomi per l’escrezione nella bile.
L’accumulo di rame che ne risulta danneggia gli epatociti e riduce la produzione di ceruloplasmina (che
quindi è un fenomeno secondario e non alla base della patologia).
Il rame è fondamentale per la produzione di vitamine, ma un suo accumulo causa una azione tossica diretta
sugli organuli cellulari determinando in ultima analisi la fibrosi e l’insufficienza d’organo.
Le ipotesi riguardo al danno provocato dal rame comprendono:
• Legame del rame a proteine coma la tubulina (forse responsabile della formazione dei corpi di
Mallory) o a gruppi sulfidrilici proteici
• Formazione dei radicali liberi con per ossidazione lipidica
Anatomia patologica
Il rame si accumula preferenzialmente a livello di:
• Fegato dove si osserva inizialmente steatosi e vacuolizzazione nucleare, successivamente infiltrati
infiammatori portali con necrosi e fibrosi periportale e quindi comparsa di cirrosi. Colorazioni con
orceina o acido rubeanico rilevano l’eccessiva quantità di rame
• Sistema nervoso centrale cavitazioni nei gangli della base, iperplasia degli astrociti e degenerazione
neuronale soprattutto intorno alle microcavità
• Occhio anelli di Kayser-Fleisher che derivano dall’accumulo di granuli color marrone di rame nel
limite esterno della cornea
• Reni degenerazione grassa ed idropica con deposizione di rame a livello del tubulo prossimale
Il coinvolgimento degli altri organi si verifica quando viene superata la capacità di accumulo del fegato.
Nei neonati la malattia non si manifesta, perché alla nascita i livelli di questa proteina sono comunque molto
bassi anche nei soggetti normali.
Le prime evidenze cliniche si hanno nell’adolescenza, e alla fine tutti i pazienti non trattati sviluppano la
malattia entro la giovinezza.
Negli stadi iniziali della malattia il fegato può mostrare soltanto steatosi e necrosi epatocitaria focale.
Quando la malattia progredisce si sviluppa epatite cronica o acuta.
Con la progressiva cronicizzazione si instaura la cirrosi che a volte insorge in un quadro asintomatico.
Raramente si può avere una epatite fulminante o necrosi epatica massiva: rara ma in genere fatale, è
caratterizzata da ittero progressivo, ascite, encefalopatia, ma senza eccessivi movimenti di enzimi epatici.
In queste forma, ma anche durante le forma acute della malattia epatica, ci può essere una anemia emolitica
negativa al test di Coombs.
Clinica
Le manifestazioni cliniche sono:
• Epatiche aspecifiche
• Neurologiche a carico del sistema extrapiramidale con incoordinazione motoria dei movimenti fini,
tremori a riposo ed intenzionali, disartria, distonia, atassia
• Psichiatriche turbe del comportamento con quadri aggressivi neurotici e psicotici
Un segno importante è l’anello di Kayser-Fleisher, indice di interessamento celebrale della malattia.
Se si trovano sintomi neurologici in assenza dell’anello, non si è in presenza del morbo di Wilson, d’altra
parte l’anello può mancare in soggetti che presentino solo un quadro di epatopatia.
Nella maggior parte dei pazienti con questi disturbi sono presenti disturbi psichici, che possono anche non
regredire interamente con la sola sospensione di rame, e che necessitano spesso una psicoterapia.
Diagnosi
È fondamentale la diagnosi precoce perchè una terapia tempestiva è in grado di prevenire o migliorare i
quadri clinici.
Un paziente al di sotto di 40 anni, con sintomi neurologici non altrimenti spiegabili e sintomi epatici di
cirrosi ad eziopatogenesi non chiara, magari con anemia emolitica Coombs negativa è fortemente sospetto.
Altri elementi:
• Diminuzione della ceruloplasmina sierica (<200 mg/l)
• Cupruria >50-75mg/24h
• Biopsia epatica positiva per cirrosi
• Cupremia ridotta
• Accumulo di rame nel fegato (>250 ug/g di peso secco epatico)
Importante è anche al biopsia epatica che permette di misurare l’eventuale accumulo di rame nell’epatocita.
http://www.hackmed.org
[email protected]
35
I reperti istologici non sono patognomonici poiché appaiono molto simili a quelli dell’apatite da farmaci o
dell’epatite virale e fondamentale quindi la determinazione dell’accumulo epatico di rame.
Anche in corso di cirrosi biliare primitiva e di colestasi prolungata si può avere accumulo di rame nel fegato
ma in questi casi i livelli sierici di ceruloplasmina sono normali.
Terapia
Rimozione rapida del rame in eccesso appena posta la diagnosi, indipendentemente dai sintomi del paziente
comporta la regressione delle manifestazioni cliniche.
A questo scopo la penicillamina in dosi elevate è la migliore risorsa, essa è una sostanza che chela i metalli
pesanti ed il rame in particolare facilitandone l’escrezione urinaria.
Per evitare due importanti effetti collaterali, l’effetto antipiridossinico e le reazioni immunitarie al farmaco,
vengono in genere somministrati contemporaneamente piridossina e prednisolone (quest’ultimo durante i
primi 20 giorni della terapia).
La terapia va mantenuta tutta la vita ed ha lo scopo di mantenere il rame al di sotto di 10ug/l.
La sospensione della terapia di solito si associa alla morte, dopo una media di 2,6 anni senza supporto
terapeutico.
Emocromatosi
Malattia caratterizzata da un’alterazione del bilancio tra assorbimento ed eliminazione di Fe che si accumula
a livello di diversi parenchimi.
La malattia ha alta prevalenza (1 eterozigote su 10) e una incidenza di malati di circa 3 pazienti su 1000.
Esistono 2 forme di emocromatosi:
1. Primitiva o idiopatica che è una malattia ereditaria autosomica recessiva dovuta ad alterazione
di un gene sul braccio corto del cromosoma 6 che determina nella forma omozigote un
assorbimento esagerato di ferro e nella forma eterozigote un lieve accumulo
2. Secondaria (emosiderosi) dovuta ad aumentato apporto orale o parenterale di ferro:
• Anemie severe associate ad eritropoiesi inefficace in cui l’eccesso di ferro deriva non
solo dalle trasfusioni ma anche dall’eccessivo assorbimento intestinale di tipo
compensatorio
• Cirrosi alcolica (in cui si ha aumento dell’apporto di ferro poichè 1 litro di vino
contiene 5 g di Fe o si ha liberazione di Fe da parte degli epatociti necrotici che viene
captato da altri epatociti)
Anche in corso di epatopatie croniche la ridotta funzione epatocellulare e la riduzione della transferrina
sierica favoriscono l’accumulo di ferro.
eziopatogenesi
Il ferro è presente in 2 forme:
Fe eminico = emoglobina 55-60% (2.5g)
Mioglobina10% (0.4g)
Citocromi,catalasi,perossidasi
Fe non eminico = Fe di deposito 30% (1.5g) ferritina e emosiderina
Fe circolante 0.1% transferrina
Il contenuto di ferro nell’organismo tende a rimanere costante.
La perdita quotidiana è di 1mg ed avviene tramite esfoliazione dell’epitelio intestinale, feci, urine, sudore,
desquamazione cutanea e bile.
Durante l’emocateresi a livello del sistema RE il Fe viene liberato dall’eme ed in parte legato alla
transferrina , in parte depositato in due forme:
• ferritina rapidamente disponibile
• emosiderina (data dall’aggregazione di più molecole di ferritina e dalla denaturazione dell’involucro
proteico) più stabile e meno disponibile
Una piccola quantità di Fe inoltre tramite la transferrina raggiunge i tessuti dove viene utilizzata per la sintesi
degli enzimi eminici.
L’assorbimento della mucosa di ferro normalmente corrisponde al fabbisogno, 1 mg/24h nell’uomo e 1,5
mg/24h nella donna con mestruazioni regolari.
In corso di emocromatosi si ha incremento dell’assorbimento di ferro.
Nella forma primitiva l’assorbimento supera i 4mg.
Non è noto il modo in cui la regolazione dell’assorbimento è alterata.
http://www.hackmed.org
[email protected]
36
La quota totale di ferro presente nell’organismo varia da 2 g nelle donne a 6g negli uomini di cui 0.5 g si
accumulano a livello del fegato nella quasi totalità a livello degli epatociti.
Nelle fasi avanzate della malattia l’organismo può contenere anche 50 g di ferro che inizialmente si
accumula negli epatociti e successivamente nelle cellule di Kupfler, nell’epitelio dei dotti biliari e nella
matrice extracellulare.
Successivamente il ferro si accumula nel parenchima di vari organi determinando fibrosi e insufficienza
funzionale.
Il danno del deposito di ferro a livello dei tessuti viene esplicato attraverso 3 meccanismi:
• perossidazione dei lipidi a causa della formazione di radicali liberi dell’ossigeno
• stimolo alla formazione del collagene
• iterazione diretta del ferro con il DNA con alterazioni letali o predisposizione al carcinoma
epatocellulare che insorge nel 20% dei casi
comunque il danno è almeno nelle prime fasi reversibile se vie effettuata la rimozione del ferro tramite
terapia appropriata.
Poiché il ferro è una epatotossina diretta caratteristicamente manca la flogosi.
Anatomia patologica
Macroscopicamente il fegato appare aumentato di volume, con superficie nodulare e colorito marronecioccolato.
Istologicamente si osserva accumulo di ferro in forma di emosiderina e ferritina all’interno degli epatociti,
delle cellule del Kupfler e delle cellule dei dotti biliari evidenziabile tramite reazione di Pearls al blu di
Prussia.
La reazione di Pearls è in grado di evidenziare in blu nerastro i granuli di emosiderina ma non la ferritina per
cui per quantificare il contenuto di ferro a livello epatico occorre determinare la concentrazione biochimica
sui tessuti non fissati.
In base alla quantità di ferro presente a livello del fegato possiamo distinguere un grado 1, 2, 3, 4.
Si ha fibrosi dapprima periportale che poi si addentra verso il centro del lobulo (fibrosi stellata) con
formazione di ponti porto-portali e porto-centrali.
Successivamente si sviluppa cirrosi micronodulare o mista.
Oltre al fegato il ferro si deposita a livello del parenchima di diversi organi:
• pancreas: deposito sia nel pancreas esocrino che nelle cellule del Langherans la cui distruzione porta
all’insorgenza del diabete di tipo I (diabete bronzino)
• cute: pigmentazione di colorito giallo-ardesia dovuta sia all’accumulo di ferro (a livello di macrofagi e
fibroblasti) che all’accumulo di melanina
• cuore: spesso ingrandito con fibre miocardiche contenenti emosiderina che determinano insorgenza di
insufficienza miocardica ed aritmie (miocardiopatia restrittiva)
• ghiandole endocrine (tiroide, paratiroide, ipofisi e surreni) di colorazione brunastra
• articolazioni: deposito a livello della membrana sinoviale con sinovite acuta e danneggiamento della
cartilagine articolare con artropatie
• testicoli piccoli ed atrofici con ipogonadismo determinato probabilmente da alterazione dell’asse
ipotalamo-ipofisario
clinica
le manifestazioni cliniche della malattia non compaiono prima dei 35-45 anni.
L’emocromatosi è 10 volte più frequente nel sesso maschile rispetto al femminile probabilmente per l’effetto
protettivo svolto dalle perdite ematiche dovute a mestruazioni e gravidanze.
A dispetto dell’epatomegalia e della fibrosi, che sono praticamente sempre presenti fin dagli stadi precoci, in
più della metà dei malati la funzionalità epatica rimane normale (raramente sono alterati gli indici di citolisi).
Anche la cirrosi tende a complicarsi con l’ascite in misura minore che in altre situazioni.
Di grande rilievo è invece la tendenza a progredire verso epatocarcinoma, che rappresenta la causa di morte
principale di questi pazienti e si verifica nel 15% dei casi.
Le manifestazioni più comuni sono la cirrosi, il diabete bronzino, la miocardiopatia e l’ipogonadismo
ipogonadotropo.
Diagnosi
La diagnosi è suggerita dagli alti livelli di ferritina (> 300 µg/l nell’uomo e > 200 µg/l nella donna) e
transferrina (> 180 µg/dl) dalla elevata saturazione della transferrina, la diagnosi di certezza si basa sulla
determinazione dell’accumulo di Fe epatico tramite biopsia.
http://www.hackmed.org
[email protected]
37
Per evidenziare l’accumulo di Fe nei parenchimi viene fatta una RM.
Per la diagnosi di emosiderosi primaria va fatta la ricerca dei geni dell’emocromatosi HFE e TFR2.
È importante il monitoraggio per l’insorgenza dell’epatocarcinoma.
Per un eventuale trattamento preventivo è importante la diagnosi precoce dei familiari: nei parenti di primo
grado è opportuno determinare la sideremia, la ferritinemia, da ripetere più volte in caso di risultato normale.
Terapia
Si basa essenzialmente sulla rimozione dell’eccesso di ferro tramite salassi o farmaci chelanti il ferro
(deferoxamina).
I salassi possono essere eseguiti a frequenza settimanale fino al raggiungimento di livelli ottimali di Hb
(11g/dl) e di ferritina (10µg/l) e successivamente vanno eseguiti con frequenza trimestrale.
La deferoxamina viene utilizzata soltanto nei pazienti che non possono essere sottoposti a salasso
(cardiopatici e ipodisprotidemici).
La riduzione della sideremia non determina miglioramento delle complicanze dell’emocromatosi per le quali
sono necessarie terapie specifiche.
Insufficienza epatica
Il fegato sintetizza e metabolizza una grande quantità di composti e di proteine endogene.
La cirrosi, che regolarmente è preceduta da una drastica diminuzione della funzionalità epatica, è complicata
da una serie di alterazioni legate all’insufficienza epatica.
Diminuzione della sintesi delle proteine plasmatiche
l’albumina, la principale proteina plasmatica, viene normalmente sintetizzata dal fegato e fra le sue funzioni
c’è quella di regolare la pressione osmotica plasmatica, la sua concentrazione di 4-5 g/dl è infatti la più
elevata fra le proteine plasmatiche.
L’ipoalbuminemia al di sotto di 2.5 g/dl determina edemi discrasici e aggrava il quadro dell’ascite.
Diminuzione della sintesi dei fattori della coagulazione:
La vitamina K assorbita a livello intestinale è utilizzata nel fegato per la produzione di tre fattori della
coagulazione, attraverso la reazione addizione di glutammato.
In corso di insufficienza epatica si verifica un deficit di sintesi e secrezione di acidi biliari che sono
fondamentali per l’assorbimento della vitamina essendo questa liposolubile.
La vitamina K viene assorbita di meno anche per effetto dell’ascite che provoca una congestione dei vasi
linfatici della mucosa intestinale, con diminuzione dell’assorbimento delle sostanze liposolubili.
La riduzione della vitamina K determina un deficit della sintesi dei fattori della coagulazione vitamina Kdipendenti con conseguente sanguinamento grave delle eventuali complicanze emorragiche
dell’ipertensione portale e la presenza di petecchie emorragiche.
La coagulopatia inoltre rende complicato lo svolgimento della paracentesi, delle biopsie epatiche e di
interventi chirurgici in caso di epatocarcinoma.
La diatesi emorragica è anche dovuta alla piastrinopenia causata dall’ipersplenismo secondario alla
splenomegalia da ipertensione portale.
Solitamente i pazienti presentano solo un aumento del PT, nelle fasi avanzate si osserva anche un aumento
dell’aPTT.
Può manifestarsi anche una CID dovuta alla riduzione oltre che dei fattori coagulanti anche dei fattori
anticoagulanti come l’antitrombina III.
La terapia si basa sulla correzione del deficit tramite somministrazione di vitamina K 5-10 mg/die per os o
10 mg/die sc (per i pazienti ricoverati o non in grado di assorbire la vitamina K).
Le trasfusioni di plasma fresco e piastrine dovrebbero essere riservate ai pazienti con sanguinamento acuto
o a coloro che devono essere sottoposti a procedure invasive.
Diminuzione del catabolismo degli estrogeni:
http://www.hackmed.org
[email protected]
38
Determina nel maschio ginecomastia, diminuzione della peluria, ipotrofia degli annessi cutanei e atrofia
testicolare.
Nella donna può produrre amenorrea e aumento del rischio di carcinoma della mammella.
Molti casi di carcinoma mammario dell’uomo sono legati a queste condizioni di iperestrismo.
La presenza di elevate concentrazioni di estrogeni è probabilmente alla basa della formazione, nei due sessi,
di particolari telangectasie, in altre condizioni idiopatiche, dette nevi a stella (spider nevi).
Si tratta di dilatazioni arteriose, che compaiono specie nel dorso delle mani e delle braccia, in cui i vasi
dilatati hanno una tipica disposizione a raggera intorno ad un asse centrale e quindi si caratterizzano per la
direzione di riempimento che va dal centro alla periferia.
Gli estrogeni hanno anche un effetto mineralcorticoideo e questo può portare a ritenzione idrica, aggravando
il già compromesso bilancio idrico e l’ascite.
Diminuzione del catabolismo dell’azoto:
Il catabolismo degli aminoacidi a livello tissutale da origine all’ammoniaca che viene eliminata a livello
epatico tramite l’incorporazione nella molecola di urea che viene poi immessa in circolo ed escreta dal rene.
In parte essa viene ritrasformata in ammoniaca ad opera delle ureasi dei batteri intestinali.
Un deficit del ciclo dell’urea tende perciò a produrre tipicamente un accumulo di ammoniaca; questo
composto è neurotossico ed è alla base dell’encefalopatia porto-sistemica.
L’alterazione del metabolismo dell’azoto determina oltre all’iperammonemia anche iperminoacidemia e
aminoaciduria e riduzione dell’uremia.
Diminuzione del catabolismo dei farmaci:
Il parenchima epatico è sede del complesso del citocromo p-450 e del DEMS.
Il mancato funzionamento di questi due sistemi è spesso alla base di reazioni eccessive e di facili
intossicazioni da farmaci.
Inoltre la presenza di bypass portosistemici tende a ridurre il passaggio di sostanze tossiche nel fegato,
diminuendo ulteriormente la loro clereance.
L’alcolista che necessita del trattamento con farmaci neurolettici deve essere monitorato con estrema
attenzione.
Farmaci come il paracetamolo o l’eritromicina sono sconsigliati.
Si possono invece dare il Tavor e il Serpox, che non hanno nessun metabolismo epatico.
Diminuzione del catabolismo degli acidi biliari:
Eritema palmare e accumulo di acidi biliari nelle articolazioni.
Colesterolo:
il colesterolo è sintetizzato nel fegato, pertanto l’insufficienza epatica determina bassi livelli di colesterolo e
di ormoni che derivano dal colesterolo come il testosterone.
Tuttavia in caso di colestasi si osservano aumenti del colesterolo.
Ipertensione portale
Il flusso epatico è di 1600 ml/min di cui:
• 75% (1200 ml/min) attraverso la vena porta che ha una pressione di 12 mmHg
• 25% (400 ml/min) attraverso l’arteria epatica che ha una pressione di 100 mmHg
La normale pressione della vena porta è molto bassa, a dispetto della grande quantità di sangue che vi
circola, perché si ha normalmente una resistenza epatica molto bassa (circa 7-10 mmHg).
Si distinguono 3 forme di ipertensione portale:
1. lieve: 7-15 mmHg
2. moderata: 15-30 mmHg
3. severa: > 30 mmHg
Tuttavia la pressione portale normale più che dal suo valore assoluto è più significativamente espressa dalla
differenza di pressione tra la vena porta e la vena cava inferiore che viene definito gradiente porto-cavale ed
è normalmente di 4-6 mmHg.
Si definisce ipertensione portale l’aumento di pressione all’interno del sistema cavale che determina un
gradiente porto-cavale > 6 mmHg.
http://www.hackmed.org
[email protected]
39
Eziopatogenesi
Ipertensione portale presinusale
1. preepatica
z trombosi venosa spleno-portale
si associa a splenomegalia ma non epatomegalia
z malformazioni portali congenite
z presenza di fistole arterovenose
z idiopatica
z ostruzione neoplastica della vena porta o da compressione linfonodale
2. intraepatica
z schistosomiasi
z sarcoidosi
z TBC
z Cirrosi biliare primitiva (stadio iniziale)
z Ipertensione portale idiopatica
Ipertensione portale sinusoidale
z Cirrosi
z Steatosi grave
Ipertensione portale mista (presinusoidale + postsinusoidale)
z Schistosomiasi
z Cirrosi biliare primitiva
z Epatite cronica attiva
z Tossicità da cloruro di vinile
Ipertensione portale postsinusoidale
1. intraepatica
z trombosi delle vene sovraepatiche (sindrome di Budd-Chiari)
z malattia veno-occlusiva (trombosi delle vene epatiche di piccolo e medio calibro)
2. postepatica
z anello congenito della vena cava inferiore
z pericardite costrittiva
z insufficienza tricuspidale
z scompenso cardiaco destro
Nella cirrosi si realizza una ipertensione sinusoidale, in cui, per vari meccanismi, la capacità dei capillari di
accogliere agevolmente il flusso ematico è compromessa e si ha pertanto un aumento delle resistenze al
flusso intraepatico.
I meccanismi con cui si instaura danno dei sinusoidi sono:
• Capillarizzazione dei sinusoidi: perdita della normali fenestrature, della parete sottile, soprattutto per
l’ispessimento della membrana basale, caratteristico dei sinusoidi della cirrosi, che comporta un
aumento delle resistenze al flusso ematico in essi
• Contrazione dei miofibroblasti che determina riduzione del lume dei sinusoidi (aspetto funzionale)
I sinusoidi epatici sono di dimensioni maggiori rispetto ai capillari, hanno un lume ampio, decorso tortuoso,
sono riccamente anastomizzati tra di loro.
La parete è discontinua e presenta numerose fenestrature, la membrana basale appare discontinua e spesso
assente.
Tra la membrana sinusoidale e la superficie degli epatociti è presente lo spazio di Disse in cui avvengono gli
scambi metabolici e dove si trovano le cellule di Kupfler e le cellule di Ito che hanno al proprietà di
accumulare nel loro citoplasma lipidi e sostanze liposolubili come la vitamina A.
• Compressione dei sinusoidi da parte dei noduli cirrotici e dei tralci fibrosi
• Deposizione di collageno negli spazi di Disse: questo produce un aumento della resistenza agli scambi
(collagenizzazione dei sinusiodi) e atrofia epatica, con ulteriore diminuzione della funzionalità
(probabilmente ad opera delle cellule di Ito o stellate che si trovano nello spazio di Disse)
• Perdita dell’architettura degli spazi portobiliari: normalmente l’arteria epatica si congiunge con la
vena porta (cioè i rami dei due vasi) con un angolo acuto, in modo da avere un effetto “aspirante” nei
confronti del flusso venoso. Oltre a questo esiste normalmente un piccolo sfintere di miociti all’inizio di
ogni sinusoide che garantisce il flusso venoso che essendo a minore pressione è sfavorito rispetto a
quello arterioso. Con la degenerazione del connettivo e il collasso della struttura lobulare che precede la
cirrosi, questa architettura viene completamente persa e sovvertita.
http://www.hackmed.org
•
[email protected]
40
Perdita dell’architettura lobulare: all’interno del lobulo cirrotico, in genere le file di epatociti che
separano i sinusoidi sono di un singolo elemento (con rapporto filiera: sinusoide = 1:1) Nella cirrosi esse
sono spesso di tre - quattro cellule; questo ha un effetto diretto di riduzione del numero di sinusoidi
pervi
Circoli collaterali
L’assenza di valvole nel circolo venoso portale facilita il reflusso del sangue dall’interno del parenchima
epatico alle radici della vena porta, dove la pressione è minore.
Questo provoca l’accumulo di sangue nei distretti a monte con la formazione di circoli collaterali portosistemici.
I principali circoli collaterali si hanno a livello delle anastomosi porto – cavali:
• Sistema del Retius: nello spazio retroperitoneale anastomosi esistenti fra le mesenteriche e le vene
retroperitoneali tributarie della azigos-emiazigos
• Plesso emorroidario: tra la vena emorroidaria superiore è tributaria della mesenterica inferiore e la
vena emorroidaria media ed inferiore tributarie della iliaca interna, la dilatazione del plesso emorroidario
è responsabile della formazione delle emorroidi
• Plesso coronario-stomacico: a livello del fondo gastrico esistono anastomosi fra le vene dello stomaco,
tributarie della vena splenica (vene gastriche brevi) e della vena gastrica di sinistra, e le vene esofagee
tributarie delle azigos Æ varici esofagee e del fondo gastrico
• Plesso periombelicale: rete vascolare superficiale della parete ombelicale che si ha in caso pervietà della
vena ombelicale, è costituita da anastomosi tra le vene paraombelicali e le vene epigastriche che da
luogo al cosiddetto caput medusae: rete vascolare periombelicale a decorso centrifugo dall’ombelico
che quando esiste anche ascite, assume le caratteristiche di una vera e propria ernia ombelicale.
Le varici duodenali e rettali sanguinano ma non massivamente, le varici retroperitoneali raramente
sanguinano e rappresentano un problema chirurgico, le varici esofagee sono ad alto rischio di sanguinamento
difficile da trattare.
Diagnosi
L’ecografia consente:
9 Analisi dimensionale e strutturale del fegato e della milza
9 Analisi quantitativa del flusso portale
9 Dimensioni della vena porta e delle vene sovraepatiche
9 Dimostrazione di circoli collaterali (entità del flusso e direzione) e ascite
9 Ricerca di eventuale trombosi portale
La portografia indiretta tramite cateterizzazione del tripode celiaco dimostra nella fase di ritorno venoso
l’architettura del sistema portale, la sede dell’ostacolo e l’entità dei circoli collaterali porto-sistemici.
Non consentono però valutazioni del flusso al contrario dell’ecografia.
La misurazione diretta della pressione sinusoidale viene fatta tramite posizionamento di un catetere nella
vena sovraepatica (pressione epatica libera) e quindi nel lobulo (pressione epatica bloccata).
La differenza tra la pressione epatica libera e quella bloccata equivale alla pressione portale a livello dei
sinusoidi.
conseguenze dell’ipertensione portale sono:
• splenomegalia (milza > 14 cm)
• sviluppo di circoli collaterali porto-cavali epatofughi
• aumento della portata arteriosa secondaria alla riduzione del flusso venoso epatopeto
la circolazione epatica diventa a 4 vie:
1. arteriosa
2. portale
3. cavale epatofuga (vene sovraepatiche)
4. cavale epatopeta (patologica)
è importante la diagnosi differenziale tra le forme:
• presinusoidale: circoli collaterali epatopeti con aspetto caratteristico
(cavernoma portale)
• sinusoidale: circoli epatofughi nella vena splenica
• postsinusoidale: circoli collaterali epatofughi, la vena porta non è ostruita
ma presenta una inversione di circolo non compensato dall’arteriolizzazione
perché le arterie epatiche sono sottili (nell’arteriografia si osserva un
http://www.hackmed.org
[email protected]
41
ristagno del m.d.c. in fase arteriosa e una amputazione funzionatale
completa delle branche portali in fase venosa con aree di mancata
opacizzazione nelle vene sovraepatiche), epatomegalia a carico soprattutto
del lobo caudato e del lobo di sinistra
Nei pazienti con ostruzione extraepatica della vena porta è importante il numero degli shunt spleno-renali
spontanei, se sono presenti c’è una minore probabilità di emorragia digestiva.
Clinica
Vanno indagate le condizioni generali (funzionalità epatica, affaticamento, anoressia, ascite) l’evoluzione
(gravità e numero di sanguinamenti).
terapia
la terapia dell’ipertensione portale è importante per la prevenzione della rottura di varici esofagee che ne
rappresentano la più grave complicanza.
La terapia medica si basa sull’utilizzo di β-bloccanti (propanololo, nadololo) che riducono la pressione
portale sia riducendo la gittata cardiaca sia aumentando le resistenze arteriolari splancniche.
Questi farmaci sono indicati nella prevenzione della prima emorragia da varici esofagee, nei pazienti con
cirrosi epatica, varici esofagee di dimensioni moderate o grandi e senza pregressa emorragia digestiva.
Nella prevenzione della recidiva dell’emorragia da varici esofagee invece possono rappresentare una terapia
alternativa alla scleroterapia o al TIPS.
L’aggiunta di nitrati per via orale (isosorbide 5-mononitrato) migliora l’effetto terapeutico dei β-bloccanti.
Si può tentare di trattare l’ipertensione portale anche in maniera radicale, cioè di risolvere il problema alla
radice e non solo di curare una delle complicanze attraverso lo shunt porto-sistemico.
Shunt portosistemico intraepatico transgiugulare TIPS
È una protesi metallica posizionata per via transgiugulare all’interno del parenchima epatico in modo da
collegare il sistema portale (branca intraepatica della vena porta) con una vena sovraepatica.
Ciò determina la riduzione della pressione portale e la decongestione dei circoli venosi epatofughi in
particolare le varici esofagee.
Un catetere introdotto attraverso la vena giugulare interna destra viene fatto progredire attraverso l’atrio
destro, la vena cava inferiore e la vena sovraepatica destra.
Si fa quindi avanzare al suo interno un ago con il quale si penetra nel vaso portale, si introduce la guida e
quindi il catetere con cui viene dilatato il tramite epatico, quindi si posiziona uno stent epatico permanente.
Indicazioni:
• sanguinamento acuto di varici non controllabile endoscopicamente
• sanguinamento ricorrente
• ascite refrattaria alla terapia farmacologica
• sindrome di Budd-Chiari
• controllo del sanguinamento nel paziente in attesa di trapianto
• sindrome epato-renale
il controllo dei risultati viene fatto tramite ecografia ed eco-doppler che permette di valutare il flusso
all’interno dell’anastomosi.
In caso di precaria visualizzazione si può ricorrere a TC, angio-RM o all’arteriografia selettiva del tripode
celiaco e della mesenterica superiore.
Una importante complicanza del TIPS è l’encefalopatia epatica.
Complicanze dell’ipertensione portale
Le più importanti sono:
z Rottura di varici esofagee e del fondo gastrico
z Ipersplenismo
z Ascite
z Encefalopatia epatica
SANGUINAMENTO DELLE VARICI ESOFAGEE
L’evento più frequente (50%) per quello che riguarda le emorragie digestive nell’etilista e nel cirrotico in
generale è la rottura delle varici esofagee.
Questa evenienza drammatica è responsabile della morte dei cirrotici in maniera inferiore soltanto al
carcinoma epatocellulare.
http://www.hackmed.org
[email protected]
42
Le motivazioni per cui le varici esofagee sono con tanta frequenza un evento drammatico sono molte; esiste
intanto una complessa serie di interazioni idrodinamiche che portano il circolo venoso dell’esofago ad avere
una pressione decisamente elevata.
Oltre a questo, le vene esofagee si trovano nel contesto di una parete piuttosto piccola, di spessore ridotto, e
con l’assenza della sierosa; la vicinanza di strutture come i pilastri diaframmatici e lo sfintere esofageo
inferiore possono inoltre comprimere le varici ed agevolarne la rottura.
A tutto questo può aggiungersi la sindrome di Mallory – Weiss, ossia la erosione della mucosa della
giunzione esofago-gastrica per il ricorrente verificarsi di episodi di pituitismo (emissione di piccole quantità
di vomito acquoso e filante la mattina ), nell’etilista cronico.
La clinica è spesso caratterizzata da un esordio brusco senza nessun sintomo preventivante, e nessuna
correlazione con fattori precipitanti evidenti.
All’emorragia può far seguito melena, sicuramente massiccia ematemesi a volte con getti ad alta pressione
che danno alla situazione un carattere di drammatica emergenza.
Le conseguenze vanno dalla anemizzazione acuta più o meno grave allo shock anche fatale; è importante la
diagnosi differenziale con altre cause di sanguinamento digestivo, anche in quei pazienti che hanno un
processo conclamato di varici.
L’endoscopia EGDS è il metodo migliore per verificare questo.
Non sempre si riesce ad intervenire data la difficoltà di trattare il sanguinamento acuto.
Se però questo si verifica più gradualmente, molte sono le possibilità, soprattutto endoscopiche, di trattare
una emorragia digestiva acuta del genere.
Terapia endoscopica
La terapia delle varici è soprattutto endoscopica, ed è sia preventiva che di emergenza.
In fase diagnostica, quando nel cirrotico si fa una endoscopia per scoprire la sede di un sanguinamento o
anche per il sospetto di varici a causa della presenza di numerosi circoli collaterali nell’addome, si possono
identificare delle varici.
Terapia del sanguinamento acuto da varici
• In questo caso è possibile effettuare la legatura delle varici, attraverso uno strumento inseribile
endoscopicamente nell’esofago, che spara alla base della varice un laccio elastico, chiudendone
l’afflusso sanguigno. La varice così trattata si riassorbe pian piano andando in necrosi ischemica. Lo
strumento contiene sette lacci e l’ultimo è bianco, diverso dagli altri.
• Durante l’emergenza è possibile intervenire dapprima con l’applicazione di un sondino naso-gastrico,
allo scopo di verificare prima di tutto se il sanguinamento è tuttora in corso, con lavaggi con acqua a
temperatura ambiente. Se si aspira sangue rosso vivo il sanguinamento è ancora in corso mentre se si
aspira sangue scuro (digerito) il sanguinamento non è più in atto. Il lavaggio ha anche lo scopo di ripulire
lo stomaco da coaguli, alleviare il senso di nausea che potrebbe portare al vomito e ad un ulteriore danno
della mucosa.
• Il Sondino di Sengastaken-Blackmoore (o di Liston Nachles) è un sondino particolare che ha alla sua
estremità due palloncini posti in successione l’uno all’altro. Questo sondino viene inserito nello stomaco,
e successivamente viene gonfiato il palloncino distale. Tirando verso l’alto si raggiunge ben presto il
blocco del LES. A questo punto, il sondino viene bloccato nella posizione con il gonfiaggio dell’altro
palloncino. Questo trattamento permette la compressione dell’origine del sanguinamento ma non può
essere mantenuto in loco per più di due – tre giorni, per evitare la necrosi ischemica della mucosa
esofagea. Il suo ruolo perciò è di emergenza nell’impossibilità di effettuare subito una terapia
endoscopica, e di prevenzione delle recidive dopo di essa.
• La Sclerosi per via endoscopica rimane la terapia di elezione di questa patologia. Si scende fino al
luogo del sanguinamento con l’endoscopio (è una terapia che si applica anche alle ulcere), e si inietta
mediante un catetere a punta sottile una delle molte sostanze sclerosanti, in genere epinefrina o
etanolamina (0,5-1mg) in ripetute somministrazioni attorno alla varice. L’effetto è quello di provocare
una tromboflebite a livello della varice con conseguente occlusione del lume e fibrosi. Il procedimento
controlla il sanguinamento nel 90-95% dei casi, ma deve essere considerato come un intervento da non
effettuare se il sanguinamento non è importante, e in ogni caso come misura preventiva è preferibile la
legatura.
Profilassi del primo sanguinamento: si somministra propanololo che è un beta-bloccante che riduce la
pressione portale mediante vari meccanismi: riduzione della gittata cardiaca, riduzione della circolazione
http://www.hackmed.org
[email protected]
43
tributaria al fegato e riduzione della resistenza vascolare a livello della circolazione epatica e dei circoli
collaterali.
Il trattamento medico delle varici esofagee si avvale anche di una serie di presidi di natura farmacologica,
che sebbene siano molto meno efficaci, possono spesso costituire un importante pretrattamento che facilita
l’esecuzione della pratica endoscopica.
Inoltre spesso possono arrestare il sanguinamento che a volte si arresta anche in modo spontaneo.
• Rapida reidratazione e prevenzione dell’ipovolemia: sono misure terapeutiche che devono essere prese
immediatamente, prima di ogni altra considerazione. Senza esagerare nell’infusione di liquidi, perché un
aumento della pressione sistemica di riempimento finisce per peggiorare l’ipertensione portale.
• Nei pazienti cirrotici in cui coesiste coagulopatia è essenziale fornire fattori della coagulazione, allo
scopo di facilitare l’arresto spontaneo dell’emorragia
• Farmaci che cercano di bloccare il sanguinamento attraverso la riduzione dell’irrorazione delle mucose
sono vasopressina per infusione endovenosa e somatostatina che è più specifica per l’apparato
gastroenterico. Questi farmaci si associano ad una alta frequenza di risanguinamento, e possono avere
molte complicazioni a livello miocardico
IPERSPLENISMO
L’ostacolo al flusso portale determina un accumulo di sangue nel parenchima splenico (splenomegalia
congestizia) che è di maggiore portata in caso di ipertensione portale di tipo presinusoidale preepatico.
Ciò determina il sequestro splenico di piastrine e leucociti con conseguente leucopiastrinopenia.
Ascite
L’ascite, ossia la raccolta di liquido libero nella cavità addominale, è una complicanza diretta della cirrosi ma
che comprende, nella sua eziologia, anche altri elementi.
L’ascite è la conseguenza di uno squilibrio tra la produzione ed il riassorbimento del liquido ascitico da parte
della sierosa peritoneale:
• Aumento della permeabilità dei capillari della sierosa: peritoniti o neoplasie peritoneali
• Riduzione della pressione colloidosmotica del plasma per ipoproteinemia: denutrizione, enteropatia
protido-disperdente, sindrome nefrosica, cachessia
• Ipertensione portale: cirrosi epatica, ostruzione della vena cava inferiore, insufficienza cardiaca
congestizia, ipervolemia (ex. da iperaldosteronismo secondario)
• Ostruzione linfatica (ascite chilosa)
La genesi dell’ascite nel cirrotico è multifattoriale e comprende:
• Teoria dell’ipoafflusso: secondo questa teoria, il danno iniziale è il sequestro di liquidi nel letto
vascolare splancnico secondario all’ipertensione portale. Per questo il volume di perfusione renale
diminuisce si ha attivazione del sistema renina-angiotensina-aldosterone (con iperaldosteronismo
secondario), inoltre si ha attivazione dei volocettori con aumento di secrezione dell’ADH, la
conseguenza è riassorbimento eccessivo di sodio e di liquidi che determina un incremento della volemia
peggiorando il quadro dell’ascite.
• La Teoria della vasodilatazione arteriolare indica invece che l’ipertensione portale produce
vasodilatazione delle arteriole del circolo splacnico, con diminuzione della pressione periferica, e quindi
ipoperfusione renale. Seguono gli stessi eventi.
• A questo si aggiunge la diminuzione della pressione oncotica del plasma (per riduzione della sintesi
epatica di proteine a causa dell’insufficienza epatica)
• Nei pazienti con cirrosi e ascite, ma non in quelli con cirrosi senza ascite, si osserva aumento del tono
simpatico centrale¸ che svolge probabilmente un ruolo centrale nella diminuzione della diuresi
• Specie in alcuni pazienti con sindrome di Budd–Chiari, è possibile un libero sgocciolamento della linfa
epatica dalla glissoniana, per la compressione delle strutture drenanti, ma anche per il sovvertimento
dell’architettura del parenchima epatico. Questo può essere la spiegazione degli alti livelli di proteine
che a volte si riscontrano nei pazienti con ascite.
clinica
All’esame obiettivo in presenza di un abbondante versamento ascitico l’addome appare globoso teso e
generalmente simmetrico, cicatrice ombelicale è piana o estroflessa.
http://www.hackmed.org
[email protected]
44
Frequente è la presenza di circoli collaterali sulla superficie addominale laterale o a raggera intorno
all’ombelico in caso di pervietà della vena ombelicale (caput medusae).
Se il versamento non è abbondante in posizione supina l’addome si presenta svasato ai lati poichè il liquido
si raccoglie nelle parti più declivi (addome batraciano).
Se il versamento è di scarsa entità può non osservarsi alcun cambiamento della forma dell’addome.
È importante la diagnosi differenziale con il globo vescicale e con una voluminosa cisti ovarica.
In posizione supina effettuando la percussione si apprezza un suono ottuso a livello dei fianchi, in decubito
laterale l’ottusità si sposta dal lato del decubito.
Questa manovra permette svelare versamenti anche di modesta entità e di differenziare il versamento liquido
da quello saccato.
Per evidenziare versamenti di piccola entità occorre percuotere in prossimità dell’ombelico con il paziente in
posizione genupettorale.
In caso di versamento cospicuo risulta positivo il segno del fiotto: brevi urti impressi con una mano a livello
del fianco inducono degli impulsi ondulatori che vengono recepiti con l’altra mano posta sul lato opposto.
In genere l’ascite si associa alla presenza di edemi periferici soprattutto perimalleolari e sacrali.
Nel 10% dei pazienti è presente versamento pleurico più frequente a destra dovuto alla perdita di liquidi
attraverso i linfatici del diaframma e agli effetti dell’ipertensione sul sistema della vena azigos.
Se la tensione addominale è cospicua si può verificare atelettasia delle basi polmonari con conseguente
alterazione della funzione ventilatoria e dispnea.
È presente spesso un alterazione della funzione dello sfintere esofageo inferiore con predisposizione alla
esofagite da reflusso.
Una complicanza dell’ascite estremamente importante da diagnosticare è la peritonite spontanea batterica
legata all’infezione del liquido ascitico da parte di batteri intestinali.
diagnosi
Il trattamento dell’ascite deve per prima cosa mirare a definire la causa di ascite: nel cirrotico, questa è
spesso progressiva e non si associa a fattori precipitanti, ma può anche essere la causa di una dieta
impropriamente ricca di sodio, o farmaci, o l’insorgenza di un epatocarcinoma.
Negli altri soggetti si deve sospettare la sindrome di Budd – Chiari.
Inizialmente si deve eseguire la paracentesi esplorativa con ago sottile allo scopo di prelevare 200 ml di
liquido per analisi.
Viene fatta una analisi di tipo biochimico, citologico e colturale.
Il normale liquido peritoneale contiene circa 1-3 g/dl di proteine, glucosio, Na e K in concentrazione uguale
al plasma e cellule mesoteliali di sfaldamento.
Il liquido trausudatizio è giallo paglierino, e non contiene cellule ne frammenti di materiale cellulare.
La presenza di un liquido torbido con aumento dei linfociti è indicativa di peritonite.
La presenza di un liquido ematico o sieroematico è indicativa di una condizione neoplastica (carcinomatosi
peritoneale) anche se nel paziente cirrotico può essere legata alla rottura spontanea o provocata di piccoli
vasi peritoneali.
L’aspetto lattescente è indicativo di una ascite chilifera causata da una ostruzione linfatica dovuta in genere
ad un linfoma o ad un altra neoplasia ma talora presente anche nella cirrosi.
L’analisi biochimica del liquido può differenziare un liquido ascitico di tipo trasudatizio (concentrazione
proteica < 3.5 g/dl) da uno di tipo essudatizio e può evidenziare la presenza di enzimi pancreatici in caso di
ascite pancreatica.
L’esame citologico può confermare la presenza di una carcinosi peritoneale.
L’esame colturale permette la diagnosi di peritonite di tipo infettivo, in particolare la peritonite spontanea
batterica nel cirrotico.
La diagnosi di versamenti di piccola entità viene fatta tramite ecografia che è in grado di evidenziare
versamenti fino a 100 ml.
Nel paziente supino in assenza di aderenze il versamento ascitico si raccoglie nelle zone più declivi: lo scavo
pelvico e le doccie parietocoliche, man mano che il volume aumenta verranno occupate la tasca di Morrison
(spazio subepatico posteriore delimitato dalla riflessione del peritoneo sul fegato e dall’origine del
mesocolon trasverso), lo spazio subfrenico destro, sinistro e infine tutta la cavità peritoneale.
L’Rx diretta addome consente l’individuazione solo di versamenti di cospicua entità: effetto “floon” diffuso
(maldefinizione dei profili dei muscoli parietali ai lati dell’addome), opacità dello scavo pelvico, anse
intestinali raccolte al centro dell’addome, sollevate dal piccolo bacino in ortostatismo, discretamente
associate per la formazione di essudato tra di esse (questo non avviene in caso di emoperitoneo in cui spesso
http://www.hackmed.org
[email protected]
45
il sangue circonda le anse senza penetrare tra di esse), separazione e galleggiamento del gas contenuto nelle
anse intestinali.
Terapia
Lo scopo della terapia è quello di ottenere una progressiva perdita di liquidi, da 500 a 1000 ml al giorno,
attraverso la diuresi spontanea se possibile, oppure con l’uso di diuretici, o alla fine tramite paracentesi
evacuativa.
Il più importante provvedimento terapeutico iniziale è la restrizione dell’apporto alimentare di Na, non
dovrebbero essere consentiti più di 1000 mg di Na al giorno.
Il riposo a letto è in grado di facilitare la diuresi attraverso la posizione supina.
I diuretici di elezione sono quelli attivi sul tubulo contorto distale (come lo spironolattone), a causa del
ruolo patogenetico dell’aldosterone.
I diuretici non vanno somministrati ad individui con aumentati livelli sierici di creatinina perché riducendo la
volemia determinano un peggioramento della funzione renale.
Lo scopo della terapia diuretica è la perdita di peso al giorno di 0.5-1 Kg nei pazienti con edema e di 0.25 Kg
nei pazienti senza edema.
Il dosaggio del farmaco va aggiustato ogni 3-5 giorni per iniziare o mantenere una diuresi adeguata.
Lo spironolattone è il diuretico di scelta che viene dato al dosaggio iniziale di 25 mg per os 2 volte al giorno
che può essere aumentato fino ad un massimo di 500 mg/die.
L’amiloride e triamterene sono utili nei pazienti che non tollerano lo spironolattone.
Quando lo spirnonollatone non riesce a stimolare sufficientemente la diuresi vanno aggiunti i diuresi
dell’ansa.
I pazienti vanno monitorati per evidenziare la comparsa di eventuali segni di contrazione del volume
circolante, alterazioni elettrolitiche, encefalopatia, insufficienza renale.
Le alterazioni idroelettrolitiche indotte da i diuretici devono essere monitorizzate poichè possono scatenare
l’insorgenza di una sindrome epatorenale.
Non è necessaria alcuna restrizione dell’apporto di liquidi, se compare iponatremia da diluizione è
sufficiente una restrizione di liquidi di 1000-1500 ml/die.
La somministrazione di albumina è riservata ai pazienti con albuminemia < 2 g/dl, deplezione del volume
intravascolare ed in caso di paracentesi evacuativa poichè la quantità somministrata viene rapidamente messa
in equilibrio con quella presente nell’ascite.
La paracentesi evacuativa viene eseguita mediante puntura diretta della parete addominale e permette di
evacuare anche quantità abbondanti di liquido.
La paracentesi viene fatta in anestesia locale con un ago-cannula 5 cm al di sotto dell’ombelico sulla linea
mediana o nella fossa iliaca dopo lo svuotamento della vescica.
La paracentesi permette di evitare gli effetti collaterali della terapia diuretica e di evitare le complicanze
dovute all’incremento della pressione intraddominale quali il reflusso gastroesofageo e l’atelettasia
polmonare, permette inoltre di evitare la comparsa di versamento pleurico.
Si deve però tener presente che la deplezione di proteine viene aggravata dalla paracentesi, perché le proteine
contenute nel liquido ascitico possono venir riassorbite.
Viene quindi contemporaneamente somministrata albumina per via endovenosa.
Peritonite batterica spontanea
I pazienti con ascite e cirrosi tendono a sviluppare una malattia spontanea di infezione batterica del liquido
peritoneale, nel senso che la sintomatologia non è giustificata da nessuna altra fonte di infezione sistemica.
Il fenomeno riguarda un 10-20% di soggetti che hanno di solito una particolare composizione del liquido
ascitico, caratterizzata cioè dalla carenza di albumina e di altre opsonine, che offrono una protezione nei
confronti di batteri.
I patogeni sono in genere batteri gram- di provenienza intestinale, che attraversano le anse e raggiungono
il liquido endoaddominale.
Clinicamente si ha una febbre, brividi, dolore addominale e distensione, riduzione dei rumori intestinali e
leucocitosi neutrofila.
I sintomi possono però anche essere minimi o assenti.
A volte si osserva peggioramento dell’ascite e dell’encefalopatia.
La diagnosi si basa sul prelievo di liquido ascitico, che deve contenere almeno 500 cellule, di cui 250 PMN,
per ml e sul successivo esame colturale.
http://www.hackmed.org
[email protected]
46
La presenza di 10000 linfociti, e la assenza di miglioramento dopo 48h di terapia indicano di solito una
infezione dovuta ad un processo sistemico differente.
La coltura del liquido ascitico in genere risulta positiva per batteri intestinali in particolare Escherichia Coli
e Streptococcus Pneumoniae.
Una forma particolare, detta non neutrofila monomicrobica è caratterizzata dalla presenza di batteri ma pochi
PMN.
La terapia specifica si instaura solo dopo l’esame del prelievo di liquido, nel frattempo va fatta una terapia
antibiotica empirica con cefalosporine di III generazione (cefotaxine) per 5-7 giorni.
Gli aminoglicosidi vanno evitati perché possono precipitare l’insufficienza renale, non raggiungono livelli
adeguati nel liquido ascitico e sono inattivati da un PH acido.
In caso di peggioramento clinico nonostante la terapia o se nessun microrganismo è stato isolato va effettuata
dopo 48-72 ore una nuova paracentesi.
Elevata è la frequenza di recidive.
La norfloxacina 400 mg/die per os riduce le recidive ma non migliora la sopravvivenza.
Sindrome epato-renale
Consiste in una insufficienza renale che si manifesta in pazienti con gravi epatopatie.
La sua patogenesi non è del tutto chiara, comunque l’alterazione non è di tipo anatomico poichè i reni
trapiantati in soggetti normali recuperano totalmente la loro attività.
Ciò indica che l’alterazione è di tipo funzionale ed è rappresentata da una ipoperfusione renale dovuta al
sequestro di liquidi a livello del versamento ascitico e dei circoli collaterali (insufficienza di tipo
prerenale).
Si ha inoltre una alterata distribuzione del flusso ematico intrarenale con relativa ischemia della corticale.
L’apertura di shunts cortico-midollari è dovuta a diversi fattori: aumento della concentrazione di renina,
attivazione del simpatico, riduzione della formazione delle prostaglandine renali, alterazione del sistema
callicreina-chinine, endotosssinamia.
L’encefalopatia si instaura spontaneamente o in seguito a cause scatenanti quali: emorragia digestiva,
terapia diuretica particolarmente intensa, paracentesi, infezioni.
Si ha oliguria ingravescente ed alterazione dei parametri di funzionalità renale:
z iperazotemia
z ipercreatinemia
z diminuita escrezione di sodio la concentrazione urinaria di sodio escreto < di 10 mEq nelle 24h (dovuta
all’iperaldosteronismo secondario)
gli altri indici di funzionalità renale sono quelli dell’insufficienza renale di tipo prerenale.
Non esiste una terapia specifica, fondamentale è la prevenzione dei possibili fattori scatenanti: evitare
sovraccarichi di diuretici, trattare l’ascite in modo non aggressivo, ripristinare eventuali riduzioni del volume
ematico conseguenti ad emorragie GI o disidratazione.
Non vanno utilizzati farmaci che inibiscono la sintesi delle prostaglandine (FANS).
encefalopatia epatica
Viene definita anche encefalopatia portosistemica.
L’encefalopatia epatica è una sindrome neuropsichiatrica caratterizzata da alterazioni neurologiche, dello
stato di coscienza e del comportamento secondaria alla disfunzione epatica.
La malattia si manifesta essenzialmente in due forme:
Acuta: l’instaurazione di una insufficienza epatica acuta da necrosi (HV, farmaci, epatite tossica) conduce al
coma epatico, in maniera però reversibile alla rimozione della causa. Può anche verificarsi in caso di
improvvisa ostruzione del circolo portale con shunt sistemico rilevante.
Cronica: situazione secondaria alla cirrosi, provocata quindi dalla progressiva riduzione della massa e della
funzionalità epatica e anche all’instaurarsi di condizioni di alterazioni vascolari progressive.
La patogenesi di queste alterazioni è legata all’accumulo di diverse sostanze tossiche che il fegato non è più
in grado di metabolizzare efficacemente, soprattutto sostanze neurotossiche.
eziopatogenesi
Le cause di ciò sono 2:
http://www.hackmed.org
z
z
[email protected]
47
compromissione della funzionalità epatica
presenza di bypass portosistemici cioè di circoli collaterali che impediscono alla sostanze tossiche
soprattutto di origine intestinale di essere metabolizzate a livello epatico
Alcuni agenti implicati sono:
• Ammoniaca: origina dalla sintesi dei batteri intestinali e non viene incorporata nella molecola di urea a
causa del deficit epatico di ureagenesi, il danno cerebrale è sia diretto per azione sulle membrane
cellulari che indiretto per blocco della produzione energetica grazie al legame con i metaboliti intermedi
del ciclo di Krebs, inoltre l’ammoniaca determina accumulo a livello del SNC di neurotrasmettitori
inibitori quali il GABA
• Mercaptani: derivati dal metabolismo intestinale della metionina ad opera dei batteri
• Dimetili solfati
• Acidi grassi a catena corta (acido butirrico, veleroico ed octanoico) riducono la soglia di sensibilità
all’ammoniaca
• Fenolo
• a-KG
• Falsi neurotrasmettitori: in corso di EPS si osserva in circolo una aumentata concentrazione di
aminoacidi aromatici (fenilalanina, tirosina e triptofano) ed una riduzione degli aminoacidi ramificati
(forse perchè utilizzati a scopo energetico) poichè questi aminoacidi hanno carrier comuni di membrana
si è ipotizzato che la riduzione di aminoacidi ramificati possa aumentare la penetrazione di quelli
aromatici a livello del SNC. Questa situazione porta da un lato alla riduzione dei normali
neurotrasmettitori (dopamina noradrenalina) e dall’altra alla sintesi di serotonina, tiramina,
octopamina e feniletanolamina che funzionano da falsi neurotrasmettitori competendo con i veri
neurotrasmettitori dopaminergici, si determina così un incremento dei neurotrasmettitori inibitori e una
riduzione di quelli eccitatori.
• Attivazione del sistema GABAergico che è il principale sistema inibitorio del SNC per la presenza di
aumentati livelli ligandi per i recettori delle benzodiazepine
Studi recenti evidenziano che probabilmente le sostanze che stimolano la progressione della malattia
encefalica abbiano anche un ruolo indiretto, favorendo la permeabilità della BEE.
Spesso, soprattutto nei pazienti con cirrosi stabilizzata, la sindrome si manifesta solamente in seguito a
condizioni precipitanti le quali agiscono o aumentando il carico di sostanze tossiche che il fegato non è in
grado di smaltire o riducendo ulteriormente la funzione epatica o aumentando la quantità di sangue che
provenendo dall’intestino viene shuntata direttamente nel circolo sistemico senza passare per il fegato.
Tra le cause precipitanti più frequenti vi sono:
• emorragia digestiva massiva che mette grandi quantità di ammoniaca nell’intestino dal catabolismo
dell’eme
• l’assunzione di una pasto ricco di proteine
• stipsi che favorisce il riassorbimento di ammoniaca
• infezioni
• sedativi
• analgesici
• l’alcalosi metabolica, provocata da vomito, da paracentesi o da eccessivo uso di diuretici, può essere un
evento scatenante importante, perché produce il passaggio dell’ammoniaca dalla forma ionizzata (NH4+)
alla forma neutra (NH3), ed è solo quest’ultima che passa la BEE.
In genere poi qualsiasi complicazione riguardante il fegato scatena con facilità la sindrome.
clinica
Dal punto di vista clinico, la malattia dà luogo a diverse manifestazioni alquanto varie.
Nei pazienti con la forma acuta il quadro regredisce sempre con la risoluzione del problema epatico.
La forma cronica può invece essere progressiva e irreversibile.
Nella forma cronica la sintomatologia iniziale è caratterizzata da alterazioni psichiche quindi disturbi della
coscienza e della motilità.
I segni principali sono:
• Disturbi del sonno: l’inversione del ciclo sonno/veglia (sonnolenza diurna) è una delle manifestazioni
più precoci
• Disturbi del comportamento: alterazione della personalità e dell’umore, della cura di sé, agitazione
psicomotoria, stato delirante-allucinatorio, confusione mentale
http://www.hackmed.org
[email protected]
48
•
Asterixis o flapping tremor: detto anche fremito epatico o “tremore a battito d’ali”, è una condizione in
cui non si riesce più a mantenere volontariamente le estremità iperestesie (per deficit dei muscoli
estensori), per cui non si riesce a flettere indietro le mani, il capo, gli arti. Può essere messa in evidenza
facendo alzare le braccia sopra al capo ed estendere le mani: si manifestano dei movimenti di tremore
oscillatorio di flesso-estensione della punta delle dita e della mano, intermittenti ed irregolari,
richiamanti un battito d’ala. Poiché questa manovra richiede una estensione volontaria, non può essere
messa in evidenza nei pazienti in coma.
• Fetor Hepaticus: caratteristico odore di mele marce dell’alito e delle urine, associato alla presenza di
mercaptani
• Aprassia costruzionale incapacità di riprodurre disegni anche semplici come una stella o di scrivere la
propria firma
• Alterazioni caratteristiche dell’EEG
Possono inoltre manifestarsi riflesso di suzione, prensione forzata, accentuazione dei riflessi osteotendinei,
segno di Babinski, riduzione dell’acuità visiva, diplopia, alterazioni della percezione (micropsie o
allucinazioni complesse), segni cerebellari, crisi epilettiche.
Le complicanze mortali sono rappresentate dall’edema cerebrale e dall’ipertensione endocranica.
Esiste la possibilità che altre patologie neurologiche si sovrappongano ad un problema epatico senza che ci
sia necessariamente un rapporto di causa effetto.
Questo è tipico soprattutto dell’alcolista, spesso affetto da varie forme di psicosi, e per questo la diagnosi
delle malattia in questione è principalmente di esclusione.
Si deve prestare attenzione, nel giovane con patologia epatica, alla diagnosi differenziale con il morbo di
Wilson.
Lo staging della malattia è il seguente:
Stadio
Stato mentale
I
Euforia o depressione, lieve confusione, +/linguaggio impacciato, alterazioni del sonno
Sonnolenza, moderata confusione
+
II
III
IV
Asterixis EEG
Grave confusione, linguaggio incoerente, forte +
sopore
Coma, inizialmente reattivo allo stimolo doloroso, poi no
Normale
Alterato
Alterato
Alterato
Un rischio notevole associato a questi pazienti è l’apparente stato di lucidità mentale che può spingere a
crederli capaci di guidare autoveicoli o effettuare lavori rischiosi.
Spesso muoiono per incidenti stradali a causa dell’aprassia.
Il quadro clinico può essere completamente reversibile ma episodi prolungati o ripetuti possono essere
responsabili di degenerazione epato-cerebrale acquisita.
Diagnosi
Si basa su semplici esercizi come fare la propria firma o seguire il contorno di un disegno che il paziente non
è in grado di eseguire in presenza di aprassia costruzionale.
I test psicometrici permettono di diagnosticare l’ECP anche in pazienti apparentemente normali dal punto di
vista neurologico (encefalopatia latente).
Importante è anche l’EEG anche se le alterazioni inizialmente sono minime e sono significative solo in fase
tardiva.
Le indagini di laboratorio evidenziano una alterazione dei parametri di funzionalità epatica ed in particolare
l’iperammonemia.
terapia
La terapia è di tre tipi:
z Supporto al coma
z Eliminazione o trattamento dei fattori epatici
z Dieta ipoproteica ed in particolare povera di proteine animali per evitare la produzione di ammoniaca,
va garantito un adeguato introito calorico (25-30 Kcal/Kg per via entrale o parenterale)
http://www.hackmed.org
z
z
z
z
z
[email protected]
49
Trattamento con antibiotici per ridurre la flora batterica intestinale che è la principale responsabile della
produzione di ammoniaca
a) Neomicina per via orale tramite SNG 1 g ogni 6 ore o tramite clistere all’1% di soluzione
(1-2 g in 100-200 ml di soluzione salina isotonica) 2-4 volte al giorno, poiché l’1-3% della
dose somministrata viene assorbita con rischio di ototossicità e nefrotossicità, è preferito
l’uso del lattulosio che è ugualmente efficace e meno tossico, nei soggetti non responsivi al
lattulosio o alla neomicina soltanto si può fare una terapia di associazione
b) Metronidazolo è utile nella terapia a breve termine quando la neomicina è inefficace o
scarsamente tollerata 250 mg per os ogni 8 ore
Somministrazione di lattulosio un disaccaride sintetico non assorbibile che metabolizzato dalla flora
batterica intestinale da origine ad acido lattico ed acido acetico che acidificano il PH intestinale
favorendo la trasformazione dell’ammoniaca in ammonio quaternario che viene più facilmente eliminato
con le feci (effetti collaterali sono la diarrea e talvolta squilibri elettrolitici)
a) Lattulosio orale: 15-45 ml 2-4 volte al giorno, le dosi di mantenimento dovrebbero essere
modificate per produrre 3-5 scariche di feci morbide al giorno. Le dosi orarie di 30-45 ml
per os possono essere utilizzate per produrre una rapida ed intensa catarsi durante la fase
iniziale del trattamento o nell’encefalopatia portosistemica associata a stipsi o
sanguinamento del tratto GI, non va somministrato in caso di ostruzione intestinale, l’uso
eccessivo può determinare disidratazione, ipernatremia
b) Lattulosio in clistere: preparati con 300 ml di lattulosio aggiunti a 700 ml di acqua di
rubinetto, possono essere somministrati 2-4 volte al giorno
Somministrazione di aminoacidi a catena ramificata per via orale o parenterale, che tendono a
riequilibrare lo squilibrio di concentrazione con quelli aromatici
vitamina K è raccomandabile contro il rischio di emorragia
flumazenil (antagonista specifico dei recettori per le benzodiazepine a livello cerebrale) si è rivelato
utile per migliorare il quadro dell’encefalopatia epatica grave
ANATOMIA PATOLOGICA DELL’INSUFFICIENZA EPATICA
Condizioni generali scadenti.
Cute pallida a causa dell’anemia da sanguinamento cronico (a causa delle alterazioni della coagulazione) e
giallastra a causa dell’ittero (o subittero presente solo sulle sclere).
Presenza di telangectasie stellari o aracniformi, eritema palmare e reticoli venosi superficiali.
Atrofia testicolare e ginecomastia nell’uomo.
Edemi soprattutto agli arti inferiori (per compressione sulla vena cava da parte dell’addome ascitico).
Cavità cranica: aracnoide fibrotica cronica specifica.
Cavità toracica: atelettasia da compressione per innalzamento del diaframma causato dall’ascite e per
idrotorace che fa parte del quadro anasarcatico, broncopolmoniti o recrudescenza di TBC facilitate dalla
stasi.
Cuore: stato degerativo torbido dovuto a disprotidemia, broncopolmonite e insufficienza coronarica per
anemia.
Addome: ascite, splenomegalia (milza aumentata di peso 500-1000 g, volume e consistenza a differenza del
tumore infettivo della milza).
Varici esofagee ed emorroidi.
Cause di morte più frequenti sono:
• Rottura di varici esofagee
• Insufficienza epatica
• Infezioni intercorrenti (per lo più broncopolmonite)
• Carcinoma epatocellulare
Stasi o congestione passiva del fegato
È in genere secondaria allo scompenso cardiaco congestizio soprattutto di destra.
Il fegato si presenta aumentato di volume e congesto, superficie liscia, con margini arrotondati (a differenza
della cirrosi in cui il margine è tagliente) e stiramento della glissoniana.
È presente dolore spontaneo o provocato causato dallo stiramento della glissoniana.
http://www.hackmed.org
[email protected]
50
Al taglio si verifica fuoriuscita di sangue.
Inizialmente si ha dilatazione delle vene centrolobulari con compressione meccanica degli epatociti
adiacenti.
Successivamente si ha il tipico aspetto “ a noce moscata” caratterizzato da aree centrolobulari rosse e
congeste circondate da zone pallide talvolta giallastre corrispondenti alla periferia del lobulo.
Gli epatociti che si trovano in stretta vicinanza della vena centrolobulare (zona 3 dell’acino) vanno incontro a
necrosi ischemica o coagulativa mentre quelli più periferici subiscono alterazioni meno gravi caratterizzate
da degenerazione grassa (steatosi) che determina la formazione delle aree giallastre.
Gli epatociti sono sporgenti poichè la degenerazione grassa determina aumento del volume cellulare.
In alcune situazioni, soprattutto quando coesiste l’insufficienza cardiaca sinistra,l’ipoperfusione arteriosa con
ipossia severa determina necrosi centrolobulare intorno ai sinusoidi congesti.
La rottura dei sinusoidi determina necrosi centrolobulare emorragica.
La necrosi massiva determina il collasso delle zone 3 dell’acino che confluiscono tra di loro e lascia intatti
soltanto gli epatociti intorno allo spazio portale (zona 1 dell’acino o periportale) determinando il quadro
istologico del fegato a lobuli invertiti: normalmente il lobo presenta centralmente la vena centrolobulare e
in connettivo in sede periferica mentre in questo caso il connettivo è presente a livello della vena
centrolobulare e lo spazio portale si trova al centro.
Se la stasi regredisce in quanto vengono rimosse le cause si verifica rigenerazione epatocitaria che porta alla
guarigione in quanto lo stoma reticolare non viene compromesso.
Se la stasi diventa cronica le cellule necrotiche vengono sostituite da connettivo portando alla fibrosi che si
manifesta a partire dalla vena centrolobulare e costituisce la cosiddetta pseudocirrosi (a differenza della
cirrosi non sono presenti noduli di rigenerazione poichè la condizione di ipossia cronica non consente la
rigenerazione cellulare) in realtà il termine più appropriato è quello di sclerosi cardiaca.
A questo stadio il fegato si presenta lievemente ridotto di volume.
Infarto epatico
L’infarto epatico è raro a causa della doppia vascolarizzazione (arteria epatica e vena porta) e della ricchezza
di anastomosi.
In genere si verifica a causa della occlusione di un ramo intraepatico dell’arteria epatica che può essere
dovuto a:
• Trombosi o embolia
• Neoplasia
• PAN
L’infarto è di tipo bianco o ischemico e appare come un area cuneiforme bianco-grigiastra con base
periferica e apice verso l’ilo.
Alla necrosi fa seguito l’infiammazione e quindi la fibrosi con esito in cicatrice.
L’occlusione di una branca intraepatica della vena porta invece non determina infarto ischemico ma
piuttosto atrofia degli epatociti secondaria alla grave congestione sinusoidale che appare come un’area rosso
scuro nettamente demarcata cuneiforme con apice verso l’ilo (infarto di Zann).
L’occlusione di un ramo principale dell’arteria epatica non determina sempre necrosi ischemica poiché il
flusso retrogrado attraverso i suoi rami accessori, insieme al flusso portale è in grado di mantenere la vitalità
del parenchima epatico.
L’unica eccezione è la trombosi o la sezione dell’arteria epatica nel fegato trapiantato che determina la
perdita dell’organo.
Ostruzione e trombosi della vena porta
Generalmente non si associa ad alterazioni patologiche a carico del parenchima epatico ma è la principale
causa di ipertensione portale di origine preepatica.
Le cause possono essere:
• Compressione estrinseca da parte dei linfonodi ilari interessati da neoplasie metastatiche
addominali
• Propagazione della trombosi della vena splenica secondaria a pancreatite
• Pileflebite in seguito a sepsi peritoneale
• Infiltrazione da parte di una neoplasia epatica
• Cirrosi epatica
http://www.hackmed.org
[email protected]
51
• Morbo di Crohn
• diverticolite
La diagnosi può essere effettuata tramite ecografia ed eco-doppler.
Alla TC con m.d.c. si ha una mancata opacizzazione della vena porta nella fase di ridistribuzione.
Sindrome di Budd-Chiari
In passato veniva definita come trombosi acuta delle vene sovraepatiche, oggi il termine è stato esteso a
comprendere tutte le sindromi occlusive acute o croniche delle vene epatiche caratterizzate da
epatomegalia, ascite e dolore addominale (ipertensione portale postepatica).
L’ostruzione è principalmente dovuta a infiltrazione tumorale o a trombosi.
Le principali cause sono:
• Stati di ipercoagulabilità
• Policitemia vera
• Gravidanza
• Postpartum
• Emoglobinuria parossistica notturna
• Epatocarcinoma o carcinoma renale
• Infezioni intraepatiche
L’ostruzione al deflusso venoso intraepatico determina una spiccata congestione venosa e sinusoidale.
Il fegato appare congesto, aumentato di volume, di colore rosso scuro con capsula tesa e al taglio fuoriesce
sangue.
Se l’ostruzione si instaura acutamente si manifesta con un improvviso e doloroso incremento di volume
epatico, mentre se si sviluppa lentamente l’epatomegalia compare in modo più insidioso ed è di solito meno
dolorosa.
In questo secondo caso si può avere atrofia degli epatociti con sclerosi centrolobulare ed evoluzione verso la
fibrosi cardiaca.
La diagnosi può essere effettuata tramite ecografia o in alternativa con TC con m.d.c. o RM.
Malattia veno-occlusiva
È una patologia caratterizzata dall’occlusione fibrotica delle vene epatiche < 1 mm con congestione epatica
secondaria.
Le cause sono:
• Radioterapia e chemioterapia (soprattutto dopo trapianto di midollo osseo)
• Terapia con azatioprina (trapiantati renali)
• Sostanze tossiche in India ed Afganistan
• Infusioni di Heliotropium usate a scopo terapeutico
La patogenesi è legata ad un danno tossico dell’endotelio di vene e sinusoidi con attivazione della
coagulazione e fibrosi intimale.
Nella fase acuta della malattia si verifica congestione centrolobulare e sinusoidale con stravaso di eritrociti
ed accumulo di macrofagi ripieni di emosiderina.
Nella fase cronica si ha fibrosi perivenulare con deposizione di emosiderina nel tessuto cicatriziale.
Peliosis epatica
È una patologia caratterizzata dalla presenza di spazi cistici ripieni di sangue non solo a livello epatico ma
anche nella milza, nei linfonodi ed in altri organi.
Microscopicamente si ha la formazione di spazi cistici che si possono confondere con dilatazioni sinusoidali
in cui le fibre reticoliniche non vanno incontro a lisi.
Le cause sono:
• Steroidi anabolizzanti
• Estrogeni sintetici
• Terapia immunosoppressiva
• AIDS
La malattia è per lo più asintomatica, talvolta si manifesta con insufficienza epatica o con emorragia per
rottura spontanea o traumatica delle cisti.
http://www.hackmed.org
[email protected]
52
Sindrome di Reye
È una malattia rara caratterizzata da steatosi epatica e da encefalopatia che nelle forme più severe può
essere anche mortale.
Colpisce soprattutto i bambini (da 6 mesi a 15 anni), esordisce in seguito ad una infezione virale (in
particolare la varicella) ed è legata all’assunzione di acido acetilsalicilico.
La patogenesi probabilmente è legata ad una alterazione del metabolismo mitocondriale con riduzione
dell’attività del ciclo di Krebs, del ciclo dell’urea e della beta-ossidazione degli acidi grassi che determina
iperammonemia, ipoglicemia ed accumulo di acidi grassi che vengono esterificati in trigliceridi e si
accumulano soprattutto a livello epatico.
Le alterazioni istopatologiche sono rappresentate da steatosi epatica microvescicolare ed edema cerebrale.
La sindrome inizia con un malessere generale simile ad una sindrome influenzale, segue un periodo
asintomatico (da pochi giorni fino ad 1 settimana), quindi compare vomito ripetuto e alterazioni del SNC
(ipereccitabilità, quindi letargia fino al coma) con tachicardia e iperpnea.
Gli esami laboratorio evidenziano le alterazioni indotte dal danno epatico acuto: riduzione dei livelli di
fibrinogeno, allungamento di PT e PTT, aumento delle transaminasi (bilirubina normale), iperammonemia,
ipoglicemia, iperazotemia.
Nel 75% dei casi si verifica guarigione mentre nel 25% si ha un coma ingravescente accompagnato
dall’incremento dei livelli di bilirubina, transaminasi e soprattutto ammonio.
La terapia è sintomatica, fondamentale è correggere l’encefalopatia epatica e l’edema cerebrale.
Ascessi epatici
Nei paesi in via di sviluppo gli ascessi epatici sono comuni e causati da infestazioni parassitarie come
amebiasi e echinococcosi.
Nei paesi sviluppati invece gli ascessi sono rari e causati da batteri piogeni che raggiungono il parenchima
epatico per diverse vie:
• Batteriemia
• Diffusione dal tratto biliare (colangite ascendente)
• Diffusione da un focolaio di infezione adiacente
Gli ascessi epatici piogenici possono essere solitari o multipli e di dimensioni variabili.
La diffusione da focolai contigui da origine a ascessi singoli e di grandi dimensioni mentre in caso di
batteriemia in genere si formano ascessi multipli e di piccole dimensioni.
Gli ascessi subcapsulari possono rompersi determinando una peritonite diffusa o saccata mentre gli ascessi
localizzati in regione sottodiaframmatica possono rompersi nella cavità toracica provocando un empiema o
un ascesso polmonare.
Clinicamente si manifesta con febbre, dolore addominale, anoressia, epatomegalia dolente.
Gli esami di laboratorio evidenziano leucocitosi neutrofila e aumento della FA.
Alla TC l’ascesso appare come una massa ipodensa di forma e margini irregolari che non presenta contrast
enhancement.
Nel suo contesto possono evidenziarsi sepimentazioni o contenuto gassoso che determina la comparsa di
livelli idro-aerei.
La terapia consiste nel drenaggio percutaneo sotto guida TC o ecografica.
La terapia antibiotica deve essere possibilmente mirata in base al materiale prelevato dalla lesione.
In caso di terapia empirica va fatta l’associazione ampicillina + aminoglicoside + metronidazolo ev per 1014 giorni seguiti da 4-6 settimane di terapia orale.
Per confermare la risoluzione va fatto un controllo strumentale.
NEOPLASIE EPATICHE
Le neoplasie epatiche possono essere distinte in:
tumori metastatici
http://www.hackmed.org
Tumori primitivi benigni
Iperplasia nodulare focale
Tumori primitivi maligni 80-90%
[email protected]
mesenchimali
epiteliali
Emangioma cavernoso
Adenoma epatocellulare
Adenoma colangiocellulare
mesenchimali
epiteliali
Angiosarcoma
Epatocarcinoma 80%
Colangiocarcinoma 10-20%
53
I carcinomi costituiscono il 90% di tutti i tumori maligni primitivi del fegato.
Il carcinoma epatocellulare costituisce l’80-90% di tutti i carcinomi primitivi mentre il restante 10-20% è
sostanzialmente rappresentato dal colangiocarcinoma.
METASTASI EPATICHE
I tumori metastatici sono molto frequenti in quanto derivano dalla metastatizzazione dei tumori del distretto
splancnico drenati dalla vena porta, appaiono come noduli piccoli e multipli o come un unico nodulo che
hanno una caratteristica discrepanza tra la crescita cellulare e l’angiogenesi per cui presentano una
ombelicatura centrale dovuta ad aree di necrosi (cosa che nel CEC si ha soltanto in presenza di noduli di
grandi dimensioni).
All’ecografia le metastasi assumono un aspetto molto variabile.
Ala TC appaiono come lesioni ipodense disomogenee con contrast enhancement meno marcato rispetto a
quello del parenchima, dovuto alla presenza di necrosi.
La diagnosi differenziale con i noduli di rigenerazione del fegato cirrotico si fa in base al fatto che non c’è
ipertrofia del lobo sinistro e non ci sono segni di ipertensione portale (aumento di diametro dei vasi portali).
L’accuratezza della TC è molto elevata, comunque per la diagnosi di certezza si può ricorrere alla biopsia.
Tumori benigni del fegato
I tumori benigni primitivi del fegato sono piuttosto rari.
ADENOMA EPATOCELLULARE
Sono i tumori benigni di riscontro più frequente nella donna durante il 3° - 4° decennio di vita.
Sono associati probabilmente ad un elevato livello di estrogeni (iperestrogenismo) dovuto all’uso di
contraccettivi orali.
Gli adenomi multipli, invece, sono associati con la glicogenosi di tipo I.
Morfologicamente sono formazioni voluminose, da 2 a 30 cm di diametro, di colore pallido grigiastro e
spesso chiazzati di bile, capsulati e ben demarcati, a localizzazione più frequentemente sottocapsulare,
costituiti da lembi o travate di epatociti normali con elevato contenuto di glicogeno e quindi più chiari.
Caratteristicamente mancano gli spazi portali (perciò è importante per la diagnosi fare una biopsia con ago
più grande che sia in grado di comprendere anche gli spazi portali che risultano presenti nel parenchima
epatico normale ma non nell’adenoma).
L’importanza clinica di queste neoplasie è dovuta a 2 motivi:
9 Quando si presentano come unico nodulo di grandi dimensioni possono essere scambiati per un
carcinoma epatocellulare
9 Gli adenomi sottocapsulari tendono a rompersi soprattutto durante la gravidanza (sotto stimolo
estrogenico) causando emorragie intraperitoneali severe
In genere è presente dolore, epatomegalia dovuta ad una massa palpabile, ma può anche esservi una
emorragia importante intratumorale che provoca anche shock.
La diagnosi è essenzialmente basata sulla TC, sulla RM e arteriografia selettiva.
Un metodo sofisticato per dimostrare l’assenza delle cellule di Kupfler è la scintigrafia con Te99, che indica
una ipocaptazione.
In circa il 10% dei casi possibile la trasformazione maligna, soprattutto negli adenomi grandi o multipli.
Se è una lesione grande, superficiale e resecabile, dovrebbe essere asportata, soprattutto se si pensa di
iniziare una gravidanza che mette la neoformazione a rischio di rottura.
ADENOMA COLANGIOCELLULARE
È un adenoma che deriva dall’epitelio dei dotti biliari.
È in genere un nodulo singolo di colore pallido e dimensioni inferiori al adenoma epatocellulare.
http://www.hackmed.org
[email protected]
54
Diversamente all’adenoma epatocellulare non è quasi mai chiazzato di bile.
La sede è prevalentemente sottocapsulare.
Istologicamente è caratterizzato da proliferazione di canalicoli e dotti biliari e connettivo abbondante.
Può andare incontro a rottura con sanguinamento in peritoneo.
IPERPLASIA NODULARE FOCALE
Si presenta come un nodulo ben demarcato parzialmente capsulato di dimensioni fino ad alcuni cm.
È caratterizzato da un area cicatriziale centrale da cui si dipartono dei setti fibrosi che vanno verso la
periferia (aspetto stellato).
I setti presentano un intenso infiltrato linfocitario ed una proliferazione di dotti biliari lungo i margini.
Il parenchima tra i setti fibrosi è costituito da epatociti normali.
Questa lesione insorge soprattutto in giovani donne tanto che si riteneva che fosse correlata all’uso di
contraccettivi orali, non è correlata a neoplasie maligne.
L’iperplasia nodulare focale è una lesione asintomatica e priva di evolutività clinica, pertanto va
attentamente differenziata dall’adenoma (che va incontro a sanguinamenti spontanei) e dalla variante
fibrolamellare dell’epatocarcinoma.
La diagnosi differenziale viene fatta tramite l’ecografia o la TC.
EMANGIOMA CAVERNOSO
È la più frequente neoplasia benigna del fegato.
Si presenta in genere come un nodulo unico rosso-bluastro e ben delimitato dal parenchima circostante, di
dimensioni non maggiori di 2 cm, in rari casi può raggiungere dimensioni tali da determinare danno da
compressione.
Viene chiamato emangioma cavernoso poichè istologicamente risulta costituito da lacune ematiche rivestite
da cellule endoteliali e separate da setti fibrosi.
La maggior parte dei pazienti è asintomatica, tuttavia si può avere dolore in caso di distensione della capsula
glissoniana per trombosi intramurale o emorragia con emoperitoneo se vi è la rottura di emangiomi
superficiali.
All’ecotomografia la lesione appare iperecogena.
Poichè la lesione non va in contro a degenerazione maligna non sono necessari provvedimenti terapeutici.
La rimozione chirurgica viene effettuata solo in caso di imponente sintomatologia dolorosa.
L’importanza nel riconoscere queste lesioni consiste nel non scambiarle per tumori maligni e nell’astenersi
pertanto dal fare una biopsia percutanea soprattutto se il nodulo è in sede sottocapsulare in quanto questa
potrebbe determinare una emorragia.
È importante inoltre la diagnosi differenziale con l’epatocarcinoma che se di piccole dimensioni può apparire
come un’area iperecogena.
L’eco-doppler non evidenzia segnale nel contesto dell’angioma a causa del flusso molto lento, mentre
nell’epatocarcinoma c’è un elevato flusso.
Alla TC con m.d.c. gli angiomi caratteristicamente vanno incontro ad un precoce contrast enhancement
periferico che si estende quindi verso il centro (andamento centripeto).
La presenza di aree persistentemente ipodense per involuzione fibrotica può creare problemi di diagnosi
differenziale con le metastasi.
In questo caso si può ricorrere alla scintigrafia con eritrociti marcati con Tc99 che evidenzia la natura
vascolare della lesione.
Epatocarcinoma maligno o epatocarcinoma primitivo
È un tumore primitivo maligno del fegato derivato dagli epatociti.
Il carcinoma epatocellulare primitivo è una delle neoplasie più comuni, di solito con eziologia legata alla
cirrosi, e incidenza elevata in Paesi come l’Asia e l’Africa, dove in alcune zone raggiunge i 500 casi per 100
mila abitanti.
In Europa è responsabile dell’1-2% delle neoplasie di riscontro autoptico; alle nostre latitudini il massimo
dell’incidenza si osserva fra i 40 e i 50 anni.
In Italia ci sono 200.000 cirrotici, e circa 14.000 casi di epatocarcinoma ogni anno, che fa un’incidenza di 610 per 105.
M>F (4/8:1)
Età 65-70 anni nelle zone a bassa incidenza mentre nelle zone ad alta incidenza 20-30 anni.
http://www.hackmed.org
[email protected]
55
Il 90% dei casi che insorgono è associato a cirrosi.
In effetti, in ogni momento il 7% dei cirrotici presenta epatocarcinoma (il 5% ogni anno).
Questo è sufficiente a definire la cirrosi come una lesione pre-neoplastica, e a giustificare uno screening
semestrale con ecografia e alfa feto – proteina (AFP).
Eziologia
Rappresentano fattori di rischio per l’insorgenza di epatocarcinoma:
Condizioni che provocano cirrosi: Qualsiasi condizione che provoca un danno epatocellulare cronico e
stimola la mitosi delle cellule epatiche aumenta il rischio di carcinoma, la displasia di frequente riscontro
nella cirrosi può avere un ruolo preneoplastico. Fra queste sono importanti:
• Cirrosi alcolica
• Emocromatosi
• Deficit di α1antitripsina
L’80% dei carcinomi epatocellulari si associa alla presenza di cirrosi.
Infezione associata da HBV e HCV: Il motivo dell’alta incidenza nelle aree di Africa e Asia è legato alla
prevalenza di questi virus, che in molti casi provocano cirrosi.
Il ruolo dell’HBV è stato ampiamente documentato come agente oncogeno puro, e si hanno prove di questo
attraverso il riscontro abituale della presenza di genoma virale nelle cellule tumorali, negli epatociti
circostanti non malati.
L’HBV potrebbe essere coivolto nella cancerogenesi epatica tramite 3 meccanismi:
z Causando cirrosi epatica con conseguenti fenomeni rigenerativi
z Inserendo il proprio DNA nel genoma dell’epatocita e causando mutazione tramite insersione
(mutazione insersionale)
z Sfruttando la proteina virale transattivatrice che può determinare l’attivazione di oncogeni cellulari
(transattivazione trascrizionale)
Sebbene siano numerose le correlazione fra HCV e carcinoma epatico, sfugge ancora il meccanismo
oncogeno di questo virus, che si pensa agisca essenzialmente attraverso la cirrosi e la relativa naturale
progressione di essa a tumore.
L’HCV è un virus ad RNA che non possiede una trascriptasi inversa e pertanto non è in grado di integrarsi
nel genoma dell’epatocita.
I pazienti con epatite C sono ad alto rischio di contrarre epatocarcinoma se sono anche HbsAg positivi come
se vi fosse una sorta di cooperatività tra i 2 virus.
Una importante conseguenza di questo è che il paziente con infezione cronica da HBV è a rischio di
carcinoma anche se non ha la cirrosi.
Carcinogeni chimici e tossine:
• Aflatossina B: tossina di un fungo (Asperigillus Flavus) che infetta in genere le derrate alimentari
non correttamente conservate, tipico di alcune regioni dell’Africa dove queste vengono conservate
nelle buche scavate per terra. Questa tossina sembra capace di interferire con l’espressione della p53.
• Cloruro di vinile
• Amianto
• Alcol: l’etanolo insieme al suo metabolita l’acetaldeide può interagire con il DNA alterandone la
riparazione inoltre agendo sul citocromo p-450 potrebbe alterare il metabolismo di alcuni
cancerogeni chimici
• Anabolizzanti ed estrogeni: i recettori per gli estrogeni sono stati trovati costantemente elevati sia
nel tessuto neoplastico che in quello cirrotico è stato perciò proposto che gli estrogeni potrebbero
agire come fattori crescita analogamente a quanto accade per il carcinoma della mammella, nel
maschio durante la progressione epatite cronica- cirrosi- epatocarcinoma si verifica un aumento di
questi recettori che nella femmina diminuiscono ciò spiegherebbe la predilezione per il sesso
maschile
Macroscopicamente possono essere presenti 3 forme:
• Nodulare: 60 – 70 % caratterizzato da un unico nodulo di dimensioni notevoli, colore biancogiallastro a volte verdastro nelle forme differenziate in cui si verifica produzione di bile (a
differenza del colangiocarcinoma in cui visto che la neoplasia origina dall’epitelio biliare non si
verifica produzione di bile), possono essere presenti aree mollicce di necrosi, il lobo colpito è
incrementato di volume e deformato, vi possono essere noduli satelliti nel parenchima
circostante
http://www.hackmed.org
•
[email protected]
56
Multinodulare: 20 – 30% caratterizzata da noduli multipli di dimensioni variabili, con meno
frequentemente aree necrotico-emorragiche, che determina una modesta epatomegalia con
aspetto simile alla cirrosi
• Diffuso (spreeding) <1%; infiltrazione massiva e destruente del fegato con formazione di
noduli minuti e biancastri, difficile da distinguere dalla cirrosi
Vi sono diversi tipi di architettura istologica:
• Trabecolare che si associa a formazione di bile
• Alveolare-acinare
• Anaplastica o solida con scarsa impalcatura stromale
Esiste poi una gradazione, fatta sul grado di differenziazione cellulare:
G1:
caratterizzato da cellule neoplastiche simili ad epatociti, disposte in trabecole che assomigliano alle filiere
epatocitarie ma più irregolari e grossolane o a formare acini, in genere è presente produzione di bile
(importante che la biopsia venga effettuata nella zona di confine tra il nodulo ed il parenchima normale in
modo che il patologo possa fare il confronto)
G2:
Caratterizzato da cellule più larghe del normale che formano acini con produzione di bile
G3:
caratterizzato da cellule atipiche con nucleo di grandi dimensioni, disposte in trabecole con occasionali
aree solide
G4:
caratterizzato da cellule atipiche con nucleo che occupa quasi tutta la cellula, di aspetto solido
Una forma a piccoli noduli e ben differenziata ha la migliore prognosi, mentre quella diffusa poco
differenziata ha la prognosi peggiore e crescita più rapida.
In circa il 4%dei casi di epatocarcinoma possono coesistere aspetti di CEC e di colangiocarcinoma (tumori
misti).
Il carcinoma epatocellulare possiede un circolo arterioso piuttosto sviluppato, non è irrorato dal circolo
portale ma da rami dell’arteria epatica.
Questa neoplasia ha tuttavia una propensione a crescere nel sistema venoso portale o epatico causando sia
metastasi intraepatiche che polmonari.
Frequente è infatti la trombosi della vena porta e la sindrome di Budd-Chiari per infiltrazione delle vene
sovraepatiche.
La metastatizzazione avviene per:
z Via ematica: polmoni, surrene, osso, meninge, pancreas, encefalo e rene
z Via linfatica: linfonodi dell’ilo epatico, pancreatici, retroaortici e retroperitoneali
z Per contiguità: diaframma, colecisti
Raramente può disseminarsi nel peritoneo.
Clinica
• Dolore addominale
70-90%
• Calo ponderale
35%
• Astenia
30%
• Ittero e vomito
8%
• Emoperitoneo
12%
• Massa addominale (epatomegalia)
43%
Il dolore insorge quando il tumore comprime le vie biliari (e si associa ad ittero) o quando infiltra la capsula
glissoniana che è innervata.
I sintomi peraltro abbondanti possono passare inosservati con una certa facilità perché spesso in questi
pazienti esiste un quadro sottostante di ascite, e quindi si interpreta la sintomatologia come un
peggioramento di essa.
La forma nodulare risulta spesso asintomatica, mentre la forma diffusa è associata ad una sintomatologia più
pronunciata.
NB. Il sospetto che su un fegato già cirrotico sia insorto un epatocarcinoma nasce nel caso in cui questi
pazienti inizino a lamentare dolenzia o dolore all’ipocondrio destro o febbre elevata persistente o ribelle alla
terapia antibiotica o che comunque abbiano un aggravamento altrimenti ingiustificato della condizione
clinica di base.
http://www.hackmed.org
[email protected]
57
L’esame obiettivo evidenzia:
z Epatomegalia spesso dolorabile
z Ittero in genere in fase tardiva
z Ascite da ipertensione portale o da carcinosi peritoneale
z Splenomegalia
NB. La trombosi della vena porta, frequente in corso di epatocarcinoma, può essere causa di splenomegalia
ed ascite o comunque fattore aggravante.
Le complicanze più temibili dell'epatocarcinoma sono l'ittero ostruttivo, l'enterorragia da rottura di varici
esofagee e l'emorragia intraperitoneale da rottura del tumore stesso.
Una percentuale di pazienti può avere anche una sindrome paraneoplastica:
D sindromi da produzione ectopica di ormoni:
• Eritrocitosi
• Ipercalcemia
• Carcinoide
• Osteoartropatia ipertrofica
D Alterazioni metaboliche
• Ipoglicemia
• Ipercolesterolemia
• Porfiria cutanea tarda
D Produzione di proteine carcinofetali
• Alfafetoproteina
• Antigene carcinoembrionario
• Isoferritine
• Disfibrinogenemia
D Produzione di proteine carcinoplacentari o isoenzimi
• Varianti dell’APL
• Varianti della γGT
Diagnosi
Indagini di laboratorio evidenziano le alterazioni tipiche della cirrosi epatica non avendo modifiche
particolari in corso di CEC.
Di notevole importanza invece è la determinazione dell’alfa-fetoproteina prodotta dalla neoplasia in seguito
ad un processo di sdifferenziazione.
L’AFP è una α1-globulina prodotta dal fegato fetale che è presente nel siero soltanto durante la vita fetale.
Valori superiori a 1000 µg/ml sono altamente diagnostici.
La concentrazione di AFP può aumentare anche in corso di patologie in cui si osserva proliferazione
epatocitaria in cui si ha un certo grado di sdifferenziazione (epatite cronica,cirrosi, necrosi epatica massiva)
ma raramente supera i 500 µg/ml.
I pazienti con CEC di piccole dimensioni cadono spesso nel range dubbio.
Il dosaggio dell’AFP è importante sia per la diagnosi che per il follow-up post-terapia.
L’antigene carcinoembrionario non è aumentato ma il suo dosaggio è importante per la diagnosi differenziale
con le neoplasie metastatiche.
Ecografia:
l’indagine di primo approccio per eccellenza, serve a monitorare la progressione della cirrosi e l’eventuale
comparsa di noduli primitivi in soggetti ad alto rischio, in etilisti cronici, in malati di epatite C.
Un HCC primitivo appare come un nodulo rotondeggiante solitamente anisoecogeno (si tenga presente che
non c’è sempre corrispondenza tra ecogenicità e densità rilevata con la TC, nel senso che la > parte dei
noduli sono ipoecogeni e iperdensi).
Ogni neoformazione epatica riscontrata con questo metodo deve essere indagata con tecniche successive.
La sensibilità di questo esame è alta per i noduli di diametro maggiore ai 3 cm, ma comunque con i nuovi
mezzi di contrasto selettivi per il tessuto epatico è possibile discriminare lesioni > 1 cm, anche se
isoecogene.
La lesione si presenta ipoecogena nell’80% dei casi, mentre nel 20% è iperecogena con un nello ipoecogeno
in periferia, perciò è molto importante la diagnosi differenziale con l’emangioma.
La presenza di una struttura iperecogena periferica molto sottile indica la presenza di una capsula limitante
esterna.
http://www.hackmed.org
[email protected]
58
Se poi vi sono vasi sanguigni adesi alla capsula ciò è molto utile per la diagnosi.
La visualizzazione è resa difficoltosa dalle disomogeneità parenchimali del fegato cirrotico e dalla
coesistenza di noduli di rigenerazione o displasici che possono presentare identiche caratteristiche
ecostrutturali.
L’eco-Doppler consente di evidenziare flusso ad alta velocità all’interno delle lesioni ed anche la eventuale
presenza di trombosi dei vasi portali o delle vene sovraepatiche.
TC spirale con m.d.c.
Vanno fatte scansioni dinamiche nello stesso piano in tempi ravvicinati per vedere la distribuzione del
m.d.c.: in fase arteriosa il contrast enhancement è rapido, intenso e disomogeneo.
N.B. l’epatocarcinoma ha una vascolarizzazione prevalentemente arteriosa perciò prende più contrasto in
fase arteriosa, in fase venosa invece prende contrasto solo la pseudocapsula e il parenchima circostante (la
cui vascolarizzazione deriva principalmente dalla vena porta).
RM
Spesso è usata al posto dell’ecografia per la sua maggiore sensibilità, ma ha un costo più elevato ed è più
complessa da utilizzare.
Arteriografia dell’arteria epatica:
Anche questa viene usata per la diagnosi differenziale con gli angiomi, fornisce informazioni sulla
vascolarizzazione della neoplasia e sull’anatomia dell’arteria epatica, la cui conoscenza è fondamentale in
caso di intervento chirurgico o di chemioembolizzazione.
Scintigrafia con tecnezio99:
Permette l’individuazione delle cellule di Kupfler dentro la massa tumorale, che hanno una attiva captazione
del mezzo di contrasto, permettendo così la differenziazione con il colangiocarcinoma.
Biopsia
Risolutiva nei confronti di una lesione identificata mediante le tecniche di imaging è la biopsia epatica
percutanea, oppure in via laparoscopica.
La biopsia si esegue sotto guida ecografica, per via percutanea transpleurica con ago di Menghini modificato.
La procedura comporta una mortalità irrisoria (<0,1%) ma è da evitare in molti pazienti con cirrosi o
comunque insufficienza epatica a causa della piastrinopenia e della coagulopatia sottostante.
Altra complicazione può essere lo spreading, cioè la diffusione iatrogena delle cellule neoplastiche nel cavo
peritoneale e pleurico, che può pregiudicare la guarigione da malattia qualora venga eseguito un trapianto.
La sensibilità della biopsia è dell’86%, limitata soltanto dall’eventualità di mancare il nodulo con l’ago,
mentre la specificità è del 100% (nessun FP se il patologo è capace).
Diagnosi differenziale
Le lesioni metastatiche sono in genere multiple e non si associano ad elevati livelli di AFP.
L’emangioma benigno produce una piccola lesione iperecogena che è difficile da distinguere dal piccolo
carcinoma iperecogeno.
L’eco-doppler non evidenzia segnale nel contesto dell’angioma a causa del flusso molto lento, mentre
nell’epatocarcinoma c’è un elevato flusso.
Alla TC con m.d.c. gli angiomi caratteristicamente vanno incontro ad un precoce contrast enhancement
periferico che si estende quindi verso il centro (andamento centripeto).
Inoltre l’emangioma non tende ad aumentare di dimensioni.
La prognosi è legata a diversi fattori, detti anche fattori prognostici di Emphill; essi sono:
• Stadio e presenza dell’EPS
• Bilirubina
• Diametro della neoplasia
• Ascite
• αFP
• Aspetti macroscopici
• Stato della capsula
• Stato della cirrosi
Dal punto di vista prognostico sono fattori favorevoli la presenza di un nodulo unico, la dimensione limitata
(< 2 cm) e la presenza di una capsula fibrosa.
Sulla base di questi ed altri dati, esiste una classificazione dei casi di epatocarcinoma mirata ad indicare quali
sono quei pazienti sui quali si può intervenire chirurgicamente, e quelli che invece necessitano di altre cure,
efficaci o palliative.
http://www.hackmed.org
[email protected]
59
Questo tipo di stadiazione è conosciuta come “Child”
Clinical staging of cirrhosis:
Table: Grading system for cirrhosis: the Child-Pugh score
Bilirubin
Albumin
Hepatic
Score
PT (Sec)
(mg/dl)
(gm/dl)
encephal
Ascites
(grade)
1
<2
> 3.5
1-4
None
None
2
2-3
2.8 - 3.5
4-6
1-2
Mild
3
>3
< 2.8
>6
3-4
Severe
Child class: A: 5 - 6, B: 7 - 9, C: > 9.
Il child inoltre si basa anche sull’aspetto morfologico: crescita infiltrativa o espansiva, presenza o meno di
capsula, tipo istologico ecc.
I pazienti che appartengono alle classe A sono ben compensati ed operabili, mentre i pazienti che
appartengono alla classe C sono scompensati e pertanto non operabili.
I pazienti che appartengono alla classe B hanno caratteristiche intermedie.
Terapia
Quando la malattia è scoperta per le sue manifestazioni cliniche in genere siamo davanti ad un quadro
troppo avanzato perché sia possibile un intervento efficace, e la sopravvivenza media è bassa, sotto 1-2 anni.
In genere però il paziente non trattato muore entro 3-6 mesi dall’evidenza clinica di neoplasia.
I soggetti in cui può essere effettuata una diagnosi precoce con lo screening spesso possono essere trattati
con migliore efficacia.
La terapia chirurgica resta attualmente l’unico intervento in grado di dare realmente la possibilità di
risoluzione.
Terapia chirurgica:
Si può fare un intervento del genere in una limitata serie di circostanze.
Il paziente deve avere una neoplasia di dimensioni non superiori a 5 cm, superficiale, facilmente
raggiungibile per via laparoscopica.
In circostanze come il quadro di una cirrosi, diventa difficile avere casi di persone in grado di sopportare un
intervento chirurgico, per diversi motivi: la massa epatica da asportare può scompensare l’insufficienza, il
quadro emo-coagulativo può essere eccessivamente alterato, i farmaci anestetici possono dare reazioni
anormali a causa della diminuita biotraformazione.
Purtroppo, nonostante esistano esami di screening per la popolazione a rischio, quali l'ecotomografia e lo
studio di marcatori tumorali (AFP) e degli indici di funzionalità epatica, ancora frequentemente vengono
diagnosticati HCC non suscettibili di trattamento radicale (resezione o trapianto epatico).
La scarsa operabilità degli HCC è dovuta a diversi fattori, tra cui le dimensioni del tumore, la sua sede, le sue
caratteristiche isto-patologiche, la gravità della cirrosi e quindi la scarsa riserva funzionale epatica, l'età
avanzata del paziente, le condizioni fisiche scadenti.
TACE:
Tra le opzioni terapeutiche acquista, quindi, un ruolo significativo la chemioembolizzazione (transarterial
chemoembolization, TACE).
Partendo dal presupposto che i nodi di HCC sono spesso ipervascolarizzati e che la loro vascolarizzazione è
per più dell'80% di origine arteriosa, a differenza del restante parenchima epatico che riceve il sangue
prevalentemente dal sistema portale, questa metodica consente la somministrazione loco-regionale di farmaci
chemioterapici e di procedere all'occlusione dei vasi arteriosi afferenti alla lesione, riducendo al minimo i
danni al parenchima circostante.
Il ramo dell’arteria epatica che vascolarizza il tumore viene embolizzato tramite l’iniezione di particelle di
lipidol contenenti agenti chemioterapici.
Alcolizzazione per via percutanea (PEA):
Si tratta di un processo di iniezione di piccole quantità di alcool con una cannula intraperitoneale, nel luogo
della lesione neoplastica sotto guida ecografica.
L’alcool etilico al 100% provoca la necrosi del tessuto tumorale.
E’ un protocollo di minor efficacia rispetto alla chemioembolizzazione, e che ha il rischio di sgocciolamento
del liquido nel peritoneo, con peritonite chimica.
http://www.hackmed.org
[email protected]
60
Inoltre è scarsamente applicabile nei tumori provvisti di capsula perché l’etanolo tende a diffondere
eccessivamente dal sito di inoculo e a causare una perdita eccessiva di parenchima epatico.
In questi casi, se proprio non esistono altre opzioni è opportuno fare più somministrazioni frazionate.
Questa metodica ha il vantaggio di essere pratica, estremamente economica.
Le lesioni voluminose o multiple possono essere trattate in seduta singola con grossi volumi di alcol in
anestesia generale.
Il trattamento di lesioni di piccole dimensioni non richiede ne sedazione ne ospedalizzazione.
Le complicanze sono rappresentate da dolore in sede di iniezione e talvolta febbre.
RITA:
La irradiazione della lesione mediante un ago con diverse espansioni che trasmette microonde ad alta
frequenza è un altro protocollo sperimentale (radiofrequenza).
Il trattamento è eseguito per via percutanea su guida ecografica.
Il meccanismo d’azione terapeutico risiede nell’ipertermia (la testina dello strumento sviluppa fino a 110°C)
che causa necrosi coagulativa come l’etanolo ma in maniera più controllabile.
Vantaggi rispetto all’alcolizzazione: meno complicanze; svantaggi: metodica + complicata e costosa,
necessita di anestesia locale o profonda se il tumore è abbastanza vicino alla glissoniana.
Altre procedure percutanee ablative sono: fotocoagulazione laser, ablazione con microonde, ablazione con
ultrasuoni.
Immunoterapia con Ab monoclonali coniugati con sostanze tossiche
Terapia ormonale con tamoxifene in caso di positività per i recettori degli estrogeni, può prolungare
significativamente la sopravvivenza ed il tempo di raddoppiamento della massa tumorale nei pazienti con
CEC non resecabile.
Questo effetto è più pronunciato nel sesso femminile.
Trapianto potrebbe essere una valida alternativa, soprattutto in caso di CEC che si instaura in un fegato
cirrotico (il tessuto cirrotico non resecato potrebbe essere sede di metastasi e inoltre di per se rappresenta una
condizione precancerosa) ma la frequenza di recidive e la presenza di metastasi a distanza ne hanno
scoraggiato l’applicazione.
Altri tumori maligni
•
•
•
Carcinoma fibrolamellare: si differenzia da quello classico per l’assenza della cirrosi sottostante e per
il fatto che colpisce soggetti giovani. Non è capsulato, ma è delimitato da una serie di setti fibrosi che lo
circoscrivono bene. In effetti ha una scarsa tendenza alla progressione, e la sopravvivenza è migliore, sia
associata alla terapia chirurgica che al trapianto di fegato (anche perché si tratta più spesso di soggetti
giovani). È importante la diagnosi differenziale con l’iperplasia nodulare focale.
Epatoblastoma: tumore dell’infanzia caratterizzato da livelli molto alti di aFP, con lesioni monofocali
di dimensioni di 4-15 cm e prognosi abbastanza favorevole
Emangioma epitelioide: lesione benigna, ma che può dare metastasi
MALATTIE DELLA COLECISTI E DELLE VIE BILIARI
La bile epatica è un liquido isotonico pigmentato con composizione simile a quella del plasma, mentre quella
colecistica è più povera di anioni organici, cloro e bicarbonato, che vengono riassorbiti a livello della
membrana basale della colecisti.
Componenti della bile:
• acqua (82%)
• acidi biliari (12%)
• lecitina e altri lisofosfolipidi (4%)
• colesterolo non esterificato (0.7%)
• bilirubina coniugata
• IgA, cataboliti ormonali, farmaci metabolizzati, muco ed elettroliti.
La secrezione giornaliera di bile ammonta a 500 – 600 ml.
I principali meccanismi che regolano il flusso biliare sono:
1. trasporto attivo di acidi biliari dagli epatociti ai canalicoli biliari
2. trasporto di Na da parte di un’ATPasi dipendente dagli acidi biliari
3. secrezione duttulare (processo secretina – dipendente cAMP mediato che risulta dal trasporto attivo
di Na e bicarbonati seguito dal flusso passivo di acqua)
http://www.hackmed.org
[email protected]
61
gli acidi biliari si dividono in primari (colico e chenodesossicolico) e secondari (desossicolico e litocolico).
I primi sono sintetizzati a partire dal colesterolo e coniugati con glicina o taurina, i secondi derivano dalla
trasformazione dei primi da parte dei batteri del colon.
La sintesi degli acidi biliari è regolata tramite un feedback-negativo che gli acidi biliari secondari esercitano
sulla sintesi dei precursori tramite l’inibizione della 7alfaidrossilasi.
Inoltre l’acido chenodeossicolico e in piccola parte anche l’acido colico svolgono un effetto inibitore sulla
HMG-CoA reduttasi che regola la sintesi di colesterolo.
Altri acidi biliari atipici o aberranti come l’UDCA o acido ursodeossicolico, oppure acidi coniugati solforici
e/o glucuronici sono prodotti in quantità apprezzabile nei pazienti con sindromi colestatiche croniche.
In condizioni normali gli acidi biliari vengono riassorbiti efficientemente (a parte l’acido litocolico) per il
95% tramite diffusione passiva lungo l’intestino ma soprattutto per trasporto attivo a livello dell’ileo distale
tramite il cosiddetto circolo entero-epatico.
Il pool normale di acidi biliari è 2 – 4 g: durante un pasto entrano nel circolo almeno una volta e nell’arco del
giorno almeno 5 – 10 volte.
L’efficienza del riassorbimento intestinale è del 95% Î perdite fecali: 0,3 – 0,6 g/die compensata da una
pari sintesi epatica che può arrivare fino a un max di 5g/die.
A digiuno lo sfintere di Oddi mantiene una contrazione tonica che serve a:
• prevenire il reflusso del contenuto duodenale nel coledoco e nel dotto di Wirsung
• favorire il riempimento della colecisti con la bile
Lo svuotamento della colecisti è stimolato dalla CCK, rilasciata dal duodeno in risposta a grassi e
amminoacidi.
La CCK determina:
1. contrazione della colecisti
2. riduzione della resistenza dello sfintere di Oddi
3. aumento secrezione epatica di bile
4. aumento del flusso biliare nel duodeno
Durante la notte quasi tutto il pool organico di bile può essere sequestrato nella colecisti la cui capacità
ammonta a 30 – 75 ml.
ITTERO
Per ittero si intende la colorazione giallastra della cute e delle mucose per aumento nel sangue della
bilirubina (iperbilirubinemia).
Quando la colorazione giallastra è limitata alle sclere e ad altre mucose visibili (bilirubinemia < 2.5 mg/dl)
su parla di subittero, quando la bilirubina raggiunge valori > 2.5 mg/dl si parla di ittero franco.
Nel neonato sono necessari livelli di bilirubina > 5 mg/dl perché l’ittero divenga apprezzabile, visto che il
colore normale del neonato è eritrosico e può mascherare la tinta gialla dell’ittero.
Quando all’incremento dei pigmenti biliari si associa anche l’aumento dei sali biliari (colalemia) si parla di
ittero colestasico che si realizza in tutte quelle condizioni in cui vi è un ostacolo al deflusso di bile.
Gli itteri vengono classificati in base al tipo di bilirubina aumentata e al meccanismo patogenetico.
Il tipo di bilirubina circolante è importante dal punto di vista della patogenesi delle manifestazioni cliniche in
quanto la bilirubina indiretta a causa della sua lipofilia attraversa la BEE e interagisce con le componenti
lipidiche tessutali determinando la comparsa di sintomi neurologici (ittero nucleare).
La bilirubina deriva per l’80% dal catabolismo dell’eme e per il 20% dall’eritropiesi inefficace e dal
catabolismo epatico delle proteine contenenti eme (mioglobina, enzimi).
A livello del sistema RE l’eme viene trasformato in bilirubina che viene veicolata dall’albumina fino al
fegato.
Il complesso bilirubina-albumina (bilirubina indiretta o non coniugata) non viene filtrata a livello renale e
pertanto non può dar luogo a bilirubinuria.
A livello epatico la bilirubina viene captata e coniugata dall’enzima glucuronil transferasi che vi lega 2
molecole di acido glucuronico formando la bilirubina diglucuronide o diretta o coniugata che viene
escreta con la bile.
A livello dell’intestino la bilirubina diretta viene deconiugata dai batteri e trasformata in bilinogeni che in
gran parte vengono eliminati con le feci (stercobilinogeno) e in piccola parte vengono recuperati tramite il
circolo enteroepatico e passano nel plasma da cui vengono eliminati attraverso le urine (urobilinogeno).
http://www.hackmed.org
[email protected]
62
Normalmente nel sangue è presente esclusivamente bilirubina indiretta (0.2-0.8 mg/dl) ed eventualmente
bilirubina diretta in tracce (0-0.2 mg/dl).
ITTERI DA BILIRUBINA NON CONIUGATA O INDIRETTA
Itteri da aumentata produzione di bilirubina
ittero emolitico da anemie emolitiche (nel neonato si possono manifestare il 1-2° giorno, la
più frequente è la MEN)
eritropoiesi inefficace che si associa ad aumentata distruzione dei progenitori midollari
eritroidi
farmaci che spiazzano la bilirubina dal legame con l’albunina (sulfamidici, salicilati,
eparina, vitamina K, alcuni antibiotici)
cause infettive: sepsi ed infezioni renali (sindrome uremico-emolitica)
emorragie interne o raccolte ematiche extravascolari (nel neonato cefaloematoma, ematomi
cerebrali)
nel neonato: policitemia (trasfusione feto-fetale nei gemelli monocoriali, feto-placentare in
caso di ritardo nella recisione del funicolo ombelicale)
itteri da ridotta captazione/coniugazione della bilirubina
sindrome di Gilbert
ittero da farmaci: alcuni farmaci come la rifampicina limita la captazione epatica, altri
inibiscono la glucuronil-transferasi (cloramfenicolo, derivati delle fenotiazine, vitamina K)
sepsi
ittero fisiologico del neonato
sindrome di Crigler-Najjar malattia ereditaria caratterizzata dalla perdita parziale o totale
dell’attività glucuroniltransferasica
ittero da latte materno
ittero transitorio familiare (alla nascita)
ipotiroidismo (alla nascita, può prolungarsi fino a 2 mesi, importante per la diagnosi)
galattosemia per deficit di glucosio che è il substrato per la formazione dell’acido
glucuronico
epatopatie
Nel neonato sono importanti anche gli itteri da ostruzione intestinale o riduzione della peristalsi che
determinano stasi intestinale con eccessiva deconiugazione e aumento del riassorbimento di bilirubina
indiretta.
In corso di incrementata emolisi extraepatica si verifica un incremento di produzione di bilirubina diretta che
determina un incremento di urobilinogeno nelle urine e di stercobilinogeno nelle feci.
Inoltre se la produzione di bilirubina indiretta supera le capacità di captazione e di escrezione del fegato si
verifica iperbilirubinemia che è prevalentemente di tipo indiretto e non si associa a bilirubinuria in quanto la
bilirubina indiretta non è in grado di attraversare il filtro renale.
ITTERI DA BILIRUBINA CONIUGATA O DIRETTA
• sindrome di Dubin-Johnson che dipende da un difetto congenito di trasporto della bilirubina coniugata
dall’epatocita al canalicolo biliare
• sindrome di Rotor che dipende da un deficit di immagazzinamento della bilirubina all’interno
dell’epatocita la quale tende a refluire nel sangue
• deficit di α1-antitripsina
• fibrosi cistica per ispessimento della bile
• malattie metaboliche (galattosemia, tirosinemia, intolleranza al fruttosio)
• farmaci steroidi, progestinici, estrogeni, fenotiazine
• sepsi
• infezioni epatiche: epatite virale, rosolia, infezione da CMV, HSV, toxoplasmosi, sifilide, varicella
• itteri in corso di malattia epatica in genere si associano all’aumento di bilirubina sia coniugata che non
coniugata
• malformazioni: atresia delle vie biliari extraepatiche, ipoplasia duttulare intraepatica
• ostruzione biliare extraepatica: ittero ostruttivo o colestasico
Gli itteri in corso di sepsi sono più frequentemente a bilirubina mista o diretta per danno all’epatocita o
deficit di escrezione.
http://www.hackmed.org
[email protected]
63
Gli itteri a bilirubina diretta, al contrario di quelli con bilirubina indiretta, si associano a bilirubinuria (urine
ipercromiche) e riduzione di stercobilinogeno nelle feci (feci ipocoliche).
Diagnosi
La diagnosi di ittero è clinicamente facile e si fa con la semplice semeiotica.
Invece quello che è importante è la diagnosi differenziale fra le differenti condizioni e tipi di ittero che si
possono avere.
Questo si può fare all’ispezione soltanto in caso di ittero molto intenso, in quanto:
• Nell’ittero diretto si verifica una ritenzione di sali biliari con prurito e accumulo di bilirubina
coniugata con colorazione verdastra della cute
• Nell’ittero indiretto si ha una colorazione rossastra della cute
A parte che queste differenze di colore vengono fuori solo per valori molto alti di bilirubinemia, non sempre
è valida l’associazione ittero diretto = ittero ostruttivo, e quindi è necessaria una diagnostica clinica e
strumentale più approfondita.
Alcune condizioni cliniche come la cirrosi o l’epatopatia grave che si accompagnano ad ittero possono
invece essere già di per se diagnostiche anche nei confronti dell’alterazione che conduce all’ittero, che
scompare trattando e compensando la malattia stessa.
Non è però possibile escludere matematicamente che un cirrotico abbia un calcolo.
Particolare importanza hanno gli indici di stasi:
• Bilirubina diretta (ma anche indiretta nelle fasi avanzate), γGT, ALP indicano comunemente un
quadro aspecifico di ostruzione al flusso della bile nel duodeno (la fosfatasi alcalina e la γ-GT sono indici di
colestasi molto più precoci dell’aumento della bilirubina)
Se oltre a questi esistono:
o Segni infiammatori (VES, proteina C, α2 globuline, leucociti) Æ patologia infiammatoria biliare
o Markers neoplastici (CA 19.9, GICA, αFP) Æ Neoplasia pancreatica o delle vie biliari
o Segni di malnutrizione Æ neoplasia
• Bilirubina indiretta, segni di emolisi (anemia, tachicardia, dispnea, febbre, dolori crampiformi
addominali, sideremia elevata) Æ anemia emolitica acuta
• Bilirubina indiretta, segni di elevata eritropoiesi (reticolocitosi marcata) Æ anemia emolitica
cronica
In epoca neonatale sono più frequenti gli itteri a bilirubina indiretta, i quali sono anche i più pericolosi per il
rischio di ittero nucleare.
Inoltre è necessaria la diagnosi differenziale con l’ittero fisiologico del neonato che si basa su diversi
parametri:
comparsa nelle prime 24 ore
incremento dei livelli di bilirubina > 5 mg/dl/die
bilirubinemia indiretta > 12 mg/dl nel nato a termine, > 15 mg/dl nel prematuro
persistenza oltre 1 settimana
associazione di condizioni morbose che aggravano il rischio potenziale
ITTERO FISIOLOGICO DEL NEONATO
È un ittero a bilirubina indiretta di entità lieve o moderata che compare nel 50% dei neonati a termine e
nell’80% dei prematuri.
Compare il 2-3° giorno e scompare verso il 4-5° giorno nel neonato a termine ed il 7-10° giorno nel
prematuro (ittero fisiologico protratto).
Il valore massimo di bilirubina è di 10-12 mg/dl nel neonato a termine e 12-15 mg/dl nel prematuro.
Il valore della bilirubina diretta è di 1-2 mg/dl.
Durante la vita intrauterina l’escrezione della bilirubina avviene tramite il fegato della madre poiché la
bilirubina indiretta circolante può passare il filtro placentare.
Questo avviene perché gli enzimi epatici sono immaturi e non hanno acquistato la capacità di
coniugazione.
Alla nascita però la bilirubina indiretta si riversa tutta nel fegato del neonato che non riesce a smaltire il
carico.
La bilirubina indiretta quindi si riversa in circolo determinando l’ittero.
Oltre all’immaturità della glucuronil-transferasi ci sono altri fattori che contribuiscono alla genesi dell’ittero:
la poliglobulia fetale e la sterilità dell’intestino del neonato.
La poliglobulia deriva dal fatto che il neonato in utero si trova in uno stato di relativa ipossia.
http://www.hackmed.org
[email protected]
64
Alla nascita con la respirazione polmonare aumenta il tasso ematico di O2 e la poliglobulia diventa inutile: si
verifica quindi una maggiore emolisi favorita anche dalla minore emivita delle emazie fetali (80 giorni
contro i 120 dell’adulto).
Poiché l’intestino del neonato è sterile la quota di bilirubina riversata nel duodeno non viene trasformata in
stercobilinogeno ed urobilinogeno e quindi la sua eliminazione fecale è scarsa mentre è maggiore il
riassorbimento tramite il circolo entroepatico con maggiore carico per il fegato.
Il digiuno o lo scarso apporto alimentare nei primi giorni di vita accentuano questo fenomeno.
Nel prematuro l’immaturità epatica ha un peso ancora maggiore per cui l’ittero e più intenso e protratto e il
valore della bilirubina può superare i 15 mg/dl valore soglia di neurotossicità (non è più un ittero
fisiologico!).
In questo caso infatti essendo la bilirubina indiretta liposolubile è in grado di superare la BEE accumulandosi
nei nuclei della base (ittero nucleare).
Fattori favorenti l’ittero nucleare nel prematuro sono:
¾ Immaturità del SNC con maggiore fragilità delle strutture nervose e maggiore permeabilità della
BEE
¾ Acidosi dovuta al fatto che l’immaturo non mangia subito alla nascita e consuma i grassi di riserva,
ne consegue un aumento dei NEFA nel sangue che competono con la bilirubina nel legame
all’albumina con aumento della quota libera di bilirubina che è quella neurotossica
N.B. oltre ai NEFA anche i sulfamidici, i salicilati, l’eparina, la vitamina K, alcuni antibiotici sono in grado
di spiazzare la bilirubina dal legame con l’albumina e vanno quindi evitati.
La sintomatologia dell’ittero nucleare è caratterizzata da :
Ipotonia
Indebolimento del riflesso di Moro e della suzione
Successivamente compare spasticità, opistotono e convulsioni tonico-cloniche.
La mortalità è elevata.
I neonati che sopravvivono presenteranno in seguito reliquati neurologici (coreo-atetosi, deficit mentale, di
linguaggio, uditivo, dei movimenti oculari, crisi convulsive).
L’ittero fisiologico del neonato a termina non richiede terapia.
L’ittero del prematuro, se il tasso di bilirubina fa temere un ittero nucleare, deve essere trattato con la
fototerapia che consiste nell’esporre il bambino nudo e con gli occhi bendati alla luce di una lampada ad
adeguata frequenza che rompe l’anello tetrapirrolico della bilirubina e forma dei composti dipirrolici
insolubili che possono essere escreti con le urine e con le feci.
Quando presente l’acidosi va trattata con soluzione glucosata al 5-10% ev.
Ittero da latte materno
Sarebbe dovuto alla presenza di uno steroide il 3-α-20-β-pregnandiolo in grado di inibire la glucuronidasi o
ad un eccesso di NEFA che competono con i recettori per la captazione della bilirubina e inibiscono la
glucuronazione.
L’inizio in genere è intorno al 6-7° giorno si attenua e scompare se viene sospeso l’allattamento materno.
Se l’allattamento viene ripreso dopo 1-2 giorni può non ricomparire per la maturazione della glucuronasi
epatica.
Non provoca impedimento all’allattamento materno.
Ittero transitorio familiare
Ittero grave e precoce causato da una sostanza presente nel siero fetale e materno probabilmente il 3-α-20-βpregnandiolo.
È una condizione transitoria che però può determinare enccefalopatia.
Sindrome di Gilbert
È una forma tardiva autosomica recessiva che si osserva intorno ai 10 anni, associata ad alterazione dei
meccanismi di captazione e trasporto della bilirubina.
È caratterizzata da un ittero cronico di lieve entità e fluttuante.
La bilirubina indiretta si aggira intorno ai 2 mg/dl.
L’ittero è accompagnato da malessere, letargia e modesti dolori addominali.
L’affaticamento, le infezioni, il digiuno esacerbano l’ittero.
Non necessita terapia.
Sindrome di Crigler-Nayar
Vi sono 2 tipi:
http://www.hackmed.org
[email protected]
65
Tipo I autosomico recessivo allo stato omozigote con completa assenza di glucuronil-transferasi,
l’ittero è precoce e può determinare complicanze neurologiche, non vi è risposta ai barbiturici
Tipo II autosomico dominante, vi è una ridotta attività della glucuronil-transferasi con ittero di
entità variabile con complicanze neurologiche rare e risposta ai barbiturici, la diagnosi è confermata
dalla presenza di iperbilirubinuria in almeno uno dei 2 genitori
ITTERO POSTOPERATORIO
Dopo un intervento di chirurgia addominale può comparire un ittero a carattere precoce o tardivo a seconda
delle condizioni che intervengono.
In genere si distinguono due classi di eventi, precoce e tardiva appunto:
• Ittero precoce: si manifesta dopo 24-48 ore e può essere:
o Diretto:
Ostruzione iatrogena delle vie biliari
Calcolosi residua
Pancreatite della testa per reazione postoperatoria
o Misto: legato alla sofferenza epatocellulare
Anestetici
Insufficienza epatica
Legatura dell’arteria epatica
o Indiretto
Trasfusioni multiple (con aumento dell’emocateresi)
Riassorbimento delle raccolte ematiche
• Ittero tardivo: si ha dopo mesi o addirittura anni, ed è per lo più secondario a stenosi cicatriziale delle
vie biliari oppure a calcolosi residua, e quindi è in genere diretto
Iter diagnostico
La radiologia tradizionale ha un ruolo marginale.
L’ecografia può mettere in rilievo una dilatazione delle vie biliari dimostrativa di un ittero colestasico da
ostruzione delle vie biliari.
L’accuratezza diagnostica e la sensibilità dell’ecografia nello studio delle vie biliari è del 92% circa.
L’ecografia da anche una indicazione del livello a cui è presente l’ostruzione e di quale è la causa.
La dilatazione del coledoco aumenta già 4 ore circa dopo la comparsa dell’ostruzione a valle, la dilatazione
delle vie biliari intraepatiche invece è molto più lenta ed è centrifuga rispetto al dotto epatico comune, spesso
asimmetrica (maggiore e più precoce nel lobo sinistro del fegato).
Nelle ostruzioni croniche del coledoco (carcinoma della testa del pancreas, stenosi iatrogene e flogistiche), ci
può essere una marcata dilatazione delle vie biliari intraepatiche ed extraepatiche con bilirubina pressochè
normale ma con marcata alterazione di FA e γ-GT.
Nelle ostruzioni neoplastiche con l’ecografia si possono avere indicazioni aggiuntive su fegato, linfonodi,
milza e vasi addominali.
Ci sono situazioni in cui pur essendo presente ostruzione delle vie biliari non si osserva la loro dilatazione:
ostruzioni troppo recenti, coledolitiasi quando l’ostruzione è incompleta e nella colangite sclerosante.
Se la sede dell’ostruzione è a livello del coledoco terminale questa è difficilmente visibile ecograficamente
a causa del meteorismo.
L’ecografia è poco accurata nella diagnosi della natura dell’ostacolo.
La colangiografia endovenosa non può essere utilizzata nella maggior parte dei casi perché l’esame può
essere effettuato soltanto se la bilirubinemia è < 3 mg/dl.
L’unica utilità è nello studio della calcolosi distale del coledoco (di solito dopo pregresso intervento di
colecistectomia) con ecografia negativa, quadro clinico di colica biliare, aumento di FA e γ-GT.
L’ERCP è importante per la possibilità di visualizzare il coledoco terminale, di avere visione diretta della
papilla, di effettuare contemporaneamente una pancreatografia, biopsia, citologia per aspirazione o brushing
della papilla o sulla bile aspirata.
L’ERCP consente inoltre l’aspirazione dei calcoli contenuti nella via biliare principale.
La PTC consiste nell’opacizzazione della via biliare per via percutanea transepatica tramite puntura con ago
molto sottile (0.6 mm di diametro) di un dotto biliare periferico dilatato attraverso la cute dell’ipocondrio di
destra.
Per essere eseguibile necessita della presenza di dilatazione delle via biliare, è quindi necessario attendere
15-20 giorni.
La TC spirale consente una analisi contemporanea del parenchima epatico, della colecisti e delle vie biliari.
http://www.hackmed.org
[email protected]
66
I limiti in particolar modo sul coledoco sono: scansione necessariamente trasversale (al contrario
dell’ecografia che consente tagli corporei multiplanari) che frammenta il decorso del coledoco (che può
essere seguito in modo continuo con l’ecografia).
La TC non è limitata come l’ecografia da aria, adipe e esiti cicatriziali, nello studio della porzione più
importante del colecodo che quello intrapancreatico o retroduodenale.
Per questo motivo la TC è in grado di evidenziare la sede e la natura dell’ostruzione rispettivamente
nell’85% e 75% dei casi dimostrando così una accuratezza diagnostica notevolmente superiore a quella
dell’ecografia.
La TC inoltre consente una accurata stadiazione che comprende fegato, pancreas, milza, vasi mesenterici,
polmoni etc.
La RM presenta un ottima panoramicità (immagini multiplanari) ed una risoluzione di contrasto superiore
alla TC.
La RM non utilizza radiazioni ionizzanti ne m.d.c. iodati (ma m.d.c. paramagnetici).
Si possono studiare le vie biliari tramite particolari programmi a sequenze soprattutto nelle scansioni
coronari (colangio-RM).
La caratterizzazione dal punto di vista istologico della lesione va fatta quando necessario con biopsia con
ago sottile eco-guidata o TC-guidata.
ittero
Dotti biliari
non dilatati
ecografia
Dotti biliari
dilatati
Causa non dimostrata
TC spirale
Massa pancreatica
Flow-chart per massa
pancreatica
calcolosi
ERCP o PTC
Diagnosticaterapeutica
Assenza di massa
pancreatica
Colangio-RM
Positivo per massa
pancreatica
Positivo per
patologia biliare
negativo
PTC o ERCP o
biopsia epatica
Diagnosi differenziale
Ittero da coledocoliatiasi:
più frequente nelle donne
ittero preceduto da colica
feci ipocoliche
segno di Courvoisier raramente positivo
rapido deperimento generale con calo ponderale
la bilirubina non va oltre 15
http://www.hackmed.org
[email protected]
67
Carcinoma della colecisti:
diagnosi è strumentale o intraoperatoria
Sindrome di Mirizzi:
all’anamenesi vi sono presegressi episodi colecistici e la bilirubina non si elevata eccessivamente
la diagnosi è strumentale o intraoperatoria
Stenosi benigne:
colangiografia
Colestasi
Indica una condizione di ostruzione al flusso biliare a qualsiasi livello delle vie biliari intra ed extra
epatiche che determina un reflusso di componenti della bile nel sangue circolante.
Colestasi da ostruzione biliare extraepatica
È determinato da un qualsiasi ostacolo al deflusso biliare nel dotto epatico comune o nel coledoco.
• Calcolo nel dotto cistico non produce colestasi a meno che non è situato nella giunzione coledococistica, i calcoli nel dotto epatico sono rari mentre sono più frequenti quelli nel coledoco (calcoli della
colecisti o del cistico possono determinare colestasi in caso di sindrome di Mirizzi)
• Tumori: carcinoma della papilla di Vater e carcinomi o papillomi del coledoco o carcinomi della
colecisti con infiltrazione delle via biliari
• Stenosi benigne dei dotti biliari che sono per lo più iatrogene per interventi sulle vie biliari o posttraumatiche
• Compressione estrinseca della via biliare linfoadenomegalia del piccolo epiploon, ulcera duodenale,
diverticolo duodenale periampollare
• Malattie pancreatiche: carcinoma del pancreas, pancreatiti acute e croniche e pseudocisti pancreatiche
con compressione del coledoco
• Atresia delle vie biliari extraepatiche
Colestasi da ostruzione biliare intraepatica
Può essere determinata dalla stenosi delle vie biliari a causa di un tumore o di altri processi occupanti spazio
• Cirrosi biliare primitiva
• Colangite sclerosante primitiva
• Atresia congenita delle vie biliari
La colestasi di natura ostruttiva viene definita anche ittero ostruttivo.
Colestasi intraepatica senza ostruzione biliare dimostrabile
• Colestasi da farmaci: alcuni farmaci come gli steroidi anabolizzanti o l’etinilestradiolo esercitano una
azione tossica diretta sulla parete dei canalicoli biliari
• Colestasi in gravidanza (ittero gravidico) una leggera tendenza alla colestasi è fisiologica in corso di
gravidanza, in alcune gestanti tuttavia il prurito diventa insopportabile e si associa ad ittero, ciò è dovuto
probabilmente all’ipersensibilità alla presenza in circolo di ormoni steroidei
• Colestasi intraepatica ricorrente benigna
• Colestasi intraepatica progressiva familiare
Eziopatogenesi
Le alterazioni presenti incorso di colestasi possono essere ricondotte a:
• Alterazione della membrana sinusoidale degli epatociti in cui si trovano la pompa sodio-potassio e
trasportatori di membrana coinvolti nel trasporto degli acidi biliari e della bilirubina
• Alterazione di microfilamenti e microtubuli
• Alterazione della permeabilità canalicolare
Anatomia patologica
Istologicamente si ha dilatazione dei canalicoli biliari con formazione di trombi biliari all’interno.
Clinica
L’insieme delle alterazioni cliniche e biochimiche che si manifesta in corso di colestasi viene indicata con il
nome di sindrome colestasica:
• Ittero ostruttivo dovuto alla iperbilirubinemia di tipo diretto
• Urine ipercromiche a causa della bilirubinuria
• Feci ipocoliche a causa della ridotta formazione di urobilinogeno
• Prurito dovuto all’accumulo di agenti pruritogeni normalmente escreti con la bile (forse gli acidi biliari)
http://www.hackmed.org
•
•
•
•
[email protected]
68
Cute iperpigmentata per la aumentata deposizione di melanina
Incremento della concentrazione ematica di acidi biliari che determina bradicardia
Incremento della fosfatasi alcalina e γ-GT
Iperlipemia caratterizzata da incremento di colesterolo e fosfolipidi (in alcuni casi anche trigliceridi)
dovuta al fatto che normalmente questi vengono escreti nella bile sotto forma di micelle insieme agli
acidi biliari
• Xantelasmi accumuli di lipidi a livello palpebrale
• Xantomi accumuli di lipidi a livello del collo e delle palme delle mani
• Accumulo di rame visto chela bile normalmente rappresenta il suo principale mezzo di escrezione
• Steatorrea da riduzione dell’assorbimento intestinale di lipidi (e vitamine liposolubili) a causa del
deficit di acidi biliari
• Osteoporosi-osteomalacia per alterato assorbimento della vitamina D dovuto al deficit dei sali biliari e
riduzione della sua attivazione (per alterazione dell’attivazione epatica mediata dalla 25-idrossilasi) che
determina iperparatiroidismo secondario con incremento del riassorbimento osseo
• Deficit di vitamina A che determina deficit di adattamento alla visione al buio
• Deficit di vitamina E che determina iporeflessia fino all’atassia
• Deficit di vitamina K che determina ridotta biosintesi di fattori della coagulazione con conseguente
allungamento del PT e del PTT
In condizioni di normalità i sali biliari esplicano una azione di surfactante a livello intestinale distruggendo le
endotossine normalmente presenti perché derivate dalla parete dei batteri gram -.
Nell’ittero ostruttivo viene a mancare questa azione e di conseguenza una quota eccessiva di endotossine
può essere riassorbita in circolo con effetto nocivo a vari livelli.
In particolare a livello renale le endotossine determinano danneggiamento dell’endotelio con possibile IRA.
Le endotossine possono innescare il processo di coagulazione intravascolare disseminata CID.
I sali biliari e la bilirubina hanno inoltre effetti nefrotossica ed epatotossico poiché causano a livello
intracellulare la dissociazione della fosforilazione ossidativa con un danno simile a quello dell’anossia.
Di conseguenza vi è anche un incremento della suscettibilità cellulare all’anossia.
Sali biliari hanno inoltre un effetto vasodepressore e cardiodepressore determinando bradicardia e
ipotensione arteriosa che amplifica il danno renale e epatico.
L’ostruzione delle vie biliari inoltre determina stasi biliare con conseguente aumentato rischio di infezioni
(colangite e colecistite).
diagnosi
• Ecografia addominale: rappresenta lo strumento più immediato e più diretto per la diagnosi delle
patologie dell’albero biliare. Fornisce informazioni dettagliate sullo stato della parete, sul flusso
dinamico, sul contenuto della colecisti e delle vie biliari. Utilissima per diagnosticare stenosi,
malformazioni, calcoli, alterazioni funzionali del flusso e masse ostruttive, lesioni della parete. Identifica
anche calcoli piccoli, di 2mm. La mancata visualizzazione della colecisti in un paziente a digiuno è
indice abbastanza sicuro di una malattia di essa. Permette inoltre di differenziare la sabbia dai calcoli, in
quanto la prima non produce ombre acustiche e si muove con il cambio di posizione. E’ l’esame più
indicato per definire le situazioni di competenza chirurgica.
• RX addome: identifica praticamente solo i calcoli calcifici (quelli che hanno più del 20% di calcio).
Purtroppo il 75 % dei calcoli della colecisti e più del 90% dei calcoli del coledoco sono radio trasparenti
essendo formati particolarmente da colesterolo. Invece risulta molto importante nella diagnosi di
complicazioni della litiasi, come la calcificazione della parete, la presenza di bollicine d’aria nella
parete, espressione della colecistite enfisematosa, o l’evidenza di una fistola bilo-enterica o fra la
colecisti e qualche altro organo.
• Colecistografia orale: Ampiamente superata dall’ecografia, si tratta di una terapia basata
sull’assunzione di un mezzo radiopaco con elevata clearence biliare, che viene osservato in fase
contrastografica dopo alcune ore, per valutare il tracciato biliare e la funzionalità di clearence. E’
limitato dalla presenza di ittero (il fegato non assorbe o non riesce ad escretare il mezzo di contrasto) e
dalla gravidanza.
• Colangiografia endovenosa: stesso principio della orale, viene iniettato un mezzo di contrasto con
clearence biliare. L’esame ha una sensibilità e specificità non superiori al 60%, e non ha alcuna utilità in
presenza di colestasi anche lieve
http://www.hackmed.org
•
[email protected]
69
Scintigrafia epatica sequenziale: esame con HIDA (Himmino Diacetic Acid) marcato, che viene
metabolizzato nel fegato ed escreto nella bile. Non ha una risoluzione elevata ma è utile in quei pazienti
con idiosincrasia ai mezzi di contrasto.
• Colangiografia diretta: è l’esame di elezione per diagnosticare il livello e l’estensione di una ostruzione
delle vie biliari. Si fa in due forme.
o PTC (colangiografia transepatica percutanea): questa procedura prevede un accesso
percutaneo attraverso il parenchima epatico fino ad incannulare un ramo del dotto biliare e vi si
inietta un mezzo di contrasto. Permette di applicare anche un drenaggio del ramo biliare a monte
dell’ostruzione, o di applicare un bypass, procedure necessarie quando la pressione delle vie
biliari è elevata. Però si può fare solo se i dotti intraepatici sono dilatati, cosa che non si verifica
con la colangite sclerosante. Disordini emocoagulativi, colangite non trattata o versamento
ascitico non lo rendono possibile
o ERCP (coledoco pacreatografia retrograda endoscopica): incannulazione della papilla del
Vater e iniezione del mezzo di contrasto, che permette una valutazione accurata dell’albero
biliare ma non delle vie epatiche, ed inoltra ha il grosso vantaggio di permettere la visione diretta
della papilla e di procedere ad alcune manovre endoscopiche, come:
Papillosfinterotomia e rimozione di calcoli
Dilatazione di stenosi benigne
Posizionamento di stents autoespansibili
Si possono avere complicazioni come la pancreatite acuta, che però si verifica nell’1% dei casi.
• Colangiografia perioperatoria: opacizzazione del cistico durante l’intervento chirurgico e lettura delle
immagini con un fluoroscopio. Permette di ridurre notevolmente gli eventi di recidiva di calcoli.
• TC e RM: trovano applicazione nel sospetto di una neoplasia delle vie biliari e nella diagnosi
differenziale dell’ittero ostruttivo da una neoplasia della testa del pancreas
• Colangio RM: molto moderna e costosa, è una forma evoluta di RMN che permette la visualizzazione
dei fluidi stazionari, e da informazioni simili alla colangiografia senza iniezione di mezzo di contrasto.
Individua stenosi, dilatazioni, ectasie eccetera, ma non è in grado di riconoscere la causa dell’ostruzione.
Si può usare quando l’ecografia non è praticabile per via del meteorismo interposto.
Terapia
Correzione del deficit vitaminico:
β-carotene 30 mg/die per os
25-colecalciferolo 50-100 µg per os 3-5 volte la settimana
vitamina K (fitonadione) 10 mg sc mensilmente
vitamina E liquida 100 UI/die per os
per stabilire l’adeguatezza della terapia sostitutiva vanno monitorati i livelli di vitamina D, vitamina A e il
PT.
Dosi eccessive di vitamina A possono essere epatolesive o teratogene per ciò la vitamina va somministrata
solo quando è possibile monitorarne i livelli.
In alcuni pazienti può essere presente deficit di zinco che si può correggere con solfato di zinco 220 mg/die
per os (50 mg di zinco elementare) per 4 settimane.
Insieme al supplemento di vitamina D va somministrato anche un supplemento di calcio (1-1.5 g/die) per
prevenire osteoporosi ed osteomalacia che vanno monitorate tramite una radiografia a doppia energia o una
densitometria della colonna.
Terapia del prurito:
il prurito va trattato con colestiramina una resina che sequestra i sali biliari.
Il farmaco va somministrato come bustina (4 mg) sciolta in acqua prima di colazione e con ulteriori dosi
prima dei pasti quando necessario per controllare la sintomatologia.
La colestiramina non va somministrata contemporaneamente ad altri farmaci in quanto potrebbe ridurne
l’assorbimento.
Gli antistaminici e la doxazepina (25 mg/die per os) possono alleviare la sintomatologia.
Se la colestiramina non è in grado di controllare il prurito si può aggiungere anche fenobarbital 60-120
mg/die per os.
• Somministrazione di sali biliari che riducono l’incidenza dell’endotossinemia
• gastroprotezione
http://www.hackmed.org
•
[email protected]
70
protezione della funziona renale: somministrazione di mannitolo che come diuretico osmotico
aumenta la VFG (non vanno somministrati invece FANS che antagonizzando la sintesi renale di
prostaglandine possono precipitare l’IRA)
• nei pazienti con diarrea è utile una dieta a basso contenuto di grassi (40-60 g/die)
• profilassi antibiotica della colangite
Interventistica delle vie biliari
Drenaggio biliare
Il drenaggio biliare può essere fatto:
• per via endoscopica ERCP in caso di patologia ostruttiva bassa
• per via percutanea PTC in caso di patologia ostruttiva alta
si può anche fare un approccio combinato endoscopico-percutaneo.
Drenaggio biliare percutaneo DBP
È indicato in caso di ostruzione al flusso biliare (ittero ostruttivo) soprattutto se di natura maligna.
Ha come fine la decompressione delle vie biliari o il ristabilimento del flusso che porta ad una riduzione
l’entità dell’ittero e miglioramento le condizioni generali.
Drenaggio biliare esterno
È il metodo più semplice di decompressione biliare per stenosi che non è possibile oltrepassare (se la stenosi
può essere oltrepassata si esegue invece un drenaggio interno-esterno).
Viene fatta una colangiografia percutanea con visualizzazione delle vie biliari dilatate, scelto il dotto biliare
più idoneo si procede alla puntura ed al posizionamento di una guida attraverso la quale si introduce un
catetere di drenaggio connesso ad un sacchetto di raccolta per drenare la bile all’esterno.
Vanno eseguiti periodici lavaggi con soluzione fisiologica ed antibiotici.
Controindicazioni:
• alterazioni della coagulazione
• allergia a m.d.c.
• formazioni vascolarizzate (rischio di emobilia)
• ascite in alcuni casi
indicazioni:
• palliazione di neoplasie
• decompressione di stenosi benigne o calcolosi
• decompressione preoperatoria in alcuni casi
• decompressione dopo PTC o ERCP
la scelta di questa tecnica si ha quando è inutile o impossibile superare l’ostacolo o in presenza di bile infetta
per evitare la contaminazione delle strutture a valle.
In condizioni elettive comunque un drenaggio esterno può diventare facilmente esterno-interno.
Complicazioni:
• ostruzione del drenaggio: va trattata con lavaggio con soluzione fisiologica (che può da solo
disostruire) o rimozione endoscopica o percutanea, sostituzione e riposizionamento
• migrazione nell’intestino: sostituzione e riposizionamento
• emorragia chemioembolizzazione o embolizzazione con spirale metallica dell’arteria
intercostale che decorre nella loggia inferiore della costa o di un’arteria epatica subsegmentaria
• emobilia per contemporanea puntura della via biliare e della vena porta
• infezioni batteriche dell’albero biliare (colangite)
• insufficiente flusso di bile attraverso il drenaggio
Una complicanza in acuto è l’empiema pleurico.
Per prevenire il reflusso della bile verso la cute si utilizzano spirali metalliche che ostruiscono le vie biliari.
Drenaggio esterno-interno
Il drenaggio esterno può essere trasformato in drenaggio esterno-interno inserendo una guida attraverso il
drenaggio esterno (che viene poi rimosso) che viene forzata a superrare l’ostacolo e fatta pervenire in
duodeno.
L’estremità distale del drenaggio si trova nel duodeno, mentre quella prossimale è fissata alla cute e lasciata
chiusa, ma periodicamente viene aperta per consentire lavaggi che garantiscono la pervietà del drenaggio.
Consente sia il ripristino del flusso biliare che la decompressione esterna a monte della lesione.
Drenaggio biliare interno
http://www.hackmed.org
[email protected]
71
Consiste nel posizionamento di una protesi natura metallica (stent) o plastica che mette in comunicazione le
vie biliari a monte ed a valle dell’ostruzione.
Viene introdotta una guida tramite il drenaggio esterno-interno e quindi viene inserita l’endoprotesi che
viene fatta progredire lungo la guida.
Lo stent viene utilizzato nella palliazione di neoplasie maligne mentre per le stenosi benigne si usa lo stent
ricoperto.
L’indicazione all’uso dell’endoprotesi è quasi esclusivamente la palliazione di neoplasie maligne, in quanto
un paziente con stent è difficilmente operabile, l’utilizzo di stent ricoperti però sta allargando il campo di
applicazione anche alla patologia benigna.
L’ostruzione dello stent metallico è più tardiva di quello plastico in cui avviene dopo 7-8 mesi.
Se ci sono stenosi multiple possono essere inserite più endoprotesi.
Il fattore limitante il flusso biliare è la dimensione dell’endoprotesi che dovrà essere la maggiore possibile
compatibilmente con i problemi di posizionamento e di invasività.
L’endoprotesi non ha alcuna comunicazione con l’esterno per cui in caso di ostruzione deve essere rimossa e
quindi sostituita.
Complicazioni:
• ostruzione dell’endoprotesi: rimozione e sostituzione (si deve anche posizionare un drenaggio
esterno che permetta di supplire alla funzione carente)
• rottura: posizionamento di un’altra protesi perché è difficile toglierla
• spostamento: è importante che l’endoprotesi sia lunga abbastanza da occupare tutta la via
biliare e un tratto del lume del duodeno
• colangiti fino al 10% dei casi
bilioplastica
Consiste nella dilatazione delle vie biliari con catetere a palloncino introdotto per via transepatica e poi
gonfiato ad alta pressione.
L’indicazione è nelle stenosi di natura benigna.
Estrazione di calcoli
Può essere fatta tramite accesso percutaneo o endoscopico (in cui è necessario dilatare la papilla con
palloncino: papillotomia).
Nell’accesso percutaneo viene fatto prima un drenaggio percutaneo esterno e quindi la dilatazione della
stenosi con catetere a palloncino e la rimozione all’esterno o l’avanzamento in intestino dei calcoli.
anomalie congenite
Circa il 10-20% della popolazione presenta anomalie del genere, che possono essere distinte in :
• Agenesia della colecisti
• Duplicazione
• Diverticoli della colecisti
• Colecisti gigante
• Colecisti a “berretto grigio”, in cui il corpo viene separato dal fondo da una piega completa o no, ma
comunque clinicamente irrilevante
• Alterazione di posizione e di sospensione, che possono predisporre alla calcolosi, alla torsione e al
volvolo
ATRESIA DELLE VIE BILIARI
È una anomalia congenita caratterizzata dalla mancata formazione di tutte o una parte delle vie biliari
extraepatiche sostituite da tessuto fibroso.
L’eziopatogenesi è sconosciuta probabilmente legata ad infezioni virali che determinerebbero insieme a
fattori genetici predisponenti una reazione flogistica delle vie biliari con conseguente cicatrizzazione.
L’atresia viene suddivisa in 3 grandi gruppi:
¾ Tipo A: atresia totale di tutte le vie biliari extraepatiche compresa la colecisti
¾ Tipo B: atresia dell’epatico comune e dei dotti biliari, colecisti e coledoco normali
¾ Tipo C: abbozzo pseudocolecistico atresico
La sintomatologia sia manifesta in epoca neonatale con ittero colestasico tardivo entro il 1° mese (bilirubina
diretta) con feci acoliche ed urine ipercromiche che persiste per più di 10 giorni.
È presente epatomegalia palpabile associata talvolta a lieve splenomegalia.
http://www.hackmed.org
[email protected]
72
I livelli di bilirubina diretta sono elevati e si accompagnano ad altri segni di colestasi quali aumento della FA
e delle γGT.
La diagnosi è ecografica e può essere confermata con la colangioscintigrafia che evidenzia la mancata
escrezione del tracciante che viene eliminato tramite il rene.
La terapia è chirurgica e consiste nella derivazione biliare su ansa intestinale anastomizzata all’ilo epatico.
deficit di α1-antitripsina
Malattia ereditaria che si manifesta nell’infanzia o in età giovanile.
L’α1-antitripsina è una glicoproteina sintetizzata da fegato che rappresenta la principale anti-proteasi
sierica.
È presente in tutte le secrezioni dell’organismo ed ha la funzione di inibire le proteasi batteriche e
leucocitarie.
L’α1-antitripsina è la principale componente nelle α1-globuline sieriche e la sua carenza può essere
evidenziata già dall’assenza del picco corrispondente all’elettroforesi.
Nel bambino il deficit si associa a epatopatia di grado variabile.
Istologicamente il fegato presenta inclusioni intracellulari di α1-antitripsina PAS + nelle cellule alla periferia
del lobulo.
Sono costituite dalla glicoproteina alterata non trasportabile attraverso la membrana cellulare e che si
accumula nelle cellule producendo la loro distruzione ed infine la cirrosi.
I dotti biliari si presentano stenotici e ipoplasici con conseguente ittero colestasico neonatale.
Nel soggetto adulto il deficit predispone all’insorgenza di enfisema.
LITIASI BILIARE
è una condizione patologica caratterizzata dalla presenza di calcoli a livello delle vie biliari: colecisti
(colelitiasi) e/o nelle vie biliari intra o extraepatiche.
I calcoli nella maggior parte dei casi si formano nella colecisti e poi migrano nelle vie biliari, solo in rare
condizioni patologiche si formano direttamente in questa sede (litiasi primitiva del coledoco).
I calcoli sono strutture cristalline derivate dall’aggregazione o concrezione delle componenti della bile
normali o patologici.
Si dividono in:
• Calcoli di colesterolo (80%)
1. puri sono rari, di colore giallo pallido, di forma rotonda o ovoidale con superficie esterna dura e
finemente granulare, in genere solitari
2. misti contengono 70% di colesterolo monoidrato, fosfolipidi, acidi e pigmenti biliari, proteine, acidi
grassi) generalmente multipli, hanno colore bianco-grigio o nerastro e sono lamellari
• Calcoli di pigmento (20%) costituiti da bilirubinato di calcio meno del 10% di colesterolo,
generalmente multipli
Tutti i tipi di calcoli possono diventare calcifici, la calcificazione è più frequente nei calcoli di pigmento
rispetto a quelli di colesterolo.
La prevalenza della litiasi biliare è del 20% ed è ultimamente in aumento.
La litiasi pigmentaria è più frequente nei paesi orientali (Giappone) e nell’Africa centrale (Uganda) ed è
correlata a specifici fattori di rischio:
• Cirrosi biliare
• Stasi biliare
• Emolisi
• Infezioni batteriche e parassitarie
La litiasi colesterolica invece è più frequente nei paesi occidentali ed è correlata a diversi fattori di rischio:
• Razza e luogo di residenza: Centro America, Messico, Cecoslovacchia e Svezia alta prevalenza, bassa
in Africa, Cina e India
• Età: in età adulta aumenta la produzione di colesterolo
• Sesso: più frequente nella donna
• Obesità e rapida perdita di peso che sono associate ad un incremento della secrezione biliare di
colesterolo
http://www.hackmed.org
•
[email protected]
73
Digiuno prolungato (anche anorresia ex. in corso di patologia neoplastica) che determina stasi della
colecisti per riduzione dello stimolo
• dieta ricca di grassi e povera di fibre
• Diabete e iperlipidemia
• Malattie del tenue: riducono il riassorbimento dei sali biliari, rendendo la bile più satura in colesterolo
(morbo di Crohn o esclusione di un tratto enterico per resezione ileale, by-pass intestinale, ileostomia)
• Fibrosi cistica: la diminuzione del riassorbimento qui si somma anche all’aumento della viscosità delle
secrezioni che possono saturare la bile
• Chirurgia gastrica: provoca la diminuzione della motilità della colecisti
• Gravidanza in cui si verifica una ridotta motilità della colecisti
• assunzione di estrogeni che aumentano l’espressione epatica dei recettori per le lipoproteine e
stimolano l’attività della HMGCoA reduttasi determinando così l’incremento della captazione del
colesterolo e della sua biosintesi
• clorfibrato determina un incremento di attività della attività della HMGCoA reduttasi e una riduzione di
attività della 7alfa-idrolasi determinando così un incremento della sintesi di colesterolo e una riduzione
della sua trasformazione in acidi biliari
• ileo paralitico postoperatorio, vagotomia, anestetici e narcotici che determinano riduzione della
motilità della colecisti
• nutrizione parenterale totale NPT in cui non si ha motilità della colecisti per alterazione dello stimolo
• alterazioni della funzione di assorbimento o secrezione delle pareti della colecisti che è più frequente
con l’invecchiamento e nella colecistite cronica
È stata inoltre notata l’associazione con altre patologie quali ulcera peptica, malattia diverticolare e stipsi.
La colelitiasi è chiamata anche malattia delle 4 F: female, fourty, fatty, fertile.
Eziopatogenesi
Calcoli di colesterolo
Il colesterolo è una sostanza relativamente insolubile in acqua che ha bisogno di una sostanza lipidica per
essere solubilizzato, la lecitina, e sostanze anfipatiche che sono in grado di formare con esse delle micelle, i
sali biliari.
I meccanismi che provocano la litiasi di colesterolo sono quindi principalmente di tre tipi:
• Aumento della produzione di colesterolo:
o Obesità
o Dieta ipercalorica
o Assunzione di farmaci come il clofibrato
o Aumento dell’attività dell’HMG-CoA, enzima chiave della sintesi del colesterolo
o Riduzione della conversione del colesterolo in acidi biliari
• Diminuzione della produzione di acidi biliari
o Diminuzione della capacità sintetica del fegato da difetti metabolici congeniti
o Riduzione della circolazione enteroepatica di sali biliari (NB: una riduzione degli acidi biliari si
osserva per eccessiva perdita intestinale in patologia intestinali estese o dopo resezione di un
lungo tratto di ileo distale)
o Riduzione della attività della 7-alfaidrossilasi, enzima chiave nella sintesi degli acidi biliari
• Formazione di vescicole difettive: normalmente le vescicole di colesterolo sono fatte in modo da essere
convertite in formazioni più stabili di fosfolipidi e colesterolo. Durante la loro formazione, le vescicole
possono acquistare troppo colesterolo, divenire instabili e favorire l’aggregazione di cristalli di
colesterolo.
Il colesterolo è reso solubile nella bile grazie alla sua associazione con i sali biliari e i fosfolipidi a formare
micelle e dalle vescicole che sono formate da aggregati monolamellari di fosfolipidi e colesterolo.
Un eccesso di soluto (colesterolo) o un deficit di solvente (acidi biliari e lecitina) determina una ridotta
stabilità della soluzione o sovrasaturazione che fa si che le vescicole monolamellari si fondano a formare
aggregati multilamellari molto più grandi definiti liposomi.
Una volta che si sono verificati questi eventi si devono avere altri fattori che facilitano la nucleazione, ossia
l’addensamento delle micelle di colesterolo non disciolte si condensi in nuclei di accrescimento che portino
alla formazione del cristallo.
http://www.hackmed.org
[email protected]
74
Il calcolo quindi si forma per la precipitazione del cristallo di colesterolo attorno ad un nucleo condensante
che può essere costituito da pigmenti, cellule sfaldate dell’epitelio della colecisti, corpi batterici e,
glicoproteine, sali di calcio e corpi estranei.
Una volta formatosi il nucleo centrale di precipitazione del calcolo l’accrescimento avviene per successiva
apposizione di cristalli di colesterolo.
Di solito infatti il tempo di permanenza della bile nella colecisti non è sufficiente perché vi sia un
addensamento consistente.
La cosiddetta bile litogena, infatti, non si contraddistingue tanto dall’eccesso di colesterolo o dal difetto di
micelle, quanto dalla capacità di accelerare la nucleazione dei cristalli.
Questo processo dipende dall’eccesso di fattori acceleranti e/o dal difetto di fattori inibenti la nucleazione.
Un ulteriore processo importante è la formazione della sabbia biliare uno spesso materiale di consistenza
mucosa, a forma di semiluna che si accumula nel fondo della colecisti costituita da cristalli di colesterolo,
colesterolo e lecitina, bilirubinato di calcio e filamenti di gel e muco.
Essa si forma quando alla nucleazione di colesterolo e sali biliari si aggiunge una riduzione della clearence
di muco dalla colecisti.
Studi indicano che la principale condizione precedente la calcolosi è appunto la sabbia biliare.
La presenza di bile litogena è la condizione necessaria ma non sufficiente perché si abbia la formazione di
calcoli.
Fondamentale infatti è la stasi all’interno della colecisti (stasi biliare).
Comuni concause della colelitiasi sono infatti la colecistite e la stasi colecistica.
La contrazione della colecisti è sotto controllo sia ormonale che nervoso, nei soggetti con colelitiasi la
contrazione della colecisti è ridotta e ciò determina un rallentato ed incompleto svuotamento della
colecisti che favorisce il processo di nucleazione e di crescita del calcolo.
La stessa bile litogena modifica la motilità della colecisti in quanto in presenza di cristalli si verifica un
alterata risposta alla colecistochinina o un incremento delle resistenze al passaggio della bile nel dotto
cistico.
Si viene così a creare un circolo vizioso in cui la stasi favorisce la formazione dei calcoli e questi a loro volta
incrementano la stasi.
Calcoli pigmentari neri
Sono più frequenti nelle popolazioni occidentali, sono costituiti da bilirubina non coniugata e elevate
quantità di glicoproteine, sono estremamente fragili ed hanno contorni angolati.
Sono associate a cirrosi e ad emolisi cronica in cui si verifica un aumento della bilirubina, si trovano quasi
esclusivamente nella colecisti, la formazione può dipendere da 2 meccanismi patogenetici:
• Sovrasaturazione di bilirubina non coniugata che essendo liposolubile tende facilmente ad aggregarsi
• Normale concentrazione di bilirubina non coniugata ma presenza di alterazioni del sistema di
solubilizzazione:
1. PH
2. iterazione con le micelle
3. motilità della colecisti: in caso di rallentato e ridotto svuotamento aumenta la concentrazione di
bilirubina non coniugata ed il contatto con le mucoproteine secrete dalla mucosa, si ha inoltre una
riduzione del PH
Calcoli pigmentari bruni
Sono più frequenti nelle popolazioni orientali, sono costituiti da alternanza di tratti di colorito bruno
(bilirubinato di calcio) e tratti di colorito giallastro (acidi grassi), sono laminari e morbidi, di consistenza
simile al sapone o al grasso.
Derivano dalla stasi biliare indotta da parassitosi complicata da una infezione batterica: la glicuronidasi
batterica opera la deconiugazione della bilirubina, la bilirubina deconiugata si lega al calcio con formazione
di bilirubinato di calcio.
Clinica
Il decorso clinico è:
9 80% asintomatico di cui il 25% sintomatico entro 10 anni
9 20% sintomatico di cui il 35% complicato entro 10 anni
CALCOLOSI DELLA COLECISTI
Possiamo distinguere:
• 80% colelitiasi asintomatica in cui vi è il rischio di sviluppare una colica biliare
http://www.hackmed.org
[email protected]
75
• 20% colelitiasi sintomatica in cui vi è il rischio di sviluppare complicanze
In genere i calcoli della colecisti sono asintomatici, fino a quando non migrano nel coledoco o nel dotto
cistico, e ne provocano infiammazione e/o ostruzione.
A questo punto si verifica il classico episodio di contrazioni ripetute e spasmodiche della parete della
colecisti che provocano la colica biliare le cui caratteristiche peculiari sono:
• Inizio improvviso causato dall’incuneamento di un calcolo nel dotto cistico
• Dolore a carattere ingravescente che raggiunge il suo acme in 5-60 minuti e perdura poi con tale
intensità per alcune ore
• Dolore inizialmente intermittente e successivamente continuo per interessamento della sierosa della
colecisti
• il dolore biliare ha al suo esordio un carattere viscerale sordo, profondo, non puntualmente localizzabile,
riferito dal paziente in sede epigastrica o nell’ipocondrio destro e solo successivamente acquisisce un
carattere somatico, irradiato alla spalla destra (interessamento del n. frenico) e al fianco posteriore
destro, fino in regione sottoscapolare destra
• l’irradiazione all’ipocondrio sinistro indica un edema pancreatico concomitante
• Spesso insorge dopo pasti copiosi e ricchi di grassi
• Spesso ma non necessariamente seguita da nausea e vomito prima alimentare e poi biliare
• A volte seguita da subittero transitorio
I meccanismi fisiopatogenetici del dolore biliare sono l’infiammazione, la distensione e lo spasmo del
viscere.
Nei pazienti con colelitiasi asintomatica o con colelitiasi sintomatica al di fuori degli episodi di colica biliare
è presente il quadro della dispepsia biliare caratterizzata da:
• Digestione lunga e laboriosa
• Peso epigastrico post-prandiale accompagnato da torpore e sonnolenza
• Eruttazione
• Aerofagia e meteorismo
• Intolleranza ai grassi
• Alvo irregolare
• Episodi di cefalea, astenia al risveglio e difficoltà nell’applicazione lavorativa
All’esame obiettivo è presente dolorabilità all’ipocondrio destro e/o all’epigastrio soprattutto in
corrispondenza del punto cistico = punto in cui la linea paracentrale (a metà tra la linea mediana e la spina
iliaca anteriore superiore) incontra a destra la IX cartilagine costale che corrisponde al fondo della colecisti.
Tipica è la positività del segno di Murfy = palpando nel punto cistico e chiedendo al paziente di compiere
una inspirazione si osserva un brusco arresto riflesso di questa provocato dalla graduale compressione del
punto cistico.
Legge di Courvasier-Terrier = in corso di colelitiasi la colecisti non si presenta aumentata di volume e
quindi palpabile, poichè la patere della colecisti si ispessisce e si riduce per alterazioni dovute alla
colecistite cronica e non può dilatarsi.
La calcolosi del coledoco finisce spesso per dar luogo, oltre alle coliche, a complicanze importanti:
• Colecistite acuta
• Pancreatite biliare circa il 30% dei pazienti con calcolosi sviluppa pancreatite. In genere
l’interessamento pancreatico si risolve con la risoluzione della malattia litiasica.
La diagnosi e la terapia dei calcoli del coledoco è possibile con la ERCP, con papillotomia preparatoria.
• Fistola bilio-digestiva con possibile occlusione intestinale da migrazione del calcolo a livello del tenue
ed arresto nella valvola ileo-cecale (ileo biliare)
• Idrope della colecisti
• Calcificazione della colecisti
• Sindrome di Mirizzi
I pazienti affetti da colelitiasi hanno un incidenza maggiore di adenocarcinoma della colecisti rispetti ai
soggetti alitiasici.
CALCOLOSI DELLE VIE BILIARI
Nella maggior parte dei casi insorge per il passaggio nelle vie biliari (soprattutto nel coledoco) di calcoli
biliari formatisi nella colecisti ed è quindi da considerare come una complicanza della colelitiasi che
insorge nel 10-25% dei casi.
http://www.hackmed.org
[email protected]
76
La formazione primitiva di calcoli nelle vie biliari è rara e quando avviene si associa a situazioni favorenti:
• Malattie emolitiche croniche
• Anomalie congenite delle vie biliari (malattia di Carioli)
• Ostruzione delle vie biliari principali (secondaria a colangite sclerosante o a stenosi chirurgiche o a
stenosi della papilla)
• Infestazione cronica della vie biliari
Dal momento che i calcoli delle vie biliari sono per la maggior parte calcoli migrati dalla colecisti la loro
composizione è la stessa di questi ultimi.
I calcoli che si formano primitivamente nelle vie biliari sono invece principalmente calcoli pigmentari.
Clinica
In caso di migrazione di un calcolo della colecisti il paziente ha già presentato la sintomatologia tipica della
colelitiasi a carattere cronico e ricorrente.
Nel momento in cui si verifica la migrazione del calcolo nel coledoco insorge una sintomatologia acuta
caratterizzata da:
• Dolore di tipo colico all’ipocondrio destro e/o all’epigastrio
• Ittero ostruttivo ad impronta colestasica
• Feci ipocoliche e urine ipercromiche
• Nausea e vomito
• A volte febbre preceduta da brividi
In molti casi la sintomatologia recede nel giro di ore o di giorni per passaggio del calcolo più distalmente in
una zona a sezione maggiore o per passaggio del calcolo in duodeno.
La sintomatologia può ripresentarsi ad intervalli di tempo variabili.
A volte la litiasi delle vie biliari può restare asintomatica e quindi misconosciuta per anni.
All’esame obiettivo si osserva dolorabilità all’ipocondrio di destra e/o all’epigastrio soprattutto in
corrispondenza del punto cistico.
Le principali complicazioni sono:
• Colangite acuta: è una infiammazione acuta del coledoco che insorge fin da subito in 3/4 dei casi
dovuta a sovrapposizione di infezione batterica. Il quadro clinico tipico è rappresentato da febbre con
brividi, ittero ostruttivo e colica biliare (triade di Charcot). La febbre è più spesso di tipo settico con
puntate termiche elevate > 39° e associate a brivido scuotente, nausea e vomito. La forma + comune è
non suppurativa, che risponde al trattamento con antibiotico. Invece la forma suppurativa si associa alla
presenza di nausea, vomito e possibilità di shock con batteriemia. Queste complicazioni si trattano con
intervento endoscopico in maniera estremamente efficace.
• Ittero ostruttivo: si può avere quando si abbia una progressiva ostruzione del coledoco nell’arco di
settimane o mesi. Di solito si associa alla fine a dolore, e se non lo fa è più indicativo di un carcinoma
comprimente delle strutture circostanti. Inoltre, secondo il principio di Courvoisier, la colecisti non è
distesa e palpabile. La bilirubina in genere non supera i 5 mg/dl. Sono presenti urine ipercromiche e feci
ipocoliche.
• Pancreatite acuta biliare: è presente nel 15% dei pazienti in cui in genere l’interessamento pancreatico
si risolve con la risoluzione della malattia litiasica.
• Cirrosi biliare secondaria da ostruzione continua o intermittente che determina dilatazione delle vie
biliari intraepatiche
Diagnosi
Gli esami di laboratorio rivelano le alterazioni dovute ad ittero ostruttivo ad impronta colestasica:
• Iperbilirubinemia diretta
• Bilirubinuria
• Aumento di ALP e γ−GT
• Aumento dei valori sierici degli acidi biliari
• Leucocitosi neutrofila in caso di colangite
Terapia
• Estrazione per via endoscopica tramite papillo-sfinterotomia: Il metodo meno invasivo è l’ERCP con
incannulamento della papilla di Vater, papillosfinterotomia ed estrazione dei calcoli con il cestello di
Dormia (basket), con successo superiore al 95%. Però non è una tecnica priva di rischi (mortalità 1%) e
ha un certo grado di insuccesso nell’identificare tutti i calcoli, quindi non sempre è possibile usarla in
http://www.hackmed.org
•
•
•
•
•
[email protected]
77
sostituzione dell’intervento chirurgico, che poi va comunque fatto, e induce a volte solo un rischio
addizionale.
Estrazione per via percutanea: tramite catetere a palloncino introdotto in corso di PTC il calcolo viene
spinto in duodeno
Intervento chirurgico: l’approccio chirurgico tradizionale ha il vantaggio di non presentare recidive, di
non correre il rischio di incannulare il Wirsung per sbaglio con conseguente pancreatite, e di identificare
tutti i calcoli presenti
litotripsia meccanica o con laser
protesi temporanea o a lungo termine per via percutanea o tramite catetere naso-biliare
dissoluzione per os tramite UDCA o transcatetere
colangite
Infiammazione delle vie biliari di natura infettiva in genere sostenuta da batteri intestinali.
Nella maggior parte dei casi fa seguito a ostruzione delle vie biliari (in genere da calcolo) ma può essere
anche conseguenza di un intervento chirurgico o endoscopico (PTC o ERCP) sulle viene biliari.
La diagnosi viene fatta tramite ecografia che rivela l’ispessimento della parete della via biliare dovuto
all’edema, dilatazioni irregolari delle vie biliari e può evidenziare la presenza di calcoli.
Tramite ERCP o PTC è possibile il prelievo della bile per l’analisi microbiologica e la decompressione
tramite drenaggio biliare esterno.
colecistite acuta
COLECISTITE ACUTA LITIASICA
Rappresenta il 90% delle colecistiti ed è più frequente nel sesso femminile.
Rappresenta la più frequente complicanza della colelitiasi.
Consegue in genere all’ostruzione del dotto cistico ad opera di un calcolo che determina stasi biliare con
diverse conseguenze:
• Infiammazione meccanica provocata da un aumento di pressione intraluminale, con congestione
venosa e linfatica e poi ischemia della mucosa e della parete della colecisti
• Infiammazione chimica causata dalla liberazione di lisolecitina (per azione degli enzimi dei PMN
sulla lecitina biliare) che determina essudazione della parete
• Infiammazione batterica, che rappresenta un fattore importante perché si è visto che circa il 5080% dei calcoli ostruttivi si accompagna ad infezione, spesso da parte di Klebsiella, Streptococco,
Stafilococco e Clostridium, è favorita dalla stasi e dall’ischemia
Anatomia patologica
La colecisti è tesa aumentata di volume e può assumere un colore da rosso vivo a violaceo fino a neroverdastro per effetto delle emorragie sottosierose.
La bile è opaca e torbida e può contenere abbondanti quantità di fibrina emorragie e pus.
La parete della colecisti si presenta ispessita, edematosa e iperemica.
clinica
Il quadro clinico tipico è rappresentato da febbre con brividi e colica biliare.
Il dolore è continuo a volte preceduto da coliche, ben localizzato in ipocondrio o epigastrio, con irradiazione
al fianco destro, mesogastrio, spalla destra e regione infrascapolare.
Il dolore aumenta con l’inspirazione e con i movimenti del tronco.
Fenomeni associati: ileo paralitico e raramente ittero.
Talvolta si associa a subittero o ittero per iperplasia dei linfonodi pericoledocici.
La febbre è continua o remittente, inizia spesso con brivido, può raggiungere i 38-39° e quindi cadere per
lisi.
La sintomatologia dolorosa iniziale è identica alla calcolosi biliare, il dolore però non tende a risolversi
spontaneamente dopo 3-4 ore, a causa dell’interessamento del peritoneo acquista i caratteri di dolore
somatico localizzato intenso ed aggravato dai movimenti del diaframma.
Spesso c’è vomito, e compaiono segni di interessamento peritoneale dell’infiammazione, con dolore da
rimbalzo che si accentua con l’ispirazione.
Esame obiettivo:
ispezione: asimmetria dell’addome da contrattura antalgica dell’emiaddome destro, interruzione
dell’inspirazione profonda.
http://www.hackmed.org
[email protected]
78
Palpazione: contrattura di difesa dell’emiaddome destro, dolorabilità in ipocondrio destro o sul punto
cistico, segno di Murphy e Blumberg positivo, presenza di piastrione infiammatorio in ipocondrio destro.
Palpazione: il focolaio colecistico da sempre un suono ottuso, circondato da un area di ipertimpanismo
formata dal colon traverso e dallo stomaco distesi per l’ileo paralitico.
Auscultazione: peristalsi torpida o assente, ipomobilità della base polmonare destra.
diagnosi
Le indagini di laboratorio rivelano leucocitosi neutrofila, incremento di transaminasi, fosfatasi alcalina e γGT e possibile iperbilirubinemia.
L’aumento della bilirubina è modesto, in genere entro 5 mg%, mentre le transaminasi possono salire ma non
oltre valori di 5 volte la norma (200 U/l).
L’ecografia evidenzia aumento di spessore e riduzione di ecogenicità della parete della colecisti causate
dall’edema (tipico aspetto a binario).
Può evidenziare inoltre la presenza di calcoli, ispessimento del tessuto pericolecistico in caso di flogosi o
eventuali raccolte fluide in caso di perforazione.
Diagnosi differenziale:
epatite acuta: assenza di peritonismo, presenza di indici di laboratorio di compromissione epatica
ulcera peptica perforata: presenza di falce d’aria sottodiaframmatica, diverso andamento del dolore per sede
e tipo di insorgenza, febbre solo nella seconda fase
pancreatite acuta: assenza della febbre, diverso andamento del dolore (bifasico)
appendicite acuta sottoepatica: età del paziente (più giovane), diverso andamento del dolore (bifasico)
terapia
Nel 75% dei casi la malattia guarisce con la terapia antibiotica, mentre nel 25% si possono avere
complicazioni che devono essere trattate con la terapia chirurgica o si può avere l’evoluzione a colecistite
cronica.
Possibili complicanze acute sono rappresentate da:
empiema della colecisti
gangrena
perforazione
COLECISTITE ALITIASICA
Rappresenta il 10% delle colecistiti e ha una maggiore prevalenza nel sesso maschile e nell’anziano.
È caratterizzata dall’assenza di calcoli nel dotto cistico.
Si verifica sempre in pazienti che presentano condizioni generali scadenti con associate patologie debilitanti.
Nell’anziano la maggiore frequenza è dovuta alla cattiva perfusione della colecisti a causa di fenomeni
aterosclerotici e alla presenza di uno stato di immunodepressione senile.
Le circostanze in cui si osserva sono:
• Traumi o gravi ustioni
• Infezioni “rare” della colecisti (Streptococco, salmonella, Leptospira, Colera) e parassitarie
• Vasculiti
• Adenocarcinoma ostruttivo della colecisti
• Malattie sistemiche come la sarcoidosi, cardiopatie, TBC, sifilide
• MOF
• Sepsi
• NPT di lunga durata
• Ileo postoperatorio di lunga durata
Si ritiene che l’infiammazione della colecisti tranne che nel caso dell’infezione primitiva sia il risultato di
una compromissione ischemica dell’organo o della stasi non indotta da calcolo.
Non esistono differenze morfologiche tra la colecistite acuta alitiasica e quella litiasica.
Clinicamente rimane indistinguibile dalla forma litiasica, e si differenzia solo per l’assenza di calcoli e in
genere per l’associazione con un quadro sottostante di una malattia grave, della quale costituisce in pratica
una complicazione.
E’ inoltre associata ad un rischio molto maggiore di complicanze quali gangrena e perforazione per la natura
ischemica della patologia e per il frequente ritardo nella diagnosi.
L’efficacia degli interventi terapeutici dipende dalla precocità della diagnosi, e dall’intervento chirurgico
precoce con controllo della fase post-operatoria.
http://www.hackmed.org
[email protected]
79
COLECISTOPATIA ALITIASICA
Alterazione della motilità della colecisti definita da una serie di criteri diagnostici.
Uno di questi si avvale della misurazione della frazione di eiezione di acido diisopropiliminodiacetico
(DIDA), dopo stimolazione con CCK.
I criteri sono:
• Episodi ricorrenti di dolore biliare
• Alla scintigrafia della colecisti con DIDA marcato con Tc99, frazione di eiezione a 45 minuti < del 40%
• Dolore all’infusione di CCK
• Anamnesi positiva per alterazione degli enzimi epatici transitorie, in corrispondenza degli episodi
dolorosi.
Questa condizione andrebbe distinta, mediante l’osservazione delle dimensioni della colecisti, dalle
disfunzioni pure dell’Oddi.
COLECISTITE ENFISEMATOSA
È una forma di colecistite acuta particolarmente severa ed a rapida evoluzione che sopravviene quando la
parete viene incontro a ischemia e gangrena, con infezione da parte di anaerobi gram- produttori di gas.
Oltre ai Clostridi, a volte si trovano aerobi come E. Coli; è frequente nei maschi anziani, soprattutto se
affetti da diabete.
Clinicamente non si distingue dalla colecistite normale.
L’Rx standard dell’addome evidenzia la presenza di aria nel lume e nello spessore delle pareti della colecisti
e talvolta anche nell’albero biliare.
colecistite cronica
è una infiammazione cronica della parete della colecisti è quasi sempre associata alla presenza di calcoli,
come una conseguenza delle ripetute infiammazioni ed episodi di colecistite acuta, oltre che al persistere
dell’infiammazione e della stimolazione meccanica.
In genere c’è anche infezione della bile.
Anatomia patologica
La colecisti è di dimensioni normali o aumentate.
La sierosa è spesso pacata dalla fibrosi sottostante e può presentare tenaci aderenze.
In sezione la parete è ispessita ha un colore bianco-grigiastro e tende ad essere più rigida.
La mucosa è in genere ben conservata a meno che l’incremento della pressione endoluminale non abbia
determinato assottigliamento ed atrofia.
Il grado di flogosi è variabile.
È presente un infiltrato linfomonocitario che se intenso da luogo alla formazione di cripte profonde epiteliali
nello spessore della parete con estroflessione dell’epitelio (seni di Rokitanski-Ashoff).
Una rara condizione è la colecistite granulomatosa in cui la colecisti è coartata, nodulare con foci di necrosi
ed emorragia e può essere scambiata macroscopicamente per una neoplasia maligna.
Diagnosi
L’ecografia rivela riduzione di volume della colecisti e aumento di spessore della parete.
Alla colescintigrafia si ha visualizzazione tardiva della colecisti.
clinica
La sintomatologia è caratterizzata da disturbi dispeptici e saltuarie coliche alternate a frequenti
riacutizzazioni infiammatorie.
Molto spesso a causa del recidivare di episodi di colecistite acuta la colecisti diventa esclusa per il
determinarsi di una ostruzione progressiva organica a livello del dotto cistico.
terapia
Siccome la terapia di elezione è chirurgica, si raccomanda in questi pazienti una profilassi antibiotica prima
dell’operazione nel caso alla colorazione di gram siano apparsi dei gram- della specie clostridio.
La colecistite cronica può rimanere asintomatica per anni, evolvere verso la forma cronica o produrre una
serie di complicanze.
http://www.hackmed.org
[email protected]
80
EMPIEMA DELLA COLECISTI
L’empiema, cioè la suppurazione in una cavità preesistente, è una complicazione che occorre nella
colecistite quando si verifica l’ostruzione del dotto cistico e l’infezione della colecisti da parte di batteri
piogeni.
La colecisti si presenta ripiena di pus.
Il quadro clinico è identico a quello della colecistite con febbre elevata e marcata leucocitosi, ma il rischio di
sepsi da parte di gram- e di perforazione è molto maggiore.
All’ecografia è visibile l’aumento di volume della colecisti e la presenza la suo interno di bile corpuscolata
(pus + fibrina).
Quindi è necessario procedere rapidamente all’evacuazione chirurgica sotto copertura antibiotica.
Proprio perché tipica del soggetto anziano può presentarsi con un quadroclinico subdolo e sfumato.
La morbilità e la mortalità dipendono dal quadro settico e dalla presenza di patologie associate
cardiocircolatorie e polmonari.
IDROPE E MUCOCELE
L’idrope e il mucocele sono derivati anch’essi dall’ostruzione del cistico, che non si infetta, ma avviene la
produzione, da parte delle cellule dell’epitelio, di una sostanza chiara trasudatizia, o di muco.
Il paziente è di solito asintomatico, ma ci può essere il rischio di empiema, perforazione o gangrena.
GANGRENA E PERFORAZIONE
È una complicanza della colecistite acuta che più frequentemente si manifesta in pazienti anziani,
immunodepressi o diabetici.
Rappresenta generalmente l’evoluzione di un empiema di una colecistite acuta litiasica o enfisematosa.
È dovuta all’ischemia protratta con conseguente gangrena.
La parete della colecisti assume un aspetto necrotico verde-nerastro.
Se non trattata tempestivamente la gangrena evolve verso al perforazione che può dare luogo ad una
peritonite diffusa o localizzata (se viene contenuta dalle aderenze peritoneali infiammatorie che si formano
attorno alla colecisti perforata).
La presenza di una soprainfezione batterica della colecisti ostruita che si accompagna alla perforazione porta
ad un ascesso nei dintorni.
La perforazione libera, sebbene più rara, è associata ad una mortalità del 30%; i sintomi sono una iniziale
diminuzione del dolore, provocata dalla decompressione, seguita dai segni della peritonite biliare o
colepritoneo.
Anche questa complicanza si tratta con la rimozione chirurgica.
Fattori di rischio di perforazione:
9 Febbre > 39°
9 Leucocitosi neutrofila
9 FC > 120
FISTOLE
Si formano in genere tra la colecisti (o raramente tra il cistico o il coledoco) ed il lume intestinale (fistole
biliodigestive).
La fistolizzazione avviene in seguito all’infiammazione e all’adesione delle due strutture.
Le più comuni sedi di sbocco di queste sono (in ordine di frequenza):
• Duodeno
• Stomaco
• Digiuno
Le fistole si possono formare anche con altri organi e strutture:
• Flessura epatica
• Parete addominale
• Pelvi renale
Le fistole con l’intestino sono naturalmente asintomatiche e si osservano casualmente durante altri esami.
Le fistole sintomatiche si possono trattare con l’escissione del tratto interessato.
Si possono formare anche fistole colecisto-coledociche per la presenza di uno o più calcoli che comprimono
il coledoco e determinano una necrosi ischemica della parete.
http://www.hackmed.org
[email protected]
81
Calcoli che si trovano nella tasca di Hartman o nel cistico determinano ittero ostruttivo (sindrome di
Mirizzi) attraverso diversi meccanismi:
Tipo I compressione dell’epatico comune
Tipo II fistola colecistico-epatica di diametro > 33% della circonferenza dell’epatico
Tipo III fistola colecistico-epatica diametro 33-66%
Tipo IV fistola colecistico-epatica > 66%
Si manifesta con ittero ostruttivo o colangiti in assenza di sintomatologia dolorosa (colica biliare), il
paziente può presentare un anamnesi di colecistite.
Entra in diagnosi differenziale con il carcinoma della colecisti.
Le fistole possono essere evidenziate tramite esame radiografico diretto che mostra la presenza di aria nella
colecisti (pneumobilia) o con mezzo di contrasto che evidenzia il reflusso di questo nella colecisti.
ILEO BILIARE
Un calcolo che penetra nell’intestino può dare occlusione intestinale.
In genere, se il tenue non presenta stenosi, questi calcoli si fermano alla valvola ileocecale o più raramente
nella flessura duodenodigiunale determinando ileo biliare.
In effetti, un calcolo di grosse dimensioni, dell’ordine di 2-3 cm, provoca una progressiva erosione del fondo
della colecisti e produce una fistola.
La rimozione per via laparoscopica è la terapia di elezione.
CALCIFICAZIONE DELLA COLECISTI
La presenza di un processo infiammatorio cronico della colecisti induce la formazione di precipitati di
calcio che si stratificano nella colecisti formando un deposito a semiluna (detti sabbia di calcio).
Quando la deposizione è prevalentemente parietale, si osserva un caratteristico aspetto ecografico detto
colecisti a porcellana.
In questi casi è consigliabile l’asportazione della colecisti per la possibilità di sviluppare un carcinoma.
PAPILLITE
Episodi flogistici recidivanti o traumatismi causati dal passaggio di piccoli calcoli attraverso la papilla ne
determina l’infiammazione con formazione di papillite cronica fibrosa.
L’alterazione della papilla di Water può determinare stasi pancreatica e reflusso bilio-pancreatico
determinando un quadro si pancreatite acuta ricorrente.
Diagnosi
• Rx addome
Di basso costo, ma individua solo quella quantità di calcoli che contengono calcio in quantità tale da essere
radiopachi, cioè il 50% di quelli pigmentati e il 20-30% di quelli di colesterolo.
I calcoli composti soprattutto da colesterolo sono radiotrasparenti, ma è sufficiente che il carbonato di calcio
sia presente per il 20% perché diventino radiopachi.
I calcoli marroni sono radiotrasparenti mentre la maggior parte dei calcoli neri sono radiopachi.
La radiografia permette di individuare la colecisti porcellana per la presenza delle calcificazioni e la
presenza di aria nelle vie biliari (aerobilia).
• Ecografia
Oggi rappresenta l’esame fondamentale per la diagnosi della calcolosi biliare per l’elevatissima accuratezza
diagnostica (identifica accuratamente il 95% dei calcoli) e la mancanza di invasività.
Inoltre permette lo studio della morfologia delle caratteristiche di parete della colecisti e il controllo
contemporaneo anche del fegato, del pancreas e delle vie biliari.
Essendo un esame in tempo reale, permette di ricevere anche informazioni sulla motilità e la contrattilità
della colecisti stessa.
La mancata visualizzazione della colecisti in un paziente a digiuno è indice abbastanza sicuro di una malattia
di essa.
Non è limitata da ittero e gravidanza.
Permette di identificazione di calcoli di piccole dimensioni fino a 1 mm che appaiono come aree
iperecogene con cono d’ombra posteriore mobili con i cambiamenti di decubito.
Generalmente i calcoli della colecisti sono addossati alla parete posteriore della colecisti (paziente supino) o
più raramente galleggiano nella bile.
http://www.hackmed.org
[email protected]
82
Permette inoltre evidenziare il fango biliare: bile di ecogenicità paragonabile a quella del parenchima
epatico.
I calcoli delle vie biliari spesso hanno disposizione impilata in quanto il calcolo prossimale determina
ostruzione del dotto e stasi biliare a monte facilitando la formazione di nuovi calcoli.
Nella colecistite acuta permette di confermare la diagnosi clinica e di monitorare l’evoluzione.
Il limite consiste nell’impossibilità di visualizzare il coledoco terminale (retropancreatico e duodenale) per
la presenza di meteorismo, ma la dilatazione delle vie biliari a monte può suggerire la presenza di calcoli e
rendere necessario lo studio con colangiografia o alla colangio-RM.
• Colangio-RM
È in grado di evidenziare i calcoli in qualunque parte delle vie biliari, i quali appaiono nelle sequenze T1pesate come aree rotondeggianti o ovalari prive di segnale nel contesto della bile marcatamente iperintensa.
Il limite di risoluzione attuale è di 3 mm.
• Colecistografia orale:
Si basa sulla somministrazione orale la sera prima dell’esame di un mezzo di contrasto iodato che viene
escreto con la bile, permette di verificare la pervietà del dotto cistico e la funzione di svuotamento della
colecisti.
Se il dotto cistico è ostruito la colecisti non viene visualizzata (colecisti esclusa).
Permette inoltre di vedere i calcoli e verificare se sono calcifici.
Rispetto all’ecografia ha diversi svantaggi.
Infatti non da risultati attendibili se:
o Bilirubina > 3 mg/dl
o Impossibilità di ingerire compresse (disfagia)
o Escrezione epatica alterata
o Calcoli molto piccoli
La scarsa o mancata opacizzazione della colecisti può dipendere da fattori extrabiliari (ridotto assorbimento
del mezzo di contrasto per patologia intestinale o ridotta escrezione per patologia epatica) o cause biliari
incapacità della parete della colecisti di concentrare la bile o ostruzione del cistico (colecisti esclusa).
Assume importanza nella valutazione funzionale della colecisti, elemento indispensabile per l’instaurazione
di un trattamento litolitico con acidi biliari.
• Colecistografia funzionale:
Viene fatta con stimolazione farmacologica della contrazione della colecisti, è utile per la diagnosi di
discinesia
• colescintigrafia:
Si basa sulla somministrazione endovenosa di un composto marcato con Tc che viene escreto con la bile,
permette l’identificazione accurata dei calcoli e contemporanea valutazione delle condizioni dei dotti biliari.
• ERCP colangiopancreatografia retrograda per via endoscopica
È l’indagine più efficace e che permette anche il trattamento tramite papillotomia endoscopica, ma a causa
della sua invasività va utilizzata sono quando si ha già il sospetto di calcolosi della via biliare principale.
Si basa sulla introduzione in duodeno di un endoscopio a visione laterale ed incannulamento della papilla di
Vater, attraverso la cannula viene immesso un mezzo di contrasto che visualizza per via retrograda l’albero
biliare.
Le complicanze sono la pancreatite acuta e la colangite.
• Colangiografia percutanea transepatica (PTC)
Consiste nella puntura percutanea di un dotto biliare sulla linea ascellare media e nella introduzione di un
mezzo di contrasto su guida ecografia o radiografica.
Una volta visualizzato l’albero biliare è possibile il posizionamento di un drenaggio esterno allo scopo di
detenere l’albero biliare.
Terapia
Terapia litolitica orale
Si fa nelle forme asintomatiche.
Dal punto di vista medico, il presidio terapeutico principale è la dissoluzione con acido ursodeossicoloco
l’UDCA o acido chenodeossicolico che oltre che essere dotati di un effetto detergente diretto sul colesterolo
determinano anche la riduzione della formazione di colesterolo inibendo l’HMG-CoA riduttasi.
UDCA: 8-10 mg/Kg/die per os
Acido chenodeossicoico: 13-16 mg/Kg/die per os in 2 somministrazioni.
http://www.hackmed.org
[email protected]
83
Sono condizioni di necessità la composizione colesterolica dei calcoli (calcoli radiotrasparenti), calcoli di
dimensioni < 20 mm mobili e la normofunzionalità della colecisti valutabile tramite colescintigrafia.
La percentuale di dissoluzione dei calcoli varia dal 25% al 50% dopo 2 anni di terapia.
Gli effetti collaterali comprendono diarrea, aumento reversibile dei livelli delle transaminasi, la frequenza è
minore con acido ursodeossicolico rispetto all’acido chenodeossicolico.
La durata della terapia è di almeno 6 mesi.
Vi è necessità di terapia di mantenimento pena la recidiva in breve termine.
La terapia non è attuabile in caso di:
• Calcoli pigmentari o calcifici
• Calcoli di piccolo diametro
• Calcoli multipli
In genere la terapia litolitica viene utilizzata in combinazione con la ESWL.
Litolisi per contatto
Consiste nell’introduzione nella colecisti di agenti chimici (solventi da contatto) capaci di sciogliere i
calcoli quali monoctanoinato metilterbutiletere MTBE.
Viene usata soprattutto per il trattamento della litiasi residua dopo colecistectomia.
La sostanza viene introdotta tramite drenaggio posizionato in un precedente intervento o per cateterismo
transepatico o trasnpapillare endoscopico.
Il caso di calcoli calcificati al MTBE viene aggiunto l’EDTA.
La litolisi si può verificare dopo alcune ore o alcuni giorni in rapporto anche con le dimensioni ed il numero
dei calcoli.
Questa metodica è poco usata a causa dell’elevata incidenza degli effetti collaterali dovuti alla tossicità delle
sostanze usate.
È indicata solo in pazienti a rischio per intervento chirurgico.
Litotripsia extracorporea con onde d’urto ESWL
Tramite opportuni apparecchi vengono generate onde d’urto ad alta pressione che poi vengono concentrate in
un fuoco corrispondente al calcolo visualizzato tramite sonda ecografica.
Costituiscono criteri di inclusione nella ESWD:
• Dimensioni > 3 cm
• Numero
• Radiotrasparenza
• Buona funzione della colecisti
Sono invece controindicazioni:
• Colecistite acuta
• Ittero ostruttivo
• Coagulopatia
• Epatopatia cronica
• Gravidanza
La litotripsia biliare a differenza di quella renale non è però risolutiva in quanto i frammenti dei calcoli
vengono eliminati con difficoltà dalla colecisti per tale motivo è necessaria una terapia coadiuvante
litolitica orale o per contatto.
Terapia chirurgica
Si basa sulla asportazione della colecisti (colecistectomia) e sulla rimozione di eventuali calcoli nelle vie
biliari.
Prima dell’intervento chirurgico va esclusa la presenza di calcoli tramite ecografia o colangiografia
intraoperatoria.
Nella litiasi asintomatica l’intervento è consigliabile:
• paziente giovane in cui in futuro si potrebbero avere complicanze poiché la percentuale di rischio è
bassa con un intervento in elezione ed aumenta quando l’intervento viene fatto in urgenza
• pazienti a rischio di complicanze: diabetici ed immunodepressi
• pazienti che devono essere operati per altri motivi
La terapia chirurgica della litiasi sintomatica avviene con una vasta modalità di tempi a seconda
dell’urgenza con cui si presenta la malattia, dall’intervento in video laparoscopia in elezione, alla
laparotomia nel caso del paziente che ha una emergenza data da una complicazione.
Chirurgia convenzionale
http://www.hackmed.org
[email protected]
84
Il trattamento della colelitiasi si basa sulla colecistectomia per via laparotomica tramite laparotomia
sottocostale trasversa destra.
Eseguita in elezione è un intervento pressochè esente da rischi che non implica la necessità di drenaggi e non
comporta problemi di decorso postoperatorio.
Chirurgicamente, l’asportazione della colecisti (colecistectomia) profilattica nei confronti di complicazioni è
limitata al verificarsi di tre fattori:
• Sintomi frequenti e importanti che interferiscono con la vita del paziente
• Pregressa complicazione della malattia
• Concomitante condizione che aumenta il rischio di malattia o calcoli molto voluminosi
In genere l’età inferiore a 50 anni è un fattore che rende ragione della necessità di operare, ma non è una
regola.
In complesso però l’intervento sulla colecisti è decisamente favorevole, associato spesso a remissione
parziale o totale dei sintomi.
In altri casi, molto più rari, la recidiva dei sintomi può essere associata alla presenza di un dotto cistico
accessorio, maggiore di un cm, residuo, che si infiamma.
Questa condizione è nota come la sindrome del moncone del dotto cistico.
Per la colecistite acuta può essere indicata la colecistostomia attraverso cui si aspira il contenuto della
colecisti e si rimuovono i calcoli, quindi si posiziona un drenaggio con l’esterno.
Il trattamento della litiasi delle vie biliari si basa coledocolitotomia con accesso diretto alle vie biliari e
rimozione dei calcoli o sulla sfinteroplastica transduodenale indicata in caso di coesistenza di stenosi
biliare che si basa sull’accesso al coledoco per via duodenale, la sfinterotomia parziale della papilla e la
rimozione dei calcoli.
In caso di vie biliari eccessivamente dilatate, calcolosi multipla e stenosi della papilla si può fare una
derivazione biliodigestiva (coledocoduodenostomia, epaticodigiunostomia, epaticodiguinoduodenostomia)
che però è un intervento complesso gravato da elevata morbilità.
Chirurgia laparoscopica
La videolaparoscopia è una tecnica molto poco invasiva che permette un minor tempo di degenza, minor
complicazioni come l’ileo paralitico post operatorio, una incisione limitata e minor dolore.
In genere però è associata a maggior rischio di complicazioni come la perforazione del dotto cistico comune,
danneggiamento del coledoco e dissezione dell’arteria epatica destra nel triangolo di Charot.
In effetti le principali limitazioni solo la capacità di manovrare gli strumenti chirurgici e di effettuare le
riprese in 3D in modo che siano visibili facilmente.
L’intervento video deve essere senza esitazioni trasformato in una laparotomia convenzionale qual’ora si
presentino difficoltà di tipo anatomico o ci siano complicanze.
Unica complicanza non necessaria di conversione del tipo di intervento è la perforazione della colecisti in
corso di intervento, che può essere trattata in video con allungamento del tempo di intervento di circa 10
min, necessari ad asportare il materiale e a lavare il campo operatorio.
I vantaggi della colecistectomia laparoscopica sono:
• Riduzione del dolore postoperatorio
• Assenza dell’ileo paralitico
• Assenza delle complicanze chirurgiche
• Assenza della cicatrice laparotomica
• Minore tempo di degenza
Terapia endoscopica
In caso di litiasi delle vie biliari associata a stenosi della papilla si può fare la papillosfinterotomia
endoscopica.
Tramite un duodenoscopio a visione laterale viene individuata la papilla e eseguita una colangiografia
retrograda, tramite una sonda diatermia detta papillotomo introdotta nell’orifizio papillare viene effettuata la
sezione dello sfintere (papillosfinterotomia) dopo di che nella maggior parte dei casi i calcoli vengono
espulsi spontaneamente nel duodeno.
Altrimenti i calcoli vengono rimossi tramite una sonda a cestello o vengono frantumati mediante un
litotritore introdotto nel canale operatorio dell’endoscopio.
Le complicanze precoci sono pancreatite acuta, emorragia, perforazione e colangite.
Una complicanza tardiva è la stenosi della papilla.
Terapia delle complicanze della colelitiasi
http://www.hackmed.org
[email protected]
85
Si basa su quattro capisaldi:
• Digiuno con applicazione di sondino nasogastrico nei pazienti in shock o con pancreatite acuta
• Infusione endovenosa idrosalina, per correggere la volemia e lo scompenso elettrolitico
• Antibiotici a largo spettro (cefalosporine di III generazione)
• Terapia antalgica
Il riscontro di un quadro di peritonite o di colecistite acuta enfisematosa deve far subito propendere per
l’intervento chirurgico.
L’intervento chirurgico può essere effettuato in 3 condizioni:
1. urgenza immediata: nelle prime 24 ore
2. urgenza differita: dopo 48-72 ore
3. intervento a distanza: entro 1-6 mesi
l’intervallo di 24-48 ore permette di:
• raggiungere la certezza diagnostica
• riequilibrare le condizioni idroelettrolitiche
• migliorare il compenso cardiocircolatorio, metabolico, ematico, biochimico e respiratorio
vantaggi della colecistectomia in differita sono:
• riduzione del rischio di perforazione soprattutto nell’anziano
• riduzione del rischio di errori diagnostici e ricadute nel periodo di attesa
• la colecistectomia in fase infiammatoria è più agevole in quanto l’edema parietale ne facilita la
dissezione
Nel caso un paziente non possa essere operato in urgenza viene fatta una colecistostomia che permette di
decomprimere la colecisti e deferire l’intervento di 6-7 giorni.
NEOPLASIE DELLA COLECISTI E DELLE VIE BILIARI
Papillomi
Sono i tumori benigni più frequenti.
Solo quelli di dimensioni maggiori possono essere diagnosticati tramite ecografia e colangiografia e possono
determinare una sintomatologia di tipo colestasico.
Raramente si ha trasformazione maligna.
Carcinoma della colecisti
Nell’80% dei casi è costituito da un adenocarcinoma.
Colpisce soprattutto intorno ai 70 anni e predilige il sesso femminile.
È la più comune patologia neoplastica delle vie biliari.
Eziopatogenesi
Nel 70% dei casi si associa a calcolosi della colecisti.
La principale causa è la colelitiasi in quanto l’insulto meccanico ed irritativo cronico prodotto dai calcoli
soprattutto se di grosse dimensioni determina l’insorgenza sulla mucosa della colecisti di displasia e quindi
di degenerazione neoplasitica.
Altri fattori associati sono:
• Obesità
• Malattie e by-pass ileali
• Nitrosamine
• Esposizione a prodotti di industria della gomma, tessile e metallurgica
Anatomia patologica
Sono presenti 2 forme:
• Forma infiltrante: determina ispessimento e aumento di consistenza diffuso della parete della colecisti
(tumore scirroso) e si estende frequentemente al di là della sierosa
http://www.hackmed.org
[email protected]
86
•
Forma vegetante: cresce nel lume come massa a cavolfiore, la porzione luminale può essere necrotica
emorragica o ulcerata
La neoplasia insorge soprattutto nel fondo e nel colletto.
La maggior parte dei carcinomi è costituita da adenocarcinomi poco differenziati o addirittura indifferenziati.
Questa neoplasia è associata ad una prognosi gravissima.
L’aggressività della neoplasia sembra non essere correlata alle sue caratteristiche biologiche quanto piuttosto
ai rapporti topografici della colecisti.
L’assenza di una barriera peritoneale nei confronti del fegato e la vicinanza alle strutture dell’ilo epatico
infatti favoriscono la precoce diffusione della neoplasia.
Diffusione avviene per:
9 Via ematica: fegato (piccoli vasi portali al IV e V segmento, rami portali maggiori al V e VI)
9 Contiguità: fegato, vie biliari, stomaco, duodeno
9 Via linfatica: linfonodi cistici e linfonodi pericoledocici (N1), mesenterici superiori, pancreaticoduodenali, retroportali, celiaci, retroportali (N2), interaorto-cavali (N3)
9 Via peritoneale
Nel 20% dei casi al momento della diagnosi il tumore presenta metastasi distanza.
La prognosi non è buona: solo il 3% dei pazienti ha una sopravvivenza maggiore di 5 anni.
Clinica
Il quadro clinico è subdolo ed aspecifico e può confondersi con quello della colecistite cronica.
In fase precoce è asintomatica poi determina dolore ipocondriaco destro che si irradia al dorso, insorge
soprattutto durante le ore della notte, si associa a calo ponderale.
In fase tardiva ci sono i segni di infiltrazione locale e metastasi a distanza: ittero, ipertensione portale,
occlusione intestinale alta, colecistite acuta alitiasica (febbre, leucocitosi, dolore localizzato).
Diagnosi
All’E.O è possibile sentire la colecisti ingrandita.
Si può avere un segno di Murphy positivo.
Il CA 19.9 > 20 unità/ml ha una sensibilità del 79.4% ed una specificità del 79%.
• Ecografia evidenzia la presenza di una massa che protrude nel lume (forma vegetante) o un
ispessimento parietale irregolare con anomalie di profilo (forma infiltrante che entra in d.d. con la
colecistite cronica)
• Colangio-RM, ERCP o PTC possono dimostrare l’interessamento dei dotti biliari
• TC è importante per la stadiazione
Terapia
Stadio I: semplice colecistectomia.
Stadio II-II-IVa intervento radicale: colecistectomia allargata: colecistectomia + linfadenectomia regionale
+ resezione al cuneo del fegato nella fovea della colecisti.
Stadio IVb terapia palliativa per eliminare l’ittero ed il dolore: drenaggio biliare esterno o interno,
anastomosi bilio-digestive, radio-chemioterapia.
NEOPLASIE DELLE VIE BILIARI
colangiocarcinoma
La neoplasia delle cellule dell’epitelio biliare intra o extraepatico colpisce soprattutto fra la 5° e la 7°
decade.
Sono più frequenti nei maschi rispetto alle femmine.
Eziopatogenesi
Condizioni predisponenti sono :
• Infezioni biliari croniche e flogosi duttali
• Stasi cronica delle vie biliari
• Infiammazioni croniche
• calcolosi
• Malattie congenite con dilatazione delle vie biliari (malattia di Carioli, fegato policistico e fibrosi
epatica congenita, in particolare la malgiunzione coledoco-pancreatica che comporta reflusso di succo
pancreatico nelle vie biliari)
http://www.hackmed.org
[email protected]
87
• Cisti biliari congenite
• Sfinterotomia transduodenale che comporta reflusso di succo enterico nella via biliare
• Cancerogeni (radon, nitrosamine, diossina, asbesto)
• Adenomi se diametro > 1 cm
• malattie autoimmuni: RCU, colangite sclerosante primitiva, cirrosi biliare primitiva
Questi fattori agiscono inducendo infiammazione cronica e colestasi e che aumenta il tempo di contatto di
eventuali cancerogeni con la mucosa.
L’insorgenza del carcinoma può essere preceduta dalla formazione di un adenoma.
Anatomia patologica
I colangiocarcinomi sono adenocarcinomi più o meno differenziati, in genere sono costituiti da uno stroma
fibroso abbondante (sclerosanti o desmoplastica).
Può esservi produzione di mucina che si deposita all’interno del lume tubulare, mai di bile.
Non vi è produzione di AFP.
Nella maggior parte insorgono in periferia ma a volte possono insorgere anche in sede ilare con produzione
di ittero ostruttivo.
Il carcinoma delle vie biliari si manifesta in 3 forme:
• Nodulare: nodulo solido e grigiastro nello spessore della parete duttale
• Papillare o polipoide è la forma più benigna e più facilmente resecabile
• Infiltrante sclerosante la più frequente soprattutto a livello dell’ilo
Nella stragrande maggioranza dei casi si tratta di un adenocarcinoma.
Il carcinoma ampollare appare come una massa emisferica a sviluppo endo o esocavitario.
La mucosa duodenale sovrastante è in genere intatta ma può presentare ulcerazioni.
In base ad una classificazione topografica (classificazione di Bismuth-Corlette) possiamo distinguere:
¾ Tipo I tumore confinato al dotto epatico comune
¾ Tipo II tumore della biforcazione
¾ Tipo III tumore della biforcazione con estensione al dotto epatico sinistro al destro o ad entrambi
¾ Tipo IV multifocale
Oppure:
¾ Tumori del tratto superiore che interessano l’ilo e penetranti nel fegato 40-60%
¾ Tumori del tratto medio che interessano l’epatico comune, la zona epatocisticocoledocica e il coledoco
fino al margine superiore del pancreas 30%
¾ Tumori del tratto inferiore che comprendono il coledoco retropancreatico e quello terminale 30%
¾ Multifocali 10%
I tumori che insorgono nella parte del coledoco compresa tra la giunzione del dotto cistico e la confluenza
dei dotti epatici destro e sinistro, a livello dell’lio epatico, vengono detti tumori di Klatskin e sono
caratterizzati da crescita lenta, caratteristiche sclerosanti e rarità di metastasi.
È un tumore a crescita lenta.
I tumori delle vie biliari hanno scarsa tendenza a dare metastasi per via ematica mentre più spesso
diffondono localmente lungo la parete della via biliare ed alle strutture circostanti e danno metastasi
linfatica.
La diffusione sottomuocosa periduttale è in genere 2 cm cranialmente e 1 cm distalmente al segmento biliare
interessato dalla neoplasia macroscopica.
Il lobo caudato è la sede più frequente di metastatizzazione epatica per questo motivo va asportato
nell’intervento chirurgico.
La via biliare è importante per il trofismo epatico per cui una sua ostruzione può determinare atrofia del lobo
epatico drenato e ipertrofia compensatoria del controlaterale.
Il fenomeno è più accentuato se viene anche infiltrato il corrispettivo ramo portale.
Clinica
Sintomi precoci:
¾ Epigastrialgie
¾ Calo ponderale
¾ Prurito
Quadro conclamato:
¾ Sindrome colestasica ad insorgenza acuta, veloce ed in assenza di colica biliare: ittero ostruttivo
ingravescente colestasico associato a malassorbimento, feci ipocoliche e urine ipercromiche e prurito.
http://www.hackmed.org
[email protected]
88
La bilirubina raggiunge presto valori maggiori di 15-18 mg/dl. L’ittero può essere intermittente nelle
forme papillari perchè si verifica necrosi del tumore con ricanalizzazione o una occlusione duttale con
meccanismo a valvola
¾ Bradicardia per presenza dei sali biliari in circolo
¾ Dolore localizzato all’ipocondrio destro
¾ colangiti o epatocolangiti
¾ Perdita di peso, astenia e febbre
¾ Emobilia (fistole biliari)
NB: nei carcinomi del terzo medio-distale in fase avanzata è presente il segno di Couvasier-Terrier =
colecisti distesa e palpabile (a margini netti, che si sposta con il respiro, consistenza duro-elastica), in
presenza di ittero ostruttivo.
È importante la diagnosi differenziale con la calcolosi della via biliare principale:
tumore delle vie biliari
Ittero ad inizio subdolo e progressivo in assenza di
dolore
Frequente positività del segno di Courvasier-Terrier
Febbre non frequente
Rapido calo ponderale
Calcolosi delle vie biliari
Ittero a brusca insorgenza accompagnato da colica
Raro segno di C.T.
Calo ponderale meno rapido
Diagnosi
Le indagini di laboratorio mettono in evidenza gli indici di colestasi.
Indagini strumentali sono rappresentate da:
• ERCP che è l’esame fondamentale che permette anche di fare la biopsia è caratterizzata da un aspetto
mozzato delle vie biliari extraepatiche (poichè il mezzo di contrasto non penetra nei dotti ostruiti) e da
un aspetto a spirale del dotto cistico
• PTC
• Colangio-RM dimostra un difetto di riempimento nel contesto di un dotto di calibro ridotto, possiede
una elevata specificità, è un esame costoso
• Ecografia che però non è in grado di evidenziare le neoplasie della papilla di Vater
• TC che evidenzia l’ostruzione delle vie biliari con dilatazione a monte
Terapia
L’unico tipo di terapia curativa è l’intervento chirurgico.
Valutazione preoperatoria:
9 condizioni generali del paziente
9 estensione
9 invasione vascolare in particolare la vena porta
9 atrofia epatica lobare
9 malattia metastatica
pazienti candidati all’intervento chirurgico:
9 buone condizioni generali
9 assenza di metastasi
9 tumori ilari con o senza infiltrazione di uno dei 2 epatici
9 tumori ilari con infiltrazione di uno dei 2 dotti epatici e con atrofia del lobo epatico dello stesso lato
9 tumori ilari che infiltrano uno dei 2 epatici con infiltrazione del ramo portale ipsilaterale
l’intervento chirurgico deve essere radicale, spesso è necessaria l’asportazione del lobo caudato e della
porzione di parenchima epatico corrispondente al tratto biliare infiltrato.
- Tumori del tratto inferiore: duodenocefalopancreasectomia
- Tumori del tratto medio: exeresi segmentaria della via biliare con linfadenectomia
- Tumori del tratto superiore: resezione della via biliare + resezione epatica
Nei pazienti inoperabili è indicato il drenaggio biliare esterno o interno palliativo:
1. chirurgico
2. endoscopico
3. percutaneo transepatico
o fare un intervento di epatico-digiunostomia.
http://www.hackmed.org
[email protected]
89
Altre condizioni patologiche della colecisti
DISFUNZIONE E STENOSI DELLA PAPILLA
La stenosi papillare è spesso la conseguenza di una alterazione infiammatoria della papilla di Vater, o di una
iperplasia ghiandolare del segmento papillare.
Ci sono 5 criteri diagnostici:
1. Dolore addominale ai quadranti superiori
2. Alterazione degli indici epatici
3. Dilatazione del cistico dimostrata mediante CPRE
4. Rallentamento del deflusso del mezzo di contrasto dal dotto maggiore di 45 minuti
5. Aumento della pressione basale dello sfintere di Oddi
Di solito si ricorre alla sfinteroplastica endoscopica, ma in condizioni più gravi ci può essere indicazione di
papillotomia.
COLECISTITI IPERPLASICHE
Gruppo di colecistopatie caratterizzate dalla proliferazione abnorme dei normali componenti tissutali.
Fra queste esistono l’adenomiomatosi, che è una proliferazione benigna dell’epitelio superficiale della
colecisti, e la colesterolosi, che è un abnorme deposito di colesterolo nella lamina propria della colecisti.
Nella forma diffusa di questa malattia, essa appare rossa edematosa con punteggiature gialle (colecisti a
fragola). Invece nella forma localizzata gli accumuli di colesterolo formano dei depositi detti polipi di
colesterolo. In circa la metà dei casi sono presenti calcoli di colesterolo.
anomalie congenite dei dotti biliari
CISTI DEL COLEDOCO
dilatazione della porzione cistica della porzione libera oppure presentarsi come diverticolo, nel qual caso si
accompagna a reflusso cronico di succo pancreatico del coledoco, con conseguente colangite ed ostruzione
biliare.
La triade costituita da dolore, ittero e massa addominale è presentata solo da un terzo dei pazienti.
Aumento del rischio di sviluppare colangiocarcinoma.
ECTASIA BILIARE CONGENITA
dilatazione congenita dei dotti principali intraepatici (malattia di Caroli) o i dotti inter- ed intralobulari
(fibrosi epatica congenita) oppure entrambi contemporaneamente.
C’è colangite ricorrente, con raccolte ascessuali all’interno e all’esterno dei dotti interessati, a volte anche
formazioni di calcoli.
Di solito viene instaurata una terapia antibiotica.
MALATTIE DEL PANCREAS
Il pancreas secerne da 1500 a 3000 ml/die di succo pancreatico che è un liquido alcalino a pH > 8
contenente fino a 20 tipi diversi di enzimi e zimogeni, la maggiore parte dei quali indispensabili per la
digestione.
La secrezione è sotto stretto controllo neuro-ormonale.
http://www.hackmed.org
[email protected]
90
La secrezione acida gastrica costituisce lo stimolo alla liberazione di secretina quando il PH duodenale
scende sotto 4,5.
La secretina a sua volta stimola la secrezione di acqua ed elettroliti da parte del pancreas.
La liberazione di CCK al livello duodeno-digiunale indotta da acidi grassi a lunga catena, aminoacidi
essenziali e dallo stesso acido stimola invece la secrezione zimogenica.
Anche gli acidi biliari stimolano la secrezione pancreatica, così come il NO sebbene il suo meccanismo non
sia riconosciuto.
La somatostatina invece inibisce la secrezione.
Lo ione più importante secreto con il succo pancreatico è il bicarbonato prodotto a livello degli acini e dei
dotti preterminali sotto stimolo della secretina, il bicarbonato serve a tamponare l’acido gastrico, poiché gli
enzimi pancreatici funzionano a pH alcalino.
Le classi di enzimi secreti sono:
e. amilolitici (amilasi pancreatica): idrolizzano gli amidi in oligosaccaridi e nel disaccaride maltosio.
e. lipolitici (lipasi, fosfolipasi A e colesterolo esterasi): questi sono secreti insieme alla colipasi che
impedisce l’inibizione della lipasi da parte dei sali biliari
e. proteolitici (rappresentati da endopeptidasi – tripsina e chimotripsina ed esopeptidasi –
carbossi/amino peptidasi, oltre a elastasi e ribonucleasi)
meccanismi di difesa contro l’autodigestione enzimatica
z compartimentalizzazione degli enzimi in granuli isolati da membrane fosfolipidiche
z presenza degli enzimi in forma di precursori inattivi (zimogeni)
z polarità metabolica dai vasi verso i capillari
z presenza di inibitori endogeni delle proteasi (PTSI, alfa2-macroglobulina, alfa1-antitripsina) che
unendosi alle proteasi creerebbero dei complessi macromolecolari eliminati dal sistema RE
La secrezione esocrina sembra richiedere la presenza locale dell’insulina ed è almeno in parte controllata da
un meccanismo a feedback negativo indotto dalla presenza di proteasi seriniche nel duodeno oppure
feedback positivo indotto da aminoacidi essenziali o da inibitori delle proteasi.
Pancreatite acuta
è una flogosi a genesi multifattoriale scatenata da una attivazione enzimatica intrapancreatica che si
manifesta essenzialmente con dolore acuto e aumento degli enzimi pancreatici nel siero e nelle urine.
L’incidenza in Europa è di circa 10/10.000 con un rapporto M:F = 9:1, fa eccezione la pancreatite acuta di
origine biliare che predilige il sesso femminile, dovuto alla maggiore prevalenza di litiasi biliare nelle
donne.
Lo spettro anatomopatologico comprende tre forme:
1. lieve o edematosa: 95% senza coinvolgimento sistemico e a risoluzione spontanea
2. severa o necrotico-emorragica con coinvolgimento sistemico (SIRS)
3. necrosi infetta
secondo anatomia patologica:
1. semplice o sierosa
2. purulenta
3. necrotico-emorragica o necrosi pancreatica acuta
in base all’andamento clinico si possono distinguere 2 forme:
1. acuta
2. acuta recidivante o ricorrente che presenta recidive dopo qualche anno
Eziologia
L’elenco dei fattori di rischio è abbastanza lungo ed è continuamente aggiornato:
• Etilismo acuto e cronico
• Colelitiasi
• Pancreatite acuta iatrogena dovuta ad interventi chirurgici o endoscopici sul pancreas o su organi
limitrofi che determinano un danno al sistema duttale o alla vascolarizzazione dell’organo (ERCP,
sfinterotomia chirurgica, agobiopsia pancreatica)
• Pancreatite acuta post-traumatica dovuta a lesione del sistema duttale
http://www.hackmed.org
[email protected]
91
• Cause metaboliche (Ipercalcemia per deposizione di sali di calcio nel parenchima pancreatico,
Insufficienza renale)
• Infezioni (Parotite, Epatiti virali, CMV, Coxsackie, Echovirus, Mycoplasma, Campylobacter, M.
Avium)
• Da farmaci (associazione ben definita con Azatioprina, 6 – Mercaptopurina, diuretici tiazidici,
Furosemide, sulfonamide, pentamidina, procainamide, Estrogeni, Tetracicline, cortisonici)
• Cause vascolari (ipoperfusione ischemica, emboli aterosclerotici), vasculiti (PAN, LES, porpora di
S.H.) e shock
• Dislipidemia (associata ad alcolismo o iperchilomicronemia fenotipo I associata a deficit di LPL o apoCII poichè i chilomicroni vengono catabolizzati dalla lipasi pancreatica con liberazione di NEFA ad
azione tossica)
• Ulcera peptica penetrante
• Ostruzione della papilla di Vater (enterite regionale, diverticolo duodenale paravateriano, carcinoma
del pancreas o della papilla) che determinano ipertensione duttale
• Malformazioni congenite (pancreas divisum = mancata fusione dei 2 abbozzi embrionari: ventrale
drenato dal Wirsung e dorsale drenato dal Santorini)
• Patologia occulta delle vie biliari (microlitiasi = calcoli <3 mm, sabbia biliare)
• Disfunzione dello sfintere di Oddi
• Fibrosi cistica
• Forme genetiche familiari dovute ad alterazione del tripsinogeno che diventa più facilmente attivabile
predisponendo a pancreatiti acute ricorrenti
La pancreatite da causa sconosciuta viene definita criptogenetica.
In generale quindi possiamo suddividere le cause di pancreatite acuta in:
1. litiasi biliare 32%
2. alcolismo 20%
3. miscellanea 29%
4. idiopatica o criptogenetica 18%
in realtà circa l’80% delle forme criptogenetiche sono dovute a microlitiasi.
La diagnosi eziologica è fondamentale perché su di essa si basa la terapia e la prevenzione delle recidive.
eziopatogenesi
Pancreatite acuta semplice
È una forma benigna a decorso autolimitante che però può evolvere nella forma acuta emorragica.
Le cause sono:
• Infezione virale (parotite)
• Intossicazioni generali
• Flogosi dell’apparato GI
È presente edema pancreatico senza la presenza di fenomeni digestivi, il pancreas si presenta tumefatto e di
volume aumentato.
Pancreatite acuta purulenta
È associata ad infezioni batteriche che pervengono al pancreas per via ematogena, per contiguità o per via
canalicolare ascendente.
Si ha distruzione del parenchima pancreatico che può determinare la diffusione dell’infezione alle zone
contigue.
Pancreatite acuta emorragica
È determinata dall’autodigestione si innesca per l’attivazione intrapancreatica dei proenzimi a causa di
numerosi fattori (come tossine batteriche, virus, ischemia, anossia e traumi diretti).
L’attivazione enzimatica determina:
• Necrosi del parenchima pancreatico
• Necrosi del tessuto adiposo (steatonecrosi)
• Emorragia intrapancreatica e peripancreatica per rottura dei vasi
Inizialmente si ha attivazione della tripsina e di seguito con un meccanismo a cascata l’attivazione degli altri
enzimi che determinano denaturazione delle proteine pancreatiche:
• Fosfolipasi A che determina la distruzione delle membrane cellulari e la trasformazione dei
trigliceridi in acidi grassi e della lecitina in lisolecitina tossica per le cellule
http://www.hackmed.org
[email protected]
92
•
Elastasi distruzione delle fibre elastiche dei vasi con conseguente emorragia e dei dotti con
liberazione del secreto pancreatico
• Trasformazione della precallicreina in callicreina con conseguente trasformazione di chininogeno in
bradichinina e callidina, sostanze ad azione vasoattiva che insieme all’istamina liberata in corso di
infiammazione determinano vasodilatazione ed incremento della permeabilità vascolare che sono
responsabili del sequestro di liquidi e dello shock
• Fattore di Hageman che determina attivazione della coagulazione e del complemento
L’autodigestione determina inoltre formazione di radicali liberi.
La trasformazione della pancreatite edematosa in pancreatite necrotico-emorragica è dovuta quindi
essenzialmente all’azione di sostanze vasoattive, richiamo di PMN e produzione di citochine (i nuovi farmaci
infatti cercano di agire riducendo la formazione di citochine).
Ost r uzione dir etta
Micr olit iasi
Migr azione del cal col o
sul l a papill a
Ost r uzione indir etta
(edema e f ibr osi da inf iammazione)
Ost r uzione
al f l usso
Cal col osi
Disf unsione di oddi
Incontinenza del l ’
oddi
Al cool
Al ter azione metabol ismo l ipidico
Aument o pr oteasi
Cal o inibitor i
aument o r adical i l iber i
Ref l usso
duodeno
pancr eatico
Steat osi
Danno pancr eatico
acuto
Pancr eatite acuta
Abuso acuto di
al cool e l ipidi
meccanismi patogenetici sono essenzialmente di tipo ostruttivo, tossico o infettivo e sono legati a diversi
fenomeni:
1. ostruzione duttale del drenaggio biliare, pancreatico o di entrambi da litiasi (incuneazione del
calcolo nell’ampolla) o alcolismo:
z Reflusso di bile in grado di favorire grazie all’azione detergente dei sali biliari e della lisolecitina
(ottenuta dalla trasformazione della lecitina della bile ad opera dei sali biliari) la solubilizzazione delle
membrane
Un calcolo può occludere transitoriamente la papilla determinando una pancreatite acuta che si risolve nel
momento in cui questo migra nel duodeno.
Il ripetersi di migrazione del calcolo può dare luogo ad una pancreatite acuta ricorrente.
La migrazione può essere innescata da un pasto abbondante che stimola contemporaneamente la secrezione
pancreatica tramite la secretina e la contrazione della colecisti tramite la colecistochinina.
z Reflusso del contenuto duodenale in grado di aggiungere oltre agli effetti della componente biliare
l’attivazione degli enzimi pancreatici ad opera dell’enterochinasi (per un danno anatomico della papilla
dovuto al pregresso passaggio di un calcolo)
z Ristagno di secreto pancreatico con aumento della pressione intracanalicolare e retrodiffusione dei
secreti dai canalicoli al parenchima (dovuto a inversione della polarità delle cellule), dovuto
all’ipertensione duttale pancreatica determinata da calcoli o microcalcoli o da una papillite stenosante o
http://www.hackmed.org
z
a.
b.
c.
d.
[email protected]
93
anche una alterazione di tipo spastico dello sfintere di Oddi (da irritazione cronica dovuta al passaggio di
calcoli)
Danno indotto dall’alcol:
alterazione del metabolismo lipidico (iperlipemia, alterazione dei fosfolipidi)
incremento della componente enzimatica del succo pancreatico a causa dell’incremento di secretina,
che determina la formazione di tappi proteici
riduzione degli inibitori delle proteasi
aumento del tono dello sfintere di Oddi (spasmo), dopo continua stimolazione si osserva
incompetenza e quindi reflusso (il fattore meccanico scatenante)
2. danno diretto alle cellule acinose (virus, tossici, trauma, endotossine, ischemia, alcol) che
determina necrosi cellulare con incremento della permeabilità cellulare o lesione della membrana che
determina la fuoriuscita degli enzimi dalle cellule
3. Deficit del sistema fisiologico degli inibitori della tripsina da iperconsumo, alterata sintesi o turbe
vascolari distrettuali
4. Danno cellulare diretto provocato da traumatismi o tossici (alcol) che può aumentare la
permeabilità cellulare o ledere le membrane determinando la fuoriuscita degli enzimi dalle cellule
5. alterazione del trasporto intracellulare degli enzimi digestivi con fusione tra granuli zimogeni ed
idrolasi lisosomali nel citoplasma
6. Danno parenchimale indotto dai NEFA ad azione tossica che si sviluppano dai trigliceridi ad opera
della lipasi (dislipidemia) che si legano al calcio con formazione di saponi insolubili che precipitano
(saponificazione) e sono responsabili della steatonecrosi
7. ipercalcemia che determina incremento del Ca nel succo pancreatico il quale causa attivazione della
tripsina e formazione di calcoli intraduttali
Fase di innesco
Fase conclamata
Attivaz. tripsina
Acidosi,
degranulazione
PMN e mastociti
Edema ed
emorragia
Lesioni vascolari
Attiv.complemento
Lisi membrane
cellulari
Liberaz. ed attivaz. Di
tutti i sistemi enzimatici
Chimotripsinogeno
Procarbossipeptidasi
Proelastasi
profosfolipasi
Effetti sistemici
Anatomia patologica
La necrosi può essere a focolaio unico o a focolai multipli o diffusa.
Nella fase iniziale il pancreas si presenta rigonfio ed edematoso con iperemia che talvolta è mascherata
dall’edema che comprime i vasi, la consistenza è aumentata.
http://www.hackmed.org
[email protected]
94
In fase conclamata il pancreas appare aumentato di volume con aspetto variegato a carta geografica:
• aree bianco-grigiastre di necrosi proteolitica
• aree rosso brunastre emorragiche
• aree bianco-giallastre piccole e rotondeggianti simili a gocce di cera (o macchie di calce) di
steatonecrosi
focolai di steatonecrosi possono essere presenti ovunque vi siano depositi di tessuto adiposo come
nell’omento, nel mesentere intestinale, nel tessuto retroperitoneale.
La cavità peritoneale contiene un liquido sieroso torbido in cui galleggiano lobuli di grasso (ascite a brodo
di pollo) mentre in fase tardiva si ha una peritonite suppurativa a causa dell’azione irritante degli enzimi
pancreatici e del passaggio di batteri attraverso la parete intestinale.
Quando prevalgono le lesioni vascolari il pancreas si può presentare con un vero e proprio infarcimento
emorragico ed ematoma peripancreatico con il quadro della pancreatite emorragica.
Quando invece prevale la necrosi parenchimale e adiposa si ha il quadro della pancreatite necroticoemorragica.
Si possono verificare raccolte ematiche o flogistiche a livello del retroperitoneo, della retrocavità degli
epiploon o del peritoneo.
Clinica
È fondamentale la diagnosi precoce della forma edematosa che precede sempre la forma necroticoemorragica.
• Dolore addominale: sintomo di gran lunga + importante, di intensità estremamente variabile, ad esordio
improvviso (spesso compare dopo pasti abbondanti o abuso di alcol) in genere comunque continuo e
fastidioso, localizzato in regione epigastrica e periombelicale, con ampia irradiazione ampia fino al
dorso (dolore a cintura) e ai fianchi (dolore a sbarra). Tale dolore è accentuato in posizione supina e
alleviato dalla posizione a canna di fucile con le ginocchia flesse sul tronco.
• Nausea, vomito inizialmente riflesso di tipo alimentare poi da ileo paralitico cioè biliare o enterico
• Segni dovuti alla peritonite sono presenti in fase avanzata: ileo paralitico, addome disteso, scarsamente
trattabile, dolente alla palpazione, iperestesia cutanea e contrattura di difesa della parete addominale di
grado variabile
• Ansia, febbricola, tachicardia e ipotensione fino ad arrivare talvolta allo shock che può dipendere da:
¾Ipovolemia secondaria a massiccia essudazione di liquidi e proteine nello spazio retroperitoneale
¾Vasodilatazione da aumentato rilascio di chinine vasoattive
¾Effetti degli enzimi in circolo
• Ittero ostruttivo: quando presente è legato alla compressione delle vie biliari da parte dell’edema
pancreatico o da una raccolta necrotico-emorragica cefalica o dalla presenza di una litiasi biliare che ha
innescato la pancreatite (pancreatite biliare)
• Massa addominale palpabile e ascite che sono eventuali segni tardivi
• Noduli eritematosi sottocutanei dovuti alla steatonecrosi peripancreatica: saponificazione dei grassi
prodotta dalla lipasi sulle cellule adipose
• Ematemesi e melena o emoperitoneo dovute a lesioni dei vasi causate dall’azione dell’elastina
• Segno di Cullen: colorazione brunastra dell’area periombelicale (emoperitoneo)
• Segno di Turner: colorazione blu-rosso o marrone-verdastra dei fianchi dipendente da catabolismo
locale dell’emoglobina, come negli ematomi contusivi.
Gli ultimi 2 segni sono espressione di uno stravaso ematico proveniente dal retroperitoneo e indicano una
grave pancreatite necrotizzante.
La triade sintomatologica caratteristica della forma più grave è data da dolore, nausea e shock.
Il decorso della pancreatite acuta in genere è caratterizzato da una fase di 1-2 settimane dominata da
fenomeni enzimatici e tossici che può concludersi come avviene nell’80% dei casi con una risoluzione
clinica ed anatomica (restitutio ad integrum) o esitare in pseudocisti.
Se si verifica estensione dei focolai di necrosi o infezione si instaura una seconda fase dominata da fenomeni
settici e da ulteriori complicazioni.
Se non insorgono complicazioni le lesioni necrotiche si risolvono con una fibrosi cicatriziale più o meno
estesa in rapporto all’entità della necrosi che solitamente però non comporta deficit funzionali esocrini o
endocrini per cui si può parlare di guarigione completa.
http://www.hackmed.org
[email protected]
95
In alcuni casi dopo una completa risoluzione possono verificarsi ulteriori episodi anche a distanza di mesi
più o meno gravi rispetto a quello di partenza che mantengono sempre le caratteristiche cliniche ed
anatomopatologiche della pancreatite acuta (pancreatite ricorrente).
diagnosi
La diagnosi viene generalmente posta in base a un movimento delle amilasi sieriche al di sopra di 2 – 3 volte
i valori normali.
le amilasi però non sono enzimi specifici pancreatici essendo presenti numerosi isoenzimi di diversa origine.
Si può avere un rialzo delle amilasi anche in altre patologie di interesse chirurgico quali colecistite acuta,
ulcera peptica perforata, occlusione intestinale e infarto intestinale.
Essendo più sensibili che specifiche le amilasi sono più utili ad escludere la eventuale presenza di
pancreatite quando negative piuttosto che a diagnosticarla quando positive.
All’amilasemia è utile associare il dosaggio dell’isoamilasi pancreatica che è invece specifica, ma tale
determinazione che viene effettuata con tecniche elettroforetiche o immunoelettroforetiche richiede tempi
tecnici assai lunghi e quindi non può essere utilizzata in urgenza.
Anche aumenti dell’amilasi nei versamenti ascitici e pleurici sono diagnostici.
Anche se il rialzo è costante l’entità del rialzo non è correlata direttamente all’entità del danno pancreatico e
dopo 2-6 giorni dall’esordio clinico i valori tendono a ritornare nella norma anche se persistono i sintomi –
segni clinici.
I pazienti con acidosi (quindi ad es. i diabetici in chetoacidosi) possono presentare un rialzo fittizio della
amilasi, per cui è di supporto un dosaggio delle lipasi sieriche che aumentano parallelamente alle amilasi e
comunque già di per sé sono diagnostiche in pazienti con iperamilasemia da cause extrapancreatiche.
L’incremento delle lipasi è più tardivo lento e graduale rispetto a quello delle amilasi e persiste fino a 2
settimane dopo l’evento acuto.
Il loro valore diagnostico è quindi importante nelle fasi tardive della malattia consentendo di diagnosticare
anche episodi modesti di pancreatite acuta giunti tardivamente all’osservazione medica o di seguire il
decorso della malattia anche dopo risoluzione del quadro clinico.
Importante è anche l’amilasuria cioè il dosaggio delle amilasi nelle urine delle 24 ore.
La comparsa dell’amilasi nell’urina è più tardiva e la sua normalizzazione più graduale, inoltre l’amilasuria è
sempre presente anche in caso di lieve iperamilasemia.
L’amilasuria è particolarmente significativa in quanto positiva anche in caso di amilasemia di modesta entità
o in fase di risoluzione della malattia.
Dopo una pancreatite acuta la clearence dell’amilasi è maggiore di quella della creatinina, esiste un indice
per valutare il rapporto fra amilasuria e clearence renale cioè:
Amilasuria creatinemia
×
× 100 . Se questo
amilasemia creatinuria
valore è < 3, non si tratta di patologia pancreatica, fra 3 e 5 è incerto, oltre a 5 è sicuramente pancreatica.
Può essere valutata anche la tripsinemia cioè la determinazione sierica della tripsina che non è molto
sensibile a causa della presenza degli inibitori plasmatici.
La leucocitosi neutrofila (15 – 20000) è molto frequente ed è proporzionale all’andamento del quadro
clinico ed alla eventuale infezione.
È presente anche incremento della VES e consumo del complemento e dell’alfa-2-macroglobulina.
Nei casi più gravi si può avere emoconcentrazione per perdita massiva di plasma nella cavità peritoneale o
nello spazio retropancreatico.
L’iperglicemia è molto frequente e dipende sia da un diminuito rilascio di insulina che dalla secrezione di
ormoni iperglicemizzanti “da stress”quali le catecolamine.
Nel 25% dei casi si ha ipocalcemia dovuta a fenomeni di saponificazione del calcio da parte degli acidi
grassi liberati dai fenomeni di steatonecrosi.
Un’ipertrigliceridemia si osserva nel 10-20% dei casi e in tal caso i livelli di amilasi sono falsamente
normali, mentre nel 25% troviamo ipossiemia, che può rappresentare l’esordio di una ARDS, e uno
slivellamento S-T.
L’emogasanalisi può evidenziare un incremento della pCO2 e una riduzione della pO2 con acidosi
respiratoria.
Può essere presente anche iperbilirubinemia nel 20-30% dei casi dovuta a compressione del coledoco
intrapancreatico per edema marcato o raccolte necrotiche cefaliche o alla presenza di litiasi biliare
(pancreatite biliare).
http://www.hackmed.org
[email protected]
96
Il dosaggio della proteina C reattiva è importante per la diagnosi differenziale tra una pancreatite acuta
emorragica in cui i valori sono elevati ma non superano i 100mg/l e una pancreatite acuta necrotico
emorragica in cui superano i 100 mg/l.
Indagini di laboratorio utili per la diagnosi di pancreatite acuta
z Amilasi sieriche
z Isoamilasi P e S
z Lipasi
z Amilasi urinarie
z Clereance amilasi/clereance creatinina
z Disturbi elettrolitici (riduzione Ca, K, Na)
z Azotemia e creatinemia
z Ematocrito
z Indici di colestasi in caso di pancreatite di origine biliare
z Proteina C reattiva, LDH, α2-macroglobulina
La diagnostica per immagini serve a confermare la diagnosi, differenziare le forme edematose da quelle
necrotico-emorragiche, valutare l’entità del danno parenchimale, identificare l’entità delle raccolte
flogistiche ed ematiche extrapancreatiche (nel retroperitoneo, nella retrocavità degli epiploon o nel
peritoneo).
La Rx diretta dell’addome è scarsamente specifico ma importante per la diagnosi differenziale con altre
patologie.
È presente un ileo funzionale localizzato al quadrante superiore sinistro o alla parte centrale dell’addome
(anse sentinella dovute alla distensione delle prime anse digiunali e del colon trasverso con brusca
interruzione a livello della regione paravertebrale sinistra).
Vi è aumento relativo della radiopacità in corrispondenza della loggia pancreatica indicativa di edema del
pancreas.
Possono essere presenti calcificazioni nella loggia pancreatica indicative di flogosi pancreatica cronica o
calcoli nell’ipocondrio destro (pancreatite biliare).
In caso di estensione extraghiandolare del processo infiammatorio in sede retroperitoneale si verifica
scomparsa o scarsa definizione dei profili dei reni o dei muscoli psoas.
L’Rx addome inoltre identifica l’ascesso o la cisti peripancreatica.
L’Rx torace può evidenziare la presenza di sequele toraciche della malattia quali il versamento pleurico
basale con addensamento parenchimale nei campi polmonari inferiori, più frequente a sinistra.
La sommistrazione di m.d.c. idrosolubile per os in fase acuta può dimostrare: distensione del duodeno con
pliche ispessite e impronta della testa del pancreas ingrandita, segno del 3 invertito per edema della papilla,
prolungato ristagno del m.d.c. in duodeno, impronta sulla parete gastrica posteriore.
L’ecografia ha un ruolo limitato nella diagnosi di pancreatite acuta per la difficoltà di valutazione del viscere
a causa dell’abbondante meteorismo intestinale, inoltre non definisce con esattezza le vie di diffusione delle
raccolte flogistiche.
Se il pancreas è visualizzabile l’ecografia è in grado di distinguere tra pancreatite edematosa e necroticoemorragica.
In caso di pancreatite edematosa evidenzia un incremento volumetrico della ghiandola con ipoecogenicità
omogenea parenchimale per effetto dell’edema a contorni netti.
In caso di pancreatite necrotico-emorragica invece evidenzia un aumento non uniforme di volume, aree
marcatamente ipoecogene e disomogenee che corrispondono ad eventuali aree necrotico-emorragiche o
focolai colliquati (ecostruttura disomogenea), contorni irregolari, raccolte liquide peripancreatiche.
L’ecografia è accurata nella valutazione di una eventuale calcolosi biliare e di versamenti liquidi
intraperitoneali.
È inoltre di estrema utilità nel monitoraggio nel tempo della patologia e delle sue eventuali complicanze.
La TC è la tecnica più importante nel sospetto di pancreatite acuta: differenzia con certezza le forma
edematose da quelle necrotico-emorragiche, valuta con precisione le aree di colliquazione del viscere, stima
la porzione di parenchima pancreatico residuo, evidenzia le raccolte flogistiche o emorragiche
retroperitoneali ed intraperitoneali, identifica eventuali pseudocisti.
La ERCP è utile in fase precoce quando si sospetta una pancreatite biliare per la possibilità di eseguire una
papillotomia con estrazione dei calcoli.
Diagnosi differenziale
http://www.hackmed.org
affezione
Ulcera
gastrica
duodenale perforata
Occlusione intestinale
Infarto intestinale
Aneurisma
fissurato
Colica biliare
[email protected]
anamnesi
o Storia di malattia ulcerosa
Dolore violento a colpo
di pugnale *
Eventuali
interventi
chirurgici
Dolore
crampiforme
intermittente
Paziente
anziano
cardiopatico
Esame obiettivo
Segni di peritonismo
97
Indagini diagnostiche
Leucocitosi
Falce d’aria subfrenica
Distensione addominale Livelli idroaerei
senza segni di difesa
Segni di peritonismo in
fase avanzata
Diarrea mista a sangue
dell’aorta Paziente anziano con Caratteristica
massa
precedenti manifestazioni pulsante
aterosclerotiche
Scomparsa dei polsi
femorali e shock
Leucocitosi
Anse intestinali distese
senza livelli idroaerei
Evidenza della sacca
aneurismatica all’eco
Calcificazioni
parietali
aortiche all’Rx addome
Dolore in ipocondrio dx Dolorabilità del punto
che
regredisce
con cistico e segno di Murphy
antidolorifici
e positivo
antispastici
Raramente
iperamilasemia
e
iperbilirubinemia
Evidenza
di
calcoli
all’eco
*in genere la perforazione dell’ulcera avviene durante la notte a causa dell’ipertono vagale mentre la
pancreatite insorge dopo un pasto abbondante o assunzione eccessiva di alcol.
Nella chetoacidosi diabetica il dolore addominale simile e il movimento delle amilasi simulano una
pancreatite ma la lipasi e le isoamilasi pancreatiche sono normali.
Le indagini diagnostiche possono essere distinte in 3 fasi:
1. fase:
- esami ematobiochimici: amilasi, colesterolemia, trigliceridemia, calcio
- ecografia addominale (accuratezza del 65%)
- TC che ha una elevata definizione
- Endoscopia superiore
2. fase:
- ERCP
- Drenaggio biliare
- Colangio-RM
- Ecoendoscopia
- CA-19.9 e CEA
3. fase:
- manometria dello sfintere di Oddi
- test di stimolazione con secretina
- indagine genetica per vedere eventuali mutazioni del gene del tripsinogeno
- determinazione della α1-antitripsina
- indagini microbiologiche
Decorso e prognosi
È importante individuare i quadri di pancreatite acuta grave che vanno trattati chirurgicamente, a tale scopo
sono stati formulati dei criteri prognostici di cui i principali sono Glasgow, Ramson, CT severy index.
Il CT severy index da una stadiazione morfologica:
• A-C pancreatite edematosa
• C-D pancreatite necrotico-emorragica
• E necrosi infetta che necessita di intervento chirurgico
Criteri prognostici negativi di Ramson e Imrie
all’atto del ricovero:
✰ Età > 55 anni
http://www.hackmed.org
[email protected]
98
> 16000 /mm3
✰ Iperglicemia > 200 mg/dl
✰ LDH sierica > 400 UI/l
✰ AST sierica > 250 UI/l
Durante le prima 48h del ricovero:
✰ Riduzione dell’Ht > 10%
✰ Sequestro di liquidi > 4000 ml
✰ Ipocalcemia < 8 mg/dl
✰ Ipossiemia < 60 mmHg
✰ Aumento dell’azotemia > 5 mg/dl dopo somministrazione c.v. di liquidi
✰ Ipoalbuminemia < 3.2 g/dl
Se sono presenti 3 o più criteri entro le 48 ore la pancreatite è grave.
Le amilasi servono per la diagnosi ma non hanno un valore predittivo.
Complicanze: spesso i pazienti sviluppano entro le prime due settimane una massa pancreatica che può
essere dovuta alla steatonecrosi con o senza infezione o ad un vero e proprio ascesso.
Complicanze più tardive sono la pseudocisti pancreatica e la pancreatite cronica ostruttiva.
Terapia
Terapia sintomatica e di sostegno
• Sedazione del dolore viene fatta tramite analgesici ma non oppiacei che aumentano lo spasmo dello
sfintere di Oddi, può essere usata la meperidina che no ha un significativo effetto sullo sfintere di
Oddi
• Riequilibrio idroelettrolitico tramite appropriate infusioni di liquidi ed elettroliti, è importante il
monitoraggio del calcio e magnesio
• Correzione dell’iperglicemia l’iperglicemia transitoria non richiede terapia mentre il diabete acuto
che può seguire un danno parenchimale grave va trattato con insulina
• Antibioticoterapia con antibiotici ad ampio spettro per prevenire le complicanze infettive
• Nutrizione parenterale totale NPT per fornire un adeguato apporto nutrizionale al paziente e mettere
a riposo la ghiandola
Terapia specifica
• Messa a riposo della ghiandola tramite digiuno assoluto e sondino naso-gastrico in caso di nausea
protratta e vomito (la riduzione dello stimolo dovuto al cibo determina la riduzione della produzione di
secretina e colecistochinina e quindi abolisce la stimolazione alla secrezione pancreatica) e
somatostatina in infusione continua o octreotide sottocute che ha una emivita maggiore che inibisce
la secrezione pancreatica sia esogena che endogena sia direttamente che indirettamente inibendo la
secrezione di secretina, colecistochinina e gastrina
• Inibizione degli enzimi pancreatici tramite il gabesato mesilato che è un inibitore sintetico delle
proteasi (usato anche come profilassi della ERCP)
Terapia intensiva
• Prevenzione e trattamento dello shock tramite ripristino del volume circolatorio (albumina, plasma,
plasma expanders o sangue intero) monitorizzato attraverso misurazione della PVC con la
consapevolezza del potenziale sequestro di liquidi in addome
• Prevenzione e trattamento delle complicanze respiratorie e renali
Terapia chirurgica
L’intervento chirurgico d’urgenza è indicato:
• Quando nonostante il trattamento medico le condizioni del paziente non migliorano
• In presenza di necrosi pancreatica documentata dalle indagini strumentali
• In caso di insorgenza di complicanze non dominabili con il trattamento medico
Durante l’intervento può anche essere fatta la cosiddetta diagnostica intraoperatoria tramite l’ecografia
intraoperatoria EIO e la colangiografia intraoperatoria che consente una esatta valutazione del danno
pancreatico, il riconoscimento di eventuali raccolte necrotiche colliquate a distanza e di una patologia biliare.
L’esplorazione chirurgica inoltre è volta a ricercare raccolte ematiche o necrotiche colliquate spesso già
tamponate o nascoste, in presenza di una tumefazione che ponga il sospetto di una raccolta può essere utile
fare una puntura con ago che evidenzia il tipo di contenuto (necrotico, emorragico o purulento) e che è
opportuno inviare per l’esame batteriologico in modo da fare una antibiotico-terapia mirata.
La terapia chirurgica si basa su:
✰ Leucocitosi
http://www.hackmed.org
[email protected]
99
•
•
Necrosectomia che consiste nell’asportazione di tutto il tessuto necrotico della ghiandola
Sequestrectomia che consiste nell’asportazione dei focolai necrotici ed autolimitati rispetto al
parenchima circostante (viene in genere fatta dopo un certo periodo di tempo che permette al focolaio
necrotico di autocircoscriversi in modo da creare un piano di clivaggio con il parenchima circostante
sano)
• Ricerca e detersione di eventuali raccolte necrotiche extrapancreatiche
• Posizionamento di tubi di drenaggio nella loggia pancreatica e nelle zone di necrosi
extraghiandolare che consentono un lavaggio peritoneale con soluzione fisiologica ed antibiotici
anche dopo l’intervento chirurgico (quotidianamente, più volte al giorno o anche in modo continuo)
L’intervento chirurgico tardivo può essere eseguito quando la fase acuta della patologia si è risolta e
consiste nella terapia della litiasi biliare o nella terapia delle complicanze locali della pancreatite.
Forma lieve o moderata: Nella maggior parte dei pazienti con pancreatite acuta la risoluzione della malattia
è spontanea, e si possono attuare dei presidi terapeutici finalizzati alla diminuzione del dolore (analgesici),
alla reidratazione e all’espansione del plasma, antiproteasici (gabesato mesilato) per ridurre il danno
pancreatico.
Importante è la sospensione dell’alimentazione tramite apporto nutrizionale parenterale in modo da
sopprimere gli stimoli secretivi.
Anticolinergici e altri farmaci anti secretivi non cambiano quindi il decorso della malattia.
In caso di pancreatite acuta accertata è importante però che si faccia una appropriata terapia antibiotica, al
fine di evitare complicazioni come gli ascessi e le ostruzioni biliari infettive.
Forma moderata: Oltre ai presidi ricordati, si fa anche l’aspirazione nasogastrica per 2-3 giorni per
evitare l’accumulo di acido nel duodeno e ridurre la liberazione di gastrina.
Forma acuta fulminante: richiede un intervento rapido con massicce quantità di liquidi, e la rigorosa
osservazione clinica per evitare complicanze del tipo MOF. Si applica quindi nutrizione parenterale totale,
ed eventualmente laparotomia con drenaggio e rimozione del tessuto necrotico.
Complicazioni delle pancreatiti acute
NECROSI INFETTA
Infezione diffusa di un’area di pancreas necrotico, con reazione infiammatoria acuta che si verifica nelle
prime due settimane della pancreatite.
Va distinta dall’ascesso che è comunque una infezione limitata, che si sviluppa in tempi più lunghi ed è
caratterizzata da una minore mortalità chirurgica.
A differenza dell’ascesso, inoltre, la necrosi infetta non può essere trattata con il drenaggio, ma solo con la
terapia chirurgica.
Il tessuto necrotico del pancreas si infetta con batteri alimentari gram-, con una probabilità condizionata a
diversi fattori, come il grado e l’estensione della necrosi, della sofferenza ischemica peripancreatica e la
perfusione d’organo.
Il sospetto si deve avere quando in un soggetto che ha avuto di recente una pancreatite si presenta incremento
della leucocitosi, febbre, e riscontro alla TC di materiale liquido in forma di flemmone.
La biopsia con agoaspirato conferma la diagnosi, ed è l’unica forma di diagnosi di certezza.
La terapia è l’intervento chirurgico d’urgenza con rimozione del tessuto pancreatico infetto.
P.S: la presenza di febbre in un paziente con pancreatite acuta può essere dovuta a: necrosi pancreatica,
ascesso, pseudocisti infetta, colangite, polmonite da aspirazione.
Si dovrebbe effettuare l’esame colturale e si dovrebbe somministrare un antibiotico a largo spettro attivo
sulla flora batterica intestinale.
ASCESSO PANCREATICO
Raccolta di materiale purulento nel tessuto pancreatico o nei tessuti circostanti.
Si forma in seguito ad infezione di un processo necrotico del pancreas secondario a pancreatite acuta,
riacutizzazione di una pancreatite cronica o trauma pancreatico.
L’infezione avviene probabilmente per colonizzazione da parte di batteri coliformi gram – provenienti dal
colon per via linfatica o per contiguità.
È una complicanza che interviene nel 2-6% dei casi di pancreatite acuta.
http://www.hackmed.org
[email protected] 100
L’ascesso può essere singolo o multiplo.
Si possono distinguere 2 forme:
• Forma precoce quale complicanza a distanza di 24-48 ore di una pancreatite necrotico-emorragica
• Forma tardiva dopo 3-4 settimane di distanza dalla pancreatite
La sede più frequente di formazione dell’ascesso è quella retropancreatica (ascesso retroperitoneale).
clinica
Le manifestazioni sono:
• Febbre settica (intermittente-remittente)
• Dolore epigastrico
• Leucocitosi marcata
• Ileo adinamico
• Rapido deterioramento delle condizioni cliniche del paziente dopo una fase di rapido miglioramento
diagnosi
La diagnosi viene fatta tramite ecografia che evidenzia un area ipoecogena a profili irregolari e contenuto
disomogeneo.
In fase avanzata sono presenti aree anecogene corrispondenti alla componente liquida nella parte superiore
dell’ascesso e aree iperecogene determinate dal materiale che si deposita nelle parti declivi.
Nella maggior parte dei pazienti però la presenza di ileo paralitico con accumulo di gas ostacola l’esecuzione
dell’indagine.
L’Rx diretta addome evidenzia la presenza di gas nel retroperitoneo (bolle di sapone).
L’Rx torace può evidenziare l’elevazione dell’emidiaframma sinistro, atelettasia delle basi, versamento
pleurico prevalentemente sinistro.
La TC è importante per definire le caratteristiche morfologiche e strutturali dell’ascesso che appare come
una massa irregolare non omogenea.
Un ascesso non trattato è mortale praticamente sempre.
terapia
Viene fatta terapia medica intensiva (come quella della pancreatite acuta) con copertura antibiotica e
intervento chirurgico d’urgenza che si basa sulla rimozione più ampia possibile del tessuto pancreatico
associata al posizionamento di drenaggi che consentono nel postoperatorio il lavaggio ripetuto con soluzioni
antisettiche.
Il trattamento percutaneo ha una efficacia solo nel 50% dei casi, e quindi di solito è necessario ricorrere alla
chirurgia e alla resezione del tessuto necrotico.
In non pochi casi sono presenti ascessi multipli.
COMPLICANZE SISTEMICHE
Mentre le complicanze locali possono intervenire anche isolatamente, quelle generali reciprocamente
concatenate e sostenute da meccanismi fisiopatogenetici comuni sono associate, configurando la sindrome
dell’insufficienza multiorgano (MOF).
Questa è causata dal passaggio in circolo dal focolaio di necrosi degli enzimi attivati e dei mediatori
della flogosi.
Insufficienza cardiocircolatoria e shock
Causata dalla diffusione degli enzimi nelle cavità sierose con conseguente versamento sieroso e quindi
sequestro di liquidi e dalla liberazione di sostanze vasoattive.
Insufficienza renale
È inizialmente legata alla ipotensione con ipoperfusione renale (insufficienza prerenale) in seguito può
instaurarsi un danno tubulare causato dagli enzimi pancreatici (necrosi tubulare acuta).
Insufficienza respiratoria
La fosfolipasi A aggredisce il surfactante alveolare essendo questo costituito da lecitina determinando una
riduzione della compliance alveolare con un quadro simile a quello dell’ARDS.
Inoltre vi può essere una diffusione flogistico-enzimatica (anche a partenza da pseudocisti o ascessi
pancreatici) attraverso il diaframma soprattutto attraverso lo iatus esofageo e aortico favorita dalla pressione
negativa intratoracica.
Spesso è presente un versamento pleurico basilare sinistro che può essere:
• enzimatico quando il prelievo del liquido pleurico mostra elevati livelli delle amilasi
• reattivo quando il liquido pleurico è privo di enzimi
http://www.hackmed.org
[email protected] 101
Lesioni gastroduodenali acute
Iperemia, ulcera o gastropatia emorragica sono dovute alla sepsi e all’ischemia (gastrite ischemica da
stress) e possono essere complicate anche da lesioni vascolari dovute all’azione dell’elastasi sulle fibre dei
vasi.
Si manifestano con ematemesi e/o melena, o emoperitoneo quando il sangue si raccoglie nel cavo
peritoneale.
Si possono avere anche emorragie gravi per erosioni dei grossi vasi quali l’arteria splenica, l’arteria
pancreatico-duodenale o l’arteria gastroduodenale.
Ostruzione delle vie biliari principali
Causata da compressione dovuta ad ascessi o pseudocisti o anche alla semplice tumefazione cefalica sulle vie
biliari che determinano un quadro di ittero ostruttivo.
Encefalopatia pancreatica
Con obnubilamento del sensorio, agitazione psicomotoria e delirio.
È dovuta alle lesioni operate dalla lipasi sulla mielina (demielinizzazione) a livello del SNC ed è anche
legata all’insufficienza epatica concomitante su base tossico-enzimatica.
Alterazioni elettrolitiche, acido-base e metaboliche
L’ipocalcemia acuta può determinare tetania.
La estesa distruzione della componente endocrina del pancreas può determinare un diabete acuto.
Nei pazienti già diabetici all’esordio della malattia può verificarsi un coma diabetico.
Coagulopatie
L’attivazione dei fattori della coagulazione da parte delle proteasi (sia in loco che in circolo) determina
sindromi emorragiche da consumo e CID.
PSEUDOCISTI
Raccolta di materiale liquido necrotico-emorragico e di succo pancreatico circoscritta da un tessuto
fibroso e di granulazione (a differenza delle cisti vere che hanno un rivestimento epiteliale).
È una raccolta di natura infiammatoria espressione di un meccanismo di difesa dell’organismo volto a
circoscrivere il materiale necrotico-emorragico.
Le cause possono essere rappresentate da:
• Traumi pancreatici penetranti o contusivi
• Pancreatite acuta necrotico-emorragica (5% dei casi)
• Riacutizzazione di una pancreatite cronica
La parete della pseudocisti può essere costituita da:
• tessuto pancreatico (pseudocisti pancreatica)
• tessuto pancreatico e tessuti circondanti il pancreas (pseudocisti intra ed extrapancreatica)
• tessuto extrapancreatico con una zona di adesione al tessuto pancreatico (pseudocisti
extrapancreatica con adesione parenchimale comunicante o meno con i dotti pancreatici)
• tessuto connettivale reattivo senza adesione o lontano dal parenchima pancreatico (pseudocisti
ectopica o da infiltrazione)
inizialmente il materiale necrotico viene circoscritto da tessuto di granulazione e tessuto connettivale reattivo
che forma la parete primaria alla quale poi si aggiunge gradualmente una parete secondaria che evolve nella
formazione di una struttura fibrosa autonoma ed indipendente.
Il tempo ritenuto necessario per la formazione di una parete sufficientemente robusta è di 4-6 settimane.
Importanti sono i rapporti che la pseudocisti ha con il parenchima pancreatico e con i dotti escretori.
Possiamo distinguere pertanto:
• pseudocisti comunicante con i dotti escretori in cui il continuo apporto di succo pancreatico tende a
farla aumentare di volume (pseudocisti rifornita) che è in continua evoluzione e più esposta a
complicanze
• pseudocisti non comunicante con i dotti escretori (pseudocisti spenta o non rifornita) che non
aumenta di volume ed ha la tendenza alla regressione spontanea
la pseudocisti all’origine è sempre in comunicazione con il sistema duttale solo in seguito può divenire
indipendente.
le sedi di più frequenti di localizzazione della pseudocisti sono il pancreas o le sue strette vicinanze anche se
si possono riscontrare anche in sedi distanti come la pelvi e il mediastino.
Nell’85% dei casi sono situate nel corpo e nella coda, nel 15% nella testa.
http://www.hackmed.org
[email protected] 102
clinica
La sintomatologia della pseudocisti è spesso difficile da distinguere nel cotesto di una pancreatite acuta o
cronica.
Il quadro clinico è caratterizzato da dolore addominale, presenza di tumefazione addominale e disturbi
dispeptici.
Il dolore presenta i caratteri del dolore pancreatico.
I sintomi segati alla tumefazione addominale sono quelli da compressione gastro-duodenale (nausea,
vomito, dispepsia) e biliare (ittero ostruttivo).
In alcuni casi può essere presente febbre e perdita di peso.
La pseudocisti che non insorge acutamente ma cronicamente può anche essere asintomatica ed è difficile
ricondurla ad un pregresso episodio di pancreatite.
All’esame obiettivo può essere palpabile una tumefazione in regione epigastrica che può estendersi anche
nell’ipocondrio sinistro, di forma rotondeggiante, parete elastica, volume variabile, fissa.
Vi può essere una sensazione di resistenza o dolorabilità alla palpazione dell’epigastrio.
Può essere presente ascite pancreatica dovuta allo sgocciolamento del contenuto della pseudocisti.
diagnosi
Le indagini di laboratorio evidenziano una iperamilasemia persistente e una leucocitosi.
L’ecografia è l’esame di elezione, che permette di distinguere una pseudocisti vera da una lesione
edematosa, la pseudocisti appare come una raccolta liquida omogenea a parete regolare.
La TC fornisce informazioni anche riguardo ai rapporti che la neoformazione assume con gli organi
limitrofi.
L’ERCP è in grado di evidenziare l’esistenza o meno di una comunicazione con i dotti pancreatici.
Gli esami del tratto digerente con mezzo di contrasto possono evidenziare la compressione di tratti intestinali
adiacenti.
Le neoplasie cistiche del pancreas sono preoperatoriamente indistinguibili dalla pseudocisti e pertanto la
diagnosi si basa sull’esame istologico intraoperatorio.
terapia
Una volta diagnosticata la pseudocisti ci si astiene per almeno 3-4 settimane dall’intervento chirurgico
poiché la cisti può risolversi spontaneamente (20% dei casi) e soprattutto per la necessita di far maturare la
pseudocisti fino alla formazione di una parete connettivale sufficientemente resistente da permettere
l’applicazione di tecniche chirurgiche valide.
Durante il periodo di attesa è bene tenere sotto stretto controllo il paziente per il rischio di comparsa di
complicanze che richiedono un intervento chirurgico d’urgenza:
• dolore causato dall’espansione e dalla compressione di altri visceri
• rottura: la rottura nella cavità peritoneale porta a peritonite grave con shock. Se si associa con
emorragia, la mortalità è anche del 60%. Se la rottura avviene nell’intestino con formazione di una
fistola il paziente presenza diarrea. La rottura nel digiuno o nel duodeno non comporta problemi mentre
la fistolizzazione nel colon è a rischio di infezione del contenuto pancreatico essendo il colon
estremamente ricco di germi e pertanto è necessario chiudere chirurgicamente la fistola
• ascesso nel momento in cui si verifica l’infezione del contenuto con suppurazione
• fissurazione della parete della pseudocisti con sgocciolamento del suo contenuto nel peritoneo che da
luogo all’ascite pancreatica
• emorragia intracistica che si manifesta con melena quando la cisti è in comunicazione con il sistema
duttale pancreatico, a volte l’emorragia può essere così cospicua da dare luogo ad uno shock se l’arteria
lienale o la gastroduodenale inglobate nella pseudocisti possono andare incontro a lisi della loro parete a
causa dell’azione degli enzimi pancreatici
durante l’intervento chirurgico viene fatta la diagnostica intraoperatoria che consiste nell’esplorazione
manuale, ecografia e colangiopancreatografia.
Può essere fatta anche la cistografia con aspirazione del liquido endocistico e sua sostituzione con mezzo di
contrasto che fornisce utili informazioni sul volume ed il contenuto della pseudocisti evidenziando
l’eventuale comunicazione con i dotti pancreatici.
L’intervento si basa su:
• drenaggio esterno sia risolutivo che preliminare ad un intervento chirurgico più complesso, in caso di
pseudocisti priva di parete propria o con parete immatura o in caso di intervento di urgenza, viene
sempre seguito da monitoraggio ecografico postoperatorio che fornisce indicazioni sulla regressione
della pseudocisti
http://www.hackmed.org
[email protected] 103
•
drenaggio interno (derivazione interna: cistogastrostomia, cistoduodenostomia, cistodigiunostomia,
cistodigiunowirsungstomia su ansa esclusa alla Roux che è la tecnica maggiormente utilizzata che fa
in modo che il contenuto della pseudocisti si svuoti a livello di un ansa ileale che posta verticalmente
con la creazione di una Y) o exeresi della pseudocisti con o senza resezione pancreatica, in caso di
pseudocisti matura con pareti robuste e fibrotiche
In alternativa al trattamento chirurgico può essere fatto un drenaggio percutaneo eco o TAC-guidato che in
genere viene fatto in 2 tempi.
Inizialmente viene fatta l’aspirazione del liquido con dosaggio dell’amilasi e del CEA ed esame
batteriologico.
Successivamente viene fatto lo svuotamento della pseudocisti.
Se la pseudocisti è non comunicante si può fare direttamente lo svuotamento.
ASCITE PANCREATICA
E’ generalmente conseguente alla rottura del dotto pancreatico, a fistola fra il dotto e la cavità
peritoneale, oppure al continuo sgocciolamento del contenuto di una pseudocisti.
La paracentesi esplorativa mette in evidenza nel liquido ascitico un levato contenuto proteico (>> 3 g/dl) e
elevati livelli di amilasi nel liquido peritoneale, a volte anche di più di 20000.
La ERCP in genere dimostra il passaggio del mezzo di contrasto dal dotto alla cavità peritoneale.
A volte l’esistenza di una fistola nella coda del pancreas provoca la presenza di un versamento pleurico a
volte anche fino all’idrotorace.
Il trattamento consiste nelle nutrizione parenterale totale e nel drenaggio continuo del liquido ascitico in
modo da promuovere l’apposizione di visceri nella sede in cui avviene la perdita del liquido pancreatico.
Se la terapia medica non ha successo viene fatta la terapia chirurgica.
Se la lesione duttale è in corrispondenza della coda del pancreas si esegue una resezione pancreatica distale,
mentre se è a livello del corpo o della testa viene fatto in drenaggio interno in un ansa digiunale.
Pancreatite cronica
Malattia infiammatoria del pancreas ad evoluzione progressiva caratterizzata da alterazioni morfologiche
irreversibili che determinano distruzione con sostituzione fibrosa del pancreas esocrino e compromissione
tardiva anche della regione endocrina.
Il danno cronico del pancreas si manifesta come complicazione e cronicizzazione di una alterazione acuta
preesistente oppure con dolore addominale persistente e malassorbimento.
Le cause della pancreatite cronica sono in pratica le stesse di quelle dell’acuta, ma sono molto più
rappresentate le forme criptogenetiche.
• Alcol
• Fumo che ha una azione tossica sulle cellule acinose
• Ereditaria (esistono forme a trasmissione ereditaria)
• Trauma
• Ipercalcemia
• Fibrosi cistica
• Patologie che determinano ostruzione dei dotti pancreatici (pseudocisti, tumori pancreatici, pancreas
divisum, stenosi o infiammazione della papilla di Vater, esiti cicatriziali di flogosi pancreatica acuta o
post-traumatica)
• emocromatosi
• Malnutrizione proteico-calorica e consumo di cassava (un tubero ad elevato contenuto di glucosidi
cianosidici dotati di azione lesiva sul parenchima pancreatico) soprattutto nelle zone tropicali
Morfologicamente si distinguono:
• forme primitive (non ostruttive) in cui la patologia interessa primitivamente gli acini,
distinte in
1. calcifiche
2. non calcifiche (a patogenesi autoimmunitaria)
• forme secondarie (ostruttive) in cui la patologia interessa i dotti
http://www.hackmed.org
[email protected] 104
eziopatogenesi
Pancreatite cronica ostruttiva 5-10%
la stenosi duttale è provocata da diverse cause:
• Stenosi papillare
• Stenosi duttale
• Lesioni duodenali
• Infiammazioni
• Cicatrici
• Neoplasie
• Anomalie congenite (presenza di dotti di calibro ridotto rispetto al normale in caso di pancreas
divisum) o acquisite (post-traumatiche) del dotto di Wirsung
All’anatomia patologica è presente stenosi del dotto con dilatazione a monte ed atrofia diffusa ed uniforme
del parenchima duttale.
L’epitelio duttale è danneggiato in modo minore rispetto alla forma calcifica.
Le lesioni prevalgono nella testa del pancreas.
Interessa l’età avanzata con prevalenza minore nei maschi poichè è legata alla patologia biliare più frequente
nel sesso femminile.
È caratterizzata da una minore frequenza di insufficienza pancreatica sia esocrina che endocrina.
Si associa ad una minore frequenza di calcificazioni.
Pancreatite cronica non ostruttiva non calcifica rarissima
La patogenesi è probabilmente di natura autoimmunitaria e caratterizzata da un danno cronico dovuto al
ripetersi di eventi acuti di attacco immune ai dotti.
L’aspetto morfologico caratteristico è quello a corona di rosario per le numerose strozzature intercalate nel
lume principale.
Pancreatite cronica non ostruttiva calcifica 90%
È la forma più frequente che riconosce diverse eziologie: alcol, ipercalcemia, ereditarietà.
Già in condizioni normali le proteine presenti nel succo pancreatico tendono ad aggregarsi, questa tendenza è
esaltata in alcune condizioni patologiche tra cui l’abuso cronico di alcol in cui si hanno molteplici
modificazioni della composizione del succo pancreatico in grado di aumentarne la viscosità e favorire la
formazione di aggregati proteici intraduttali:
• Aumentata secrezione di enzimi pancreatici (per aumento del tono parasimpatico con un maggior
rilascio di CCK e gastrina)
• Ridotta secrezione di bicarbonati con conseguente diminuzione del PH per riduzione delle secrezione di
secretina
• Diminuita secrezione di citrati che normalmente chelano il Ca con aumentata disponibilità di ioni calcio
• Aumentata produzione di lattoferrina proteina in grado di promuovere la precipitazione delle altre
proteine
• Diminuita produzione di PSTI
L’epitelio duttale in seguito al contatto prolungato con gli aggreganti proteici va in contro progressivamente
ad un processo di atrofia con fibrosi e stenosi.
Tuttavia la formazione di aggregati proteici non comporta necessariamente la comparsa di litiasi pancreatica
che richiede anche la precipitazione di calcio sugli aggregati proteici (ciò spiega la genesi legata
all’ipercalcemia in cui inoltre si ha anche incremento di gastrina) con formazione di veri e propri calcoli
pancreatici intraduttali.
Il succo pancreatico normalmente è soprassaturo di calcio che è mantenuto in soluzione da proteine
stabilizzanti che ne prevengono l’organizzazione in forma di cristalli quali la PSP (pancreatic stone protein).
La secrezione di PSP ad opera delle cellule acinose risulta marcatamente ridotta nei soggetti con pancreatite
cronica calcifica.
Questo difetto può essere acquisito in seguito ad azione citolesiva di tossici quali l’alcol o congenito
geneticamente determinato (forma ereditaria).
Questa forma ha maggiore prevalenza tra i 40 ed i 50 anni, si associa più frequentemente al sesso maschile
(M:F=9:1) e all’abuso di alcol e sigarette.
È una malattia recidivante e si associa maggiormente a insufficienza sia endocrina che esocrina.
Inoltre si hanno calcificazioni che sono invece meno frequenti nella forma ostruttiva.
http://www.hackmed.org
[email protected] 105
Istologicamente negli stadi iniziali della malattia si possono ritrovare i precipitati proteici intraduttali e sono
presenti lesioni sclerotiche tipicamente focali e capricciose.
Negli stadi più avanzati la fibrosi diffonde a tutto l’organo e sui tappi proteici si ha la precipitazione del
calcio con formazione dei calcoli intraduttali.
I dotti pancreatici per fenomeni di trazione o compressione da parte del tessuto sclerotico subiscono notevoli
alterazioni della loro struttura con caratteristica alternanza di stenosi e dilatazioni (aspetto a corona di
rosario)
Negli stadi tardivi la fibrosi va ad interessare anche le insule.
Macroscopicamente la ghiandola è di consistenza dura e presenta foci di calcificazione e calcoli ben
sviluppati di variabili dimensioni fino ad alcuni cm.
Frequente è la formazione di pseudocisti.
Clinica
La tipica triade sintomatologica è rappresentata da calcificazioni pancreatiche, steatorrea e diabete
mellito.
Sono presenti episodi dolorosi ricorrenti alternati a periodi di benessere.
La frequenza degli episodi dolorosi tende ad aumentare soprattutto nel paziente alcolista.
Il dolore è intenso, continuo, a localizzazione epigastrica con irradiazione al dorso (a sbarra) ed ai fianchi (a
cintura), difficile da trattare e che può richiedere narcotici.
L’assunzione di un pasto abbondante, specie se contenente alcool o grassi, lo fa aumentare.
È presente dolorabilità nella zona coledocico-pancreatica.
Gli episodi dolorosi si accompagnano a dimagrimento dovuto alla perdita di appetito e soprattutto al fatto
che l’assunzione di cibo peggiora la sintomatologia dolorosa.
La sintomatologia dolorosa può essere accompagnata anche da dispepsia, meteorismo, nausea e vomito dopo
assunzione di cibi grassi.
Si può associare anche ittero dovuto all’edema pancreatico.
Generalmente le ricorrenze algiche sono più frequenti nei primi anni della malattia per poi ridursi
progressivamente e scomparire dopo 10 anni, tuttavia nel 5-10 dei casi il dolore può essere assente fin
dall’inizio (forma silente di pancreatite cronica: painless pancreatitis).
Nella genesi sembrano coinvolti:
• Irritazione perineurale
• Dilatazione del dotto pancreatico da accumulo di secreto
• Pseudocisti pancreatiche
In una fase più tardiva della malattia, dopo circa 5 anni, si ha la progressiva attenuazione della
sintomatologia dolorosa e lo sviluppo di:
insufficienza esocrina
la comparsa tardiva di questa situazione dipende dal fatto che il pancreas possiede una riserva funzionale
notevole, sono quando questa si riduce dell’80% si manifestano i sintomi e segni della maldigestione.
La riduzione della secrezione di enzimi pancreatici e di bicarbonato che determina una acidificazione del PH
che ostacola l’attivazione degli enzimi ed in particolare della lipasi determina la sindrome da
malassorbimento con steatorrea e dal calo ponderale che è aggravato anche dal fatto che l’assunzione di
cibo peggiora la sintomatologia dolorosa.
Il malassorbimento comunque non si associa a carenza di vitamine liposolubili.
Insufficienza endocrina
Si manifesta come diabete mellito che insorge nel 50% dei casi in genere dopo 5-6 anni dall’esordio della
malattia.
Si hanno marcate oscillazioni della glicemia e frequenti episodi ipoglicemici.
Diagnosi
La triade classica è rappresentata dalla presenza di calcificazioni pancreatiche, steatorrea e diabete
mellito.
Questa però è presente solo nel 30% dei pazienti.
I livelli sierici di amilasi e lipasi sono nella norma (per esaurimento funzionale del pancreas) a differenza
della forma acuta.
Si possono dosare i livelli ematici di tripsina, che risulteranno classicamente bassi.
Test di funzionalità esocrina
Esplorano la massa di parenchima ancora funzionante, si distinguono in:
• Diretti che misurano direttamente i prodotti della secrezione pancreatica dopo adeguata stimolazione
http://www.hackmed.org
[email protected] 106
1. test con secretina e ceruleina
2. test con secretina e bombesina
• Indiretti che valutano l’escrezione nelle feci o nella urine dei prodotti della digestione operata dagli
enzimi pancreatici su sostanze esogene somministrate
1. PABA
2. PLT
3. chimotripsina fecale
4. trigliceridi marcati
5. test di Schilling
6. test parotidei
7. test di misurazione dei grassi fecali
test di funzionalità endocrina
1. carco orale di glucosio con determinazione dei livelli sierici di glucosio e di insulina
2. test al glucagone con dosaggio del peptide C
3. test di tolleranza all’insulina si valuta il decremento di glucosio dopo 30 min dalla somministrazione
di insulina
indagini strumentali
• Rx addome: evidenzia la presenza di calcificazioni che possono essere diffuse o circoscritte e sono
frequenti nella forma calcifica meno in quella ostruttiva (lineari quelle intraduttali e diffuse quelle
intracinose). Le calcificazione in una certa % di pazienti non sono permanenti e possono anche
scomparire.
• Rx torace che può evidenziare la presenza di versamenti pleurici durante gli episodi di riacutizzazione
della malattia
• Ecografia rappresenta la prima indagine strumentale da eseguire nel sospetto di una pancreatite cronica,
permette di evidenziare la presenza di calcificazioni, dilatazioni o stenosi dei dotti pancreatici, atrofia
della ghiandola (più precoce nella forma ostruttiva e più tardiva in quella calcifica), presenza di fibrosi
(ecogenicità aumentata)
• Pancreatico -RM evidenzia le alterazioni morfologiche del parenchima e del sistema duttale (scansione
dinamica dopo somministrazione di secretina)
• TC ha una maggiore definizione dell’ecografia, permette di individuare alterazione di dimensioni e
struttura della ghiandola, calcificazioni, alterazioni dei dotti pancreatici e delle vie biliari
• ERCP: unica metodica non chirurgica che permette la visualizzazione diretta dei dotti sia pancreatici che
biliari. Distingue fra forma calcifica in cui sono presenti calcificazioni capricciose e ostruttiva in cui è
presente dilatazione a monte della stenosi e tra pancreatite cronica e adenocarcinoma duttale. Può
migliorare il dolore cronico consentendo il drenaggio di un dotto pancreatico ostruito per calcoli, spasmo
o stenosi papillari
Il Grading della pancreatite cronica di tipo ostruttivo viene fatto con la ERCP:
Lieve: alterazioni dei dotti secondari
Moderata: alterazioni del dotto principale
Grave: completo sovvertimento dell’architettura del dotto principale
Sospetto
clinico
ecografia
Diagnosi
negativa
Diagnosi
incerta
http://www.hackmed.org
[email protected] 107
TC
Diagnosi
negativa
Diagnosi certa
Diagnosi
incerta
Test funzionali
ERCP
Intubazione
duodenale e altri test
funzionali
Diagnosi
negativa
Diagnosi incerta
Complicanze
• Malassorbimento di cobalamina (B12) con anemia megaloblastica causato dalla mancata distruzione da
parte delle proteasi pancreatiche del fattore intrinseco nel duodeno ed è corretto con facilità dalla
somministrazione di enzimi pancreatici
• Intolleranza al glucosio è sempre presente: complicanze più rare sono la chetoacidosi, il coma diabetico e
la neuropatia. La retinopatia è invece più frequente a causa della carenza dell’assorbimento della
vitamina A
• Versamento pleurico e ascite pancreatica
• Sanguinamento intestinale derivato da ulcera peptica, gastrite, rottura di pseudocisti nel duodeno o di
varici gastroesofagee, conseguenti alla trombosi della vena splenica dovuta ad estensione del processo
infiammatorio dal pancreas
• Ittero secondario ad ostruzione biliare per estensione della infiammazione
• Dolore osseo da osteoporosi osteomalacia causato dal deficit di assorbimento della vitamina D
• Aumentata incidenza di carcinoma pancreatico
• Ascite pancreatica causata dalla rottura spontanea o provocata di pseudocisti nel cavo peritoneale o nel
dotto principale con raccolta di un essudato ad elevato contenuto proteico (enzimi pancreatici)
• Lesioni cavitarie: cisti e pseudocisti
Terapia
Eliminazione dei fattori eziologici.
Terapia medica:
• Controllo del dolore con analgesici non oppiacei
• Prevenzione del malassorbimento tramite somministrazione di enzimi pancreatici che vengono
somministrati 20-30 minuti prima dei pasti principali e di eventuali spuntini + inibitori di pompa se non
sono gastroprotetti
• Terapia nutrizionale
1. astensione assoluta dall’alcol
2. pasti piccoli e frequenti ad alto contenuto proteico
3. riduzione dell’apporto di grassi
4. somministrazione di trigliceridi a catena media (MTC) che vengono idrolizzati più facilmente dalla
lipasi pancreatica
5. supplementi di vitamine liposolubili
• terapia del diabete
1. dieta
2. ipoglicemizzanti orali
3. terapia insulinica
terapia chirurgica
indicazioni al trattamento chirurgico sono:
• terapia medica inefficace soprattutto nel controllo del dolore
http://www.hackmed.org
[email protected] 108
•
presenza di complicanze quali pseudocisti, ostruzione biliare con ittero, stenosi gastroduodenale,
emorragie, fistole, ascessi, ascite pancreatica e versamenti pleurici
durante l’intervento viene fatta la diagnostica intraoperatoria tramite colagiopancreatografia e ecografia.
Il trattamento chirurgico si basa su:
• derivazione pancreatico digiunale (derivazione del doto pancreatico principale e anche di quelli
parenchimali su ansa esclusa alla Roux) in caso di distribuzione focale delle lesioni sclerotiche, stenosi
o ostruzione del Wirsung a livello della testa del pancreas, discreta conservazione del tessuto insulare
• interventi demolitivi primari o secondari (cioè in caso di recidiva dopo derivazione) in caso di
alterazioni marcate del Wirsung, complicazioni, sospetto di neoplasia pancreatica maligna:
1. duodenocefalopancreatectomia quando le alterazioni sono prevalentemente a livello della
testa del pancreas
2. resezioni pancreatiche quando le lesioni o le complicanze sono localizzate prevalentemente
nel corpo e nella coda
3. pancreatectomia totale
Tumori del pancreas
I tumori del pancreas comprendono tumori che originano dalla componente endocrina cioè dalle insule
pancreatiche e tumori che originano dalla componente esocrina.
I tumori benigni del pancreas esocrino sono estremamente rari e nella maggior parte dei casi rappresentano
un rilievo autoptico casuale.
Le forme più frequenti sono:
- cistoadenoma
- neoplasie papillari cistiche
- papillomi intraduttali
- adenomi
Carcinoma del pancreas
Il carcinoma del pancreas è una neoplasia maligna che trae origine dalla componente esocrina della
ghiandola cioè dall’epitelio dei dotti pancreatici (acini) o dai tubuli secretori.
La neoplasia è piuttosto frequente essendo la quarta causa di morte per cancro.
L’incidenza è di 10/10000 l’età media è 60-80 anni e vi è una lieve predilezione per il sesso maschile.
La sede è:
• 60% testa
• 15% corpo
• 6% coda
nel 20% dei casi il tumore è così diffuso che non è possibile una esatta localizzazione della sua sede di
origine.
La sopravvivenza è bassa a causa della difficoltà di diagnosi precoce e la mancanza di terapia efficace.
Eziopatogenesi
Fattori di rischio certi sono:
• Fumo
• Caffè
• Dieta iperlipidica
• Pancreatite cronica
• Contatto prolungato con i derivati del benzene
Non fattori di rischio eventi come alcolismo, diabete, colecistectomia.
Anatomia patologica
Macroscopicamente il tumore si presenta di dimensioni variabili, bianco-grigiastro, di consistenza aumentata
(tumore desmoplastico) con margini ben definiti.
La crescita è di tipo infiltrativo ed aggressivo.
Istologicamente il tumore è ben differenziato e possono essere presenti 2 forme:
• adenocarcinoma duttale 90% che deriva dalle cellule duttali o duttulari e può essere semplice,
mucinoso o cistico (cistoadenosarcoma)
http://www.hackmed.org
[email protected] 109
• adenocarcinoma acinoso 10% che deriva dalle cellule acinose
Il tumore ha una diffusione locale molto rapida, perché il pancreas non ha la tonaca sierosa essendo un
organo retroperitoneale.
I tumori della testa del pancreas tendono a comprimere precocemente l’ampolla di Vater, il duodeno ed i
coledoco, provocando ittero ostruttivo ed insufficienza epatica, mentre i tumori del corpo e della coda
tendono ad invadere lo spazio retroperitoneale, surrene, milza, mesocolon trasverso e stomaco.
Nei carcinomi della testa la compressione del sistema portale (vena mesenterica o vena porta) o anche
l’infiltrazione può dare ipertensione portale con ascite ed epato-splenomegalia.
Nei carcinomi della coda si può avere infiltrazione della vena splenica.
Diffonde anche rapidamente per via linfatica ai linfonodi peripancreatici, gastrici, mesenterici, omentali e per
via celomatica ed ematica.
Le metastasi a distanza possono essere intraaddominali (fegato e carcinosi peritoneale) o extraddominali
(polmoni).
Frequentemente il fegato è interessato da noduli tumorali multipli che provocano una marcata epatomegalia.
T1
T1a
T1b
T2
Tumore limitato al pancreas
Diametro massimo < 2 cm
Diametro massimo > 2 cm
Tumore esteso al duodeno, ai dotti biliari, al tessuto
peripancreatico
Tumore esteso allo stomaco, milza, colon o ai grossi
vasi adiacenti
Assenza di metastasi ai linfonodi regionali
Metastasi ai linfonodi regionali
Assenza di metastasi a distanza
Presenza di metastasi a distanza
T3
N0
N1
M0
M1
Stadio I
Stadio II
T1-T2
T3
N0
N0
M0
M0
Stadio III
Stadio IV
ogni T
ogni T
N1
ogni N
M0
M1
Tumore limitato al pancreas
Tumore che interessa anche gli organi vicini ma senza metastasi
linfonodali
Presenza di metastasi linfonodali
Presenza di metastasi a distanza
Clinica
Il carcinoma pancreatico è caratterizzato dalla triade sintomatologica:
• Dolore sordo continuo e profondo epimesogastrico, nei carcinomi della testa è dovuto alla distensione
del dotto pancreatico con conseguente pancreatite da ritensione, è localizzato al mesogastrio, irradiato a
destra e posteriormente ed aumentato dall’assunzione di cibo, nei tumori del corpo e della coda è dovuto
all’invasione del plesso solare ed è localizzato in sede epigastrica, talvolta può insorgere
improvvisamente tipo colica, si irradia all’ipocondrio ed alla spalla destra, si accentua in posizione
supina mentre è alleviato dalla posizione a canne di fucile
• Ittero caratteristico della localizzazione cefalica è di tipo colestasico, dovuto alla compressione sul
coledoco, è spesso accompagnato da segni di colestasi quali prurito, urine ipercromiche e feci ipocoliche,
se si associa ad una colecisti distesa e palpabile costituisce il segno di Courvoisier-Terrier
• Calo ponderale dovuto ad anorresia, dispepsia e malassorbimento
• Nausea e vomito dovuti all’ostruzione più o meno completa del duodeno
• Alterazioni dell’alvo o steatorrea dovute al deficit enzimatico pancreatico
• Diabete di recente comparsa o improvviso aggravamento di una condizione dismetabolica precedente
dovuto all’insufficienza endocrina
• Sindrome di Trousseau o tromboflebite migrante, presente nel 10% dei casi dovuta alla produzione di
fattori aggreganti le piastrine e di procoagulanti da parte del tumore
Se si esclude l’ittero, i sintomi di esordio sono in genere abbastanza insidiosi.
L’ittero invece ha comparsa improvvisa, senza dolore iniziale ed è provocato dall’ostruzione del coledoco.
http://www.hackmed.org
[email protected] 110
Diagnosi
I carcinomi della testa del pancreas si trovano in posizione strategica per comprimere l’ampolla di Vater, il
coledoco o il duodeno e danno pertanto più precocemente segni di ostruzione biliare che ne permettono una
diagnosi più precoce.
Possono quindi essere diagnosticati quando hanno ancora dimensioni ridotte.
Al contrario i carcinomi del corpo e della coda tendono a svilupparsi in modo silente diventando manifesti
soltanto quando si sono estesi a strutture adiacenti o hanno dato metastasi disseminate.
Esame obiettivo
La neoplasia in fase avanzata determina una tumefazione endoaddominale profonda di consistenza
aumentata e fissa sui piani superficiali e profondi.
Nel caso di ostruzione delle viene biliari è possibile palpare la colecisti come una massa teso-elastica
profonda nell’ipocondrio di destra (colecisti distesa e palpabile).
In caso di epatomegalia il fegato deborda dall’arcata costale.
segno di Courvoisier-Terrier: ittero associato a colecisti distesa e palpabile in assenza di colangite e
senza colica biliare fa ipotizzare una neoplasia del pancreas.
È importante per differenziare il cancro dall’ittero a genesi litiasica in cui la colecisti non è distensibile a
causa della concomitante flogosi cronica.
L’ipertensione portale può essere responsabile anche di ascite ed epatosplenomegalia.
Esami di laboratorio
In caso di ostruzione del coledoco sono presenti alterazioni dei test di funzionalità epatica indicativi di
colestasi.
Sono alterati anche i test di funzionalità pancreatica in modo simile a quanto avviene in corso di pancreatite
cronica: aumento di lipasi e amilasi sieriche, riduzione o assenza degli enzimi pancreatici nel liquido
duodenale, presenza di grassi nelle feci.
Può anche essere presente iperglicemia asintomatica.
I marker che esistono sono due:
CEA: sensibile ma poco specifico
CA19.9: sensibilità 81%, specificità 90%; non è però precoce.
Attualmente si cerca di usarlo come programma di Screening.
Indagini strumentali
È molto difficile identificare un tumore del pancreas se di dimensioni < 2-3 cm, quando ciò avviene
rappresenta un reperto occasionale.
• Ecografia: è l’indagine di prima scelta, permette di evidenziare la neoplasia che in genere appare come
un area ipoecogena, della quale si possono valutare le dimensioni e i rapporti con i dotti pancreatici e
biliari, le neoplasie cistiche sono ben differenziabili dalle pseudocisti per la presenza di setti o
calcificazioni eccentriche
• TC: sensibilità per lesioni del diametro di almeno 2 cm evidenzia un incremento di volume settoriale con
riduzione di densità, evidenzia l’80% delle lesioni maligne, può dare falsi positivi, risulta fondamentale
per valutare l’estensione della malattia e quindi per lo staging (interessamento di cava, aorta, asse
spleno-portale)
• RM ha una elevata sensibilità nell’individuazione di piccole lesioni e consente un accurato studio delle
vie biliari (colangio-RM), dei dotti pancreatici (pancreatico-RM) e dei vasi (angio-RM), inoltre è in
grado di evidenziare con maggiore sensibilità della TC l’invasione del tessuto peripancreatico
• ERCP: serve per la diagnosi differenziale di altre cause di ittero ostruttivo quali principalmente la
colelitiasi, evidenzia l’infiltrazione o l’ostruzione neoplastica dei dotti pancreatici e la stenosi del
coledoco terminale (è patognomonico il rilievo a monte del tumore di una doppia dilatazione sia a livello
biliare che pancreatico: “double duct sign”) nel corso dell’indagine è possibile fare un trattamento
palliativo o preliminare dell’ostruzione biliare mediante endoprotesi e inoltre si può prelevare il succo
pancreatico e fare un brushing duttale fondamentale per l’indagine citologica
• Colangiografia epatica percutanea PTC
• Agobiopsia con guida ecografica: conferma del sospetto clinico ma è associata a rischio di
disseminazione (seeding)
• Angiografia: permette di valutare l’estensione della massa, non viene più usata per la diagnosi ma solo
nel preoperatorio
Dopo l’intervento chirurgico spetta alla diagnostica per immagini valutare lo stato delle anastomosi e gli
eventuali residui tumorali.
http://www.hackmed.org
[email protected] 111
Terapia
Unica efficace è la resezione chirurgica completa:
• duodenocefalopancreasectomia in caso di carcinoma della testa, che comporta
l’asportazione in blocco del duodeno, della testa del pancreas, della porzione distale della
via biliare (compresa la colecisti ed il dotto cistico) fino all’epatico comune e dei 2/3 distali
dello stomaco
• pancreasectomia radicale distale
• pancreasectomia totale
E’ possibile solo nel 10% dei casi, non associati a metastasi toraciche o addominali e la mortalità è alta.
Criteri di inoperabilità:
9 infiltrazione o compressione del Wirsung o del coledoco
9 infiltrazione del cellulare lasso peripancreatico
9 infiltrazione di arteria o vena mesenterica superiore
9 infiltrazione del tripode celiaco
Vi è inoltre una elevata probabilità di recidiva locale.
L’intervento chirurgico va quindi seguito da un trattamento di radiochemioterapia.
La chemioterapia consiste nell’infusione continua di 5-fluorouracile, la radioterapia (50 Gy) va
somministrata ad un volume limitato alla neoplasia pancreatica con un margine adiacente di circa 3 cm ed ai
linfonodi locoregionali metastatici.
Le dimensioni limitate dei campi di irradiazione sono dovuti alla concomitante chemioterapia e dalla
vicinanza di organi dotati di scarsa tolleranza alla radioterapia quali fegato, stomaco, duodeno, intestino
tenue, vasi arteriosi e venosi mesenterici.
Forme alternative alla terapia sono:
• acceleratori lineari dotati di tecnologia conformazionale, capaci cioè di modellare
perfettamente il volume di trattamento secondo il volume di malattia rendendo possibile la
somministrazione di dosi molto elevate nel focolaio tumorale con risparmio degli organi di
rispetto
• brachiterapia interstiziale in sede intraoperatoria consistente nell’impianto di sorgenti
radioattive costituite da aghi di I125
• radioterapia intraoperatoria (IORT) che utilizza degli acceleratori dedicati miniaturizzati
collocati nella sala operatoria opportunamente schermata e che consente di somministrare
dei sovradosaggi sulla neoplasia se giudicata inoperabile o sulla sede della malattia resecata
o su un eventuale residuo postchirurgico con tossicità ridotta
Nelle forme avanzate o comunque considerate inoperabili viene fatta radiochemioterapia a scopo
palliativo.
La chemioterapia si basa sull’infusione di 5-fluorouracile mentre la chemioterapia non essendo preceduta da
chirurgia rappresenta un trattamento locale esclusivo e quindi raggiunge dosi di 60 Gy.
Un intervento palliativo è una protesi del Wirsung con un tubicino di materiale a memoria di forma.
Nella gestione del paziente affetto da carcinoma del pancreas un ruolo essenziale è dato dalla terapia di
supporto i cui obiettivi principali sono quelli di mantenere un soddisfacente stato di nutrizione, correggere la
sindrome da malassorbimento, controllare il dolore.
Il trattamento medico del dolore è spesso inefficace, alternative sono: neurotomia del plesso gangliare
simpatico o del plesso celiaco, blocco neurolitico mediante alcolizzazione, radioterapia esterna (50-60 Gy).
Tumori cistici del pancreas
Rappresentano il 5% dei tumori del pancreas.
Sono in genere localizzati nel corpo e nella coda e si presentano come masse indolenti a rapida crescita.
Anatomia patologica
Possono essere di 3 tipi:
- Cistoadenoma sieroso o adenoma microcistico: massa ovoidale multinodulare, provvista di una
pseudocapsula, sulla superficie di taglio presenta numerosissime piccole cisti (microcisti) che
conferiscono alla neoformazione un caratteristico aspetto a nodo d’ape o spugnoso, le cisti non sono mai
in comunicazione con il sistema duttale e contengono un liquido chiaro sieroso che può contenere enzimi
pancreatici, il rivestimento delle cisti è costituito da un singolo strato di epitelio cuboidale piatto
http://www.hackmed.org
[email protected] 112
-
Cistoadenoma e cistoadenosarcoma mucinoso: ampia massa rotondeggiante, provvista di
pseudocapsula, uniloculare o multiloculare, con superficie interna irregolare per la presenza di numerose
escrescenze a carattere villoso che si proiettano nel lume della cavità, le cisti contengono un liquido
denso filante, mucoide
Clinica
I tumori cistici del pancreas sono spesso silenti o si accompagnano a sintomi vaghi o aspecifici quali
anorresia, dispepsia, moderato calo ponderale.
La sintomatologia è legata esclusivamente alla crescita del tumore che quando raggiunge notevoli dimensioni
può dare disturbi di natura compressiva e manifestarsi come massa addominale epigastrica o ipocondrica
sinistra.
Diagnosi
L’Rx diretta addome rivela la presenza di calcificazioni che sono sempre assenti nelle pseudocisti e nelle
cisti non neoplastiche.
All’ecografia gli adenomi sierosi appaiono come masse ad ecogenicità mista e consistenza solida con piccole
cisti ipoecogene e spesso calcifiche.
I tumori cistici mucinosi invece appaiono come formazioni anecogene a contorni irregolari con
sepimentazioni ed escrescenze papillari.
Una migliore risoluzione è ottenibile con la TAC.
Terapia
Si basa sulla exeresi chirurgica radicale della neoplasia.
TUMORI NEUROENDOCRINI
Appartengono ai tumori del sistema neuroendocrino diffuso che sono cellule endocrine sparse in numerosi
organi e tessuti che producono ormoni ad azione endocrina o paracrina.
Il sistema neuroendocrino diffuso si trova infatti a livello di sistema ipotalamo-ipofisario, ghiandola pineale,
sistema gastroenteropancreatico, paratiroidi, midollare del surrene, gangli simpatici, tiroide, polmone,
mammella, utero e prostata, fegato e vie biliari, timo.
Le cellule neuroendocrine gastrointestinali e delle insule pancreatiche costituiscono nel loro insieme il
sistema endocrino gastroentero-pancreatico.
Queste cellule poiché sono in grado di accumulare amine e/o captarne i precursori e decarbossilarli sono
state chiamate anche cellule APUD (amine precursor uptake and decarboxylation ) per questo motivo i
tumori neuroendocrini vengono anche definiti apudomi.
Queste cellule hanno in comune l’origine dalla cresta neurale (anche se si è visto che alcune originano
dall’endoderma) e similitudini strutturali che possono essere messe in evidenza tramite
l’immunoistochimica.
Le cellule neuroendocrine si colorano bene con l’impregnazione argentica e per questo vengono anche
chiamate cellule argentaffini, sono ricche di granuli che possono contenere oltre ad ormoni peptidi ed
amine anche specifici marker quali l’enzima enolasi-neurospecifica, cromogranina, sinaptofisine e
gonadotropine umane.
Non tutti i tumori neuroendocrini sono in grado di produrre e mettere in circolo ormoni o amine attive e non
tutte le sostanze immesse in circolo sono in grado di determinare una sindrome clinica.
I tumori neuroendocrini vengono pertanto differenziati in:
•
tumori funzionanti che rilasciano in circolo ormoni che sono in grado di determinare una
sindrome clinica
•
Tumori non funzionanti che non rilasciano ormoni in circolo e che rilasciano ormoni che
non sono in grado di determinare una sindrome clinica (sono quindi asintomatici finchè non
raggiungono dimensioni tali da determinare sintomi da compressione)
TUMORI NEUROENDOCRINI GASTROENTERICI
Sono chiamati tumori neuroendocrini perché possono secernere una varietà di peptidi normalmente espressi
da cellule dell’intestino che sono stati identificati anche nelle cellule nel SNC.
http://www.hackmed.org
[email protected] 113
Viceversa i peptidi e recettori inizialmente isolati nel sistema nervoso sono stati poi identificati anche nelle
cellule intestinali o GEP: gastrina, somatostaitina, colecistochinina, VIP, sostanza P, GLP-1, encefalina,
neurotensina, TRH.
I GEP secernono diversi ormoni in base alla sede di origine.
Le metastasi possono secernere un diverso peptide rispetto al tumore primitivo per fenomeni di mutazione
genetica.
gastrico
duodenale
ileale
Instamina, serotonina
Gastrina, SST, serotonina
Serotonina, sostanza P
Serotonina sostanza P
Entroglugaone, sostanza P
PP, PYY, serotonina
Insulina, gastrina, glucagone
I GEP vengono quindi distinti in pancreatici e non pancreatici.
I GEP possono produrre più di un peptide, la sintomatologia clinica è dovuta al peptide che viene secreto in
maggiore quantità.
Caratteristiche biologiche comuni, rari, piccoli < 1 cm, crescita lenta, solitamente metastatizzano prima di
diventare sintomatici, possono crescere in modo silente per anni, i sintomi mimano patologie che hanno
diverse eziologie.
I caratteri biologici che sono indice di benignità o malignità sono incerti, l’unico attendibile è la presenza di
metastasi a distanza.
I GEP hanno incidenza di 5 su 100.000.
Soltanto i carcinoidi rappresentano il 50% dei GEP e hanno una prevalenza di 1.5/100.000.
I GEP fanno parte di una MEN1 nel 5-25% dei casi.
TUMORI NEUROENDOCRINI DEL PANCREAS
I tumori neuroendocrini del pancreas TEP derivano dalle cellule neuroendocrine del pancreas che si
trovano prevalentemente raggruppate a livello delle insule pancreatiche ma che si possono trovare anche
sparse a livello del parenchima esocrino.
Sono tumori rari con una frequenza inferiore a quella dei carcinoidi.
I più frequenti sono insulinoma e gastrinoma.
Possono essere:
•
Tumori unici 75-95% dei casi
•
Tumori multipli 5-25% dei casi nell’ambito della MEN I (soprattutto forme non
funzionanti)
In genere i tumori funzionanti al momento della diagnosi sono di piccole dimensioni in quanto in genere la
diagnosi è precoce visto che questi determinano delle sindromi cliniche, al contrario i tumori non funzionanti
in genere al momento della diagnosi sono di grandi dimensioni in quanto si manifestano solo quando danno
sintomi da compressione.
Il comportamento biologico di questi tumori è variabile.
Possono essere benigni o maligni con differenti gradi di aggressività.
Non ci sono criteri istologici di malignità la quale dipende dalla presenza di metastasi ematiche o linfonodali.
Anche le dimensioni non si correlano con l’aggressività ma sono ben correlate con la gravità della sindrome.
I TEP possono derivare dai 5 tipi cellulari presenti a livello delle insule pancreatiche:
•
Cellule A secernenti glucagone (glucagoma)
•
cellule B secernenti insulina (insulinoma)
•
cellule D che producono somatostatina (somatostatinoma)
•
cellule PP che producono polipeptide pancreatico (polipeptidoma pancreatico)
•
cellule enterocromaffini (carcinoide)
Ognuna di queste cellule è in grado di secernere anche altri peptidi regolatori, come gastrina, VIP, ACTH
eccetera.
http://www.hackmed.org
[email protected] 114
Clinica
I tumori funzionanti determinano una sintomatologia clinica determinata dalla secrezione inappropriata di
uno o più ormoni quando questi sono biologicamente attivi.
Si tratta quindi di una vera e propria sindrome paraneoplastica la cui entità è correlata alla massa tumorale
in quanto una maggiore dimensione del tumore implica anche una maggiore produzione e dismissione in
circolo delle sostanze biologicamente attive.
I tumori funzionanti invece determinano una sintomatologia da compressione caratterizzata da:
•
dolore addominale
•
ittero che meno frequente rispetto all’adenocarcinoma del pancreas che tende a localizzarsi
nella testa e quindi a comprimere più facilmente il coledoco mentre i TEP sono più
frequentemente localizzati a livello del corpo e della coda
•
epatomegalia
•
cachessia e calo ponderale
•
emorragia
•
pancreatite acuta ricorrente per occlusione neoplastica del Wirsung o di uno dei dotti
pancreatici principali
terapia
la terapia di elezione è quella chirurgica basata a seconda dei casi su:
•
enucleoresezioni nei tumori più piccoli
•
resezione corpo e coda del pancreas
•
duodeno-cefalo-pancreatectomia in cui vengono rimossi anche i linfonodi limitrofi in
caso di tumore maligno
•
debulking asportazione di una porzione soltanto del tumore che non determina guarigione
ma riduce la quantità di ormone e quindi l’entità della sindrome paraneoplastica
sindrome di zollinger-ellison
È una sindrome caratterizzata da ipersecrezione acida gastrica ed ulcerazioni multiple a livello di stomaco e
prima parte del duodeno (bulbo) associate ad un gastrinoma.
Il gastrinoma è un tumore endocrino secernente gastrina che insorge prevalentemente a livello pancreatico
(cellule insulari non β) anche se nel 13% dei casi è stato ritrovato in sede extrapancreatica.
Dal 25 al 50% dei tumori del genere si associano alla sindrome MEN1, ossia alla presenza di neoplasie
endocrine multiple, soprattutto con l’iperparatiroidismo.
Circa l’80% origina dalle isole pancreatiche, gli altri prendono origine dal triangolo dei gastrinomi (vertici
al livello di: confluenza tra cistico e dotto epatico, limite tra seconda e terza porzione del duodeno, confine
tra corpo e testa del pancreas).
Nel 40% dei casi non siamo in grado di trovare il tumore primitivo in quanto questo è dimensioni troppo
piccole.
Anatomia patologica
In genere il tumore è di piccole dimensioni circa 1 cm e tende ad essere multiplo.
In circa il 60% dei casi il gastrinoma è maligno e tende a metastatizzare a livello di linfonodi, fegato ed ossa,
ma ha un lento accrescimento.
A livello gastrico è presente iperplasia delle cellule parietali.
Fisiopatologia
La patologia ulcerosa è causata dall’ipersecrezione di acido da parte delle cellule parietali rese ipertrofiche
dalla stimolazione inappropriata da parte della gastrina prodotta dal tumore.
Le ulcere sono particolarmente aggressive e poco responsive alla terapia (intrattabilità dell’ulcera) e la
recidiva postchirurgica è del 60% (nell’ulcera normale è del 10%).
Nella maggior parte dei casi le ulcere tendono localizzarsi nella prima porzione del duodeno nei rimanenti
casi si trovano in sedi atipiche nello stomaco, nel duodeno e nel digiuno.
Le ulcere possono essere solitarie o multiple ed in genere non superano i 2 cm di diametro.
L’ipersecrezione acida che in genere supera i 15mEq/ora determina un forte abbassamento del PH gastrico
che determina inattivazione degli enzimi pancreatici.
L’ipersecrezione di HCl determina danneggiamento della mucosa intestinale con riduzione dell’assorbimento
aumento della motilità intestinale.
La diarrea cronica che si verifica può spiegarsi con diversi meccanismi:
http://www.hackmed.org
[email protected] 115
•
•
Aumento del volume di liquido che raggiunge l’intestino causato dall’ipersecrezione gastrica
Inibizione dell’assorbimento di acqua ed elettroliti a livello del digiuno causata dagli elevati livelli di
gastrina
• Riduzione del PH duodenale con inattivazione della lipasi pancreatica e precipitazione degli acidi
biliari con conseguente malassorbimento di grassi (steatorrea) e stimolazione della secrezione
idroelettrolitica del colon (diarrea secretiva)
• Accelerato svuotamento gastrico
• Effetto lesivo diretto dell’acidità gastrica sulla mucosa duodenale
Nel 50% dei pazienti si ha concomitante secrezione di altri peptidi da parte del tumore o delle sue metastasi.
Clinica
La sintomatologia è caratterizzata fondamentalmente da diarrea con steatorrea ed anorresia, dolore
addominale.
Il dolore sebbene sovrapponibile come caratteristiche al dolore ulceroso in caso di ulcera duodenale
semplice, talvolta è invece persistente, non dominabile dalle comuni terapie farmacologiche e tipicamente
associato a vomito acido.
Si può verificare anche perforazione intestinale come complicanza dell’ulcera peptica.
La sintomatologia può avere un andamento cronico o presentarsi episodicamente.
Diagnosi
Si fa essenzialmente tramite la dimostrazione dell’aumento della concentrazione ematica di gastrina
(ipergastrinemia) tramite radioimmunoassay (RIA) soprattutto G17 e G34.
L’ipergastrinemia si può verificare anche in molte altre condizioni patologiche:
ipergastrinemia appropriata (conseguente allo stimolo fisiologico cioè la diminuzione di HCl)
1. iposecrezione acida (gastrite atrofica, gastrite autoimmune, antiacidi, vagotomia)
2. sindrome uremica
3. farmaci (anticolinergici, antiacidi, anti-H2)
ipergastrinemia inappropriata (si ha aumento sia di gastrina che di HCl)
1. iperfunzione di cellule G
2. sindrome di Zolliger-ellison
Sono perciò stati introdotti dei test da stimolo per discriminare tra queste diverse patologie, in particolare
viene utilizzato il test alla secretina: nei pazienti con sindrome di Z.E. dopo somministrazione di secretina si
verifica un aumento marcato dei livelli di gastrina, mentre dopo stimolazione con un pasto standard la
gastrinemia non aumenta o aumenta soltanto lievemente.
Ciò è dovuto al fatto che il gastrinoma è un tumore pancreatico e perciò possiede i recettori per la secretina.
Si ha inoltre incremento della portata acida basale BAO e della portata acida massima dopo stimolo
MAO con un rapporto BAO/MAO > 0.6.
L’esofagoduodenoscopia evidenzia un’ipertrofia delle pliche a livello del corpo e del fondo dello stomaco
causata dall’ipertrofia delle cellule parietali.
La Phmetria rivela un Ph gastrico di circa 1.
Confermata la diagnosi di gastrinoma si procede alla localizzazione del tumore tramite RMN, TC e
angiografia pancreatica.
Terapia
Se il tumore è solitario ben circoscritto e non ha dato metastasi questo viene rimosso.
Se invece si ha una neoplasia endocrina multipla o sono presenti metastasi si utilizza la terapia medica (H2
antagonisti ed inibitori delle pompa protonica) e se questa fallisce si procede con la pancreatectomia
totale.
Insulinoma
È un tumore che origina dalle cellule β del pancreas.
Nell’80% dei casi si tratta di un adenoma singolo benigno, nel 10% di un carcinoma e nel 10% di adenomi
multipli.
Gli insulinomi rappresentano i tumori neuroendocrini del pancreas più comuni.
Picco di incidenza 30-60 anni.
90% sono sporadici, nel 10% sono associati alla sindrome multipla neuroendocrina (MEN 1) insieme ad
adenomi ipofisari e ipoplasia o adenoma delle paratiroidi.
Nel 50% sono pluriormionali, producono anche glucagone, PP, gastrina.
http://www.hackmed.org
[email protected] 116
Il sintomo cardine degli insulinomi è la presenza a digiuno di crisi ipoglicemiche che se non trattate possono
evolvere fino al coma ipoglicemico.
La sintomatologia è dovuta alla liberazione inappropriata di insulina da parte delle cellule tumorali.
Le concentrazioni così elevate di insulina non dipendono da una sua aumentata produzione da parte del
tumore bensì da una difettosa regolazione dell’omeostasi glicemica per cui le cellule tumorali continuano a
secernere insulina anche in presenza di basse concentrazioni glicemiche (secrezione inappropriata di
insulina).
Anatomia patologica
Gli insulinomi variano di dimensioni da lesioni così piccole da essere difficili da individuare anche al tavolo
operatorio a masse enormi.
Appaiono come noduli capsulati composti da cordoni o isolotti di cellule B ben differenziate che
all’immunoistochimica mostrano granuli ripieni di insulina.
P.S. l’iperinsulinismo si può associare anche ad iperplasia delle cellule B caratteristica dei neonati di madre
diabetica.
La lunga esposizione all’iperglicemia materna infatti determina un aumento del numero e delle dimensioni
delle insule che nel periodo postnatale diventano iperattive determinando episodi di ipoglicemia.
Clinica
L’ipoglicemia si manifesta lontano dai pasti o la mattina a digiuno ed è precipitata dall’attività fisica.
I sintomi dell’ipoglicemia sono il risultato della sofferenza del SNC dovuta all’insufficiente apporto di
glucosio (neurogliceopenia) e all’attivazione adrenergica.
Possono quindi essere classificati in 2 gruppi:
1. sintomi adrenergici
•
sudorazione
•
tremori
•
agitazione
•
midriasi
•
palpitazioni
•
tachicardia
2. sintomi neuroglicopenici
•
astenia
•
cefalea
•
difficoltà di concentrazione
•
alterazioni di coscienza
•
disturbi visivi
•
eruttazione, fame, nausea, vomito, crampi addominali
•
irritabilità e comportamento bizzarro (per interessamento corticale)
•
attacchi epilettici e convulsioni (per interessamento mesencefalico)
successivamente si ha confusione, allucinazioni e crisi convulsive fino al coma con tendenza all’ipotermia.
I sintomi adrenergici sono prevalenti quando la glicemia diminuisce rapidamente e costituiscono un segnale
di allarme per il paziente che può interrompere la crisi ingerendo dello zucchero.
Queste manifestazioni possono tuttavia mancare in pazienti con neuropatia autonomica o in trattamento con
β-bloccanti, in questi casi l’ipoglicemia può progredire inavvertita fino al coma.
Al contrario quando l’ipoglicemia insorge lentamente predominano i sintomi neuroglicopenici.
Nei soggetti sani si verifica un incremento degli ormoni controregolatori quando la glicemia è di 65 mg/dl i
sintomi adrenergici compaiono quando la glicemia scende sotto i 55 mg/dl i sintomi neuroglicopenici
compaiono a 50 mg/dl ma possono mancare finchè la glicemia non raggiunge i 20 mg/dl dato che
l’attivazione adrenergica incrementa il flusso cerebrale così da consentire un sufficiente apporto di glucosio
al cervello.
Nei soggetti anziani con lesioni aterosclerotiche questo meccanismo di compenso non è possibile ed i segni
di nerutoglicopenia possono manifestarsi per valori di glicemia più elevati.
Infine i pazienti diabetici in cattivo stato di compenso possono diventare sintomatici quando la glicemia è di
80-100 mg/dl per il fatto che l’iperglicemia protratta determina un innalzamento della soglia di risposta degli
ormoni controregolatori all’ipoglicemia.
Caratteristicamente, i sintomi associati all’insulinoma inizialmente sono intermittenti, perché la secrezione di
insulina è transitoria.
Questo è associato quindi spesso ad un periodo di digiuno.
http://www.hackmed.org
[email protected] 117
Con il progredire del tempo si instaurano costantemente.
Diagnosi
Per fare diagnosi di ipoglicemia è necessaria la cosiddetta triade di Whipple:
• Ipoglicemia a digiuno
• Sintomi di ipoglicemia
• Reversibilità di questi dopo infusione endovenosa di glucosio
La triade di Wipple va dimostrata con test del digiuno prolungato:
¾ Attacco glicemico a digiuno
¾ Glicemia < 26 mg/dl durante l’attacco
¾ Risposta della sintomatologia alla assunzione di zucchero
Dosaggio insulina e peptide C ogni 6 ore o quando ha l’attacco.
In genere i sintomi sono così precoci che la diagnosi si fa per tumori ancora molto piccoli.
In circa il 30% dei pazienti con insulinoma si ha una ipoglicemia sintomatica dopo una notte di digiuno.
Per gli altri pazienti è necessario programmare un digiuno prolungato fino a 72 ore in regime di ricovero e
sotto stretta sorveglianza medica con prelievi ogni 6 ore per la determinazione della glicemia e
dell’insulinemia (anche peptide C e proinsulina).
La prova viene interrotta quando il paziente presenta sintomi di ipoglicemia e dopo il prelievo viene infuso
glucosio.
I criteri di diagnosi dell’insulinoma sono:
•
Insulinemia > 6µU/ml ed elevati livelli di peptide C e proinsulina
•
Insulina / glucosio > 0.4
•
Assenza di Ab anti-insulina e sulfaniliuree
Se l’ipoglicemia non compare entro 72 ore il digiuno può essere protratto oltre le 72 ore e associato
all’esercizio fisico.
Nei casi in cui la risposta al digiuno sia dubbia può essere fatto un carico endovenoso di insulina e valutata
la soppressione del peptide C, una mancata soppressione infatti è indicativa di produzione autonoma di
insulina.
È anche opportuno determinare la calcemia per escludere un iperparatiroidismo associato in caso di MEN I.
Per localizzare il tumore vengono impiegate l’ecografia, la TC e l’arteriografia (somministrazione del
mezzo di contrasto tramite l’arteria pancreatico-duodenale: i tumori sono ipervascolarizzati).
Può essere fatta una Eco-endoscopia per lesioni cefalopancreatiche.
L’octreoscan consiste nella scintigrafia con octreotide che si lega ai recettori per la somatostatina, è
importante non tanto per la localizzazione ma per la terapia perché se ci sono recettori si può utilizzare la
somatostatina per ridurre la sintomatologia visto che blocca la secrezione di insulina.
La diagnosi differenziale comprende alcune disfunzioni di ipersecrezione di sostanze iperglicemizzanti,
come tumori secernenti cortisolo, feocromocitoma, e la assunzione di sostanze come insulina o composti
simili.
terapia
La terapia definitiva consiste nella resezione chirurgica.
Durante l’intervento chirurgico è importante monitorare i livelli di glicemia poiché la completa rimozione
del tessuto tumorale ne determina un genere un brusco aumento.
La terapia medica si basa sul diazossido che inibisce la secrezione insulinica o l’octreotide una sostanza
somatostatina-simile che determina un incremento della glicemia (solo nei pazienti positivi all’octreoscan).
Attenzione per quei pazienti che non possono essere operati, a monitorare sempre la terapia cronica: in non
pochi casi possono insorgere metastasi secernenti glucagone che implicano un radicale cambiamento dei
farmaci somministrati.
Vipoma
Malattia rara (1 caso su un 10 milioni) caratterizzata dalla presenza di un tumore entero-pancreatico
produttore di VIP polipeptide intestinale vasoattivo.
Le manifestazioni cliniche sono secrezione endoluminare di potassio, con diarrea acquosa di tipo
secretorio, ipokalemia, ipocloremia, disidratazione, flushing e insufficienza renale.
La diarrea può superare i 3 litri al giorno e la perdita di bicarbonato e potassio con le feci produce acidosi
metabolica e ipokaliemia (l’acidosi ipokaliemica danneggia il rene).
Il VIP induce la secrezione di glucagone e anche la diminuzione del potassio.
http://www.hackmed.org
[email protected] 118
La secrezione di insulina è diminuita dalla perdita di potassio.
Le cellule insulari che controllano la glicemia sono infatti così regolate: il glucosio che entra dall’esterno
attiva la glicolisi, produce ATP, e attiva la pompa del sodio, la quale pompa all’intero potassio.
La [K+] è quindi proporzionale a quella del glucosio.
L’insulina quindi viene secreta in presenza di alte concentrazioni di potassio, il glucagone durante la
ipokalemia.
Molti pazienti con VIPoma sviluppano iperglicemia.
La diagnosi è facile e si basa sulla presenza di alti livelli di VIP in associazione a diarrea di almeno 1l al
giorno.
I VIPomi a differenza di altri tumori pancreatici possono raggiungere dimensioni notevoli prima di essere
clinicamente evidenti.
La localizzazione del tumore viene fatta tramite ecografia, TC e angiografia.
Sono in genere abbastanza maligni, e al momento della diagnosi hanno già dato metastasi nel 60% dei casi.
La terapia è l’escissione chirurgica, ma non sempre questa è possibile per la presenza di metastasi.
Esistono farmaci anti secretori, come il prednisolone, e l’octreotide.
Nei pazienti con metastasi viene usata la chemioterapia con streptozocina e 5-fluoro-uracile.
Glucagoma
È un tumore neuroendocrino che origina dalle cellule A e secerne glucagone.
Nel 70% dei casi si tratta di tumori maligni a lenta crescita localizzati prevalentemente nel corpo e nella coda
del pancreas.
In alcuni casi sono associati alla MEN1.
Livelli di glucagone sopra ai 1000 ng/l sono indicativi, livelli più bassi possono essere associati al diabete ed
altre patologie del fegato.
Le alterazioni metaboliche nel catabolismo degli aminoacidi e nella produzione di glucosio producono
iperglicemia, diminuzione della concentrazione di aminoacidi (ipoaminoacidemia) anche del 25%, e
ipocolesterolemia.
L’attività catabolica del glucagone determina anche calo ponderale.
Una manifestazione caratteristica è un rash cutaneo migrante o dermatite eczematosa caratterizzata da
lesioni maculoeritematose a margini migranti evolventi in lesioni bollose che alla guarigione residuano
pigmentazioni bronzine.
Le lesioni sono spesso confluenti e sono localizzate prevalentemente al viso e nelle aree soggette a
sfregamento quali gomiti, glutei, estremità distali e perineo.
L’iperglicemia porta alla resistenza insulinica che predispone al diabete secondario.
La localizzazione del tumore viene fatta tramite ecografia TC e arteriografia.
La terapia radicale chirurgica è risolutiva solo nel 30% dei casi: nonostante le dimensioni, infatti, non danno
sintomi importanti per molto tempo.
La chemioembolizzazione dell’arteria epatica e l’alcolizzazione danno risultati buoni, molto meglio della
chemioterapia.
La terapia medica in caso di tumori non resecabili si basa su streptozotocina, 5-fluorouracile e
somatostatina.
La lenta crescita comunque permette una lunga sopravvivenza anche di quei pazienti che hanno già
metastasi.
Somatostatinoma
È un tumore neuroendocrino delle cellule D secernente somatostatina caratterizzato dalla triade
sintomatologica:
• Diabete mellito dovuto alla ridotta secrezione di insulina (associata anche a ridotta secrezione di
glucagone)
• Colelitiasi dovuta alla inibizione della contrazione della colecisti con conseguente stasi biliare che
facilita la formazione di calcoli (l’inibizione della colecistochinina)
• Diarrea probabilmente per l’inibizione del blocco di ormoni che stimolano la motilità intestinale
• steatorrea per inibizione della secrezione pancreatica sia di enzimi che di bicarbonato
In genere sono unici principalmente localizzati alla testa del pancreas, voluminosi e metastatici al momento
della diagnosi.
http://www.hackmed.org
[email protected] 119
La diagnosi viene fatta tramite il riscontro di elevati livelli di somatostatina e ridotte concentrazioni di GH,
glucagone ed insulina dopo carico orale di glucosio.
La terapia medica consiste nella somministrazione di streptozotocina e 5-fluorouracile.
Carcinoidi
Sono tumori a lenta velocità di crescita ma con capacità di invasione e metastatizzazione e pertanto maligni.
Originano dalle cellule enterocromaffini.
Le sedi sono:
• Appendice 35-45%
• Intestino tenue 20-40%
• Sigma-retto 12-15%
• Bronchi 10-14%
• Altre sedi: esofago-stomaco-colon , vie biliari, pancreas, tratto urogenitale, tiroide, mammella
L’età media di insorgenza è la 5-6° decade.
I carcinoidi rappresentano il 50% delle neoplasie maligne dell’intestino tenue.
Anatomia patologica
I tumori che insorgono nello stomaco e nell’ileo tendono ad essere multicentrici mentre i rimanenti tendono
ad essere solitari.
I carcinoidi del tenue si presentano come rilevatezze bulbose del fondo che spesso ne ostruiscono il lume.
In altre sedi del tratto GI si presentano come placche giallastre o noduli grigiastri.
Caratteristicamente al taglio si presentano solidi e di consistenza aumentata a causa della ricca reazione
desmoplastica.
Istologicamente le cellule si presentano uniformi con citoplasma scarso e nucleo rotondo o ovale con
cromatina addensata.
L’architettura è variabile (aspetti insulari, trabecolari, ghiandolari o indifferenziati) se la struttura è
ghiandolare la d.d. con l’adenocarcinoma viene fatta tramite l’immunoistochimica.
Le cellule infatti contengono granuli secretori contenenti cromogranina A, sinaptofisine e enolasineurospecifica.
La malignità è correlata a:
sede: 34% dei carcinoidi che originano dal piccolo intestino sono maligni contro 2% dell’appendice.
Dimensioni del tumore: le metastasi compaiono in funzione delle dimensioni
Presentazione clinica: emorragia ed occlusione sono in genere da tumore maligno
Gli unici criteri di malignità sono l’infiltrazione dei tessuti contigui e la presenza di metastasi a distanza.
Clinica
In alcuni casi la neoplasia è asintomatica e viene scoperta in modo casuale.
Sintomi da massa occupante spazio:
¾ Stomaco: emorragia
¾ Ileo: emorragia o occlusione
¾ Appendice: appendicite acuta
¾ Retto: asintomatici o emorragia
Può anche essere presente una sindrome da carcinoide espressione di una ipersecrezione ormonale di
serotonina o 5-HT.
La serotonina è una amina biogena che deriva dal triptofano la cui sintesi avviene a livello delle cellule
enterocromaffini dotate della specifica decarbossilasi.
La 5-HT una volta prodotta passa in circolo dove in minima parte rimane libera ed in grado di esplicare la
sua azione biologica e in massima parte viene captata dalle piastrine che costituiscono una sorta di deposito
circolante e che la liberano occasionalmente in corso di infiammazione o nei fenomeni emocateretici.
La serotonina viene degradata dal fegato grazie alle monoaminossidasi o MAO ad acido 5idrossindolacetico 5-HIAA.
La serotonina ha diverse azioni biologiche:
• Azione vasomotoria
• Effetto antidiuretico per azione costrittiva sull’arteriola efferente
• Aumento della motilità gastrointestinale
• Stimolazione della secrezione intestinale di acqua ed elettroliti
• Inibizione della secrezione acida gastrica
http://www.hackmed.org
[email protected] 120
• Broncocostrizione
• Azione sulla regolazione dell’emostasi
Il carcinoide inoltre può produrre altri ormoni che contribuiscono alla sintomatologia: callicreina (che è
responsabile della formazione di bradichinina), istamina, prostaglandina, motilina, sostanza P.
Le manifestazioni della sindrome da carcinoide sono rappresentate da:
• Flush cutaneo che consiste in una vampata di calore e nell’arrossamento seguito da cianosi del
volto spesso secondario all’assunzione di alcol, fragole, caffè, cioccolato, all’eccitamento psichico o
all’esercizio fisico, può diffondere anche al collo, agli arti superiori ed al torace (è dovuto all’azione
vasodilatatrice della bradichinina) può dare anche telangectasie
• Diarrea spesso accompagnata da tenesmo e da dolore addominale crampiforme
• Crisi asmatiformi di broncocostrizione
• Reazioni fibrotiche dell’endotelio (fibrosi endocardica destra) e specialmente delle valvole
tricuspidali e polmonari (ispessimento e stenosi dei lembi valvolari)
• Oliguria e riduzione della VFG
• Dermatite pellagroide, edemi perilesionali e declivi che diventano rapidamente edemi duri (fibrosi),
artriti
Si ha inoltre ispessimento del meso (per reazione fibrotica) nei pressi del tumore in caso di carcinoide
dell’intestino.
Per i carcinoidi intestinali lo sviluppo della sindrome richiede la presenza di metastasi epatiche che invece
non sono necessarie per i carcinoidi extraintestinali (come quelli del polmone e dell’ovaio).
Ciò è dovuto al fatto che il sangue refluo dall’intestino viene drenato tramite il sistema portale direttamente
al fegato dove la 5-HT viene inattivata cosa che non avviene in caso di metastasi.
Nei carcinoidi extraintestinali il sangue che drena il tumore raggiunge tardivamente il fegato e la 5-HT viene
quindi metabolizzata a livello polmonare, questo è anche il motivo per cui il danneggiamento avviene a
carico della parte destra del cuore.
Inoltre il carcinoide può secernere altri ormoni tipici dei GEP manifestandosi anche con altre sindromi.
Diagnosi
In assenza di segni clinici della sindrome da carcinoide la diagnosi è in genere occasionale o come reperto
chirurgico (ex. in caso di appendicectomia per appendicite) o in corso di esame endoscopico o all’autopsia.
Se invece il paziente presenta sintomi tipici di sindrome da carcinoide viene fatto il dosaggio ematico di 5HT nel plasma e nel sangue povero di piastrine (perché le piastrine captano la serotonina) e acido 5-HIAA
urinario.
Possono essere anche fatti test di stimolazione con alcol, secretina, pentagastrina, Ca che determinano il
rilascio di serotonina da parte delle cellule tumorali.
Le indagini strumentali dipendono dalla sede del tumore.
Può essere fatta la scintigrafia con metaiodiobenzilguanidina (MIBG) che consente la localizzazione del
tumore mediante la fissazione del radioisotopo alla massa tumorale.
Terapia
Si basa sull’exeresi chirurgica del tumore e delle metastasi.
Solo in caso in cui non sia realizzabile una asportazione completa è indicata l’exeresi parziale della neoplasia
allo scopo di diminuire la massa producente 5-HT e ritardare lo sviluppo della neoplasia.
Le metastasi epatiche vanno sempre trattate sia a scopo curativo (se uniche) o per controllare la
sintomatologia clinica.
In associazione con la terapia chirurgica sottrattivi o in alternativa ad essa può essere fatta anche terapia
medica basata su:
• Chemioterapia
• Farmaci che bloccano la sintesi di serotonina
• Octreotide
Le metastasi uniche epatiche di adenocarcinoma del colon, tumore di Wilms, carcinoide sono le uniche che
vengono trattate con la resezione o con il trapianto di fegato.
INDICAZIONI PER LA ERCP
Sospetto di malattia biliare
• Ittero o colestasi
http://www.hackmed.org
• Complicazioni post-colecistectomia
• Complicazioni post-chirurgia biliare
• Colangite acuta
• Pancreatite acuta biliare
• Conferma di alterazioni dimostrate in altre metodiche di immagine
Sospetto di malattia pancreatica
• Ittero ostruttivo
• Sintomatologia dolorosa addominale
• Iperamilasemia
• Recente insorgenza di diabete mellito
• Dimagrimento inspiegabile
• Steatorrea
• Varici gstriche
• Ascite o versamento pleurico
• Papillotomia endoscopica
Procedure endoscopiche terapeutiche
• Drenaggio biliare endoscopico
• Drenaggio pancreatico endoscopico
• Dilatazione delle stenosi con palloncino
Valutazione preoperatoria
• Panceatite cronica
• Pseudocisti pancreatiche
Altre procedure
• Raccolta di succo pancreatico o di bile
• Manometria dello sfintere di Oddi
[email protected] 121