CORSO DI BIOCHIMICA PER INGEGNERIA
BIOMEDICA
2° ESERCITAZIONE
FIBROSA
1) Il collagene è una proteina________________(globulare
/ fibrosa).
È
formata
CATENE ALFA
tre_____________________(catene
da
alfa/alfa
eliche) con
SINISTRORSO
__________________(destrorso/sinistrorso)
che vanno a
andamento
DESTRORSO
formare il tropocollagene che ha andamento__________________(destrorso
/sinistrorso). La struttura primaria è caratterizzata dalla ripetizione del
GLY/X/Y
tripeptide_______________(Gly-X-Y/Ala-X-Y);
X
e
Y
possono
essere
4-IDROSSIPROLINA O 5-IDROSSILISINA
____________________________________________________________,
residui che
hanno
subito
avvengono
modificazioni
ad
opera
di
post-traduzionali.
un
enzima
Queste
che
modificazioni
necessita
di
VITAMINA C
____________________(vitamina
C/ vitamina B) e la cui carenza comporta
SCORBUTO (pellagra / scorbuto).
l’insorgenza della malattia ______________
Catena
α sinistrorsa
Collagene
Tre eliche si arrotolano
insieme con un
andamento destrorso
( TROPOCOLLAGENE)
N
H2 C
O
O
O
C
C
C
C
N
CH
1
2
3
5
HO
O
CH
1
Collagene
Gly -X-Y
Unità tripeptidica
ripetuta
CH2H2 C
2
N
2
3
5
4
4
CH
CH
N
CH
1
2
HCH
2C 5
3 CH
4
4
CH2
CH2
4-idrossiprolina
HO
ACIDO ASCORBICO
(vitamina C)
CH
C
NH
CH
CH2
CH2
CH2
CH2
C
2
3 CHH2 C 5
OH
NH
CH
1
O
O
OH
H
C
OH
H
C
CH2
CH2
NH3
NH3
OH
5-idrossiLisina
Collagene
Legami covalenti
CROCIATI
inter-intramolecolari
tra Lys, HyLys, o His
TROPOCOLLAGENE
MALATTIE DEL COLLAGENE DOVUTE A MUTAZIONI
GENICHE:
sostituzione di un residuo di Gly con Cys o Ser in ciascuna
catena
α:
Sindrome di Ehlers-Danlos
MALATTIE DEL COLLAGENE DOVUTE A MUTAZIONI
GENICHE:
sostituzione di un residuo di Gly con Cys o Ser in ciascuna
catena
α:
Osteogenesi imperfetta (sindrome ossa di vetro)
Collagene
SCORBUTO
carenza di
vitamina C
2) Le -cheratine (rispondere vero o falso)
a) sono proteine globulari
b) sono formate prevalentemente da -eliche
c) sono formate prevalentemente da residui
aminoacidici di piccole dimensioni
d) l’unità fondamentale delle -cheratine è la
protofibrilla
e) le struttura delle -cheratine è resa stabile da
legami idrogeno
-cheratina
catena polipeptidica
con oltre 100 residui,
elica destrorsa
due polipeptidi danno
origine a un
avvolgimento avvolto
dimerico e sinistrorso
2 file sfalsate di dimeri si associano testa-coda
2 protofilamenti si associano e formano le protofibrille
-cheratina
4 protofibrille
Conformazione nativa
-cheratina
Il numero dei ponti disolfuro è indice della durezza delle
α-cheratine
Disegnare la curva di ossigenazione di una emoglobina avente
un valore di p50 pari a 30 torr e determinare come varierà
(rappresentandole graficamente) questa curva al variare dei
seguenti parametri:
1) diminuzione del pH
2) diminuzione della concentrazione di BPG
3) motivare le risposte ai punti 1) 2)
3.
Curva di dissociazione dell’O2 per l’emoglobina
Hb + 4O2 = Hb(O2 )4
Hb
sigmoidale
L’emoglobina
lega
l’O2
quando
la
pressione
parziale
del gas (pO2) è
elevata (polmoni) e
lo rilascia quando la
pressione è bassa
(tessuti).
pCO2↓
pCO2↑
tu
Camera mia bella
Influenza della pCO2
Influenza del pH
tessuti
polmoni
Influenza del
2,3- BPG
4. Data la seguente reazione:
Fruttosio-6-fosfato
→
Fruttosio-1,6-bisfosfato
Fosfofruttochinasi
Calcolare la velocità iniziale della reazione enzimatica della
fosfofruttochinasi sapendo che la concentrazione iniziale del
Fruttosio-6-fosfato è 0.03 mM, la concentrazione della
fosfofruttochinasi è 10 mM, Km corrisponde a 0.1 mM, Vmax a
0.66 mM/min.
Spiegare brevemente il significato di Km.
CINETICA ENZIMATICA:
concentrazione del substrato
• La velocità di una reazione catalizzata da un
enzima aumenta all’aumentare della
concentrazione del substrato fino a
raggiungere una velocità massima (Vmax).
In questa condizione i siti attivi
dell’enzima sono saturi del substrato
Quando tutto l’enzima è saturato con il
substrato:
[ES] = [Etot]
V0 = Vmax
La curva che esprime la
relazione tra V0 e S ha un
andamento iperbolico ed è
espressa algebricamente dalla
equazione di Michaelis-Menten
Costante di
Michaelis e
Menten
La Km è quella
concentrazione di substrato
a cui la V0 è pari a metà
della Vmax
L’equazione di
Michaelis-Menten
• descrive la variazione della velocità
di reazione al variare della
concentrazione del substrato.
v0 = velocità iniziale della reazione
Vmax= velocità massima
Km = costante di Michaelis-Menten
[S] = concentrazione del substrato
Caratteristiche della Km
• La Km è pari alla concentrazione di substrato alla
quale la velocità della reazione (V0) è 1/2 della
Vmax.
• La Km riflette l’affinità dell’enzima per il
substrato:
Km piccola = alta affinità dell’enzima per il substrato
Km grande = bassa affinità dell’enzima per il
substrato.
• Ogni enzima ha una Km caratteristica per un dato
substrato.
• La Km non varia al variare della [E].
I PARAMETRI
CINETICI POSSONO
ESSERE USATI PER
CONFRONTARE LE
ATTIVITA’ DEGLI
ENZIMI
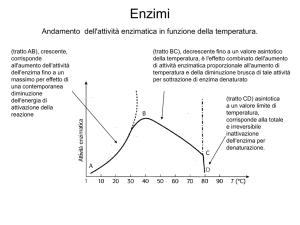
6) Che influenza possono avere temperatura e pH sull’attività di
un enzima?motivare la risposta
CINETICA ENZIMATICA
FATTORI CHE MODIFICANO LA VELOCITA’
DELLE REAZIONI ENZIMATICHE:
1) pH (curva a campana)
2) temperatura (curva bifasica a causa della
denaturazione)
3) [S] (iperbole rettangolare a causa della
saturazione)
4) inibitori
CINETICA ENZIMATICA:
pH
• Ciascun enzima ha un pH ottimale al quale la
reazione è catalizzata con la massima
efficienza.
Esso in genere rispecchia il pH dell’ambiente in
cui l’enzima svolge normalmente le sue funzioni.
• La concentrazione degli H+ (pH) influenza
l’attività enzimatica modificando la geometria del
sito attivo e la distribuzione delle cariche
elettriche dei gruppi coinvolti nel legame del
substrato o nel processo catalitico stesso.
• Valori di pH estremi possono anche provocare la
denaturazione dell’enzima.
CINETICA ENZIMATICA:
pH
CINETICA ENZIMATICA:
temperatura
• La velocità di reazione aumenta con
l’aumentare della temperatura
fino a raggiungere un picco.
• Un ulteriore innalzamento della
temperatura provoca una
diminuzione della velocità di
reazione a causa della
denaturazione dell’enzima.
CINETICA ENZIMATICA:
temperatura
7) Indicare se le seguenti affermazioni relative al legame
dell’ossigeno all’emoglobina sono vere o false.
a) L’effetto Bohr fa diminuire l’affinità per l’ossigeno in seguito
all’aumento del pH.
b) Il biossido di carbonio fa aumentare l’affinità per l’ossigeno
dell’emoglobina , legandosi ai gruppi amminici terminali delle
catene polipeptidiche.
c) L’affinità dell’emoglobina per l’ossigeno aumenta
all’aumentare della percentuale di saturazione.
d) Il tetramero di emoglobina lega 4 molecole di 2,3-BPG.
e) Il sangue fetale ha un’affinità per l’ossigeno più elevata del
sangue dell’adulto, perché la HbF ha una minore affinità per
il 2,3-BPG.
f) La composizione dell’HbF è α2δ2.
Influenza del
2,3- BPG
Influenza del
2,3- BPG
Il 2,3 BPG è una piccola molecola
dotata di cariche negative che
consentono il legame a una serie di
cariche positive di catene laterali di
AA situati sulle due catene β,
formando ponti salini e stabilizzando
la forma T.
Il sito per il 2,3 BPG è presente
solo nella forma tesa T.
Influenza del
2,3- BPG
Nell’Hb deossigenata (T) è
presente
una
cavità
centrale che si restringe
consistentemente in Hb in
forma R (ossigenata): tale
cavità nella forma T ospita
il
2,3
BPG,
modulatore
allosterico negativo.
EMOGLOBINA FETALE (HbF)
Il significato del 2,3 BPG
appare chiaro se si confronta
la curva di saturazione dell’
HbA materna e dell’ Hb e
fetale.
Gli
eritrociti
fetali
contengono
un
Hb
con
struttura quaternaria α2 2.
Fra le catene il 2,3-BPG si
lega più debolmente rispetto a
quello che avviene nell’ HbA.
La curva di saturazione dell’’Hb
fetale è a sinistra rispetto a
quella della HbA materna,
indicando maggiore affinità
per O2.
L'O2 rilasciato nella circolazione placentare dall’ Hb materna a certe
pressioni parziali, viene assunto dall’ Hb fetale, più affine, e ciò
soddisfa l'esigenza fisiologica di rifornimento di O2 al feto da parte
della madre.
8) Come possono essere classificate le proteine di membrana?
Componente
proteica
INTEGRALI: strettamente
associate al doppio strato
lipidico tramite interazioni
idrofobiche (rimovibili con
detergenti oppure tramite
reazioni enzimatiche)
PERIFERICHE: interazioni
elettrostatiche e legami a H con
i domini idrofilici delle proteine
integrali e con le teste polari dei
lipidi di membrana (rimovibili
con agenti in grado di interferire
con il legame)
ANFITROPICHE: si trovano sia
nel citosol che associate alle
membrane a seconda del tipo di
regolazione a cui sono
sottoposte
Componente
proteica
Proteine integrali di membrana
Interazioni idrofobiche tra lipidi
di membrana e domini idrofobici
delle proteine
Componente
proteica
Proteine integrali di membrana
Barile β
Porine
Consentono ai soluti
polari di attraversare
la membrana
9) Quali sono i costituenti di questi lipidi di membrana:
a) triacilgligerolo
b) acido fosfati dico
c) ceramide
Triacilgliceroli
( Trigliceridi )
Tr i a c i l gl i c e ro l i ( Tr i gl i ce r i d i )
– T. Semplici:
Glicerolo
Legame
estere
3 ac. grassi uguali
– T. Misti:
Glicerolo
2 (o 3) ac. grassi diversi
Glicerofosfolipidi ( fosfogliceridi)
Legame estere
Legame
fosfodiestere
Legame estere
Glicerofosfolipidi (fosfogliceridi)
Glicerofosfolipidi (fosfogliceridi)
sfingolipidi
Legame ammidico
10) Scrivere la formula di struttura di un triacilglicerolo a
piacere e specificare:
è un trigliceride misto o semplice?
Che tipi di legami sono presenti tra le varie molecole
costituenti?
Tr i a c i l gl i c e ro l i ( Tr i gl i ce r i d i )
– T. Semplici:
Glicerolo
Legame
estere
3 ac. grassi uguali
– T. Misti:
Glicerolo
2 (o 3) ac. grassi diversi
11) Descrivere in modo sintetico le caratteristiche
dei doppi strati lipidici. Inoltre, spiegare
brevemente a cosa si riferiscono i seguenti termini:
a) mobilità trasversale
b) mobilità laterale
c) asimmetria
Modello a mosaico fluido
Componente
Lipidica
Aggregazione di
Lipidi Anfipatici
in acqua
Glicerofosfolipidi
Sfingolipidi
Liposoma
Dinamica delle membrane
La struttura e la flessibilità delle
membrane dipendono dalla temperatura e
dalla composizione in lipidi
Le membrane sono
FLUIDE
La struttura e la
flessibilità delle
membrane dipendono
dalla temperatura e
dalla composizione in
lipidi
a temp. fisiologiche stato fluido ordinato
a temperature intermedie
alla temperatura di transizione
di fase (Tm) passano allo stato
fluido
La temperatura di
transizione aumenta in
proporzione
alla lunghezza della catena
degli acidi grassi e al grado
di saturazione
Dinamica delle
membrane
a) Il calore produce un movimento
termico delle catene laterali
Transizione solido → fluido
b) Diffusione laterale nel
piano del doppio strato
c) Diffusione attraverso il doppio strato
t1/2 → da ore a giorni ( reazione non catalizzata)
.
secondi (reazione catalizzata da flippasi)
I fosfolipidi, oltre a spostarsi
lateralmente lungo il piano dello
strato bimolecolare, possono
passare da uno strato all’altro
per inversione testa-coda
FLIP-FLOP
Dinamica delle
membrane
FLIP-FLOP
questo movimento è
limitato dalla difficoltà
di trasferire la testa
idrofilica della molecola
lipidica attraverso la
zona centrale
idrofobica dello strato
bimolecolare.
A temperatura fisiologica
Dinamica delle membrane
Ca 2+
PE=
fosfatidiletanolammina
PS= fosfatidilserina
Interazione del Colesterolo
con i lipidi di membrana
Interazione del Colesterolo
con i lipidi di membrana
12) Descrivere le differenze tra trasporto attivo e trasporto
passivo attraverso le membrane
Diffusione
semplice
Trasporto di
soluti
attraverso le
membrane
Trasporto di
soluti
attraverso le
membrane
Soluti polari
Diffusione facilitata
trasporto passivo
Trasporto di soluti attraverso le
membrane:
cotrasporto
Trasporto di soluti attraverso le
membrane
Velocità ridotte,
Saturabili
Alta stereospecificità
Velocità elevate
non saturabili
Minore stereospecificità
Diffusione secondo
gradiente di
concentrazione
Diffusione contro gradiente di concentrazione
Trasporto di soluti attraverso le
Diffusione contro gradiente membrane
di concentrazione
Trasporto di soluti
attraverso le membrane
Un esempio di trasporto
attivo primario è dato dalle
ATPasi:
Na+ K+ ATPasi
ha la funzione di
mantenere la differenza di
composizione ionica tra il
citosol e il mezzo
extracellulare
[Na+]↓
[K+]↑
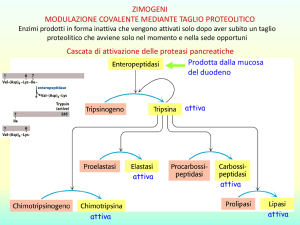
13) Che cosa sono gli enzimi? Quale ruolo
svolgono all’interno degli esseri viventi?
Gli Enzimi
catalizzatori biologici
rendono possibile da un
punto di vista cinetico
le reazioni chimiche
Sono le proteine più importanti e più specializzate
Presentano un elevato grado di specificità per il
substrato
Operano in soluzioni acquose con temperature e pH
blandi
Struttura generale degli enzimi
Sono proteine
globulari complesse:
Parte proteica
Addotto
enzima-substrato
Parte
non-proteica
Cofattore
(ione metallico)
Coenzima
(natura organica: vitamina o altro)
Gruppo
Prostetico
SITO ATTIVO:
specifica porzione
dell’enzima,
deputata al
legame con il
substrato che
porta alla
formazione
dell’addotto ES
Addotto ES
Proprietà dei Catalizzatori
I catalizzatori sono
sostanze capaci di
abbassare l’energia di
attivazione rendendo piú
facile la formazione
dell’addotto ES: la reazione
diviene quindi piú veloce.
14) Sapendo che :
a)il ΔG di idrolisi dell’ ATP ( ATP →ADP + Pi) corrisponde a -31 KJ/n
b)il ΔG di idrolisi della reazione
Fruttosio 1,6 bisfosfato
Pi + fruttosio 6-fosfato
corrisponde a -13.7 KJ/n
Calcolare il ΔG della reazione
ATP + Fruttosio 6 fosfato → ADP + Pi
+ fruttosio 1,6-bisfosfato
Reazioni accoppiate
Somma :
Reazioni accoppiate
1° semireazione endoergonica
2° semireazione esooergonica
Reazione complessiva accoppiata
15) Spiegare in che cosa consiste la fosforilazione a livello
del substrato. Fai un esempio
7) Fosforilazione a livello del substrato:
ADP riceve un fosfato da un intermedio
metabolico
10) Fosforilazione a livello del substrato:
ADP riceve un fosfato da un intermedio metabolico