TERMODINAMICA
La termodinamica è quella parte della fisica che riguarda gli scambi di energia fra sistemi;
la termochimica ne costituisce un capitolo, ma si limita ad affermare il principio di
conservazione dell’energia, mentre non dice nulla ne’ sulla qualità dei vari tipi di energia,
ne’ sulla direzione in cui si evolvono spontaneamente i processi. In questa parte si
cercherà di capire qual è la spinta che fa sì che un dato processo si evolva
spontaneamente in un dato modo e sotto quali vincoli le diverse forme di energia possono
trasformarsi l’una nell’altra.
Reversibilità e spontaneità.
Si dice spontanea una trasformazione che avviene nel senso indicato senza interventi
dall’esterno. E’ esperienza comune che vi sono trasformazioni che avvengono
spontaneamente in tutti i casi (es. combustione del carbone, espansione di un gas) e
trasformazioni che non possono mai avvenire spontaneamente (es. compressione di un
gas, decomposizione di CO2 in C + O2), e inoltre vi sono trasformazioni che avvengono
spontaneamente in certe condizioni (es. di temperatura e pressione) e non in altre. Il più
semplice tentativo di razionalizzazione di questi comportamenti potrebbe essere che le
reazioni spontanee siano quelle esotermiche, che cioè avvengono con cessione verso
l’esterno di energia termica. In realtà, benché molte reazioni esotermiche siano
spontanee, almeno in condizioni ambiente, ciò non è necessariamente vero: ad es. in
condizioni ambiente è spontanea la fusione del ghiaccio, che è endotermica. E’ allora
interessante stabilire come prevedere se e in quali condizioni una data trasformazione
potrà essere spontanea, sia per progettare le condizioni migliori in cui farla avvenire col
massimo rendimento (nel caso, ad es., che si voglia preparare industrialmente una data
sostanza). sia per mettersi nelle condizioni migliori per impedirla, quando sia
indesiderabile (es. esplosioni, corrosione dei metalli ecc.). Va considerato un concetto
importante: ogni fenomeno è caratterizzato da due aspetti, quello cinetico - la sua
velocità - e quello termodinamico - la possibilità che avvenga dal punto di vista
energetico - e questi due aspetti non vanno mai confusi. Occorre sempre valutare
preliminarmente l’aspetto termodinamico; una volta stabilita la possibilità che un processo
avvenga, si può passare a considerarne la velocità. In questo capitolo e in tutti quelli
riguardanti gli equilibri si tratterà l’aspetto termodinamico; riguardo alla velocità, si vedrà
poi la Cinetica.
Finora si è parlato delle trasformazioni dal punto di vista dei prodotti che se ne possono
ottenere, ma in molti casi l’interesse principale di una trasformazione riguarda il suo
bilancio energetico; la termodinamica riguarda anche i limiti entro cui le varie forme di
energia possono essere trasformate le une nelle altre, e il rendimento ottenibile.
Dato che calore e lavoro non sono funzioni di stato (vedi Termochimica), la spontaneità
delle trasformazioni che coinvolgono scambi di calore e di lavoro dipende dal modo in cui
le trasformazioni stesse vengono effettuate. In particolare, si distingue fra trasformazioni
reversibili e irreversibili; una trasformazione reversibile avviene attraverso infiniti stati di
quasi equilibrio, e quindi richiede in teoria un tempo infinito per avvenire. Il concetto di
trasformazione reversibile è un concetto limite; più una trasformazione avviene in
condizioni che si avvicinano a questo limite, e maggiore sarà il suo rendimento energetico.
Il secondo principio della termodinamica.
Questo fondamentale principio può essere enunciato in moltissimi modi equivalenti, cioè
dimostrabili l’uno a partire dall’altro, ciascuno dei quali mette in luce una delle diverse
basilari implicazioni di questa legge.
1) QUALUNQUE TRASFORMAZIONE SPONTANEA E’ ACCOMPAGNATA DA UN
AUMENTO DI ENTROPIA DELL’UNIVERSO
In una trasformazione dallo stato A allo stato B di un sistema, la grandezza (Qrev/T) = S
viene definita ENTROPIA. L’entropia è una funzione di stato che rappresenta il rapporto
fra il calore scambiato durante la trasformazione condotta in maniera reversibile e la
temperatura a cui tale trasformazione avviene. Si noti che, pur non essendo il calore una
funzione di stato, lo diventa se si definisce il modo in cui la trasformazione deve avvenire.
Se consideriamo (vedi Termochimica) che il calore è un modo incoerente di trasferimento
dell’energia, che aumenta i moti caotici delle particelle di materia, quanto più calore si
trasferisce ad un corpo, tanto maggior agitazione disordinata si impartisce alle particelle
che lo costituiscono. L’entropia rappresenta il rapporto fra l’effetto “caoticizzante” del
calore e la misura del caos termico preesistente, che è la temperatura. Quanto minore è la
temperatura del corpo che scambia calore, tanto maggiore sarà l’entropia, intesa come
incremento del caos termico.
2) NON E’ POSSIBILE REALIZZARE UNA TRASFORMAZIONE IL CUI SOLO
RISULTATO SIA L’ASSORBIMENTO DI CALORE DA UNA RISERVA TERMICA E LA
SUA COMPLETA CONVERSIONE IN LAVORO.
Mentre è possibile convertire completamente lavoro in calore, al tasso di conversione di
4,184 J/cal (ad esempio l’energia cinetica di un corpo in movimento può essere
completamente dissipata in calore attraverso gli attriti, finché il corpo si ferma), non è
possibile il contrario, in quanto è necessaria la presenza di una seconda sorgente di
calore, a temperatura inferiore alla prima, alla quale trasferire parte del calore.
NO
SI
LAVORO
LAVORO
In base a questo enunciato, non è ad esempio possibile far viaggiare una nave sfruttando
l’energia contenuta nel mare, che è un immenso serbatoio di calore, perché quell’energia
sarebbe comunque sfruttabile solo a patto di consumarne una parte per scaldare un
serbatoio di calore a T inferiore (nel caso specifico a T < ambiente). Il significato di questo
enunciato, in definitiva, è che, se si vuole utilizzare una certa quantità di energia,
disponibile sotto forma di energia termica, per poterlo fare è necessario pagare una
“tassa” energetica, dissipando parte di questa stessa energia per scaldare qualcos’altro,
che di solito è l’ambiente. Quindi, ogni volta che trasformiamo una qualche forma di
energia, come l’energia chimica immagazzinata nei combustibili fossili, in energia termica
per poi utilizzare quest’ultima in una macchina termica per produrre lavoro meccanico, il
processo complessivo dissipa buona parte dell’energia utilizzata, per motivi intrinseci e
non eliminabili.
3) NON E’ POSSIBILE REALIZZARE UNA TRASFORMAZIONE IL CUI SOLO
RISULTATO SIA IL TRASFERIMENTO DI ENERGIA DA UN CORPO FREDDO AD
UNO PIU’ CALDO.
Questo dato di fatto fa parte dell’esperienza quotidiana: mettendo a contatto due corpi a
temperatura diversa, il calore fluisce liberamente dal più caldo al più freddo, finché si
arriva all’equilibrio termico e i due corpi si trovano entrambi alla stessa temperatura,
intermedia fra quelle iniziali. E’ naturalmente possibile trasferire calore da un corpo freddo
ad uno più caldo, come avviene nei frigoriferi, a patto però di spendere energia sotto
forma di lavoro per ottenere questa trasformazione.
LAVORO
NO
SI
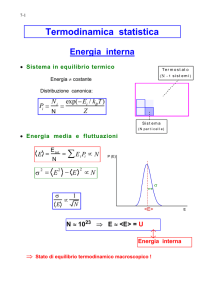
L’entropia è una grandezza estensiva, essendo il rapporto fra una grandezza estensiva
(Q) e una intensiva (T). Poichè Q dipende dalla massa del sistema, anche S ne dipende.
Il fatto che un processo spontaneo possa avvenire solo se accompagnato da un aumento
di entropia:
S = (dQrev / T) > 0
implica che, se la trasformazione è spontanea, alla fine di essa si sarà prodotto un
disordine termico delle particelle complessivamente maggiore di quello che c’era all’inizio.
Ecco che torniamo ad un concetto già espresso in altra forma: non si può trasformare
completamente il calore (movimento incoerente delle particelle) in lavoro (movimento
coerente), perché il disordine termico, cioè l’entropia, diminuirebbe e quindi il processo
non sarebbe spontaneo, cioè richiederebbe che venisse compiuto lavoro.
Si noti, però, che l’entropia del sistema aumenta se il sistema è ISOLATO (vedi
Termochimica), cioè se non scambia energia con l’esterno. Siccome avremo a che fare
molto più spesso con sistemi CHIUSI, ci occorre un criterio di spontaneità che coinvolga
una grandezza riferita a un sistema di questo tipo. Se consideriamo allora un sistema
chiuso che scambia energia con l’ambiente, l’equazione precedente si può sintetizzare:
Suniverso 0
dove con “universo” intenderemo il complesso (sistema + ambiente).
L’unico modo che un sistema chiuso ha per influire sull’entropia dell’ambiente circostante
è quello di scambiare con esso calore, aumentando o diminuendo così il moto termico
delle sue particelle e quindi la sua entropia. Se però il sistema cede spontaneamente
calore all’ambiente, significa che questo si trova ad una temperatura più bassa. Quindi:
S sis = (dqceduto/T2) < 0
S amb = (dqassorbito/T1) > 0
T2
ma poiché T2 > T1, S sis < S amb
T1
Suniverso = S sis + S amb > 0
Dato che, come si è detto, Samb viene influenzato dal sistema mediante scambio di
calore (che, se si opera a pressione costante, corrisponde all’entalpia), possiamo scrivere:
Samb = - (Hsis / T)
dove il segno (-) è dovuto al fatto che, se nel sistema avviene un processo esotermico
(H < 0), ne deriva S
amb
> 0 (T è espressa in K, quindi è sempre positiva!).
L’enunciato 4) può quindi venire espresso nella forma seguente, dove compaiono solo
grandezze riferite al sistema:
Ssis - (Hsis / T) 0
A questo punto, DEFINIAMO una nuova funzione di stato termodinamica, l’energia libera
G, come segue:
G = H - TS
e quindi vediamo, dall’espressione precedente, che per ogni reazione spontanea
G < 0
mentre per ogni reazione all’equilibrio
G = 0
Il motivo per cui questa grandezza viene chiamata ENERGIA LIBERA si ricollega
all’enunciato 2) del secondo principio della termodinamica: avendo a disposizione una
data quantità di energia (H), solo una parte di essa è libera, ossia disponibile per
compiere lavoro, mentre il resto (TS) deve essere dissipato per aumentare l’entropia
dell’ambiente.
4)
IL DISORDINE DELL’UNIVERSO E’ IN AUMENTO.
Questo enunciato è strettamente legato al precedente. Vi sono trasformazioni che non
prevedono scambi termici, ma che sono ugualmente spontanee: ne è un classico esempio
l’espansione di un gas nel vuoto: non viene compiuto lavoro, non viene scambiato calore.
E’ noto, però, che la direzione osservata per questo processo è sempre quella per cui le
particelle del gas tendono ad andare a distribuirsi uniformemente in tutto lo spazio a
disposizione:
non
si
osserva
mai,
viceversa,
che
il
gas
dell’ambiente
entri
spontaneamente in una bombola comprimendosi. In realtà, non è vero che un tale
fenomeno sia impossibile: è semplicemente del tutto improbabile. L’entropia, ossia il
disordine, è un concetto che può essere espresso anche da un punto di vista statistico. Si
consideri il seguente sistema:
spontanea
non spontanea
La probabilità P che N particelle di gas, libere di muoversi attraverso il rubinetto, si trovino
tutte in una metà del recipiente è data da (1/2)N; se N = 100, P = 8 x 10-31, ovvero, c’è
circa una probabilità su 1030 (mille miliardi di miliardi di miliardi) che il fenomeno venga
osservato.
In questo senso, esiste anche una definizione statistica di entropia, enunciata da
Boltzmann:
S = k ln
dove k è la costante di Boltzmann, che vale ~ 1,38 x 10-23 J K-1, ln è il simbolo del
logaritmo naturale (in base e) e rappresenta il numero dei microstati possibili, o
probabilità termodinamica. Nel caso in esame, un microstato è una delle possibili
disposizioni delle particelle all’interno dello spazio accessibile. Più un sistema è ordinato,
meno microstati equivalenti ci sono a disposizione. Anche questo è un concetto ben
radicato nell’esperienza comune: in casa vostra un oggetto, come ad esempio un libro, è
considerato “in ordine” quando si trova “al suo posto”, cioè, probabilmente, su uno
scaffale, o tutt’al più sul tavolo. Se si trova in un altro posto qualsiasi all’interno dell’intera
casa lo si considera “fuori posto”, o “in disordine”: quindi il numero di posizioni in cui il libro
è fuori posto è molto maggiore rispetto alle posizioni in cui è in ordine: la situazione
“ordinata” dispone di molti meno microstati rispetto a quella disordinata. Una mole di una
sostanza in fase gas è molto più disordinata di una mole della stessa sostanza nello stato
solido cristallino, in cui le particelle sono fisse all’interno di un reticolo, con una libertà di
movimento (vibrazioni termiche) molto limitata. Per questo motivo, una reazione chimica
in cui fra i prodotti vi sono più moli di gas che fra i reagenti è certamente una
reazione disordinante, con S > 0. In generale, Sgas >> Sliquido > Ssolido.
Il significato di questo enunciato è quindi che lo svolgersi di un processo in una data
direzione E’ UNA QUESTIONE PROBABILISTICA: più microstati accessibili ci sono, più è
probabile che il processo si verifichi. Si noti che il concetto di probabilità termodinamica è
correlato con quello di INFORMAZIONE: più uno stato è ordinato, più informazioni
abbiamo sulla posizione delle particelle che lo costituiscono. L'evoluzione spontanea dei
sistemi va nella direzione della perdita d'informazione.
Il terzo principio della termodinamica
A differenza dell'entalpia (vedi Termochimica), per la quale viene definito uno zero
arbitrario di riferimento, l'entropia è data in valore assoluto, perché lo zero di entropia
esiste ed è definito dal terzo principio della termodinamica: UN CRISTALLO PERFETTO
DI UNA SOSTANZA PURA ALLA TEMPERATURA DI 0 K HA ENTROPIA ZERO. Questo
perché allo zero assoluto (che, come vedremo, non è raggiungibile) ogni sostanza è allo
stato solido cristallino e le vibrazioni termiche degli atomi nel reticolo si annullano. In
questo caso si ha un solo microstato accessibile e quindi il disordine è nullo: abbiamo
tutte le informazioni per descrivere completamente il sistema. Evidentemente, tutte le altre
situazioni possibili, a T maggiore di 0, avranno entropia > 0, perché saranno più
disordinate di così. Allora, le tabelle di entropia molare standard, S° (J mol-1 K-1), riportano
solo valori positivi, normalmente riferiti a 25°C (ricordo ancora una volta che la dizione
condizioni standard non è riferita alla temperatura, ma a P = 1 atm e concentrazioni 1 M).
Questi valori saranno in generale molto più alti per le sostanze che, alla T considerata,
sono gassose. Essendo l'entropia una funzione di stato estensiva, anche i suoi valori
possono essere trattati in base alla legge di Hess (vedi Termochimica):
S°reazione = (bi S°prodotti) - (aj S°reagenti)
dove a e b sono i coefficienti stechiometrici delle varie sostanze in gioco.
Come si è visto parlando del secondo principio, quanto più è bassa T a cui avviene la
trasformazione, tanto maggiore è l'aumento di entropia. Allora, l'efficienza della
conversione di calore in lavoro aumenta con il diminuire della temperatura della sorgente
fredda. Tuttavia c'è un limite a questo, enunciato proprio dal terzo principio, che si può
anche esprimere semplicemente così:
T0K
Ovviamente, è impossibile avere un rendimento > 1. A 0 K il rendimento è totale perché
anche la minima quantità di calore ceduta alla sorgente fredda produce un enorme
aumento di entropia. Ma poiché lo zero assoluto è una situazione limite, non
raggiungibile in un numero finito di passaggi, si ritorna al primo enunciato del secondo
principio: non è possibile convertire tutto il calore di una sorgente energetica in lavoro,
perché non è sempre possibile avere una sorgente, più fredda di quella di partenza, in cui
dissipare una parte del calore assorbito.