Patologia generale - Prof. Batetta
Lezione 41 (12-03-13) -Parte 2- Marco Palmas
Il glicogeno non può essere accumulato
oltre un quantitativo di circa 200 grammi
perché può essere estremamente
pericoloso per il fegato. Il suo aumento è
solitamente dovuto a patologie genetiche
con alterazione degli enzimi che sono
coinvolti nel suo metabolismo. Il glicogeno
infatti ha principalmente due enzimi (anche
se in realtà ce ne sono molti di più) che si
occupano della gestione del suo
metabolismo quali la glicogeno sintetasi
(quando c’è glucosio in eccesso questo
viene conservato sotto forma di glicogeno)
e le fosfatasi (enzimi che si occupano di
scindere la molecola di glicogeno in singole
molecole di glucosio). La molecola di glicogeno è una molecola ramificata, polimero del glucosio, in cui le
molecole di glucosio lineari sono legate con un legame α-glicosidico (1-4). Nel punto di ramificazione il
glucosio assume un legame α-glicosidico (1-6). Quindi la molecola di glicogeno è ben ramificata: questo
fatto le conferisce una maggiore solubilità intracellulare.
Il glicogeno è infatti una molecola solubile in acqua e non è possibile conservarne in quantitativi elevati:
l’effetto del glicogeno sulla cellula è quello di aumentare l’osmolarità intracellulare, infatti sono necessari
3 ml di acqua per 1 grammo di glicogeno.
La molecola di glicogeno si costituisce in presenza di glucosio in eccesso, come ad esempio nella fase postprandiale. In condizioni di carenza di glucosio la fosfatasi provvede a scindere il glicogeno per tenere
costanti i livelli di glucosio nel sangue (mantenimento del valore della glicemia).
Vi è una differenza importante tra il glicogeno muscolare e il glicogeno epatico: mentre il primo non può
essere utilizzato per il controllo dei valori glicemici, il secondo può invece essere utilizzato a questo scopo.
L’acido lattico prodotto dal lavoro muscolare può tuttavia essere riconvertito in glucosio nell’organo
epatico: l’acido lattico fa parte della categoria dei substrati non glucidici dal quale è possibile ricostituire il
glucosio tramite gluconeogenesi.
GLICOGENO
Gli enzimi fosfatasi e glicogeno sintetasi
vengono controllati da degli ormoni.
La glicogeno sintetasi (che favorisce la
formazione del glicogeno) viene
regolata dall’insulina. Quest’ultima
infatti non serve solamente ai tessuti
insulino-dipendenti per acquisire il
glucosio extracellulare tramite i glucotrasportatori bensì serve anche ad
attivare gli enzimi che permettono la
sintesi del glicogeno intracellulare.
La fosfatasi (che favorisce la scissione
del glicogeno) viene regolata dal
FOSFORILASI
ATTIVA
GLICOGENO
SINTETASI
INATTIVA
-
ADP
-
ADP
CHINASI
FOSFATASI
+
ATP
P
FOSFATASI
+
ATP
+
P
ATTIVA
INATTIVA
CORTISOLO
INSULINA
GLUCOSIO
ADRENALINA
GLUCAGONE
GLUCOSIO
CORTISOLO
cortisolo. La fosfatasi è un enzima che viene attivato durante le fasi di digiuno.
Il cortisolo fa parte del gruppo degli ormoni controregolatori perché svolgono l’effetto opposto a quello
dall’insulina: mentre l’insulina consente l’utilizzo dell’energia e la conservazione dell’energia ed è pertanto
da considerarsi un ormone anabolizzante, il cortisolo, e più in generale gli ormoni controregolatori,
mettono a disposizione l’energia accumulata nei substrati energetici dell’organismo; proprio per questo
vengono definiti ormoni catabolizzanti. L’insulina inoltre agisce tramite meccanismi di fosforilazione
enzimatica mentre gli ormoni controregolatori agiscono tramite meccanismi di defosforilazione.
Pertanto, mentre la glicogeno sintetasi in presenza di insulina verrà attivata, la fosforilasi, al contrario, sarà
disattivata. La presenza di un equilibrio tra ormoni controregolatori e l’insulina è un fattore molto
importante. L’effetto globale sul metabolismo energetico è dato dall’equilibrio tra le due tipologie
ormonali.
Altra molecola importante per il metabolismo energetico è quella
dei trigliceridi. I trigliceridi sono molto più efficienti dal punto di vista
energetico in quanto 1 grammo di questi ultimi produce 9 Kcal. Non
è possibile sostituire un consistente quantitativo equi-calorico di
trigliceridi in glicogeno in quanto quest’ultimo, essendo
osmoticamente attivo, farebbe aumentare a dismisura il peso
corporeo.
Un’altra differenza molto importante tra glicogeno e lipidi sta nel
fatto che il glucosio, proveniente dal glicogeno delle riserve epatiche,
permette di mantenere un’omeostasi glicemica per brevi periodi di
tempo (circa 24 ore) mentre ulteriore glucosio può essere sintetizzato a seguito della mobilitazione degli
acidi grassi.
La mobilitazione del tessuto adiposo a scopo energetico richiede un tempo maggiore rispetto alla
mobilitazione del glucosio dal glicogeno. Gli acidi grassi necessitano di ossigeno per poter essere utilizzati e
infatti l’ossidazione di questi ultimi avviene a livello mitocondriale. Pertanto in situazioni di ipossia verrà
utilizzato prevalentemente il glucosio che, tuttavia, prenderà la via metabolica della glicolisi anaerobia con
produzione di grandi quantitativi di acido lattico che, in casi molto gravi, può portare al coma da acidosi
lattica. Le caratteristiche chimiche degli acidi grassi e del glucosio rendono pertanto necessario l’utilizzo di
entrambe le fonti energetiche.
L’organizzazione del metabolismo energetico umano garantisce una continua produzione di energia al
fronte di una ingestione di cibo a periodi intermittenti. Il controllo dell’acquisizione dei nutrienti e la
regolazione del suo utilizzo e conservazione sotto forma di substrati energetici viene regolato in base alla
situazione fisiologica dell’individuo. Se il soggetto si trova a digiuno, il metabolismo subirà delle regolazioni
differenti rispetto a quando l’individuo si trova sotto l’influenza di un’abbondante quantitativo di cibo
ingerito. Il cibo in eccesso verrà accumulato sotto forma di lipidi che potranno essere utilizzati nei momenti
di digiuno: è pertanto intuibile che gli individui con un abbondante accumulo lipidico hanno la possibilità di
sopravvivere per tanto tempo senza nutrirsi. Non è tuttavia possibile effettuare lo stesso discorso per
l’acqua la cui costante acquisizione è necessaria per la sopravvivenza dell’individuo.
I substrati energetici utilizzati durante il digiuno per la sintesi del glucosio sono:
Piruvato (5%)
Aminoacidi (25%) provenienti dal tessuto muscolare (in gran parte glutammina e alanina)
Glicerolo (10%) proveniente dalla demolizione degli acidi grassi
Lattato (60%) proveniente in buona parte dagli eritrociti
Viene pertanto attivata la glicogenolisi e in minor misura la gluconeogenesi. I meccanismi di sintesi del
glucosio a partire da questi substrati energetici vengo inibiti dall’insulina e attivati dagli ormoni
controregolatori quali cortisolo, adrenalina e glucagone. Il tessuto nervoso può utilizzare corpi chetonici e
necessita di glucosio anche durante le fasi di digiuno prolungato.
OMEOSTASI GLICEMICA
Il valore normale di glicemia a digiuno varia tra i 70 mg/dl e i 100 mg/dl. Secondo gli attuali criteri, il valore
di glicemia di 126 mg/dl è il valore stabilito per la diagnosi di diabete mellito. Il range di glicemia compreso
tra i 110 e 126 mg/dl viene considerato di “intolleranza” al glucosio. Anche il range che varia tra i 100 e 110
mg/dl è estremamente discusso, in quanto, secondo molti diabetologi, il possedere un valore di glicemia
superiore a 100 mg/dl può essere un indice di allerta in quanto ci può già essere una situazione
“intolleranza” ai carboidrati. La glicemia è differente nella donna in gravidanza in quanto i valori che si
riscontrano sono più bassi.
Nel controllo ormonale della glicemia risulta di fondamentale importanza il ruolo del fegato e l’interazione
dei vari ormoni quali insulina e ormoni controregolatori: a questo pool ormonale possiamo aggiungere
anche l’ormone della crescita (GH) che favorisce la sintesi delle proteine. L’insulina è secreta dalle β-cellule
pancreatiche: viene rilasciata quando si ha una tendenza all’aumento dei valori glicemici, favorisce la
captazione del glucosio nei tessuti insulino-dipendenti e contemporaneamente inibisce l’attività degli
ormoni controregolatori. L’insulina è un ormone anabolizzante e pertanto favorisce l’utilizzo dei substrati
esogeni e la conservazione degli stessi (se i substrati sono in eccesso). Gli ormoni controregolatori sono
invece catabolizzanti in quanto permettono l’utilizzo di substrati endogeni.
L’insulina risulta essere un ormone importante anche nel controllo del metabolismo lipidico oltre che
fondamentale per il controllo della glicemia. I lipidi intervengono in maniera evidente nel metabolismo
energetico e nel controllo dello stesso. Nel metabolismo lipidico il fegato si occupa della sintesi delle
lipoproteine quali VLDL. L’enzima LPL, attivato dalle APO-C2, viene utilizzato per trasferire i trigliceridi,
contenuti nelle VLDL e chilomicroni, all’interno della cellula adipocitaria. La LPL pertanto consente lo
“svuotamento” delle VLDL. L’adipocita ottiene i trigliceridi tramite le lipoproteine ricche di trigliceridi quali
sono le VLDL e chilomicroni. Questa operazione di cessione dei trigliceridi all’adipocita è esercitata dalla
LPL. La LPL oltre che dalla APO-C2 può essere attivata dall’insulina e infatti, nell’individuo diabetico
insulino-resistente, i trigliceridi risultano aumentati in quanto l’insulina non è sufficiente (o non è efficiente)
per attivare la LPL, con conseguente aumento dei trigliceridi nel circolo ematico. Un’altra lipoproteina che
subisce un’alterazione è la HDL che è presente in quantitativi ridotti a livello ematico.
L’assetto lipidico dell’individuo che ha problemi nel controllo del metabolismo dei carboidrati sarà pertanto
caratterizzato da ipertrigliceridemia (in quanto l’insulina non è sufficiente o non è capace ad attivare la
LPL), abbassamento dei livelli di HDL e formazione di LDL piccole e dense. L’insulina risulta pertanto di
fondamentale importanza per la captazione degli acidi grassi e conseguente sintesi dei trigliceridi. Per
questo motivo l’insulina viene anche definita come “ormone ingrassante”. L’individuo che ingerisce grandi
quantitativi di cibo necessita di una grande produzione di insulina per l’accumulo dell’energia sotto forma
di substrati energetici. Pertanto, sia gli zuccheri a livello epatico che vengono trasformati in acidi grassi e
VLDL con immissione degli stessi nel circolo ematico, sia il fatto che l’insulina di un individuo insulinoresistente ha una bassa efficienza, verrà provocato un aumento dei trigliceridi ematici (aumento della
sintesi dei trigliceridi a livello epatico + blocco nella captazione degli stessi).
L’effetto dell’insulina su un individuo che ingerisce grandi quantitativi di cibo si manifesta con un aumento
della massa corporea, prevalentemente di tessuto adiposo: lo stesso non avviene negli individui con livelli
molto bassi di insulina dove l’effetto anabolico dell’ormone non può essere svolto in maniera altrettanto
efficiente.
Quando l’insulina viene meno l’enzima lipasi viene attivato all’interno dell’adipocita: questo enzima si
occupa di scindere i trigliceridi intracellulari in 3 molecole di acidi grassi più una molecola di glicerolo
riversandole nel circolo ematico. Una lipasi iperattiva farà aumentare i livelli ematici di acidi grassi e
glicerolo. Gli ormoni controregolatori si occupano di attivare e regolare l’attività della lipasi: gli acidi grassi
riversati in circolo vengono utilizzati dai tessuti insulino-dipendenti, come avviene ad esempio nel caso di
un digiuno prolungato.
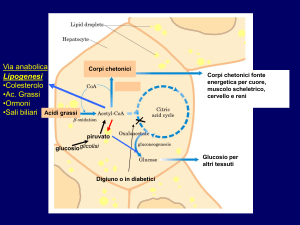
La scissione degli acidi grassi provoca la formazione di substrati energetici utilizzabili a livello mitocondriale:
all’interno di quest’ultimo avverrà la sintesi di molecole quali Acetil-CoA, corpi chetonici e anidride
carbonica.
I corpi chetonici si formano pertanto dall’eccesso di produzione di Acetil-CoA: questi sono importantissimi
in quanto costituiscono un substrato energetico utilizzabile dal sistema nervoso. Il glucagone promuove la
formazione dei corpi chetonici mentre l’insulina riduce la loro sintesi. Le situazioni di coma da cheto-acidosi
sono delle condizioni a cui possono andare incontro gli individui affetti da diabete di tipo 1 proprio perché,
non disponendo di insulina, viene incrementata a dismisura la sintesi di corpi chetonici.
Nel diabete di tipo 2, dove l’insulina è presente, ci può essere una iperglicemia con assenza di corpi
chetonici rendendo pressoché nulla la probabilità di insorgenza di coma da cheto-acidosi.
I corpi chetonici sono: acetone, acido acetacetico e acido β-idrossibutirrico; i livelli ematici di questi ultimi
non devono essere superiori ai 3 mg/dl.
La principale differenza, in termini di effetti applicati al nostro organismo in caso di eccesso, tra l’acetone e
l’acido β-idrossibutirrico è che il primo è volatile e viene rilasciato con la respirazione (tipico segno di
riconoscimento del paziente in stato di cheto-acidosi) mentre il secondo è estremamente pericoloso in
quanto dissociandosi aumenta i livelli di idrogenioni ematici: se pertanto la produzione di idrogenioni
supera la capacità tampone del nostro organismo, si incorre nella cheto-acidosi. Ci sono persone che non
riconoscono l’odore acetonemico (anosmia), situazione oltretutto, non infrequente. Nei bambini, la
demolizioni degli acidi grassi in determinate condizioni patologiche, è molto più frequente di quanto non lo
sia negli adulti: in presenza di un episodio febbrile ci può essere una prevalenza di ormoni controregolatori
che provocano la demolizione degli acidi grassi portando alla formazione di corpi chetonici. Spesso i
bambini in queste condizioni risultano essere inappetenti andando a peggiorare così la situazione di chetoacidosi dovuta alla continua ed eccessiva scissione di acidi grassi.
Situazioni simili possono verificarsi anche negli adulti che rimangono a digiuno, per motivi patologici (es:
anoressia e bulimia) o non patologici, per diverso tempo.
L’insulina è caratterizzata da due catene: catena α e catena β.
La sua sintesi avviene tramite la sintesi di una molecola di preproinsulina, trasformazione in proinsulina. Nel Golgi viene
clivato un segmento, chiamato peptide C, che viene emesso
assieme all’insulina matura attraverso dei granuli secreti in
presenza di stimolo di secrezione (principalmente l’aumento
della glicemia). A livello delle isole pancreatiche abbiamo la
presenza di diverse cellule:
1. β-cellule (60-80%) che secernono insulina
2. α-cellule (15-20%) che secernono glucagone
3. δ-cellule (5-10%) che secernono somatostatina
4. PP (15-20%) che secernono polipeptide pancreatico.