Appunti di Fisica Moderna
Ingegneria Elettronica, Ingegneria dei Modelli e dei Sistemi ed
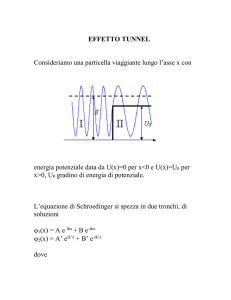
Ingegneria delle Telecomunicazioni
G. Balestrino
1
1 RICHIAMI SULLE ONDE ..............................................................................................................3
1.1
Generalità .............................................................................................................................3
1.2
Onde trasversali e longitudinali ...........................................................................................4
1.3
L’equazione d’onda..............................................................................................................5
1.4
Onde sinusoidali...................................................................................................................6
1.5
Onde sinusoidali tramite esponenziali di argomento immaginario......................................9
1.6
Velocità di fase e velocità di gruppo..................................................................................12
1.7
Esercizi...............................................................................................................................14
2 CENNI DI MECCANICA QUANTISTICA .............................................................................16
2.1
Aspetti quantistici delle onde elettromagnetiche ...............................................................16
2.2
Aspetti ondulatori delle particelle dotate di massa ............................................................23
2.3
La meccanica ondulatoria: l’equazione di Schrödinger.....................................................26
2.4
Significato fisico della funzione d’onda, il principio di indeterminazione........................28
2.5
Equazione di Schrödinger indipendente dal tempo: stati stazionari ed evoluzione
temporale........................................................................................................................................31
2.6
Alcuni esempi di soluzione dell’equazione di Schrödinger indipendente dal tempo. .......33
2.6.1
Particella libera (caso unidimensionale) ....................................................................33
2.6.2
Buca di potenziale a pareti infinite ............................................................................35
2.6.3
Buca di potenziale a pareti finite................................................................................38
2.6.4
L'
effetto tunnel ...........................................................................................................40
2.6.5
Oscillatore armonico unidimensionale.......................................................................43
2.6.6
L’atomo di idrogeno...................................................................................................45
2.7
Lo spin; bosoni e fermioni; il principio di esclusione di Pauli. .........................................47
2.8
Metalli, isolanti, semiconduttori ........................................................................................49
2.9
Esercizi...............................................................................................................................53
3 TERMODINAMICA STATISTICA .........................................................................................57
3.1
Stati di un sistema termodinamico .....................................................................................57
3.2
Temperatura ed entropia ....................................................................................................61
3.3
Legge dell’aumento dell’entropia ......................................................................................63
3.4
Il fattore di Boltzman .........................................................................................................65
3.5
Energia libera di Helmotz ..................................................................................................68
3.6
Funzione di distribuzione di Planck...................................................................................70
3.7
Potenziale chimico e distribuzione di Gibbs......................................................................71
3.8
Potenziale chimico del gas perfetto ...................................................................................72
3.9
Somma di Gibbs.................................................................................................................74
3.10 Distribuzioni di Fermi-Dirac e Bose-Eistein .....................................................................77
3.11 Esercizi...............................................................................................................................79
2
1 RICHIAMI SULLE ONDE
1.1 Generalità
La propagazione ondulatoria è uno tra i fenomeni più diffusi in fisica: si pensi alle onde sulla
superficie di un liquido, oppure alle onde acustiche, oppure alle onde elettromagnetiche o anche alla
rappresentazione ondulatoria delle particelle microscopiche come gli elettroni. Pur essendo la natura
dei fenomeni ondulatori così varia, essi sono descritti con lo stesso formalismo matematico. In
questa sezione introdurremo alcuni concetti fondamentali inerenti la propagazione per onde che
potranno poi di volta in volta essere applicati a casi particolari.
In tutti i casi l’onda è caratterizzata da una “perturbazione” ψ. La perturbazione rappresenta lo
spostamento di una certa grandezza fisica rispetto al suo valore di equilibrio. La natura fisica della
perturbazione varia a secondo del particolare tipo d’onda considerato: ad esempio, nel caso di un
onda che si propaghi lungo un filo teso, la perturbazione rappresenta lo spostamento di un elemento
di lunghezza dl del filo rispetto alla condizione di equilibrio (filo teso orizzontale), nel caso di
un’onda acustica che si propaghi nell’aria la perturbazione rappresenta la variazione della densità
locale dell’aria rispetto al suo valore all’equilibrio, nel caso di un’onda elettromagnetica ψ
rappresenta la variazione del campo elettromagnetico rispetto al suo valore di equilibrio. Si
potrebbe continuare ancora a lungo con gli esempi. In ogni caso è vero sempre che la perturbazione
ψ, che rappresenta un’onda in movimento nello spazio, è funzione sia del vettore posizione r che
( )
del tempo t: ψ r, t . Nel caso in cui l’onda si propaghi in una precisa direzione individuata dall’asse
x, il vettore posizione va sostituito con l’ascissa x. La funzione ψ può assumere le forme più
svariate (vedi ad esempio Figura 1.1-1).
ψ(x,t)
c
X
Figura 1.1-1
Nel caso indicato in figura la perturbazione ψ si sposta, ad istanti successivi, verso destra con
velocità c.
Abbiamo ora due possibilità:
• la forma della perturbazione rimane immutata al variare del tempo e quindi l‘onda trasla
rigidamente verso destra mantenendo immutata la sua forma;
• la traslazione è accompagnata da una distorsione della forma d’onda
In generale sono possibili entrambi i casi a seconda del particolare problema di propagazione per
onde considerato. Nel caso in cui sia verificata la prima alternativa diremo che l’onda si sta
propagando in un mezzo non dispersivo, mentre nel secondo caso diremo che l’onda si propaga in
3
Perturbazione
un mezzo dispersivo. L’origine del termine
dispersivo, riferito al mezzo di propagazione,
sarà chiarito più avanti.
y
y’
Supponiamo
ora che l’onda si propaghi in un
c∆t
mezzo non dispersivo e che quindi la forma
d’onda non cambi nel tempo (fig.1.1-2)
In Figura 1.1-2 è rappresentata una
perturbazione progressiva (che si muove nel
verso positivo dell’asse x) in due istanti
t0
successivi
to e to+∆t. la forma della
t0+∆t
perturbazione
non
cambia:
essa
è
semplicemente traslata di c∆t dove c
x=x'
rappresenta la velocità di propagazione
dell’onda. Consideriamo ora, accanto al
sistema di riferimento fisso x,y un sistema x’,
Figura 1.1-2 Perturbazione in due istanti successivi in
y’ in movimento con la stessa velocità
un mezzo non dispersivo
dell’onda c. Se il mezzo è non dispersivo la
perturbazione apparirà “congelata” nel sistema di riferimento mobile: la forma della perturbazione
non si modifica al passare del tempo. In queste condizioni la ψ sarà esclusivamente funzione
dell’ascissa x’ e non dipenderà dal tempo (ψ(x’)). D’altro canto, la legge di trasformazione delle
coordinate, quando si passa dal sistema di riferimento fisso (x,y) al sistema mobile (x’,y’) è (avendo
ipotizzato che all’istante iniziale to=0 le origini dei due sistemi di riferimento coincidano) x=x’+ct,
da cui si ricava x’=x-ct. Poiché la forma d’onda nel sistema di riferimento fisso ed in quello mobile
coincidono (ψ(x,t)≡ψ(x’)), possiamo esprimere la funzione ψ nel sistema fisso come ψ(x-ct),
avendo sostituto x’ con x-ct. Nel caso in cui l’onda si propaghi nel verso negativo dell’asse x (onda
regressiva), si otterrà, analogamente ψ(x+ct). Tutto ciò si può riassumere dicendo che una generica
perturbazione ψ che si propaghi in un mezzo non dispersivo deve essere funzione della
combinazione lineare della variabile posizione e del tempo (x±ct) dove c rappresenta la velocità di
propagazione dell’onda mentre il segno meno e più si riferiscono, rispettivamente, ad onde
progressive e regressive. Queste semplici considerazioni ci consentono di concludere che una
generica funzione della posizione e del tempo f(x,t), può rappresentare un’onda soltanto se le
variabili x e t appaiono in combinazione
lineare.
Ad esempio, quindi, la funzione
a
f(x,t)=A(x-ct)2 è atta a rappresentare un’onda
mentre non lo è la funzione f(x,t)=A(x2-ct2).
ψ
1.2 Onde trasversali e longitudinali
ψ
c
Figura 1.2-1
Una prima classificazione delle onde
può essere fatta in base all’angolo che la
direzione della perturbazione ψ e la direzione
di propagazione dell’onda formano tra di
loro. Nel caso in cui queste due direzioni
siano parallele le onde vengono dette
longitudinali, mentre nel caso esse siano
mutuamente perpendicolari le onde vengono
dette trasversali. Un esempio di onda
trasversale
è
rappresentato da una
perturbazione che si propaga lungo un filo
teso: ogni elemento del filo si sposta nella
4
direzione perpendicolare al filo stesso mentre l’onda si propaga nella direzione del filo. Un esempio
di onda longitudinale è rappresentato dalle onde acustiche nei gas: in questo caso la perturbazione
(variazione della densità del gas rispetto al valore di equilibrio) è diretta parallelamente alla
direzione in cui si propaga l’onda. La differenza tra onde trasversali e longitudinali è illustrata in
Fig.1.2-1 considerando il caso di una fila di punti materiali di massa m separati, in condizioni di
equilibrio, da una distanza a e legati alla posizione di equilibrio da forze di tipo elastico. Nella
figura in alto le masse sono ferme nella posizione di equilibrio; nella figura intermedia le masse
sono investite da una perturbazione che si propaga lungo la catena spostando le masse stesse
parallelamente alla direzione di propagazione; infine, in basso, è rappresentata una perturbazione
tale che lo spostamento è perpendicolare alla direzione di propagazione dell’onda stessa.
1.3 L’equazione d’onda
In un gran numero di sistemi non dispersivi, caratterizzati da un preciso valore all’equilibrio della
grandezza fisica rilevante (ad esempio la densità in gas oppure la posizione di un elemento di
lunghezza dl in un filo teso) si osserva che, nel caso in cui il sistema venga perturbato, la
perturbazione, ovverosia lo spostamento (ψ) della grandezza fisica rilevante dal suo valore in
condizioni di equilibrio soddisfa la seguente equazione alle derivate parziali:
∂ 2ψ
1 ∂ 2ψ
=
∂x 2 c 2 ∂t 2
Eq. 1.3-1
quest’equazione prende il nome di equazione d’onda. In questa forma essa è valida nel caso di
propagazione in una dimensione (asse x). Si può verificare a posteriori che un’onda viaggiante
qualsiasi, rappresentata da un generica funzione ψ ( x ± ct ) , è soluzione dell’equazione d’onda. Per
provarlo sostituiamo la funzione ψ all’interno dell’equazione d’onda. A questo scopo è necessario
calcolare preventivamente le derivate parziali della ψ rispetto alla posizione x ed al tempo t.
Indicando con ψ’ (ψ’’) la derivata prima (seconda) della funzione rispetto al suo argomento,
abbiamo per la regola di derivazione di funzione di funzione:
∂ψ
∂
∂ 2ψ
= ψ ' ( x ± ct ) = ψ ' e
= ψ ''
∂x
∂x
∂x 2
∂ψ
∂
∂ 2ψ
= ψ ' ( x ± ct ) = ψ '(− c ) e
= c 2ψ ''
∂t
∂t
∂t 2
Queste espressioni, sostituite nell’equazione d’onda 1.3-1, la rendono soddisfatta.
Ricaviamo ora l’equazione d’onda per un caso particolare. Consideriamo il problema di masse puntiformi m disposte
lungo una retta. Inizialmente le masse sono in equilibrio distanziate di a (vedi Figura 1.3-1 ). Supponiamo che le masse
siano collegate tra di loro da molle ideali tutte uguali, di constante elastica K e lunghezza a riposo a. Inizialmente ogni
punto materiale è in equilibrio. Ad un certo istante uno dei punti viene spostato dalla condizione di equilibrio
avvicinandolo, per esempio, al punto alla sua destra. Lo spostamento darà luogo ad una perturbazione che si propagherà
ψi-1
i-2
i-1
ψi
ψi+1
i
i+1
i+2
Figura 1.3-1 Perturbazione in una catena d’atomi investita da un’onda longitudinale.
5
lungo la catena. Se indichiamo con ψs lo spostamento del generico punto dalla posizione di equilibrio, la forza che
agisce sul punto iesimo potrà essere espressa come
F = − K (ψ i − ψ i −1 ) − K (ψ i − ψ i +1 )
per il secondo principio della dinamica
ma = m
∂ 2ψ
= K (ψ i +1 + ψ i −1 − 2ψ i )
∂t 2
Eq. 1.3-2
L’accelerazione è stata espressa tramite una derivata parziale rispetto al tempo poiché la perturbazione ψ è anche
funzione della posizione. Supponiamo ora che la lunghezza d’onda λ della perturbazione sia molto maggiore della
separazione spaziale tra i punti (λ>>a). In questo caso, detto limite del continuo, si considera la variabile posizione
come una variabile continua. Si potrà quindi esprimere la perturbazione nel modo seguente:
ψ i = ψ (x ) , ψ i −1 = ψ (x − a ), ψ i +1 = ψ (x + a )
Eq. 1.3-2
Inoltre, poiché la lunghezza d’onda è molto maggiore di a, la perturbazione varierà di poco quando ci si sposta di a. In
queste condizioni la perturbazione potrà essere sviluppata in serie di Taylor nell’intorno di x conservando soltanto i
termini più importanti dello sviluppo:
∂ψ a 2 ∂ 2ψ
+
+ ......
∂x
2 ∂x 2
∂ψ a 2 ∂ 2ψ
ψ (x + a ) = ψ ( x) + a
+
+ ......
∂x
2 ∂x 2
ψ (x − a ) = ψ ( x) − a
Eq. 1.3-4
Sostituendo le espressioni 1.3-3 e 1.3-4 nell’equazione 1.3-2 otteniamo
∂ 2ψ
m ∂ 2ψ
=
∂x 2
Ka 2 ∂t 2
per confronto con l’espressione 1.3-1, che rappresenta l’equazione di propagazione delle onde, verifichiamo facilmente
che la velocità di propagazione delle perturbazioni lungo la catena è
c=a
K
m
1.4 Onde sinusoidali
Le onde possono assumere le forme più svariate. Un caso particolarmente importante, per motivi
che saranno chiari successivamente, è quello delle onde che hanno forma sinusoidale. In questo
caso la perturbazione si riscrive come ψ ( x ± ct ) = A sin[k ( x ± ct )] . La costante k (detta numero
d’onda), deve essere misurata in rad/m in modo tale che l’argomento del seno risulti un angolo
misurato in radianti.. Nel caso di un’onda sinusoidale vengono definiti la lunghezza d’onda λ ed il
periodo T. Queste due grandezze sono legate dalla relazione c = λ , dove c prende il nome di
T
velocità di fase. Per preservare la periodicità spaziale in λ della perturbazione è necessario che la
2π
2π
costante k sia definita come k =
. La pulsazione ω dell’onda viene definita come ω =
. Si
λ
T
2π
definisce ora il vettore d’onda k come il vettore che ha modulo
(numero d’onda), direzione
λ
parallela e verso concorde alla direzione di propagazione dell’onda. La velocità di fase c può essere
6
anche espressa come c =
come
k
. Con le convenzioni esposte sopra la perturbazione può essere scritta
2π
Eq. 1.4-1
t = A sin (kx ± ωt )
λ
T
dove ω viene detta pulsazione. kx±ωt rappresenta la fase dell’onda sinusoidale ed A la sua
ampiezza. Il segno + si riferisce ad onde sinusoidali regressive, mentre il segno – a quelle
progressive.
L’onda sinusoidale scritta come A sin (kx ± ωt ) implica che all’istante iniziale (t=0), la ψ
nell’origine (x=0) sia necessariamente nulla. Ovviamente questa circostanza non sempre è
verificata. Per non perdere di generalità nell’espressione dell’onda sinusoidale si aggiunge un
angolo ϕo, che rappresenta la fase iniziale (t=0, x=0), all’argomento della funzione seno:
ψ = A sin kx ±
2π
ω
ct = A sin kx ±
ψ = A sin (kx − ωt + ϕ 0 )
Eq. 1.4-2
λ
-6
-4
-2
0
2
4
6
8
10
c∆t
Figura 1.4-1 Rappresentazione di un onda sinusoidale di velocità c in due istanti successivi
Le onde sinusoidali si prestano bene per studiare gli effetti di interferenza. Osserviamo infatti che,
essendo l’equazione differenziale delle onde lineare, se due funzioni f(x,t) e g(x,t) sono
separatamente soluzioni dell’equazione, anche la loro combinazione lineare lo è. Questa circostanza
viene espressa nel cosiddetto “principio di sovrapposizione” che afferma che se due onde
attraversano la stessa regione di spazio la perturbazione totale risultante è costituita dalla somma
delle perturbazioni individuali:
ψ = ψ 1 +ψ 2
Nel caso delle onde sinusoidali questa circostanza permette alcune interessanti considerazioni.
Supponiamo inizialmente che due onde sinusoidali aventi lo stesso vettore d’onda, la stessa
pulsazione e la stessa ampiezza A ma fase iniziale diversa, si propaghino entrambe nel verso
positivo dell’asse x. La perturbazione totale sarà allora espressa come:
7
ψ = ψ 1 + ψ 2 = A sin (kx − ωt + ϕ1 ) + A sin (kx − ωt + ϕ 2 )
Eq. 1.4-3
Grazie all’identità trigonometrica
A+ B
A− B
sin A + sin B = 2 sin
cos
2
2
l’Eq. 1.4-5 potrà essere riscritta come ψ = 2 A cos
Eq. 1.4-4
ϕ1 − ϕ 2
sin kx − ωt +
ϕ1 + ϕ 2
.
2
2
Quest’espressione rappresenta ancora un’onda viaggiante con lo stesso vettore d’onda k e la stessa
ϕ − ϕ2
ϕ + ϕ2
pulsazione ω, ma con fase iniziale pari a 1
ed ampiezza 2 A cos 1
. In particolare
2
2
osserviamo che se la differenza tra ϕ1 e ϕ2 è pari a 2nπ, con n numero intero qualsiasi, allora
l’ampiezza dell’onda sarà pari a 2A (onde in fase), mentre invece, se la differenza di fase è
(2n+1)π, allora l’ampiezza è nulla (onde in controfase).
Un altro caso interessante è quello in cui interferiscano due onde sinusoidali di uguale ampiezza, di
uguale vettore d’onda ed uguale pulsazione che si propaghino lungo l’asse x in versi opposti. In
questo caso la perturbazione totale potrà essere espressa come:
ψ = ψ 1 + ψ 2 = A sin (kx − ωt + ϕ1 ) + A sin (kx + ωt + ϕ 2 )
Utilizzando la stessa identità trigonometrica 1.4-3 otterremo questa volta
ψ = 2 A sin kx +
ϕ1 + ϕ 2
cos ωt +
ϕ 2 − ϕ1
Eq. 1.4-6
2
2
La perturbazione è riportata in figura 1.4-2 a diversi istanti successivi, nell’ipotesi che entrambe le
fasi iniziali siano nulle. La perturbazione così ottenuta non rappresenta più un’onda viaggiante,
infatti le variabili posizione e tempo non compaiono in combinazione lineare ma sono
separatamente argomento delle funzioni sin e cos. La ψ definita nell’equazione viene detta “onda
stazionaria”.
Dall’analisi dell’equazione 1.4-7 si osserva
che l’ampiezza dell’onda stazionaria evolve
ψ
nel
tempo come indicato in figura 1.4-2.
t=0
All’istante iniziale l’ampiezza è massima.
Decresce
diventando nulla a un quarto di
t=T/8
periodo e diventa massima negativa a metà
t=(1/4)T
periodo. Successivamente la perturbazione
x
evolve ciclicamente con periodo T. I punti
t=(3/8)T
nei quali l’ampiezza delle oscillazioni è
sempre
nulla vengono detti nodi, i punti in
t=T/2
cui l’ampiezza dell’oscillazione è massima
nodi
ventri. I nodi rimangono fermi nel tempo e
ventri
questa circostanza implica che non vi sia
Figura 1.4-2 Evoluzione di un’onda stazionaria
in funzione del tempo
propagazione di energia collegata con le
onde stazionarie.
Un’ulteriore classificazione delle onde può essere effettuata in base alla forma del fronte d’onda. Il
fronte d’onda è definito da tutti quei punti nello spazio che, ad un certo istante, hanno la stessa fase.
Per esempio se si getta un sasso in uno specchio d’acqua tranquillo si generano dei fronti d’onda
circolari (onde circolari). In fig.1.4-3 sono rappresentate due onde particolarmente rilevanti: onde
sferiche (generate da una sorgente puntiforme) ed onde piane (generate da una sorgente molto
lontana). In entrambi i casi la lunghezza d’onda λ corrisponde alla distanza tra due fronti d’onda
8
λ
k
k
consecutivi. La direzione di
propagazione, individuata dal
vettore d’onda k è definita
univocamente nel caso di onde
piane, mentre varia da punto a
punto ed è sempre diretta
radialmente nel caso di onde
sferiche.
Figura 1.4-3 Fronti d’onda sferici e piani
1.5 Onde sinusoidali tramite esponenziali di argomento immaginario
A volte può essere particolarmente comodo rappresentare le onde sinusoidali tramite esponenziali di
argomento immaginario. A questo proposito richiamiamo le equazioni di Eulero:
e iϕ − e −iϕ
e iϕ + e −iϕ
, cos( x) =
sen(ϕ ) =
Eq. 1.5-1
2i
2
combinando le due equazioni insieme si ottiene
e iϕ = cos(ϕ ) + isen(ϕ ), e −iϕ = cos(ϕ ) − isen(ϕ )
L’esponenziale di argomento immaginario è quindi un numero complesso la cui parte reale è
rappresentata dalla funzione cos( ϕ ) e la parte immaginaria dalla funzione sen( ϕ ). Il suo modulo è
e iϕ =
(sen ϕ )2 + (cos ϕ )2
=1
In Fig. 1.5-1 viene rappresentata la funzione eiϕ nel piano complesso. L’esponenziale di argomento
immaginario è rappresentato da un vettore di modulo unitario che forma un angolo ϕ con l’asse Re.
Al variare di ϕ tra zero e 2π l’apice del vettore percorre una traiettoria circolare.
La perturbazione sinusoidale sarà quindi espressa come
ψ ( x, t ) = Ae i (kx −ωt +ϕ0 )
Eq. 1.5-2
dove ϕ0 rappresenta l’eventuale fase iniziale.
L’ampiezza dell’onda sinusoidale sarà quindi rappresentata
Im
dalla parte reale (o dalla parte immaginaria) dell’esponenziale
eiϕ. La rappresentazione tramite esponenziali di argomento
immaginario risulta particolarmente vantaggioso in riferimento
ai
pacchetti d’onda. Le perturbazioni reali che si propagano nei
ϕ
mezzi fisici non sono mai rappresentate da onde sinusoidali
Re
ideali. In pratica i mezzi di propagazione reali hanno
necessariamente dimensioni fisiche finite. In queste condizioni
non è possibile immaginare al suo interno la propagazione di
un’onda sinusoidale ideale. Nella realtà le perturbazioni hanno
un’estensione
limitata nello spazio come, ad esempio, quella
Figura 1.5-1 Parte reale ed
indicata in fig.1.1-1. Le perturbazioni reali prendono il nome di
immaginaria dell’esponenziale di
argomento immaginario
pacchetto d’onda. Il perché del termine pacchetto d’onda sarà
chiaro più avanti. L’importanza delle onde sinusoidali deriva
dalla circostanza che le perturbazioni reali possono essere considerate come la sovrapposizione di
un certo numero di onde sinusoidali aventi opportuna ampiezza.
9
Consideriamo infatti una funzione periodica f(x) con periodo Λ, quale ad esempio quella
rappresentata in Fig. 1.5-2 .
Se sono soddisfatte le condizioni di Dirichelet allora questa funzione potrà essere sviluppata in serie
di Fourier
∞
2nπx
, con n numero intero.
f ( x) =
c n exp i
Λ
n = −∞
2 nπ
Ovvero, avendo definito k n =
,
Λ
f ( x) =
∞
c n exp(ik n x )
Eq. 1.5-3
n = −∞
L’equazione 1.5-3 esprime la circostanza che una perturbazione periodica con periodo Λ può essere
espressa come la sovrapposizione di un numero elevato (idealmente infinito) di onde sinusoidali,
con numero d’onda multiplo intero di 2π , ed ampiezza cn (componenti di Fourier).
Λ
Spesso però soltanto un numero limitato di componenti contribuiscono effettivamente, le
altre avendo un’ampiezza cn trascurabile.
Moltiplichiamo ora l’equazione 1.5-3, primo e secondo membro, per exp(− ik n'x ) , con n’ numero
intero ed integriamo l’espressione risultante tra -Λ/2 e Λ/2. Otteniamo così
Λ
2
−Λ
exp(− ik n 'x ) f ( x )dx =
2
con k n − k n ' =
∞
Λ
cn
n = −∞
2
−Λ
exp(i(k n − k n ')x )dx
Eq. 1.5-4
2
2π
2π
n − n' =
m , con m a sua volta numero intero.
Λ
Λ
(
)
Λ
ora è facile mostrare che l’integrale
2
−Λ
exp i
2
2π
mx dx è pari a Λ se m=0 (n=n’) ed è nullo se m≠0
Λ
Λ
’
(n≠n ). Infatti, se m=0 l’esponenziale è pari a 1 e l’integrale
2
dx =
−Λ
2
Λ
Λ
− −
= Λ . Invece, se
2
2
m≠0, dal calcolo dell’integrale si ottiene
2π
exp i mx
Λ
2π
i m
Λ
Λ
Λ
2
=
−Λ2
exp(iπm) − exp(− iπm) 1−1
=
=0
2π
2π
i m
i m
Λ
Λ
f(x)
. In base a questa proprietà, nella somma a
secondo membro nell’equazione 1.5-4 rimane
solo il termine n’, tutti gli altri essendo nulli:
Λ
x
Figura 1.5-2 Perturbazione periodica con periodo Λ
2
−Λ
exp(− ik n 'x ) f ( x )dx = c n 'Λ
2
A questo punto non è più necessario
mantenere l’apice al numero intero n’.
10
Potremo quindi esprimere i coefficienti cn come:
Λ
1 2
cn =
exp(− ik n x ) f ( x )dx
Λ −Λ
2
E’ possibile ora sostituire quest’espressione dei coefficienti cn nell’equazione 1.5-3
f (x ) =
Λ
∞
1 2
exp(− ik n x ) f ( x )dx exp(ik n x )
Λ −Λ
n = −∞
Eq. 1.5-5
2
2πn
2π
, segue che ∆k = k n+1 − k n =
Λ
Λ
L’equazione 1.5-5 si potrà riscrivere nel modo seguente:
Ora, poiché k n =
f (x ) =
∞
1
2π
n = −∞
Λ
2
exp(− ik n x ) f ( x )dx exp(ik n x )∆k
−Λ
2
supponiamo ora che il periodo della funzione f(x) diventi molto grande Λ → ∞ , in queste
circostanze ∆k → dk , k potrà essere considerata una variabile continua e la somma potrà essere
sostituita con un integrale:
f (x ) =
dove
∞
g (k ) exp(ikx )dk
−∞
∞
1
f ( x ) exp(− ikx )dx
2π −∞
La f(x) e la g(k) prendono il nome rispettivamente di integrale di Fourier e trasformata di Fourier
g (k ) =
Spesso si ridefinisce la trasformata di Fourier G (k ) = (2π ) 2 g (k ) ottenendo infine:
1
F (x ) =
1
∞
G (k ) exp(ikx )dk
Eq. 1.5-5
2π −∞
integrale di Fourier
e
∞
1
G (k ) =
F ( x ) exp(− ikx )dx
Eq.1.5-6
2π −∞
trasformata di Fourier.
La rappresentazione dei pacchetti d’onde tramite l’integrale di Fourier diviene trasparente se si
moltiplica la F(x) per il fattore di dipendenza temporale exp(-iωt). In questo caso otteniamo:
G(k)
ko
∆k
k
Figura 1.5-3 Trasformata di Fourier a gradino di semilarghezza ∆k a k0
11
1
1
a)
0.5
0.5
-15
-10
-5
0
5
b)
10
15
-15
-10
-5
0
-0.5
-0.5
-1
-1
5
10
15
Figura 1.5-4 Due pacchetti d’onda nello spazio reale corrispondenti a due valori di ∆k. La funzione G(k) è quella
indicata in Fig. 1.5-3. Nel caso del pacchetto d’onda a) ∆k è il doppio del valore di b).
1
∞
G (k ) exp[i (kx ωt )]dk
Eq. 1.5-7
2π −∞
In pratica l’espressione 1.5-7 rappresenta la sovrapposizione di onde sinusoidali con k diverso. Il
peso relativo delle componenti di diverso k è dato dalla trasformata di Fourier G(k). Si può vedere
facilmente che più è stretta la funzione G(k) nello spazio dei k, meno è localizzata, nello spazio
reale, la perturbazione ψ. In particolare assumiamo che la funzione G(k) sia definita nel modo
seguente:
ψ ( x, t ) =
G(k)=0 per k < ko-∆k e k > ko+∆k
G(k)=A per ko-∆k < k < ko+∆k
In questo caso la ψ(x) potrà essere rappresentata da
ψ (x ) =
k 0 + ∆k
A exp(ikx )dk
k 0 − ∆k
In figura 1.5-4 viene rappresentata la perturbazione per due diversi valori di ∆k, semilarghezza in k
del pacchetto d’onda, nel rapporto 2 a 1: ∆k nel caso della perturbazione a) è il doppio di quella
relativa alla perturbazione b) . Si può osservare come la funzione G(k) più estesa nello spazio k
corrisponda al pacchetto d’onda più localizzato nello spazio reale (Fig.1.5-4 a).
1.6 Velocità di fase e velocità di gruppo
Abbiamo visto come la velocità con la quale si muove una perturbazione sinusoidale di pulsazione
ω e numero d’onda k, sia pari a c =
ω
. Questa velocità prende il nome di velocità di fase. In alcuni
k
casi la velocità di fase dipende dalla lunghezza d’onda λ della perturbazione. Se questo avviene si
dice che il mezzo di propagazione è dispersivo. Il rapporto tra pulsazione e numero d’onda non è
più costante, ovvero la dipendenza tra pulsazione e numero d’onda non è più espresso tramite una
semplice legge lineare. In caso di propagazione in mezzi dispersivi sarà necessario esprimere ω
come una generica funzione di k, ω(k). La relazione che lega la pulsazione al numero d’onda prende
il nome di relazione di dispersione. La forma esplicita della relazione di dispersione dipenderà dal
particolare caso considerato. Esempi di propagazione non dispersiva sono la propagazione della
radiazione elettromagnetica nel vuoto e del suono nell’aria. Un esempio di propagazione dispersiva
è rappresentato dalle onde elastiche nei solidi.
12
ω
ω
k
k
(a)
(b)
Figura 1.6-1 Due diverse curve di dispersione: a) mezzo non dispersivo, b) mezzo dispersivo
In Fig. 1.6-1 a) viene rappresentata la relazione di dispersione per un mezzo non dispersivo, mentre
in Fig. 1.6-1 b) viene rappresentata la relazione di dispersione per un mezzo dispersivo. Nel primo
-5
10
10
10
8
8
8
6
6
6
4
4
4
2
2
2
0
5
x
10
-2
Figura 1.6-2 perturbazione a t=0
15
-5
0
5
x
10
-2
Perturbazione a t=∆t
Mezzo non dispersivo
15
-5
0
5
x
10
15
-2
Perturbazione a t=∆t
Mezzo dispersivo
caso la velocità di fase è costante ed uguale alla pendenza delle semirette. Nel caso in cui si abbia
propagazione di un pacchetto d’onde in un mezzo dispersivo, le diverse componenti di Fourier del
pacchetto avranno velocità di fase diversa. In queste condizioni le componenti più veloci del
pacchetto sopravanzeranno quelle più lente ed il pacchetto si allargherà deformandosi durante il
moto. Quindi nel caso di una perturbazione in movimento in un mezzo dispersivo la velocità di fase
non rappresenterà più la velocità della perturbazione. In questo caso si introdurrà una nuova
grandezza, detta velocità di gruppo vg, che misura la velocità del massimo del pacchetto d’onde. Si
può dimostrare che, per pacchetti d’onda la cui trasformata di Fourier è sufficientemente stretta
intorno ad un valore medio ko del vettore d’onda, la velocità di gruppo è pari alla derivata delle
dω
pulsazione rispetto al vettore d’onda calcolata per ko: v g =
.
dk k
Nella figura 1.6-2 è mostrata l’evoluzione temporale di un pacchetto d’onda. Nel caso di
propagazione in un mezzo non dispersivo il pacchetto d’onde si muove senza cambiare la sua forma
con una velocità di gruppo che coincide con la velocità di fase c delle sue componenti di Fourier.
Nel caso di propagazione in un mezzo dispersivo, le diverse componenti di Fourier si muovono con
13
velocità di fase diversa. La perturbazione si muove con velocità di gruppo pari a
dω
deformandosi.
dk k0
Diamo ora un argomento qualitativo per spiegare perché la velocità del pacchetto d’onde sia pari a
dω
. La forma spaziale del pacchetto d’onde è causato dall’interferenza delle onde con diverso k.
dk k0
Le diverse componenti sono arrangiate in modo tale che esse interferiscano in modo distruttivo
ovunque nello spazio eccetto che nella posizione x(t ) del pacchetto, ove l’interferenza è costruttiva.
Poiché l’interferenza deve mantenersi costruttiva nel punto di coordinate x(t) che individua la
posizione del pacchetto, la fase ( ϕ (k ) = kx − ω (k )t ) delle diverse componenti di Fourier in tale
punto non potrà dipendere dal vettore d’onda k:
dϕ
dω
= 0 = x(t ) −
t
dk
dk
dω
t = vg t .
da cui segue x(t ) =
dk
1.7 Esercizi
Esercizio 1
La relazione di dispersione delle onde elastiche lungo una catena di atomi può essere espressa,
nell’intervallo
π
a
<K<
π
a
, dalla relazione
ω=
4C
Ka
sin
, dove K rappresenta il vettore
M
2
d’onda, a la distanza tra gli atomi, M la massa di ciascun atomo e C la costante elastica di
interazione tra due atomi vicini. Si calcoli la velocità di gruppo e la velocità di fase delle onde nel
caso in cui λ sia molto maggiore di a.
Nel limite λ>>a abbiamo Ka<<1. La funzione sin può essere espressa tramite lo sviluppo in serie di
Taylor come
Ka
.
2
Ca 2
Quindi ω =
K.
M
La velocità di fase
ω
K
e la velocità di gruppo
dω
coincidono e sono entrambe uguali a
dK
Ca 2
.
M
Esercizio 2
La relazione di dispersione approssimata per le onde in acqua profonda è data da
T
ω 2 = gk + k 3
ρ
dove g è l’accelerazione di gravità, ρ è la densità dell’acqua e T la tensione superficiale dell’acqua
(7.2 10-4N). Si calcoli per quale valore della lunghezza d’onda la velocità di fase e la velocità di
gruppo sono coincidenti.
La velocità di gruppo delle onde è pari a
14
2
T
dω 1 g + 3 ρ k
=
.
dk 2
ω
Perché la velocità di gruppo sia uguale alla velocità di fase è necessario che
dω ω
=
dk
k
ω2
1
T
g +3 k2 =
ρ
2
k
T
D’altro canto sappiamo che ω 2 = gk + k 3
Questa condizione è verificata se
ρ
Dal confronto di queste due equazioni otteniamo
ρg
T
k=
λ = 2π
≅ 1.7 cm
T
ρg
Esercizio 3
Quali tra queste funzioni possono rappresentare un’onda che si propaga in un mezzo non
dispersivo?
3
f ( x, t ) = ( x + ct )
f ( x, t ) = x − ct 2
f ( x, t ) = Atg
f ( x, t ) = A sin
x + ct
L
x
ct
− B cos
L
L
Esercizio 4
Per molte applicazioni tecnologiche è necessario depositare uno strato
sottile (detto film) su un supporto fisico avente proprietà differenti
θ
(detto substrato). Una tecnica per misurare lo spessore del film film
consiste nell’inviare un fascio di radiazione elettromagnetica,
substrato
collineare e monocromatica, ad un angolo di incidenza θ rispetto alla
superficie del film. Parte della radiazione sarà riflessa dalla superficie
del film e parte dall’interfaccia. Aumentando l’angolo di incidenza si avranno fenomeni di
interferenza che daranno luogo a modulazioni dell’intensità della radiazione riflessa. Supponendo
che la lunghezza d’onda della radiazione incidente sia pari a 0.5µm e che il primo massimo
dell’intensità riflessa si osservi per θM=10°, si calcoli lo spessore d del film (si supponga il
coefficiente di rifrazione n del film pari a 1).
La differenza di cammino ottico tra il raggio riflesso dalla superficie del film e quello riflesso dal
substrato è
2l sin(θ ) dove l rappresenta lo spessore del film. Il primo massimo dell’intensità diffratta si otterrà
quando tale differenza di cammino ottico sarà pari alla lunghezza d’onda della radiazione:
l=
λ
2 sin (θ )
= 1.44µm
15
2
CENNI DI MECCANICA QUANTISTICA
2.1 Aspetti quantistici delle onde elettromagnetiche
Le equazioni di Maxwell, al loro apparire alla fine del secolo scorso, sembravano costituire
una teoria coerente e completa dei fenomeni elettromagnetici, teoria oggi denominata
“elettromagnetismo classico". Come si è visto nel Corso di Fisica II, da tale teoria si
ottiene una descrizione della luce in termini di onde costituite da un campo elettrico E ed
un campo di induzione magnetica B, che obbediscono alla stessa equazione ricavata da
D’Alambert per le corde vibranti:
∇ 2 E ( x, y , z ) =
1 ∂2 E
c 2 ∂t 2
;
∇ 2 B ( x, y , z ) =
1 ∂2 B
c 2 ∂t 2
Eq 2.1-1
Le onde elettromagnetiche (e.m) hanno la peculiarità di essere solo trasversali (sia E che B
sempre perpendicolari alla direzione di propagazione), hanno E sempre perpendicolare a B,
1
e velocità c molto più elevata delle onde elastiche: c =
= 3 × 10 8 ms −1 . La teoria di
ε 0 µ0
Maxwell non pone limiti nè superiori nè inferiori alle frequenze ν (o alle lunghezze d'
onda
7
λ=c/ν) ammissibili: sono rilevabili onde em. da ν~10 Hz (cioè λ≅10 m, p. es. quelle
emesse dalle comuni linee elettriche) a ν~1020 Hz (cioè λ~10-12 m, p. es. i raggi γ emessi da
alcuni nuclei). La luce visibile al nostro occhio corrisponde al ristretto intervallo λ~0.4-0.7
µm.
E" noto che ogni onda e.m. trasporta energia, con densità volumica data (nel vuoto) da
W =
1
1
ε0E2 +
B2
2
2µ 0
Eq. 2.1-2
e che incidendo ortogonalmente su una superficie piana vi proietta un'
energia per unità di
2
tempo e di area (cioè un’intensità J) pari a J = ε 0 cE
Sperimentalmente, la natura ondosa della luce è pienamente confermata dalle esperienze di
interferenza e diffrazione, le cui modalità risultano in perfetto accordo con la teoria dell'
elettromagnetismo classico. Ben presto tuttavia ci si rese conto che alcuni importanti
16
Fig. 2.1-1
a)
fenomeni,
molecole,
Maxwell.
emissione
atomici.
soprattutto legati a oggetti microscopici, come elettroni, atomi,
etc., non erano spiegabili in base alle sole equazioni di
Illustriamo brevemente tre esempi emblematici: a) lo spettro di
del corpo nero, b) l’effetto fotoelettrico esterno, c) gli spettri
Lo spettro di emissione, del corpo nero.
In fisica viene detto . "corpo nero" un corpo capace di assorbire totalmente onde e.m. di qualunque
frequenza (e di conseguenza, come si dimostra, anche di emetterle), Sperimentalmente, un corpo
nero viene realizzato praticando una piccola apertura in una grande cavità: un’onda e.m. che entri
nell'
apertura molto difficilmente può riemergerne, per cui appunto dall'
esterno l'
apertura appare
nera (per questo se guardiamo un palazzo le sue finestre ci appaiono scure, tanto più quanto più
sono piccole, e quanto più è grande la stanza dietro di esse).
Sperimentalmente, si trova che un corpo nero tenuto a temperatura T emette onde e.m. con
uno "spettro" (cioè una distribuzione di intensità in funzione della lunghezza d'
onda)
continuo dalla caratteristica forma "a campana", di ampiezza crescente con T. Rayleigh e
Jeans elaborarono una elegante teoria di "termodinamica della radiazione" basata
sull’elettromagnetismo classico, che per motivi di spazio rinunciamo ad esporre (il lettore
interessato può consultare per esempio il Mencuccini-Silvestrini, "Fisica II”, ediz. Liguori,
pagg. 498-502). Tuttavia, lo spettro previsto da tale teoria si avvicinava alla curva
sperimentale solo per λ molto lunghe, e per λ → 0 addirittura divergeva; quest'
ultimo
risultato, fisicamente assurdo, venne detto "catastrofe ultravioletta".
Fu Planck, nel 1900, a notare che la teoria di Rayleigh e Jeans poteva essere portata in
ottimo accordo con l’esperienza, a patto di inserire in essa due ipotesi aggiuntive:
1) che nella cavità lo scambio di energia tra le pareti e le onde e.m. contenute avvenisse
non in modo continuo, bensì in quantità discrete, multiple di una energia elementare detta
"quanto" di energia Eo
2)che per ogni onda e.m. il quanto di energia fosse proporzionale alla frequenza: Eo = hν,
con h=6.63 10-34Js (costante di Planck).
E’ da sottolineare che le ipotesi 1) e 2) sono del tutto estranee all'
e.m. classico (che non
assegna alla frequenza delle onde e.m. alcun ruolo importante negli scambi di energia), ma
non in contraddizione con esso, almeno nel senso che per la densità di energia e l’intensità
globali dell'
onda restano valide le.formule 2.1-1 e 2.1-2. Il fatto nuovo è di considerare
l'
energia dell’onda come una quantità "granulare" anziché continua. L’entità dei "grani",
cioè dei quanti, dipende dalla frequenza ma è comunque molto piccola: per esempio, per la
c
luce gialla, di 0.5 µm, il quanto vale E 0 = hν = h ≅ 4 × 10 −19 J ed è ragionevole che una
λ
"granularità" così minuta sia generalmente inosservabile nei fenomeni macroscopici, in cui
vengono scambiate quantità di energie enormemente maggiori di hv.
In definitiva è possibile descrivere il fenomeno della propagazione dell’energia
elettromagnetica sia tramite un approccio ondulatorio che tramite un approccio
corpuscolare. L’elettromagnetismo descrive il fenomeno tramite onde, mentre la meccanica
quantistica utilizza la descrizione corpuscolare. Entrambi questi approcci sono corretti e
vanno utilizzati a secondo del particolare problema da affrontare. Nell’approccio
corpuscolare si introduce una particella collegata alla radiazione elettromagnetica che
prende il nome di fotone. Questa particella viene indicata dal simbolo indicato in figura
17
ε
Φ
x
Figura 2.1-3 Elettroni in un metallo. Φ
rappresenta il potenziale di estrazione
2.1-1. Questo simbolo richiama lo stretto legame tra i fotoni e le onde elettromagnetiche. I
fotoni hanno le seguenti proprietà:
•
Il loro numero non si conserva, possono essere generati o distrutti;
•
posseggono un’energia pari ad hν;
h
•
posseggono un impulso pari a k dove =
e k rappresenta il vettore d’onda
2π
•
sono privi di massa e si muovono con velocità pari alla velocità della luce.
In figura 2.1-2 viene mostrato un fascio di radiazione elettromagnetica nelle due
rappresentazioni ondulatoria e corpuscolare. Nello scenario ondulatorio la radiazione è
rappresentata da un’onda (approssimativamente sinusoidale). Un aumento dell’intensità del
fascio corrisponde ad un aumento dell’ampiezza dell’onda. Nello scenario corpuscolare la
radiazione è rappresentata da un fascio di fotoni, ciascuno di energia hν. Un aumento
dell’intensità del fascio corrisponde ad un aumento del numero di fotoni. L’energia totale
del fascio è pari a nhν.
b)
L'
effetto fotoelettrico esterno
Lo studio dell'
elettrostatica e dei fenomeni di conduzione elettrica ha mostrato che all’interno dei
metalli esistono elettroni sostanzialmente liberi di muoversi. Poiché gli elettroni non fuoriescono
spontaneamente, è naturale supporre che la loro energia potenziale dentro il metallo sia minore che
nel vuoto (v. Fig. 2.I-3) di una quantità Φ, detta "potenziale di estrazione ("work function" in
inglese). Se questo è vero, ogni onda e.m. inviata contro la superficie del metallo dovrebbe col suo
campo elettrico far oscillare gli elettroni, cedendo loro energia, sino a far loro superare la barriera
di potenziale Φ che li separa dall’esterno. In base all'
elettromagnetismo classico, la frequenza delle
onde e.m. utilizzata è irrilevante, purché la loro intensità sia abbastanza grande.
Il fenomeno sopra descritto, detto effetto fotoelettrico esterno, si verifica realmente, ma
Un aumento dell’intensità del fascio
implica:
Aumenta l’ampiezza dell’onda
(Descrizione ondulatoria)
Aumenta il numero di n fotoni
Energia totale nhν
(Descrizione corpuscolare)
Figura 2.1-2 Rappresentazione ondulatoria (sopra) e corpuscolare (sotto) della radiazione elettromagnetica
18
con altre modalità, assolutamente non comprensibili in base alla teoria classica.
Sperimentalmente si trova infatti che, per ogni metallo, esiste una frequenza minima νs
(frequenza di soglia) per l'
onda e.m. incidente. per ν<νs, l’onda e.m. non riesce ad estrarre
elettroni per quanto grande sia la sua intensità. Invece, per ν>νs, l’onda estrae comunque
elettroni; l'
energia cinetica degli elettroni estratti è proporzionale a (ν-νs), e il loro numero
è proporzionale all'
intensità dell'
onda.
Questo problema venne risolto da Einstein nel 1905, applicando all'
effetto fotoelettrico
l’ipotesi di Planck, supponendo cioè che ronda e.m. possa cedere a ciascun elettrone del
metallo non quantità arbitrarie di energia, ma solo un quanto hν alla volta. E'chiaro allora
che:
1) tra la frequenza di soglia e il
potenziale di estrazione esiste la
ε
relazione hνs=Φ;
2) se hν<Φ, nessun elettrone può
acquisire energia sufficiente per
Φ
superare la barriera
3) se hν>Φ, tutti gli elettroni che
assorbono un quanto escono dal metallo,
x
con energia cinetica T data da:
T = hν − Φ = h(v − v s )
4) a parità di frequenza, aumentando
Figura 2.1-4 Rappresentazione schematica
dell’effetto fotoelettrico
l’intensità dell'
onda, si aumenta il
numero dei quanti che investe il metallo,
e quindi il numero degli elettroni emessi.
Il fenomeno è descritto in figura 2.1-4
Viene quindi confermato che, almeno agli effetti dell'
interazione con la materia, le onde
e.m. possono essere descritte, oltre che come onde, anche come fasci di "fotoni”.
c)
Gli spettri atomici
Il primo modello atomico quantitativo (J. Thomson, 1899) schematizzava l’atomo come
una "goccia” di carica positiva, all'
interno della quale gli elettroni erano disposti in modo
da minimizzare l’energia elettrostatica (v. Fig. 2.1-5)
Tale modello non resistette al vaglio degli esperimenti. Rutherford, studiando le
traiettorie di particelle α lanciate contro lamine metalliche e deflesse per interazione
coulombiana dagli atomi del metallo, stabilì senza ambiguità che nell'
atomo tutta la carica
positiva era concentrata in un nucleo di dimensioni dell'
ordine di 1 Fermi = 10-15 m, cioè
~105 volte più piccolo dell’atomo stesso. Prese quindi corpo il cosiddetto "modello
planetario", secondo cui nell’atomo gli elettroni orbitano attorno al nucleo come pianeti
attorno al sole.
Tuttavia, secondo l’elettromagnetismo classico, un atomo così fatto non potrebbe essere
stabile. Si è visto infatti, nel Corso di Fisica II, che una carica elettrica sottoposta ad una
accelerazione a irraggia onde e.m., perdendo per unità di tempo un’energia pari a
µ0e2 a 2
P=
6πc
Secondo il modello planetario, perché si abbia equilibrio meccanico, l'
accelerazione
centripeta dell'
elettrone, dovuta all'
attrazione coulombiana col nucleo, dovrebbe essere
molto intensa, data la corta distanza (~1 A=10-10 m) tra i due. Di conseguenza l'
elettrone
19
dovrebbe perdere rapidamente la sua energia per
irraggiamento, precipitando sul nucleo in tempi
brevissimi.
Anche accettando la stabilità dell'
atomo come
dovuta a fattori incogniti, resterebbe la difficoltà
che gli elettroni dovrebbero essere in grado di
assorbire e riemettere allo stesso modo onde e.m.
di qualunque frequenza. Invece, è ben noto che
gli
spettri
atomici
presentano
picchi
Figura 2.1-5
estremamente netti di assorbimento e di
Modello dell’atomo di Thomson: la goccia
emissione per certe frequenze ben precise (“righe
di carica positiva è rappresentata in grigio,
spettrali"), caratteristiche di ogni elemento.
gli elettroni dai puntini neri
Rydberg e Ritz osservarono che tali righe
spettrali presentavano notevoli regolarità, e che
in particolare le corrispondenti frequenze obbedivano alla relazione empirica
hν = R
1
1
− 2
2
M
N
Eq. 2.1-3
dove M ed N sono numeri interi (N>M), h è la costante di Planck e R (costante di Rydberg)
è pressoché la stessa per tutte le righe e per tutti gli atomi ed approssimativamente uguale a
13.6 eV.
Ancora una volta, l'
ipotesi dei quanti consentì una spiegazione del problema, almeno nei
seguenti termini fenomenologici (N. Bohr, 1913). Consideriamo l'
atomo più semplice,
cioè quello di idrogeno, e supponiamo che le orbite elettroniche siano circolare
Supponiamo che (per motivi per ora non chiari) il momento angolare (o momento della
quantità di moto) dell’elettrone attorno al nucleo possa assumere solo valori discreti bN,
multipli della costante di Planck h divisa per 2π (di seguito indicata in breve come ).
bN = mω N rN2 = N
Eq. 2.1-4
dove rN è il raggio dell'
orbita, ωN la velocità angolare di rotazione. Ne segue che:
ωN =
N
mrN2
Eq. 2.1-5
Poiché la forza centripeta agente sull’elettrone è data dall'
attrazione colombiana elettronenucleo, deve essere inoltre:
mω N2 rN =
1 e2
4πε 0 rN2
Eq. 2.1-6
Sostituendo l’equazione 2.1-6 nella 2.1-5 si trova:
4πε0 2 2
rN =
N ,
me2
ωN =
1
(4πε0 )2
me4
3 3
N
Eq. 2.1-7
Quindi, come conseguenza dell'
ipotesi espressa dall’equazione 2.1-1, sia la frequenza di
rotazione sia il raggio delle orbite possono assumere solo valori discretí. Lo stesso si
verifica per l'
energia totale dell'
elettrone:
20
mv 2
1 e 2 m(ω N rN )
1 e2
E tot = E cinetica + E potenziale =
−
=
−
2
4πε 0 rN
2
4πε 0 rN
utilizzando l’equazione 2.1-6, si ottiene infine
2
E tot
e2
1 e2
1 1 e2
1 me 4
=
−
=−
=−
8πε 0 rN 4πε 0 rN
2 4πε 0 rN
2 (4πε 0
1
)
2
1
cos t
=− 2
2
N
N
Eq. 2.1-8
dove cost~2.18*10-18 J (13.6 eV) e coincide con la costante di Rydberg degli spettri
atomici.
A questo punto, il modello atomico di Bohr è in grado di spiegare quantitativamente
l’esistenza delle righe spettrali, al seguente modo. Normalmente, l'
elettrone risiede nello
"stato fondamentale", cioè sull’orbita di minima energia (N=1), la più vicina al nucleo, di
raggio
4πε 0 2
r1 =
≅ 0.53 × 10 −10 m = 0.53 Å
(raggio di Bohr)
me 2
Il raggio di Bohr da un’idea delle dimensioni dell’atomo di idrogeno. L’energia dello stato
fondamentale E0 (N=1) è E0=-cost=-2.18*10-18J (oppure -13.6 eV). A seguito di
irraggiamento con radiazione elettromagnetica, l’elettrone può assorbire un fotone
portandosi su un'
orbita più esterna o, come si dice, compiendo una transizione verso uno
"stato eccitato". Si intende come primo stato eccitato lo stato caratterizzato N=2, secondo
stato eccitato quello caratterizzato da N=3 e così via. Nel caso l’elettrone si trovi
inizialmente nello stato fondamentale (N=1), vi sarà assorbimento solo per le onde e.m.
aventi frequenze νN tali che
1
hν 1N = E N − E1 = cos t 1 − 2
N
l’elettrone può poi tornare (”decadere”) allo stato fondamentale, riemettendo un fotone di
frequenza νN oppure compiere un’altra transizione verso uno stato ancora più esterno M,
assorbendo un altro fotone di energia
1
1
Eq. 2.1-9
hν NM = E M − E N = cos t
− 2
2
N
M
in accordo con la relazione sperimentale empirica trovata da Rydberg e Ritz.
L’elettrone può infine decadere verso lo stato fondamentale, eventualmente passando per
orbite intermedie: i fotoni emessi hanno comunque frequenze date dalla 2.1-9.
Sempre accettando l'
ipotesi di Bohr, una volta nello stato fondamentale l’elettrone non
cadrebbe sul nucleo irraggiando la sua energia, semplicemente perché non avrebbe a
disposizione orbite più basse su cui portarsi: ciò significa che una transizione per avvenire
necessita di uno "stato finale" disponibile.
21
In definitiva possiamo riassumere la situazione nel modo seguente. Normalmente
Figura 2.1-6 Livelli energetici dell’atomo di idrogeno
l’elettrone nell’atomo di idrogeno risiede sul livello di energia più bassa N=1 (stato
fondamentale). Supponiamo che l’atomo di idrogeno sia investito da radiazione
monocromatica (una sola frequenza e quindi una sola energia). Se l’energia dei fotoni
incidenti coincide con quella di una transizione tra il livello fondamentale ed uno dei livelli
Figura 2.1-7 Rappresentazione schematica dell’atomo di Bohr con le sue principali transizioni
22
eccitati dell’idrogeno, allora il fotone potrà essere assorbito e di conseguenza l’elettrone
potrà transire ad uno stato eccitato ( hν fot = E N − E 0 ). Diversamente il fotone non potrà
essere assorbito. Se l’energia del fotone è maggiore di –E0 (“energia di ionizzazione”) il
fotone potrà essere assorbito e l’elettrone potrà allontanarsi indefinitamente dal nucleo
positivo. Questo fenomeno prende il nome di ionizzazione dell’atomo di idrogeno. Per la
conservazione dell’energia l’energia cinetica finale dell’elettrone sarà pari a
T = hν fot + E 0 ( si ricordi che E0 è un’energia di legame e quindi definita negativa).
In conclusione, in questo capitolo abbiamo visto come diversi fenomeni indichino
che l’energia delle onde elettromagnetiche è quantizzata in fotoni di entità hν. Alla stessa
conclusione porta lo studio della trasmissione di altri tipi di energia, come quella termica.
Ad esempio l’andamento con la temperatura del calore specifico a volume costante dei gas
perfetti a molecola biatomica e poliatomica devia sostanzialmente dalla teoria classica di
Doulong e Petit. Tale difficoltà si risolve ammettendo che l’energia rotazionale e quella
vibrazionale delle molecole siano entrambe quantizzate. Nel Corso di Fisica dello Stato
Solido si mostrerà che la quantizzazione delle vibrazioni dei reticoli cristallini (modelli di
Einstein e di Debye) rende ragione del fatto che il calore specifico dei solidi svanisce per
T→0.
In generale, la quantizzazione dell’energia emerge dai fenomeni riguardanti scambi
energetici tra o con oggetti microscopici (atomi, elettroni molecole, etc.). Dato il piccolo
valore della costante di Planck (h~10-18 J.s), generalmente è impossibile osservare tale
quantizzazione nei fenomeni macroscopici: essi possono essere descritti assumendo h=0.
Di conseguenza, un requisito di ogni corretta teoria quantistica è di condurre a formule che.
si riducano a quelle corrispondenti della fisica classica facendone il limite per h→0.
2.2 Aspetti ondulatori delle particelle dotate di massa
Nella prima parte del corso sono stati illustrati alcuni fenomeni di interferenza tra onde. La
trattazione matematica svolta è indipendente dalla natura della perturbazione
(compressione di volume, deformazione di taglio, campo elettrico e magnetico). Il motivo
è che l'
interferenza e la diffrazione, che esamineremo in questo capitolo, sono
intrinsecamente legate al tipo di dipendenza funzionale che una grandezza ha dalle variabili
posizione e tempo; il verificarsi di tali fenomeni costituisce pertanto un'
indicazione
inoppugnabile della natura ondosa della propagazione.
Perché si verifichino interferenza e diffrazione, occorre che le onde (di qualunque natura
siano) interagiscano con strutture geometriche aventi dimensioni caratteristiche
paragonabili alla lunghezza d'
onda λ. Ad esempio, si può facilmente vedere che la luce
visibile è diffratta da reticoli aventi passo dell'
ordine del micron, molto vicina alla
lunghezza d’onda della radiazione visibile. Allo stesso modo, i raggi X (onde e.m. aventi
λ∼1Å) sono diffratti da strutture cristalline aventi parametro reticolare ~1-10 Å.
23
Fascio di
raggi X
θ
A
B
C
d
D
Piani
atomici
Figura 2.2-1 Diffrazione alla Bragg da un reticolo cristallino
Consideriamo un cristallo, sul quale viene inviato un fascio di raggi X "monocromatici”,
cioè aventi tutti la stessa lunghezza d’onda (v. Fig. 2.2-1 ). Ciò che accade è
completamente spiegabile con l’elettromagnetismo classico. L’onda e.m. investe tutti gli
atomi del cristallo, i cui elettroni entrano istantaneamente in vibrazione come delle
minuscole antenne, riemettendo in tutte le direzioni ondine aventi la stessa λ. Nel semplice
modello di Bragg si suppone che ogni piano atomico, vedi Figura 2.2-1, si comporti come
un piano semiriflettente: riflette una parte della radiazione e lascia passare il resto. In
questo modo ci sarà interferenza tra le onde riflesse da ciascuno dei piani atomici.
L’interferenza sarà costruttiva solo se la differenza di fase tra le onde è pari a 2πN (con N
intero), cioè se la differenza di cammino tra le onde riflesse da ogni piano atomico e da
quello sottostante è pari ad un numero intero di lunghezze d’onda. Dalla figura si vede che
tale differenza di cammino è pari alla somma delle lunghezze dei segmenti BD e DC,
ovvero 2BD. Se definiamo d e θ, rispettivamente, la distanza interplanare e l’angolo di
incidenza (angolo che il fascio di raggi X forma con il piano cristallografico), allora è
semplice verificare che 2BD è pari a 2dsin(θ). In definitiva avremo condizioni di
interferenza costruttiva (diffrazione intensa dai piani cristallografici) quando:
Nλ = 2d sin(θ )
Eq. 2.2-1
Questa formula rappresenta la legge di Bragg e, pur essendo stata ricavata nell’ambito di
un modello fisico estremamente semplice, è verificata nella pratica con grande precisione.
Nel Corso di Fisica dello Stato Solido verrà mostrato come la diffrazione dei raggi X costituisca
una tecnica potentissima per ricavare importanti e dettagliate informazioni sui solidi, come la
dimensione e la struttura della cella unitaria, la disposizione degli elettroni nel legame chimico, la
qualità strutturale dei monocristalli, etc. Qui ci interessa invece evidenziare un fatto sperimentale, a
prima vista sorprendente: ripetendo l’esperienza descritta in Fig. 2.2-1, ma inviando sul cristallo,
anziché un'
onda elettromagnetica, avente lunghezza d’onda confrontabile con la distanza
interatomica, un fascio monoenergetico di elettroni (come fecero Davidson e Germer nel 1927), o
di neutroni, o di protoni, o di qualunque altro tipo di particelle dotate di massa (purché
sufficientemente minuscole), il fenomeno della diffrazione si presenta sostanzialmente con le stesse
modalità (pur di scegliere per ogni tipo di particelle l’energia cinetica opportuna, come si
comprenderà in seguito). Come conseguenza immediata di questo risultato sperimentale, si è
costretti ad ammettere che anche alle particelle dotate di massa come l'
elettrone, il neutrone, il
protone etc., è in qualche modo associata un'
onda. La natura di quest’onda risulta a tutta prima
alquanto misteriosa. Possiamo però, effettuando esperimenti di diffrazione con un cristallo avente
distanza interplanare d nota e utilizzando la legge di Bragg (eq. 2.2-1) determinarne la λ., e cercare
un’eventuale correlazione con altri parametri delle particelle usate, p. es. l’energia, la velocità, la
massa. Sperimentalnente, si trova che tale correlazione esiste ed è esprimibile con la seguente
semplice formula, detta "relazione di De Broglie"
24
h
Eq. 2.2-2
p
dove p è la quantità di moto delle particelle (p=mv) e h è la costante di Planck. La presenza
della costante di Planck nella relazione di De Broglie indica che esistono strettissime
relazioni con la quantizzazione delle onde e.m. illustrata precedentemente. Dalla relazione di
λ=
De Broglie segue che la relazione tra l'
energia E delle particelle dotate di massa e la lunghezza
d’onda associata ad esse è molto diversa da quella che vale per i fotoni. Per questi ultimi infatti è
E=
hc
Eq. 2.2-3
λ
mentre per una particella di massa m, utilizzando la relazione di De Broglie , si ha
2 2
p2
h2
k
=
=
Eq. 2.2-4
2
2m 2mλ
2m
Di conseguenza, la condizione λ~1 A, necessaria per avere effetti di diffrazione,
corrisponde a energie ben diverse per particelle di massa diversa. Per gli elettroni (di
massa me~10-30 Kg, abbiamo
h2
Ee =
≈ 10 −17 J ≈ 100eV
2 me λ 2
E=
per i neutroni e i protoni, di massa M ~ 2000 volte maggiore, si ha
E n ≈ 10 −20 J ≈ 0.1eV
mentre i fotoni "appropriati” (cioè i raggi X, aventi λ ≈ 1 A) hanno energia
Ef =
hc
≈ 10 −15 J ≈ 10 4 eV
λ
Raggi X, elettroni e neutroni sono quindi tre sonde diverse utilizzabili per le indagini
diffrattometriche sul solidi Ognuna ha vantaggi, svantaggi e peculiarità per le quali
rimandiamo al Corso di Fisica dello Stato Solido.
La relazione di De Broglie p=h/λ conferisce un significato fisico molto chiaro alla
condizione 2.1-4 arbitrariamente posta da Bohr alla base del suo modello atomico.
Figura 2.2-2 Elettroni nell’atomo di Bohr visualizzati come onde sinusoidali di opportuna lunghezza d’onda
25
Riscrivendo infatti la relazione di De Broglie in termini della quantità di moto posseduta
dall'
elettrone sulla sua orbita circolare, si ha:
h
N
= p N rN
2π
cioè, per la relazione di De Broglie posto pN=h/λ, si ottiene
h
h
N
= rN
2π
λ
ovvero
Nλ = 2πrN
In altre parole, la condizione postulata da Bohr su basi puramente intuitive corrisponde al
fatto che la λ dell'
onda associata all’elettrone sia contenuta un numero intero N di volte
nell'
orbita dell'
elettrone stesso (Fig. 2.2-2): questa condizione assicura che l’onda associata
all’elettrone non autointerferisca in modo distruttivo, il che ben si accorda con l’esistenza
di uno stato stabile.
Poiché a tutti gli elettroni è associata un'
onda, anche gli elettroni appartenenti a un
solido e liberi di muoversi dentro di esso (come avviene nei metalli) possono subire effetti
di diffrazione da parte dei reticolo cristallino.
Se per esempio un elettrone libero viaggia in direzione ortogonale a un insieme di piani
reticolari spaziati di d, la relazione di Bragg, scritta per θ=π/2 ci dice che l’elettrone sarà
diffratto all’indietro (cioè a un angolo θ=π) se la sua onda associata ha una lunghezza
d'
onda pari a
2d
(con N intero)
λN =
N
cioè se l’energia cinetica dell'
elettrone vale
2
2
2 2
p
N h
1 h
E=
=
=
2
2m 2m λ N 8md 2
Ma l'
onda diffratta all'
indietro verrà nuovamente diffratta in avanti dallo stesso insieme di
piani reticolari, e così via: ne risulta un'
onda stazionaria. Ciò significa che gli elettroni di
tale energia non riescono a muoversi, neanche se applichiamo dall’esterno un campo
elettrico. Torneremo su questo argomento più avanti quando verrà descritta la differenza tra
metalli, isolanti e semiconduttori.
2.3
La meccanica ondulatoria: l’equazione di Schrödinger
Dopo il successo del modello atomico di Bohr nello spiegare le righe spettrali
dell'
idrogeno e degli elementi più "semplici", Sommerfeld e altri cercarono di proseguire
sulla stessa strada, introducendo la possibilità di orbite ellittiche, generalizzando la
condizione di quantizzazione 2.1-4, etc. Nonostante gli sforzi compiuti, non si andò molto
lontano. Per costruire una teoria che spiegasse in dettaglio il comportamento della materia
a livello microscopico, era necessario un salto qualitativo nella comprensione della natura
dell'
onda associata alle particelle dotate di massa e, sperabilmente, l’individuazione di una
equazione differenziale del tipo di quelle di Maxwell, la cui soluzione fornisse la
dipendenza spazio-temporale dell'
onda stessa.
Questo traguardo fu raggiunto nel 1925 da Schrödinger, con un procedimento altamente
immaginativo, basato su un profondo intuito fisico. La teoria costruita sull'
eq. di
Schrödinger è detta "meccanica ondulatoria”, proprio perché permette di ricavare
26
l'
espressione dell'
onda associata alle particelle, detta "funzione d'
onda". Nello stesso anno
venne sviluppata da Heisenberg una formulazione alternativa della meccanica dei quanti,
basata su un formalismo matematico matriciale. Ben presto si dimostrò in modo rigoroso
che le due teorie, benché matematicamente diversissime, erano assolutamente equivalenti
dal punto di vista fisico, in quanto conducevano agli identici risultati. La meccanica
ondulatoria di Schrödinger ha avuto tuttavia utilizzazione assai più vasta rispetto alla
"meccanica delle matrici” di Heisenberg proprio perché, fornendo le funzioni d'
onda,
permette una visualizzazione assai più intuitiva dei risultati dei calcoli. Il nucleo della
meccanica quantistica è costituito dalla celebre equazione di Schrödinger. Di questa
equazione si possono dare argomenti di ragionevolezza, essa comunque non può essere
dedotta in modo rigoroso in base ad un ragionamento fisico. In altri termini si può dire che
l’equazione di Schrödinger rappresenta un principio della fisica (come ad esempio il
secondo principio della dinamica di Newton). La correttezza dell’apparato della meccanica
ondulatoria, e quindi dell’equazione di Schrödinger, si basa sulla circostanza che i
comportamenti da essa dedotti risultano essere in perfetto accordo con gli esperimenti.
L’equazione di Schrödinger è un’equazione lineare alle derivate parziali che, nella forma
più generale viene scritta nel modo seguente:
(T + V (x, y, z ))Ψ (x, y, z, t ) = i
∂
Ψ ( x, y , z , t )
∂t
Eq. 2.3-1
p2
rappresenta l’energia cinetica della particella quantistica, V(x,y,z) l’energia
2m
potenziale delle eventuali forze conservative applicate alla particella e Ψ(x,y,z,t) la
funzione d’onda che rappresenta il comportamento quantistico della particella. Il
significato fisico della funzione d’onda Ψ verrà chiarito più avanti. Osserviamo qui che
essa sarà, in generale una grandezza complessa. In meccanica quantistica la quantità di
moto è rappresentata da un “operatore” differenziale. Per ciascuna delle componenti vale:
∂
∂
∂
p x = −i
, p y = −i
, p z = −i
∂z
∂x
∂y
ovvero
dove T =
p = −i ∇
In definitiva l’equazione di Schrödinger si può scrivere nel modo seguente:
2
∂
−
∇ 2 Ψ (x, y, z, t ) + V ( x, y, z )Ψ ( x, y, z, t ) = i
Ψ ( x, y , z , t )
Eq. 2.3-2
2m
∂t
Nel caso di un problema ad una sola dimensione l’equazione si riscrive più semplicemente
come
2
∂
∂ 2 Ψ ( x, t )
+ V ( x )Ψ ( x, t ) = i
Ψ ( x, t )
Eq. 2.3-3
−
2
2m ∂x
∂t
L’equazione di Schrödinger nella meccanica quantistica ha lo stesso ruolo centrale che
nella meccanica classica svolge il
meccanica classica conoscendo le
equivalente, l’energia potenziale del
possibile risolvere (almeno in linea
d2r
secondo principio della dinamica F = m 2 .Nella
dt
forze applicate al punto materiale (o, il che è
punto materiale) e le condizioni iniziali del moto è
di principio) l’equazione del moto per calcolare in
modo completamente deterministico la traiettoria (la funzione r (t ) del punto materiale). In
modo analogo l’equazione differenziale di Schrödinger, noto il potenziale delle forze
applicate al punto materiale e, come vedremo, le “condizioni al contorno”, consente di
calcolare (in linea di principio, cioè a parte le eventuali difficoltà di calcolo) la funzione
27
d’onda. Essa dà accesso a tutte le informazioni possibili su un sistema quantistico. Più
avanti risolveremo l’equazione di Schrödinger in alcuni casi semplici, e apparirà chiaro che
essa comporta calcoli molto più complessi rispetto ai corrispondenti problemi trattati in
meccanica classica. E’ quindi assolutamente impensabile (anche se in astratto corretto)
sostituire alla meccanica classica quella ondulatoria, per trattare problemi relativi al mondo
macroscopico.
2.4 Significato fisico della funzione d’onda, il principio di indeterminazione
Storicamente, si sono avute lunghe discussioni e polemiche su quale fosse l’esatto
significato fisico della funzione d'
onda Ψ(x,y,z,t). Il significato fisico ormai accettato è che
il modulo quadro della Ψ (che è in generale una funzione complessa, e della quale
indichiamo con Ψ* la complessa coniugata) rappresenti la "densità di presenza" d(x,y,z,t)
della particella nel punto (x,y,z) al tempo t:
Ψ ( x, y , z , t ) = Ψ ( x, y , z , t )Ψ ∗ ( x, y , z , t ) = d ( x, y , z , t )
2
Eq. 2.4-1
in termini matematici, la probabilità dP che la particella al tempo t si trovi in un intorno di
volune dV (=dxdydz) del punto di coordinate x,y e z è pari a:
dP = Ψ ( x, y, z, t )Ψ ∗ ( x, y, z, t )dxdydz
Eq. 2.4-2
La Ψ ricavata risolvendo l’equazione di Schrödinger è chiaramente definita a meno di una
costante moltiplicativa. Tale costante viene scelta in modo da "normalizzare" la Ψ, cioè in
modo che sia
Eq. 2.4-3
Ψ ( x, y, z , t )Ψ ∗ ( x, y, z , t )dxdydz = 1
tutto lo spazio
in accordo col fatto che la probabilità di trovare la particella cercandola in tutto lo spazio
deve essere l.
Concettualmente, è da sottolineare il fatto che la particella non è "diluita" in tutta la regione
di spazio in cui Ψ è non nulla: in un certo volume ∆V può esservi una probabilità molto
piccola di trovare la particella; ma se la si trova lì, la si trova tutta. Molte volte, tuttavia,
nei problemi in cui si ha un gran numero di particelle, confondere la loro densità di
presenza con (p. es.) la densità di carica da esse portata è corretto, in quanto per grandi
numeri la frequenza tende alla probabilità.
Questo aspetto "probabilistico" della meccanica quantistica costituisce forse la maggiore
novità (abbastanza sconcertante, agli inizi) rispetto alla fisica classica. Come apparirà
chiaro dagli esempi che saranno svolti più avanti, nella meccanica quantistica, si rinuncia a
descrivere le traiettorie esatte delle particelle, e a trarre da una equazione del moto, a
partire da condizioni iniziali note, deduzioni certe sulla situazione futura. L’equazione di
Schrödinger fornisce solo informazioni circa la probabilità con cui possono verificarsi le
possibili situazioni future.
Così, della generica variabile dinamica α (p. es. la velocità, o il momento angolare della
particella, etc.), in generale non è dato di conoscere il valore preciso, ma solo il "valore
aspettato" < α >, definito come una specie di "media pesata" su tutto lo spazio fatta
utilizzando la seguente formula:
α =
ΨαΨ ∗ dV
spazio
28
La meccanica quantistica dice che, effettuando un gran numero di misure della grandezza
α, la media di tali misure coinciderà certamente col "valore aspettato"; ma non per questo
ci dà modo di prevedere con certezza il valore che darà la singola prossima misura. Così
come le leggi della probabilità ci dicono che, gettando un dado sei milioni volte, otterremo
(con ottima approssimazione) ognuno dei sei numeri un milione di volte: ma ciò non ci
aiuta affatto a conoscere il risultato del prossimo lancio.
Rispetto alla fisica classica, un'
altra rilevante novità è costituita dal principio di
indeterminazione di Heisenberg. Esso stabilisce che esistono alcune coppie di grandezze di
un sistema quantistico (in particolare, le coordinate posizionali e le componenti della
quantità di moto di una particella; l’energia e la "durata" di un suo stato) i cui valori, per
legge di natura, non possono essere determinati contemporaneamente in modo esatto. Il
prodotto delle incertezze "intrinseche" sui loro valori è dell'
ordine della costante di Planck
diviso 2π cioè di
:
∆x ⋅ ∆p x ≈ ,
∆y ⋅ ∆p y ≈ ,
∆z ⋅ ∆p z ≈
∆E ⋅ ∆t ≈
Eq. 2.4-4
Queste relazioni di indeterminazione non hanno nulla a che fare con gli errori di misura
della fisica classica. Esse sono indipendenti dalla precisione degli strumenti di misura e
rappresentano ancora un principio della meccanica quantistica. In pratica ogni tentativo di
ridurre per esempio l’incertezza ∆p sulla quantità di moto si traduce in un aumento
dell'
incertezza ∆r sulla posizione. Naturalmente, l’indeterminazione di una misura reale
sarà non inferiore all'
indeterminazione "intrinseca", per cui le relazioni di indeterminazione
vanno scritte
∆x ⋅ ∆p x ≥ ,
∆y ⋅ ∆p y ≥ ,
∆z ⋅ ∆p z ≥
∆E ⋅ ∆t ≥
Eq. 2.4-5
Il principio di indeterminazione svanisce, assieme al concetto di quanto di energia hν,
per h→ 0, cioè nel limite in cui la meccanica quantistica tende alla fisica classica.
Il principio di indeterminazione sopra illustrato lascia perplessi se si visualizzano le
particelle come punti materiali, ma appare abbastanza naturale se si pensa che alle
particelle è associata un'
onda. Per esempio, consideriamo il caso in cui la Ψ abbia la forma
di un'
onda piana sinusoidale di numero d’onda k che si propaga lungo l'
asse x (vedremo in
seguito sotto quale condizioni si verifica questo caso particolare)
Ψ = A exp[i(kx − ωt )] = A exp i
px
x − ωt
In questo caso, essendo noto in modo esatto il numero d’onda, la quantità di moto px della
particella è, a sua volta, perfettamente nota ( ∆p → 0 ). Se calcoliamo ora la densità di
presenza della particella utilizzando l’Eq. 2.4-1 troviamo che essa è indipendente dalla
posizione
2
d ( x ) = ΨΨ ∗ = A exp[i (kx − ωt )]A ∗ exp[− i (kx − ωt )] = A
La probabilità di trovare la particella è costante in qualunque punto dello spazio; quindi, in
questo caso l'
indeterminazione ∆x sulla posizione è totale ( ∆x → ∞ ), in accordo con il
29
principio di indeterminazione di Heisenberg che afferma che il prodotto delle due
indeterminazioni deve comunque essere maggiore o uguale di una quantità finita
(∆p∆x ≥ ) .
G/k)
Più in generale, una particella avente
un'
indeterminazione finita ∆x sulla
sua localizzazione è rappresentata da
un gruppo (o "pacchetto", secondo
un inglesismo ormai diffuso) d'
onde
avente larghezza ∆x. In questo caso,
per illustrare in pratica la relazione
∆k k0
k
di indeterminazione che lega la
posizione
di
una
particella
Fig. 2.4-1 Trasformata di Fourier a forma rettangolare di
quantistica alla sua quantità di moto
semilarghezza ∆k
(∆p∆x ≥ ) , consideriamo un
pacchetto d’onda caratterizzato da una trasformata di Fourier G(k) espressa dalla seguente
relazione:
G(k)=A per k0-∆k<k<k0+∆k, G(k)=0 altrimenti (figura 2.4-2).
La quantità di moto della particella sarà quindi uguale a k 0 con una indeterminazione pari
ad ∆k . Nello spazio reale il pacchetto d’onda sarà espresso dall’integrale di Fourier
ψ ( x, t ) =
k 0 + ∆k
A exp(i(kx − ωt ))dk
k 0 − ∆k
La densità di probabilità di trovare la particella quantistica è data da ψ ( x,t ) . Tale densità
si può calcolare senza particolari difficoltà ed è rappresentata all’istante t=0 nella figura
2.4-1. La densità di probabilità ψψ* ha un
massimo per x=0 e si annulla per la prima
π
π
volta nei punti di ascissa −
e
. La
ψψ*
∆k ∆k
figura 2.4-2 mostra come la probabilità di
trovare la particella sia sostanzialmente
diversa da zero soltanto in questo
2π
intervallo di ampiezza
. Questo
∆k
risultato è in accordo con il principio di
x
π
π
−
indeterminazione ( ∆p∆x ≥ ). Infatti, nel
∆k
∆k
nostro caso, sostituendo otteniamo
Figura 2.4-2 rappresentazione di una particella
π
Si
osservi
come,
∆k ∗
≥ .
quantistica come un pacchetto d’onda la G(k) è data
∆k
in Fig. 2.4-1
aumentando la larghezza della funzione
G(k) nello spazio k (e quindi
l’indeterminazione sull’impulso p), la larghezza della distribuzione di probabilità nello
spazio reale si riduca in modo da soddisfare sempre il principio di indeterminazione
2
Il principio di indeterminazione, e in generale l’assenza di un vero determinismo nella
meccanica quantistica, sono stati oggetto di numerose critiche e lunghe polemiche. E'noto
che Einstein, che dette importanti contributi alla nascita di teorie di tipo quantistico, non
condivise mai l’interpretazione probabilistica della funzione d'
onda; è famosa la sua
affermazione "non posso credere che Dio giochi a dadi con l’universo". Einstein non
30
metteva in dubbio che la meccanica quantistica desse risultati in accordo con l'
esperienza,
ma continuò a credere sino all’ultimo che essa fosse una specie di "approssimazione
statistico-fenomenologica”, e che al di là di essa esistessero "variabili nascoste" soggette a
equazioni del moto di tipo classico, tali da permettere previsioni certe sulle situazioni
future a partire dalle condizioni iniziali, salvando così il principio di causalità. E’
interessante vedere nel suo epistolario con Born (A. Einstein, M. Born, "Scienza e vita:
lettere 1916-1955", ediz. Einaudi 1973) con quanta pertinacia Einstein cercasse di
costruire paradossi che mettessero in crisi il principio di indeterminazione; paradossi che il
suo corrispondente risolveva amichevolmente ma implacabilmente ad uno ad uno,
riconducendoli nell’ambito della meccanica quantistica canonica.
Einstein non riuscì mai a tradurre queste sue idee (o "pregiudizi”, secondo Born) in una
teoria coerente che facesse da alternativa alla meccanica quantistica, né hanno avuto
successo gli altri che hanno provato dopo di lui. Per quanto neppure oggi la questione
possa dirsi del tutto chiusa, L’importante ai fini pratici è che innumerevoli confronti con
l'
esperienza abbiano mostrato che i risultati offerti dalla meccanica quantistica sono, come
si è già detto, del tutto affidabili.
2.5 Equazione di Schrödinger indipendente dal tempo: stati stazionari ed evoluzione
temporale
Consideriamo un problema ad una sola dimensione (1D) e supponiamo che la funzione
d'
onda Ψ (x, t ) sia separabile nel prodotto di due funzioni, rispettivamente della sola
posizione x e del solo tempo t:
Ψ ( x, t ) = ψ ( x )u (t )
Eq. 2.5-1
Sostituendo questa espressione nell’equazione di Schrödinger si ha:
−
2
2m
u (t )
d2
d
ψ ( x ) + V ( x )ψ ( x )u (t ) = i ψ ( x ) u (t )
2
dt
dx
dividendo per ψ(x)u (t)
−
2
1 d2
1 d
ψ (x ) + V (x ) = i
u (t )
2
2m ψ ( x ) dx
u (t ) dt
l’identità tra il primo membro (funzione solo di x) ed il secondo (funzione solo di t) può
sussistere solo se entrambi sono uguali alla stessa costante ε che, come è facile verificare
deve avere le dimensioni di una energia. Si ottengono quindi due equazioni differenziali:
2
d2
−
ψ ( x ) + V ( x )ψ ( x ) = εψ ( x )
2m dx 2
d
i
u (t ) = ε u (t )
dt
Eq. 2.5-2
La seconda è immediatamente integrabile, e dà
u (t ) = cos t ⋅ exp(− iωt )
avendo posto ω = ε
31
La prima è detta equazione di Schrödinger indipendente dal tempo, e le sue soluzioni
dipenderanno dall'
espressione dell'
energia potenziale V(x). In generale, la soluzione
dell’equazione di Schrödinger dipendente dal tempo (eq. 2.3-3 ) potrà essere espressa come
il prodotto della soluzione dell’equazione indipendente dal tempo per il fattore di
evoluzione temporale cos t ⋅ exp(− iωt ) :
Ψ ( x, t ) = ψ ( x )e −iωt
Eq. 2.5-3
L’equazione di Schrödinger indipendente dal tempo può essere riscritta come:
Hψ ( x ) = εψ ( x )
Eq. 2.5-4
dove H è l’operatore hamiltoniano. Esso non è altro che l'
hamiltoniana classica del sistema
(cioè, cfr. il Corso di Meccanica Razionale, l’energia del sistema espressa in termini delle
coordinate generalizzate e dei loro momenti coniugati) nella quale alle variabili dinamiche
classiche sono stati sostituiti i corrispondenti operatori quantistici: p. es, alla quantità di
∂
.
moto viene sostituito l'
operatore p ≡ −i
∂x
La 2.5-4 è una "equazione agli autovalori'
, cioè in generale ammette soluzioni solo per
alcuni valori di ε, detti "autovalori dell'
energia", che saranno indicati con εn . In
corrispondenza al generico autovalore εn, esistono una o più funzioni d'
onda ψ(x)n,i , dette
"autofunzioni”. Se le autofunzioni sono più di una (cioè se i=1,2,3,...,m) si dice che "il
livello energetico εn, è m volte degenere". Gli indici come n ed i, che identificano (o, come
si dice, "etichettano") una certa autofunzione, si dicono numeri quantici. In generale, essi
indicano il valore di quantità dinamiche che caratterizzano lo stato rappresentato dalla ψn,i :
per esempio, n è legato appunto al valore dell'
energia dello stato.
Ognuna delle autofunzioni ψn,i rappresenta uno stato stazionario del sistema; è infatti nulla
l’evoluzione temporale della corrispondente Ψ(x,t) 2, che è la quantità osservabile. Per
le 2.4-1 e 2.5-3 si ha infatti:
2
∗
∗
∗
Ψ ( x, t ) = Ψ ( x, t ) ⋅ Ψ ( x, t ) = ψ n ,i ( x )u (t ) ⋅ψ n ,i ( x ) u (t ) =
= ψ n ,i ( x ) ⋅ψ n ,i ( x ) cos t exp(iωt ) exp(− iωt ) = ψ n ,i ( x ) cos t
∗
2
2
2
dove la dipendenza da t è svanita. Notare che la stazionarietà di tali autostati è in
accordo col principio di indeterminazione espresso dalla seconda delle eq. 2.4-5: infatti
l’energia del generico autostato ψn,i (x) è εn , perfettamente definita e l’autostato stesso è
"eterno", cioè l’indeterminazione sulla sua "età” è totale.
Nel prossimo capitolo è illustrata la soluzione dell'
equazione di Schrödinger
indipendente dal tempo in alcuni casi semplici ma notevoli Attraverso tali esempi, si
può acquisire il procedimento standard che va seguito per risolvere i problemi di
meccanica quantistica.
Lo stato più generale della particella è invece costituito da una "sovrapposizione
di autostati", rappresentata da una funzione d'
onda del tipo
Ψ ( x, t ) =
a n ,iψ n ,i ( x )e − iωn t
n ,i
Eq. 2.5-5
cioè da una combinazione lineare a coefficienti costanti an,i delle autofunzioni ψn,i ,
ciascuna moltiplicata per il suo fattore di evoluzione temporale e iωnt con ω n =
εn
.
32
E’ facile verificare che la Ψ(x,t) non soddisfa l’equazione di Schrödinger indipendente
dal tempo:
2
2
∂2
∂2
− iω n t
(
)
HΨ ( x, t ) = −
+
V
a
ψ
x
e
=
a
−
+ V ψ n ,i (x )e −iωnt =
n , i n ,i
n ,i
2
2m ∂x 2
2
m
∂
x
n ,i
n ,i
a n,i ε nψ n,i ( x )e −iωnt ≠ cos t
=
n ,i
a n,iψ n ,i ( x )e −iωnt = cos tΨ ( x, t )
n ,i
Tale funzione non rappresenta quindi uno stato stazionario del nostro sistema, ma bensì
uno stato il cui la densità di probabilità ΨΨ* varia nel tempo. D’altra parte poiché la
Ψ(x,t) rappresenta comunque uno stato consentito del sistema, essa sarà, come è facile
verificare, soluzione dell’equazione dipendente dal tempo:
ε
ε
ε
−i n t
−i n t
ε
∂
∂ −i n t
i
Ψ ( x, t ) = a n ,iψ n ,i ( x )i
e
= a n,iψ n,i ( x )i − i n e
= a n ,iψ n,i ( x )ε n e
=
∂t
∂t
n ,i
n ,i
n ,i
= HΨ ( x, t )
Effettuando una misura dell’energia della particella in uno stato non stazionario si potrà
trovare uno qualunque dei valori εn. La probabilità di trovare (e la frequenza con cui,
ripetendo un gran numero di volte la misura, effettivamente si trova) un certo εn è
2
certamente proporzionale a
a n ,i , cioè alla somma dei moduli quadri dei
i
coefficienti che moltiplicano le autofunzioni stazionarie corrispondenti a εn. Tuttavia
nulla di certo è dato di sapere sul risultato della singola misura ancora da effettuare.
2.6 Alcuni esempi di soluzione dell’equazione di Schrödinger indipendente dal
tempo.
2.6.1
Particella libera (caso unidimensionale)
Per una particella libera, cioè non soggetta a forze, l'
energia potenziale V è nulla, e l’equazione
di Schrödinger indipendente dal tempo si riduce, nel caso unidimensionale, a:
d2
ψ (x ) = εψ (x )
2m dx 2
che ha come soluzione generale (cfr. i Corsi di Analisi Matematica)
−
2
Eq. 2.6-1
ψ ( x ) = C1e ikx + C 2 e −ikx
Eq. 2.6-2
avendo posto
2mε
k=
2
Eq. 2.6-3
ed essendo C1 e C2 costanti arbitrarie. Ricordando la 2.5-3, la dipendenza spaziotemporale della funzione d'
onda "completa" Ψ(x, t) è
Ψ ( x, t ) = ψ ( x )u (t ) = C1e i (kx−ωt ) + C 2 e −i (kx+ωt )
Eq. 2.6-4
La Ψ(x, t) più generale è dunque formata dalla sovrapposizione di due onde piane, una
33
progressiva e una regressiva di uguale numero d’onda k
pulsazione ω =
ε
=
2mε
2
ed uguale
.
Se la particella è libera su tutto l’asse X, qualunque valore di ε (e quindi di k) è
consentito, cioè la particella può avere qualunque energia. Notare inoltre che, in tal
+∞
caso, la funzione d’onda non è normalizzabile: infatti,
ΨΨ ∗ dx diverge, e non può
−∞
essere posto uguale ad 1, a meno di non far tendere a zero C1 e C2, cioè la ψ stessa. Ciò
dipende dalla circostanza che stiamo considerando il caso ideale non fisico del moto di
una particella libera in uno spazio ideale illimitato. Normalmente, se consideriamo una
singola particella in movimento nel verso positivo (o negativo) dell’asse x, la soluzione
ω
k
Figura 2.6-1 Relazione di dispersione ω(k) di una particella
libera
dell’equazione di Schrödinger sarà correttamente rappresentata solo dall’onda
progressiva
(o
quella
regressiva).
In
questo
caso
sarà
2
∗
i ( kx −ωt ) ∗ − i ( kx +ωt )
ΨΨ = C 2 e
C2 e
= C 2 indipendente da x: in altre parole, si ha uguale
probabilità di trovare la particelle in qualunque punto lungo l’asse x. Nel caso generale,
l'
onda progressiva e quella regressiva interferiscono, e la ΨΨ* avrà dei massimi e dei
minimi; in particolare, se è C1 =C2, si ha un'
onda stazionaria, con ventri e nodi nei punti
rispettivamente di massima e minima probabilità di presenza della particella.
In figura 2.6-1 è rappresentato l’andamento della pulsazione ω =
ε
=
k2
in funzione del
2m
numero d’onda k (relazione di dispersione). Tale relazione è quadratica, di conseguenza, la
velocità di fase c =
ω
k
dell’onda non è costante ma dipende da k secondo la legge c =
k
.
2m
Supponiamo ora che la particella quantistica sia rappresentata da un pacchetto d’onde centrato
intorno ad un valore ko. In questo caso la velocità con cui si muove il massimo del pacchetto
d’onda (velocità di gruppo), che è l’equivalente della velocità classica della particella, sarà data
da v g =
dω
dk
=
k0
k
, diversa, come atteso, dalla velocità di fase c. In base a quanto detto si
m
capisce bene che un pacchetto d’onde non potrà essere una soluzione dell’equazione di
Schrödinger indipendente dal tempo per la particella libera. Infatti le diverse componenti, con
34
diverso numero d’onda, avrebbero velocità di fase diversa e tenderebbero a disperdersi durante
il moto cambiando quindi la forma del pacchetto. Si può facilmente verificare quanto detto
sostituendo l’espressione di un generico pacchetto d’onde nell’equazione di Schrödinger
indipendente dal tempo della particella libera:
k 0 + ∆k
2
2
d2
d2
(
)
−
ψ
x
=
−
2m dx 2
2m dx 2
=
A exp(ikx )dk = −
k 0 − ∆k
2 k 0 + ∆k
k 0 + ∆k
2 m k 0 − ∆k
k 0 − ∆k
Ak 2 exp(ikx )dk ≠ cos t ∗
2 k 0 + ∆k
2m k0 −∆k
A
d2
[exp(ikx )]dk =
dx 2
A exp(ikx )dk = εψ ( x )
D’altra parte il pacchetto d’onde sarà, come è facile verificare, soluzione dell’equazione
di Schrödinger dipendente dal tempo.
Consideriamo ora il caso di una particella che non è libera su tutto l'
asse x ma per la
quale esistono delle limitazioni, cioè delle "condizioni al contorno" (come negli esempi
che saranno fatti in seguito), da queste deriva in generale una quantizzazione
dell’energia, almeno per gli stati di energia più bassa (stati legati).
Nella pratica, molte volte si è interessati a particelle contenute in un recipiente
grande sulla scala microscopica ma non infinito, e delle cui "pareti" non si sa bene come
descrivere matematicamente gli effetti. Una brillante soluzione a questo problema, che
consente di continuare a considerare la propagazione di onde ideali sinusoidali in un
recipiente di dimensioni finite, è stata data da Born e Von Kármán n, e consiste
nell'
imporre al contorno le "condizioni periodiche". Idealmente si tratta di chiudere il
recipiente su se stesso in modo tale che l’onda sinusoidale disponga, per la sua
propagazione, di un mezzo ideale di dimensioni infinite. Se per esempio il "recipiente"
(nel caso unidimensionale) è il segmento da x=0 a x=L, si impone che sia:
ψ(x=0)=ψ(x=L)
Fisicamente, questo corrisponde a chiudere il segmento in una circonferenza,
eliminando completamente i bordi e gli effetti ad essi connessi.
2.6.2
Buca di potenziale a pareti infinite
Mantenendoci nel caso unidimensionale, supponiamo ora che le forze agenti sulla particella
corrispondano a un'
energia potenziale V(x) data da:
V(x) = 0
V(X) =
per -a x a
per x<-a ; x> a
denominata (v. Fig.2.6-2) "buca di potenziale" (in inglese "potential well", cioè
letteralmente" pozzo" di potenziale) quadrata a pareti infinite.
V(x)
-a
0
+a
x
Figura 2.6-2 Buca di potenziale a pareti
infinite
35
All’interno della buca I"equazione di Schrödinger si scrive esattamente come la 2.6-1,
per cui la soluzione più generale è ancora data dalla 2.6-2. Per comodità di conto
successivo, effettuiamo una diversa scelta delle costanti arbitrarie di integrazione,
ponendo:
C1 =
1
B
A+
2
i
C2 =
;
1
B
A−
2
i
dove A e B sono le nuove costanti. Sostituendo le
nuove costanti in 2.6-2 ed utilizzando le formule di Eulero, si ottiene
B ikx 1
B −ikx
e ikx + e − ikx
e ikx − e − ikx
1
ψ ( x ) = C1 =
A+
e +
A−
e
=A
+B
=
Eq. 2.6-5
2
i
2
i
2
2i
= A cos(kx ) + B sin (kx )
Fuori della buca, l'
eq. di Schródinger sarebbe:
2
2
d
−
ψ (x ) + Vψ ( x ) = εψ ( x )
2m dx 2
. Per evitare tale divergenza, deve essere ψ = 0. Fisicamente, ciò significa
con V
che la particella ha probabilità nulla di trovarsi fuori della buca, non potendo superare
una barriera energetica infinita. Da questo vengono le seguenti condizioni al contorno
da imporre alla 2.6-5:
ψ(-a) = 0 =A cos(ka) -B sin(ka)
ψ(+a) = 0 =A cos(ka) +B sin(ka)
Escludendo la soluzione banale A = B = 0, che renderebbe identicamente nulla la 2.6-5,
si hanno le seguenti due alternative (I) e (II) :
(I): A = 0; sin (ka ) = 0
ka = nπ
(II): B = 0; cos(kx ) = 0
ka = (2n + 1)
k=n
π
2
π
a
= 2n
π
2a
=N
k = (2n + 1)
π
2a
π
2a
=N
(N pari)
π
2a
(N dispari)
dove n è un intero ed L rappresenta la larghezza della buca di potenziale(L=2a).
Ricordando la relazione che lega l’energia al numero d’onda per una particella libera, si
hanno dunque i seguenti autovalori discreti dell’energia:
2 2
2 2
k
π
εN =
=
N2
Eq. 2.6-6
2
2m
2mL
ε
ε4
ε3
ε2
ε1
-a
0
+a
x
Figura 2.6-3 Autovalori dell’energia per
una particella in una buca di potenziale a
pareti infinite
36
con N numero intero.
Lo schema di questi livelli energetici è mostrato in Fig. 2.6-3.
Si noti che la quantizzazione dell’energia è derivata dalle condizioni al contorno: come
già detto, questo è un fatto generale.
In corrispondenza di N pari ed N dispari si hanno rispettivamente le autofunzioni:
π
(N pari)
ψ N ( x ) = B N sen N x
L
π
(N dispari)
ψ N (x ) = AN cos N x
L
Poiché tutti i livelli energetici sono non degeneri, per etichettare le autofunzioni è
sufficiente il numero quantico dell'
energia N.
Le costanti AN e BN vanno determinate imponendo che sia 1 la probabilità di trovare la particella
cercandola in tutto il segmento tra –a e +a (condizioni di normalizzazione):
+a
ψ ( x )ψ * (x )dx = 1
−a
e non è difficile vedere che viene
1
AN = B N =
a
In totale, gli autostati della particella, corrispondenti agli autovalori dell'
energia 2.6-6,
sono dati dalle autofunzioni:
π
π
π
1
1
1
x ;
sen 2 ⋅
x =
sen x
ψ 1 (x ) =
ψ 2 (x ) =
cos 1 ⋅
a
2a
2a
a
a
a
π
π
π
1
1
1
x ;
sen 4 ⋅
x =
sen 2 ⋅ x
ψ 3 (x ) =
ψ 4 (x ) =
cos 3 ⋅
a
2a
2a
a
a
a
ψ 5 (x ) =
1
a
cos 5 ⋅
π
2a
x ;
ψ 6 (x ) =
1
a
sen 6 ⋅
π
2a
x =
1
a
sen 3 ⋅
π
a
x
I grafìci di queste autofunzioni e delle corrispondenti densità di presenza ψ Nψ N∗ sono
mostrati in Fig. 2.6-4. Notare che il numero dei nodi delle ψN aumenta con N, cioè con
l’energia dello stato; questo è un altro fatto generale della meccanica quantistica, che
2
Ψ1
Ψ1
Ψ2
Ψ3
2
Ψ3
*
Ψ
-a
2
Ψ2
ψψ
+a
+a
-a
Figura 2.6-4 Densità di presenza per le tre autofunzioni di energia più bassa della particella in una buca di
potenziale a pareti infinite
37
può essere osservato anche nei casi che verranno affrontati successivamente.
Notare infine che la descrizione quantomeccanica della situazione fisica si esaurisce
nella conoscenza della densità di presenza d(x)=ψ(x)ψ*(x). Non sappiamo esattamente
quale sia la traiettoria della particella, e anzi (secondo la visione di Heisenberg e Born, e
contrariamente all'
opinione di Einstein) non ha senso chiederselo. L'
informazione
portata dalla d(x) è che, effettuando un gran numero di misure su tutto l'
asse x, un
istogramma della "frequenza di reperimento" della particella nei vari punti avrà
certamente la forma della d(x) stessa. Ma per quel che riguarda la singola misura da
effettuare, la d(x) fornisce solo la probabilità (e mai la certezza) di reperimento. In
realtà, osservando con attenzione in figura l’andamento della ψ22 è facile capire che
l’idea classica di traiettoria debba essere abbandonata per una particella quantistica.
Infatti per tale autofunzione, come pure per altre, la densità di presenza d(x) è nulla al
centro della buca ed assume il suo massimo valore nei punti di ascissa –a/2 e a/2. Tale
circostanza è incompatibile con l’idea classica di traiettoria che imporrebbe alla
particella di passare comunque per il centro.
2.6.3
Buca di potenziale a pareti finite
L’energia potenziale sia ora come in Fig. 2.6-6, cioè
V(x)=0
V(x)=V0
per
per
–a ≤ x ≤ a
x < -a; x > a
Dentro la buca, l’equazione di Schrödinger è identica al caso precedente, e la soluzione
generale ancora della forma
ψ (x ) = A cos(kx ) + B sin(kx )
Fuori della buca, l’equazione di Schrödinger è invece:
2
d2
−
ψ (x ) + V0ψ ( x ) = εψ ( x )
con Vo finito.
2m dx 2
2m(V0 − ε )
d2
In forma canonica:
ψ (x ) −
ψ (x ) = 0
2
2
dx
Ponendo
q=
2m(V0 − ε )
2
al solito, la soluzione più generale è
ψ ( x ) = Ce qx + De − qx
V(x)
V0
-a
0
+a
x
Figura 2.6-5 Rappresentazione schematica di un
buca di potenziale a pareti finite
Interessiamocì agli stati aventi ε < Vo , che
per la VI.6, hanno q reale; questi sono detti
"stati legati", in quanto classicamente la
particella con energia inferiore a Vo
resterebbe confinata nella buca. In questo
caso la soluzione dell’equazione di
Schrödinger
è
rappresentata
da
esponenziali
di
argomento
reale.
Naturalmente, per evitare divergenze (che
non avrebbero senso fisico) della ψ(x) per
38
x→ ±∞, occorre che per x<0 sia D = 0, e che per x>0 sia C = 0. In totale, le autofunzioni devono
essere della forma:
ψ ( x ) = Ce qx
ψ ( x ) = A cos kx + B sin kx
ψ ( x ) = De −qx
x < −a
−a≤ x≤ a
x > +a
Le condizioni al contorno da imporre sono la continuità della ψ(x) e della sua derivata
prima ovunque, e in particolare nei punti x= ±a dove l'
energia potenziale è discontinua.
Questo è necessario per soddisfare il requisito fisico che la densità di presenza della
particella d(x)=ψ(x)ψ*(x) sia ovunque una funzione univocamente definita e "regolare",
senza punti angolosi né discontinuità. Una volta imposte le condizioni al contorno è
possibile svolgere il calcolo esplicito delle singole autofunzioni e degli autovalori
dell'
energia.
Tale calcolo è piuttosto tedioso. Risolvendolo per via numerica, si trovano gli εN e le ψN
mostrati in Fig. 2.6-6. E'molto notevole il fatto che le ψN (e le corrispondenti d(x)
=ψNψN* siano significativamente non nulle anche al di fuori del segmento -a ≤ x ≤ +a,
benchè la corrispondente εN sia minore della barriera di potenziale Vo. In altre parole,
mentre una particella classica avente energia cinetica minore di Vo non potrebbe in
nessun modo superare le barriere di potenziale alte Vo situate a x = ±a, la particella
quantistica ha probabilità non nulla di trovarsi al di là di esse. Le funzioni d’onda, e
quindi le d(x), estendono una coda esponenziale all’interno della regione proibita (ε
<V0) avente lunghezza caratteristica è pari a 1/q. In base alla definizione di q si vede
che tale lunghezza è tanto maggiore quanto più vicina è l’energia della particella
all’energia V0 della barriera. Questa circostanza si può facilmente verificare nella figura
nel caso dell’autofunzione ψ3 la cui energia è molto vicina all’energia della barriera.
Quest’effetto di sconfinamento dell’elettrone è analogo all'
effetto tunnel, trattato più in
dettaglio nel paragrafo seguente. A causa di questo sconfinamento dell’elettrone oltre le
pareti della buca, la lunghezza d’onda λ, associata a ciascuno stato quantico è, nel caso
di buca finita, maggiore di quanto sarebbe se l’elettrone fosse intrappolato in una buca
-a
a
Figura 2.6-6 Le tre autofunzioni di energia più bassa per una buca
di potenziale a pareti finite
39
di profondità infinita. Pertanto, poiché l’energia della particela quantistica libera è
inversamente proporzionale al quadrato di λ, l’energia εN posseduta dalla particella in
ciascuno stato quantico è minore nel caso di buca finita rispetto a quello di buca infinita.
Mentre nel caso di buca infinita il numero di livelli quantistici a disposizione della
particella è infinito, nel caso di buca finita tale numero è limitato e dipende da V0 e la
larghezza della buca. Se l’energia della particella è maggiore di V0, gli stati non sono
più quantizzati e la particella diviene libera di muoversi lungo tutto l’asse x.
2.6.4
L'effetto tunnel
Supponiamo ora di avere, anziché una buca, una barriera di potenziale (v. Fig. 2.6-7),
cioè un’energia potenziale definita come:
V(x)=0
V(x)=V0
per x < 0; x >L
per 0 ≤ x ≤ L
Come al solito, l'
equazione di Schrödinger si scrive, rispettivamente:
2
2
d
−
ψ (x ) = εψ (x )
x < 0; x > L
2m dx 2
2
d2
−
ψ (x ) + V0ψ ( x ) = εψ (x )
0≤ x≤L
2m dx 2
E'immediato vedere che tale equazione è soddisfatta da autofunzioni della seguente
forma:
ψ ( x ) = Ae ikx + Be − ikx
ψ ( x ) = Fe −qx + Ge qx
ψ ( x ) = Ce
ikx
x<0
0≤ x≤L
x>L
Eq. 2.6-7
dove si è posto, come in precedenza, k =
2 mε
,e q=
2m(V0 − ε )
; q è al solito reale se
l’energia ε della particella è inferiore alla barriera di potenziale Vo. Il senso fisico delle
autofunzioni del tipo della 2.6-7 diventa chiaro se le si moltiplica per la parte temporale e − iωt .
A sinistra della barriera si ha un'
onda piana progressiva e una regressiva, rappresentanti
rispettivamente un fascio di particelle incidenti sullo scalino posto a x = 0, e un fascio di
particelle riflesse da esso. Dentro la barriera si hanno anche due fasci di particelle
propagantesi nei due versi (fasci formati
V(x)
rispettivamente dalle particelle che
hanno superato lo scalino a x = 0 e da
quelle riflesse dallo scalino a x = L), ma
ora le loro funzioni d’onda non sono
oscillatorie,
bensì
smorzate
esponenzialmente con la distanza dai
x
rispettivi scalini Infine, a destra della
0
L
barriera si ha solo un’onda piana
progressiva, rappresentante le particelle
Figura 2.6-7 Barriera di potenziale di altezza finita
40
T
1
0.8
0.6
0.4
0.2
0
1
2
3
4
5
6
7
ε/V0
Figura 2.6-8 Trasmissione attraverso una barriera in
funzione del rapporto tra l’energia della particella e l’altezza
della barriera
derivate prime. Ne conseguono le relazioni:
che hanno superato la barriera, e
si allontanano all'
infinito.
E'da notare che, classicamente,
il
corrispondente problema
avrebbe una soluzione ben
diversa: nessuna delle particelle
incidenti da sinistra con energia
cinetica ε < Vo potrebbe
superare la barriera posta in x=0,
ma tutte verrebbero riflesse
all’indietro.
Il calcolo quantistico va ultimato
imponendo
alle 2.6-7 la
continuità ai bordi ( x = 0 e x =
L ) delle funzioni e delle loro
A+ B = F +G
Fe − qL + Ge qL = Ce ikL
ikA − ikB = −qF + qG
− qFe − qL + qGe qL = iKCe ikL
cioè 4 equazioni nelle 5 incognite A, B, F, C, C (in generale grandezze complesse che
rappresentano le ampiezze dei 5 fasci).
Una caratteristica fisica molto importante della barriera tunnel è rappresentata dal
coefficiente di trasmissione T. Il coefficiente T rappresenta la frazione di particelle
incidenti che superano la barriera. Il flusso di particelle incidenti sulla barriera da
sinistra è proporzionale aψ iψ i* = Ae ikx A∗ e − ikx = AA * . Allo stesso modo il flusso di
particelle che si allontana dalla barriera, dopo averla attraversata, è proporzionale a
ψ tψ t* = Ce ikx C * e − ikx = CC * . Il coefficiente di trasmissione T è quindi dato dal rapporto
CC *
. Dalle formule questo rapporto può essere calcolato e risulta:
AA*
V02 sinh 2
T = 1+
2m(V0 − ε )
4ε (V0 − ε )
−1
L
Eq. 2.6-8
Come è fisicamente ragionevole, T decresce all'
aumentare sia di V0 che di L. Un
andamento di T per un valore fissato di L e V0, al variare del rapporto ε/V0 è mostrato in
Fig. 2.6-8. Si vede che per ε ~ Vo/2 (cioè particelle incidenti con energia cinetica pari
alla metà dell'
altezza della barriera) si ha ancora un "tunnelling" significativo.
41
Sull’effetto tunnel (effetto, come si è visto, tipicamente quantistico, senza alcun analogo
classico) è basato il funzionamento di alcuni componenti elettronici e quello del
microscopio più sensibile oggi esistente, che consente di ottenere immagini reali degli
atomi nel solidi. Questo strumento prende il nome di microscopio ad effetto tunnel (in
inglese Scanning Tunnel Microcope, STM) ed è basato sul fatto che la corrente di
tunnel (proporzionale al coefficiente T) dipende criticamente secondo la formula 2.6-8
dallo spessore della barriera. Il principio di funzionamento del microscopio STM è
illustrato in figura 2.6-9. Una punta estremamente acuminata, idealmente terminata con
un singolo atomo, è tenuta ad una distanza molto piccola (circa 10-9 m) dalla superficie
della quale si vuole investigare la morfologia. Tra la superficie e la punta è applicata
una differenza di potenziale elettrico ∆V. La barriera è rappresentata dallo spazio l(x)
che separa la punta dalla superficie. In queste condizioni una corrente di tunnel Jt
passerà tra la punta e la superficie. L’intensità di questa corrente dipende in modo
critico dalla distanza l(x). Tramite un sofisticato sistema di controllo basato su cristalli
piezoelettrici la punta viene fatta scorrere orizzontalmente nella direzione x senza
variare la sua quota z. Nel corso del movimento (scanning) della punta lungo la
superficie la distanza l(x) e di conseguenza la corrente di tunnel Jt varieranno. Avendo
quindi misurato la Jt(x) sarà possibile ricostruire la l(x) e quindi la morfologia della
superficie. Questo tipo di microscopio è oggi disponibile commercialmente ed utilizzato
in laboratori di tutto il mondo. Una applicazione spettacolare della microscopia ad
effetto tunnel è mostrata in fig. 2.6-10. Questa immagine è stata ottenuta nel 1993
presso il centro ricerche IBM di Almaden in California. In questo caso, tramite tecniche
di nano manipolazione, quarantotto
Figura 2.6-9 Principio di funzionamento di un microscopio ad
effetto tunnel (STM)
42
Figura 2.6-10 Recinto quantistico di atomi di ferro sulla superficie di un cristallo di silicio
atomi di ferro sono stati disposti in cerchio su di una superficie di rame. Il raggio della
circonferenza è pari a sette Å. La circonferenza è stata chiamata “quantum corral”
(recinto quantico). Il “corral” è il recinto dove vengono tenuti gli animali d’allevamento
negli Stati Uniti. Nel caso del recinto quantistico gli animali sono sostituiti dagli
elettroni. Gli elettroni sono visibili nell’immagine STM come ondine. Il cerchio di
atomi di ferro costituisce una barriera di potenziale per gli elettroni. Gli elettroni,
all’interno del recinto quantistico formano onde stazionarie circolari. Si può anche
osservare come per effetto tunnel alcuni elettroni possano uscire dal recinto: le deboli
onde fuori dal cerchio di atomi di ferro.
2.6.5
Oscillatore armonico unidimensionale
Per un oscillatore armonico unidimensionale, soggetto a una forza di richiamo
1
elastica di costante K, l'
energia potenziale è pari a Kx 2 per cui l’eq. di Schrödinger si
2
scrive:
ε
2
n=4
d 2ψ ( x ) 1 2
9
−
+ Kx ψ ( x ) = εψ ( x ) Eq. 2.6-9
ε4
2 ω0
2m dx 2
2
4
n=3
7
2
ω0
5
2
ω0
n=2
ω0
n=1
ω0
n=0
3
2
1
2
0
ε3
ε2
ε1
ε0
Figura 2.6-11 Rappresentazione
schematica dei livelli energetici
dell’oscillatore armonico
quantistico. Si osservi che l’energia
del livello fondamentale non è zero
Questa equazione differenziale si sa risolvere
esattamente, ma il calcolo è piuttosto lungo (vedi
p. es.. L Schiff, "Quantum Mechanics", ediz.
McGraw-Hill, pagg. 66-76) e rinunciamo a
riportarlo. Si trovano i seguenti . autovalori
dell'
energia:
εn = n +
1
2
K
1
= n+
m
2
ω0
43
Quindi una particella quantistica soggetta a una forza elastica può assumere solo certi
K
valori dell'
energia (v. Fig. 2.6-11), spaziati di ω 0 , dove ω 0 =
è la pulsazione
m
propria di una particella classica di ugual massa e soggetta alla stessa forza. Inoltre,
l’oscillatore quantistico non può avere energia nulla: lo stato fondamentale ha energia
1
ε 0 = ω 0 , detta "energia di punto zero".
2
Figura 2.6-12 Rappresentazione grafica della densità di presenza per alcune autofunzioni di diversa energia
dell’oscillatore armonico quantistico. Per confronto viene anche mostrata la densità di presenza classica. La
densità di presenza dell’oscillatore classico dc(x) è ovviamente inversamente proporzionale alla velocità del
punto materiale che oscilla. Pertanto dc è minima per x=0 e tende a divergere per x uguale all’ampiezza
dell’oscillazione. Si osservi la differenza di comportamento tra l’oscillatore classico e quello quantistico.
I livelli energetici dell’oscillatore armonico quantistico sono tutti non degeneri, cioè in
corrispondenza di ognuno di essi si trova una sola autofunzione. Per classificare le
autofunzioni basta quindi il solo numero quantico n che conta i livelli energetici. Le ψ,
per n = 0, 1, 2, 3 sono (avendo posto a = mω 0 / )
ψ 0 (x ) =
a
ψ 2 (x ) =
a
π
e
8 π
−
a2 x2
2
(4a
2
ψ 1 (x ) =
x − 2)e
2
−
a2 x2
2
ψ 3 (x ) =
a
2 π
2axe
a
48 π
(8a
−
3
a2 x2
2
x − 12ax )e
3
−
a2 x2
2
44
che sono mostrate in Fig. 2.6.11. Si osservi che, come al solito, all'
aumentare di n e
quindi dell’energia, cresce il numero di nodi della funzione d'
onda, e che per n dispari la
probabilità di trovare la particella nell'
origine è nulla.
2.6.6
L’atomo di idrogeno
Il problema questa volta è tridimensionale. L'
energia potenziale è quella dovuta all'
interazione
coulombiana nucleo-elettrone
e2
4πε 0 r
per cui si ha l'
eq. di Schrödinger si scrive:
2
1 e2
2
−
∇ψ r −
ψ r = εψ r
2m
4πε 0 r
V (r ) =
1
()
()
()
Eq. 2.6-10
Tabella 1
Simbolo
sistema
nome
valori
n
Elettrone in un
atomo
Numero quantico
principale
1, 2, 3, ...
l
Elettrone in un
atomo
Numero quantico
azimutale
0, 1, ..., n-1
Elettrone in un
atomo
Numero quantico
magnetico
Elettrone
Numero quantico
di spin
La 2.6-10 si sa risolvere esattamente, usando le coordinate polari, e con un
procedimento lungo e complesso (v. p. es. lo Schiff, op. cit.) che omettiamo. Le
autofunzioni risultano classificate da tre numeri quantici, tradizionalmente detti n
(numero quantico principale"), l (numero quantico "azimutale") ed ms (numero quantico
"magnetico"). Essi possono assumere i seguenti valori:
n = 1, 2,3,4,.....
l = 0, 1, 2, ..., (n-1)
ml = -l,-l+1,…, l-1, l
Il legame tra tali numeri quantici e i parametri fisici dello stato dell'
elettrone è il
seguente. L’energia dello stato dipende solo dal valore di n, secondo la formula
1 me 4
εn = − 2
n (2πε 0 )2
che è esattamente la stessa formula ottenuta con il modello atomico di Bohr.
45
Il numero quantico l è legato al momento angolare dello stato dell'
elettrone, che vale in
modulo b = l ⋅ (l + 1) . Poiché, come detto, l=0 è un valore ammesso, l’elettrone può
trovarsi in stati aventi momento angolare nullo, assai difficili da visualizzare come
"orbite classiche”. Infine, il numero quantico ml misura, in unità di -h, la proiezione di
b su un qualunque asse. Notare che la massima proiezione possibile è l , mentre
b = l ⋅ (l + 1) ; si dimostra che anche questa è una conseguenza del principio di
indeterminazione.
I livelli energetici sono degeneri 2l+1 volte (quindi quelli aventi l = 0 non lo sono); è
facile calcolare che ad ogni εn corrispondono n2 autofunzioni diverse.
Tradizionalmente, vengono denominati s p d f g h... gli stati aventi rispettivamente l = 0,
1, 2, 3, 4,....
Infine esiste un quarto numero quantico, quello di spin ms, che raddoppia la
degenerazione di tutti i livelli. In Tabella 1 sono riportati tutti i numeri quantici che
definiscono lo stato quantistico di un elettrone nell’atomo di idrogeno.
Negli atomi a più elettroni le degenerazioni vengono rimosse (cioè i livelli energetici
corrispondenti ad ogni autofunzione leggermente separati tra loro) a causa delle
interazioni coulombiane tra gli elettroni stessi.
Restando all’atomo d’idrogeno, per gli stati più bassi in energia, il calcolo fornisce le
seguenti autofunzioni (in termini di r, θ, ϕ, ed etichettate con i numeri quantici n, l, m)
ψ 1, 0, 0 =
ψ 2 , 0, 0 =
1
πa 0
1
8πa 0
ψ 2,1, −1 = −
ε
n=4
n=3
n=2
n=1
exp −
3
1−
3
1
πa 0
4s
3s
2s
3
r
a0
r
r
exp −
a0
2a 0
r
r
sin θ exp(− iϕ ) exp −
8a 0
2a 0
Livello di ionizzazione, ε=0
4p
4d
3p
3d
4f
2p
1s
l=0
l=1
l=2
l=4
Figura 2.6-13 rappresentazione schematica dei livelli energetici
dell’atomo di idrogeno
46
ψ 2,1, 0 =
ψ 2,1, +1 =
1
32πa0
1
πa 0
3
3
r
r
cos θ exp −
a0
2a 0
r
r
sin θ exp(− iϕ ) exp −
8a 0
2a 0
In tabella 2 è mostrata la forma tridimensionale della densità di presenza
2
d ( x, y , z ) = ψ ( x, y , z ) di alcuni stati. Si può vedere che gli stati s, cioè aventi l=0,
hanno simmetria sferica (infatti non dipendono da θ o ϕ). Gli stati p, cioè aventi l=1,
hanno la forma di un doppio lobo, mentre per valori più elevati di l si hanno forme più
complesse.
Queste distribuzioni spaziali vengono spesso chiamate “nubi elettroniche”, mentre
propriamente sono “nubi di probabilità” di trovare l’elettrone (tutto l’elettrone)nei vari
punti nello spazio. Comunque, agli effetti pratici, poiché ‘elettrone passa in ogni punto
r
()
2
dello spazio un tempo proporzionale a ψ r , sulla scala dei tempi macroscopici è
come se la sua carica fosse effettivamente distribuita nello spazio in modo
()
2
proporzionale a ψ r .
Tabella 2 Nella tabella sono mostrati alcuni orbitali atomici per diversi valori dei numeri quantici n, l,
m. Solo gli orbitali s, caratterizzati da l=0 hanno simmetria sferica.
n=1, l=0
n=2,l=0
n=2, l=1
n=3, l=0
n=3,l=1
n=3,l=2
ml = 0
ml = 1
ml = 2
2.7 Lo spin; bosoni e fermioni; il principio di esclusione di Pauli.
Oltre ad essere associate a una funzione d'
onda ψ, le particelle quantistiche posseggono
un'
altra proprietà sconosciuta ai punti materiali della fisica classica, cioè un momento
angolare (momento della quantità di moto) "intrinseco”. Esso è detto "spin" (trottola in
47
inglese) perché classicamente può essere visto come dovuto a un moto rotatorio della
particella attorno a un proprio asse di simmetria. Lo spin è una caratteristica definita e
immutabile il cui valore dipende dal particolare tipo di particella: esso non dipende né
dallo stato dinamico della particella stessa, né da eventuali interazioni con altre
particelle.
Lo spin della particella è indicato in generale con s, ad esso è associato un numero
quantico (generalmente indicato con ms) che va aggiunto a quelli che "etichettano" la ψ
per caratterizzare completamente lo stato della particella. I valori consentiti dello spin
sono s = 0, 1/2, 1, 3/2, 2, 5/2, ... Il momento angolare associato con lo spin vale in
modulo s(s + 1) , e la sua proiezione bz su un qualunque asse (indicato in generale
come asse z) è quantizzata in unità di e può assumere soltanto i valori ms=-s, s+1,…,+s (cfr. quanto detto per il numero quantico l a proposito dell’atomo di
idrogeno). Per esempio, nel caso dell’elettrone, essendo s = 1/2, possiamo avere
esclusivamente ms = ± 1/2.
Come si vedrà in seguito, va fatta una fondamentale distinzione tra particelle che
hanno spin intero (dette "bosoni", poichè seguono la statistica di Bose-Einstein) e quelle
che hanno spin semi-intero (dette "fermioni", poiché seguono la statistica di FermiDirac). L’elettrone, il neutrone e il protone hanno s = 1/2 e sono quindi fermioni,
mentre il fotone ha s = 1 ed è un bosone. Nello studio delle proprietà elettriche e
magnetiche dei solidi, s'
incontrano alcune "quasi-particelle” che sono tutte bosoni:
hanno s = 0: il "fonone”(quanto delle vibrazioni reticolari) e il "plasmone" (quanto delle
oscillazioni collettive del gas di elettroni di conduzione), mentre ha s= 1 il "magnone"
(quanto delle "onde di spin'che si formano nei materiali ferrmagnetici e nelle ferriti). I
bosoni più peculiari sono certamente le "coppie di Cooper", formate da due elettroni (i
quali singolarmente sono fermioni) aventi spin opposto; lo spin della coppia è quindi
nullo. Queste coppie costituiscono i portatori della "supercorrente" (corrente a
resistenza nulla) nei materiali superconduttori.
Le particelle quantistiche di una data specie (p. es. gli elettroni, o i fotoni, etc.) sono
intrinsecamente indistinguibili: p. es., non v'
e'modo di distinguere, usando qualunque
rivelatore di elettroni, il segnale dato da un elettrone da quello dato da un altro.
Vediamo le conseguenze di tale indistinguibilità sulla forma delle funzioni d'
onda.
Indichiamo lo stato complessivo di un sistema di N particelle identiche con la funzione
insieme delle variabili (cioè sia le
d’onda ψ (q1 , q 2 ,.., qi ,...q N ) , dove ogni qi indica l'
coordinate spaziali che quelle di spin) dell'
iesima particella. Poiché le particelle sono
indistinguibili, qualunque stato del sistema deve restare inalterato se vengono scambiate
due particelle qualunque i e j. Ciò significa che il modulo quadro (che è la quantità
osservabile) della ψ non deve mutare scambiando, nell’argomento della funzione, i ruoli
di qi e di qj. Dev'
essere cioè:
ψ (q1 , q 2 ,.., qi , q j ,...q N ) = ψ (q1 , q 2 ,.., q j , qi ,...q N )
2
2
Questo implica che scambiare nella ψ i ruoli di qi e di qj equivale a moltiplicare la ψ
stessa per un numero complesso di modulo unitario:
ψ (q1 , q 2 ,.., qi , q j ,...q N ) = e iδψ (q1 , q 2 ,.., q j , qi ,...q N )
Eq. 2.7-1
Effettuando poi un nuovo scambio di qi e qj , la ψ deve risultare moltiplicata per un ulteriore
fattore e iδ , ma d'
altra parte torna identica a quella iniziale. Ne segue che è
(e )
iδ 2
= 1 , cioè e iδ = ±1
Sostituendo nella 2.7-1, si hanno due possibilità: può essere
48
ψ (q1 , q 2 ,.., q i , q j ,...q N ) = +ψ (q1 , q 2 ,.., q j , q i ,...q N )
Eq. 2.7-2
oppure
ψ (q1 , q 2 ,.., q i , q j ,...q N ) = −ψ (q1 , q 2 ,.., q j , qi ,...q N )
Eq. 2.7-3
(si dice che la ψ è rispettivamente simmetrica o antisimmetrica rispetto allo scambio di
particelle).
La natura utilizza entrambe queste possibilità. Sperimentalmente, si trova che vale la
2.7-2 per tutte le particelle che hanno spin nullo o intero (cioè i bosoni: i fotoni, i
fononi, i plasmoni, i magnoni, le coppie di Cooper..) mentre vale la 2.7-3 per tutte le
particelle che hanno spin semi-intero (cioè i fermioni: gli elettroni, i neutroni, i protoni
... ).
Nel caso dei fermioni, supponiamo che due delle N particelle siano nello stesso stato,
cioè che la funzione d’onda dipenda da due variabili qi e qj , in modo identico.
Scambiando i ruoli di qi e qj, la ψ deve restare inalterata, mentre per la 2.7-3 deve
cambiare segno: non c'
è modo di sanare questa contraddizione, a meno che non sia ψ =
0. Di conseguenza, non esistono stati collettivi di un sistema di particelle a spin semiintero in cui due particelle occupino lo stesso stato; in altre parole, due particelle a spin
semi-intero non possono avere tutti i numeri quantici (quelli della funzione d'
onda
spaziale e quello di spin) uguali" (Principio di Pauli).
E Principio di Pauli ha cruciali conseguenze sulla struttura dell'
atomo, delle molecole e
dei solidi. Precedentemente sono stati illustrati gli stati quantistici disponibili
nell’atomo di idrogeno per l’unico elettrone presente, e i corrispondenti livelli energetici
(Fig. 2.6-11). Negli atomi aventi numero atomico Z > 1, per gli stati disponibili ai
singoli elettroni si ha uno schema molto simile: semplicemente, l'
interazione
coulombiana tra i diversi elettroni causa lievi spostamenti dei livelli energetici degli
stati aventi ugual valore di n ma diversi valori di l, ml ed ms (come si dice, "rimuovendo
le degenerazioni” presenti nell’atomo di idrogeno).
Poiché gli elettroni sono fermioni, in base al Principio di Pauli essi non possono stare
tutti nello stato ad energia più bassa: ciascuno di essi deve occupare uno stato
caratterizzato da un diverso insieme dei numeri quantici n, 1, ml ed ms. Lo stato
fondamentale collettivo di un atomo avente Z elettroni è quindi quello che vede
occupati gli Z stati più bassi in energia. Al variare di Z da 1 (atomo di idrogeno) a 103
(atomo di Lawrenzio) si costruisce così la Tavola di Mendeleyev, illustrata nel Corso di
Chimica..
Nelle molecole, la situazione è molto simile a quella degli atomi. Nel solidi, esiste un
"gas" di elettroni liberi, formato dagli elettroni esterni dei singoli atomi; gli stati e i
livelli energetíci a disposizione di questi elettroni sono radicalmente diversi da quelli
degli atomi liberi, a tali stati va applicato il Principio di Pauli In mancanza di questo,
cioè in base alla sola fisica classica, gran parte delle modalità con cui avviene il
trasporto elettrico nei metalli e nei semiconduttori sarebbero assolutamente inspiegabili
2.8 Metalli, isolanti, semiconduttori
Nel capitolo 2.6-1 abbiamo risolto il problema di una particella quantistica libera
di muoversi lungo l’asse x. In questo caso è stato dimostrato che la soluzione
dell’equazione di Schrödinger indipendente dal tempo è rappresentata da un’onda piana
sinusoidale. L’energia cinetica della particella non è quantizzata e può assumere un
49
ε
2π/L
k
Figura 2.8-1 Relazione di dispersione ε(k) di un
elettrone libero in un conduttore unidimensioanle di
lunghezza L. I punti rappresentano gli stati ammessi.
La separazione tra due stati adiacenti in k è pari a 2π/L.
I punti pieni sono stati occupati.
valore qualsiasi, legato al vettore d’onda k dalla relazione di dispersione parabolica
2 2
k
ε=
.
2m
Il fenomeno del trasporto elettrico nei metalli può essere descritto tramite un semplice
modello di elettroni liberi. In questo modello si suppone che gli elettroni di conduzione
siano completamente liberi dagli atomi genitori e si muovano in un potenziale esterno
nullo: elettroni liberi. Una differenza comunque con il modello ideale della particella
libera è che adesso gli elettroni sono comunque confinati all’interno di un conduttore
metallico di dimensioni finite. Le dimensioni del conduttore sono macroscopiche e
quindi molto maggiori delle distanze che separano gli atomi. In queste condizioni
possiamo aspettarci che le correzioni dovute alle dimensioni finite dei metalli possano
modificare il modello degli elettroni liberi senza stravolgerne l’impianto. Da un punto di
vista concettuale il problema è che le onde ideali sinusoidali, soluzioni del problema
della particella libera, non possono a rigore propagarsi in un conduttore di dimensioni
finite. Un metodo semplice per aggirare il problema delle dimensioni finite dei
conduttori è quello di applicare le condizioni al contorno di Born e Von Kármán (o
condizioni periodiche). Per semplicità considereremo un conduttore unidimensionale
costituito da una fila di N atomi spaziati tra di loro di una distanza a (detta parametro
reticolare): lunghezza totale della catena L=Na. Le condizioni periodiche di Born e von
Kármán ψ ( x + L ) = ψ ( x ) equivalgono, da un punto di vista topologico, a unire
idealmente gli estremi del conduttore (x=0 e x=L) consentendo ad un’onda sinusoidale
di lunghezza indefinita di potersi propagare in un conduttore molto lungo ma comunque
di dimensioni finite. L’applicazione delle condizioni al contorno ad onde sinusoidale
consentono di scrivere
exp(ik 0 ) = exp(ik (0 + L ))
Da questa relazione segue che 1 = exp(ikL ) e quindi L = 2nπ con n numero intero
k
qualsiasi positivo o negativo. Di conseguenza il numero d’onda delle onde sinusoidali
che si propagano lungo la catena atomica è una variabile che può assumere soltanto
2π
. In Fig. 2.8-1 è riportata la curva di dispersione
alcuni valori, precisamente k = n
L
50
ε(k) che ha un andamento parabolico. La curva è disegnata per punti in quanto, a
ragione delle condizioni al contorno, non tutti i valori di k sono consentiti. Ciascun
puntino rappresenta uno stato quantico. La differenza tra due valori di k consecutivi è
2π
pari a
. Non tutti gli stati quantici sono occupati. Il numero di stati occupati dipende
L
dal numero di elettroni di conduzione a disposizione. Consideriamo quindi, a titolo di
esempio, un metallo monovalente (Li, Na, Au, Ag,…). In questo caso il numero totale
di elettroni di conduzione sarà pari al numero N di atomi lungo la catena. Gli N elettroni
andranno sistemati negli stati quantici cominciando ad occupare quelli di energia più
bassa. Essendo gli elettroni fermioni essi obbediranno al principio di esclusione di
Pauli. Ciascuno stato sarà caratterizzato da una coppia di numeri quantici: n ( numero
quantico principale che determina l’energia dello stato) ed ms (numero quantico di
spin). I primi quattro elettroni cominceranno ad occupare gli stati di energia più bassa
n=±1 (trascuriamo lo stato n=0 che corrisponde ad una soluzione non fisica con k=0 e
quindi con lunghezza d’onda λ infinita), due in n=+1 e due in n=-1 disposti con spin
antiparallelo. Nel caso quindi di un metallo monovalente gli stati di energia più alta
N 2π
π
occupati avranno n=±N/4, il numero d’onda corrispondente sarà k = ±
e
=±
4 L
2a
2
2
π
. Il numero d’onda massimo e la massima
la corrispondente energia ε =
2m 2a
energia prendono il nome di numero d’onda di Fermi kF ed energia di Fermi εF.
Naturalmente kF ed εF sarebbero stati diversi (maggiori) se il metallo fosse stato
composto da atomi con una valenza più alta. E’ importante osservare che in questo
semplice modello detto del gas di elettroni liberi o gas di Fermi, gli elettroni sono in
movimento anche a temperature molto prossime allo zero. Infatti tutta l’energia degli
elettroni, in mancanza di qualsisia forza (e quindi di qualsiasi energia potenziale), non
potrà che essere energia cinetica. Avremo quindi ε n =
2
π
2
n 2 = 12 mv 2 . Questa
2m 2 L
relazione ci consente di calcolare la velocità con la quale si muovono gli elettroni.
L’elettrone più veloce sarà quello avente energia pari all’energia di Fermi.
Naturalmente, pur essendo gli elettroni tutti in movimento, non vi sarà trasporto netto di
carica elettrica poiché la velocità media del sistema di tutti gli elettroni è nulla.
Consideriamo ora il caso in cui un campo elettrico E costante sia applicato per esempio
nel verso negativo dell’asse x (vedi Figura 2.8-2). In questo caso avremo una forza F=eE, dove e rappresenta il modulo della carica dell’elettrone, che agisce su ciascuno degli
dp
elettroni nel metallo. In base al secondo principio della dinamica avremo − eE =
.
dt
dk
Essendo inoltre p = k potremo scrivere . − eE =
. Questa relazione implica che, se
dt
il campo è applicato nel verso negativo dell’asse x, gli elettroni, rappresentati da stati
occupati sull’asse dei k, tenderanno a spostarsi collettivamente verso stati con k
maggiore generando la situazione illustrata in figura. A questo punto la media delle
velocità del sistema di elettroni, calcolata su tutti gli stati occupati,
vi
ki
i
i
v=
=
non sarà più nulla e vi sarà quindi una velocità di deriva diversa da
N
m N
zero nel verso opposto al campo elettrico applicato e quindi una corrente elettrica.
51
ε
Nel modello del gas di Fermi
abbiamo completamente trascurato
l’interazione degli elettroni con gli
ioni che costituiscono il metallo. La
descrizione di questa interazione è
piuttosto complessa e sarà uno degli
argomenti principali del corso di
Fisica dello Stato Solido. In questo
corso affrontiamo il problema in
k
E
modo semplificato considerando la
natura ondulatoria degli elettroni.
Figura 2.8-2 Stati occupati in un campo applicato E.
Movendosi all’interno di un
reticolo cristallino gli elettroni di
conduzione possono subire effetti di diffrazione esattamente come qualsiasi altra onda.
In particolare, consideriamo un elettrone che si propaghi lungo la nostra catena
costituita da ioni positivi: se la lunghezza d’onda associata all’elettrone soddisfa le
condizioni di Bragg λ = 2a sin(ϑ ) , con a distanza interatomica e θ pari a 90°,
l’elettrone sarà riflesso all’indietro. Questa circostanza si verifica se λ = 2a , ovverosia
π
se k = ± . Nel caso in cui si verifichino le condizioni di riflessioni alla Bragg, si
a
formerà un’onda piana regressiva, di uguale vettore d’onda ed uguale ampiezza, che
interferirà con l’onda progressiva dando luogo ad un’onda stazionaria. A questo punto
vi sono due espressioni possibili per l’onda stazionaria risultante:
ψ + ( x ) = Asen(kx)
ψ − (x ) = A cos(kx)
Queste due soluzioni sotto forma di onda stazionaria differiscono solo di un angolo di
fase di 90° eppure sono profondamente diverse quanto ad implicazioni fisiche.
Consideriamo infatti le densità di presenza dell’elettrone costruita a partire dalle due
onde stazionarie
ψ +ψ +∗ = AA∗ sen 2 (kx)
ψ −ψ −∗ = AA∗ cos 2 (kx)
Ψ-
Ψ+
*
ΨΨ
x
Figura 2.8-3 Densità di presenza per le due soluzioni possibili di un
elettrone con k=π/a. I cerchi neri rappresentano la posizione degli ioni
positivi
52
ε
-
Ψ ( π /a)
Eg
+
Ψ ( π /a)
- π /a
π /a
k
Figura 2.8-4 Apertura della “gap” proibita Eg in conseguenza dell’interazione
degli elettroni del metallo con il reticolo cristallino di parametro reticolare a.
Poiché l’elettrone è una particella carica, la densità di presenza spaziale rappresenta
anche una densità di carica. Le due densità di carica sono state graficate in Figura 2.8-3
in funzione dell’ascissa x lungo la catena atomica che rappresenta il nostro metallo
unidimensionale. I pallini neri rappresentano gli atomi della catena distanziati di a. Gli
atomi del metallo hanno perso gli elettroni di valenza e sono carichi positivamente (ioni
positivi). Come si vede dalla figura le due onde stazionarie distribuiscono la carica
dell’elettrone in modo diverso lungo la catena di ioni. In particolare la ψ+ addensa
carica elettrica negativa intorno allo ione positivo, mentre la ψ- addensa carica elettrica
negativa a metà strada tra gli ioni positivi. Di conseguenza alle due onde stazionarie è
associata un energia elettrostatica diversa, maggiore nel caso di ψ- rispetto a quella di
π
ψ+. In definitiva gli elettroni con numero d’onda k = ±
saranno rappresentati da
a
onde stazionarie: la loro energia cinetica sarà nulla ed avranno esclusivamente energia
elettrostatica. Le due soluzioni possibili avranno energia elettrostatica diversa. La
situazione è rappresentata in figura 2.8-4. La differenza tra l’energie delle due onde
stazionarie è pari ad Eg e viene detta gap di energia proibita: come si vede dalla figura
infatti non esistono stati quantistici che hanno energia nell’intervallo Eg. Gli stati
quantistici consentiti hanno tutti valori che ricadono all’interno di bande di energia
consentite. Tutti i solidi hanno una struttura a bande che è schematizzata in figura 2.8-4.
Le bande di energia consentite sono separate tra di loro da bande di energia proibite. Il
comportamento metallico o isolante del solido dipende dal riempimento delle bande.
Nel caso in cui le bande non siano completamente piene, il solido si comporta come un
metallo e risponde all’applicazione di un campo elettrico esterno con una corrente
elettrica. Nel caso di bande completamente piene il solido si comporta come un isolante:
l’applicazione di un campo elettrico non da luogo ad alcuna corrente elettrica. Infatti in
questo caso gli elettroni non hanno a disposizione stati vicini in k nei quali spostarsi,
dovrebbero passare alla banda superiore per aumentare il proprio numero d’onda, ma
l’energia fornita dal campo elettrico applicato non è, in generale sufficiente ad effettuare
questo salto interbanda. Nella descrizione a bande dei solidi la differenza tra isolanti e
semiconduttori è esclusivamente quantitativa e dipende dall’ampiezza della banda
proibita. Se Eg è non molto maggiore di 1 eV si parla di semiconduttori, in caso di gap
proibite più ampie di isolanti.
2.9 Esercizi
53
Esercizio 1
Un fascio di raggi X di sezione circolare e raggio 1mm, aventi lunghezza d'
onda λ=0.1nm, investe
perpendicolarmente uno schermo assorbitore di spessore d. L’intensità del fascio all’interno
d
dell’assorbitore diminuisce secondo una legge esponenziale I ∝ exp −
, dove t è una costante
t
(detta lunghezza d’assorbimento) caratteristica del materiale (nel nostro caso t=1µm). Sapendo
che l’intensità Φ del fascio (energia che incide perpendicolarmente su di un’area unitaria
nell'
unità di tempo) è pari a 10 kJ/m2s , si calcoli lo spessore minimo dell’assorbitore affinché il
numero di fotoni X che riescono a passare per secondo sia minore di 100.
Il numero di fotoni incidenti sull’assorbitore nell’unità di tempo è pari a N i =
Φπr 2
≅ 1.3 × 1013
hν
Detto Nf il numero di fotoni che passano oltre l’assorbitore, poiché l’assorbimento è esponenziale,
abbiamo
Nf
Ni
d
= exp −
d = t ln
≅ 26 µm
Ni
t
Nf
Esercizio 2
Un elettrone (indicato tramite la linea tratteggiata in figura),
caratterizzato da una lunghezza d’onda di De Broglie pari a 1 nm,
si muove in assenza di forze applicate (regione I). Ad un certo
istante l’elettrone attraversa una regione (II), di larghezza d= 1
mm, caratterizzata da un campo elettrico E=10 V/cm diretto come
in figura. Successivamente l’elettrone torna a muoversi in una
regione (III) priva di forze applicate. Si calcoli la lunghezza
d’onda di De Broglie dell’elettrone nella regione III.
E=0
I
e
E
II
E=0
III
d
h2
L’energia iniziale dell’elettrone è pari a ε i =
= 2.4 × 10 −19 J
2
2mλi
Il lavoro compiuto dal campo elettrico sarà pari a eEd
Quindi l’energia finale sarà ε f = ε i + eEd = 4 × 10 −19 J
Da cui λ f =
h
2mε f
= 0.77nm
Esercizio 3
Una buca di potenziale 1D a pareti infinite, di larghezza 100Å, alla temperatura di 0K, contiene 49
elettroni. Quale sarà la velocità VF dell’elettrone con l’energia più elevata?
I livelli energetici della buca di potenziale hanno energia : ε n =
2 2
π n2
2m L2
con n intero.
54
Poiché gli elettroni sono fermioni, in ogni singolo livello energetico si possono sistemare due
elettroni (uno con spin “down” ed uno con spin “up”). Per n=24 sono sistemati 48 elettroni, per cui
il 49° è sistemato nel livello n=25. La sua energia sarà quindi: ε 25 =
D’altro canto
2 2
1 2
π 252
mvF =
2
2m L2
vF = 25
π
mL
2 2
π 252
2m
L2
= 9 ⋅ 105 m / s
Esercizio 4
Un fascio di elettroni viene indirizzato verso un cristallo caratterizzato da una distanza
interplanare d=3Å. In queste condizioni si ottiene un picco intenso di diffrazione per un angolo di
incidenza Θ pari a 30°. Qual è l’energia del fascio di elettroni incidenti? Se si vuole ottenere un
picco di diffrazione per lo stesso valore dell’angolo di incidenza, utilizzando, però, un fascio di
radiazione elettromagnetica oppure un fascio di neutroni, quale dovrà essere l’energia,
rispettivamente, della radiazione elettromagnetica o dei neutroni?
Nelle condizioni di diffrazione λ = 2dsinϑ
l’energia dell’elettrone sarà ε e =
2 2
k
h2
h2
=
=
= 16.7eV
2me
2λ2 me 8d 2 sin 2ϑ ⋅ me
Nel caso in cui si utilizzino fotoni ε f = hν =
hc
λ
=
hc
= 4.1KeV
2dsinϑ
Esercizio 5
Un atomo di idrogeno viene ionizzato mediante radiazione elettromagnetica. Sapendo che
l'
elettrone estratto (inizialmente nello stato energetico fondamentale) possiede un'
energia cinetica
residua pari a 30 eV, si determini la lunghezza d'
onda della radiazione incidente.
L'
energia della radiazione elettromagnetica è pari alla somma dell'
energia di ionizzazione
dell'
atomo di idrogeno (13.6 eV) e dell'
energia cinetica residua (30eV). Pertanto dovrà essere:
hν = h
c
λ
= 43.6eV
λ ≅ 2.85*10−8 m
Esercizio 6
Un metallo viene illuminato tramite brevi impulsi di radiazione elettromagnetica di lunghezza
d’onda pari a 200 nm. Un rivelatore di elettroni posto a 1 m dal metallo rivela i primi elettroni 1 µs
dopo che la radiazione ha raggiunto il metallo. Si stimi l’energia di estrazione degli elettroni dal
metallo.
Per la conservazione dell’energia, l’energia del fotone incidente deve essere eguale all’energia di
estrazione dell’elettrone più l’ energia cinetica dell’elettrone stesso nel vuoto: hν = Φ +
1
mv 2
2
Gli elettroni più veloci percorrono 1 m in 10-6 s, pertanto la loro velocità sarà 106 m/s. Quindi:
55
Φ=h
c
1
− mv 2 = 3.37 eV.
λ 2
Esercizio 7
Gli elettroni emessi da un filamento di tungsteno riscaldato vengono accelerati per una distanza
l=0.1 m tramite un campo elettrico applicato E. Il fascio così generato viene fatto incidere con un
angolo θ=20° su di una superficie cristallina caratterizzata da una distanza interplanare d=4 Å.
Quale dovrà essere il modulo del campo elettrico E affinché si abbia diffrazione dal cristallo? Si
consideri solo la riflessione al primo ordine (n=1).
Per la legge di Bragg avremo
λ = 2d sin θ , (n=1). D’altro canto l’energia cinetica degli elettroni
h2
dovrà eguagliare il lavoro compiuto dal campo elettrico
= eEl . Quindi otteniamo:
2mλ2
h2
E=
≡ 196V / m .
8meld 2 sin 2 θ
Esercizio 8
In una buca di potenziale 1D a pareti infinite di larghezza 50 Å e temperatura idealmente uguale a
0 K, sono confinati 6 elettroni. Ad un certo istante sulla buca viene inviata radiazione
elettromagnetica policromatica (contenente tutte le lunghezze d’onda). Quale sarà la massima
lunghezza d’onda che il sistema sarà in grado di assorbire?
I livelli energetici all’interno della buca sono dati dalla formula
nπ
εn =
2m L
2
2
Essendo gli elettroni fermioni, il livello occupato più alto sarà n=3.
La massima lunghezza d’onda assorbita (minima energia) corrisponderà alla transizione di un
elettrone dal livello n=3 al livello n=4. Quindi:
7 2π 2 hc
8mL2 c
∆ε = ε 4 − ε 3 =
=
da cui segue λ =
= 11.8 µm
2 mL2
λ
7h
Esercizio 9
Tre elettroni, a temperatura idealmente pari allo zero assoluto, sono intrappolati in una buca di
potenziale (1D) a pareti infinite, di larghezza pari ad L=10Å. Investendo il sistema quantistico con
una radiazione policromatica avente energie E comprese nell'
intervallo 1eV<E<4eV, si osservano
alcune righe di assorbimento. Si determini il numero delle righe, indicando esplicitamente quali
sono le transizioni elettroniche coinvolte, e la massima frequenza assorbita.
Poiché gli elettroni sono fermioni, per T che tende allo zero assoluto sono disposti in modo da
occupare lo stato fondamentale e, parzialmente, il primo livello eccitato (n=2).
L'
autovalore dell'
energia εn vale:
2
π2
2
2mL
2
n ; con
π2
2
2
2mL
= 3.77 ⋅10 −1 eV = B = cost.
E'facile rendersi conto che con la radiazione policromatica a disposizione possono essere assorbite
le energie corrispondenti alle seguenti quattro transizioni:
n = 1 → n = 2;
∆ε = ε 2 − ε 1 = B(4 − 1) ≈ 1.13eV
56
n = 2 → n = 3;
n = 1 → n = 3;
∆ε = ε 3 − ε 2 = B(9 − 4) ≈ 1.89eV
∆ε = ε 3 − ε 1 = B(9 − 1) ≈ 3.02eV
Ne consegue che la massima frequenza assorbita sarà:
ε −ε
ν max = 3 1 = 7.3 ⋅1014 Hz
h
Esercizio 10
Un neutrone animato da velocità v=100 m/s, incide su una barriera di potenziale di altezza V0 non
nota Si calcoli l'
altezza della barriera, sapendo che la probabilità di trovare la particella
immediatamente dopo il bordo della barriera (x=a+) è 102 volte superiore della probabilità di
trovarla ad una distanza d=10-8 m (cioè in x=a+d).
L'
energia (solo cinetica) della particella è ε =
1 2
mv
2
La funzione d'
onda per x>a si scrive: Ce − qx in cui q =
2m(V0 − ε )
ψ (a )
P (x = a + )
C 2 e −2 qa
Il rapporto tra le due probabilità ci dice che
=
=
= e 2 qd = 10 2
2
2 −2 q ( a + d )
+
(
)
P x=a+d
C e
ψ (a + d )
+
1
V0 = ε +
2m
3
ln10
d
2
2
= 8.5 ⋅10 −24 J = 5.3 ⋅10 −5 eV
TERMODINAMICA STATISTICA
3.1 Stati di un sistema termodinamico
Nel corso di Fisica 1 è stata affrontata il problema della descrizione del comportamento di
sistemi complessi, quali ad esempio i gas, utilizzando un numero ridotto di grandezze fisiche
direttamente misurabili dette variabili termodinamiche di stato. Tale descrizione di sistemi
complessi (termodinamica classica) trascura completamente la struttura microscopica del sistema.
Un approccio diverso parte invece dalla descrizione microscopica del sistema ed utilizza i metodi
della statistica e del calcolo delle probabilità per arrivare a descriverne. Questo secondo approccio
costituisce la termodinamica statistica.
Il punto di partenza per la costruzione della termodinamica statistica è il concetto di stato
quantico. Considereremo in questa trattazione soltanto gli stati quantici stazionari, ovverosia quelli
che sono soluzione dell’equazione di Schrödinger indipendente dal tempo. I sistemi che
confideremo potranno essere costituiti da una o più particelle. Nel caso di sistemi a più particelle, in
generale, trascureremo l‘interazione tra le particelle stesse. Ogni stato quantico ha un’energia
definita, e tutti gli stati con uguale energia definiscono un livello energetico. La molteplicità o
degenerazione di un livello energetico rappresenta il numero di stati quantici diversi che hanno la
57
stessa energia: ad esempio, nel caso dell’atomo di idrogeno, il livello energetico fondamentale è due
volte degenere, il primo livello eccitato otto volte degenere e così via. E’ necessario non fare
confusione tra stato quantico e livello energetico: nella termodinamica statistica: ciò che è rilevante
è lo stato quantico.
A scopo di semplificazione per sviluppare i concetti fondamentali della termodinamica statistica,
considereremo come sistema termodinamico un sistema binario ideale. Un sistema binario è
costituito da particelle che possono accedere soltanto a due stati diversi ( zero o uno, bianco o nero,
pari o dispari, ..). Per fissare le idee considereremo come sistema fisico binario quello composto dai
momenti magnetici elementari (spin) degli elettroni. La componente del momento magnetico lungo
una generica direzione z (µz) negli elettroni è associato al numero quantico di spin ms dell’elettrone
(=±1/2) tramite la relazione µ z = −2m s µ B , dove µB rappresenta il magnetone di Bohr (pari a
9.27×10-24 J/T). Pertanto, scelta una qualsiasi direzione orientata z, la proiezione del vettore
momento magnetico dell’elettrone lungo tale direzione sarà pari a µ B . I due stati del sistema
binario saranno quindi quelli in cui la proiezione del momento magnetico è parallela o antiparallela
rispetto all’asse orientato z. Naturalmente, nel caso in cui non vi sia alcun campo magnetico esterno
applicato, i due stati saranno degeneri (eguale energia). Se invece vi è un campo applicato B diretto
lungo la direzione z, allora l’energia associata al momento magnetico sarà +µBB oppure - µBB nel
caso il cui i versi dei vettori campo magnetico e proiezione del momento magnetico siano,
M=3µB
µB
µB
µB
-µB
-µB
-3µB
-3µB
rispettivamente, discordi o concordi. In questo caso, quindi, la differenza in energia tra i due livelli
sarà ∆ε=2µBB. Nel caso di un sistema termodinamico costituito da un solo momento magnetico
elementare in assenza di campo magnetico avremo due stati quantici differenti degeneri. La
presenza di un campo magnetico elimina tale degenerazione. Consideriamo ora un sistema
termodinamico binario costituito da N particelle (spin). Per fissare le idee supponiamo N=3. Il
numero totale di stati diversi è pari ad otto. Gli otto stati accessibili al sistema sono indicati in
figura. In assenza di un campo magnetico applicato tutti gli stati sono degeneri e la loro energia può
essere assunta pari a zero del sistema dipende dalla particolare configurazione e varia come indicato
in figura. In presenza di un campo magnetico B applicato nella direzione z, gli stati acquistano
un’energia pari a ε= -MB.
Pertanto, anche in presenza di un campo applicato, la seconda, la terza e la quarta configurazione,
così come la quinta, la sesta e settima configurazione sono degeneri. Come si vede, nel caso
illustrato, il numero di configurazioni diverse è pari a otto. Più in generale si può dimostrare che,
nel caso di un sistema binario costituito da N elementi, il numero di stati accessibile è pari a 2N. Se
Figura 3.1-2 Configurazioni possibili di un sistema di tre momenti magnetici elementari
si considera una particolare proprietà, ad esempio il momento magnetico totale associato allo stato,
alcuni stati possono essere, come abbiamo
ε
=+
µ
B
2
B
visto,
equivalenti. Questo è, ad esempio il caso
z
degli stati due, tre e quattro, rispetto al
momento magnetico globale. Il numero di stati
equivalenti (o funzione di molteplicità) si può
ε1=-µBB
calcolare utilizzando la formula
N!
B=0
B//z
g=
N↑!N↓!
Figura 3.1-1 Stati energetici di un momento
magnetico elementare in un campo B applicato nella
direzione z
di
dove N↓ e N↑ rappresentano il numero
spin
orientati,
rispettivamente,
58
antiparallelamente o parallelamente al campo magnetico. Se definiamo un eccesso di spin, che
rappresenta lo sbilanciamento tra le popolazioni di spin su e spin giù, come 2s = N ↑ − N ↓ , allora,
poiché N = N ↑ + N ↓ , potremo riscrivere la funzione di molteplicità come
N!
g (N , s ) =
N
( 2 + s )!(N 2 − s )!
Man mano che le dimensioni del sistema crescono, il calcolo dei fattoriali nella formula che
esprime la funzione di molteplicità, diviene sempre più difficile. In pratica, quando si considerano
sistemi che comprendono un numero di particelle dell’ordine del numero di Avogadro
(N≈NA=6×1023mol-1), tale formula è, in pratica, inutilizzabile. E’ possibile però dimostrare che,
quando N è molto grande ed s molto minore di N ( s << 1, N >> 1 ) la funzione di partizione può
N
essere approssimata attraverso una distribuzione gaussiana:
g ( N , s ) ≅ g ( N ,0) exp(− 2s 2 N )
con g ( N ,0 ) = (2 πN ) 2 N
La distribuzione gaussiana g(N,s) è mostrata, a titolo di esempio, in figura.
L’integrazione rispetto a s della distribuzione di Gauss, tra - e + , come è facile verificare,
fornisce il valore esatto 2N per il numero totale di stati. La funzione di molteplicità ha il suo valore
massimo per s=0 e decresce rapidamente sia per s positivo che negativo. La g(N,s) si riduce a e-2
del valore massimo g(N,0) per s = N ( s N = 1 in
1
può essere utilizzata per
figura). La quantità 1
g(N,s)
N
una stima ragionevole dell’ampiezza relativa della
distribuzione. Tale ampiezza relativa diminuisce
0.5
rapidamente al crescere delle dimensioni del sistema
(N). Ad esempio per un sistema costituito da N≈100
particelle essa è 10-1, mentre per un sistema
macroscopico costituito da 1022 particelle, essa è
appena dell’ordine di 10-11.
0
-3
-2
-1
1
2
3
12
s
N
Assunto fondamentale della termodinamica statistica è
che il sistema ha la stessa probabilità di trovarsi in uno
Figura 3.1-3
qualsiasi degli stati accessibili al sistema stesso. Si
intendono per stati accessibili al sistema quelli
compatibili con la descrizione macroscopica delle caratteristiche fisiche del sistema stesso quali
l’energia, la magnetizzazione etc. Questa proprietà rispecchia la circostanza che non vi è alcun
motivo per preferire uno stato accessibile rispetto ad un altro a sua volta accessibile. Ad esempio,
nel caso del sistema di tre spin elementari considerato precedentemente, in assenza di campo
magnetico applicato, tutti gli otto stati possibili sono accessibili ed equiprobabili. Questa
circostanza implica che la configurazione in cui due spin siano rivolti verso l’alto, ed uno solo verso
il basso è tre volte più probabile della configurazione in cui tutti e tre gli spin sono paralleli. In
generale, la probabilità che si verifichi una particolare configurazione, caratterizzata ad esempio da
un particolare valore di s, sarà pari al rapporto tra il numero totale di stati accessibili e la funzione di
molteplicità della particolare configurazione:
2N
P (s ) =
.
g (N , s )
Nel caso del sistema di tre spin si ottengono le probabilità 1/8, 3/8, 3/8, 1/8 per le quattro
configurazioni che prevedono, rispettivamente, tre spin rivolti in alto, due in alto ed uno in basso,
59
due in basso ed uno in alto, tre in basso. Naturalmente sarà sempre vero che la somma delle
probabilità su tutte le configurazioni possibili, caratterizzate da un particolare s, è pari ad uno
P (s ) = 1
s
Indichiamo ora con X una qualsiasi grandezza fisica macroscopica associabile al sistema
termodinamico (energia, momento magnetico, etc.). Il suo valore dipenderà dalla particolare
configurazione del sistema. Pertanto, la grandezza fisica X potrà assumere molti valori diversi
quante sono le configurazioni possibili non equivalenti del sistema. In generale queste
configurazioni non sono equiprobabili: alcune configurazioni sono poco probabili, altre lo sono di
più: una singola misura su un particolare sistema troverà un particolare valore di X associabile ad
una delle configurazioni possibili. In termodinamica statistica si introduce il concetto di media
statistica <X> della grandezza fisica X. Tale valore rappresenta il valore medio che si otterrebbe a
seguito della misura di X su un numero molto grande di sistemi termodinamici identici. La media
statistica si calcola come
g (N , s))
X =
X (s ) P (s ) =
X
2N
s
s
Nell’approssimazione gaussiana la somma viene sostituita da un integrale in ds tra -∞ e +∞ e la
media statistica si calcola come
X = (2 πN )
12
+∞
(
)
X (s ) exp − 2 s 2 N ds
−∞
Ad esempio, nel caso, già più volte considerato, del sistema costituito da tre spin possiamo calcolare
il momento magnetico medio del sistema
1
3
3
1
M = 3µ B + µ B − µ B − 3µ B = 0
8
8
8
8
In generale per una distribuzione binomiale, la media statistica dello sbilanciamento tra le due
popolazioni <2s> (eccesso di spin), nell’approssimazione gaussiana, si ottiene come
2 s = (2 πN )
12
+∞
(
)
2 s exp − 2 s 2 N ds
−∞
In questo caso è immediato verificare che l’integrando è una funzione dispari (prodotto di una
funzione pari quale la funzione di Gauss, per la funzione dispari s) e che, pertanto, il suo integrale
tra -∞ e +∞ è pari a zero. Questo risultato equivale a dire che se si getta in aria un numero elevato di
volte una moneta, ci aspettiamo che lo sbilanciamento tra testa e croce sia molto piccolo.
Naturalmente questo non implica che se, ad esempio, lanciamo 10 volte una moneta avremo
sicuramente sempre cinque volte testa e cinque volte croce ( 2s = 0 ): il risultato effettivo del
lancio fluttuerà intorno a questo valore medio. Una misura conveniente dell’ampiezza delle
fluttuazioni intorno al valor medio è rappresentato dal valore quadratico medio dello sbilanciamento
(2s )2
(2s )2
. La media statistica di <2s2> può essere calcolata tramite
= (2 πN )
12
+∞
(2s )2 exp(− 2s 2
)
N ds
−∞
L’integrando è ora una funzione pari è sarà diverso da zero. Svolgendo esplicitamente il calcolo si
ottiene
(2s )2
= N e quindi
(2s )2
= N
La fluttuazione relativa di 2s, ossia il rapporto tra il valore quadratico medio di 2s e le dimensioni
del sistema termodinamico risulta quindi:
60
(2s )2
=
1
N
N
Quanto più è grande il sistema, tanto più piccola sarà la fluttuazione relativa. Questo spiega perché
per sistemi termodinamici macroscopici (N molto grande) il valore misurato di una qualsiasi
grandezza fisica macroscopica coincide in pratica con la media termodinamica. Invece per sistemi
molto piccoli il valore misurato si può discostare anche in maniera sensibile dalla sua media
termodinamica. Questa osservazione è molto importante in connessione con il funzionamento di
molti moderni dispositivi di dimensioni nanometriche, costituiti quindi da un numero molto piccolo
di componenti elementari (ad esempio elettroni, spin, etc.) In questo caso le fluttuazioni
termodinamiche possono condizionare in modo sensibile il comportamento del dispositivo
rendendolo inaffidabile.
3.2 Temperatura ed entropia
Supponiamo ora di avere un sistema termodinamico
costituito da quattro spin. Supponiamo che i
quattro spin siano diretti tutti parallelamente ad un campo magnetico applicato B.L‘energia del
sistema sarà pari a -4µBB. Se il sistema è isolato, ovvero non può scambiare energia con l’esterno,
la configurazione non potrà variare ed i quattro spin rimarranno paralleli. Consideriamo un secondo
sistema
costituito anch’esso da quattro spin, questa volta diretti in verso opposto a quello del
campo magnetico applicato. L’energia complessiva del sistema
sarà pari a +4µBB. Anche in
questo caso, se il sistema è isolato, l’energia non può variare ed i quattro spin sono vincolati a
rimanere antiparalleli rispeto al campo. Supponiamo di mettere in contatto energetico i due sistemi
(o, come si dice in contatto termico) tra di loro, lasciandoli però isolati rispetto all’ambiente esterno
come illustrato in figura.
L’energia totale del sistema, inizialmente pari a zero, non potrà
variare. Saranno invece possibili scambi di energia tra i due
sistemi. Questo implica che se uno spin del primo sistema si
capovolge, aumentando quindi l’energia di A1 deve, allo stesso
tempo, capovolgersi anche uno spin di A2 in modo tale che
l’energia del sistema A1 + A2 rimanga immutata. In altre parole è necessario che l’eccesso di spin 2s
del sistema complessivo non vari. Naturalmente potranno variare s1 ed s2 con la condizione però che
s1+s2=s rimanga immutato. In particolare, accanto alla configurazione illustrata in figura saranno
possibili molte altre configurazioni equivalenti. In particolare potremo avere le seguenti cinque
configurazioni:
In base al calcolo elementare delle probabilità, la funzione di molteplicità di ciascuna di queste
configurazioni complessive sarà data dal prodotto delle funzioni di molteplicità di A1 ed A2:
g ( N , s ) = g1 (N 1 , s1 ) × g 2 ( N 2 , s − s1 )
61
Se calcoliamo esplicitamente la funzione di molteplicità per le cinque configurazioni possibili
otteniamo 1, 16, 36, 16 e 1, rispettivamente. Inoltre noi sappiamo che la probabilità che si verifichi
un particolare stato è proporzionale alla funzione di molteplicità
P (s ) ∝ g ( N , s )
Questo implica che la configurazione in cui in A1 (s1=2), così come in A2, due spin siano rivolti
verso l’alto e due verso il basso è 36 volte più probabile di quella in cui tutti gli spin di A1 sono
rivolti verso l’alto e tutti quelli di A2 verso il basso. In altre parole, se noi prepariamo il sistema
nella configurazione con tutti gli spin di A1 rivolti in alto e tutti quelli di A2 rivolti in basso, e
lasciamo evolvere il sistema consentendo scambi di energia tra A1 ed A2, è molto probabile che, in
istante successivo troveremo il sistema in una configurazione in cui sia in A1 che in A2 metà degli
spin sono rivolti in alto e metà in basso. E’ facile poi osservare che la funzione g ( N , s1 ) ha un
massimo tanto più stretto quanto più è grande N (si verifichi questa circostanza considerando
nell’esempio precedente N=6).
Trattiamo ora il problema da un punto di vista più generale. Supponiamo di aver preparato due
sistemi A1 ed A2 caratterizzati dalle funzioni di molteplicità g ( N 1 , s1 ) e g ( N 2 , s − s1 )
con s1+s2=s. Supponiamo di mettere i due sistemi in contatto termico permettendo all’energia di
fluire da un sistema all’altro senza che varino s, N1 ed N2. s1 e, conseguentemente, s2 varieranno. La
funzione g ( N , s ) =
g ( N 1 , s1 ) × g ( N 2 , s − s1 ) , rappresenta la funzione di molteplicità del sistema
s1
composto, ovverosia il numero totale di stati diversi accessibili, caratterizzati dallo stesso valore di
s. Nella sommatoria, la quantità s1 varia tra -½N1e +½N1, se N1<N2. Il prodotto
g ( N 1 , s1 ) × g ( N 2 , s − s1 ) avrà un massimo in corrispondenza di un certo valore di s1 che indicheremo
con ŝ1 . Se il numero di particelle che costituiscono i due sistemi è molto grande, questo massimo
sarà molto stretto (vedi figura)
g ( N 1 , s1 ) × g ( N 2 , s − s1 )
s1
ŝ1
s
Le proprietà fisiche del sistema A1, così come quelle del sistema A2, dipendono dalla particolare
configurazione del sistema (si consideri,. ad esempio, il momento magnetico complessivo). D’altra
parte la configurazione caratterizzata da ŝ1 è molto più probabile di qualsiasi altra configurazione.
Non faremo quindi un grosso errore a supporre che le proprietà fisiche del sistema A1 siano
esattamente quelle che si ottengono per s1 = ŝ1 . In conclusione, se si mettono in contatto termico
due sistemi termodinamici essi evolveranno spontaneamente dalla configurazione iniziale a quella
più probabile (caratterizzata dal massimo della funzione di molteplicità g e detta configurazione di
di equilibrio termico s = sˆ ) che massimizza la funzione di molteplicità. Naturalmente è possibile
che i sistemi si trovino già nella configurazione che massimizza la funzione di molteplicità: in
questo caso non vi sarà evoluzione spontanea.
Nell’indicare la funzione di molteplicità di un sistema termodinamico utilizzeremo più in generale
l’espressione g(N,U), dove U indica l’energia interna del sistema che è funzione di s. Ad esempio
nel caso di un sistema di N spin in un campo magnetico l’energia U sarà pari a 2sµBB. Perché vi sia
62
un massimo nel prodotto g1 ( N 1 , s1 ) × g 2 ( N 2 , s − s1 ) è necessario che il suo differenziale, in
corrispondenza ad uno scambio infinitesimo di energia si annulli.
∂g1
∂g 2
g 2 dU 1 +
g1 dU 2 = 0
∂U 1 N
∂U 2 N
1
12
In termodinamica si indica nel pedice, accanto al simbolo di derivata parziale, la grandezza fisica
che rimane costante. Naturalmente, poiché gli scambi di energia avvengono esclusivamente tra i
sistemi A1 ed A2, sarà, necessariamente dU 1 = − dU 2 . Di conseguenza avremo:
∂g1
∂U 1
N1
∂g 2
1
=
g1
∂U 2
N12
1
g2
che potremo riscrivere nel modo seguente
∂ ln ( g1 )
∂U 1
=
N1
∂ ln ( g 2 )
∂U 2
N12
Definiamo ora l’entropia termodinamica come
σ = ln g
La condizione di equilibrio è caratterizzata da
∂σ 1
∂σ 2
=
∂U 1 N
∂U 2 N
1
12
Definiamo ora una temperatura fondamentale τ tramite la relazione
1
∂σ
≡
τ
∂U N
Questo implica che due sistemi termodinamici in contatto termico tra di loro, ma isolati
dall’esterno, evolvono spontaneamente fino a raggiungere la stessa temperatura. Le relazioni che
legano la temperatura fondamentale e l’entropia termodinamica alla temperatura assoluta ed
all’entropia classica studiate nel corso di Fisica 1 sono, rispettivamente, τ ≡ k B T e σ ≡ S k B . La
temperatura fondamentale ha le dimensioni di un’energia mentre l’entropia termodinamica è
adimensionale.
3.3 Legge dell’aumento dell’entropia
Si abbiano due sistemi termodinamici composti da N1 ed N2 particelle ed aventi energia iniziale U1i
ed U2i. Poniamo i due sistemi in contatto termico consentendo all’energia di fluire liberamente
dall’uno altro con il vincolo che non siano possibili scambi energetici con l’esterno (sotto forma di
calore o lavoro meccanico). In queste condizioni l’energia totale U=U1+U2 deve rimanere costante.
Il sistema complessivo inizialmente si troverà nella configurazione caratterizzata dalla funzione di
partizione g1i ( N 1 ,U 1i )g 2i ( N 2 , U − U 1i ) , e quindi da un’entropia iniziale σ i = ln( g1 g 2 ) . Lasciato
libero di evolversi esso raggiungerà la configurazione di equilibrio caratterizzata dalla circostanza
che g1 f (N 1 , U 1 f )g 2 f (N 2 , U − U 1 f ) ≥ g 1i ( N 1 , U 1i )g 2i ( N 2 , U − U 1i ) , e quindi σ f ≥ σ i . Naturalmente
la funzione di molteplicità finale sarà coincidente con quella iniziale soltanto nel caso che
accidentalmente il sistema complessivo si trovi già nella configurazione più probabile. Questo caso
è molto poco probabile specialmente se N1 ed N2 sono molto grandi, in pratica la molteplicità della
configurazione finale è sempre molto maggiore di quella iniziale. Queste considerazioni portano ad
enunciare la legge di aumento dell’entropia.
A titolodi esempio e per spiegare meglio i concetti esposti precedentemente consideriamo due
sistemi macroscopici costituiti rispettivamente da N1e N2 spin. Poiché N è molto grande e lo
63
sbilanciamento di spin 2s molto minore di N, potremo utilizzare l’approssimazione gaussiana per
2s 2
esprimere la funzione di molteplicità g ( N , s ) = g (0) exp −
. Per il sistema complessivo
N
2
avremo
quindi
2s
g ( N , s ) = g1 ( N 1 ,0 )g 2 ( N 2 ,0 ) exp − 1
N1
2
2s
exp − 2
N2
con la condizione che
s = s1 + s 2 e N = N 1 + N 2 . Considerando che s 2 = s − s1 , la funzione di molteplicità del sistema
complesso sarà data da g ( N , s ) = g 1 (N 1 ,0 )g 2 ( N 2 ,0 ) exp −
2 s1
2(s − s1 )
−
N1
N2
2
2
.
Consideriamo ora il logaritmo naturale della funzione di molteplicità, esso rappresenta l’entropia
2
2
2s
2(s − s1 )
del sistema σ ≡ ln ( g ( N , s )) = ln ( g1 ( N 1 ,0 )g 2 ( N 2 ,0 )) − 1 −
. La configurazione finale di
N1
N2
equilibrio si otterrà per quel valore di s1 che massimizza la funzione entropia. Pertanto, dovrà essere
∂σ
∂ 2σ
= 0,
< 0 (per garantire l’esistenza di un massimo). Nel nostro caso otteniamo
2
∂s1
∂s1
4s 4(s − s1 )
∂σ
=− 1 −
, dove
N1 , N 2 , s
sono costanti al variare di s1. Inoltre
∂s1
N1
N2
∂ 2σ
1
1
= −4
+
< 0 , il che assicura che si tratti effettivamente di un massimo. Il massimo
2
N1 N 2
∂s1
s1
s − s1
s
=
= 2 : i due sistemi sono in equilibrio rispetto a
N1
N2
N2
scambi di energia, quando i rispettivi eccessi percentuali di spin sono uguali. Nel caso particolare in
1
1
cui l’eccesso complessivo di spin sia nullo (s=0) avremo s1
+
= 0 il che implica s1 = 0 e
N1 N 2
dell’entropia si ottiene quindi quando
quindi anche s 2 = 0 . In questo caso il massimo della funzione di molteplicità sarà pari a
2
g Max = g1 ( N 1 ,0)g 2 ( N 2 ,0) =
2 N1 + N 2
π N1 N 2
L’entropia massima sarà
σ Max = ln 2 − ln π − 12 ln(N 1 N 2 ) + ( N 1 + N 2 ) ln 2
se N1 ed N2 sono molto grandi, l’ultimo termine nella somma è di gran lunga il più importante così
che si potrà scrivere
σ Max ≅ ( N 1 + N 2 ) ln 2
Supponiamo ora che i due sistemi termodinamici consistano entrambi in un numero di spin pari a
metà del numero di Avogadro. Nel primo sistema inizialmente tutti gli spin sono rivolti verso l’alto,
mentre nel secondo sono tutti rivolti verso il basso. I due sistemi vengono messi in contatto termico
e lasciati liberi di evolvere. La condizione finale di equilibrio, come si è visto, sarà quella in cui, in
ciascuno dei due sistemi, metà degli spin sono rivolti in alto e metà in basso. Vogliamo ora
calcolare la variazione di entropia tra lo stato iniziale e quello finale. L’entropia finale è stata
appena calcolata, sarà sufficiente sostituire N1+N2 con NA. Per calcolare l’entropia dovremo,
preliminarmente calcolare la funzione di molteplicità iniziale. In questo caso, poiché lo
sbilanciamento tra le due popolazioni è molto alto ( s ≈ N ), per il calcolo della funzione di
molteplicità dovremo utilizzare l’espressione binomiale, quindi:
(N A 2)! × (N A 2)! = 1
g i = g1i × g 2i =
(N A 2)!1! (N A 2)!1!
64
L’entropia iniziale sarà quindi σ i = ln g1 = 0 . La variazione di entropia
∆σ = σ Max − σ i = N A ln 2
Per ottenere la variazione dell’entropia clasica sarà sufficiente moltiplicare questo numero per la
costante di Boltzman:
∆S = k B N A ln 2 = R ln 2
dove R è la costante dei gas perfetti.
3.4 Il fattore di Boltzman
Consideriamo ora un sistema costituito da una particella che abbia a disposizione più stati quantici
caratterizzati da diversi valori dell’energia. Questo è, ad esempio, il caso di un elettrone in una buca
di potenziale. In figura 3.4-1 sono indicati tre stati possibili con energia crescente pari a ε1, ε2 ed ε3.
Se il sistema A costituito dall’elettrone nella buca di potenziale può scambiare energia con una
sorgente termica S esterna allora l’elettrone avrà la possibilità di trovarsi in uno qualsiasi dei livelli
indicati come pure in un livello ancora superiore. In questa sezione calcoleremo la probabilità che il
sistema si trovi proprio in uno stato di energia εs. Se U è l’energia totale del sistema costituito da
A+S e εs è l’energia del sistema S. Allora l’energia della sorgente sarà pari a U-εs. Calcoliamo ora
la funzione di molteplicità del sistema complesso A+S. La funzione di molteplicità del sistema
complesso sarà pari al prodotto tra la funzione di molteplicità di A e quella di S. Se il sistema S si
trova in uno stato completamente determinato, per esempio il primo livello eccitato nel caso
dell’elettrone nella buca di potenziale, allora la sua funzione di molteplicità sarà pari ad 1. Quindi
g S + A = g S × 1 . Consideriamo ora due stati accessibili al sistema complesso S+A, il primo in cui il
sistema A è caratterizzato da un’energia ε1 (e quindi la sorgente S da un’energia U-ε1) ed il secondo
in cui il sistema A è caratterizzato da un’energia ε2 (e quindi la sorgente S da un’energia U-ε2). Il
rapporto tra le probabilità che si verifichino queste due particolari configurazioni caratterizzate da
una diversa energia del sistema S, sarà pari al rapporto tra le funzioni di molteplicità
P(ε 1 ) g S (U − ε 1 ) × 1 g S (U − ε 1 )
=
=
Eq. 3.4-1
P(ε 2 ) g S (U − ε 2 ) × \ g S (U − ε 2 )
Il rapporto di probabilità tra i due stati del sistema dipende dalla configurazione del sella sorgente.
Tale rapporto di probabilità, utilizzando la definizione di entropia termodinamica,, si potrà
riscrivere come:
P(ε 1 ) exp(σ S (U − ε 1 ))
=
= exp(σ S (U − ε 1 ) − σ S (U − ε 2 )) ovvero:
P(ε 2 ) exp(σ S (U − ε 2 ))
P(ε 1 )
= exp(∆σ S )
P(ε 2 )
ε4
ε4
ε4
ε3
ε3
ε3
ε2
ε1
ε2
ε1
ε2
ε1
-a
0
+a
x
-a
0
+a
x
-a
0
+a
x
Figura 3.44-1 Particella in una buca di potenziale. Da sinistra a destra, rispettivamente, nello stato fondamentale,
nel primo e nel secondo stato eccitato.
65
Ovviamente, l’energia interna della sorgente S sarà sempre
molto maggiore di ε, energia del sistema S. In queste
condizioni l’entropia potrà essere sviluppata in serie di Taylor
nell’intorno di ε. Ricordando che lo sviluppo in serie di Taylor
di f(x) nell’intorno di x0 è
df
d2 f
1
f (x0 + a ) = f (x0 ) + a
+ a2
+ ....
dx x0 2!
dx 2 x
0
U-εs
εs
possiamo scrivere
A
S
σ (U 0 − ε ) = ο (U 0 ) − ε
Figura 3.4-2 Rappresentazione
schematica dei sistemi A ed S
dσ
dU
+
U0
1 2 d 2σ
ε
2!
dU 2
+ ....
U0
Poiché l’energia del sistema è enormemente più piccola di
quella della sorgente, nello sviluppo in serie di Taylor possiamo trascurare i termini del secondo
ordine o superiore in ε. Il rapporto di probabilità diventa
P(ε 1 ) exp(σ S (U − ε 1 ))
=
≅
P(ε 2 ) exp(σ S (U − ε 2 ))
exp σ (U 0 ) − ε 1
exp σ (U 0 ) − ε 2
dσ
dU
U0
dσ
dU
U0
semplificando e ricotdando la definizione di temperatura possiamo infine scrivere
ε1
P(ε 1 )
τ
=
ε
P(ε 2 )
exp − 2
τ
exp −
Eq. 3.4-2
Questa espressione rappresenta forse il risulatato più importante di tutta la termodinamica statistica.
Il termine exp − ε viene detto fattore di Boltzman. Esso è proporzionale alla probabilità che uno
( τ)
stato termodinamico di energia ε sia occupato quando la temperatura è pari a τ. La probabilità di
occupazione di un particolare stato termodinamico caratterizzato da un’energia εi è quindi
P(ε s ) = P(ε i )
exp −
εs
τ
Eq. 3.4-3
ε
exp − i
τ
sommando su tutti gli stati s accessibili al sistema otteniamo
P(ε s ) = 1 = P(ε i )
s
da cui segue
P(ε i ) =
exp −
εi
exp −
s
exp −
εs
εi
τ
τ
τ
Eq. 3.4-4
Z
avendo definito Z (funzione di partizione) come la somma su tutti gli stati accessibili del fattore di
Boltzmann
66
Z=
exp −
s
εi
τ
Eq. 3.4-5
E’ facile verificare che la somma della probabilità su tutti gli stati accessibilli al sistema è pari ad
uno
exp −
εi
τ
Z
=1
Z
Z
i
A questo punto sarà possibile calcolare il valore medio ad una temperatura τ di qualsiasi grandezza
fisica X che dipenda dalla configurazione del sistema utilizzando la seguente formula
P(ε i ) =
i
X i P(ε i ) =
X =
=
X i exp −
i
εi
τ
Eq. 3.4-6
Z
i
Nel caso in cui X rappresenti proprio l’energia media del sistema, tale formula si riscrive nel modo
seguente
ε i P(ε i ) =
U≡ U =
ε i exp −
i
εi
τ
Eq. 3.4-7
Z
Un modo diverso di esprimere l’energia media del sistema è il seguente
∂ ln Z
U =τ 2
∂τ
Infatti
i
U =τ 2
∂ ln Z τ ∂Z τ
=
=
∂τ
Z ∂τ
Z
2
2
∂
exp −
i
∂τ
εi
τ
=
τ
2
1
Z τ
2
ε i exp −
i
εi
=
τ
Eq. 3.4-8
ε i exp −
i
εi
τ
Z
Consideriamo ora il caso particolare rappresentato da un elettrone in un campo magnetico applicato
B (Fig. 3.4-3). Come abbiamo visto sono possibili soltanto due stati per questo sistema, uno con
spin parallelo al campo e verso concorde, l’altro con verso discorde. L’energia di questi due stati
sarà quindi ε1=+µBB e ε2=-µBB, rispettivamente (avendo assunto zero l’energia dell’elettrone in
mancanza di campo magnetico applicato). Naturalmente, se la temperatura è molto bassa,
(idealmente zero K) l’elettrone occuperà esclusivamente il livello più basso. Ad una temperatura
finita T la probabilità di occupazione dei due livelli sarà data dal rispettivo fattore di Boltzmann.
Vogliamo ora calcolare l’energia media di questo sistema a temperatura T
ε = ε 1 P(ε 1 ) + ε 2 P(ε 2 )
La funzione di partizione del sistema sarà pari a
ε1=+µBB
z
ε1=-µBB
B=0
B//z
67
Figura 3.4-3 Livelli energetici di un elettrone in un campo
magnetico applicato.
1
0.8
<µ>/µB
0.6
0.4
0.2
0
1
2
τ/ε
x
3
4
5
Fig. 3.4-4 Variazione con la temperatura del momento magnetico medio, in
unità di µB del sistema rappresentato in Fig. 3.4-3
−
µB
−
µB
Z =e τ +e τ
e quindi l’energia media
µB
U = − µB
e τ −e
µB
+
τ
−
µB
τ
µB
−
τ
= − µB ⋅ tgh
µB
τ
+e
e
E’ possibile calcolare il momento magnetico medio di questo sistema in funzione della temperatura
τ. Infatti noi sappiamo che l’energia di un momento M in un campo magnetico B è pari a
U = − M ⋅ B , ovvero, poiché µ rapprenda la media del momento lungo la direzione di B
U =− µ B
µB B
τ
µ = µ B ⋅ tgh
3.5 Energia libera di Helmotz
Si definisce l’energia libera di Helmotz nel modo seguente:
F = U − τσ
Eq. 3.5-1
per trasformazioni a volume e temperatura costante si dimostra che F ha un massimo quando il
0
U/µBB
-0.2
-0.4
-0.6
-0.8
-1
1
2
3
4
5
τ/ε
Figura 3.5-5 Variazione con la temperatura dell’energia
media, in unità di µBB, del sistema rappresentato in Fig.3.4-3
68
sistema termodinamico raggiunge l’equilibrio. Ovverosia, ogni trasformazione spontanea
irreversibile darà luogo ad un aumento dell’energia libera di Helmotz, mentre nel caso di una
trasformazione ideale reversibile, l’energia di Helmotz rimarrà costante. In formula:
dF ≤ 0
Eq. 3.5-2
Dove il segno < vale per trasformazioni spontanee, mentre il segno = vale per trasformazioni ideali
reversibili. Dimostriamo ora tale proprietà
Infatti, differenziando l’equazione 3.5-1 otteniamo
dF = dU − τdσ − σdτ
l’ultimo termine a temperatura costante è nullo, pertanto
dF = dU − τdσ
Eq. 3.5-3
δQ
Inoltre dalla disequazione di Clausius (vedi corso di Fisica 1), sappiamo che dσ ≥
τ
Dove il segno > vale nel caso di una trasformazione irreversibile mentre il segno uguale è valido per
una trasformazione ideale reversibile. Pertanto, sostituendo nella Eq. 3.5-3 otteniamo
dF ≤ dU − δQ = −δL
Se il sistema non compie e non subisce lavoro meccanico dall’esterno (ipotesi del volume costante
nel caso dei gas) allora δL=0. In questo caso dF ≤ 0 , il che corrisponde ad affermare che la
funzione di Helmotz ha un minimo rispetto a tutte le trasformazioni a volume e temperatura
costante. Il ruolo dell’energia libera di Helmotz nelle trasformazioni a temperatura e volume
costante è uguale a quello svolto dall’energia U nei processi puramente meccanici (supposti sempre
isoentropici, non essendo permessi cambiamenti della configurazione interna).
Per una trasformazione qualsiasi (non a temperatura e volume costanti) abbiamo:
dF = dU − τdσ − σdτ
e, per il primo principio della termodinamica
dF = −σdτ − pdV
Eq. 3.5-4
Supponiamo ora di esprimere l’energia libera di Helmotz in funzione delle variabili
termodinamiche V e τ. Abbiamo quindi:
∂F
∂F
dF (V ,τ ) =
dτ +
dV
Eq. 3.5-5
∂τ V
∂V τ
Confrontando le Eq. 3.5-4 e 3.5-5, seguono le due identità termodinamiche
∂F
∂F
= −σ ;
= −p
∂τ V
∂V τ
Sostituendo la prima delle due nella definizione dell’energia libera di Helmotz (Eq. 2.5-1)
otteniamo l’equazione differenziale
∂F
∂ (F τ )
F = U +τ
ovvero
−τ 2
=U
∂τ V
∂τ
e considerando la relazione 3.4-8 si ottiene
∂ (F τ )
∂ ln Z
=τ 2
∂τ
∂τ
da cui segue, infine
F = −τ ln Z
Eq. 3.5-6
Pertanto, conoscendo la funzione di partizione Z di un sistema termodinamico sarà possibile
calcolare sia l’energia media del sistema U che la sua energia libera di Helmotz. Ad esempio, caso
di un gas perfetto schematizzabile come N atomi in una scatola, si ottiene (per il calcolo esplicito
vedi “Termodinamica Statistica” di Kittel e Kroemer edito da Boringhieri)
−τ 2
69
1
Z=
N!
3
Mτ
2π 2
N
2
V
Eq. 3.5-7
dove M rappresenta la massa dell’atomo e V il volume della scatola.
Calcoliamo l’energia interna utilizzando l’espressione
∂ ln Z
U =τ 2
∂τ
Dall’equazione 3.5-7 si ottiene
1
M
ln Z = ln
+ 32 N ln (τ ) + 32 N ln
+ N ln (V )
N!
2π 2
dove solo il secondo termine a destra dell’equazione dipende dalla temperatura.
Sostituendo tale espressione nell’equazione 3.5-8 otteniamo
1
U = τ 2 32 N = 32 Nτ
τ
Eq. 3.5-8
Se il numero di atomi che costituiscono il sistema è pari al numero di Avogadro, otteniamo in
termini di temperatura classica
U = 32 N A k B T = 32 RT
R costante dei gas perfetti.
Il calore molare a volume costante, per un gas costituito da molecole monoatomiche, sarà
dU
CV =
= 32 R
dT V
3.6 Funzione di distribuzione di Planck
Consideriamo ora un oscillatore armonico quantistico. Il problema è stato discusso nella prima parte
del corso dove si era visto che gli autovalori dell’energia sono dati dall’espressione
ε S = ( 12 + s ) ω
dove ω rappresenta la pulsazione dell’oscillatore ω = K .
M
Naturalmente a temperatura idealmente zero, l’oscillatore occupa il livello di energia minima s=0.
Ci poniamo ora il problema di calcolare quale sia il livello medio occupato (media statistica di s)
per un valore generico τ della temperatura. Avremo, trascurando l’energia di punto zero 12 ω ,
∞
∞
. s =
s =0
sP (s ) =
s =0
s exp (− s ω τ )
Z
Eq. 3.6-1
Cominciamo a calcolare la funzione di partizione
Z=
∞
s =0
exp(− s ω τ )
se poniamo x = exp(− ω τ ) , sarà sempre x<1. Quindi la funzione di partizione si potrà riscrivere
∞
1
1
Z = xs =
=
Eq. 3.6-2
1 − x 1 − exp(− ω τ )
s =0
70
Inoltre, avendo posto y = ω τ potremo scrivere
∞
∞
d ∞
d
1
exp(− y )
s exp(− s ω τ ) = s exp(− sy ) = −
exp(− sy ) = −
=
dy s =0
dy 1 − exp(− y ) (1 − exp(− y ))2
s =0
s =0
Eq. 3.6-3
In definitiva, utilizzando le 3.6-2 e 3.6-3 otteniamo
exp(− y )
1
s =
=
1 − exp(− y ) exp( y ) − 1
ossia
1
s =
Eq. 3.6-4
exp( ω τ ) − 1
Questa funzione è detta distribuzione di Planck. Essa consente di calcolare ad una temperatura τ
qual’è il livello medio di occupazione dell’oscillatore armonico quantistico. L’energia media U
dell’oscillatore sarà data dall’espressione
ω
U= ω s =
Eq. 3.6-5
exp( ω τ ) − 1
Applicazione: si calcoli il calore specifico (a volume costante) di un solido costituito da N
oscillatori armonici elementari.
Vogliamo anche osservare come la funzione di Planck sia anche adatta a descrivere la distribuzione
all’equilibrio termico di fotoni in una cavità. In una cavità i fotoni possono essere assorbiti 0 emessi
dalle pareti tenute alla temperatura T (il numero di fotoni non si conserva). Il problema è calcolare,
per una certa temperatura T della cavità, quale sia il numero medio s di fotoni con energia ω . In
termini classici si potrà affermare che l’energia media del modo di frequenza ω è pari a s ω . Il
problema del calcolo del numero medio di fotoni all’interno della cavità a temperatura T con
energia ω si risolve osservando che lo spettro di energia per questo problema è identico a quello
dell’oscillatore armonico quantistico (senza energia di punto zero). Pertanto la funzione di Planck
sarà in grado di fornire la risposta anche nel caso dei fotoni.
3.7 Potenziale chimico e distribuzione di Gibbs
Precedentemente abbiamo considerato le proprietà di due sistemi termodinamici in contatto
energetico tra di loro giungendo alla definizione di temperatura: l’energia fluisce dal corpo a
temperatura più alta a quello più freddo finché la temperatura dei due sistemi non sia la stessa
(equilibrio termico). In questo capitolo considereremo il caso in cui i due sistemi siano anche in
grado di scambiare particelle (sistemi in contatto termico e diffusivo). Dal punto di vista del
contatto diffusivo i due sistemi saranno in equilibrio quando il flusso netto di particelle sarà nullo.
71
dN
N1
dN
U
N2
Sorgente termica a temperatura τ
Fig. 3.7-1 Rappresentazione schematica di due sistemi in contatto termico e diffusivo alla
stessa temperatura τ
Nel caso in considerazione il numero totale di particelle N è fisso, però possono individualmente
variare N1 ed N2 numero di particelle nel primo e nel secondo sistema, rispettivamente. Inoltre sarà
sempre verificata la condizione dN1 = -dN2. La temperatura dei due sistemi sarà la stessa ed il
volume costante. Se consideriamo il sistema globale 1+2 esso subirà trasformazioni a volume,
temperatura e numero di particelle costanti. In queste condizioni la funzione di Helmotz F è
appropriata per descrivere il sistema 1+2, con F = F1 + F2 = U 1 + U 2 − τ (σ 1 + σ 2 )
All’equilibrio avremo un minimo di F rispetto a variazioni dN1 = -dN2 = dN
∂F1
∂F2
dF =
dN 1 +
dN 2 = 0
∂N 1 τ ,V
∂N 2 τ ,V
ovvero
∂F1
∂F2
=
∂N 1 τ ,V
∂N 2
τ ,V
Si definisce il potenziale chimico come
∂F
µ (τ ,V , N ) =
∂N τ ,V
Eq. 3.7-1
All’equilibrio sarà
dF = µ1 dN 1 + µ 2 dN 2 = (µ1 − µ 2 )dN = 0
quindi, all’equilibrio
µ1 = µ 2
In condizioni di non equilibrio sarà
dF = (µ1 − µ 2 )dN < 0
Nel caso sia µ1>µ2, dN dovrà essere negativo: il sistema a potenziale chimico più alto perde
particelle a vantaggio di quello a potenziale chimico più basso finché non sarà raggiunto
l’equilibrio.
3.8 Potenziale chimico del gas perfetto
72
A rigore, nel caso di un gas perfetto la popolazione N di molecole può variare soltanto di numeri
interi. Pertanto è appropriato definire il potenziale chimico come segue
F ( N ) − F ( N − 1)
µ=
Eq. 3.8-1
1
usando la formula F = −τ ln Z con
ln Z = − ln( N !) + N ln
Mτ
2π 2
3
2
Mτ
V , avendo posto nQ =
2π 2
3
2
, dimensionalmente l’inverso di
un volume e quindi una concentrazione otteniamo:
µ = τ [ln( N !) − ln(( N − 1)!) − N ln(nQV ) + ( N − 1) ln(nQV )] = τ [ln( N ) − ln (nQV )] = τ ln
N
nQV
In definitiva considerando che N/V rappresenta la concentrazione di particelle n, possiamo scrivere
µ = τ ln(n nQ )
Eq. 3.8-2
oppure, considerando che in base alla legge dei gas perfetti è pV = Nτ
µ = τ ln( p τnQ )
Eq. 3.8-3
La quantità nQ prende il nome di concentrazione quantistica. Diamo ora un argomento qualitativo
per mostrare che:
a) un gas perfetto in condizioni di bassa concentrazione (n<<nQ) si comporta come un gas di
particelle classiche;
b) un gas perfetto in condizioni di alta concentrazione (n>>nQ) si comporta come un gas di
particelle quantistiche.
Infatti è ragionevole che i fenomeni di interferenza quantistica, legati alla natura ondulatoria delle
particelle, si manifestino prevalentemente in condizioni di alta concentrazione quando la probabilità
di sovrapposizione spaziale delle funzioni d’onda di particelle diverse è non trascurabile. Questa
condizione si verifica se un gran numero di particelle occupa contemporaneamente un volume pari a
λ3, dove λ rappresenta la lunghezza d’onda di De Broglie della particella. Tale lunghezza d’onda si
può stimare a partire dall’energia termica della particella
1
3
h2
3τM 2
ε= τ=
λ
=
2
2Mλ2
h2
E’ possibile quindi definire una concentrazione critica pari a
3
2
h2
n= 3 =
3τM
λ
Tale concentrazione coincide a meno di fattori numerici trascurabili con la concentrazione
quantistica. E’ chiaro quindi che se la concentrazione di particelle è molto minore di nQ gli effetti di
interferenza saranno trascurabili ed il gas potrà essere considerato un gas di particelle classiche.
D’altra parte, se la concentrazione è maggiore di nQ, gli effetti di interferenza quantistica non
potranno essere più trascurati.
1
In molti casi è possibile che sulle particelle agisca anche una forza esterna che ne modifica
l’energia potenziale. Questo, ad esempio, è il caso delle particelle dotate di massa soggette alla
forza peso. In questo caso se le particelle si trovano ad una quota che differisce di h, la loro energia
potenziale differirà di mgh. Una situazione analoga si verifica nel caso di particelle cariche in un
campo elettrico. In questo caso la differenza di energia potenziale è q∆V dove q rappresenta la
73
Riserva
Particelle: N0-N1
Energia: U0-ε1
Riserva
Sistema
Stato 1
N1 ε1
Particelle: N0-N2
Energia: U0-ε2
Sistema
Stato 2
N2 ε2
Fig. 3.9-1 Rappresentazione schematica di un sistema termodinamico in contatto termico e
diffusivo con una sorgente
carica della particella e ∆V la differenza di potenziale elettrico. Ogni volta che si consideri
l’equilibrio in sistemi soggetti anche a forze esterne bisognerà tener conto anche del potenziale
esterno. Le condizioni di equilibrio si avranno quando saranno eguali i potenziali chimici totali
definiti come
µ tot = µ int + µ ext
dove il potenziale chimico interno è quello considerato precedentemente mentre quello esterno è
dovuto alle forze esterne.
3.9 Somma di Gibbs
Si può dimostrare con un procedimento semplice ma alquanto noioso, che omettiamo, la seguente
identità termodinamica
∂σ
Eq. 3.9-1
µ = −τ
∂N U ,V
Il fattore di Boltzmann ricavato precedentemente permette di calcolare la probabilità che un sistema
termodinamico, in contatto termico ma non diffusivo (numero di particelle costante) con una
sorgente, occupi uno stato di energia εs. Consideriamo ora lo stesso problema nel caso in cui il
sistema possa scambiare sia energia che particelle con una sorgente: sistema in contatto termico e
diffusivo con la sorgente. Naturalmente si potranno supporre le dimensioni della sorgente molto
maggiori di quelle del sistema.
Se N0 ed U0 rappresentano rispettivamente il numero totale di particelle e l’energia totale nel
sistema e nella riserva, allora è ovvio che se il sistema ha energia pari ad εs ed è occupato da Ns
particelle, allora la riserva avrà energia U0-εs e particelle N0-Ns. Possiamo supporre che il sistema
sia in uno stato completamente determinato, ad esempio, nel caso di una buca di potenziale
supponiamo di sapere che una particella si trova in un livello di energia ε. Come al solito la
probabilità che si verifichi una particolare configurazione del sistema complesso sorgente più
sistema sarà proporzionale al prodotto delle funzioni di molteplicità
P(N , ε ) = g R (N 0 − N ,U 0 − ε ) × 1
essendo lo stato del sistema completamente determinato la sua funzione di molteplicità è pari a uno.
Il rapporto tra le probabilità di trovare il sistema termodinamico in uno stato caratterizzato da
un’energia ε1 e da N1 particelle oppure in uno stato caratterizzato da un’energia ε2 e da N2 particelle
sarà
P( N 1 , ε 1 ) g S ( N 0 − N 1 , U 0 − ε 1 )
=
P( N 2 , ε 2 ) g S ( N 0 − N 2 , U 0 − ε 2 )
Utilizzando la definizione di entropia
74
σ ( N , ε ) = ln( g S ( N 0 − N ,U 0 − ε ))
Eq. 3.9-2
si ottiene
P( N 1 , ε 1 ) exp[σ (N 0 − N 1 ,U 0 − ε 1 )]
=
P( N 2 , ε 2 ) exp[σ ( N 0 − N 2 ,U 0 − ε 2 )]
poiché la riserva è molto più grande del sistema, e quindi N0>>N ed U0>>ε , si può considerare lo
sviluppo in serie di Taylor della funzione entropia σ dell’Eq. 3.9-2 troncandola al primo ordine in N
ed ε.
∂σ
∂σ
σ (N 0 − N ,U 0 − ε ) = σ (N 0 ,U 0 ) − N
−ε
+ ...... in questo modo si ottiene
∂N 0 U
∂U 0 N
0
P( N 1 , ε 1 )
=
P( N 2 , ε 2 )
exp σ ( N 0 , U 0 ) − N 1
exp σ ( N 0 , U 0 ) − N 2
∂σ
∂N 0
− ε1
U0
∂σ
∂N 0
−ε2
U0
0
∂σ
∂U 0
∂σ
∂U 0
exp − N 1
N0
=
exp − N 2
N0
∂σ
∂N 0
∂σ
∂N 0
Utilizzando le identità termodinamiche
∂σ
∂σ
1
µ = −τ
e =
.otteniamo, infine
∂N U τ
∂U N
N µ − ε1
exp 1
P( N 1 , ε 1 )
τ
=
N µ −ε2
P( N 2 , ε 2 )
exp 2
− ε1
U0
−ε2
U0
∂σ
∂U 0
N0
∂σ
∂U 0
N0
Eq. 3.9-3
τ
Il termine exp
Nµ − ε
τ
rappresenta il fattore di Gibbs. Tale fattore è dunque proporzionale alla
probabilità che il sistema sia costituito da N particelle ed abbia un’energia ε.
Definiamo ora la somma di Gibbs come la somma dei fattori di Gibbs su tutti gli stati e su tutte le
particelle
∞
ζ =
exp
Nµ − ε s
τ
N =0 s
dove
=
exp
ASN
Nµ − ε s
τ
Eq. 3.9-4
indica la somma su tutti gli stati e numeri. La probabilità di trovare il sistema in uno stato
ASN
caratterizzato da N particelle e da un’energia totale ε sarà dunque
Nµ − ε
exp
τ
P(N , ε ) =
ζ
Eq. 3.9-5
Infatti
75
P( N , ε s )
=
P( N 1 , ε 1 )
Nµ − ε
exp
τ
N µ − ε1
exp 1
τ
exp
quindi
Nµ − ε s
τ
P( N , ε s ) = P( N1 , ε 1 ) ASN
N µ − ε1
ASN
exp 1
1 = P( N1 , ε 1 )
τ
ζ
N µ − ε1
exp 1
τ
P(N1 , ε 1 ) =
exp
N1 µ − ε 1
τ
ζ
In analogia con quel che avviene con il fattore di Boltzmann, il fattore di Gibbs può essere utilizzato
per calcolare il valore medio di una qualsiasi grandezza X che dipenda da N ed εs secondo la
formula
X ( N , ε s )P( N , ε s ) =
X =
ASN
X ( N , ε s ) exp( Nµ − ε s τ )
ASN
ζ
Eq. 3.9-6
Un problema di particolare interesse è quello di calcolare il numero di particelle medio in un
sistema in contatto termico e diffusivo con un sorgente
N exp(( Nµ − ε s ) τ )
ASN
N =
Eq. 3.9-7
ζ
Altre espressioni di N , in alcuni casi di maggiore utilità pratica, si possono dedurre a partire dalla
definizione di ζ.
∂ζ 1
=
N exp[( Nµ − ε ) τ ]
∂µ τ ASM
quindi
τ ∂ζ
∂ ln ζ
N =
=τ
ζ ∂µ
∂µ
Eq. 3.9-8
Applicazione: impurezza in un semiconduttore
Gli atomi di parecchi elementi chimici, se sono presenti in piccola percentuale nella struttura
cristallografica di un semiconduttore (impurezze), possono facilmente ionizzarsi cedendo un
elettrone alla banda di conduzione (ad esempio fosforo in un cristallo di silicio). Le impurezze
costituiscono dei sistemi termodinamici molto piccoli in equilibrio termico e diffusivo con il
serbatoio costituito dal resto del semiconduttore: essi scambiano con il semiconduttore sia energia
che elettroni.Chiamiamo Ei l’energia di ionizzazione dell’impurezza, ovvero l’energia necessaria
perché l’elettrone abbandoni l’impurezza. Supponiamo inoltre che l’impurezza possa legare un solo
elettrone. Gli stati possibili per il sistema impurezza saranno tre: impurezza ionizzata, impurezza
con un elettrone con spin “up” (ms= +1/2) , impurezza con un elettrone con spin “down” (ms= -1/2).
La situazione è schematizzata in Fig.3.9-2.
76
Impurezza occupata da
un elettrone con spin
up
U=-Ei
N=1
Impurezza ionizzata
U=0
N=0
Impurezza occupata da un
elettrone con spin down U=-Ei
N=1
Fig. 3.9-2 Rappresentazione schematica di una impurezza in un semiconduttore
Se µ è il potenziale chimico del semiconduttore, la somma di Gibbs potrà essere calcolata come
ζ = 1 + 2 exp[(µ + Ei ) / τ ]
La probabilità che l’impurezza sia ionizzata è pari a
1
1
P(U = 0, N = 0 ) = =
ζ 1 + 2 exp[(µ + Ei ) / τ ]
La probabilità che sia neutro sarà
2 exp[(µ + Ei ) / τ ]
P(U = − Ei , N = 1) = 1 − P(0,0) =
1 + 2 exp[(µ + Ei ) / τ ]
3.10 Distribuzioni di Fermi-Dirac e Bose-Eistein
Consideriamo come caso particolare un sistema costituito da un singolo orbitale che può essere
occupato al più da una particella fermionica. La situazione può essere schematizzata come in figura
3.10-1.
Il nostro sistema è costituito da un orbitale in contatto termico e diffusivo con un sistema molto più
grande. L’orbitale può essere vuoto o occupato da una singola particella (fermione). Nel primo caso
avremo N1=0 e ε1=0, nel secondo N1=1 e ε1=ε. Possiamo quindi scrivere:
µ −ε
ζ = 1 + exp
τ
da cui segue
exp
N =
µ −ε
µ −ε
exp
1
τ
τ
=
=
µ −ε
ε −µ
ζ
1 + exp
exp
+1
τ
τ
Il numero medio di occupazione definisce la funzione di Fermi-Dirac
Riserva
Particelle: N0
Energia: U0
Riserva
Sistema
Stato 1
N1=0
ε1=0
Particelle: N0-1
Energia: U0-ε
Sistema
Stato 2
N2=1
ε2=ε
Figura 3.10-1 Rappresentazione schematica di un sistema in contatto termico e diffusivo
con una sorgente. Le particelle sono fermioni.
77
fFD
1.2
1
0.8
0.6
0.4
τ1
0.2
0
-4
-2
τ3
0
ε-µ
2
4
Figura 3.10-2 Funzione di Fermi-Dirac per diversi valori crescenti della
temperatura τ
f FD (ε ,τ ) ≡ N =
exp
1
ε −µ
τ
Eq. 3.10-1
+1
Dall’analisi della funzione di Fermi-Dirac si vede che il numero di occupazione per dei fermioni è
sempre compreso tra zero ed uno. In particolare, quando l’energia ε è uguale al potenziale chimico
µ, la probabilità di occupazione è sempre pari ad un mezzo. Il potenziale chimico dipende dalla
temperatura e tende a diminuire a temperature molto alte. Il potenziale chimico a temperatura zero
prende il nome di energia di Fermi
µ (τ = 0) ≡ ε F
Eq. 3.10-2
Consideriamo ora il caso in cui ad occupare l’orbitale siano bosoni, cioè particelle che non
obbediscono al principio di esclusione di Pauli. Questo è il caso, ad esempio, di una buca di
potenziale a pareti infinite occupata da un numero complessivo di particelle bosoniche Ntot. Un
particolare livello energetico ε potrà contenere zero oppure un numero N di particelle con l’unica
condizione che N sia minore od uguale a Ntot. In generale la situazione potrà essere rappresentata
come in figura 3.10-3.
In questo caso la funzione di partizione di Gibbs si potrà scrivere
Nµ − ε i
N (µ − ε )
ζ = exp
= exp
= xN
τ
ASN
avendo definito
ε −µ
x = exp −
τ
N
τ
N
con x<1
In queste condizioni la serie geometrica ha come somma (in realtà la somma andrebbe estesa solo
fino ad N0, ma N0 è un numero molto grande)
Riserva
Particelle: N0
Energia: U0
Riserva
Sistema
Stato 1
N1=0
ε1=0
Particelle: N0-N
Energia: U0-Nεs
Sistema
Stato 2
N2=N
ε2=Nε
s
Figura 3.10-3 Rappresentazione schematica di un sistema in contatto termico e diffusivo
con una sorgente. Le particelle in questo caso sono bosoni e non obbediscono al principio
di esclusione di Pauli.
78
ζ =
1
=
1− x
1
1 − exp −
ε −µ
τ
Se definiamo la funzione di distribuzione di Bose-Einsten come il numero medio di occupazione di
un certo livello di energia ε quando la temperatura è pari a τ, otteniamo:
−
τ ∂ζ
f BE (ε ,τ ) ≡ N =
= τ 1− e
ζ ∂µ
ε −µ
τ
∂
∂µ
τ 1− e
1
1− e
−
ε −µ
τ
=
1− e
−
−
ε −µ
τ
ε −µ
τ
2
−
∂
e
∂µ
dove abbiamo utilizzato l’equazione 3.9-8. Otteniamo quindi
1
f BE (ε ,τ ) = ε − µ
e
ε −µ
τ
=τ
1
1− e
−
e
ε −µ
τ
−
ε −µ
τ
τ
Eq. 3.10-4
−1
τ
In pratica, l’unica differenza formale con la funzione di distribuzione di Fermi-Dirac è rappresentata
soltanto dal segno meno a denominatore. Questa piccola differenza ha conseguenze enormi sul
comportamento del sistema di bosoni rispetto ai fermioni. Nel caso di bosoni il numero di
occupazione può essere molto grande, il potenziale chimico deve essere negativo o nullo per evitare
numeri di occupazione negativi.
5
fBE
4
3
2
1
0
τ3
τ1
1
2
3
4
5
ε-µ
Figura 3.10-4 Funzione di Bose-Einstein per diversi valori crescenti della temperatura
Nel caso in cui l’energia dello stato sia molto maggiore del potenziale chimico, e quindi il numero
di occupazione molto minore di 1, le due distribuzioni tendono alla stessa espressione
−
ε −µ
τ
f FD ≅ f BE ≅ e
Tale espressione rappresenta il “limite classico” delle distribuzioni quantistiche di Fermi-Dirac e
Bose-Einstein. Si può facilmente osservare che, in base all’equazione 3.8-2, se la concentrazione di
particelle è molto minore della concentrazione quantistica, allora il potenziale chimico è negativo
ed, in modulo, molto maggiore di τ. In queste circostanze l’approssimazione classica delle
distribuzioni quantistiche è certamente giustificata.
3.11 Esercizi
Esercizio 1
Due recipienti adiabatici identici, collegati da un rubinetto, contengono una mole di gas perfetto.
Inizialmente il rubinetto è chiuso ed il gas è confinato nel primo recipiente mentre il secondo è
79
vuoto. Ad un certo istante il rubinetto viene aperto ed il gas si espande nel secondo recipiente. Si
calcoli la funzione di molteplicità g del gas sia nello stato iniziale che in quello finale. Si stimi
infine la variazione di entropia conseguente alla trasformazione.
Nella situazione iniziale, poiché tutte le molecole si trovano nel primo contenitore, abbiamo
N A!
gi =
=1
N A!0!
Nella situazione finale, al termine dell’espansione, le molecole di gas saranno distribuite con eguale
N A!
probabilità tra il primo ed il secondo contenitore. Quindi g f =
. Poiché NA è un
(N A / 2)!( N A / 2)!
1/ 2
2
numero molto grande, potremo utilizzare l’approssimazione gaussiana. Quindi g f ≅
2N .
πN A
2 1
Avremo quindi: ∆σ = σ f − σ i = ln g f − ln g i = ln − ln N A + N A ln 2 . I primi due termini sono
π 2
trascurabili rispetto al terzo, quindi ∆S = k B ∆σ = k B N A ln 2 = R ln 2 = 5.76 JK −1
Esercizio 2
Un sistema costituito da 1022 elettroni non interagenti si trova a temperatura 100 K in un campo
magnetico applicato pari ad 1T. Ad un certo stante il campo viene spento ed il sistema evolve verso
un nuovo stato d’equilibrio. Si calcoli la variazione di entropia ∆σ tra lo stato iniziale
(immediatamente dopo che è stato spento il campo) e lo stato finale di equilibrio.
Esercizio 3
Un sistema termodinamico è costituito da tre atomi identici aventi numero quantico azimutale l=1.
In conseguenza il numero quantico magnetico può assumere i valori ml= +1,0,-1. Questa
circostanza implica che il momento magnetico orbitale, rispetto ad una direzione z, può assumere
esclusivamente i valori +µ B, 0, -µB.
1. Si calcoli la funzione di molteplicità g del sistema al variare del suo momento magnetico
complessivo µ.
2. Si ipotizzi che un campo B sia applicato nella direzione z e che, successivamente, questo
campo venga spento lasciando i momenti magnetici liberi di riarrangiarsi fino a
raggiungere lo stato più probabile. Si calcoli la variazione di entropia ∆σ tra lo stato
iniziale e quello finale.
µ1
µ 1+ µ2
+2
+1
µ1+µ2+ µ3
+3
+2
+1
+1
+2
+1
0
0
+1
0
-1
µ1
µ1+µ2
+1
0
µ1+µ2+ µ3
+2
+1
0
0
+1
0
-1
-1
0
-1
-2
µ1
µ1+µ2
0
-1
µ1+µ2+ µ3
+1
0
-1
-1
0
-1
-2
-2
-1
-2
-3
Dalla tabella si vede che g(+3)=1, g(+2)=3, g(+1)=6, g(0)=7, g(-1)=6, g(-2)=3, g(-3)=1. Lo stato più
probabile è quello caratterizzato da un momento magnetico nullo.
80
La variazione di entropia sarà
∆σ=ln(gf)-ln(gi)=1.95
Esercizio 4
Studiando lo spettro di emissione di un gas riscaldato di atomi di idrogeno, si osserva che il
rapporto di intensità tra la linea spettrale a 653 nm (transizione da n=3 ad n=2) e la linea
spettrale a 486 nm (transizione da n=4 a n=2) è pari a 20. Si stimi la temperatura del gas.
Le linee spettrali di emissione sono dovute al decadimento degli elettroni, rispettivamente, dal terzo
e dal secondo stato eccitato al primo stato eccitato. Un rapporto di intensità tra le linee di emissione
pari a 20 implica che il secondo livello eccitato sia popolato il doppio rispetto al primo.
Utilizzando il fattore di Boltzmann
ε − ε1
P(ε 2 )
da cui
= 2 = exp 3
P(ε 3 )
K BT
T=
ε3 − ε2
K B ln(20 )
=
R
1 1
5
R
−
=
≅ 725K
K B ln(20) 4 9
36 K B ln(20)
Esercizio 5
Un elettrone si trova in una buca di potenziale 1D a pareti infinite di larghezza 5 nm. Sapendo che
il rapporto tra le probabilità che l’elettrone si trovi al primo stato eccitato o nello stato
fondamentale è 10-4, si calcoli la temperatura T
Esercizio 6
Un gas ideale di molecole di idrogeno (H2) alla temperatura di 300 K, è contenuto in un recipiente
cilindrico. Il recipiente è in rotazione intorno al proprio asse con velocità angolare ω=1000 rad/s.
Supposta n(0) la concentrazione delle molecole a distanza 0 dall’asse di rotazione, a quale distanza
r dall’asse di rotazione la concentrazione n(r) sarà uguale a 2n(0)?
Si ricordi che la forza centrifuga è pari a mω2r.
L'
energia potenziale del campo della forza centrifuga è −
Per cui il potenziale chimico totale è : µ = τ ln
Mω 2 r 2
2
n( r )
Mω 2r 2
−
= costante
na
2
La costante si può ricavare dal valore per r=0: τ ln
n( r )
n (0 )
Mω 2 r 2
−−
= τ ln
na
2
na
Da cui si ricava
n(r ) = n(0) exp
Mω 2 r 2
2τ
e quindi finalmente: r =
r2 =
2τ
Mω 2
2K BT
Mω 2
ln(2)
ln(2) ≈ 1.3 ⋅ 10 2 cm
81
N.B. la massa della molecola di H2 è circa uguale alla massa di 2 protoni.
Esercizio 7
Un tubo sottile chiuso su se stesso è sagomato a formare un quadrato di lato 2 m. Il tubo ha una
capacità di 1 litro e contiene 0.1 moli di gas perfetto. Il tubo viene posto in rotazione intorno ad un
asse perpendicolare al piano definito dal quadrato e passante per il centro geometrico del
quadrato stesso con velocità angolare pari a 100 rad/s. Si calcoli il rapporto tra la pressione
massima e quella minima all’interno del tubo.
Esercizio 8
In una buca di potenziale 1D a pareti infinite di larghezza 1000 Å e temperatura idealmente uguale
a 0 K, vengono confinati in successione 2000 elettroni. Quale sarà l’energia εF dell’ultimo
elettrone confinato all’interno della buca? Il sistema viene quindi riscaldato fino a 1000 K. In
queste condizioni, supponendo che il potenziale chimico coincida con εF, quale sarà la probabilità
che uno stato con energia ε=0.99εF risulti vuoto?
I livelli energetici all’interno della buca sono dati dalla formula
nπ
εn =
2m L
2
2
Essendo gli elettroni fermioni, il livello occupato più alto sarà n=1000. Quindi:
1000π
= ε F ≡ 5.5 × 10 −18 J
2m
L
La probabilità che lo stato sia vuoto è pari a
2
1 − f FD (ε ) = 1 −
2
1
= 0.02
exp[(ε − µ ) / τ ] + 1
Esercizio 9
Un gas ideale di molecole di idrogeno (H2) alla temperatura di 300 K, è contenuto in un recipiente
cilindrico. Il recipiente è in rotazione intorno al proprio asse con velocità angolare ω=1000 rad/s.
Supposta n(0) la concentrazione delle molecole a distanza 0 dall’asse di rotazione, a quale distanza
r dall’asse di rotazione la concentrazione n(r) sarà uguale a 2n(0)?
Si ricordi che la forza centrifuga è pari a mω2r.
L'
energia potenziale del campo della forza centrifuga è −
Per cui il potenziale chimico totale è : µ = τ ln
Mω 2 r 2
2
n( r )
Mω 2r 2
−
= costante
na
2
La costante si può ricavare dal valore per r=0: τ ln
n( r )
n (0 )
Mω 2 r 2
−−
= τ ln
na
2
na
Da cui si ricava
n(r ) = n(0) exp
Mω 2 r 2
2τ
r2 =
2τ
Mω 2
ln(2)
82
e quindi finalmente: r =
2K BT
Mω 2
ln(2) ≈ 1.3 ⋅ 10 2 cm
N.B. la massa della molecola di H2 è circa uguale alla massa di 2 protoni.
Esercizio 10
Quale dovrebbe essere la pressione di un gas di idrogeno molecolare (H2) a temperatura ambiente
affinché la sua concentrazione eguagli la concentrazione quantica nQ.
La concentrazione quantica è pari a: nQ =
Mτ
2π 2
3
2
ove M è la massa della molecola di idrogeno (≈
2 protoni). Ma la concentrazione n può essere ricavata anche dall’equazione di stato dei gas perfetti
PV = Nτ (dove N è il numero di molecole di gas): n =
Mτ
= nQ =
τ
2π 2
P
3
2
Mτ
P =τ
2π 2
3
2
N P
=
per cui uguagliando:
V
τ
≈ 1.15 ⋅ 10 5 atm
Esercizio 11
Un metallo monovalente è costituito da atomi disposti in una struttura cubica, separati tra di loro
da una distanza pari a 0.4 nm. Si stimi la concentrazione del gas di elettroni e la si confronti con la
concentrazione quantica nQ a temperatura ambiente.
La concentrazione di elettroni nel metallo è pari all’inverso del volume della cella unitaria
1
n = 3 ≅ 1.6 × 10 28 m −3
a
3
Mτ 2
La concentrazione quantistica nQ =
≅ 1.3 × 10 25 m −3
2
2π
Il gas di elettroni (gas di Fermi) si trova senz’altro in regime quantistico.
Esercizio 12
Un singolo elettrone è confinato in una buca di potenziale 1D a pareti infinite di larghezza 50Å ed
a temperatura ambiente. Quale sarà il rapporto tra le probabilità di occupazione del primo livello
eccitato e del livello fondamentale? E tra il secondo livello eccitato e lo stato fondamentale?Quale
sarà l’energia media del sistema
L’energia dei primi due livelli sarà:
2 2
π
4 2π 2
ε1 =
,
ε
=
2
2mL2
2mL2
di conseguenza avremo:
P(ε 2 )
ε − ε2
P(ε 3 )
ε −ε
= exp 1
= 0.17 e
= exp 1 3 = 0.01
P(ε1 )
τ
P(ε1 )
τ
Considerando solo i primi tre livelli (infatti si può verificare che
P(ε 4 )
≈ 10 − 4 ) otteniamo:
P(ε1 )
83
U =
ε S exp(−ε S / τ )
Z
= 2.2 ⋅ 10 − 2 eV
Esercizio 13
Come varia la concentrazione di molecole, e quindi la pressione, nell’atmosfera terrestre in
funzione della quota h? Si consideri l’atmosfera costituita da un gas ideale di molecole di azoto N2
di massa M, in contatto termico e diffusivo. Si supponga inoltre che la temperatura non dipenda
dalla quota h e sia pari a T.
Il potenziale chimico totale sarà µ = µ int + Mgh
All’equilibrio τ ln
n( h )
n(0)
+ Mgh = τ ln
nQ
nQ
n(h) = n(0) exp −
con τ = k BT
Mgh
τ
Esercizio 14
La presenza di una membrana semipermeabile consente ad alcune cellule vegetali di mantenere al
loro interno una concentrazione di ioni potassio (K+) maggiore di un fattore 104 rispetto alla
concentrazione nell’ambiente circostante. Supponendo che la cellula si trovi a temperatura
ambiente, si stimi la differenza di potenziale elettrico tra l’interno e l’esterno della cellula. Si
supponga che il potenziale chimico abbia l’espressione data nel caso del gas perfetto.
In condizioni di equilibrio, la differenza di potenziale chimico tra l’interno e l’esterno della cellula
sarà uguale alla differenza di potenziale elettrostatico:
µ = τ ln
n
nQ
da cui e∆V = ∆µ = τ ln
ni
= 0.23V
ne
Esercizio 15
Un semiconduttore è caratterizzato da una gap di energia proibita pari a 0.4 eV. Supponendo che il
potenziale chimico sia disposto a metà della gap di energia proibita, si calcoli il numero di
occupazione di un livello energetico posta 0.1 eV sopra la soglia della banda di conduzione Si
supponga la temperatura pari a 300 K
.
84
!
' (
"#
!
$ %%$
#
'
% $
' ( +
%
' &,
-
- /
0 #&
#
1&
#
$
#
3&
1&
# #
4-(
#
4-
#
%
)
#
$
%
-
%$
5 #
+
$$
$
-
87
).
&
$
%
)
$%
$
-
(
:
+4 "#
&
7
!#
:&
-
#3
8
!#9
$
%
$
-
&
$
%
-
& 7
!
$
## 7
2
% %
#3
2
2 #5
64
).
$
(
-
1&
#
)*
%
$
1&
#
2
&
$
%%
)
(;
:
-
+6
%
$%
5#8 ' &,
-
$
5/##
3
%% % $
8< (
$
0
.$
85