Capitolo
11
L’ecocardiografia
Una grave instabilità emodinamica che si verifichi nel perioperatorio del paziente cardiochirurgico può riconoscere meccanismi causali diversi (Tabella 11.1). Poiché lo scompenso emodinamico, soprattutto se insorto acutamente, ha una prognosi infausta se non
prontamente riconosciuto e trattato, è fondamentale l’impiego di un monitoraggio emodinamico adeguato che permetta di ottimizzare la gestione clinica di questi pazienti.
Come già detto nel Capitolo 10, i sistemi di monitoraggio emodinamico di cui può
avvalersi l’intensivista per la misura dei parametri emodinamici più importanti a fini
diagnostici e terapeutici sono attualmente numerosi e diversi tra loro, cosi che è possibile scegliere quello più appropriato nei vari scenari clinici e in base alle caratteristiche del
paziente. Il profilo emodinamico dello scompenso acuto è comune a condizioni patologiche diverse, ognuna delle quali riconosce un proprio meccanismo fisiopatologico il cui
riconoscimento è fondamentale sia in termini di diagnosi precisa sia di trattamento specifico. In questo contesto si inserisce l’ecocardiografia in area critica cardiochirurgica.
Negli ultimi anni, il ruolo dell’ecocardiografia, sia nel suo approccio transtoracico (ETT)
sia in quello transesofageo (ETE), è diventato fondamentale nella gestione emodinamica
del paziente critico. In questo capitolo si cercherà di spiegare perché questa metodica
riveste un ruolo così importante nell’iter diagnostico-terapeutico del paziente critico.
Scompenso cardiaco acuto
Nel Capitolo 10, si è già enfatizzato che, di fronte a un paziente critico, emodinamicamente instabile, diventa prioritario definire con precisione il profilo emodinamico che lo caratterizza al fine di approntare, il più rapidamente possibile, le adeguate misure terapeutiche.
La gestione emodinamica di tali pazienti richiede pertanto la scelta dell’opportuno sistema
© 2011 Elsevier S.R.L. Tutti i diritti riservati.
11 L’ecocardiografia
Rubia Baldassarri, Fabio Guarracino
214
Parte I La gestione della fase acuta
Tabella 11.1 Cause di instabilità emodinamica
Sindrome coronarica acuta
Insufficienza ventricolare destra primitiva o secondaria
Sepsi severa e shock settico
Patologia valvolare
Ipertensione
Endocardite
Miocardite acuta
Aritmie
Tamponamento cardiaco
Mismatch di volume/IRA
Embolia polmonare
Dissezione aortica
IRA: insufficienza renale acuta.
di monitoraggio il cui compito è quello di stabilire a che tipo di alterazione emodinamica
siamo di fronte: il paziente è in bassa portata? Le pressioni di riempimento sono aumentate? Come sono le resistenze vascolari sistemiche? La saturazione venosa mista (SvO2) è nel
range di normalità? Ciascuno dei sistemi di monitoraggio attualmente a disposizione degli
intensivisti è in grado di rispondere a tutte queste domande, ma nessuno riesce ad andare
oltre la supposizione per quanto riguarda la diagnosi, cioè la comprensione del preciso
meccanismo fisiopatologico responsabile del quadro clinico.
Nel paziente cardiochirurgico, la causa principale di scompenso emodinamico nel
perioperatorio è riconducibile a un evento avverso cardiaco. In questo contesto si inserisce l’ecocardiografia, perché con questa tecnica non solo è possibile ottenere gli stessi parametri emodinamici dei sistemi di monitoraggio normalmente utilizzati in area
critica, ma è anche possibile effettuare in modo semi- o del tutto non invasivo, uno
studio morfo-funzionale del cuore e delle strutture cardiache che permette l’identificazione dell’eventuale patologia cardiaca sottostante (Figura 11.1).
Approccio diagnostico dell’instabilità
emodinamica
Di fronte a un quadro di grave instabilità emodinamica, la corretta gestione clinica
prevede, oltre all’immediato sostegno delle funzioni vitali con terapia spesso solo sintomatica, la necessità di una diagnosi precisa in tempi brevi al fine di ottimizzare il
trattamento e seguirne l’efficacia nel tempo. Secondo l’opinione dell’Autore, l’approccio più adeguato a questo scopo è quello di sottoporre il paziente a un monitoraggio emodinamico clinico e laboratoristico, al fine di selezionare i pazienti in cui lo
scompenso emodinamico è causato da una patologia cardiaca da quelli in cui l’instabilità emodinamica riconosce meccanismi fisiopatologici di altra natura.
CAPITOLO 11 L’ecocardiografia
215
Figura 11.1
Schema di approccio al paziente emodinamicamente instabile.
Per questo motivo, tutti i pazienti cardiochirurgici o comunque ricoverati in UTI
(Unità di Terapia Intensiva) postcardiochirurgica, devono essere monitorizzati, quotidianamente e al bisogno, con:
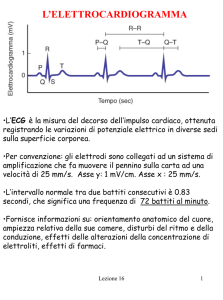
• elettrocardiogramma (ECG) a 12 derivazioni: è indispensabile per confermare o
escludere le eventuali alterazioni della traccia visibile sul monitor;
• prelievi emogasanalitici (EGA) ripetuti a orario;
• rx torace;
• esami ematochimici a orario, compresa la curva enzimatica e il dosaggio giornaliero
dei peptici natriuretici (BNP [Brain Natriuretic Peptide] e pro-BNP).
ECG La valutazione del ritmo cardiaco è di fondamentale importanza nel paziente
cardiochirurgico e in ogni paziente che sia ricoverato in area critica per problemi cardiaci o per grave instabilità emodinamica. Ritmo, frequenza cardiaca e tratto ST-T sono
espressioni grafiche dell’attività elettrica cardiaca e pertanto utili segnali di un’eventuale alterazione funzionale. Aritmie acute con scompenso emodinamico devono essere
prontamente riconosciute e trattate, così come le variazioni della frequenza cardiaca, al
fine di ridurre il consumo di ossigeno miocardico (tachicardia) e di ottimizzare la portata cardiaca (CO) nella bradicardia. Le alterazioni del tratto ST-T sono spesso indice di
sindrome coronarica acuta (SCA) e meritano un’attenzione particolare, soprattutto
nell’immediato postoperatorio dei pazienti sottoposti a rivascolarizzazione coronarica.
EGA Nei pazienti sottoposti a ventilazione meccanica, invasiva e non-invasiva, il
monitoraggio seriato degli scambi gassosi, acquisisce un significato fondamentale per
la gestione dei parametri di supporto ventilatorio e per le modalità di weaning respiratorio. Un’eventuale alterazione dei parametri emogasanalitici è indice di un mismatch
216
Parte I La gestione della fase acuta
ventilatorio che può riconoscere cause cardiache o polmonari e che, pertanto, richiede
un approfondimento diagnostico. La corretta interpretazione dell’EGA diventa ancora
più importante nei pazienti in respiro spontaneo, in cui può essere il primo segno di
un’alterazione cardiorespiratoria.
Rx torace Il ruolo di questo esame strumentale nella gestione intensivistica del
paziente cardiochirurgico è ormai consolidato. L’attento esame della radiografia del torace permette di individuare lesioni polmonari, quadri di congestione polmonare come
nello scompenso cardiaco, l’eventuale presenza di pneumotorace o di versamento pleurico e di suggerire il sospetto di patologie dell’aorta toracica (dissezione, aneurisma) o di
versamento pericardico, in caso di slargamento del mediastino. Dal profilo dell’ombra
cardiaca e dei vasi mediastinici sono inoltre ottenibili importanti informazioni. Le informazioni ottenute possono spiegare condizioni di dispnea e/o alterazione degli scambi
gassosi o giustificare l’inefficacia della ventilazione assistita.
Esami ematochimici La valutazione dell’emocromo, del profilo emocoagulativo
e degli esami ematochimici è una costante nel paziente cardiochirurgico. La diminuzione in acuto dei valori di emoglobinemia è spesso indice di sanguinamento in atto, così
come l’anemia cronica può suggerire uno stato di malnutrizione o di insufficienza renale
perioperatoria.
Un assetto emocoagulativo alterato è spesso presente nei pazienti sottoposti a
bypass cardiopolmonare, così come può essere espressione di un quadro di sepsi grave
o shock settico.
La valutazione dei parametri chimici di funzionalità renale (creatininemia, clearance della creatinina) è spesso un indice precoce di insufficienza renale acuta, così come
un’eventuale alterazione degli indici di colestasi e di necrosi tissutale può essere suggestiva di colecistite acuta o di ischemia e/o di infarto intestinale.
Enzimi cardiaci
Nel paziente postcardiochirurgico, così come nel paziente critico con interessamento
cardiaco, il monitoraggio della troponinemia assume un significato diagnostico e prognostico quando se ne valuti l’andamento nel tempo. Un elevato valore di troponina,
spesso associato a quello di altri marcatori cardiaci, è espressione di ischemia miocardica e, pertanto, il suo monitoraggio, integrato con informazioni cliniche, ecocardiografiche ed elettrocardiografiche, è fondamentale per la gestione clinica del paziente critico.
Peptidi natriuretici
Il dosaggio costante di questi peptidi sta conquistando un ruolo sempre più ampio nell’iter diagnostico-terapeutico del paziente critico in area cardiologica. Il dosaggio del
BNP, e del suo precursore pro-BNP, ha un valore predittivo negativo molto elevato
(> 95%) nella diagnosi di patologia cardiaca. Pertanto, di fronte a una condizione clinica
di scompenso acuto e grave instabilità emodinamica o, in pazienti fortemente dispnoici, un valore normale o non aumentato, rispetto a una determinazione precedente in
condizioni di stabilità, di BNP è un valido indice di esclusione di patologia cardiaca in
atto, per cui è necessario affrontare un percorso di diagnosi differenziale.
Anche il valore prognostico dei peptidi natriuretici è attualmente molto suggestivo e
interessante. È ormai chiaro che il BNP è in grado di predire la mortalità e di stratificare il
CAPITOLO 11 L’ecocardiografia
217
rischio di complicanze cardiache, come lo scompenso cardiaco acuto e le ischemie miocardiche ricorrenti. In modo particolare, il dosaggio di questi peptidi, definisce il profilo
di mortalità a breve e lungo termine, nei pazienti con sindrome coronarica acuta.
Alla luce di quanto riportato è indubbio il significativo ruolo svolto da questi markers biochimici nella gestione perioperatoria del paziente cardiochirurgico complicato, così come in quello con decorso regolare. Considerando anche la semplicità con cui
vengono effettuati sia il prelievo sia il dosaggio del BNP e del pro-BNP, l’esame è facilmente eseguibile ogni volta che venga ritenuta necessaria la sua valutazione. Nel
paziente cardiochirurgico il dosaggio quotidiano dei peptidi natriuretici ha sicuramente un valore aggiuntivo nella gestione del paziente critico.
Se nel paziente emodinamicamente instabile o comunque critico, i parametri ricavati dal monitoraggio emodinamico e i risultati degli esami strumentali e laboratoristici
sopracitati sono indicativi di patologia cardiaca, l’approccio diagnostico più adeguato,
secondo il parere dell’Autore, è quello di sottoporre il paziente a esame ecocardiografico per la valutazione della funzione cardiaca. Con l’ecocardiografia, sia con la modalità
transtoracica, quando eseguibile, sia con quella transesofagea è possibile confermare o
escludere l’eventuale sospetto diagnostico e ottenere una completa ed esaustiva valutazione della morfologia e della funzione cardiaca. Identificare la natura della patologia
cardiaca in atto permette inoltre di approntare il trattamento terapeutico necessario e
suggerisce il sistema di monitoraggio più consono alla condizione clinica (Figura 11.2).
È molto probabile, infatti, che in questo tipo di situazione il paziente necessiti di un
monitoraggio più avanzato rispetto a quello di base al fine di completare l’inquadramento diagnostico e di migliorare le prestazioni terapeutiche.
Ovviamente, nei pazienti in cui gli esami strumentali e biochimici di base non
orientino verso il sospetto clinico di una cardiopatia, è necessario proseguire le indagini diagnostiche per comprendere l’effettiva causa dell’instabilità emodinamica e del
deterioramento delle condizioni cliniche.
Ecocardiografia
L’ecocardiografia è una tecnica diagnostica per immagini che si avvale dell’uso degli
ultrasuoni (US) per indagare la morfologia e la funzione del cuore e delle strutture
cardiache. Si tratta di una metodica assolutamente non invasiva, nella sua modalità
Figura 11.2
L’ecocardiografia permette di identificare la patologia in atto e approntare il trattamento
terapeutico necessario.
218
Parte I La gestione della fase acuta
ETT, e semi-invasiva in quella ETE; può essere effettuata direttamente al letto del
paziente consentendo un’indagine diretta e immediata del cuore e delle strutture
cardiache. Se molto si conosce sulle capacità diagnostiche dell’ecocardiografia, forse
meno conosciuto è il suo ruolo come sistema di monitoraggio emodinamico. Grazie
all’applicazione di formule matematiche, tra le quali le più importanti sono l’equazione di continuità, l’equazione di flusso e l’equazione di Bernoulli, l’ecocardiografia
permette la valutazione quantitativa di variabili emodinamiche molto utili nella
gestione del paziente critico. Attraverso la misura di aree e volumi, integrata con i
dati clinici e con gli eventuali parametri misurati con altri sistemi di monitoraggio
(quali per esempio pressione arteriosa e pressione venosa centrale), è possibile calcolare in tempo reale pressioni, gradienti valvolari fino a parametri più impegnativi
quali le pressioni polmonari, lo stroke volume (SV) e la CO. Il vantaggio indiscusso
dell’ecocardiografia come strumento di monitoraggio emodinamico è senza dubbio
la scarsa o nulla invasività del sistema e la sua capacità di ottenere i parametri emodinamici più importanti per la gestione emodinamica del paziente critico in tempo
reale e in modo diretto, senza dovere ricorrere a manovre particolarmente indaginose o invasive. Questa tecnica di monitoraggio, però, soffre anche di alcune limitazioni
tecniche e interpretative che vanno sempre considerate perché il monitoraggio sia
attendibile e realmente utile a fini clinici. I calcoli emodinamici vengono effettuati
sulla base di proiezioni specifiche la cui acquisizione deve essere adeguata affinché
la misura sia valida. Per esempio, quando si voglia misurare l’SV e calcolare la CO, i
parametri necessari a questo fine sono il diametro del tratto di efflusso del ventricolo
sinistro (LVOT) e il VTI (integrale velocità/tempo) calcolato sul flusso transaortico
(Figura 11.3); ovviamente anche un minimo errore nell’acquisizione di tali misura
viene amplificato nello svolgimento dell’equazione matematica, con conseguente
variazione significativa del risultato finale. È pertanto necessario che l’ecografista
esperto usi sempre un’estrema cautela nell’acquisizione dei dati e nella loro interpretazione, cercando di rimanere fedele a ciò che riesce a “vedere” e a misurare in
modo sicuro. Un altro limite della tecnica è che la misura di alcuni parametri emodi-
Figura 11.3
Calcolo dello SV e della gittata cardiaca mediante ecocardiografia Doppler.
CAPITOLO 11 L’ecocardiografia
219
namici, quali per esempio la pressione sistolica polmonare (PAPs), richiede la presenza di rigurgiti valvolari (insufficienza tricuspidalica) che non tutti i pazienti, seppure critici, hanno. Tutte queste considerazioni si aggiungono anche al fatto che, per
ovvi motivi, l’ecocardiografia non può essere impiegata come un sistema di monitoraggio continuo del paziente critico, ma solo estemporaneo, anche se ripetibile al
bisogno o come controllo nel tempo.
Metodi di calcolo emodinamico
Nel paragrafo precedente è stato introdotto il concetto che l’ecocardiografia permette
la misura di alcune delle più importanti variabili emodinamiche attraverso calcoli
matematici. La quantificazione emodinamica con gli US è resa possibile da sofisticati
programmi, presenti nella macchina, che integrano le misure acquisite dall’operatore.
Tutto questo è possibile grazie all’applicazione delle equazioni sopra elencate, che
saranno citate brevemente, rimandando l’approfondimento a testi specifici sull’ecocardiografia.
Equazione di flusso
Secondo questa equazione il flusso ematico (F), che passa attraverso una determinata
sezione, è uguale al prodotto dell’area della sezione (AS) attraversata per la velocità
media (v) dei globuli rossi che transitano in tale sezione:
F = AS × v
In pratica, l’applicazione di questa equazione matematica in ecocardiografia permette la misura della CO. Infatti, se consideriamo il flusso attraverso la valvola aortica
(AV), la sua quantificazione altro non è che la gittata sistolica che, moltiplicata per la
frequenza cardiaca, dà la CO sistemica.
L’area della AV viene misurata attraverso il diametro dell’LVOT, considerando che
entrambe queste strutture, per la loro conformazione anatomica, possono essere paragonate a un cerchio. Tale misura viene effettuata nella proiezione medio-esofagea asse
lungo (AVLAX) a 120°, dove sia la AV sia l’LVOT sono ben rappresentati e facilmente
misurabili con l’eco bidimensionale (2D) da una mano esperta. La velocità media dei
globuli rossi è espressa dal VTI, cioè dall’integrale velocità-tempo che la maggior parte
delle macchine di ultima generazione calcola automaticamente, applicando la tecnica
Doppler sul flusso valvolare transaortico. La proiezione più idonea per questa misurazione è la transgastrica profonda (deep TG) a 0°, dove l’allineamento tra il fascio di US
e il flusso ematico è ottimale.
Equazione di continuità
È l’espressione della legge di conservazione del flusso, in quanto stabilisce che il flusso
che passa attraverso due diverse sezioni di uno stesso condotto nel quale scorre è identico a livello delle due sezioni anche se queste hanno un’area diversa. Considerando
l’equazione di flusso (F = AS × v), è chiaro che là dove l’area è minore, il flusso deve avere una maggiore velocità per mantenersi uguale. Questa formula, in ecocardiografia,
permette la stima dell’area valvolare ed è soprattutto utile in quei pazienti in cui è
220
Parte I La gestione della fase acuta
presente una stenosi valvolare e nei quali il gradiente transvalvolare non è misurabile
ai fini della quantificazione della stenosi stessa.
Equazione di Bernoulli
Senza entrare in dettagli matematici, considerando che questa equazione è molto
complessa, si sottolinea che il suo valore in ecocardiografia è relativo alla sua applicazione, che permette la stima del gradiente transvalvolare registrabile in presenza
di una stenosi valvolare. È una legge fisica che un flusso, per mantenersi costante,
debba aumentare la sua velocità quando passa attraverso un restringimento del
canale in cui transita e perché ciò avvenga occorre che si crei un gradiente di pressione tra i due versanti del restringimento. In pratica, con la tecnica Doppler si misura la velocità del flusso attraverso un ostio valvolare ristretto, si eleva al quadrato e si
moltiplica per 4 e, tramite questa equazione, si ricava la differenza di pressione tra i
due versanti della stenosi, cioè il gradiente transaortico e/o transmitralico. La formula di Bernoulli permette in pratica di misurare la differenza di pressione esistente
tra due camere cardiache (atrio e ventricolo, ventricolo sinistro e aorta, ventricolo
destro e arteria polmonare) che sono tra loro connesse da un ostio valvolare. Se è
possibile conoscere, attraverso i sistemi di monitoraggio emodinamico convenzionale, il valore assoluto della pressione in una delle due camere cardiache considerate, applicando l’equazione di Bernoulli l’ecocardiografia permette la stima della
pressione presente nell’altra camera.
Questa misura è possibile solamente in presenza di un rigurgito valvolare.
• Per esempio, la misura della pressione sistolica polmonare si effettua in presenza di
insufficienza tricuspidale campionando la velocità del jet di rigurgito con il Doppler
continuo e ricavando la differenza di pressione tra atrio e ventricolo destro applicando l’equazione di Bernoulli. Conoscendo la PVC, e quindi la pressione vigente in atrio
destro, la si può sommare al gradiente misurato e ottenere così la pressione sistolica
del ventricolo destro che, in condizioni in cui non siano presenti alterazioni a carico
della valvola polmonare, è sovrapponibile alla pressione sistolica polmonare.
• Stesso discorso vale per le sezioni sinistre. In presenza di insufficienza aortica è possibile misurare la pressione telediastolica del ventricolo sinistro (EDLVP) conoscendo la pressione diastolica aortica, che è sempre facilmente misurabile. Campionando
con il Doppler la velocità del jet da rigurgito aortico e applicando l’equazione di Bernoulli, si ottiene la differenza di pressione tra aorta e ventricolo sinistro da cui è
possibile risalire alla pressione telediastolica del ventricolo sinistro. Poiché, quando
è presente disfunzione cardiaca sinistra la EDLVP aumenta, è intuitivo che la velocità
del rigurgito aortico diminuisce e, pertanto, la misura del gradiente pressorio tra aorta e ventricolo sinistro risulta sottostimata così come la EDLVP.
• In presenza di rigurgito mitralico, l’equazione di Bernoulli permette di misurare la
pressione atriale sinistra (LAP). Misurando con il Doppler la velocità del rigurgito
mitralico, si campiona la differenza di pressione tra ventricolo e atrio sinistro. Assimilando la pressione sistolica del ventricolo sinistro alla pressione arteriosa media
(che è vero solo in assenza di patologia valvolare aortica), sottraendo a quest’ultima
il gradiente pressorio calcolato con Bernoulli, si ottiene la LAP.
È importante sottolineare che con il Doppler vengono misurate velocità e non pressioni in senso assoluto, che sono successivamente ottenute applicando l’equazione di
Bernoulli.
CAPITOLO 11 L’ecocardiografia
221
Alla fine di questo paragrafo sulle modalità di calcolo emodinamico e sull’applicazione delle equazioni matematiche necessarie, è importante fare alcune considerazioni. La prima e ovvia deduzione è che per potere quantificare le variabili
emodinamiche con l’ecografia è necessario che le misure su cui devono essere effettuati i calcoli matematici siano sempre attendibili. Per questo motivo, la ricerca dei
jet da rigurgito, la visualizzazione delle sezioni valvolari, i rapporti anatomici tra le
camere cardiache devono essere sempre acquisiti nelle proiezioni più idonee e
visualizzati in modo ottimale.
Ecocardiografia nel tamponamento
cardiaco
Il tamponamento cardiaco rappresenta una delle possibili complicanze del paziente
cardiochirurgico. Si verifica soprattutto nel postoperatorio come conseguenza diretta
della manovre chirurgiche e non è infrequente in corso di accertamenti diagnostici
preoperatori come la coronarografia o in quei pazienti sottoposti a procedure invasive
che comportano l’introduzione di guide e cateteri nelle camere cardiache e nei grossi
vasi (procedure interventistiche percutanee, impianto o estrazione di pacemaker). Il
tamponamento cardiaco si verifica quando la presenza di liquido all’interno del pericardio raggiunge una quantità tale da comprimere le camere cardiache così da ostacolarne il normale riempimento e svuotamento nelle diverse fasi del ciclo cardiaco. In
condizioni normali il pericardio può essere considerato come uno spazio virtuale in
quanto contiene solo una piccolissima quota di liquido, tale da garantire lo scorrimento reciproco dei due foglietti di cui è costituito, quello viscerale e quello parietale. Se la
quantità di liquido pericardico aumenta, i due foglietti tendono a separarsi e lo spazio
pericardico aumenta visibilmente fino a un limite massimo che è dato dalla sua espansibilità. Da un punto di vista emodinamico non è tanto importante la quantità del versamento pericardico, quanto la velocità, e cioè il tempo, in cui questo si forma. Quando
l’iniziale compenso dovuto alla separazione dei foglietti pericardici ha raggiunto il
valore massimo, ogni ulteriore aumento del versamento determina un aumento della
pressione all’interno del pericardio comprimendo le camere cardiache e riducendone
il volume. Quando il versamento si accumula in poco tempo all’interno del pericardio,
la fase compensatoria iniziale viene rapidamente superata con conseguenti e spesso
gravi ripercussioni emodinamiche. In queste situazioni, come per esempio nell’immediato postoperatorio come conseguenza di un sanguinamento attivo nel mediastino, il
tamponamento cardiaco si manifesta generalmente come un evento acuto che comporta una grave instabilità emodinamica e che necessita di un rapido trattamento
evacuativo al fine di recuperare un’adeguata performance cardiaca. Non bisogna
comunque dimenticare che la presenza di materiale organizzato all’interno di un versamento pericardico anche di modesta entità, come per esempio trombi o coaguli, può
comunque determinare ripercussioni emodinamiche se localizzata in sedi importanti
per la dinamica circolatoria come lo sbocco delle vene cave o delle vene polmonari, la
cui compressione altera significativamente la normale dinamica cardiaca. Si tratta dei
così detti versamenti loculati. Nel sospetto clinico di versamento cardiaco e ancor più
in quello di tamponamento cardiaco, l’ecocardiografia gioca un ruolo determinante a
fini diagnostici. Con l’eco infatti è possibile evidenziare direttamente la presenza di
materiale in pericardio e identificarne la natura liquida o corpuscolata. Sia la modalità
222
Parte I La gestione della fase acuta
Figura 11.4
Visualizzazione di effusione pericardica in approccio sottoxifoideo.
transtoracica sia quella transesofagea sono in grado di rivelare un tamponamento
cardiaco massivo, ma l’ETE è sicuramente ottimale nella diagnosi fine di versamenti di
minore entità o localizzati in sedi non reperibili con l’ETE. In un paziente emodinamicamente instabile e con i segni clinici dello shock a volte è sufficiente appoggiare la
sonda ecocardiografica sul torace in corrispondenza della finestra sottoxifoidea per
evidenziare il tamponamento cardiaco (Figura 11.4). Non bisogna comunque dimenticare che i pazienti cardiochirurgici presentano drenaggi toracici e medicazioni sulla
parete anteriore del torace che possono rendere difficoltoso l’ETT. I segni ecocardiografici del tamponamento cardiaco sono rappresentati dal collasso sistolico dell’atrio
destro e da quello diastolico del ventricolo destro, dallo spostamento verso sinistra del
setto interventricolare e dalla riduzione del volume delle camere sinistre, oltre che
naturalmente dalla presenza di versamento pericardico. Tali reperti sono compatibili
con la compressione che il versamento pericardico esercita sulle camere cardiache
quando la pressione intrapericardica supera quella vigente all’interno del cuore. Poiché nelle sezioni destre e sinistre, così come negli atri e nei ventricoli, le pressioni
intracavitarie sono diverse in rapporto alla loro funzione e alla loro anatomia, in caso
di versamento pericardico l’atrio destro sarà il primo a collassare e lo farà in sistole,
seguito dal ventricolo destro (VD) che collasserà in diastole. Per ultimo sarà interessato
il ventricolo sinistro (VS) che ha pareti più spesse e un regime pressorio più elevato.
L’esame ecocardiografico bidimensionale (2D) è in grado di rilevare le alterazioni morfologiche delle camere cardiache provocate dal tamponamento. Il collasso sistolico
dell’atrio sinistro è un reperto eco altamente specifico di tamponamento e si evidenzia
molto bene con l’eco 2D. Il collasso diastolico del VD è ben visibile con la metodica 2D,
ma è ancor meglio visualizzato con l’M-Mode in cui si può definirlo temporalmente. Se
si applica la tecnica Doppler si possono ricavare informazioni aggiuntive sul flusso
transmitralico e su quello attraverso la valvola tricuspide in rapporto alla ventilazione.
Durante la fase inspiratoria, il flusso attraverso la tricuspide aumenta in quanto
CAPITOLO 11 L’ecocardiografia
223
diminuiscono sia la pressione intratoracica sia quella intrapericardica. Per lo stesso
motivo emodinamico, il flusso transmitralico si riduce.
In ultima analisi l’ecocardiografia è sicuramente uno strumento diagnostico importante nel tamponamento cardiaco, anche se non bisogna trascurare il fatto che è sempre la clinica a guidare l’interpretazione dei dati ecocardiografici. Il riconoscimento di
un’effusione pericardica massiva o di materiale parcellare che comprime una sezione
localizzata del cuore è sicuramente indicativo per la diagnosi e guida la strategia terapeutica che potrà essere evacuativa (pericardiocentesi) o chirurgica.
Ecocardiografia nel paziente ipovolemico
La fisiologia cardiaca e la fisiopatologia dello scompenso cardiaco insegnano che
l’adeguatezza del precarico e la regolare alternanza tra le due fasi del ciclo cardiaco,
sistole e diastole, sono fondamentali per il mantenimento di una CO adeguata. In
modo particolare, la normalità della fase diastolica riveste un significato determinante in quanto condiziona il regolare riempimento cardiaco.
Nello scompenso cardiaco acuto l’ottimizzazione della volemia è una della strategie
fondamentali per la corretta gestione emodinamica. Capire se un paziente è sufficientemente “pieno” oppure “vuoto” e passibile di ulteriore riempimento è basilare in
pazienti critici come il cardiopatico e in particolare il cardochirurgico, il cui assetto
emodinamico è spesso compromesso dalla patologia di base così come dall’insorgenza
di complicanze che determinano uno scompenso cardiaco acuto. Di fronte a un paziente con grave instabilità emodinamica associata a ipotensione marcata e segni di ipoperfusione periferica il primo presidio terapeutico è quasi sempre rappresentato dall’espansione volemica con la somministrazione di fluidi in quantità tale da ripristinare
delle pressioni di perfusione adeguate. Nel paziente critico la valutazione della volemia
e soprattutto della capacità che ha il paziente di rispondere al carico volemico sono
estremamente importanti. In questo contesto l’ecocardiografia gioca un ruolo fondamentale nella comprensione delle condizioni di carico sia statiche sia dinamiche.
L’ecocardiografia permette di valutare l’assetto volemico del paziente attraverso
l’acquisizione di indici statici che esprimono lo stato volemico a fine diastole, quali
l’area e il volume dell’LV, e di indici dinamici che esplorano le variazioni della volemia
in risposta al carico. Poiché il precarico può essere definito come la lunghezza delle
fibre miocardiche a fine diastole, la misura dell’area e del volume telediastolico del
ventricolo sinistro sono in teoria sufficienti a valutare la volemia. Agli effetti pratici,
però, questi parametri non sono in grado di predire la risposta al carico volemico, in
quanto non esiste un valore soglia che funzioni da riferimento per indicare il grado di
adeguatezza della volemia. Ciò è dovuto al fatto che le dimensioni telediastoliche sono
influenzate moltissimo dalla compliance ventricolare che è estremamente variabile
nel paziente critico. Per questo motivo, negli ultimi anni sono stati pertanto individuati alcuni parametri che esplorano in modo dinamico il profilo emodinamico del
paziente critico. Questi ultimi si basano sul principio dell’interazione cardiopolmonare
per cui, durante ventilazione meccanica a pressione positiva, l’SV varia in rapporto alle
fasi ventilatorie per la variazione della pressione intratoracica. Questo è tanto più vero
nel paziente ipovolemico. Tali variazioni sono espressione dell’adeguatezza o meno
della volemia e predicono con buona attendibilità la risposta del paziente al riempimento, cioè l’incremento dell’indice cardiaco (CI, cardiac index) di almeno il 15% a un
carico di liquidi, la così detta fluid responsiveness.
224
Parte I La gestione della fase acuta
∆V peak%: tra gli indici dinamici di fluid responsiveness il ∆V peak% esprime la variazione della velocità del flusso aortico il cui cut-off è un valore superiore al 12%, secondo
la formula:
(Vmax − Vmin)
∆V peak% = ______________
(Vmax + Vmin)/2
Tale misura viene effettuata sul flusso valvolare aortico campionato in apicale
5 camere con l’ETT e in transgastrica profonda a 0° con l’ETE. Si applica il Doppler
pulsato e si misura la velocità massima e minima del flusso.
Tra gli indici dinamici più attendibili si riconoscono la distensibilità della vena cava
inferiore (VCI) e la collassabilità della vena cava superiore (VCS). Queste valutazioni si
basano sul meccanismo per il quale alcune strutture vascolari, come appunto le vene
cave, variano il loro diametro nelle fasi della ventilazione a pressione positiva.
Indice di distensibilità della VCI
Il diametro della VCI varia durante le fasi della ventilazione meccanica nel senso che
aumenta nell’insufflazione per l’incremento del ritorno venoso e diminuisce nell’espirio. La differenza in percentuale di tale variazione è indice di fluid responsiveness, in
quanto maggiore sarà questo valore migliore sarà la risposta del paziente al riempimento; un aumento superiore al 18% di tale indice predice un incremento dell’indice
cardiaco > 15%.
Diametro VCI esp
Diametro VCI insp
Diametro VCI insp − _______________
× 100
La VCI si visualizza bene sia con l’ETT (proiezione sottoxifoidea) sia con l’ETE
(proiezione bicavale) associando al 2D la modalità M-Mode.
Indice di collassabilità della VCS
Poiché questo vaso ha un decorso interamente intratoracico, è estremamente sensibile alla volemia e risente della ventilazione meccanica in senso opposto alla VCI.
Infatti il suo diametro aumenta durante la fase espiratoria e si riduce fino quasi al
collasso nell’insufflazione. La differenza in percentuale dei due diametri è l’indice di
collassabilità e predice con una specificità del 100% e una sensibilità del 90% la risposta all’espansione volemica nel senso che un indice > 36% prevede un aumento del
CI dell’11%.
Diametro VCS insp
Diametro VCS esp
Diametro VCS esp − _______________
× 100
Il limite di questa metodica è che la VCS, per la sua posizione anatomica, si visualizza solamente con l’ETE in proiezione bicavale o in esofagea alta. C’è un’unica condizione in cui, nonostante il diametro della VCS indichi uno stato di “pieno”, il paziente
necessiti un ulteriore riempimento ed è, per ovvi motivi fisiopatologici, il tamponamento cardiaco.
Gli indici dinamici di fluid responsiveness presentano alcuni limiti tra i quali il fatto
che, poiché si basano sull’interazione cardiopolmonare, le misure devono essere effettuate durante ventilazione meccanica e pertanto non sono validate per il paziente in
respiro spontaneo.
CAPITOLO 11 L’ecocardiografia
225
Ovviamente tutto questo ragionamento fisiopatologico non comprende il paziente
in cui l’ipovolemia è assoluta come nel sanguinamento acuto perioperatorio, nel quale
gli unici presidi terapeutici sono la trasfusione e l’individuazione della fonte di sanguinamento con tentativo di risoluzione chirurgica o medica a seconda del caso.
Valutazione delle pressioni di riempimento
Lo studio della diastole nel paziente critico attraverso l’acquisizione dei pattern di flusso transmitralico e venoso polmonare offre anche la possibilità di indagare le condizioni di carico e delle pressioni di riempimento che, in un paziente critico, spesso emodinamicamente instabile, hanno un valore diagnostico importante. In un paziente nel
quale l’analisi del flusso transmitralico presenta un’alterazione del rapporto E/A e del
DT (Deceleration Time) (E/A > 2 e DT < 160 msec), la pressione di incuneamento capillare è > 18 mmHg e supera i 20 mmHg se il DT < 120 msec.
Sulla base del pattern del flusso venoso polmonare se il rapporto tra il VTI dell’onda S e
la somma del VTI dell’onda S e dell’onda D risulta < 0,4 la EDLVP è superiore ai 20 mmHg.
La pressione capillare polmonare è > 15 mmHg se E/Vp > 1,4 e se E/E’ > 11.
Ecocardiografia nella disfunzione
ventricolare sinistra
La disfunzione acuta del ventricolo sinistro (VS) è una delle cause più probabili di
shock cardiogeno e grave instabilità emodinamica nel paziente cardiochirurgico.
Spesso conseguenza di ischemia e/o IMA (infarto miocardico acuto) perioperatorio,
va riconosciuta e adeguatamente trattata sia per limitare l’estensione del danno miocardico, sia per ottimizzare la funzione ventricolare. Mentre in sala operatoria, l’approccio ecocardiografico allo studio del ventricolo sinistro è necessariamente l’ETE,
nei pazienti ricoverati in UTI, la prima valutazione della funzione ventricolare sinistra
può essere effettuata con modalità transtoracica, riservando l’ETE ai casi più complicati o a quei pazienti in cui la finestra toracica non sia adeguata. Lo studio ecografico
del VS è sia morfologico sia funzionale e la valutazione della funzione ventricolare
deve riguardare sia la funzione sistolica sia quella diastolica. La valutazione della
morfologia del VS è fondamentale per capire se ci troviamo di fronte a un ventricolo
normale per forma e dimensioni e che contrae rapporti adeguati con le strutture cardiache anatomicamente contigue. Lo studio morfologico del VS si effettua con la
modalità bidimensionale, acquisendo tutte le proiezioni standard codificate per il
ventricolo sinistro.
Funzione sistolica
La funzione sistolica del VS viene valutata attraverso l’acquisizione di alcuni indici che
si ricavano da misure di diametri, aree e volumi. Il VS può essere paragonato a un solido
con una forma precisa e molto complessa che, per produrre la gittata sistolica, modifica
la sua forma e, di conseguenza, il suo volume durante la fase eiettiva del ciclo cardiaco.
Per questo motivo, nel passaggio dalla telediastole alla telesistole, i diametri, l’area e il
volume della cavità ventricolare sinistra cambiano significativamente. È su questo
principio che si basa il calcolo degli indici sistolici, che vengono ricavati dall’analisi
226
Parte I La gestione della fase acuta
matematica delle variazioni delle misure ventricolari. È importante sottolineare che gli
indici sistolici non danno alcuna informazione sulla contrattilità dell’LV, ma solo sull’efficienza della fase eiettiva. Tutte queste misure, affinché siano attendibili, devono
essere eseguite nelle proiezioni più idonee alla loro acquisizione.
Indici di funzionalità sistolica Si distinguono in base al parametro misurato in:
• frazione di accorciamento (SF), quando si misuri la variazioni dei diametri della
cavità ventricolare sinistra;
• variazione dell’area di accorciamento frazionato (FAC), quando si misura la variazione dell’area ventricolare sinistra;
• frazione di eiezione (FE), quando si considerino le variazioni del volume ventricolare sinistro.
SF. Esprime, in percentuale, la variazione del diametro telediastolico (EDD) e telesistolico (ESD) del VS, secondo la formula EDD − ESD/EDD x 100 e si considera normale
se il suo valore è > 30%. La SF si misura con tecnica M-Mode nella proiezione transgastrica asse corto medio-papillare a 0°. Una volta che la proiezione ecografica sia stata
correttamente acquisita, cioè i due muscoli papillari siano ben evidenti e allineati, e
l’immagine sia centralizzata nello schermo e adeguatamente ingrandita, si posiziona il
cursore centralmente alla cavità ventricolare e si applica l’M-Mode. L’immagine ottenuta è in movimento e pertanto deve essere congelata per potere misurare i diametri. Il
cursore viene posizionato in corrispondenza dell’endocardio della parete anteriore (in
basso nell’ETE e in alto nell’ETT) e di quella posteriore (in alto nell’ETE e in basso nell’ETT) in diastole (QRS sull’ECG) e, successivamente, in sistole (apice dell’onda T sull’ECG) (Figura 11.5). Le macchine di moderna generazione misurano automaticamente la SF. La misura della SF è attendibile quando i diametri sono misurati ponendo il
cursore sull’endocardio delle pareti ventricolari e non su quello dei muscoli papillari e
se la linea che unisce le due pareti è perfettamente allineata.
Figura 11.5
Misura della frazione di accorciamento con metodica M-Mode.
227
CAPITOLO 11 L’ecocardiografia
FAC. Esprime la percentuale di variazione tra l’area ventricolare telediastolica (EDA) e
quella telesistolica (ESA) secondo la formula (EDA − ESA/EDA)·100 e si calcola nella stessa proiezione in cui si misura la SF, cioè la transgastrica asse corto medio-papillare a 0°.
Il suo valore è considerato nella norma se è > 40%. Acquisita correttamente la proiezione
e congelata l’immagine, si cerca la fase diastolica con la corrispondenza dell’ECG (QRS)
e si traccia il contorno della cavità ventricolare sul bordo endocardico con l’apposito
comando “traccia”; l’ecografo fornisce automaticamente l’area telediastolica premendo
il tasto invio alla fine della manovra. La stessa operazione si esegue in sistole e, una volta
tracciato tutto il perimetro della cavità ventricolare e calcolata l’ESA, si può applicare la
formula e ottenere la FAC (Figura 11.6). Tale misura deve essere effettuata non includendo i muscoli papillari nella traccia del contorno della cavità ventricolare sinistra.
FE. È la misura più complessa tra gli indici sistolici in quanto, esprimendo una variazione di volume, richiede l’applicazione di algoritmi che possono assimilare il VS a un
solido convenzionale. La FE è l’indice più utilizzato nella pratica clinica per la descrizione della funzione ventricolare sinistra, anche se non quantifica la contrattilità del
VS, ma solo la sua capacità eiettiva. La FE è definita come la percentuale della variazione tra il volume telediastolico del VS (EDV) e quello telesistolico (ESV) secondo la formula (EDV − ESV/EDV)·100 e il suo valore è considerato normale se > 60%.
Tra i metodi usati per il calcolo della FE, i più comuni sono quello area-lunghezza e
il metodo di Simpson (Figura 11.7).
Il metodo area-lunghezza considera il VS come un ellissoide e calcola il volume ventricolare attraverso la misura dell’area e del diametro ventricolari sia in sistole, sia in diastole.
Il metodo di Simpson suddivide la cavità ventricolare in tante fette sovrapposte dall’apice alla base, ognuna delle quali è assunta di forma ellissoidale cilindrica; il volume
del VS viene calcolato come la somma del volume di ciascuna fetta.
I moderni ecografi sono dotatati del software per calcolare la FE con il metodo di
Simpson prendendo come riferimento l’area del VS e il suo diametro misurato dall’apice al piano mitralico nelle due fasi del ciclo cardiaco. Il calcolo della FE viene effettuato
nelle due proiezioni medio-esofagee 4 e 2 camere: congelata l’immagine, con l’ausilio
dell’ECG, ci si posiziona nella fase diastolica del ciclo cardiaco e si misura l’EDA del VS,
tracciando con la trackball il contorno endocardico della camera ventricolare e, successivamente, il diametro, ponendo il cursore prima sull’endocardio dell’apice e, dopo aver
Figura 11.6
Misura della FAC.
228
Parte I La gestione della fase acuta
Figura 11.7
Metodo Simpson per la misura della frazione di eiezione.
premuto il tasto invio, sul punto medio del piano valvolare mitralico. Tale manovra viene ripetuta in sistole e quindi, applicando la formula di riferimento, premendo di nuovo
il tasto invio, la macchina calcola automaticamente la FE.
La misura degli indici sistolici può essere influenzata da numerosi fattori sia fisiologici
sia patologici, che devono essere sempre tenuti presenti quando si voglia studiare la funzione ventricolare sinistra. In particolare non bisogna dimenticare che sia la SF sia la FAC
sono misure di funzione ventricolare ottenute a livello di un segmento specifico del VS
che è la porzione medio-papillare, che non sempre è rappresentativo della totalità del
ventricolo sinistro. Per esempio, la presenza di un aneurisma ventricolare in sede apicale
o di una qualunque alterazione che condizioni la morfologia del VS, se non evidenziate
da un esame completo del VS con tutte le proiezioni disponibili, possono indurre in errore sull’effettiva funzionalità ventricolare sinistra. Un’altra importante considerazione
deve essere fatta sulla misura della FE. Il calcolo della FE viene fatto sulla variazione del
volume ventricolare sinistro che a sua volta dipende dall’area della camera ventricolare e
dal suo diametro in asse lungo misurati nelle proiezioni medio-esofagee 4 e 2 camere. È
fondamentale che, perché le misure siano attendibili, tali proiezioni siano acquisite correttamente, tenendo conto che una minima variazione della lunghezza ventricolare o
una difettosa definizione del bordo endocardico possono inficiare la misura di diametro
e area rispettivamente. È perciò importante che nelle proiezioni interessate siano correttamente visualizzati l’apice ventricolare e l’interfaccia tra sangue e parete ventricolare.
Valutazione della cinetica regionale
La valutazione ecocardiografica della funzione ventricolare sinistra non può prescindere dallo studio della cinetica regionale e della contrattilità miocardica. Questo è particolarmente vero nel paziente cardiochirurgico in cui l’ischemia miocardica perioperatoria
è una complicanza possibile e relativamente frequente.
L’ischemia miocardica comporta un’alterazione del movimento del segmento miocardico interessato fino alla totale assenza di contrazione nei casi di infarto con necrosi tissutale
CAPITOLO 11 L’ecocardiografia
229
(Tabella 11.2). L’ecocardiografia, evidenziando le anomalie della cinetica parietale, permette non solo di fare diagnosi di ischemia, ma anche della sede localizzando con precisione i territori ischemici. Un’altra importante considerazione è che le alterazioni ecografiche
dell’ischemia miocardica precedono anche di alcune ore le modificazioni elettrocardiografiche, per cui la valutazione eco permette una diagnosi precoce di lesione miocardica.
Da un punto di vista ecocardiografico, in condizioni fisiologiche la contrattilità del
miocardio si valuta come movimento e come ispessimento. Questo significa che durante
la sistole le pareti ventricolari si muovono dalla posizione iniziale verso il centro della
cavità ventricolare e che il loro spessore aumenta. Per convenzione, affinché si parli un
linguaggio universale, è stato proposto un modello segmentale secondo il quale il VS è
stato suddiviso in tre regioni che dal piano atrioventricolare all’apice sono distinte rispettivamente in basale, media e apicale. Ciascuna regione è a sua volta divisa in segmenti,
per un totale di 16 (attualmente è stato introdotto un modello a 17 segmenti, utilizzato
prevalentemente negli studi di vitalità miocardica con eco-stress, in cui l’apice è considerato a parte). Questo sistema di valutazione permette di esplorare ogni segmento delle
pareti ventricolari e di osservare il grado di movimento e di ispessimento che lo caratterizza in modo da evidenziare l’eventuale ischemia e di collocarla in una zona precisa del
ventricolo e in uno specifico territorio di distribuzione coronarica.
La disfunzione sistolica del VS, soprattutto se acuta, compromette, spesso in modo
severo, il perioperatorio del paziente cardiochirurgico e ne condiziona sia la gestione
clinica sia il trattamento terapeutico. Questi pazienti hanno generalmente bisogno di
essere adeguatamente monitorizzati al fine di ottimizzare sia la gestione emodinamica
sia il trattamento specifico.
L’uso di inotropi, di supporti meccanici, così come la necessità di ricorrere a rivascolarizzazione miocardica deve essere opportunamente valutato sulla base del quadro clinico e sui dati forniti dall’ecocardiografia. Lo studio ecocardiografico della funzione sistolica del VS è fondamentale in area critica cardiochirurgica dove può davvero
fare la differenza tra una gestione corretta e un errato inquadramento diagnosticoterapeutico del paziente critico.
Funzione diastolica
Considerata a lungo la cenerentola della funzione cardiaca, la diastole è oggi ritenuta un tempo fondamentale del ciclo cardiaco e dell’attività ventricolare sinistra. In
condizioni fisiologiche la funzione del VS si esprime attraverso l’alternanza ciclica e
regolare delle due fasi del ciclo cardiaco, la sistole e la diastole, il cui prodotto finale
Tabella 11.2
Cinetica
Movimento*
Ispessimento
Normale
> 30%
Normale
Lievemente ipocinetico
10-30%
Inferiore al normale
Severamente ipocinetico
< 10%
Minimo
Acinetico
Nessuno
Nessuno
Discinetico
Movimento paradosso
Ridotto in sistole
*: riduzione della distanza dal centro della cavità ventricolare.
230
Parte I La gestione della fase acuta
Figura 11.8
Fasi del ciclo cardiaco e corrispondenti profili pressori in aorta, atrio e ventricolo sinistri.
AP: pressione atriale. LAP: pressione atriale sinistra. LVP: pressione ventricolare sinistra.
è la gittata sistolica (Figura 11.8). La diastole non è un fenomeno puramente passivo
deputato al mero riempimento ventricolare, ma una fase attiva del ciclo cardiaco dal
cui contributo dipende la normale funzionalità ventricolare sinistra. La comprensione di quanto sia importante la valutazione della funzione diastolica del VS per la
gestione emodinamica del paziente critico e in particolare del paziente cardiochirurgico, è una delle maggiori conquiste degli ultimi anni. La valutazione non invasiva della diastole si effettua esclusivamente con l’ecocardiografia che, pertanto,
diventa lo strumento diagnostico fondamentale per evidenziare le eventuali alterazioni di questa fase del ciclo cardiaco.
Fisiologia della diastole
La fase diastolica del ciclo cardiaco dura normalmente circa 0,5 secondi, cioè 1,5 volte
la durata della sistole. Può essere suddivisa in quattro fasi a ognuna delle quali spetta
un preciso ruolo fisiologico:
1) rilasciamento isovolumetrico: in questa fase che inizia con la chiusura della AV e
termina con l’apertura della valvola mitrale (VM), la pressione nel VS diminuisce
senza che si verifichino variazioni di volume della camera ventricolare; in questa
fase il VS si prepara al riempimento riducendo la pressione intracavitaria al di sotto
di quella atriale sinistra e determinando l’apertura della VM;
2) riempimento rapido: con l’apertura della VM il VS comincia a riempirsi in modo
rapido per la differenza pressoria esistente tra ventricolo e atrio sinistro. In questa fase avviene circa l’80% di tutto il riempimento ventricolare sinistro. La velocità con cui il ventricolo si riempie raggiunge un valore di picco in coincidenza
con il massimo gradiente pressorio, per ridursi poi progressivamente fino a interrompersi quando la pressione nel VS si equilibra con quella in atrio sinistro;
3) diastasi: fase breve in cui la VM è ancora aperta, ma non avviene alcuno riempimento per l’equilibrio tra le due pressioni;
231
CAPITOLO 11 L’ecocardiografia
4) contrazione atriale: la contrazione dell’atrio sinistro “spreme” il sangue residuo
nell’LV contribuendo a un 15-20% del riempimento ventricolare.
La corretta alternanza e l’adeguata durata di ciascuna fase è fondamentale per la normalità della diastole che si esprime come il giusto equilibrio tra compliance e riempimento ventricolare. Una diastole è normale quando permette al VS di riempirsi senza
che la sua pressione aumenti e l’alterazione di una qualunque di queste fasi è responsabile di disfunzione diastolica.
Valutazione ecocardiografica della diastole
La diastole si studia esaminando il flusso transmitralico e il flusso refluo dalle vene
polmonari con il Doppler pulsato e con la recente introduzione di due metodiche quali il Color M-Mode e il Doppler tissutale.
Doppler transmitralico
Con il Doppler pulsato si studia la velocità del flusso ematico attraverso la VM durante le
fasi di riempimento rapido e della contrazione atriale. In proiezione medio-esofagea
4-camere si posiziona il cursore in modo che sia allineato al flusso transmitralico collocando il campione in corrispondenza della punta dei due lembi valvolari subito al di
sotto del piano valvolare mitralico. In condizioni normali si registrano due velocità di
flusso che al Doppler pulsato appaiono come due onde: l’onda E che corrisponde al
riempimento rapido e l’onda A che corrisponde alla contrazione atriale. Lo spazio compreso tra E e A è la diastasi. Il normale rapporto tra l’onda E e l’onda A è > 1 (Figura 11.9).
Sull’onda E è possibile misurare il DT, inteso come il tempo necessario alla velocità di
flusso di tornare alla linea dello zero dal picco massimo. L’analisi del flusso transmitralico è uno step fondamentale nello studio della funzione diastolica, ma non bisogna
Figura 11.9
Pattern di flusso transmitralico.
232
Parte I La gestione della fase acuta
dimenticare che può essere influenzato da diversi fattori come l’età, le condizioni di
carico e la frequenza cardiaca. In alcune condizioni, la variazione del precarico può
risultare utile a rivelare un’alterazione diastolica non evidente in condizioni di riposo e
ciò assume un significato particolare nel paziente critico in cui le condizioni volemiche
sono spesso alterate dall’instabilità emodinamica, dalla ventilazione meccanica o
dall’uso di farmaci vasodilatatori o vasocostrittori.
Flusso venoso polmonare
Con il Doppler pulsato si analizza la velocità del flusso refluo dalle vene polmonari
ponendo il campione circa 1 cm all’interno dello sbocco della vena polmonare esaminata, che generalmente è la superiore sinistra per la maggiore facilità con cui si visualizza.
Per lo studio del flusso venoso polmonare è indicata l’ETE, in quanto solamente l’approccio transesofageo ne permette la visualizzazione e l’acquisizione. Dalla proiezione
medio-esofagea 4 camere, ruotando in toto la sonda verso sinistra e anteflettendola leggermente, si visualizza il coumadin ridge che separa l’auricola dalla vena polmonare
superiore sinistra. Quello che si va a esaminare con il Doppler è un flusso venoso la cui
velocità è < 1 m/secondo e le cui caratteristiche risentono fortemente sia della contrazione atriale sia di quella ventricolare. Il tipico pattern del flusso polmonare è caratterizzato
da tre onde: onda sistolica S e onda diastolica D, che sono positive, e l’onda A che appare
come un’onda negativa (Figura 11.10). L’onda S è generalmente divisa in due componenti che sono dette S1 e S2. S1 è legata al rilasciamento atriale, mentre S2 è la conseguenza di come la contrazione ventricolare influenzi il flusso venoso polmonare quando
il piano atrio-ventricolare si abbassa verso l’apice cardiaco. S2 è contemporanea all’onda
E del flusso transmitralico e come questa è influenzata dalla compliance ventricolare,
dall’insufficienza mitralica e dall’aumento della pressione in atrio sinistro. L’onda D è
propriamente protodiastolica in quanto rappresenta la velocità del flusso venoso polmonare refluo subito dopo l’apertura della VM. L’onda A esprime la velocità del flusso venoso
Figura 11.10
Doppler del flusso venoso polmonare.
233
CAPITOLO 11 L’ecocardiografia
polmonare in corrispondenza della contrazione atriale ed è negativa in quanto in questa
circostanza il flusso inverte la sua direzione. È contemporanea all’onda A del flusso transmitralico. In condizioni normali A è molto piccola e il rapporto S/D è circa pari a 1.
Come per il flusso transmitralico, anche il flusso venoso polmonare è influenzato da fattori come l’età, la frequenza cardiaca, la ventilazione e le condizioni di carico.
Velocità di propagazione intraventricolare
La velocità di propagazione intraventricolare (Vp) è una misura introdotta recentemente nello studio della funzione diastolica e che sembra meno influenzata dalle condizioni di carico volemico rispetto all’analisi più tradizionale dei flussi transmitralico e
venoso polmonare. Si ottiene impiegando contemporaneamente le metodiche color
Doppler e M-Mode e rappresenta la velocità con cui il sangue passa dall’atrio sinistro
all’LV in protodiastole e fluisce poi all’interno del VS dal piano atrio-ventricolare fino
all’apice ventricolare. In un VS con compliance e rilasciamento adeguati, il flusso ha
una velocità normale, mentre rallenta in condizioni in cui la diastole è alterata e le
pressioni ventricolari sono aumentate, per cui è maggiore il tempo necessario affinché
il VS si riempia. Si misura in proiezione ME 4 camere ponendo il cursore in modo che
l’apice del triangolo di scansione degli US attraversi atrio e ventricolo sinistro passando per la VM che rimane al centro della linea; successivamente si aggiunge il color
Doppler sistemando il volume campione nel VS coprendo la distanza tra VM e apice.
Selezionando il comando M-Mode si visualizza una rappresentazione spazio-temporale
della diastole all’interno del VS (Figura 11.11). Generalmente è necessario ridurre la
scala del colore per ridurre il limite di Nyquist e ottenere un aliasing precoce, e ridurre
il guadagno per vedere due distinte aree di colore di cui una protodiastolica, che
corrisponde al riempimento rapido, e una telediastolica in corrispondenza della contrazione atriale, corrispondenti all’onda E e all’onda A del pattern transmitralico.
L’analisi della Vp si esegue misurando la pendenza dell’onda protodiastolica, che va
Figura 11.11
Misura della velocità di propagazione (Vp) al color M-Mode.
234
Parte I La gestione della fase acuta
misurata a partire dal piano mitralico, in corrispondenza dell’apertura della mitrale,
fino ad almeno 3-4 cm in basso nella cavità ventricolare mettendo il cursore sul bordo
sinistro dell’area di colore che rappresenta la velocità di flusso al color-Doppler. Una Vp
è normale quando è ≥ 55 cm/secondo. Ovviamente se la valutazione viene effettuata
con l’ETE le due velocità al color-Doppler appaiono come positive.
Doppler tissutale
Con questa metodica di recente introduzione è possibile impiegare il Doppler per misurare velocità decisamente inferiori a quella del sangue, quali quelle del miocardio. Il miocardio ventricolare si contrae in sistole e si rilascia in diastole determinando lo spostamento
della base del VS, cioè il piano atrio-ventricolare verso l’apice in sistole e il suo ritorno
verso l’atrio sinistro in diastole. Per questo meccanismo fisiologico il miocardio anulare
mitralico segue lo spostamento della base in sistole e in diastole. Se con il Doppler si campiona il miocardio anulare mitralico, risultano delle velocità sistoliche (discesa dell’anulus
verso l’apice) e diastoliche (risalita dell’anulus verso l’atrio).
Il Doppler tissutale (TDI) si esegue posizionando il cursore in corrispondenza dell’anulus mitralico in proiezione asse lungo 4 camere nella quale c’è il migliore allineamento tra il fascio di US e la direzione in cui si muove il miocardio anulare. Il migliore
allineamento corrisponde al lato settale dell’anulus mitralico dove però la velocità tissutale può essere influenzata dalla presenza della valvola aortica. Si preferisce quindi
campionare l’anulus laterale considerando che spesso la visualizzazione di questa porzione della parete laterale non è sempre ottimale. Il pattern del TDI è costituito da una
velocità sistolica e da due velocità diastoliche che appaiono rispettivamente come
deflessioni negative e positive all’ETE e opposte all’ETT (Figura 11.12). L’analisi delle
velocità tissutali consente un’adeguata valutazione delle due fasi del ciclo cardiaco. La
velocità sistolica è considerata normale se > 8 cm/secondo ed esprime una compromissione della funzione sistolica quando è al di sotto di questo valore. Le due velocità
Figura 11.12
Analisi con Doppler tissutale dell’anulus mitralico: si osservino le velocità sistolica e diastolica.
235
CAPITOLO 11 L’ecocardiografia
diastoliche sono definite come onda E’ (protodiastolica) e onda A’ (telediastolica). In
condizioni di diastole fisiologica E’ > 8 cm/sec e il rapporto E’/A’ > 1. L’analisi delle
velocità miocardiche non è influenzata dalle variazioni volemiche ed è pertanto
un’analisi specifica sia della funzione sistolica globale sia della diastole.
Patologia della diastole
Una consensus conference internazionale, basandosi sui dati ecocardiografici, ha distinto la disfunzione diastolica in tre diversi profili patologici che corrispondono alla progressiva evoluzione dell’alterazione diastolica:
• alterato rilasciamento;
• pseudonormalizzazione;
• pattern restrittivo.
Le anomalie dei dati ecocardiografici sono riportate nella Tabella 11.3.
Alterato rilasciamento Rappresenta la fase iniziale della disfunzione diastolica
ed è caratterizzato da una riduzione dell’onda E al pattern transmitralico come espressione di una ridotta velocità del riempimento rapido ventricolare. In questa condizione
il tempo di rilasciamento isovolumetrico (IVRT) è aumentato, per cui la pressione
all’interno del VS scende più lentamente ritardando il riempimento ventricolare. Se
questa condizione è generalmente ben tollerata da pazienti asintomatici e per altro
sani, diventa significativa nei pazienti critici in cui, poiché la pressione intracavitaria
rimane più a lungo elevata, può verificarsi una riduzione della perfusione miocardica.
Considerando che in questi pazienti il consumo di ossigeno miocardico è spesso maggiore della norma per la patologia in atto, si può ben comprendere come l’alterato rilasciamento può assumere un significato decisamente patologico.
Anche il flusso venoso polmonare si altera quando il rilasciamento ventricolare è
compromesso. L’onda D, che dipende dal gradiente tra vena polmonare, atrio sinistro e
LV, è ridotta per diminuzione della velocità diastolica.
Proseguendo nella valutazione funzionale della diastole, la Vp diminuisce nei
pazienti con disfunzione diastolica anche in fase iniziale, così come l’onda E’ al TDI
con inversione del rapporto E’/A’.
Pseudonormalizzazione Se la disfunzione diastolica progredisce, l’aumentata
rigidità del VS determina un aumento delle pressioni intracavitarie. Il pattern transmitralico appare normale (da cui il nome di questa alterazione), ma ovviamente normale
non è. Il flusso venoso polmonare è ora caratterizzato da un aumento della velocità
Tabella 11.3 Pattern di disfunzione diastolica e corrispondenti reperti ecocardiografici
Pattern
E/A
DT
S/D
Alterato rilasciamento
<1
> 220 msec
> 1 onda A alta < 45 cm/sec
E9 < 8 cm/sec
Pseudonormalizzazione > 1
150-220 msec
< 1 onda A >
30 cm/sec
< 45 cm/sec
E9 < 8 cm/sec
Restrittivo
< 150 msec
<1
< 45 cm/sec
E9 < 8 cm/sec
>2
Vp
TDI
DT: tempo di decelerazione. Vp: velocità di propagazione intraventricolare. TDI: Doppler tissutale.
236
Parte I La gestione della fase acuta
diastolica (onda D) che supera la velocità sistolica (onda S) per aumento della pressione
atriale sinistra. In questa situazione si assiste anche all’aumento dell’onda A per maggiore contributo della contrazione atriale in situazioni di aumentata LAP. L’analisi della
Vp mostrerà una riduzione. Il Doppler tissutale sull’anulus mitralico mostrerà una riduzione di E’ che ha una rilevante importanza diagnostica: in presenza di flusso transmitralico normale (E/A > 1) il riscontro di un E’ ridotto deve immediatamente sollevare il
sospetto di quadro pseudonormale, e spingere a un’attenta valutazione e a una misura
del rapporto E/E’ per rilevare la presenza di pressioni atriali sinistre aumentate.
Pattern restrittivo È la forma più grave di disfunzione diastolica in cui l’evoluzione della patologia ha raggiunto lo stato più avanzato di riduzione della compliance
ventricolare e di alterato rilasciamento di parete. In questa condizione, l’aumento
delle pressioni intracavitarie è decisamente significativo con conseguenze cliniche di
evidente scompenso cardiaco.
Il pattern transmitralico presenta un aumento dell’onda E con rapporto E/A > 2. Questo
profilo Doppler è da mettere in relazione all’aumento della LAP e, di conseguenza, del gradiente atrioventricolare che determina un aumento della velocità del riempimento protodiastolico. L’aumento della pressione telediastolica del VS (EDLVP) è la diretta conseguenza
della riduzione della compliance ventricolare ed è responsabile dell’accorciamento del DT
rilevabile al Doppler transmitralico. Il rapido equilibrio tra pressione ventricolare e atriale
riduce significativamente il tempo necessario affinché il flusso transmitralico torni a zero.
In questo stadio avanzato di disfunzione diastolica con aumento della LAP e della
EDLVP, il flusso venoso polmonare presenta una riduzione dell’onda S con S/D decisamente < 1 e una componente A aumentata con velocità di picco che possono raggiungere anche i 40 cm/secondo. La Vp si presenterà molto ridotta, in genere < 30 cm/sec, e
l’analisi al Doppler tissutale mostrerà una severa riduzione della velocità anulare E’, in
genere sotto i 3 cm/sec.
Considerazioni cliniche
La valutazione della diastole nel paziente cardiochirurgico è estremamente importante
a fini diagnostici e soprattutto terapeutici. La disfunzione diastolica può essere la causa dell’instabilità emodinamica così come di altre criticità che si osservano nel perioperatorio del paziente cardiochirurgico. Riconoscerla per trattarla, ma soprattutto per
evitare di intraprendere provvedimenti terapeutici inopportuni con la possibilità di
aggravare la patologia diastolica è fondamentale nella gestione del paziente critico.
Lo studio della diastole guida e condiziona l’espansione volemica e il controllo del
precarico, l’uso degli inotropi e dei b-bloccanti nel paziente critico, così come può giustificare, nei casi in cui la compliance ventricolare è ridotta, il difficile weaning respiratorio in assenza di patologia respiratoria nota.
Ecocardiografia nella disfunzione
ventricolare destra
Lo studio del ventricolo destro (VD) è una tappa fondamentale dell’esame ecocardiografico standard. Sebbene siano presenti alcune caratteristiche anatomiche che lo rendono difficilmente assimilabile a qualsiasi figura geometrica e la sua posizione lo renda
CAPITOLO 11 L’ecocardiografia
237
meno facilmente esplorabile del VS, l’ecocardiografia permette la valutazione della
morfologia e della funzione del VD sia con la modalità transtoracica sia con quella
transesofagea.
L’anatomia del VD è tale per cui nella valutazione funzionale di questa camera ventricolare si devono impiegare metodiche diverse da quelle utilizzate per il VS. L’esame
del VD inizia con l’osservazione della morfologia ventricolare e dei suoi rapporti con le
sezioni sinistre. Il VD normalmente ha una lunghezza pari ai 2/3 di quella del VS e nelle
proiezioni in asse lungo non partecipa normalmente alla costituzione dell’apice cardiaco (Figura 11.13); in sezione traversa, visibile nelle proiezioni in asse corto, ha una
forma semilunare caratteristica con il setto interventricolare di forma concava verso il
VS. Già a una prima osservazione ecocardiografica si può valutare se la forma e le
dimensioni del VD sono normali o alterate, e questo per il fatto che la prima manifestazione di disfunzione ventricolare destra è un aumento delle dimensioni della camera ventricolare con perdita della forma semilunare e variazione dei rapporti anatomici
con il VS (Figura 11.14).
Il VD è caratterizzato da una fisiologia di camera a bassa pressione ed elevata capacità di accogliere volume (alta compliance), con scarsa capacità di affrontare aumenti
di postcarico sostenuti. Per questo motivo, nelle patologie che determinano un aumento, soprattutto se acuto, delle resistenze vascolari polmonari, il VD reagisce aumentando il suo volume. Se in fase iniziale questa dilatazione ha un significato compensatorio
in quanto permette al VD di mantenere un’adeguata gittata sistolica, successivamente
l’aumento dello stress di parete e del consumo di ossigeno miocardico determinano
una grave alterazione della funzione ventricolare destra riduzione della gittata
sistolica. La dilatazione del VD ha ripercussioni anche sul VS e la sua funzione.
Quando il VD si dilata perde la sua normale forma semilunare e il setto interventricolare si appiattisce e si sposta verso il VS comprimendolo e ostacolandone il
riempimento. La riduzione della gittata sistolica destra comporta riduzione del
precarico ventricolare sinistro che, associato alla difficoltà con cui il VS si riempie,
Figura 11.13
Proiezione 4 camere al TEE.
238
Parte I La gestione della fase acuta
Figura 11.14
Fisiopatologia della disfunzione ventricolare destra: si osservino le conseguenze sul
ventricolo sinistro e sull’emodinamica sistemica. (In alto, da Pierce LNB. Management of
the mechanically ventilated patient. 2nd ed. St Louis, Saunders, 2007.)
ha come conseguenza la riduzione della gittata sistolica sistemica e quindi un
quadro di bassa portata.
L’interdipendenza ventricolare è uno dei principali meccanismi fisiopatologici dello
scompenso cardiaco e pertanto la disfunzione ventricolare destra deve essere adeguatamente riconosciuta e trattata.
CAPITOLO 11 L’ecocardiografia
239
Indici di funzione sistolica destra
TAPSE Il metodo TAPSE (Tricuspidal Annular Plane Systolic Excursion) misura il
movimento che l’anello tricuspidalico effettua durante la sistole ventricolare. La
migliore proiezione in cui eseguire questa misura è la 4 camere. Si posiziona il cursore
in corrispondenza dell’anulus laterale e si applica l’M-Mode. Una volta congelata
l’immagine, il TAPSE è la differenza tra il punto più basso e quello più alto dell’escursione tricuspidalica (Figura 11.15). Un TAPSE < 16 mm è indice di disfunzione moderata dell’RV, mentre un valore < 11 mm esprime una severa disfunzione ventricolare
destra.
FAC La Fractional Area Change, misurata analogamente a quanto si fa sul ventricolo
sinistro, fornisce una stima della funzione sistolica del ventricolo destro. Il limite inferiore di normalità è 35%.
Doppler tissutale Il principio su cui si basa è lo stesso per cui questa metodica è
impiegata nella valutazione del VS. Il TDI valuta le velocità miocardiche del VD a livello
dell’anulus tricuspidalico. In proiezione inflow-outflow al TEE, e in 4 camere al TTE, il
cursore viene posizionato sul miocardio anulare in corrispondenza del lembo posteriore della valvola tricuspide e poi si applica il Doppler pulsato. Come per il VS si evidenziano velocità sistoliche che, se < 10 cm/sec, sono indice di disfunzione ventricolare destra, e diastoliche che permettono una valutazione di questa componente del
ciclo cardiaco.
Scompenso destro
Nel paziente cardiochirurgico lo scompenso destro è un’evenienza possibile che non
sempre può essere valutata con i sistemi tradizionali di monitoraggio emodinamico.
Basti pensare che l’insufficienza tricuspidalica moderata condiziona l’acquisizione
Figura 11.15
Associazione delle modalità eco 2D e M-mode per la misura del TAPSE.
240
Parte I La gestione della fase acuta
delle pressioni polmonari con il cateterismo arterioso polmonare inficiando anche la
stima della CO. La valutazione ecocardiografica sia con la ETT sia con la ETE è sicuramente uno strumento diagnostico fondamentale nella gestione emodinamica e clinica
del paziente critico.
Lo scompenso ventricolare destro, in acuto, si può presentare in diverse condizioni
cliniche anche particolarmente impegnative come l’embolia polmonare acuta, in cui le
resistenze vascolari polmonari aumentano drammaticamente per occlusione del letto
arterioso. L’ecocardiografia transesofagea permette di fare diagnosi sia di disfunzione
ventricolare destra sia di embolia polmonare, visualizzando la presenza di trombi in
arteria polmonare o in uno dei suoi rami.
Il ventricolo destro può scompensarsi acutamente anche in conseguenza di una
sindrome coronarica acuta che interessi il territorio di distribuzione del VD. In questo caso, ancora una volta l’ecocardiografia permette di associare ai segni di alterazione funzionale l’alterazione della cinetica ventricolare destra e del suo impegno
sistolico.
Un’altra importante valutazione ecocardiografica nella diagnosi di disfunzione ventricolare destra è il rilievo di insufficienza tricuspidale (IT) ed eventualmente di ipertensione polmonare (Figura 11.16). I pazienti con scompenso destro spesso sviluppano ipertensione polmonare, la quale richiede un trattamento specifico e particolari
atteggiamenti protettivi nella ventilazione meccanica. L’esame ecocardiografico permette inoltre di distinguere i reperti propri dello scompenso acuto (apicalizzazione del
VD, perdita della convessità del setto interventricolare, IT) da quelli della disfunzione
cronica quali l’ipertrofia ventricolare e l’ipertensione polmonare. Non è infrequente
che pazienti con disfunzione cronica del VD, come per esempio i gravi broncopneumopatici, possano scompensarsi acutamente per l’insorgenza di una delle condizioni
cliniche suddette. In questo caso i reperti ecocardiografici saranno d’ausilio nell’iter
diagnostico-terapeutico.
Le proiezioni ottimali per la visualizzazione delle camere destre sono le ME 4 camere e inflow-outflow e la transgastrica asse corto medio-papillare; con l’ETE il VD si
Figura 11.16
Immagine di IT.
CAPITOLO 11 L’ecocardiografia
241
visualizza bene in apicale 4 camere e in parasternale asse lungo e asse corto mediopapillare.
Considerazioni cliniche
Il paziente affetto da scompenso acuto del VD è generalmente un paziente critico le cui
condizioni cliniche richiedono un monitoraggio emodinamico avanzato e che spesso
pone un serio problema di diagnosi differenziale. Di fronte a un paziente con i segni e i
sintomi dello shock cardiogeno (ipotensione severa, oliguria, desaturazione arteriosa)
e i parametri emodinamici di cuore polmonare acuto (aumento delle pressioni polmonari, della PVC e desaturazione venosa mista), soprattutto se sono presenti dispnea,
tachicardia e alterazioni dei parametri emogasanalitici, il sospetto clinico di embolia
polmonare acuta è inevitabile.
L’ecocardiografia gioca un ruolo fondamentale nel percorso diagnostico di questi
pazienti che per loro condizioni generali sono difficilmente trasportabili nei reparti di
radiologia al fine di effettuare le indagini strumentali quali la scintigrafia polmonare o
l’angioTAC. Il paziente con embolia polmonare è generalmente un paziente critico le
cui condizioni cliniche possono deteriorare rapidamente se non si intraprende la terapia adeguata o se questa risulta inefficace. La disponibilità di un esame strumentale
come l’ETT e soprattutto l’ETE, che permetta una valutazione diagnostica direttamente al letto del malato in modo rapido e sicuro e consenta di confermare o escludere la
diagnosi di embolia polmonare, è fondamentale al fine di intraprendere la corretta
gestione emodinamica e terapeutica di questi pazienti. È importante sottolineare che
l’unica diagnosi di certezza è la visualizzazione diretta del trombo in arteria polmonare
o in uno dei suoi rami principali (Figura 11.17). Per questo motivo l’ETE è sicuramente
l’approccio migliore nell’esame ecocardiografico in quanto solo con questa metodica
si riescono a visualizzare in modo adeguato le arterie polmonari anche se con il limite
del ramo sinistro in parte coperto dall’interposizione del bronco principale sinistro.
Ovviamente la mancata visualizzazione di materiale trombotico in arteria polmonare
Figura 11.17
Trombo in arteria polmonare.
242
Parte I La gestione della fase acuta
o comunque nelle sezioni destre, soprattutto se sono presenti i reperti ecocardiografici
di sovraccarico ventricolare destro, non permette di escludere con certezza la diagnosi
di embolia polmonare acuta per cui in questi casi è necessario ricorrere ad accertamenti diagnostici più invasivi.
Un’altra importante informazione “ecografica” è l’eventuale presenza di un forame
ovale pervio (PFO) con shunt destro sinistro per aumento delle pressioni destre e possibile passaggio di materiale trombotico dall’atrio destro a quello sinistro con conseguente embolizzazione sistemica. La presenza di PFO deve essere attentamente valutata al fine di ottimizzare anche la ventilazione meccanica per non peggiorare lo shunt.
Il PFO deve essere sempre sospettato in quei pazienti che sottoposti a ventilazione
meccanica desaturano acutamente e non rispondono alle variazioni della FiO2 erogata
e delle pressioni inspiratorie. La proiezione bicavale all’ETE è sicuramente il migliore
approccio ecocardiografico per riconoscere questa anomalia (Figura 11.18).
I pazienti con scompenso ventricolare destro pongono inoltre il problema della
ventilazione meccanica che deve essere adeguata alle condizioni di sovraccarico
ventricolare destro al fine di non peggiorare il quadro emodinamico. L’interazione
tra la funzione respiratoria e quella cardiaca è tale che le resistenze vascolari polmonari sono direttamente influenzate dalle variazioni cicliche dei volumi polmonari
durante la ventilazione (Figura 11.19). I vasi polmonari responsabili delle resistenze
vascolari sono divisi in vasi extralveolari e in capillari alveolari. Senza entrare in dettagli fisiopatologici che non sono di pertinenza di questo capitolo, si ricorda che
entrambi i vasi, seppure in maniera opposta, risentono dell’aumento dei volumi polmonari che si verifica durante la ventilazione, modulando le resistenze vascolari
polmonari (RVP). L’espansione polmonare durante l’insufflazione determina un
aumento del calibro dei vasi extralveolari per stiramento del parenchima polmonare
e una compressione dei capillari alveolari per l’aumento della pressione alveolare. Di
fatto le RVP dipendono dall’equilibrio tra le due porzioni del letto vascolare polmonare. Durante ventilazione meccanica, le resistenze vascolari polmonari aumentano
in modo significativo e la situazione peggiora se si applica una PEEP (Positive End
Figura 11.18
Visualizzazione di shunt a livello del setto interatriale.
CAPITOLO 11 L’ecocardiografia
243
Figura 11.19
Interazione cardiopolmonare: impatto della ventilazione polmonare sul riempimento cardiaco.
Expiratory Pressure Pressione) che, mantenendo dilatati gli alveoli, comporta una
compressione continua sui capillari alveolari.
In questi pazienti pertanto la ventilazione meccanica deve essere adattata alla
situazione emodinamica cercando di mantenere pressioni medie nelle vie aeree non
elevate e di impiegare bassi valori di PEEP. In alcune condizioni particolari la pronazione del paziente può migliorare la situazione attraverso la ridistribuzione dei flussi
polmonari e la variazione del rapporto ventilazione/perfusione.
Nei pazienti con grave ipertensione polmonare refrattaria alla terapia medica e
con grave disagio ventilatorio, l’erogazione di ossido nitrico deve essere presa in seria
considerazione al fine di ridurre le RVP e migliorare il profilo emodinamico. L’impiego di ventilazione protettiva, di PEEP non elevate e la necessità di somministrare
ossido nitrico nei casi con grave ipertensione polmonare devono essere valutati caso
per caso e in questi pazienti l’eco aiuta non solamente a fare diagnosi di scompenso
acuto del VD, ma anche a monitorizzare la risposta al trattamento.
Ecocardiografia nelle complicanze
perioperatorie
Un’altra importante applicazione dell’ecocardiografia è quella dedicata alla diagnosi e
alla gestione terapeutica delle complicanze che, nel perioperatorio del paziente cardiochirurgico, possono insorgere più o meno acutamente. Queste verranno dettagliatamente descritte nel Capitolo 14, per cui in questa fase ci si limiterà a sottolineare
come sia fondamentale riconoscere per potere intervenire in tempi rapidi le complicanze meccaniche dell’IMA come l’insufficienza mitralica acuta da rottura di muscolo
papillare, la rottura di cuore, il tamponamento cardiaco. Allo stesso modo non è asso-
244
Parte I La gestione della fase acuta
lutamente trascurabile il ruolo dell’ecocardiografia nella diagnosi di patologie acute
quali la dissezione aortica. Non bisogna dimenticare inoltre che in un’UTI postcardiochirugica l’impiego dell’ecocardiografia permette di controllare periodicamente l’esito
dell’intervento chirurgico, così come di riconoscere eventuali peggioramenti della funzione cardiaca o l’insorgenza di complicanze acute.
Insufficienza mitralica
La valutazione anatomo-funzionale della valvola mitrale (VM) riconosce nell’ETE il
suo principale strumento diagnostico al punto che questa metodica è stata individuata come una raccomandazione di classe I dalle linee guida sull’impiego dell’ecocardiografia perioperatoria. L’ETE permette infatti una valutazione completa della
valvola mitrale e dell’apparato sottovalvolare che risulta estremamente utile non solo
nel contesto cardochirurgico, ma anche in ambito intensivistico sul paziente critico.
La VM può essere alterata, sia anatomicamente sia funzionalmente, sia per un processo degenerativo proprio della struttura valvolare sia come conseguenza di una
disfunzione ventricolare sinistra. Quest’ultima situazione è facilmente intuibile se si
considerano gli stretti rapporti anatomici tra VM e VS.
In seguito a una lesione ischemica del miocardio il VS si rimodella per dilatazione
postischemica dei segmenti di parete danneggiati con conseguente modificazione della geometria della camera ventricolare. Lo spostamento della base di impianto del
muscolo papillare che si trova in quel tratto di parete lo allontana dall’anello valvolare
e determina lo stiramento verso l’apice ventricolare del lembo valvolare a cui invia le
corde tendinee, con conseguente abbassamento del punto di coaptazione dei lembi
valvolari e incontinenza valvolare.
La VM può risultare insufficiente anche nei pazienti con miocardiopatia dilatativa
dove l’eccessivo aumento delle dimensioni della camera ventricolare sinistra comportano una dilatazione dell’anello valvolare che perde così la sua normale morfologia e
funzionalità.
È importante sottolineare però che una VM normale per morfologia e funzione può
scompensarsi acutamente per alterazione dell’apparato sottovalvolare come in seguito
a una rottura di corde tendinee o della testa di uno dei muscoli papillari. Ne deriva
un’insufficienza mitralica (MR) acuta spesso associata a grave scompenso emodinamico. È questo il caso della MR che si verifica come possibile complicanza meccanica
dell’IMA. In questa peculiare situazione clinica l’MR si può verificare precocemente
per rottura di uno dei muscoli papillari o di corde tendinee con conseguente scompenso cardiaco acuto. Senza entrare nel dettaglio specifico, in quanto questo argomento
verrà ripreso nel Capitolo 14, è importante sottolineare come la visualizzazione diretta
di un’insufficienza mitralica severa associata all’immagine di una porzione di muscolo
papillare che fluttua in atrio sinistro assieme al lembo valvolare consensuale è diagnostica in senso assoluto. L’ecocardiografia assume un ruolo fondamentale nella diagnosi
della disfunzione valvolare mitralica sia in acuto sia nei pazienti con patologia valvolare preesistente. In particolare l’approccio transesofageo consente una valutazione anatomica completa dell’apparato valvolare mitralico con visualizzazione dei lembi valvolari, dell’anello e dell’apparato sottovalvolare con corde tendinee e muscoli papillari, e
funzionale con riferimento al movimento dei lembi valvolari e al flusso transmitralico.
L’ETE studia inoltre l’anatomia e la funzione del VS permettendo non soltanto la diagnosi del vizio valvolare, ma anche di comprendere la fisiopatologia del danno. Rimandando a un testo di ecocardiografia la dissertazione sulla tecnica ecocardiografica e
CAPITOLO 11 L’ecocardiografia
245
sulla nomenclatura delle varie proiezioni in accordo con le linee guida, in questo contesto si ricorda che le proiezioni ETE utili allo studio della VM sono le ME 4 camere, 5
camere, commissurale a 60°, 2 camere (90°) e LAX AV a 120° e le due proiezioni TG
medio-valvolari (0°) e 2 camere a 90° e la deep TG.
Ecocardiografia nel paziente settico
Il paziente settico, in particolare se presenta un quadro di shock settico, è per definizione
emodinamicamente instabile ed estremamente impegnativo da un punto di vista della
gestione clinica. In ambito cardiochirurgico, la sepsi rappresenta una sfida importante
per l’intensivista in quanto questi pazienti sono spesso portatori di protesi valvolari e/o
vascolari la cui infezione è di difficile trattamento e risoluzione clinica.
Si è già sottolineato come l’ecocardiografia rivesta il doppio ruolo di strumento diagnostico e di monitoraggio emodinamico. Questo ne giustifica l’indubbio valore nella
gestione clinica del paziente settico dove l’eco, in entrambe le sue modalità transtoracica
e transesofagea, permette sia una valutazione della funzionalità cardiaca, spesso depressa nelle gravi forme di shock settico, sia del profilo emodinamico, così da guidare le strategie terapeutiche e di riempimento volemico. Particolarmente utili a tale proposito
sono gli indici di riempimento sia statici sia dinamici di cui si è già parlato nel paragrafo
sul paziente ipovolemico.
La valutazione ecocardiografica del paziente settico è fondamentale nella fase iniziale di inquadramento diagnostico. È noto che nel 35-50% dei pazienti settici è presente una fase iniziale ipocinetica caratterizzata da una disfunzione ventricolare sinistra con riduzione degli indici sistolici e del CI (Figura 11.20). Anche la funzione del
VD può deprimersi in corso di sepsi sia per la miocardiodepressione propria di questa
patologia, sia per un aumento del postcarico, come nei pazienti in ventilazione
Figura 11.20
Shock settico: quadro di bassa portata con CI depresso e ridotta SvO2.
246
Parte I La gestione della fase acuta
meccanica. Nel paziente settico, soprattutto se portatore di protesi valvolari o se affetto
da disfunzione delle valvole native, non bisogna trascurare la possibilità che il quadro
settico sia conseguente a un’endocardite. l’ETE ha una sensibilità decisamente maggiore (90-100%) dell’ETT nel riconoscimento delle vegetazioni sugli apparati valvolari
sia nativi sia protesici e ha una notevole specificità (88-100%).
La tipica lesione dell’endocardite batterica è la vegetazione che si forma sul versante a
bassa pressione delle valvole cardiache, cioè l’atriale nelle atrioventricolari e il ventricolare nelle semilunari (Figura 11.21). La presenza di vegetazioni sui lembi valvolari è un
criterio diagnostico assolutamente specifico per l’endocardite e assume anche un valore
prognostico significativo in quanto le loro dimensioni e mobilità sono strettamente correlate al rischio di embolizzazione.
Nonostante non ci sia ancora pieno accordo tra gli autori sul rapporto tra dimensioni delle
vegetazioni e rischio embolico, numerosi studi hanno dimostrato che vegetazioni più
grandi di 10 mm sono correlate a un maggiore rischio di embolizzazione specialmente se
collocate sulla valvola mitrale. È noto che l’evento embolico aumenta fino al 25% il tasso
di mortalità dell’endocardite infettiva.
L’ETE è in grado anche di riconoscere la presenza di eventuali complicazioni dell’endocardite quali l’ascesso perivalvolare, la perforazione, la rottura o l’estensione del processo
a strutture adiacenti non valvolari. Inoltre l’eco valuta il grado di lesione valvolare e l’eventuale presenza di rigurgito valvolare (Figura 11.22). Nella valutazione ETE dell’endocardite possono incorrere sia falsi postivi sia falsi negativi. I primi sono generalmente
dovuti a lesioni valvolari che possono essere scambiate per vegetazioni (corpi di Lambl,
strati di fibrina ecc.) o alla presenza di artefatti dovuti alle protesi valvolari. I falsi negativi sono correlati alla mancata visualizzazione delle vegetazioni, più frequente nelle
fasi iniziali dell’endocardite, per pregressa embolizzazione o per ombra acustica.
Il valore predittivo negativo dell’ETE è circa del 98%, così che un esame negativo
non è sufficiente a escludere con certezza la diagnosi in caso di forte sospetto clinico
per endocardite. In tali circostanze, l’esame deve essere ripetuto dopo 7-10 giorni. A
causa dell’alta sensibilità e del forte valore predittivo negativo, l’ETE è considerata uno
Figura 11.21
Immagine di endocardite valvolare aortica.
CAPITOLO 11 L’ecocardiografia
247
Figura 11.22
Insufficienza mitralica da endocardite: si osservi l’origine del jet dalla perforazione del
lembo anteriore della mitrale.
strumento essenziale nella diagnosi e nel trattamento dell’endocardite nei pazienti
settici in UTI.
Ecocardiografia nell’arresto
cardiorespiratorio
Una situazione clinica particolare, in cui l’ecocardiografia può assumere un ruolo
molto importante, è quella del paziente in arresto cardiorespiratorio. Si tratta di una
condizione estrema in cui l’immediata attuazione delle manovre di rianimazione
cardiopolmonare (RCP) costituisce il trattamento prioritario per garantire una
perfusione tissutale adeguata.
Nel paziente cardiochirurgico le cause di arresto cardiopolmonare sono spesso
riconducibili alla patologia cardiaca di base o sono strettamente correlate alla procedura chirurgica a cui è stato sottoposto e alle sue eventuali complicanze. L’ecocardiografia assume in queste condizioni un ruolo determinante nel riconoscere la presenza
di patologie acute (IMA, embolia polmonare, dissezione aortica, tamponamento cardiaco, grave ipovolemia) che possono essere suscettibili di trattamento immediato con
possibilità di ripresa delle funzioni vitali.
In corso di rianimazione cardiopolmonare, l’ecocardiografia, valutando la funzionalità cardiaca, permette inoltre di investigare quadri in cui è presente attività elettrica in
assenza di polso (PEA) e di monitorizzare sia l’efficacia delle manovre rianimatorie sia
l’eventuale ripresa della contrattilità. Essa permette di valutare la risposta alla terapia
intrapresa e allo stesso tempo consente di confermare o escludere il sospetto diagnostico. Sebbene l’ETT sia l’approccio più diretto e immediato, l’ETE rappresenta uno
strumento diagnostico migliore in caso di arresto cardiopolmonare perché non richiede l’interruzione delle manovre rianimatorie come necessario per la modalità transto-
248
Parte I La gestione della fase acuta
Tabella 11.4 Informazioni fornite dall’ecocardiografia durante RCP
Reperto TEE
Diagnosi
Movimento sistolico di parete presente
Circolazione presente
Asistolia, PEA, altro ritmo
Cuore fermo
Ridotta FAC o FE
Insufficienza ventricolare
Cinetica di parete presente, assenza di polso,
ritmo regolare
Pseudo-PEA
Assenza di cinetica di parete presente, assenza
di polso, ritmo regolare
PEA
Ventricolo ipercontrattile, EDA ridotta
Ipovolemia
Dilatazione VD
Sospetta embolia polmonare
Tamponamento cardiaco
Tamponamento cardiaco
EDA: area ventricolare telediastolica. FAC: fractional area change. FE: frazione di eiezione. PEA: pulses electric
activity. RCP: rianimazione cardiopolmonare. TEE: ecocardiografia transesofagea. VD: ventricolo destro.
racica in cui bisogna appoggiare la sonda sul torace. Per questo motivo, soprattutto nei
casi in cui la rianimazione si protrae a lungo o in cui ci sia il forte sospetto diagnostico
di una patologia reversibile per cui è necessaria una diagnosi rapida e precisa, l’impiego dell’ETE è, a parere dell’Autore, particolarmente indicato.
In caso di arresto cardiopolmonare, la capacità di fornire in tempo reale informazioni dettagliate sul cuore e sulla presenza di condizioni che alterano la funzione cardiaca
fino alla sua completa abolizione rende l’ecocardiografia particolarmente utile alla
gestione dell’emergenza (Tabella 11.4). Per questo motivo, negli ultimi anni l’impiego
dell’ecocardiografia si è esteso anche ai reparti di emergenza e in area critica non specificamente cardiochirurgia. È comunque opportuno sottolineare che durante RCP
l’ETE ha decisamente un valore aggiuntivo rispetto all’ETT per i motivi sopra citati e
che quindi l’impiego di questa metodica richiede un training appropriato per potere
acquisire e soprattutto interpretare correttamente le informazioni ottenute. A questo
proposito è auspicabile che un numero sempre maggiore di intensivisti e rianimatori si
avvicini a questa tecnica. Si desidera concludere questo paragrafo sottolineando quanto sia importante e utile visualizzare direttamente il cuore valutandone anatomia e
funzione durante la RCP invece di affidarsi ai soli parametri emodinamici che sono
spesso di difficile reperimento e interpretazione in questi casi.
Conclusioni
L’ecocardiografia è uno strumento diagnostico che, integrando le informazioni morfofunzionali sulle strutture cardiache con i parametri emodinamici direttamente ricavati
dalla metodica stessa, diventa un presidio insostituibile in area critica e, in particolare,
in area critica cardiochirurgica. Il tradizionale monitoraggio emodinamico fornisce
una serie di parametri più o meno suggestivi di disfunzione cardiaca (CO ridotta, pressioni di riempimento elevate ecc.), con i quali però non è assolutamente possibile fare
diagnosi. L’ecocardiografia, esplorando la morfologia e la funzione cardiaca, permette
CAPITOLO 11 L’ecocardiografia
249
di diagnosticare con certezza la patologia cardiaca in atto. In un paziente gravemente
ipoteso e con segni di shock, come già più volte sottolineato, è fondamentale una diagnosi rapida e precisa per potere approntare l’adeguato trattamento terapeutico in tempi brevi. In assenza di una causa evidente della sindrome clinica (emorragia in atto, aritmia maligna, evidenza elettrocardiografia ed enzimatica di infarto miocardico acuto), e
comunque sempre di fronte a un dubbio clinico, l’ecocardiografia permette di raccogliere in tempo reale, direttamente al letto del malato e in modo semi-invasivo, tutte le
informazioni necessarie alla diagnosi.
Poiché in ambito cardiochirurgico le principali cause di instabilità emodinamica
grave sono riconducibili a una disfunzione cardiaca acuta (sinistra e/o destra), al tamponamento cardiaco, alle complicanze meccaniche dell’IMA (rottura di muscolo papillare, rottura di cuore, insufficienza mitralica acuta ecc.), alla dissezione aortica, all’embolia polmonare e alla sindrome da ostruzione dinamica dell’efflusso ventricolare sinistro, l’ecocardiografia gioca un ruolo determinante nella diagnosi immediata di tali
patologie. Nonostante l’evidente valore dell’ecocardiografia come strumento diagnostico in area critica, non bisogna dimenticare che questa metodica ha comunque dei
limiti che sono sia tecnici sia legati alla dipendenza dall’operatore. Generalmente, nel
paziente critico il primo approccio ecocardiografico è quello transtoracico per la semplicità di esecuzione e per la totale mancanza di invasività. È ben noto che il paziente
ricoverato in UTI ha spesso una “cattiva finestra” ecocardiografica per la presenza di
ferite e drenaggi chirurgici e per la ventilazione meccanica a cui è generalmente sottoposto. In tali condizioni l’ETE, in assenza di controindicazioni specifiche, è spesso la
soluzione del problema.
È importante sottolineare che l’acquisizione di immagini ecocardiografiche e la
quantificazione “ecodinamica” devono essere effettuate da un operatore esperto in
grado di interpretare correttamente le informazioni ricavate, spesso in condizioni
fisiopatologiche difficili, dall’esame.
Letture consigliate
Achong N, Wahi S, Marwick TH. Evolution and outcome of diastolic dysfunction. Heart
2009;95:813-818.
Arques S et al. Usefulness of bedside tissue Doppler echocardiography and B-type natriuretici
peptide (BNP) in differentiating congestive heart failure from non cardiac causes of acute
dyspnea in elderly patients with a normal left ventricle ejection fraction and permanent, nonvalvular atrial fibrillation: insights from a prospective, monocenter study. Echocardiography
2007 May;24(5):499-507.
Arques S, Roux E, Luccioni R. Current clinical application of spectral tissue doppler echocardiography (E/E’ ratio) as noninvasive surrogate for left ventricular diastolic pressures in the diagnosis of of heart failure with preserved left ventricular systolic function. Cardiovasc Ultrasound
2007 Mar;26(5):16.
Blaivas M. Transesophageal echocardiography during cardiopulmonary arrest in the emergency
Department. Resuscitation 2008;78:135-140.
Bossone E et al. Prognostic role of transesophageal echocardiography in acute type A aortic
dissection. Am Heart J 2007;153(6):1013-1020.
Cerqueira MD et al. Standardized Myocardial Segmentation and Nomenclature for Tomographic
Imaging of the Heart A Statement for Healthcare Professionals From the Cardiac Imaging
Committee of the Council on Clinical Cardiology of the American Heart Association. Circulation 2002;105:539-542.
Cheitlin MD, Armstrong WF, Aurigemma GP, et al. ACC/AHA/ASE 2003 guideline update for the
clinical application of echocardiography: a report of the American College of Cardiology/Ameri-
250
Parte I La gestione della fase acuta
can Heart Association Task Force on Practice Guidelines (ACC/AHA/ASE Committee to Update
the 1997 Guidelines for the Clinical Application of Echocardiography). 2003. American College
of Cardiology Web Site.
Douglas PS, Khandheria B, Stainback RF et al. ACCF/ASE/ACEP/ASNC/SCAI/SCCT/SCMR 2007
appropriateness criteria for transthoracic and transesophageal echocardiography. J Am Coll
Cardiol 2007;vol. XX, no. X.
Guarracino F. Ecocardiografia transesofagea in area critica. Milano: Elsevier; 2008.
Guarracino F. Il monitoraggio emodinamico in area critica. Milano: Elsevier; 2009.
Guarracino F et al. Right ventricular failure: physiology and assessment. Minerva Anestesiol 2005
Jun;71(6):307-312.
Guidelines for the Echocardiographic Assessment of the Right Heart in Adults: A Report from the
American Society of Echocardiography. J Am Soc Echocardiogr 2010;23:685-713.
Huttemann E. Transoesophageal echocardiography in critical care. Minerva Anestesiol
2006;72:891-913.
Iglesias I. Intraoperative TEE Assessment During Mitral Valve Repair for Degenerative and Ischemic Mitral Valve Regurgitation. Semin Cardiothorac Vasc Anesth 2007;11:301.
Lang RM et al. Recommendations for Chamber Quantification: A Report from the American
Society of Echocardiography’s Guidelines and Standards Committee and the Chamber Quantification Writing Group, Developed in Conjunction with the European Association of Echocardiography, a Branch of the European Society of Cardiology. J Am Soc Echocardiogr
2005;18:1440-1463.
Slama M et al. Respiratory variations of aortic VTI: a new index of hypovolemia and fluid responsiveness. Am J Physiol Heart Circ Physiol 2002;283:H1729-H1733.
Vahanian A, et al. Guidelines on the management of valvular heart disease. The Task Force on the
Management of Valvular Heart Disease of the European Society of Cardiology. Eur Heart J
28:230–268.
The Task Force on the Management of Valvular Heart Disease of the European Society of Cardiology. European Heart Journal 2007;28:230-268.
van der Wouw PA et al. Diagnostic Accuracy of Transesophageal Echocardiography During Cardiopulmonary Resuscitation. J Am Coll Cardiol 1997;30(3):780-783.
Veillard-Baron A et al. Superior vena caval collapsibility as a gauge of volume status in ventilated
septic patients. Intensive Care Med 2004;30:1734-1739.
Wann S et al. Echocardiography in pericardial disease. J Am Soc Echoc 2008;21:7-13.