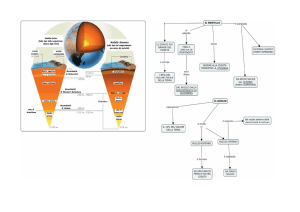
La mobilità degli elementi chimici
Gli ioni contenuti nella parte sinistra del diagramma sono quelli che in soluzione si
presentano sotto forma di cationi semplici. Gli ioni nella parte centrale del diagramma sono
quelli che formano idrossidi insolubili. Gli ioni nella parte destra del diagramma sono quelli
invece che diventano solubili grazie alla formazione di gruppi anionici complessi.
La mobilità geochimica di ogni singolo elemento e quindi
la sua ripartizione fra fasi fisse (matrici solide) e fasi mobili
la sua modalità di circolazione nelle acque naturali
la sua biodisponibilità
la composizione delle acque naturali
dipendono oltre che dalla composizione elementare e mineralogica delle rocce, dai fattori
interni intrinseci di ogni elemento (es.: z/r) da condizioni chimico-fisiche (T °C, pH, Eh, attività
delle specie disciolte), condizioni ambientali, e condizioni idro-dimamiche.
La mobilità dei singoli elementi chimici sarà inoltre da porre in relazione a
- formazioni di complessi chimici,
- fenomeni di assorbimento e scambio ionico con matrici solide (anche colloidi),
- processi di dissoluzione e precipitazione
- processi di attività biologica
Per esempio condizioni di pH e condizioni Redox (Eh) saranno determinanti per comprendere
la mobilità di elementi contraddistinti da numerosi stati di ossidazione (es. composti
contenenti ferro, composti contenenti zolfo).
Diagrammi Eh – pH
Sono fondamentali per
comprendere la speciazione di
molti elementi chimici e la loro
mobilità.
Questi diagrammi sintetizzano studi sperimentali di laboratorio in condizioni controllate
Questi diagrammi sintetizzano studi sperimentali di laboratorio in condizioni controllate
Nei processi di interazione acqua-roccia, gli elementi più mobili tenderanno a passare in
soluzione per primi, e nelle rocce alterate risulteranno impoveriti rispetto alle corrispondenti
rocce fresche.
Un approccio quantitativo si potrebbe avere guardando simultaneamente analisi chimiche di
una roccia e delle acque che in questa circolano...
In tale tabella le analisi sono difficili da comparare anche perchè sono espresse in ossidi per la
roccia e in ppm per l’acqua.... Tuttavia anche con tale approccio emerge che per esempio
l’alluminio è il meno mobile degli elementi presi in considerazione.
Una migliore comparazione della mobilità relativa dei vari elementi si può ottenere
analizzando composizioni chimiche delle rocce e del residuo fisso contenuto nelle acque
(entrambe le analisi sono espresse in ppm) che in queste circolano.
Da tale semplice tabella emerge che alcuni elementi vengono ripartiti preferenzialmente
nella fase fluida (es.: Ca, Na, F, B), mentre altri rimangono preferenzialmente nella matrice
solida (es. Al, Zn, Cu, Pb).
Stime quantitative della mobilità degli
elementi si potrebbero ottenere anche
confrontando la composizione chimica
di rocce fresche (es. colonna I
nell’esempio preso in esame) e dei
corrispettivi alterati (saprolite o
regolite; colonna III dell’esempio).
Una reale stima della mobilità
elementare (tesa a comprendere ciò
che è uscito dal sistema) durante il
processo di alterazione della roccia
fresca e della sua trasformazione in
saprolite (detto anche regolite) non
può essere tuttavia desunta con una
semplice differenza fra i valori riportati
in colonna I con quelli riportati in
colonna III.
E’ necessario tenere in considerazione che durante la trasformazione da roccia fresca a
saprolite vi è una generale perdita in peso (in quanto il sistema è aperto, e una
significativa quantità di materia è allontanata dal sistema).
Per cui, se idealmente immaginiamo che
l’analisi I è riferita a un volume di roccia pari a
100 g di materiale (contenenti in questo caso
71.48 g di SiO2, 14.61 g di Al2O3, 0.69g di Fe2O3
ecc ecc) l’analisi III non sarà più riferita a 100 g
di roccia bensì ad un volume inferiore. Quindi
nel saprolite che si è ottenuto da 100 g di
roccia fresca non avremmo 70.51 g di SiO2,
bensì 70.51 x un “coefficiente di perdita in
peso” (che sarà ovviamente minore di uno).
Roccia fresca
100
g
Analisi I
Saprolite
79.4
g
Analisi II
Coeff Perdita in peso = 14.61/18.4=0.794
I grammi di SiO2, Fe2O3, FeO, MgO (ecc.)
effettivamente rimasti nel sistema si otterranno
moltiplicando le concentrazioni della colonna II
per questo coefficiente (0.794) ottenendo i
contenuti riportati in colonna A. La differenza fra i
numeri di colonna I e quelli in colonna A mi
daranno le reali perdite in peso (a partire da 100
g) per ogni sostanza (colonna B). La colonna C mi
esprime dette perdite in % rispetto alla quantità
originale. Tutti gli ossidi, seppur in modo
differente, tendono a diminuire ad eccezion fatta
per l’alluminio (di cui si è assunta a priori
l’immobilità) del Fe2O3 (che aumenta a causa
dell’ossidazione) e della quantità di H2O che
aumenta in quanto compaiono nel saprolite molti
minerali idrati non presenti nella paragenesi
mineralogica iniziale.
Roccia fresca
100
g
Analisi I
Saprolite
79.4
g
Analisi II
Coeff Perdita in peso = 14.61/18.4=0.794
Un’idea generale della mobilità elementare e del chimismo delle acque di una
determinata regione potrebbe essere fornita da un grafico come questo in cui
vengono riportati i risultati di migliaia di analisi con curve di frequenza cumulativa
delle concentrazioni dei distinti elementi.
Se oltre alla composizione della acque, in
una certa regione sono note anche le
composizioni delle rocce madri e dei
sedimenti da queste prodottisi si potrebbe
fare un grafico simile
In tale diagramma si pùo notare che diversi
elementi hanno diverso comportamento e
quindi diversa mobilità nei processi
supergenici. Esistono elementi come Si, Al,
Fe fra i maggiori e Ti, Mn, V, Co, Ni fra i
minori che sembrano non avere affinità per
la fase fluida. Tali elementi nei processi di
alterazione tendono evidentemente a
concentrarsi in fasi secondarie di
neoformazione. Altri elementi (es. Ca, Mg,
Na, K, B, C, S) tendono invece ad entrare
preferenzialmente in soluzione e sono quindi
estremamente più mobili.
Esistono anche elementi a comportamento
intermedio.
Nel valutare la mobilità degli elementi, è interessante notare come varia la
composizione delle acque al variare della loro conducibilità elettrica (collegata alla
quantità totale di sali in esse disciolte). Tale grafico è stato preparato
dall’elaborazione di migliaia di analisi chimiche di acque della nostra penisola.
Si evincono diversi gradi di mobilità fra le sostanze prese in considerazione. Alcuni di questi componenti molto importanti
nelle acque a bassa salinità sembrano non aumentare particolarmente nelle acque più salate. Ciò è probabilmente significa
che vengono raggiunte le condizioni di saturazione di alcune fasi solide che contengono tali elementi, che precipitando
tamponano un loro ulteriore aumento in soluzione.
In generale si osserva che passando da acque a bassa salinità ad acque più salate vi è una graduale trasformazione da
acque Carbonato-alcalino terrose a acque clorurate alcaline.
Studi sulla mobilità elementare sono di notevole importanza per studiare contaminazioni
in atto.
Studi sulla mobilità elementare durante una
contaminazione in atto richiedono che le analisi
geochimiche vengano elaborate.
Modelli di diffusione delle sostanze inquinanti possono
delineare l’entità della problematica, e permettere di
sviluppare e prevedere scenari futuri.