Biologia molecolare 2/ed
Robert F. Weaver
Copyright © 2009 – The McGraw-Hill Companies srl
Capitolo 7 Gli operoni: il controllo fine della trascrizione nei
procarioti
Per il ripasso
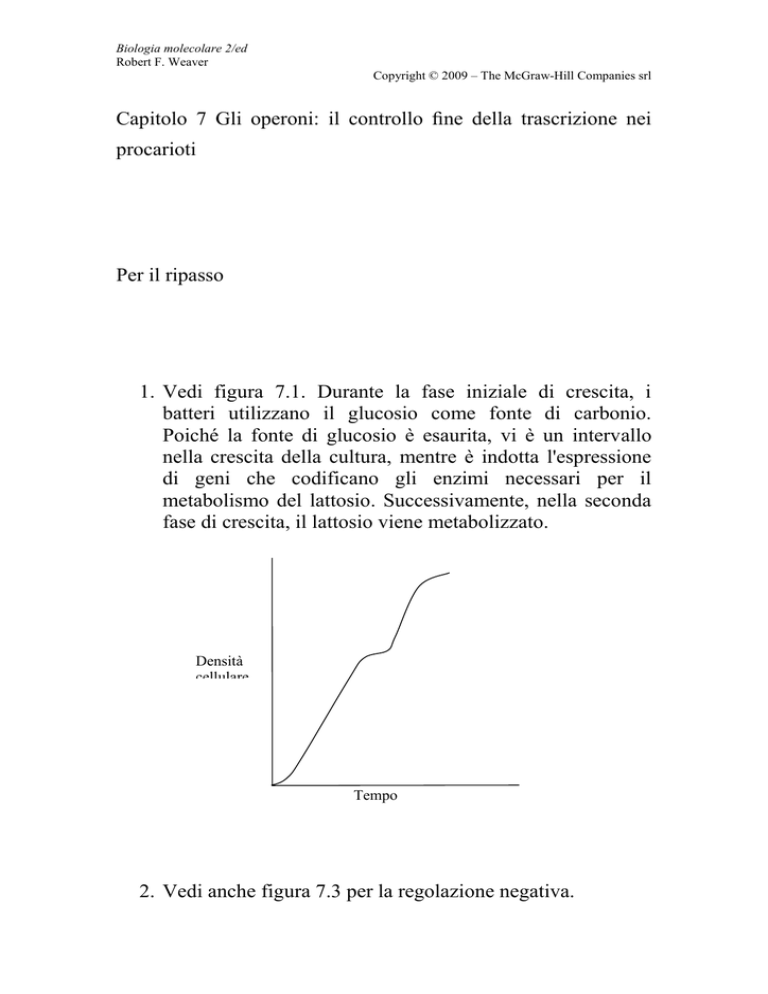
1. Vedi figura 7.1. Durante la fase iniziale di crescita, i
batteri utilizzano il glucosio come fonte di carbonio.
Poiché la fonte di glucosio è esaurita, vi è un intervallo
nella crescita della cultura, mentre è indotta l'espressione
di geni che codificano gli enzimi necessari per il
metabolismo del lattosio. Successivamente, nella seconda
fase di crescita, il lattosio viene metabolizzato.
Densità
cellulare
Tempo
2. Vedi anche figura 7.3 per la regolazione negativa.
Biologia molecolare 2/ed
Robert F. Weaver
Copyright © 2009 – The McGraw-Hill Companies srl
Regolazione negativa
negativanegativ
-lattosio
a
Trascrizione assente
X
lacI
promotore
lacZ
lacY
lacA
Tetramero
del
repressore
Monomero di
repressore
+ lattosio
operatore
La trascrizione procede
POL
promotore
L’induttore
allolattosio
operatore
lacZ
lacY
lacA
Biologia molecolare 2/ed
Robert F. Weaver
Copyright © 2009 – The McGraw-Hill Companies srl
Regolazione Positiva
La trascrizione
highglucose
glucose
low
X
ATP
cAMP
ATP
cAMP
+
catabolite
catabolite
CAP
activator
CAP
activator
protein,
CAP
protein, CAP
no transcription
procede
X
POL
promoter
promotore
operator
operatore
lacZ
lacZ
lacY
lacY
glucosio basso- proteina attivatrice del catabolismo CAPglucosio alto- proteina attivatrice del catabolismo CAPpromotore-operatore
3. La β-galattosidasi è un enzima che idrolizza il legame βgalattosidico nel dissaccaride, il lattosio, in modo da ottenere
zuccheri semplici, glucosio e galattosio. La galattoside permeasi
è un enzima necessario per il trasporto di lattosio in E. coli.
4. Entrambi i controlli negativi e positivi del lac operon di E.
coli permettono di utilizzare le fonti di carbonio a
disposizione con la massima efficienza. Al fine di attivare
il lac operon, due condizioni ambientali devono essere
soddisfatte. In primo luogo, il lattosio deve essere presente
ed il sistema di controllo negativo del lac operon richiede
lattosio per essere de-represso. In questo modo si evita di
sintetizzare gli enzimi per metabolizzare la fonte di
carbonio che non è presente. La seconda condizione
ambientale che deve essere soddisfatta per l'espressione
dei geni del lac operon, è che il glucosio non deve essere
presente. Bassi livelli di glucosio attivano un percorso di
regolamentazione che induce l'espressione dei geni
lacA
lacA
Biologia molecolare 2/ed
Robert F. Weaver
Copyright © 2009 – The McGraw-Hill Companies srl
necessari per il metabolismo del lattosio. In questo modo
si garantisce che, se sia il glucosio e il lattosio sono
disponibili, i batteri utilizzeranno la fonte di carbonio più
efficiente, vale a dire il glucosio.
5. Fai riferimento ai contenuti online 7.1. I saggi di binding
utilizzando un filtro di nitrocellulosa con DNA dell’operatore
lac marcato insieme al repressore purificato, possono essere
utilizzati per dimostrare che il sito dell’operatore lac è il
responsabile del sito di legame per il repressore. In questi
esperimenti, il DNA dell’operatore marcato è legato alla
crescente quantità di repressore e che la miscela viene fatta
passare attraverso un filtro di nitrocellulosa. Solo il DNA legato
alle proteine è trattenuto sul filtro e ci aspettiamo che i dati
mostrano una maggiore quantità di DNA marcato all’aumentare
della concentrazione del repressore. Il grafico sottostante illustra
il previsto aumento dei complessi DNA-repressore in presenza
di un aumento del repressore e dimostra anche come il DNA
diventi limitante quando le curve raggiungono il plateau. Come
controllo in questo esperimento, si può testare la capacità del lac
operon di legare il repressore in presenza di un induttore
artificiale (IPTG). Potremo predire che in presenza
dell’induttore il repressore non sarà in grado di legare
l'operatore. I predetti risultati vengono visualizzati nella figura
sottostante.
DNA marcato trattenuto sul filtro
Concentrazione del repressore
Per verificare che sia l'operatore a cui il repressore è legato, in
questi esperimenti, si può utilizzare un mutante (OC)
dell’operatore, la cui attività costitutiva suggerisce che esso
abbia una ridotta affinità per il repressore. C’è bisogno di una
concentrazione notevolmente più elevata di repressore per
raggiungere la massima capacità di legame con l’operatore
mutato. Così, quello che viene geneticamente definito come
l'operatore è realmente il sito di legame per il repressore.
Biologia molecolare 2/ed
Robert F. Weaver
Copyright © 2009 – The McGraw-Hill Companies srl
5. Fai riferimento ai contenuti online 7.2. Il seguente
esperimento può essere utilizzato per mostrare che l'RNA
polimerasi può legarsi al promotore lac anche in presenza
del repressore. Incubiamo DNA contenente il promotore
lac con il repressore e consentire al repressore di legare
l'operatore. Abbiamo poi aggiunto induttore e rifampicina.
La rifampicina inibisce la formazione del complesso
aperto del promotore, ma non inibisce la trascrizione da un
complesso aperto del promotore. Potremo predire che, se
la formazione di un complesso aperto del promotore
richiede il rilascio del repressore dall’operatore, la
trascrizione non si verificherebbe quando la rifampicina
viene aggiunta dal momento che il complesso aperto del
promotore non si formerebbe in presenza dell’antibiotico.
Se, tuttavia, l'RNA polimerasi era già legata ad un
complesso aperto del promotore prima del rilascio del
repressore, l’aggiunta di rifampicina non pregiudicherebbe
la trascrizione quando aggiunta con il repressore così come
descritto. In un esperimento di questo tipo ci si
aspetterebbe di osservare la trascrizione dopo l'aggiunta di
induttore e di rifampicina, sostenendo l'ipotesi che l'RNA
polimerasi può legarsi al promotore lac in presenza del
repressore.
6. Fai riferimento ai contenuti online 7.3. Studi di cinetica in
vitro possono essere utilizzati per dimostrare che il
repressore lac impedisce all’RNA polimerasi di legare il
lac operon. In un esperimento di questo tipo, un promotore
lac è incubato con l’RNA polimerasi in presenza di un
analogo dell’UTP contrassegnato con un γ-fosfato
fluorescente. Il rilascio di pirofosfato fluorescente può
essere usato per calcolare il tasso di trascrizione abortivo.
La trascrizione abortiva è il risultato di legami ripetuti di
una polimerasi ad uno stampo e la produzione di brevi
frammenti di oligonucleotidi. In un esperimento come
questo, se aggiungiamo eparina, il tasso di formazione di
trascritti abortivi diminuisce perché l’eparina legherà la
Biologia molecolare 2/ed
Robert F. Weaver
Copyright © 2009 – The McGraw-Hill Companies srl
polimerasi e si staccherà dallo stampo. Possiamo
ipotizzare che, se il repressore interferisce con il rebinding della polimerasi al lac operon, l’aggiunta del
repressore per il saggio può anche tradursi in una riduzione
del tasso di trascrizione abortivo. Come controllo negativo
si esegue il test in assenza di DNA stampo. Il grafico
seguente mostra i risultati attesi. La pendenza delle linee ci
dà il tasso di trascrizione abortiva dopo l'aggiunta di
eparina e dopo l'aggiunta del repressore. Come previsto,
l'eparina compete con il promotore per il legame della
polimerasi portando ad una diminuzione nella formazione
dei trascritti abortivi. Allo stesso modo, la diminuzione
osservata nel tasso di formazione di trascritti abortive,
dopo l'aggiunta di repressore è consistente con
l’interferenza dap arte del repressore con il legame della
polimerasi al promotore.
Intensità della fluorescenza
Tempo (sec)
Nessuna aggiunta
+ Eparina
+ Repressore
Senza DNA
8. Fai riferimento ai contenuti online 7.5. Studi di costrutti di
mutanti lac in cui uno o più operatori sono stati rimossi, sono
Biologia molecolare 2/ed
Robert F. Weaver
Copyright © 2009 – The McGraw-Hill Companies srl
stati utilizzati per dimostrare che tutte e tre gli operatori lac sono
necessari per la totale repressione. Müller-Hill et al. utilizzarono
il fago λ per introdurre i costrutti mutanti in ceppi di E. coli
mancanti del gene lacZ, e dosando il grado di repressione nell’E.
coli lisogeno. La repressione in presenza di ogni gene introdotto
dal costrutto è stata misurata confrontando l’attività della βgalattosidasi in presenza e in assenza dell’induttore IPTG.
Mutare l'uno o l'altro degli operatori ausiliari ha mostrato scarso
effetto sulla repressione. Tuttavia, la rimozione di entrambi gli
operatori ausiliari ha determinato una diminuzione della
repressione di 50-volte.
9. Un comodo test che ci permette di misurare la stimolazione
dell’attività β-galattosidasica con l'aggiunta di cAMP, è stato
sviluppato da Zubay e collaboratori. Un estratto cellulare di E.
coli è disponibile per misurare l’attività β-galattosidasica
dell'estratto dopo l'aggiunta di diverse quantità di cAMP. Una
stimolazione dell’attività β-galattosidasica dopo l’aggiunta di
AMP ciclico, è in linea con la presenza di una proteina, la CAP
(proteina attivatrice dei cataboliti), nell'estratto che dopo il
legame con l’AMP ciclico attiva il lac operon. Esistono mutanti
di E. coli con una proteina CAP a ridotta affinità per l’AMP
ciclico. Siamo in grado di utilizzare estratti cellulari da questi
mutanti di E. coli e misurare l'attività β-galattosidasica in questi
estratti dopo l'aggiunta di quantità crescenti di AMP ciclico.
Potremo prevedere che, a causa della CAP mutata presente negli
estratti cellulari, potremo osservare una diminuzione dell’attività
β-galattosidasica da parte dell’AMP ciclico. I dati attesi sono
riportati nella figura sottostante.
ATTENZIONE!!!!!MANCA LA FIGURA SOTTOSTANTE!!!!
10. Il complesso CAP-cAMP funziona in diversi modi per
attivare la trascrizione dal promotore lac. In primo luogo, il
complesso CAP-cAMP stimola indirettamente la formazione di
un complesso aperto del promotore. Ciò è dovuto al fatto che
viene stimolata la formazione di complessi chiusi del promotore
Biologia molecolare 2/ed
Robert F. Weaver
Copyright © 2009 – The McGraw-Hill Companies srl
che aumentano la possibilità di formare complessi aperti. Il
complesso CAP-cAMP riduce anche l’inefficiente inizio di
trascrizione che si verifica ad un sito alternativo del promotore,
P2, all’interno del lac operon. Questo ha l'effetto di aumentare
la disponibilità di molecole di RNA polimerasi per la
formazione di complessi aperti del promotore a livello del
promotore P1, che è il sito più efficiente per il legame alla
polimerasi. Una volta legato al sito attivatore a monte del sito di
legame della polimerasi, il complesso CAP-cAMP interagisce
direttamente con l'RNA polimerasi. In particolare, la Regione
Attivatrice I (ARI) del CAP-cAMP interagisce con il dominio
carbossi-terminale della subunità α dell’RNA polimerasi I (αCTD) (figura 7.19). L'interazione tra ARI e α-CTD conduce al
legame cooperativo della RNA polimerasi al promotore. Infine,
il complesso CAP-cAMP curva il suo DNA per il legame e
questo stimola la trascrizione facilitando le interazioni con
l'RNA polimerasi.
11. Vedere la Figura 7.11. Il seguente esperimento di
elettroforesi può essere utilizzato per dimostrare che il legame
del complesso CAP-cAMP al promotore lac piega la molecola
di DNA. In un esperimento di questo tipo si potrebbe
approfittare del fatto che un frammento di DNA piegato avrà
una minore mobilità elettroforetica. La posizione della curva
influenzerà la mobilità su gel. In altre parole, due molecole
proteiche delle stesse dimensioni legate allo stesso pezzo di
DNA, differiranno nella loro mobilità a seconda di dove la
proteina lega il DNA. Una proteina legata al centro influenzerà
la mobilità maggiormente che se fosse legata lateralmente.
Possiamo usare la digestione con gli enzimi di restrizione per
generare frammenti di DNA della stessa dimensione, che
contengono tutti i siti di legame per il complesso CAP-cAMP in
posizioni diverse, ma conosciute. Vorremmo quindi legare il
complesso CAP-cAMP al DNA e prevedere quale frammento di
DNA avrà la mobilità più bassa. Ci aspettiamo che, quando il
sito di legame si trova nel centro del frammento la mobilità sarà
più bassa e in saggi, utilizzando costrutti che presentano il sito
Biologia molecolare 2/ed
Robert F. Weaver
Copyright © 2009 – The McGraw-Hill Companies srl
di legame lontano dal centro, vedremo una diminuzione della
mobilità causata dalla sua distanza dal centro del frammento di
DNA. Ci aspettiamo che il frammento di DNA con la mobilità
più bassa avrà il sito di legame per CAP-cAMP al centro del
frammento di DNA, sostenendo in tal modo l'ipotesi che il
legame del complesso CAP-cAMP al promotore lac piegherà la
molecola di DNA. La Figura 7.18 mostra che questa previsione
è stata confermata da un esperimento.
12. Vedere la Figura 7.10. La cristallografia a raggi X è stata
utilizzata per confermare la presenza di una piega nella
molecola di DNA a livello della regione del promotore lac in
risposta al legame del complesso CAP-cAMP.
13. Vedere la Figura 7.13. La repressione dell’operone
dell’arabinosio richiede il legame di AraC sia per il sito araO2
che per araI nell’ operone araBAD. Questi due siti di legame
sono separati da oltre 20.000 coppie di basi e l’ansa della
sequenza di DNA coinvolta è necessaria a queste proteine per
interagire tra loro. La loro interazione è subordinata al fatto di
essere allineati gli uni con gli altri sulla faccia corretta del DNA.
In altre parole, dopo che l’ansa si è formata ciascuno deve essere
su un lato dell’elica che gli permette di interagire. L’inserimento
di un frammento di DNA, che introduce uno o più giri interi
dell’elica, non interferirà con le interazioni proteina-proteina,
poiché non modificherà le loro posizioni sulla faccia del DNA.
D'altro canto, se un numero non-intero di giri sono stati
introdotti, tra i due siti di legame alle proteine, le proteine si
troveranno su facce diverse del DNA dopo la formazione del
cappio. L'interazione tra le proteine non può verificarsi in
quanto l’elica non può girare intorno per consentire alle proteine
di contattarsi l'un l'altra. Il diagramma sottostante illustra questo
fenomeno. Sulla sinistra del diagramma un numero intero di giri
dell’elica del DNA è stato introdotto tra i due siti di legame per
le proteine, e, sulla destra un numero non-intero di giri è stato
introdotto e, di conseguenza, le proteine non sono in grado di
interagire.
Biologia molecolare 2/ed
Robert F. Weaver
Copyright © 2009 – The McGraw-Hill Companies srl
Formazione dell’ansa
L’ansa non si forma
Questo avvolgimento non si verifica
14. Vedere Figura 7.14
-
Arabinosio
Biologia molecolare 2/ed
Robert F. Weaver
Copyright © 2009 – The McGraw-Hill Companies srl
+ Arabinosio
Ara C+ arabinosio
Trascrizione
15. Fai riferimento ai contenuti online 7.8. Al fine di dimostrare
che l’arabinosio può interrompere l’ansa di repressione formata
da AraC, possiamo usare l'elettroforesi per rilevare la
formazione dell’ansa in presenza e in assenza di arabinosio. Per
fare questo esperimento, si preparano "minicircoli" di DNA di
circa 400 coppie di basi che contengono I siti di araO2 e la araI
separati da 160 coppie di basi. Per rilevare la formazione
dell’ansa in questo costrutto possiamo approfittare del fatto che
la formazione di un’ansa in un pezzo di DNA superavvolto ne
aumenterà la mobilità elettroforetica. Vorremmo quindi marcare
tali minicircoli e incubarli in presenza e in assenza di arabinosio.
Sottoporremo quindi il DNA ad elettroforesi e ci aspetteremo di
vedere un aumento della mobilità del DNA in assenza di
arabinosio a causa della presenza dell’ansa di repressione.
Tuttavia, nel campione con arabinosio vedremo una mobilità
elettroforetica più bassa del DNA, perché l’arabinosio ha
ostacolato la formazione dell’ansa da repressione.
16. Fai riferimento ai contenuti online 7.8. Per dimostrare che
entrambi araO2 e araI sono coinvolti nella formazione dell’ansa
di repressione possiamo utilizzare I minicircoli usando i
costrutti mutati. Il principio alla base di questi esperimenti è il
seguente. Se la stabilità del circuito di repressione richiede il
legame di AraC per entrambi araO2 e araI, perturbando il
legame di AraC a uno di questi siti per mezzo di una mutazione
nella sequenza di DNA, si ridurrà la stabilità dell’ansa di
repressione. Vorremmo istituire l'esperimento nel modo
seguente. Vorremmo far legare AraC ai minicircoli marcati
contenenti sia I siti di legame selvatici, sia i siti di legame che
Biologia molecolare 2/ed
Robert F. Weaver
Copyright © 2009 – The McGraw-Hill Companies srl
trasportano una mutazione sul sito di legame araO2 o su
entrambi i siti araI. Poi aggiungiamo minicircoli selvatici non
marcati, eseguiamo l’elettroforesi, e misuriamo il tempo
impiegato dall’ansa di repressione per dissociarsi per metà.
Siamo in grado di misurare la perdita delle anse di repressione
marcate cercando una più bassa mobilità elettroforetica. Quanto
più rapidamente i complessi si dissociano, meno stabile, sarà la
repressione. Ci aspettiamo di osservare che I minicircoli con
mutazioni sul sito di legame araO2 o su entrambi i siti araI
sono più facilmente convertiti in circoli svolti rispetto a quelli
selvatici. Da ciò si può dedurre che entrambi I siti araO2 e ariI
sono necessari per la formazione dell’ansa da repressione.
17. Fai riferimento ai contenuti online 7.8. Per dimostrare che
rimuovendo l’arabinosio dalle anse di repressione si permette
loro di riformarle, potremo eseguire il seguente esperimento.
Potremo creare le anse di repressione come descritto in
precedenza e aggiungere arabinosio ad una serie di reazioni
prima di sottoporle ad elettroforesi. Potremo osservare una
diminuzione della mobilità del complesso di DNA che riflette
l’interruzione dell’ansa di repressione. Se poi prendiamo la
restante miscela di reazione e la diluiamo con tampone, staremo
effettivamente diminuendo la concentrazione di arabinosio ed
osserveremo il riformarsi dell’ansa di repressione su
elettroforesi.
18. Due sono gli esperimenti necessari per dimostrare che araI2
è importante nel legare AraC quando il DNA è nella forma
svolta ma non in quella avvolta. Il primo esperimento è stato
effettuato utilizzando la methylation interference. Il principio
alla base di questo approccio è che le regioni del DNA che
legano AraC e che sono importanti per la formazione delle anse
saranno inibite dal formare le anse quando sono metilate.
Pertanto, in una miscela di molecole di DNA parzialmente
metilate, che hanno formato anse dopo la metilazione, ci si
aspetterebbe che solo il DNA non metilato possa formare anse
in regioni critiche. Per eseguire questo esperimento dovremo
Biologia molecolare 2/ed
Robert F. Weaver
Copyright © 2009 – The McGraw-Hill Companies srl
metilare parzialmente i minicircoli di DNA in modo che, in
media, solo una base, o un piccolo numero di basi, per molecola
sono metilati. Possiamo poi aggiungere AraC per avvolgere il
DNA e separare il DNA avvolto da quello svolto. Se una
regione del DNA è responsabile dell’avvolgimento quando lega
AraC abbiamo selezionato in modo efficace contro le molecole
metilate in questa regione e ci aspettiamo di trovare solo
molecole avvolte che non sono state metilate su questo sito. Se
analizziamo i modelli di metilazione delle molecole avvolte
dopo questa parte di esperimento, ci aspettiamo di trovare le
basi di araI1 altamente metilate nel DNA svolto, ma non
metilate nel DNA avvolto. Tuttavia, se guardiamo alla
metilazione nella regione di araI2 sia nel DNA avvolto e nel
non avvolto troveremo DNA metilato in entrambi i campioni
indicando che AraC non contatta araI2 nella fase avvolta.
Vorremmo istituire un secondo esperimento (Figura 7.25) per
dimostrare che ara12 è importante nel legame AraC quando il
DNA si trova svolto. La chiave per questo esperimento è il gel
shift utilizzando minicircoli selvatici e mutanti di araI2. In
questo esperimento avremmo dovuto far legare AraC a
minicircoli selvatici e mutanti di araI2. Vorremmo poi rompere
l’ansa e linearizzare i circoli con un enzima di restrizione e
determinare se AraC è legato ad araI2 selvatico o mutante. Ci
aspettiamo di vedere una perdita di legame nel minicircolo nel
sito araI2. Questo ci dice che araI2 è necessario per il legame di
AraC nello stato svolto.
19. Vedere la Figura 7.16. I geni dell’operone del trp in cellule
di E. coli vengono inattivati in risposta ad elevate concentrazioni
di triptofano. Un modello per questo meccanismo di controllo
negativo è il seguente. Un monomero di aporepressore esiste
nella cellula e non ha alcuna affinità per l’operone trp a meno
che non sia associato ad un corepressore. Il triptofano è il
corepressore, e la sua associazione con l’aporepressore si
traduce in un cambiamento allosterico che consente la
formazione di un complesso attivo del repressore. Questo
complesso si lega all'operatore trp come dimero, reprimendo
Biologia molecolare 2/ed
Robert F. Weaver
Copyright © 2009 – The McGraw-Hill Companies srl
l'espressione di geni trp strutturali. Così, quando il triptofano è
abbondante nella cellula, i geni del trp operon sono repressi e
quando è scarso, l’operone è liberato dalla repressione.
20. Si vedano le figure 7.17 e 7.18. L’attenuazione nel trp
operon è facilitata da un attenuatore all’interno di una sequenza
leader a monte del primo gene strutturale nel trp operon.
L'attenuatore è composto da un invertita ripetuta nella sequenza
di DNA, seguita da una serie di T nel filamento non-stampo. In
presenza di triptofano, la molecola di RNA forma un cappio a
causa della auto-complementarità delle invertite ripetute. Il
tratto di U, che rende instabile le coppie di basi UA con lo
stampo, si combina con l’ansa per rendere l’ibrido trascritto/
stampo instabile. Ciò si traduce nella terminazione della
trascrizione e onseguente rilascio del trascritto.
21. La traduzione della regione leader del trp non può
continuare nei geni strutturali del trp a causa di una sequenza di
terminazione della traduzione, alla fine della sequenza leader del
trp.
22. Vedere la Figura 7.21. Quando il triptofano è scarso,
l'attenuazione dell’ operone del trp può essere ignorata, il che
consente l'espressione dei geni strutturali nell’operone. Il
controllo delle sequenze di DNA nella sequenza leader rivela
alcune caratteristiche che sono fondamentali per la capacità
della RNA polimerasi di aggirare la sequenza di attenuazione
quando triptofano livelli all'interno della cellula sono bassi.
Nella sequenza leader ci sono infatti due invertite ripete che
daranno origine ad un RNA contenente due regioni in grado
formare un’ansa a gomito. La seconda ansa a gomito a valle è
associato ad un tratto di U. Questo è l'attenuatore funzionale. La
prima ansa a gomito, a monte, non ha a se associato il tratto di
oligo ad U e non funziona da attenuatore. La sequenza leader
può formare un’ansa a gomito composta da una singola
ripetizione da ciascuna delle due anse a gomito. Quest’ansa
alternativa non è associata con un tratto di poli U, e quindi non
Biologia molecolare 2/ed
Robert F. Weaver
Copyright © 2009 – The McGraw-Hill Companies srl
porterà ad attenuazione. La formazione di quest’ansa alternativa
impedisce la formazione dell’ansa a valle necessaria per
l'attenuazione. La formazione del’ansa alternativa è favorita
quando il ribosoma temporeggia su due codoni triptofano a
monte delle invertite ripetute. Questa condizione di stallo si
verifica in situazioni in cui le concentrazioni di triptofano sono
basse. Così, quando il triptofano è limitante, la trascrizione può
procedere attraverso i geni strutturali.
23. Vedere la Figura 7.22. Un ribointerruttore è una sequenza di
RNA all'interno della 5'UTR di un mRNA che controlla la
sintesi o la traduzione di quell’RNA stesso. Questo risultato è
ottenuto grazie al legame di una piccola molecola, o ligando, ad
una specifica regione del ribointerruttore chiamata aptamero. Un
esempio è l’operone ribD di Baccillus subtilus. Un elemento
conservato, l’elemento RFN, lega il Flavin Mononucleotide
(FMN) un prodotto dell’ operone ribD. Si ritiene che il legame
dell’FMN
all’aptamero
provoca
un
cambiamento
conformazionale nell’elemento, con la conseguente formazione
di un terminatore. In questo modo il prodotto dell’operone
spegne la propria produzione.
24. La In-line probing è una tecnica che ci permette di sondare
la struttura di una molecola di RNA. Il taglio spontaneo di
molecole di RNA si verifica più facilmente in assenza di
struttura secondaria. Ciò è dovuto al fatto che l’idrolisi ha
bisogno di un raccordo a 180° tra l’attacco nucleofilo ed il suo
substrato, e che tale raccordo è impedito a causa di appaiamento
di basi in regioni di un RNA. Questo ci consente di visualizzare
le modifiche nella struttura secondaria che possono insorgere a
seguito di un legame di un ligando con il suo aptamero.
Separando i frammenti tagliati su un gel e osservando
un’impronta sulla lastra autoradiografica si permette la
visualizzazione di qualsiasi regione dell’RNA meno sensibile al
taglio. Questo è analogo ad un’impronta che si osserva in un
esperimento di DNase footprinting. Per fare un esperimento di
in-line probing, un frammento di RNA contenente l’aptamero è
Biologia molecolare 2/ed
Robert F. Weaver
Copyright © 2009 – The McGraw-Hill Companies srl
marcato e quindi incubato in presenza e in assenza del suo
ligando. Il pattern di taglio spontaneo è osservato tramite
elettroforesi ed autoradiografia. Una serie di frammenti sulla
lastra autoradiografica che mancano esclusivamente in presenza
del ligando suggeriscono che il ligando è legato a questo sito
nell’RNA inducendo un cambiamento nella sua struttura
secondaria.
Domande Analitiche
1)
Fenotipo in assenza di induttore
Fenotipo in presenza di induttore
Spiegazione
a) Tutti i geni sono selvatici quindi la funzione selvatica è
presente e la β-galattosidasi è prodotta solo per induzione.
b) L’allele Z- mutato è recessivo rispetto all’allele Z +.
L'enzima prodotto dal gene selvatico è sufficiente a fornire un
fenotipo selvatico.
c) L’allele I- mutato è recessivo rispetto all’allele I +. La
proteina di repressore prodotta dall’allele selvatico sarà
sufficiente per legare l'operatore in entrambi i geni. In altre
parole, la mutazione sarà complementata in trans dal singolo
allele selvatico.
d) L' allele Is mutato è dominante rispetto all’allele I +. Le
proteine di repressore prodotte dall’allele Is non sono in grado di
legare l’induttore che non può essere rilasciato dall’operatore. Il
repressore prodotto in merodiploidia conterrà subunità
dell’allele mutato, così come il selvatico. Questo renderà il
tetramero non funzionale e sarà permanentemente associato con
l'operatore.
Biologia molecolare 2/ed
Robert F. Weaver
Copyright © 2009 – The McGraw-Hill Companies srl
e) L'allele Oc mutato è dominante rispetto all’allele O +. L’
operatore mutato non è in grado di legare il repressore e quindi
produrrà proteine di β-galattosidasi costitutivamente nel suo
operone, indipendentemente dalla presenza o assenza di
induttore.
f) Dato che la mutazione Oc è nel promotore che controlla
l’espressione di un gene mutato lacZ, la mutazione del gene
lacZ "cancellerebbe" la mutazione Oc. L’allele Z- è epistatico
sull’allele Oc.
g) Poiché la mutazione Oc rende il promotore incapace di
impegnare il repressore, "cancellerebbe" il fenotipo dell’allele Is
che produce il repressore che non è in grado di legare
l'induttore. L'allele Oc è epistatico sull’allele Is e questo
operatore darà espressione costitutiva del gene della βgalattosidasi. L’operatore selvatico non sarà reprimibile perché
l'allele Is è dominante sull’allele I+ per le ragioni spiegate al
punto d. Tuttavia, dal momento che l'altra copia del gene lacZ
produce β-galattosidasi costitutivamente ci sarà β-galattosidasi
prodotta in presenza dell’induttore.
2. (a) Dato che il fenotipo del ceppo mutante # 1 è costitutivo
(l’induttore non è necessario per l'attività), il suo genotipo deve
contenere una mutazione sia nel gene I od O, cioè I- o Oc.
Pertanto, C (il gene mutato nel ceppo # 1) è sia I o O. Il mutante
# 2 è anche costitutivo, in modo che il suo genotipo è sia I- o
Oc. Pertanto, A è sia I che O. Finora sappiamo che A e C sono I
e O, ma non necessariamente in quest'ordine. Per eliminazione
ciò significa che B deve corrispondere a Z. Ora abbiamo
bisogno di determinare se A = I e C = O, o viceversa. Il fenotipo
del Mutante # 3 fornisce la risposta. Perché è costitutivo e la
forma mutante è dominante, C- deve essere Oc. Se si trattasse di
I-, l'altra possibilità costitutiva, la mutazione sarebbe stata
recessiva, e nessuna β-galattosidasi sarebbe stata prodotta in
assenza di induttore. Quindi A = I, B = Z, e C = O.
Biologia molecolare 2/ed
Robert F. Weaver
Copyright © 2009 – The McGraw-Hill Companies srl
(b) Il diploide parziale nella linea 4 non riesce a produrre βgalattosidasi, anche in presenza di induttore. Questa è il dato, la
mutazione (A-) è dominante, e A- deve pertanto essere Is.
D'altro canto, il fenotipo del ceppo in 5 è lo stesso di quello nel
ceppo selvatico. Pertanto, la mutazione (A-) nel genotipo del
ceppo indicato in 5 deve essere recessivo, cioè A- = I-.
Pertanto, i due genotipi sono:
IsO+Z+/I+O+Z+
I-O+Z+/I+O+Z+
3.
a. Cellule di E. coli con un operatore lac mutato che non è in
grado di legare il repressore, esprimerà i geni del lac operon
costitutivamente. In altre parole, i geni sono espressi in presenza
e in assenza di lattosio.
b. Cellule di E. coli con un repressore lac mutato che non può
legare l’operatore lac esprimerà i geni del del lac operon
costitutivamente. In altre parole, i geni sono espressi in presenza
e in assenza di lattosio.
c. Cellule di E. coli con un repressore lac mutato che non può
legare l’allolattosio non sarà in grado di esprimere i geni del lac
operon. Il legame all’allolattosio è richiesto per rilasciare il
repressore dall’operatore e senza che questo legame la derepressione non può avvenire. In altre parole, i geni saranno
repressi sia in presenza che in assenza di lattosio.
d. Un promotore lac che non può legare CAP ed AMP ciclico
non sarà in grado di attivare il promotore in risposta a bassi
livelli di glucosio e, quindi, indipendentemente dalla presenza
di lattosio, i geni dell’operone lac non saranno indotti.
4.
Biologia molecolare 2/ed
Robert F. Weaver
Copyright © 2009 – The McGraw-Hill Companies srl
a. Dal momento che questo operon controlla l’espressione dei
geni in un pathway anabolico ci si aspetterebbe che sia
reprimibile dallo stesso prodotto terminale del pathway cioè
fenilalanina. Questo evita inutili costi energetici di sintetizzare
fenilamina quando è abbondante nella cellula.
b. La breve cornice di lettura vicino al 5' finale è probabile che
contenga un attenuatore analogo a quello che si trova nell’
operone trp. Ci aspettiamo che la sequenza leader contenga
sequenze tipiche di un attenuatore. In particolare, esso contiene
una sequenza che permette all’RNA di formare un ansa a gomito
seguita da una serie di T nel filamento codificante risultante in
una serie di U nel filamento di RNA, dopo la separazione
dell’appaiamento di basi AU nella regione ibrida DNA / RNA.
Questa struttura porterà alla terminazione della trascrizione dei
geni dell’operone mentre la fenilalanina è abbondante.
Analogamente all’operone del trp, se la fenilalanina è scarsa, I
codoni della fenilalanina, prima della struttura ad ansa, causano
la pausa del ribosoma e prevengono la formazione di anse
associate con l'attenuatore. Così l’attenuazione è superata
quando trp è scarso.
c. Se codoni di fenilalanina sono stati modificati in codoni per
leucina l’operone sarebbe poi diventato sensibile ai livelli di
leucina piuttosto che di fenilalanina, e in presenza di scarse
concentrazioni di leucina, l’operone sarebbe stato in grado di
ignorare l'attenuazione. L'attenuatore avrebbe perso la sua
capacità di rispondere ai livelli di fenilalanina.
d. Questo tipo di regolazione è chiamato attenuazione e si
basa sul fatto che nei procarioti, una molecola di RNA può
avere un ribosoma legato mentre è ancora in fase di
trascrizione. Questo tipo di regolazione non è possibile negli
eucarioti in quanto la trascrizione e la traduzione sono
separati spazialmente e temporalmente.
Biologia molecolare 2/ed
Robert F. Weaver
Copyright © 2009 – The McGraw-Hill Companies srl
5. Un esperimento di in-line probing può essere utilizzato per
determinare se una molecola di mRNA, X, da E. coli contiene
un aptamero che lega una piccola molecola Y. In tale saggio,
potremo marcare una molecola X di mRNA ed incubarla in
presenza od in assenza di Y e consentirne il taglio spontaneo.
I prodotti sarebbero quindi sottoposti ad elettroforesi ed
autoradiografia. Le aree in cui le bande autoradiografiche
sono presenti, solo in assenza del putativo ligando Y, sono
quelle dove l’RNA ha subito un cambiamento
conformazionale risultante in una struttura secondaria che
impedisce il taglio spontaneo. Questo suggerisce che l'RNA
ha legato Y.


![mutazioni genetiche [al DNA] effetti evolutivi [fetali] effetti tardivi](http://s1.studylibit.com/store/data/004205334_1-d8ada56ee9f5184276979f04a9a248a9-300x300.png)







![(Microsoft PowerPoint - PCR.ppt [modalit\340 compatibilit\340])](http://s1.studylibit.com/store/data/001402582_1-53c8daabdc15032b8943ee23f0a14a13-300x300.png)

