INIBITORI DELLA DNA-TOPOISOMERASI
La topoisomerasi è un enzima deputato al rilassamento dei superavvolgimenti delle catene di DNA;
nelle cellule eucariotiche ne esistono due diversi tipi:
La topoisomerasi I è un monomero in grado di tagliare un singolo filamento del duplex di
DNA e non richiede cofattori energetici;
La topoisomerasi II al contrario agisce come dimero, taglia entrambe i filamenti del DNA ed
è ATP dipendente.
Tra i farmaci più utilizzati nella lotta contro il cancro rientrano tutta una serie di composti in grado
di formare un complesso ternario con il DNA e la topoisomerasi (stabilizzando quindi il cosiddetto
“cleavable complex”) e di ostacolare una fase specifica del processo catalitico che consiste nella
rigiunzione del DNA precedentemente tagliato.
I composti che inibiscono la topoisomerasi I agiscono principalmente durante la fase replicativa del
ciclo cellulare (fase S), invece le lesioni causate dagli inibitori della topoisomerasi II sono associate
alla fase di trascrizione dell’RNA ed avvengono quindi durante quasi tutto il ciclo cellulare (fase
G2/M).
Nelle cellule umane i due enzimi non sono espressi allo stesso modo: la topoisomerasi I è molto
abbondante nei tessuti tumorali del colon, invece la II predomina a livello della mammella e delle
ovaie. La figura 1 riporta i principali inibitori della topoisomerasi e suggerisce che anche alcuni tipi
di stress ossidativi, quali la produzione di perossido di idrogeno, possano agire in modo analogo,
stabilizzando il complesso e generando corpi apoptotici.
Figura 1: Inibitori della Topoisomerasi II (a sinistra) e della Topoisomerasi I (a destra)
Campotencina
Irinotecan
Topotecan
10,11-(etilendiossi)-7-[(Nmetilpiperazino)-metil]-20(S)camtpotencina.
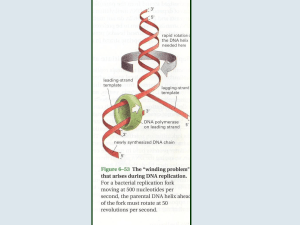
Le topoisomerasi esplicano la loro azione mediante un residuo tirosinico che da attacco nucleofilo
ad un fosfato della catena desossiribonucleica; il filamento di DNA resta ancorato all’enzima
mediante legame fosfotirosinico fin quando, eliminata la tensione dovuta ai superavvolgimenti, una
reazione inversa alla precedente ristabilirà il legame fosfodiesterico e libererà l’enzima.
Figura 2: Struttura cristallografica della Topoisomerasi I associata ad un frammento di DNA
La figura 2 rappresenta la struttura ricostruita mediante la tecnica di diffrazione di raggi X della
topoisomerasi I associata covalentemente ad un frammento di DNA di 22 paia di basi; l’enzima ha
una dimensione di circa 90 kD ed è composto da 4 domini principali: il dominio N-terminale (24
kD) fortemente carico, importante per l’interazione con le altre proteine nucleari ma non
strettamente necessario per il folding proteico, il dominio core (54 kD), il domino linker (7 kD)
carico positivamente, ed il domino C-terminle (6,3 kD) dove si trova il sito attivo con l’OH
serinico.
Questi diversi domini sono organizzati in due lobi che abbracciano e bloccano il duplex di DNA: un
lobo superiore costituito dal subdominio I e II del core, ed un lobo inferiore formato dal subdominio
III e dal dominio C-terminale.
Nel sito attivo dell’enzima vi sono dei residui amminoacidici fortemente conservati: due arginine
(488 e 590), un’istidina (His 632) ed una tirosina (tyr 723). Tutti questi residui sono posizionati
intorno al legame fosfodiesterico da scindere. Come già detto la rottura del singolo filamento di
DNA avviene per attacco nucleofilo dell’OH tirosinico. Sorprendentemente non c’è nessun residuo
amminoacidico abbastanza vicino in grado di agire da base per attivare l’ossigeno tirosinico;
probabilmente lo stato di transizione pentavalente è stabilizzato dalle due arginine mediante ponti
idrogeno e dal residuo istidinico che protona l’ossigeno in 5’ del gruppo uscente.
LA CAMPTOTNCINA
La Camptotencina è un alcaloide naturale estratto da piante come la Campoteca Acuminata, dotata
di forte attività antitumorale poiché in grado di stabilizzare il complesso DNA-topoisomerasi I
interferendo quindi con i comuni processi di disavvolgimento del materiale genetico.
Figura 3: L’alcaloide di origine vegetale Camptotencina
Redinbo et al. in passato hanno proposto un modello d’interazione secondo il quale la
Campotencina intercalandosi nel duplex di DNA si sovrappone parzialmente (con il suo C 7) al
residuo guaninico +1 della catena di DNA scissa mentre l’anello lattonico e l’ossidrile legato al
centro chirale 20(S) stabiliscono interazioni con i residui Arg 364, Asp 533 ed Asn 722 (Fig. 4).
Figura 4: Modello della Camptotencina intercalata nel complesso DNA-Topoisomerasi I
Questi ed altri studi hanno evidenziato che la parte della molecola in cui si trovano il lattone, il
piridone e l’idrossile 20(S) è di fondamentale importanza per la sua attività.
Purtroppo l’utilità clinica della campotencina è fortemente limitata dall’elevata tossicità e dalla
bassa solubilità; sono state quindi condotte molte ricerche con lo scopo di valutare i sostituenti
migliori da inserire sugli anelli A e B e si è arrivati alla sintesi dei tre derivati al momento più
utilizzati, ossia il Topotecan, l’Irinotecan ed il 10,11-(etilendiossi)-7-[(N-metilpiperazino)-metil]20(S)-camptotencina.
In seguito si è cercato di semplificare la struttura della camptotencina al fine di ridurne la tossicità,
ma tutti i composti tetraciclici, triciclici e biciclici risultavano completamente sprovvisti di attività
sia in vivo che in vitro.
Kurihara ed i suoi collaboratori hanno studiato a lungo gli analoghi della campotencina con l’anello
C aperto, concludendo che l’inattività di tali molecole fosse attribuibile alla mancanza di planarità.
Nella tabella di seguito riportata sono elencati tutta una serie di analoghi rigidi della campotencina, i
derivati oxodiidroindolidenici, ottenuti per sintesi chimica. Lavorando poi a temperature più elevate
tutti questi composti sono stati ulteriormente trasformati in derivati della campotencina carbossilati
nella posizione 7 in modo da confermare che l’attività riscontrata in vivo sia attribuibile
esclusivamente ai derivati oxodiidroindolidienici e non a tracce di contaminanti.
Tabella 1: Derivati oxodiidroindolidenici della Camptotencina e relativi valori di IC50
L’isomero S della camptotencina ha un IC50 approssimativamente di 0,7 µm, mentre l’isomero R è
essenzialmente inattivo.
Il composto 7 ha un IC50=5,8 µm e, analogamente a ciò che accade per la camptotencina, il suo
isomero S puro ha un valore di IC50 leggermente inferiore e l’isomero R è completamente inattivo;
tutto ciò è giustificato da uno stesso meccanismo d’azione.
Il fluoroderivato in posizione 5 ha IC50=1,2 e, come per gli altri derivati, l’isomero S è ancora più
attivo; il 5,6 difluoroderivato ha IC50 = 1,5 mentre il 5,6,7 trifluoroderivato è quasi inattivo.
Anche la sostituzione con un metile in posizione 5 porta ad un composto con buona attività.
Invece le sostituzioni in 6 riducono notevolmente l’attività rispetto agli analoghi non sostituiti;
probabilmente sono le costrizioni steriche a determinare le sostituzioni ottimali sull’anello A.
Figura 5: Sovrapposizione di un derivato della camptotencina (in giallo) con
il 6-fluoro-2-oxodiidroindolidene (in verde)
Il 6-fluoro-2-oxodiidroindolidene risulta essere il più attivo e presenta delle analogie con un noto
derivato della campotencina, il 9-ammino-10,11-(metilendioxi)campotencina. Infatti, come
mostrato in figura 5 l’ossigeno carbonilico sostituisce l’azoto chinolonico dell’anello B (agiscono
entrambi da basi di Lewis) e il fluoro si sovrappone perfettamente ad un ossigeno del sostituente
metilendiossi.
Nella tabella 2 sono infine riportati i derivati carbossilici: la campotencinica con la funzione acida
in 7 è circa tre volte meno attiva del farmaco non funzionalizzato. Da notare l’estere etilico con il
ponte etilendiossi in posizione 10,11 che ha un IC50=0,7.
Tabella 2: Derivati 7-carossilati della Camptotencina e relativi valori di IC50
REFERENCES
Matthw R Redinbo, James J Champoux and Wim GJ Hol: Structural insights the function of type IB
topoisomerase. Elsevier Science Ltd (1999)
Annette K. Larsen, Alexandre E. Escargueil and Andrzej Skladanowski: From DNA damage to G2
arrest: the many roles of topoisomerase II: Progress in cell cycle research, Vol 5, 295-300 (2003)
Karen Lackey, Jeffrey M. Besterman, Wade Fletcher, Peter Leitner, Bradley Morton and Daniel D.
Sternbach: Rigid analogs of camptothencin as DNA Topoisomerase I Inhaibitors. J. Med. Chem.
38, 906-911 (1995).


![mutazioni genetiche [al DNA] effetti evolutivi [fetali] effetti tardivi](http://s1.studylibit.com/store/data/004205334_1-d8ada56ee9f5184276979f04a9a248a9-300x300.png)


![(Microsoft PowerPoint - PCR.ppt [modalit\340 compatibilit\340])](http://s1.studylibit.com/store/data/001402582_1-53c8daabdc15032b8943ee23f0a14a13-300x300.png)