17 aprile 2003
prof. Romagnoli
Parliamo oggi di ematopoiesi.
Si è già parlato del sangue, dei corpuscoli del sangue, della loro struttura, del loro ruolo funzionale,
della loro durata di vita limitata nel circolo.
Questa durata di vita è di solo pochi giorni per i globuli bianchi: già dopo 48 ore che si ha la
mancanza di formazione di nuovi globuli bianchi si vedono i sintomi gravi di carenza di globuli
bianchi in circolo. Le piastrine durano un po’ di più. Se si smette di produrre nuove piastrine, gli
effetti si vedono dopo una settimana: il soggetto comincia a sanguinare e muore per emorragia. I
globuli rossi resistono di più: vivono quasi quattro mesi. Gli enterociti, le cellule dell’epitelio
intestinale vivono 48 ore. I globuli bianchi vivono un po’ di più: 2-3 giorni in circolo, ma poi
qualche altro giorno nei tessuti. Quindi, ci sono cellule che vivono meno dei globuli rossi. Però, se
si arriva oltre un certo periodo, si vedono i sintomi di carenza.
È necessario, quindi, che gli elementi del sangue vengano continuamente riprodotti e messi in
circolo.
E questo è il compito della ematopoiesi, o emopoiesi che dir si voglia, la quale è, in definitiva, la
produzione del sangue.
Nella vita post-natale la sede regina della ematopoiesi è il midollo osseo.
Abbiamo visto che dentro le cavità dell’osso c’è un tessuto morbido; ecco perché il nome di
midollo: è un tessuto lasso.
Istologicamente lo possiamo inquadrare nei connettivi reticolari tridimensionali, quelli con una
trama esile e delicata di fibre reticolari e ampi spazi tra queste fibre.
In questi spazi si vengono a trovare cellule capaci di proliferare, capaci di dare origine a tutti gli
elementi del sangue circolante ed anche, attraverso di loro, a elementi propri dei tessuti connettivi.
Se si guarda il midollo di individuo adulto, si vede che la maggior parte del midollo, quello che
occupa il canale delle diafisi di tutte le ossa lunghe. in realtà è a riposo sotto il profilo ematopoietico
1
e, praticamente, nelle maglie di questo connettivo reticolare crescono cellule adipose. Ci sono
pochissime cellule legate all’ematopoiesi. Ci sono prevalentemente cellule adipose. L’aspetto di
questo tessuto è giallognolo per la presenza del tessuto adiposo, tessuto adiposo giallo.
Invece, nelle cavità dell’osso spugnoso, quindi nella epifisi delle ossa lunghe, nelle ossa brevi, nelle
ossa piatte, si trova un midollo di aspetto rosso vivo. È midollo ematopoietico, impegnato
intensamente nella produzione di cellule del sangue. Ci sono in esso, quindi, anche tanti elementi
della serie rossa, cioè globuli rossi e loro progenitori, che sono responsabili del colore bello rosso di
questo midollo.
Quindi, si distingue tra midollo giallo e midollo rosso.
Quando si vuole studiare il midollo si va a prelevare proprio dalle ossa.
Un tempo, era molto usata la puntura dello sterno. Lo sterno è un osso piatto. Pungendolo di lato si
può estrarre midollo tra le due superfici corticali, esterna e interna, dello sterno, del corpo dello
sterno. Nell’operazione di prelievo, aspirando violentemente con l’ago, si rompe un po’ di trabecole
dell’osso spugnoso, che è delicatino, si aspira e viene giù midollo osseo.
Oggi, molto più usata è l’ala dell’ileo. Essa si presta anche a piccoli prelievi a tipo carotaggio, con
dei piccoli trapani che prendono una carotina di osseo: quindi, si può studiare il midollo osseo
anche nei suoi rapporti con l’ambiente in cui è inserito. La suddetta è anche la sede da cui si prende
midollo osseo nei casi di trapianto di midollo osseo. L’osso dell’anca è un osso piatto. C’è osso
rosso. È ben protetto. Non c’è il rischio, come altrove, di andare a pungere organi interni se si
sbaglia la mira, perché qui c’è un piano di protezione contro i visceri delicati dell’addome, né di
certo ci sono visceri come il cuore.
Cosa troviamo dentro il midollo osseo?
Innanzitutto, troviamo le cellule staminali ematopoietiche, le quali costituiscono una minoranza
delle cellule del midollo, ma pure si pongono all’inizio della storia.
Oggi si tende a chiamarle proprio così: cellule staminali ematopoietiche, stem cells.
Le cellule staminali danno origine a tutta la progenie delle cellule del sangue.
Il termine più antico era emocitoblasto, che qualcuno ancora usa, se non altro per affezione, perché
è stato proprio un italiano, il Perlata, colui che si è interessato all’argomento e ha partorito l’idea
che esista una cellula di questo tipo, capace proprio di dare origine a tutti gli elementi del sangue.
2
La vecchia dizione di emocitoblasta, in fondo, corrisponde come concetto a quella di cellula
staminale che l’ha sostituita più di recente.
Blasta è cellula che produce altre cellule o cellula che produce qualche cosa di esterno. Abbiamo,
per esempio, il fibroblasta, l’osteoblasta, ecc.
Blasta è anche la cellula progenitrice, quella poco matura di per sé, ma capace di dare origine a
tante altre cellule.
Quindi, come già detto, è un termine più antico, ma che ha in fondo la stessa valenza di quello di
cellula staminale, è un termine a questo molto simile.
Queste cellule staminali cosa fanno?
Vale il discorso fatto a suo tempo a proposito del compartimento germinativo, e del compartimento
germinativo di una zona staminale e di una zona di espansione. [E questo modello è stato partorito
proprio, tra l’altro, a partire dal midollo osseo.]
Questa cellula staminale prolifera e dà origine a nuove cellule staminali.
La prima cosa che deve fare, difatti, è riprodurre sé stessa.
Come detto, le cellule staminali si riproducono abbastanza lentamente e sono in grado di mantenere
la loro stessa popolazione per tutta la vita dell’individuo, e forse anche di più, se uno le trasferisce
in vitro.
Delle cellule figlie, però, alcune cominciano a prendere un’altra strada e si trasferiscono in un
diverso stadio. “Si trasferiscono” funzionalmente, non necessariamente morfologicamente (questo
magari dopo, come vedremo). Si trasferiscono in quello che è il compartimento di espansione.
Cioè, alcune delle cellule figlie della cellula staminale prendono un’altra strada, cominciano a
riprodursi vivacemente, quindi aumentano molto di numero, e, nello stesso tempo, cominciano
anche un percorso differenziativo.
Quindi, l’espansione numerica delle cellule e anche l’inizio dell’acquisizione di caratteri
differenziati vanno per un certo tempo di pari passo.
Cosa succede?
Succede che si formano, in prima battuta, due tipi di progenitrici.
Ci si potrebbe chiedere come hanno fatto a immaginarsi queste “cose strane”.
È bene vedere come brevemente, perché si capisca come certe idee maturino attraverso percorsi
spesso complessi e intricati.
3
I primi studi sono stati fatti su topini.
È possibile prendere un animale e trattarlo in maniera tale da distruggere completamente le cellule
del suo midollo osseo.
Si possono usare farmaci, che colpiscono le cellule proliferanti.
Si possono usare radiazioni ionizzanti.
Il metodo migliore impiega radiazioni ionizzanti a forti dosi.
Si può prendere l’animale, irradiarlo.
In questa maniera l’animale muore dopo pochi giorni di infezione e tutto quanto relativo.
I primi esperimenti si facevano, addirittura, mettendo in circolazione crociata un animale trattato e
un animale non trattato.
Si vedeva che elementi dall’animale non trattato andavano a ripopolare l’organismo dell’animale
trattato.
Questo non solo sopravviveva là dove era rifornito temporaneamente di sangue e, soprattutto, di
globuli bianchi dal donatore. Si poteva anche interrompere la circolazione crociata e l’animale
sopravviveva egualmente.
E poi, era possibile anche far proseguire normalmente l’esistenza dell’animale, di là
dall’esperimento in questione, sia pure con qualche cautela finché questo aveva pochi globuli
bianchi (andava tenuto in camere sterili, come si fa con gli uomini quando si esegue questo stesso
trattamento).
Se gli veniva infuso del midollo osseo, si vedeva che le cellule infuse andavano a ripopolare la
milza, oltre che, come atteso, il midollo osseo. Nel topo, difatti, per varie ragioni, questo processo
avveniva anche nella milza.
Cosa succedeva?
La milza è un organo che c’ha tanti globuli rossi, in maniera da apparire rossino.
C’ha anche delle zone bianchicce, perché ricche di cellule.
Ma quando si è irradiato il topo, le zone bianchicce spariscono e si riformano piccole macchioline
bianchicce solo se si fa questo trattamento, cioè se gli si iniettano elementi del midollo osseo.
Uno andava a guardare queste zone bianchicce, che sono colonie di cellule.
4
Si vedevano dei gruppettini di cellule dove c’erano globuli rossi, globuli bianchi, megacariociti (che
producono le piastrine). Si vedevano degli altri gruppi dove c’erano soltanto progenitori dei globuli
rossi. Si vedevano delle altre colonie di cellule dove c’erano soltanto progenitori dei globuli
bianchi.
Allora ecco l’idea.
Si immagina che ogni colonia derivi da un unico progenitore.
Da un lato, ci devono essere dei progenitori che possono fare colonie in cui si trova di tutto,
progenitori che, quindi, ancora possono dare origine a diversi tipi di discendenti, sino a formare
delle colonie dove si trovano cellule tutte d’un tipo.
Dall’altro lato, ci devono essere dei progenitori ormai specializzati per un certo tipo di discendenza.
Si ritiene che questi, nell’ordine logico e solito della vita di queste cellule, vengano dopo i
precedenti, se no non si potrebbe spiegare il risultato.
Più recentemente, studi analoghi si sono cominciati a fare anche in vitro.
Si sono trovati terreni di coltura adatti per il midollo osseo.
Oggi addirittura si comincia, manipolando i fattori di crescita e di stimolo aggiunti ai terreni di
coltura, anche a capire quali sono gli elementi, i fattori che regolano l’indirizzo verso una storia o
l’altra della vita di queste cellule.
Questo cenno storico spiega anche perché gli elementi progenitori delle varie cellule si trovano
indicati anche come unità formanti colonie.
Di base, difatti, questo è il nome che si dà a quella cellula che, impiantata nella milza di un topo
irradiato, oppure oggi anche coltivata in vitro, è in grado di formare una colonia, una unità con tutto
dentro.
La CFU, colony forming unit, è per spleen che nella milza forma una colonia dove c’è di tutto.
E poi ci sono le colony forming units E (eritrocitarie), le colony forming units di vario tipo, che poi
si rivedranno.
Una volta fatta questa piccola introduzione, molto sommaria, è bene precisare, così per inciso, che
una cosa del genere si può fare anche nell’uomo.
Quando si fa? La situazione favorita per fare di queste sperimentazioni è quando il paziente ha delle
malattie del midollo osseo, per esempio delle leucemie; e allora bisogna trattare con farmaci contro
le cellule proliferanti e con radiazioni ionizzanti, in dosi tali che per uccidere tutte le cellule
tumorali bisogna uccidere anche le cellule buone del midollo di questo soggetto.
5
Allora come si fa a farlo campare? Bisogna prendere qualche altro paziente, che sia sano e paziente,
prendergli un po’ di midollo osseo e iniettarlo al paziente trattato, in maniera che questo rigeneri e
ricostituisca tutto il suo midollo a partire dalle cellule donate. Si chiama trapianto di midollo osseo
ed è praticato in clinica: è un intervento certamente ancora oggi molto impegnativo, ad alto rischio
di insuccesso, che merita di essere fatto solo di fronte a malattie a loro volta ad altissimo rischio di
mortalità.
Allora, partiamo dalla cellula ematopoietica staminale.
Noi vediamo - vediamo attraverso questi esperimenti!: non è che li sappiamo riconoscere al
microscopio, questi elementi (sappiamo che ci sono perché ne vediamo i figli, ma non riusciamo a
riconoscere con precisione i genitori) – un progenitore detto mieloide e un progenitore detto
linfoide.
Perché questi termini?
Si erano accorti, gli istologi, nella prima metà del secolo scorso, che i linfociti, innanzitutto, hanno
un percorso di formazione, sviluppo, differenziamento, diverso da quello di tutte le altre cellule del
sangue e, inoltre, compiono parte del loro differenziamento (a quell’epoca si pensava tutto) in sedi
diverse dal midollo osseo. I granulociti, i monociti, i globuli rossi e le cellule da cui derivano le
piastrine compiono tutto il loro ciclo differenziativo, finché non passano in circolo, nel midollo
osseo e non ritornano, poi, a compiere altre tappe della loro vita nel midollo osseo stesso.
Ecco perché si parlava, e si può proseguire a parlare anche oggi:
di una ematopoiesi mieloide, che è quella caratteristica del midollo osseo, quindi quella che
porta alla formazione di globuli rossi, di globuli bianchi, esclusi i linfociti, e di progenitori
delle piastrine;
di una ematopoiesi linfoide, che è quella che porta alla produzione dei linfociti.
Lasciamo un attimo da parte il progenitore linfoide. Che cosa ne succede lo vedremo dopo.
Proseguiamo con il progenitore mieloide.
Da questo a un certo punto cominciano a derivare una serie di elementi, che cominciano a prendere
un indirizzo via via specifico.
Un elemento si differenzia verso i globuli rossi.
6
Si chiama serie la successione delle cellule dall’elemento progenitore fino all’elemento maturo e
ben differenziato.
Poniamoci, dunque, a livello della serie rossa.
Ci sono all’inizio degli elementi che noi non sappiamo riconoscere microscopicamente, ma
sappiamo che già si sono indirizzati, hanno indirizzato la loro famiglia (famiglia che verrà, visto che
ancora non c’è) verso la carriera di globuli rossi.
Lo sappiamo perché nella milza, come abbiamo visto, ci sono delle colonie fatte solo da elementi
rossi.
Sappiamo che questo elemento progenitore è caratterizzato già dall’essere sensibile a certi fattori di
stimolo che promuovono la formazione di globuli rossi.
A un certo punto, cammina cammina lungo questa serie rossa, quindi generazione cellulare dopo
generazione cellulare, cominciano, altre cellule, a non essere più così anonime (piccole cellule…
tre nucleoli… citoplasma basofilo… chissà che cellula è!!?: così sono non solo i linfociti che hanno
ancora i nucleoli, ma anche i progenitori molto precoci che non sappiamo riconoscere).
Cominciano ad acquistare delle stigmate morfologiche caratteristiche, che ci fanno capire che ormai
siamo di fronte a un elemento che sta dando luogo alla generazione dei globuli rossi.
E quindi arriviamo ad elementi morfologicamente riconoscibili.
Una delle cose che si richiedono agli studenti è di saper riconoscere questi progenitori identificabili,
di cui tra poco si parlerà.
Una serie è, dunque, questa serie rossa.
Un altro elemento progenitore è una CFU, una colony forming unit, una cellula che, impiantata
nella milza, genera granulociti neutrofili (i granulociti per eccellenza, perché sono i più numerosi) e
monociti.
Da questa poi si differenziano due elementi: un elemento che, non direttamente, ma attraverso una
serie di tappe intermedie, riconoscibile al microscopio, diventa un granulocita neutrofilo ( cellula
polimorfonucleata); un altro elemento che diventa un monocita.
Nello stesso modo si formano cellule che prendono il cammino verso il granulocita eosinofilo e
verso il granulocita basofilo.
7
Vedremo come esistano delle chiare similitudini nelle tappe di sviluppo dei vari tipi di granulociti.
A questa similitudine morfologica corrisponde però un percorso distinto e separato: cioè, da
precursori mieloidi si staccano: un elemento che, dopo una serie di tappe in cui ancora non è
riconoscibile, comincia a mostrare i segni del differenziamento basofilo, specializzato per questo;
un altro elemento per l’eosinofilo; un altro elemento che prima rimane in grado di fare sia neutrofili
sia monociti e poi convince alcune delle sue cellule a diventare granulociti.
Analogamente, ci sono elementi che diventano megacariociti, e daranno poi origine alle piastrine.
I megacariociti sono delle grosse cellule da cui derivano le piastrine, come vedremo tra poco.
Dalla cellula staminale pluripotente, si arriva alla cellula staminale mieloide e alla cellula
staminale linfoide.
Sulla serie linfoide ci torneremo sopra.
La serie mieloide.
Elementi, cellule diverse si preparano al differenziamento.
-
Una che sa fare tutto.
-
Una che va verso gli elementi della serie rossa.
-
Una che va verso il megacariocita, la cellula che dà origine alle piastrine, dette anche
trombociti.
-
Una che va verso granulociti neutrofili e monociti.
-
Una eosinofila.
-
Una basofila.
C’è tutta una serie di fattori di crescita, una serie di molecole regolative che, agendo con
meccanismo recettoriale, stimolano la proliferazione e il differenziamento di questi elementi.
Non c’è da sapere, evidentemente, quali sono queste molecole.
Quello che è importante richiamare all’attenzione è semplicemente che si cominciano a conoscere,
tramite gli esperimenti in vitro di cui si diceva, quali sono i fattori importanti nei vari passaggi.
Una si conosce sicuramente, giacché fa notizia. È quella che dagli elementi progenitori dei globuli
rossi stimola poi lo sviluppo dei globuli rossi stessi. In sigla di parla di EPO, che sta per
eritropoietina (“poieo” faccio, quindi la poietina è una cosa che fa fare; “eritro” globuli rossi).
Invale il cattivo vezzo, nel mondo sportivo, di farsi trattare con eritropoietina per aumentare il
numero di globuli rossi circolanti, così da aumentare la capacità di trasporto dell’ossigeno,
8
aumentare la capacità di lavoro aerobico. Qual è il rischio? Il problema basilare è che la dimensione
dei vasi non cresce al crescere della concentrazione di globuli rossi nel sangue, cosicché i vasi
corrono il rischio di vedersi intasati: un sangue troppo ricco di globuli rossi diventa molto viscoso e
con facilità, passando soprattutto nelle vene, dove il circolo è lento, dove il flusso sanguigno è più
lento, può coagulare dentro ai vasi, fino addirittura a portare a morte il soggetto.
Analogamente, si conoscono fattori delle altre poietine.
Cosa dobbiamo considerare adesso?
Brevemente, le varie linee.
La serie rossa si caratterizza a partire dal primo elemento visibile.
Il primo elemento che sappiamo riconoscere della serie rossa lo chiamiamo proeritroblasto.
E’ una cellula abbastanza grande.
È da tener presente che il midollo osseo si colora come si colora il sangue, con le stesse miscele.
E si va a colori per individuare le caratteristiche cellulari.
-
Il proeritroblasto è una cellula relativamente grande, sui 12 micron circa di diametro (10-12
micron).
-
C’ha il citoplasma basofilo, delicatamente basofilo.
-
Ha il nucleo grande, rotondo, con la cromatina molto fine.
-
Quindi, presenta una trama cromatinica fine.
-
Mostra più di un nucleolo, due-tre nucleoli.
Poi, dopo il proeritroblasto, compaiono gli eritroblasti.
Gli eritroblasti si caratterizzano perché:
-
diventano di dimensioni via via minori;
-
all’inizio della loro storia hanno un aumento della basofilia citoplasmatica;
-
poi, pian piano, diventano invece col citoplasma acidofilo.
E’ una cosa che aveva colpito l’attenzione, questa della cellula basofila di partenza che, pur
dovendo arrivare a una cellula acidofila, cominciava il suo processo di differenziamento col
divenire ancora più basofila.
9
Il Serrata, ematologo italiano, si pose il problema, che invero pareva definire una situazione
paradossale, nota proprio come paradosso del Serrata.
Oggi sappiamo perché tutto questo accade.
Questa cellula, per produrre emoglobina, ha bisogno di ribosomi e, quindi, la prima cosa che fa è
aumentare i ribosomi di cui dispone. Ecco dunque che aumenta la basofilia citoplasmatica.
In questa maniera può sintetizzare emoglobina. L’emoglobina è acidofila. Pian piano, così, il
citoplasma arricchito della nuova molecola cambia colore.
È interrotta la sintesi e invece si accumula il prodotto.
-
L’altra caratteristica degli eritroblaasti è che perdono il nucleolo.
-
La cromatina si comincia ad aggregare in zolle grossolane, che pigliano un colore
particolarmente brillante, diventano viola cupo. Si parla di aspetto laccato della cromatina,
nelle comuni colorazioni del sangue.
Quindi, ci troviamo di fronte a modificazioni del nucleo e a modificazioni del citoplasma.
In base al progressivo diminuire delle dimensioni e alle caratteristiche del citoplasma si parla:
di un eritroblasto basofilo, col citoplasma bello blu intenso;
di un eritroblasto policromatofilo, col citoplasma in cui chiazze blu si alternano a
chiazze rosa, acidofile, visto il rosa proprio dell’eosina, oppure il colore viene una via di
mezzo tra le due tinte;
di un eritroblasto acidofilo.
eritroblasto basofilo citoplasma blu, basofilo.
eritroblasto policromatofilo (”poli” vuol dire più, “croma” colore, quindi che ha affinità per più
colori) citoplasma mezzo rosa mezzo blu, oppure un mélange, una via di mezzo tra rosa e blu
eritroblasto acidofilo, detto anche ortocromatico (“ortòs” vuol dire diritto, giusto)
citoplasma ormai del colore giusto, del colore giusto del globulo rosso.
E infine, si arriva al globulo rosso.
Fino ad ora, giacché si è parlato della cromatina, è evidente ci fosse anche il nucleo.
10
I progenitori dei globuli rossi devono avere il nucleo. In caso contrario, non potrebbero tirare fuori
le istruzioni per sintetizzare l’emoglobina, non potrebbero dividersi ed espandersi.
Fino all’eritroblasto, e sicuramente al policromatofilo, questo nucleo è dunque presente.
Nell’acidofilo a volte non si capisce bene. Certo è che anche a livello di quest’ultimo eritroblasto, di
può osservare che le cellule si dividono, proseguendo ad aumentare di numero: per questo,
naturalmente, è necessaria la presenza del nucleo.
Allo stadio di eritroblasto acidofilo, al nucleo viene dato lo sfratto.
Innanzitutto, si ha un addensamento del nucleo.
E poi, questo nucleo, intero oppure frammentato in piccoli pezzi, va a finire a ridosso della
membrana.
Qui si stacca dalla superficie della cellula una specie di gemma, che contiene pochissimo
citoplasma e il nucleo, il quale si perde e se ne va.
La cellula, così, alla fine, rimane priva di nucleo e di organuli.
In fondo, questi processi di degenerazione del nucleo, di gemmazione del citoplasma, ricordano un
po’ quanto descritto a proposito dell’apoptosi, quando una cellula deve morire.
Evidentemente, gli stessi meccanismi sono usati sia quando la cellula deve morire e farsi tutta a
pezzi, sia quando la cellula non deve morire, ma deve egualmente eliminare il nucleo. In
quest’ultimo caso, difatti, per allontanarlo deve sfruttare alcuni meccanismi in tutto simili a quelli
propri dell’apoptosi
.
Quindi, a livello della serie rossa, dopo la fase di differenziamento del proeritroblasto, troviamo
nell’ordine: eritroblasto basofilo, eritroblasto policromatofilo, eritroblasto acidofilo, globulo rosso.
Nelle prime fasi di vita, il globulo rosso è maturo e messo in circolo.
Nel midollo osseo, i capillari sanguigni presentano cellule endoteliali che si lasciano staccare
facilmente l’una dall’altra per far passare gli elementi che devono poi andare in circolo.
Ci deve essere un sistema di colloquio tra le cellule endoteliali e gli elementi del midollo, perché
solo le cellule mature possono passare in circolo, quindi possono dare un segnale alle cellule
endoteliali perché si stacchino e lascino loro spazio per passare.
Addirittura, a volte sembra che le cellule endoteliali possano formare come dei canali attraverso il
citoplasma, così da permettere, da favorire il passaggio degli elementi maturi.
11
Gli elementi immaturi normali in circolo non passano. Quindi, ci deve essere un sistema di arresto.
C’è da ricordare che il globulo rosso appena formato mantiene un po’ di ribosomi dentro. C’ha un
po’ di tracce ancora che sta finendo di consumare. Se noi prendiamo il sangue fresco, senza prima
fissarlo, e lo mescoliamo con un particolare colorante basico che si chiama blu brillante di cresile,
questo po’ di ribosomi precipitano, quindi riescono a formare una specie di reticolato dentro il
globulo rosso basofilo, un reticolato che si vede. Per questa rete basofila nel citoplasma, questi
globuli rossi giovani sono chiamati reticolociti.
Essi rappresentano poco meno dell’1% delle cellule. Questa percentuale torna. Un globulo rosso
vive circa 120 giorni. Il reticolocita rimane tale circa 24 ore, poi perde questo materiale che lo
contraddistingue. E quindi, ogni globulo rosso passa circa un centoventesimo della sua vita come
reticolocita. Su tutti i globuli rossi che in un momento sono in circolo, un centoventesimo saranno
quelli formati nell’ultimo giorno, saranno reticolociti (0.8 per mille circa).
I numeri visti costituiscono un dato interessante, perché in certe malattie del sangue può diventare
importante andarli a contare.
I reticolociti non si vedono se non si cercano. Bisogna prendere il sangue fresco, mescolarlo subito
col colorante, e fare lo striscio subito dopo per andare a vedere queste cellule. Diversamente, esse
non si possono contare. Va fatta la ricerca quando si fa il prelievo. A prelievo finito non si ha più il
tempo per procedere.
Vi dico subito anche le caratteristiche della serie bianca, quella ben studiata è la serie dei
granulociti, quella che porta alla formazione dei granulociti: neutrofilo, eosinofilo, basofilo.
Il primo elemento che vediamo lo chiamiamo mieloblasto.
Il mieloblasto rassomiglia al proeritroblasto.
È una cellula a 12, anche a 14 μm di diametro.
È una cellula grande.
Ha nucleo rotondo.
Presenta più d’un nucleolo.
Ha citoplasma delicatamente basofilo.
Allora la differenza dov’è?
La differenza è che il mielocita ha nel citoplasma tutta una serie di granuli azzurrofili: ha già
cominciato a sintetizzare e produrre enzimi lisosomiali e a formare una serie di lisosomi – lisosomi
12
che contengono solo enzimi, corrispondono al vecchio concetto di lisosoma primario – di
dimensioni tali da essere visibili al microscopio ottico come granuli di un colore rosso venoso.
Questo colore rosso venoso, nelle comuni colorazioni per il sangue, viene (fuori) solo se si usano
nella miscela colorante dei particolari coloranti basici che si chiamano azzurres.
Ecco perché sono detti azzurrofili, questi granuli: perché prendono l’azzurre e diventano viola (non
rimangono blu).
A un certo punto, cosa succede?
Questi mieloblasti son tutti uguali.
Il mieloblasto è anonimo: non sappiamo assolutamente che tipo di granulocita diventerà.
A un certo punto, in una zona di queste cellule, cominciano a comparire dei granuli specifici:
neutrofili, eosinofili, oppure basofili.
In quale zona?
Dove c’è il golgi, perché i granuli specifici vengono formati attraverso la serie reticolo
endoplasmatico-apparato di Golgi.
C’è una particolarità interessante: è stato visto che mentre i granuli azzurrofili gemmano dalla
faccia trans del Golgi, i granuli specifici sembrano gemmare dalla faccia cis del golgi.
Per ora questo dato è stato riportato più volte e mai contraddetto.
Quindi avrebbero un percorso un po’ particolare: avrebbero un breve soggiorno nel golgi le
molecole che ci sono qui.
Di fatto, quello che importa dal punto di vista morfologico è che noi vediamo che in una zona del
citoplasma vengono a mancare i granuli azzurrofili e invece compaiono i granuli basofili (?!?
“specifici”??).
Il nucleo vede diminuire il numero dei nucleoli e si fa un po’ a barchetta, cioè diventa un nucleo
praticamente semisferico.
Il citoplasma è più abbondante dalla parte dove il nucleo è piatto ed è proprio qui che si trova
l’apparato del Golgi ed è proprio qui che cominciano a comparire i garnuli specifici.
Questo elemento si chiama promielocita.
Promielocita, che potremo a questo punto distinguere in promielocita neutrofilo, promielocita
eosinofilo, promielocita basofilo, perché vediamo i granuli specifici di vario aspetto.
La tappa successiva qual è?
Questa cellula si riempie di garnuli specifici: non stanno più solo vicino al nucleo, nella zona del
Golgi, ma tutta la cellula si riempie di granuli specifici, mentre diminuiscono, perché non se ne
formano più e si dividono (visto che le cellule continuano a dividersi), e quindi i granuli azzurrofili
precostituiti si ripartiscono tra le cellule figlie.
13
Diminuiscono i granuli azzurrofili e la cellula si riempie tutta di granuli specifici.
Il nucleo mantiene le caratteristiche che si dicevano.
Questo sarà chiamato mielocita.
L’ultimo stadio qual è?
Il nucleo si deforma.
Sappiamo che i granulociti hanno il nucleo polilobato, poco o molto, ma polilobato.
Ebbene, la prima deformazione è quella del nucleo a ferro di cavallo.
A ferro di cavallo perché appare come una C molto marcata, stretta e con una curva proprio di
almeno 180°.
La tappa successiva è l’intaccatura del nucleo proprio a formare due lobi.
A questo punto il granulocita può anche passare in circolo.
In condizioni di estremo stimolo del midollo, per esempio infezioni importanti, anche i
metamielociti possono passare in circolo.
Elementi più immaturi normali non passano in circolo.
Se uno vede in circolo un promielocita, porta iella, perché significa che questa è una cellula che
non è più sotto i meccanismi di controllo che regolano il passaggio in circolo, significa che quindi
è fuori delle possibilità di controllo dell’organismo, è una cellula tumorale che fa quel che le pare.
Quindi, il mieloblasto: solo granuli azzurrofili.
I mielociti: granuli specifici.
Il promielocita: tanti granuli azzurrofili e pochi granuli specifici.
Il mielocita: granuli specifici dappertutto nel citoplasma.
Il metamielocita: come il precedente e il nucleo a ferro di cavolo.
Segnatevi questi aspetti schematici.
Il midollo osseo è un campo difficilissimo.
Cosa vi chiediamo noi? Di sapere lo schema, e la logica che c’è dietro, perché questa è alla base per
capire le potenzialità rigenerative, le potenzialità terapeutiche, tutto quel che succede nel bene e nel
male nel midollo osseo. Vi chiediamo di conoscere gli elementi identificativi delle varie serie, nella
14
maniera schematica che si è vista. Rimangono fuori i monoliti e i megacariociti, di cui si parlerà
comunque tra breve. Vi chiediamo, se vedete uno striscio di midollo, di sapere identificare quelle
cellule – e magari vi diciamo quali sono noi – che sono con le stimmate molto chiare, cioè
chiaramente identificabili. Per il resto, a meno di non essere specialisti, è molto difficile parlare
degli altri elementi presenti.
Quindi, il senso dello studio non deve essere che voi siate in grado di interpretare un qualsiasi
striscio di midollo. Ma di dimostrare, identificando quelle cellule che hanno i segni molto chiari di
quali sono, di conoscere lo schema di evoluzione di queste cellule.
Cosa voglio dirvi? Intanto, questo era lo schema che mi premeva. Vi aggiungo un altro dato. Vi ho
detto che proeritroblasti, eritroblasti, mieloblasti, promielociti, mielociti, metamielociti non devono
mai passare in circolo. Guai, trovarli: è segno che qualcosa di grosso è sfasato in queste cellule e nei
loro rapporti con i capillari del midollo.
Non è così per le cellule staminali. Le cellule staminali sono delle cellule vagabonde. Vedrete
quando farete embriologia che ce l’hanno nel sangue, per giocare un po’ con le parole, perché si
formano in una certa zona dell’embrione, poi migrano in un’altra zona dell’embrione attraverso i
vasi sanguigni, poi, quando al terzo mese, comincia a formarsi tessuto osseo, migrano dentro alle
cavità dell’osso per formare tessuto osseo. Quindi, è nella loro storia: quella di spostarsi usando il
circolo sanguigno. E noi, un tempo non si sapeva, ma ora sappiamo che nel nostro sangue circolante
qualche cellula staminale… pochissime, sono una non so quante migliaia di globuli bianchi, quindi
sono pochissime. Passano in circolo. Noi non le riconosciamo. La morfologia ricorda quella dei
linfociti. Per cui, a voler sapere se una cellula fatta a linfocita in realtà è una cellula staminale,
dovresti metterla in coltura e vedere cosa sa fare. Però, sappiamo, proprio dal fatto che dal sangue
periferico, se uno lo mette in coltura, si riesce a tirar fuori di tutto, che esistono delle cellule
staminali circolanti. Cosa ci dice questo? Ci dice che le cellule staminali, di suo, possono
attraversare la barriera midollare, ci dice che possono andare in circolo, e poi… poi non le
ritroviamo mica in altri tessuti!, le cellule staminali midollari. Quindi, significa che ritornano nel
midollo osseo. Devono avere delle molecole di membrana che riconoscono altre molecole di
membrana sui capillari del midollo osseo, e permettono loro di ritornare a casa (homing, dicono gli
anglosassoni). Il ritorno a casa nel midollo, dunque, si basa sul riconoscimento specifico tra
molecole di membrana della cellula che è in circolo e molecole di membrana dei capillari del
distretto dove farà ritorno.
Questo ci spiega anche una cosa. Quando noi facciamo il trapianto di rene, bisogna riattaccare il
rene dov’era. O da qualche altra parte, ma insomma sempre collegato con tutti i suoi tubicini, com’è
nell’organismo di partenza. Quando facciamo il trapianto di cuore o di fegato: lo stesso. Quando si
15
fa il trapianto di midollo, non è che si va a rimettere le cellule dentro le ossa! Si iniettano in circolo.
Si prende il midollo del donatore e si inietta, come fosse una trasfusione di sangue, si mette in
circolo. Ci pensano da sole, le cellule staminali, a trovare dove andare a stare. Non hanno bisogno
che ce le mettiamo noi. Da sole: hanno i recettori per riconoscere i capillari del midollo osseo, e
uscire dal circolo lì, e piazzarsi lì, senza bisogno di altre indicazioni. Questo tenetelo presente.
Vedrete, chi di voi si interesserà alla problematica, che addirittura è possibile, con certi stimoli, con
certi farmaci, aumentare il numero di cellule staminali in circolo per certi scopi terapeutici.
Quindi, le cellule staminali paradossalmente possono trovarsi in circolo, una minima quantità. Poi,
come si sa, si invecchia, più si invecchia meno si ha voglia di andare a spasso. Succede anche alle
cellule staminali. Nel feto ne troviamo tante in circolo. Nel bambino ancora ancora. Via via che
passano gli anni il numero diminuisce, e si stabilizza intorno alla vostra età. Questo, spiega, per
inciso, perché una fonte preziosa di cellule staminali è il sangue del cordone ombelicale. E c’è ora
tutto un programma per la raccolta e la conservazione di questo sangue a scopo terapeutico perché lì
si trovano tante cellule staminali, che ancora sono molto abbondanti nel circolo fetale, e quindi nel
sangue che circola anche dentro i vasi del cordone ombelicale (e poi diminuiranno negli anni
successivi).
Due ultimi dettagli, che poi tanto dettagli non sono, sulle cellule staminali ematopoietiche.
Primo. Grande potenzialità rigenerativa delle cellule ematopoietiche. Esperimenti su animali… Non
sappiamo se sia vero anche sull’uomo, ma sicuramente gli esperimenti sui roditori di laboratorio ci
dicono che nell’animale pan-irradiato, quindi con dose letale, è sufficiente infondere una cellula
staminale, una sola, per rigenerare tutto il midollo di quell’animale e farlo vivere nel tempo
successivo. Una cellula. Sembra che una cellula staminale sia sufficiente, almeno nell’animale, per
rigenerare tutto un midollo.
Secondo. Ma in fondo, diceva un vostro compagno, questa storia che le cellule staminali vanno a
giro è solo espressione di una mentalità disposta ad andare a giro? Quando farete l’ematopoiesi prenatale, vedrete, è vitale per queste cellule che devono spostarsi dalla sede dove si formano
all’abbozzo del fegato, quando compare il fegato, e poi, da questo, addentro il tessuto osseo, quando
compare il tessuto osseo. E quindi, probabilmente, non hanno modo di sapere se c’è già pronto un
ambiente osseo: vanno a giro, se lo trovano si fermano se non lo trovano tornano indietro. Quindi
probabilmente è un fatto di questo tipo. Ma, uno dice, non è che può rivelare anche qualche altra
cosa? Ve lo dico sottovoce. Da un paio di anni, sono comparse delle segnalazioni in cui, in modelli
sperimentali… Sono stati presi degli animali, sono stati pan-irradiati, gli sono state iniettate cellule
midollari di un altro animale… Si hanno le indicazioni che cellule figlie di quelle donate non solo
vanno a ricostituire il midollo dell’animale ricevente, ma piccole quote di cellule figlie di queste
16
sembrano andarsi a ritrovare anche in tessuti epiteliali, in tessuti connettivali. Allora, uno si chiede,
come fanno a dire che sono quelle del donatore e non quelle del ricevente? Perché usano dei
missmatch (?) maschio-femmina. Per cui, se io in un soggetto femminile inietto cellule di un
donatore maschio, posso andare a ricercare il cromosoma Y nelle cellule dei vari tessuti, e vedere se
derivano dall’organismo ricevente o dall’organismo donatore. Ecco. Allora: qualche cellula
staminale può varcare la barriera endoteliale anche fuori del midollo e trasformarsi in una cellula
staminale dell’epidermide, di una ghiandola o di quel che volete. Sarà vero, non sarà vero, sarà
importante…: non lo so, ma penso di sì. I risultati, provati da più laboratori, sono alquanto
convincenti. Quello che non si sa è se si tratta di un evento eccezionale, che succede perché questo
animale è stato pan-irradiato e quindi in qualche modo la sua biologia è diversa e ha particolari
condizioni di stimolo alle cellule staminali di tutti i tessuti (tra le altre cose la pan-irradiazione non
danneggia solo il midollo, danneggia anche altri tessuti, tutte le cellule proliferanti), o se rappresenti
il venire a galla di un fenomeno che, sia pure a basso ritmo, succeda anche in condizioni normali o
comunque sia utilizzabile, per esempio a fini di una medicina rigenerativa, per far rigenerare tessuti
anche diversi dal midollo osseo. Sarà importante, non sarà importante… Da due anni si sa qualcosa,
è probabile che tra altri quattro si possa già cominciare a dire se è un tema promettente e destinato a
svilupparsi oppure se rimane una curiosità sperimentale. Ve l’ho presentato, vi ripeto, sottovoce,
perché sono ancora dati da capire bene. Però è certamente uno dei campi in cui la ricerca di base per
la medicina sta andando avanti, perché voi intuite, anche superficialmente, quelle che potrebbero
essere le implicazioni pratiche, di avere “una fonte di cellule”. E magari si potrebbero utilizzare
quelle del cordone ombelicale, che tutto sommato è materiale a perdere, non costa niente (tra
virgolette). Poter avere una banca di cellule da cui poter rigenerare non solo midollo, ma anche altri
tessuti. Ripeto: è di certo abbastanza vero quanto in più hanno dimostrato. Ma sarà significativo da
un punto di vista biologico-clinico o sarà una rarità sperimentale, solo il tempo lo dirà.
Per ora, voi tenete per certo: in primo luogo, che in circolo si trova un piccolo contingente di cellule
midollari; in secondo luogo, che questo contingente può anche essere aumentato trattando con
farmaci che stimolino il passaggio in circolo; in terzo luogo, che queste cellule midollari dal circolo
stanno ritornando nel midollo osseo [tanto è vero che anche se io le inietto in un animale diverso o
in un organismo, anche umano, diverso da quello di partenza, vanno a piazzarsi nel midollo osseo
(se poi vanno a piazzarsi anche da qualche altra parte mettiamoci, per ora, un punto interrogativo,
lasciamo aperta la questione, non è chiusa)].
Vedete. Questo è un aspetto del midollo osseo.
17
Una cellula grande, col nucleo con cromatina chiara, debole basofilia, niente granuli nel citoplasma.
Un proeritroblasto.
Una cellula un po’ più piccola, col citoplasma blu anche questa. Un eritroblasto basofilo.
Cellule col citoplasma un po’ a mélange. Eritroblasto policromatofilo. Eritroblasto acidofilo.
Vedete le zolle grossolane della cromatina.
E poi da qui nasceranno i globuli rossi maturi.
I globuli rossi, mentre si formano, è stato visto stanno accolti da una cellula che gli fa da… a me
sembra una portaerei, ma la chiamano cellula nutrice. È un macrofago, un macrofago con delle
propaggini. E a ridosso, quasi nelle tasche formate tra uno pseudopodo e l’altro del macrofago,
vengono a trovarsi gli elementi progenitori della serie rossa.
Questo macrofago che sa fornire? Intanto, un microambiente, anche per contatti intercellulari, che
creano le condizioni ideali per la formazione di globuli rossi. Secernono, probabilmente, fattori
solubili che stimolano la proliferazione e il differenziamento di queste cellule. Terzo, mette a
disposizione ferritina.
Tenete presente che il globulo rosso deve fare tanto gruppo eme. Gli servono i mitocondri, perché la
sede di sintesi del gruppo eme sono i mitocondri. Il DNA è nucleare. Quindi: gli enzimi per la
sintesi dell’eme vengono sintetizzati dai ribosomi dello ialoplasma sulla base di istruzione del DNA
nucleare, ma poi una volta sintetizzati, questi enzimi entrano dentro la matrice mitocondriale,
attraverso i sistemi di importo mitocondriali, ed esercitano la loro attività catalitica dentro i
mitocondri. E poi il gruppo eme riesce. E poi, hanno bisogno, per fare il gruppo eme… ci vogliono
gli enzimi, per fare la componente organica, e ci vuole ferro. Il ferro si ottiene dal circolo. E nel
circolo il ferro gira attaccato a una proteina che si chiama transferrina. I macrofagi dell’isolotto
eritropoietico, come si chiama, secernono la componente proteica di una proteina che si chiama
ferritina. Apoferritina sarebbe la proteina senza il ferro attaccato. A questa apoferritina si lega il
ferro, che dalla transferrina circolante passa a questa apoferritina che diventa ferritina. E la vediamo
sulla superficie dei globuli rossi, dove si costituisce per la combinazione della apoferritina secreta
dai macrofagi e del ferro che viene dal circolo. I globuli rossi la endocitano. È un processo di
endocitosi mediata da recettori: c’è tutta una serie di vescicole coated che mediano l’assorbimento
della ferritina, e poi utilizzano il ferro per la sintesi del gruppo eme, per fare emoglobina.
Bene. Quindi, questo macrofago serve da supporto meccanico, da supporto interattivo attraverso la
membrana, da supporto trofico, in quanto mette a disposizione ferritina per l’assorbimento del
ferro… e, ripeto, sembra anche da fattore di secrezione di molecole solubili che stimolano questi
processi.
18
Questo è un isolotto eritropoietico. Vedete: questo è il macrofago. E queste cellule, che intorno, a
contatto con questa, si stanno differenziando. Vedete questo aspetto della cromatina, con queste
zolle grossolane degli eritroblasti. E poi, si differenziano in globuli rossi.
Ecco qui un elemento che ormai ha perso il nucleo. C’ha ancora qualche mitocondrio, c’ha qualche
ribosoma. È un reticolocita. Se io lo guardassi all’ottico, questo sarebbe un reticolocita. C’ha ancora
una forma un po’ bizzarra. Evidentemente ha appena buttato fuori il nucleo, e deve ancora
polimerizzare lo scheletro sotto membrana per prendere la bella forma a lente biconcava.
Ecco, qui volevo farvi vedere che ci sono dei globuli rossi che c’hanno dentro questo materiale
granuloso, questa sostanza granulo-filamentosa, come viene detta, che li qualifica come reticolociti.
Qualche volta, al microscopio ottico, si riconoscono i reticolociti anche nei comuni strisci, perché
possono presentare degli anelli basofili così, nel citoplasma. Si chiamano anelli di Cabot: sono
residui dell’involucro nucleare.
In questa cellula, vedete, il nucleo, invece che essere tutto espulso… in qualche modo il materiale
nucleare è stato buttato fuori, ma l’involucro è rimasto e forma questi anelli di Cabot, oppure corpi
di Jolly, che sono sempre residui di cromatina rimasta dentro.
Sono gli unici casi, ma sono poche le cellule caratterizzate così… Sono gli unici casi in cui potete
veder qualcosa in un comune striscio, se no dovete fare la ricerca dei reticolociti, per benino, con la
colorazione sopravitale.
Questa cellula ha qui nel citoplasma tanti granulini violacei, granulini azzurrofili. Allora: cellula
grande, citoplasma basofilo, nucleo tondo, granuli azzurrofili. Mieloblasto.
In questa cellula qui, nella zona intorno al nucleo, c’è meno punteggiatura violacea. Cosa vuol dire?
Che lì cominciano a comparire granuli specifici neutrofili. Ricordatevi: i granuli neutrofili sono
piccoli ma risolvibili. Quindi impartiscono una sfumatura grigiastra al citoplasma. Non è facile
risolvere i singoli casi. Un promielocita neutrofilo.
Questo è un nucleo a ferro di cavallo di un metamielocita.
Qui ormai granuli azzurrofili ce ne son pochini. Questo è un mielocita.
Questa è una cellula che è piena di granuli che sono granuli eosinofili. Quindi sarà un mielocita
eosinofilo.
Eccoci qui a una cellula gigante, decisamente fuori misura.
19
Ci sono, nel midollo osseo, delle cellule giganti, dai 70 ai 100 μm di diametro. Con questo buffo
nucleo bitorzoluto. Sembra una patata quando fa i butti, e perciò lo chiamiamo nucleo gemmante.
Quindi, nucleo gemmante: vi faccia venire in mente un tubero da cui gemmino, giustappunto, tante
piccole protuberanze. Grosso nucleo. Cellula con grosso nucleo. Be’, è grosso il nucleo, è grosso
tutto. Ma colpisce questo grosso nucleo. Ecco il nome: megacariocita. Cellula dal grosso nucleo.
Il megacariocita si forma da un elemento progenitore in cui si va incontro a una divisione del nucleo
senza divisione del citoplasma, e poi i due corrodi cromosomici figli si rifondono insieme nello
stesso nucleo. Si chiama endomitosi. In fondo, è una cellula che usa il processo mitotico per
raddoppiare ordinatamente il proprio patrimonio cromosomico. E c’ha un nucleo poliploide. Tra 12
e 72 ploidi. Quindi: fortemente poliploide. L’esigenza di avere tanti cromosomi: per dirigere la
sintesi di materiale dentro un abbondante citoplasma. E c’è bisogno di questa superficie irregolare
del nucleo per garantire la superficie di scambio tra nucleo e citoplasma.
Cosa fa questa cellula? Questa cellula, il megacariocita, è il progenitore delle piastrine. Dentro il
citoplasma si formano i granuli che si trovano dentro le piastrine. Poi i mitocondri. Tubuli di
reticolo liscio. Poi, a un certo punto, compaiono delle vescicole che si allungano, delimitate da
membrana, con l’aspetto della membrana esterna cellulare, che si fondono tra loro, si fondono con
la superficie cellulare, e spezzano il citoplasma in tanti piccoli isolotti ognuno dei quali diventa una
piastrina.
Ecco qui, elementi giovani. Citoplasma basofilo, senza granuli. Nucleo non proprio grandissimo.
Megacarioblasti.
E gli elementi maturi. Megacariociti.
E qui vedete bene un megacariocita, come si dice, in piastrinazione, o in piastrinogenesi. Dalla
superficie della cellula… è come se fossero tanti coriandolini… si sfaldano via frammenti di
citoplasma. Voi capite che prima si deve accumulare tutto quel che serve: i granuli, il reticolo, i
mitocondri, il citoscheletro (l’actina, la tubulina per fare i microtubuli, ecc.). Poi, devono formarsi
delle membrane che formano come dei solchi tra un pezzettino di citoplasma e un altro, collegati
con la membrana esterna, per cui si stacca come una zolla di citoplasma, benché marcato dalla sua
membrana. E quella è una piastrina. E qui vedete ce ne stanno tante, che formano proprio una specie
di propaggine, che sporge dalle cellule endoteliali, e poi si sfalda in piastrine che vanno via in
circolo.
20
Ecco qui, un’immagine al microscopio elettronico. Intravedete queste fessure che si formano e che
poi, confluendo tra loro, e saldandosi alla superficie cellulare, suddividono il citoplasma in
frammenti che diventano piastrine.
Più semplice è la storia dei monociti.
Qualcuno parla di un monoblasto, promonocita, monocita. Ma, in realtà, i termini monobalsto,
promonocita ci parlano di una cellula che rassomiglia un po' al mieloblasto. Grande, con il nucleo,
con nucleoli, citoplasma … (?). Qualche granulo azzurrofilo, ma pochini pochini, così come il
monocita, di granuli azzurrofili, ce n’avrà pochini pochini, uno o due. Quindi, in fondo, non sono
altrettanto ben caratterizzati. Sono come… Il progenitore del monocita, quando appare
riconoscibile, è un po’ più grosso del monocita, un pochino più basofilo del monocita, con tra o
quattro granuli azzurrofili in più di un monocita. Quindi, è meno ben caratterizzato, meno ben
riconoscibile.
Allora: da monocita, una volta che passa nei tessuti, si differenzia in macrofagi, e altre cellule
collegate coi macrofagi.
I granulociti possono passare nei tessuti e rimangono granulociti.
I linfociti li vedremo la volta prossima, la storia dei linfociti.
Dal midollo osseo derivano anche i mastociti.
Sappiamo che da cellule midollari è possibile tirare fuori unità formanti colonie mastocitarie.
In vitro, è possibile dare elementi con caratteristiche sostanzialmente staminali. Vi dico
sostanzialmente perché c’è ancora difficoltà ad identificarle con certezza.
Comunque è possibile, a partire da progenitori midollari, tirare su colonie di mastociti. Si
cominciano a sapere quali sono i fattori che regolano il differenziamento dei mastociti. Quello che
non sappiamo… è chiaro che ci deve essere un progenitore midollare, ci deve essere un elemento
circolante, e poi si va nei tessuti, e qui compie l’ultima tappa differenziativa e diventa mastocita,
cioè sviluppa i granuli basofili, metacromatici, si arricchisce di eparina, di istamina e di tutte le altre
molecole che gli va di produrre, e quindi si mette a fare il suo lavoro. Non sappiamo che aspetto
abbia l’elemento circolante. Probabilmente si confonde, anche lì, con i monociti. Magari c’avrà
l’aspetto a piccolo monocita.
Quando si liberano le cellule del sangue, in genere si cerca di staccare i globuli bianchi. Si fa una
centrifugazione: i globuli rossi vanno a fondo e rimangono a galla i globuli bianchi. Ci si sbarazza
21
in qualche modo delle piastrine. I globuli bianchi si fanno aderire… si mettono dentro a un vasetto
da coltura, e alcuni di loro si appiccicano subito al vetro. Quelli che si appiccicano: vai!, sono
cellule appiccicosissime, sono monociti. C’hanno già la adesività che poi sarà tipica dei macrofagi.
Quelle che non aderiscono le consideriamo grosso modo linfociti. E poi, questi linfociti sapete che
si possono dividere, sulla base di certe caratteristiche delle molecole di membrana, in linfociti T, in
linfociti B e nelle cellule che non sono né T né B (un tempo si parlava di “cellule nulle”, oggi come
oggi anche nella letteratura anglosassone prevale il termine “cellule non T non B”, cioè cellule di
cui non si può dir nulla, che comprendono probabilmente elementi natural killer, cellule staminali in
visita di piacere per il circolo, progenitori dei mastociti, elementi che in qualche modo non
appartengono a nessuna serie ben caratterizzata).
Quindi, ecco che sappiamo bene che in circolo esistono i progenitori dei mastociti, è ragionevole
ritenere che abbaino la morfologia di probabilmente piccoli monociti, ma non possiamo identificarli
con certezza mentre sono in circolo, si confondono con gli altri elementi. Siamo certi che derivano
dal midollo. Come hanno fatto? Hanno provato anche nell’uomo. Con quel giochino dei trapianti
maschio-femmina. Cioè, in soggetti che sono stati sottoposti a trapianto di midollo osseo per ragioni
terapeutiche, e in cui, non essendoci un donatore dello stesso sesso, è stato usato un donatore
maschio per un soggetto femmina – si cerca di non farlo perché ci sono alcuni antigeni minori di
istocompatibilità sul cromosoma Y, ma, se non c’è nulla di meglio, si fa –. A distanza di anni, sono
state prese delle biopsie di pelle, che si studia bene, non è fortemente traumatica. Ed è stato visto
che esistevano mastociti, così come i macrofagi, che avevano il cromosoma Y. E quindi significa
che derivavano dalle cellule del donatore, e quindi dal midollo osseo, che si era rigenerato a partire
dalle cellule trapiantate.
Quindi, siamo certi che i mastociti derivano dal midollo osseo. L’aspetto degli elementi circolanti…
non ha un aspetto proprio, e quindi si confonde con i piccoli monociti.
L’unica cosa che si riconosce bene dentro il midollo osseo è il megacariocita: è grande e c’ha
questo nucleo gemmante.
Vi dicevo. I monociti passano in circolo e diventano macrofagi.
Il destino più comune di queste cellule è diventare macrofagi. Diventano più grandi, acquistano
capacità fagocitaria, diventano capaci di un buon movimento ameboide, sviluppano tutti i recettori
di membrana – un po’ ce l’hanno di già i monociti, ma di più ne sviluppano i macrofagi per essere
adesivi, per riconoscere il materiale da fagocitare, e via discorrendo -, sviluppano il citoscheletro,
sviluppano gli enzimi lisosomiali. E diventano macrofagi! C’è molto da raccontare su questa storia.
22
Quello che è interessante è che non solo possono diventare macrofagi.
Abbiamo visto gli osteoclasti e i condroclasti. Bene, i monociti possono diventare osteoclasti. Si
fondono tra loro e diventano cellule capaci di riassorbire tessuti mineralizzati attraverso meccanismi
molto sofisticati.
Cellule di questo tipo possono andare a piazzarsi intorno all’endotelio nei capillari encefalici, e
diventano cellule – ne risenterete parlare a proposito di tessuto nervoso – di microglia, o microglia.
I neuroni sono delle cellule con dei prolungamenti. Queste cellule… sarà meglio non farsi notare…
e mettono su anche loro dei piccoli prolungamenti. Microglia spinosa, si chiama, perché sviluppa
delle piccole propaggini sottili delle cellule. Evidentemente ci devono essere dei fattori… Io ve lo
dico come una battuta, ma ci devono essere, nell’ambito del tessuto nervoso, dei fattori che
stimolano la sintesi e l’organizzazione di molecole del citoscheletro in maniera da sviluppare
propaggini un po’ in tutte le cellule che ci sono. Queste cellule normalmente stanno lì, diciamo
inerti, ma se si crea un danno, se del tessuto nervoso va incontro a alterazioni, si attivano alla
fagocitosi, e possono diventare grosse, globose, microglia globosa. Fagocitano quel che c’è, spesso
fagocitano grassi di membrana, diventa microglia schiumosa, perché dentro si formano tante
goccioline, tanti lisosomi pieni di grasso in fondo, e quindi con l’aspetto un po’ di cellule
schiumose. In fondo, sono dei macrofagi un po’ particolari, specializzati per vivere dentro il sistema
nervoso.
Non solo. Macrofagi li possiamo trovare in posizione endoteliale. Nel fegato, per esempio, alternate
a delle cellule endoteliali dei capillari del fegato, ci sono delle cellule, ci sono dei veri e propri
macrofagi, si chiamano cellule di Kupper, o von Kupper, che sono dei macrofagi.
Negli organi come la milza, come i linfonodi, lo stesso possiamo trovare a tappezzare spazi linfatici,
al posto di cellule endoteliali linfatiche, macrofagi.
E inoltre, dove c’è anche questo tessuto reticolare tridimensionale, macrofagi si possono trovare
nelle maglie di questo reticolo, ma anche aderenti alle fibre reticolari, allungate a ridosso di ognuna.
Tutto sommato, queste cellule, senz’altro diverse per dimensioni, per certe caratteristiche… però
sono tutte collegate tra loro da una capacità fagocitarla, da una origine dal monocita… E sono di
origini in un insieme che ha assunto termini diversi di volta in volta. Quando, all’inizio, non si
capiva bene che per esempio alcuni macrofagi che stavano a tappezzare vasi erano macrofagi, non
erano cellule endoteliali capaci di fagocitare, erano veri e propri macrofagi, si parlava di sistema
reticolo-istiocitario. Istiocita è un vecchio termine per macrofago. Sistema reticolo-endoteliale o
sistema reticolo-istiocitario. Sistema reticolo-endoteliale: cellule che stanno nel tessuto reticolare,
cellule che stanno in posizione endoteliale e fagocitano. Sistema reticolo-istiocitario: le solite
cellule di prima, ma valorizzando l’attività istiocitaria, cioè la fagocitosi. Il termine ora è diventato
23
sistema dei fagociti mononucleati: fagociti perché son fagociti (be’, alla fine c’è da metterci anche
l’osteoclasta, che funziona non fagocitando, ma rigurgitando gli enzimi, ma insomma sempre lui è),
mononucleati perché derivano dal monocita… ritorna fuori il vecchio termine di leucociti
mononucleati. Come se quegli altri, di nuclei, ne avessero tanti… sappiamo che è un solo nucleo,
polimorfo. Però, il vecchio termine di leucocita mononucleato, per indicare linfociti e monociti,
cioè gli agranulociti insieme, in questa parola… Fagocita mononucleato.
Qual è la filosofia, al di là dei termini che si possono dare o non dare?
Ricordatevi che esiste una congerie di cellule, imparentate tra loro, con un unico progenitore
midollare e un unico progenitore circolante, e che possono assumere aspetto, posizione e attitudini
funzionali diverse, dal macrofago (che non fa altro che fagocitare) alla cellula di microglia (che sa
stare lì ferma, buona, e attende che ci sia qualcosa da fagocitare anche per anni, prima di mettersi in
attività) all’osteoclasta (che rigurgita i suoi enzimi, ma anche i suoi protoni per ingerire l’osso)…
Quindi, sia èpure con attitudini diverse, ci sono queste cellule tutte imparentate tra loro, e che
quindi risentono anche di stimoli fisiologici e patologici, e si modificano in condizioni fisiologiche
e patologiche, in qualche modo coordinatamente tra loro.
Tra le cellule che fanno parte di questo sistema dei macrofagi, in fondo, ci sono anche delle cellule
che sono specializzate per una funzione particolare: la presentazione di antigeni.
Qui occorre fare una piccola premessa. E poi, questo discorso andrà mezzo oggi e mezzo la volta
prossima.
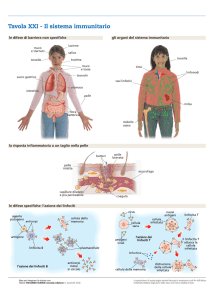
Voi avete già visto che esistono dei linfociti, detti linfociti T, e degli altri linfociti, detti linfociti B.
Possiamo qui fare un piccolo passo indietro.
Come nascono questi linfociti? Tenete presente che io morfologicamente non li distinguo: i linfociti
T e i linfociti B sono rigorosamente uguali.
Sono diversi per molecole di membrana. Quindi, con anticorpi diretti contro le molecole di
membrana dell’uno o dell’altro posso distinguerli. Sanno aderire… i linfociti T aderiscono ai
globuli rossi di montone e i linfociti B no, perché c’hanno una molecola di membrana che s’incastra
con quella dei globuli rossi. Quindi, c’hanno delle molecole diverse, che io posso riconoscere o con
la tecnica delle cosiddette rosette, facendoli legare a dei depositi, o con anticorpi diretti contro di
esse. Ma, morfologicamente, sono uguali.
Sono anche diversi funzionalmente, e sono diversi per la maniera come maturano.
24
Cosa sappiamo?
Noi vediamo che dalla cellula staminale ematopoietica si differenzia non solo un progenitore
mieloide, ma un progenitore linfoide.
Questo progenitore linfoide, a sua volta, può prendere due strade: può diventare un precursore dei
linfociti T oppure può diventare un precursore dei linfociti B.
Cosa succede? Il precursore dei linfociti T passa in circolo. È una cellula molto molto molto
immatura. Niente di male se passa in circolo. E c’ha delle molecole di membrana che le permettono
di fare homing, cioè di andare a localizzarsi nel timo. Il timo è un organo piazzato subito dietro lo
sterno. E nel timo, attraverso un lungo processo – casomai ci torneremo su la volta prossima se ci
sarà tempo, se no ve ne parleranno gli immunologi, ve ne parlerà qualcun altro –, l’importante è che
nel timo questa cellula diventa un linfocita T, capace di riconoscere un certo antigene.
Ricordatevi: questo processo di differenziamento comporta: in primo luogo, proliferazione
cellulare; e in secondo luogo, addirittura delle mutazioni del genoma di questa cellula, infatti va
incontro a un rimaneggiamento di uno dei suoi cromosomi, per formare delle molecole di
membrana nuove, che vengono esposte in membrana e che sono fatte in modo tale, ognuna, da
sapere riconoscere un pezzettino di un antigene.
Ogni cellula fa un suo cammino differenziativo, sviluppa una sua particolare serie di mutazioni che
fanno sì che questa sappia esprimere un recettore di membrana solo per uno e specifico pezzettino
di antigene.
Questa cellula, ormai matura per poter riconoscere l’antigene, ormai riconoscibile dal punto di vista
morfologico, istochimico funzionale come un linfocita, passa in circolo. È un linfocita molto
ingenuo, per cui si usa il termine inglese naif, naif, linfocita naif, o linfocita vergine, perché non ha
mai visto il suo antigene. Sa prepararsi, sa rispondere a un antigene, ma non ha mai visto nella sua
vita quell’antigene, cioè non l’ha ancora mai incontrato venuto dall’esterno. È un linfocita T maturo
vergine, o naif. Che è maturato, che si è differenziato attraverso un lungo e complesso processo nel
timo. Fondamentale in questo processo è che ci sono delle mutazioni somatiche che portano a far
esprimere una proteina nuova, non c’era nel genoma, è nata da un rimaneggiamento complesso del
genoma, che sa riconoscere, come una chiave e la serratura, solo uno specifico pezzettino di un
antigene.
Si chiama epitopo un frammento di antigene riconosciuto da un linfocita T.
E quindi, pensate che, tra le cellule non T non B che si trovano in circolo, ci sono anche delle
cellule staminali linfoidi pre-T che stanno andando verso il timo.
La cellula, invece, progenitrice delle B, rimane nel midollo osseo, ed è nel midollo osseo che
subisce l’analogo processo di proliferazione e differenziamento e mutazione somatica per diventare
capace di riconoscere un pezzettino di antigene.
25
I pezzettini di antigene che sono riconosciuti dai linfociti B sono un po’ di versi da quelli che sono
riconosciuti dai linfociti T. Le zone degli antigeni riconosciute dai linfociti B si chimano
determinanti antigeni.
Quindi: il pezzo di antigene riconosciuto da un linfocita T lo chiamiamo epitopo; il pezzo di
antigene riconosciuto da un linfocita B lo chiamiamo determinante antigene.
Sulla stessa molecola ci sono e epitomi per i linfociti T e determinanti antigeni per i linfociti B.
Il linfocita B, maturo, vergine anche lui, o naif, passa in circolo, non ha mai incontrato il suo
antigene, c’ha sulla membrana molecole capaci di riconoscere l’antigene.
Le molecole di membrana del linfocita T sono fatte a modo loro: si chiamano recettore della cellula
T (T cell recector). Ogni cellula c’ha un solo tipo di recettore per un solo epitopo.
I recettori di membrana delle cellule B sono fatti proprio come gli anticorpi, di cui vi ho parlato
parlando di immunoistochimica, come gli anticorpi, quindi fatti a Y. Solo che il tratto lungo della Y
mantiene una sequenza idrofobica, per cui è ancorato alla membrana, rimane come molecola di
membrana. E fa da recettore per il suo determinante antigenico. Ogni linfocita B esprime un solo
recettore per un solo tipo di determinante.
Ora, il sistema dei linfociti è disegnato per rispondere agli antigeni. Ed è disegnato cercando di
garantire insieme vari requisiti. Deve essere capace di rispondere: primo, alla svelta; secondo,
specificamente (vi ricordate: la risposta immunitaria garantita dai linfociti T è una risposta
specifica, contro quella molecola, non contro qualche altra che magari le rassomiglia). È una
risposta che deve essere dotata di memoria: per cui, la seconda volta che quell’antigene penetra
nell’organismo deve essere in grado di evocare la risposta in maniera molto più rapida, molto più
intensa, molto più efficace. E deve essere ben regolata, questa risposta: bisogna stare attenti, perché
questo sistema potrebbe mettersi a rispondere contro molecole self. E sono guai. Ci sono delle
patologie dove i linfociti impazziscono, tra virgolette, e si mettono ad attaccare il self.
Bene, quindi ci deve essere un sistema che è un sistema… mentre maturano le cellule, quelle che
vengono ad esprimere recettori per le cellule T o immunoglobuline di membrana reattive contro il
self vanno uccise. È un meccanismo di mutazione- selezione. Mutazione casuale per fare questi
recettori di membrana. E selezione! Quelli che non fanno i recettori si eliminano. Quelli che fanno
recettori che reagiscono contro il self si eliminano pure. Come succede ciò e come ciò si altera ve lo
spiegheranno gli immunologi. E poi ci sono ulteriori meccanismi di controllo anche a livello di
risposta da parte delle cellule vergini mature.
E il sistema di attivazione di questa risposta, però, è molto sofisticato.
Cosa succede in risposta alla presenza di un antigene nel nostro organismo?
26
Be’, si fa presto a dirlo. Le cellule capaci di riconoscere quell’antigene, dal contatto con l’antigene
vengono stimolate a proliferare, cambiano anche un po’ aspetto mentre proliferano, diventano un
po’ più grosse, un po’ più basofile (si parla di linfoblasti per evocare in genere una cellula capace di
proliferare vivacemente), e danno origine a che cosa? A delle nuove generazioni di cellule. Alcune
si mettono a lavorare per dar noia all’antigene: si chiamano cellule effettrici, perché fanno qualcosa.
Vedremo che cosa fanno le cellule effettrici B e che cosa fanno le cellule effettrici T. Altre si
chiamano cellule della memoria. Queste non sono come quelle naif, vergini. Queste sono
estremamente agguerrite e ben memorizzanti, per cui, quando l’antigene dovesse rientrare
nell’organismo, le cellule della memoria sono capaci di riconoscerlo, proliferare e produrre nuovi
elementi effettori molto più rapidamente, molto più intensamente, e gli elementi effettori sono
anche molto più fortemente aggressivi verso l’antigene di quanto non succeda durante la risposta da
parte delle cellule vergini.
La prima risposta che si ha davanti all’ingresso di un antigene, quella garantita dalle cellule naives,
è la risposta primaria. Quella che si ha in risposta a successive reintroduzioni dell’antigene, da parte
di cellule della memoria, si chiama risposta secondaria. Le risposte secondarie sono più rapide,
intense ed efficaci.
Bene. Vedo l’antigene e rispondo. Fosse semplice!!!… Perché i linfociti sono cellule molto
sofisticate. E anche un po’ pigrotte: la pigrizia deriva dal fatto che se fossero troppo reattive
rischierebbero di rispondere contro stimoli incongrui, dalle sostanze nutritizie al self.
Allora. Intanto vediamo cosa fanno.
L’elemento effettore B è la plasmacellula. Ne abbiamo già parlato della plasmacellula. Quindi,
quando un linfocita B viene stimolato perché incontra un antigene, diventa un linfoblasto B,
prolifera da cellule della memoria B e plasmacellule B che producono, a questo punto si mettono a
secernere all’esterno anticorpi contro quell’antigene. Un clone di plasmacellule, tutte figlie della
stessa madre, e tutte che producono anticorpi tutti uguali, tutti della stessa classe, tutti contro lo
stesso determinante antigene, quello per cui era predisposto il linfocita da cui deriva.
E le cellule T, invece? Qui veniamo al discorso che vi dicevo della sofisticatezza.
Le cellule T, normalmente, quando vedono un antigene dicono “oh, guarda, bellino!”, e si fermano
lì. Hanno bisogno di qualcuno che gli tiri una gomitata nello stomaco “oh!! ma ti sei accorto che è
arrivato quello?? datti da fare!!!”. Cioè, hanno bisogno di uno stimolo, di un aiutino. Si parla di
help, proprio, all’inglese, di un aiuto per entrare in risposta. Sono pochissimi gli antigeni, lo
vedrete, che sanno stimolare una risposta B direttamente. Chi è che dà l’aiuto ai linfociti B e gli dice
27
“datti una mossa!”? Sono alcuni linfociti T. Li chiamiamo linfociti T helper, coadiuvanti. Quindi,
quando arriva l’antigene, stimola il linfocita T helper, il linfocita T helper dice “aiuto! allarme!
allarme!”, prolifera, dà cellule T helper della memoria e cellule T helper effettrici, contro
quell’antigene. Cosa fanno le cellule T helper effettrici? Vanno vicino alla cellula B diretta contro
lo stesso antigene e dicono “tu-tu”, nell’orecchio, e quella si sveglia. Il “tu-tu” è rappresentato dalla
secrezione di una serie di molecole solubili: sono molecole secrete da un leucocita o derivato di
leucocita, che agiscono su un altro leucocita. Appartengono alla categoria delle citochine. Vi
ricordate? Questo nome ve l’ho già dato. Secernono delle citochine, che stimolano il linfocita B…
C’è di mezzo anche l’antigene, che garantisce che la cellula T stimola quella B specifica solo per
quell’antigene.
Ma non finisce qui. Ogni sistema sofisticato e delicato, normalmente, non è solo regolato in
attivazione, ma è regolato anche in blocco. Cioè, non solo c’è un acceleratore per andare più veloci,
ma c’è anche un freno per rallentare, non basta levare il piede dall’acceleratore per fermarsi,
bisogna avere anche il freno. Alcune cellule T sono delle cellule T suppressor, inibitrici, che fanno
il gioco opposto alle precedenti. Sono meno note, meno studiate nei dettagli. Stanno riemergendo
ora all’attenzione dopo un periodo di oblio perché sono più difficili da studiare. Ma, servono a far sì
che la risposta immunitaria duri un certo tempo, finché c’è un antigene, e poi sappia andare a
riposo.
Alcuni linfociti T sono diretti direttamente contro antigeni sulla membrana di cellule bersaglio…
cellule tumorali, cellule infestate da virus, ecc. che esprimano sulla membrana queste molecole not
self. Loro sono molto chiare. “Tu, sei un estraneo. Prima di ammazzo e poi ti chiedo chi sei.”.
Quindi, sono predisposte per riconoscere le molecole not self presenti sulla superficie di cellule, ci
vanno accanto e mandano dei segnali per uccidere la cellula. Questi segnali sono rappresentati: a)
da molecole di membrana del linfocita T che fa questo lavoro, che reagiscono con molecole di
membrana della cellula bersaglio ed attivano l’apoptosi della cellula bersaglio. b) Seconda
possibilità. Il linfocita T secerne dei granulini citoplasmatici con l’aspetto dei granuli azzurrofili che
c’ha, ma che non sono lisosomi, sono dei granuli secretori che contengono alcune molecole che si
incastrano nella membrana della cellula bersaglio, si chiamano perforine. Fanno una specie di
buchino nella cellula bersaglio. la prima idea era che queste perforine si limitassero a far passare
ioni: la cellula bersaglio perde il controllo della membrana e muore per lisi. Probabilmente il
meccanismo è più sofisticato, perché questo sarebbe più svantaggioso, perché la cellula morta
libererebbe molecole tossiche. Il meccanismo è ancora più sofisticato: attraverso il buchetto, fatto
dalle perforine, passano altre molecole contenute nel granulo del linfocita T, che entrano dentro il
citoplasma e attivano di nuovo il programma di apoptosi. “Grazie per avere pigiato il pulsante di
autodistruzione!”. Ricordate l’apoptosi. Il risultato qual è? Che la cellula bersaglio muore, e se
28
muore per apoptosi muore in maniera da non disperdere sostanze irritanti e tossiche. E poi, il
cadavere (tra virgolette) viene fagocitato dai macrofagi. I macrofagi hanno un particolare recettore
di membrana proprio per riconoscere le cellule in apoptosi e farle fuori. Le cellule T che fanno
questo lavoro si chiamano linfociti T citotossici o, più semplicemente, linfociti T killer. Anche loro:
arriva l’antigene, la cellula lo sente, la cellula prolifera e dà origine a linfociti T killer della
memoria, pronti a rientrare in funzione a un prossimo attacco e linfociti T killer effettori che vanno
vicini alla cellula bersaglio e, o attraverso molecole di membrana, o attraverso il sistema perforine e
altre molecole secretorie (non vi do i nomi perché diventa una cosa complicatissima), determinano
la morte della cellula bersaglio.
Vi dicevo, e con questo chiudo: non crediate che sia così semplice!
Il linfocita T, sofisticatissimo: non si fa conoscenza con chi arriva a casa, e basta. I linfociti vedrete
che avranno bisogno che di un antigene venga estratto un fra virgolette biglietto da visita, venga
depositato su un vassoietto apposito (e vedremo come è fatto questo vassoietto). Solo allora
sapranno riconoscere l’antigene, e attivarsi per dare origine poi a elementi helper, o a elementi
citotossici, o a elementi suppressor. E se sono elementi helper poi si attiverà la risposta B.
Complicatissimo! Quindi, questo processo di prendere l’antigene e tirar fuori il biglietto da visita,
tra virgolette, poi vedremo che cos’è, per mostrarlo ai linfociti, si chiama presentazione antigenica.
E cellule della famiglia dei macrofagi sono specializzate per presentare antigeni.
Il seguito al prossimo incontro.
29