http://www.fis.unipr.it/corsi/fisicacing/cinformatica/
Termodinamica
Temperatura e Calore
I Principio della Termodinamica
Teoria cinetica dei gas
II Principio della Termodinamica
Richiami
PRESSIONE
Per pressione si intende il modulo della forza
normale ad una data superficie diviso per la
superficie stessa. E’ una grandezza scalare.
Unità di misura nel SI: 1 N/m2 = 1 Pascal (Pa)
Altre: 1 atmosfera (1 atm) = 1.01325 105 Pa
1 bar = 105 Pa
1 atm = 760 mm Hg=1.033 Kg/cm2
ΔF
p=
ΔA
bar ≈ pressione esercitata da una colonna di mercurio alta 760 mm, alla
temperatura di 0 °C in un luogo in cui g=9.80665 m/s2
torr = pressione esercitata da una colonna di mercurio alta 1 mm, alla
temperatura di 0 °C in un luogo in cui g=9.80665 m/s2
DENSITA’
La densità di un dato volume V di materiale è
definita come la massa Δm dell’elemento divisa
per il suo volume ΔV. E’ una grandezza scalare.
In generale può dipendere da pressione (gas) e
temperatura (solidi e fluidi)
Δm
ρ=
ΔV
MODULO DI
COMPRESSIONE
ρH2O = 1 g/cm3
(T = 4 °C)
Una pressione Δp esercitata
su una superficie provoca una
una variazione di volume ΔV.
Il rapporto:
Δp
B=−
ΔV V
è definito modulo di compressione
Temperatura
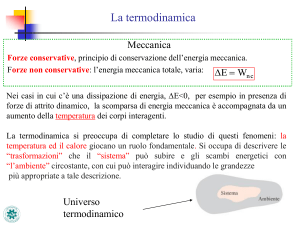
SISTEMA TERMODINAMICO B Insieme di uno o più corpi di composizione
nota che si trovano in una regione dello spazio
delimitata da superfici ideali o reali che li
distinguono dal resto (detto AMBIENTE)
Costituito in genere da un insieme di particelle (atomi, molecole) molto elevato (gas:
~1022 particelle in un volume di un litro) in movimento (in un gas: urtano)
SISTEMA TERMODINAMICO + AMBIENTE = UNIVERSO TERMODINAMICO
• DESCRIZIONE MICROSCOPICA Æ Studio delle forze su ogni particella, note velocità e
momento
• DESCRIZIONE STATISTICA
Æ Determinati i valori medi delle quantità microscopiche
• DESCRIZIONE MACROSCOPICA Æ Descrizione attraverso grandezze macroscopiche che
caratterizzano lo stato del sistema nel suo complesso
(es. pressione, volume, temperatura,
magnetizzazione,..)
Si definiscono COORDINATE (VARIABILI) TERMODINAMICHE
grandezze fisiche MACROSCOPICHE OSSERVABILI E MISURABILI
INTENSIVE:
hanno carattere locale, indipendente
dalla quantità di materia del sistema
(es: PRESSIONE)
ESTENSIVE:
hanno carattere globale; proprietà
additiva
(es: VOLUME)
SI DEVE INDIVIDUARE UN NUMERO LIMITATO DI COORDINATE TERMODINAMICHE
SUFFICIENTI A DETERMINARE LO STATO TERMODINAMICO DEL SISTEMA
Un sistema costituito (i) da una singola specie chimica (atomica o molecolare),
(ii) presente in una sola fase è descrivibile attraverso PRESSIONE,
TEMPERATURA e VOLUME di cui SOLO DUE SONO INDIPENDENTI
Un sistema di questo tipo è definito IDROSTATICO
Le coordinate termodinamiche caratterizzano lo STATO MACROSCOPICO del
sistema perciò sono anche definite VARIABILI DI STATO.
STATO Uno stato
macroscopico corrisponde ad un numero molto elevato di possibili STATI
MICROSCOPICI
La descrizione microscopica e macroscopica sono correlate, es:
Pressione
Urti con le pareti del contenitore
Temperatura
Energia cinetica media traslazionale
Quando lo stato termodinamico del sistema è stazionario e ogni
coordinata termodinamica ha lo stesso valore in tutto il sistema si
dice che il sistema si trova in uno
STATO DI EQUILIBRIO TERMODINAMICO
Per un sistema in equilibrio termodinamico esiste una
RELAZIONE FUNZIONALE fra le VARIABILI DI STATO
Tale relazione è definita EQUAZIONE DI STATO
SISTEMA APERTO:
il sistema PUÒ scambiare energia e materia
con l’ambiente
SISTEMA CHIUSO:
il sistema PUÒ scambiare energia ma NON
materia con l’ambiente
SISTEMA ISOLATO:
il sistema NON PUÒ scambiare energia NE’
materia con l’ambiente
L’UNIVERSO TERMODINAMICO è un sistema ISOLATO
Un sistema isolato è separato dall’ambiente da PARETI ADIABATICHE
NON SONO POSSIBILI INTERAZIONI TERMICHE, MECCANICHE, CHIMICHE
(dal greco: che non può essere attraversato ES: POLISTIROLO)
(massa, composizione
e concentrazione)
Un sistema non isolato è separato dall’ambiente da PARETI DIATERMICHE
NON SONO POSSIBILI INTERAZIONI MECCANICHE, CHIMICHE, POSSIBILI QUELLE TERMICHE
(dal greco: attraversato dal calore = CONDUTTORE)
Se due sistemi che si trovano in stati termodinamici diversi sono messi in
CONTATTO TERMICO i loro stati macroscopici (le loro proprietà) VARIANO
I cambiamenti sono detti TRASFORMAZIONI TERMODINAMICHE
Si raggiunge una nuova condizione stazionaria, detta DI EQUILIBRIO TERMICO
fra i due sistemi
PRINCIPIO ZERO DELLA TERMODINAMICA:
Due sistemi in equilibrio
termico con un terzo
sistema sono in
equilibrio termico fra loro
Questo consente di introdurre il concetto di TEMPERATURA
(grandezza scalare)
Se due sistemi sono in equilibrio termico fra loro si dice che hanno la
STESSA TEMPERATURA
oppure:
Esiste una grandezza, detta TEMPERATURA, che caratterizza i
sistemi termodinamici in equilibrio. Due sistemi sono in equilibrio
termico fra loro se e solo se le loro temperature hanno lo stesso valore
Per la MISURA della temperatura (T) si utilizza un SISTEMA CAMPIONE,
detto TERMOMETRO, che presenta variazioni significative e misurabili di
una sua proprietà quando viene messo in CONTATTO TERMICO con sistemi
che hanno diversa temperatura
Definizione dell’UNITA’ di MISURA e della SCALA per la TEMPERATURA
Si deve scegliere una sostanza, detta SOSTANZA TERMOMETRICA,
che presenta una proprietà fisica dipendente in modo semplice dalla
TEMPERATURA (T), detta PROPRIETA’ TERMOMETRICA.
In generale ogni scala per la temperatura è legata ad una sostanza
termometrica e ad una proprietà termometrica particolare: le diverse
scale non necessariamente coincidono. Esiste però anche una SCALA
ASSOLUTA, INDIPENDENTE dalle proprietà di qualsiasi sostanza
(scala KELVIN)
In generale : T=f(x) , cioè il valore di temperatura T è legato da una relazione
funzionale al valore x di una opportuna proprietà termometrica. Nel caso più
semplice la relazione è lineare: T=ax+b
tarare la scala: nel semplice caso di una relazione lineare
si devono scegliere due punti fissi in modo da determinare le costanti a e b
E’ quindi necessario
Scala Celsius
¾ T=0 oC al punto di fusione dell’acqua (a pressione atmosferica)
¾ T=100 oC al punto di ebollizione dell’acqua (a pressione atmosferica)
¾ suddivisione della scala in 100 parti fra questi due punti: ogni tacca della
suddivisione corrisponde ad un grado Celsius (1 oC)
Scala Fahernheit
¾ Punto di congelamento di una miscela di ghiaccio e sale (T ~ 0 oF T ~ -18 °C)
¾ Temperatura normale del corpo umano (T ~ 98,6 oF , T ~ 36,6 oC)
¾ suddivisione della scala in 96 parti fra questi due punti: ogni tacca della
suddivisione corrisponde ad un grado Fahrenheit (1 oF)
TF = 9/5 TC + 32
ΔTF = 9/5 ΔTC
TERMOMETRI
Un esempio di dispositivo per la misura della temperatura è il comune
TERMOMETRO a MERCURIO:
sostanza termometrica = MERCURIO
proprietà termometrica = VOLUME (V ~T)
In generale la misura della temperatura è sensibile alla scelta della sostanza
termometrica, in particolare nei casi in cui i termometri operano lontano dai
punti di calibrazione.
Si è notato che i termometri a GAS a VOLUME COSTANTE sono
quelli che presentano minori differenze nella misura della temperatura
di uno stesso sistema al variare della sostanza termometrica
In questo caso
la proprietà
termometrica è
la PRESSIONE
Se si sostituisce T(°C) con T+273,15 si può far corrispondere il
valore T=0 alla condizione in cui p=0. In questo caso si ha
T = αx
(un solo punto di calibrazione)
Scala Kelvin
E’ stata introdotta una scala termometrica che utilizza UN SOLO PUNTO DI
CALIBRAZIONE ed una relazione di proporzionalità diretta fra temperatura e
variabile termodinamica: T = ax. Poiché non è semplice riprodurre con precisione
il punto di fusione e di ebollizione dell’acqua (dipendenti dalla sua purezza) si è
utilizzato come punto di calibrazione il PUNTO TRIPLO dell’acqua, lo stato
in cui coesistono 3 fasi, solida (ghiaccio), liquida (acqua), gassosa (vapore).
Al punto triplo:
TC = 0,01 oC,
p = 611 Pa
Per convenzione si è assunto che:
TC °C
¨ al punto triplo la temperatura dell’acqua sia T=273,16 K. Il Kelvin è definito
come la frazione 1/273,16 della temperatura del punto triplo dell’acqua
¨T
C
= T – 273,15 ΔT = ΔTC
TERMOMETRI
Il termometro a GAS a VOLUME COSTANTE può essere tarato
considerando un solo punto di calibrazione: il punto triplo dell’acqua
operando con la scala Kelvin
Misura della temperatura di ebollizione dell’acqua (T=373.125K)
ptr è la pressione del gas
al PUNTO TRIPLO
p
Τ ≈ 273,16
ptr
ptr
⎛
p ⎞
Τ = lim ⎜ 273,16 ⎟
ptr ⎠
ptr →0 ⎝
• He mostra la minore dipendenza da ptr
• consente misure di T fino a 5 K
Il KELVIN è stato assunto come unità di misura della temperatura nel Sistema
Internazionale. La scala Kelvin coincide con la SCALA ASSOLUTA della temperatura.
DILATAZIONE TERMICA
Δl = αlΔT
con
1 ⎛ ∂l ⎞
α= ⎜ ⎟
l ⎝ ∂T ⎠ p
l: lunghezza; Δl: variazione di lunghezza; ΔT: variazione di temperatura
α è definito COEFFICIENTE DI DILATAZIONE TERMICA LINEARE
(a pressione costante)
ΔV = β VΔT
con
1 ⎛ ∂V ⎞
β= ⎜
⎟
V ⎝ ∂T ⎠ p
V: volume; ΔV: variazione di volume; ΔT: variazione di temperatura
β
è definito COEFFICIENTE DI DILATAZIONE CUBICA
(a pressione costante)
Per una sostanza omogenea β=3α
Caso dell’acqua
LA CONDUZIONE DEL CALORE
Calore(Q): energia scambiata tra due sistemi unicamente
a causa della loro diversa temperatura
I meccanismi di scambio del calore sono di tre tipi:
CONDUZIONE, CONVEZIONE ED IRRAGGIAMENTO
CONDUZIONE
La trasmissione del calore per conduzione avviene senza spostamento macroscopico di
materia; parti di uno stesso corpo possono essere a temperatura diversa e dove è più elevata
la temperatura, maggiore è il moto di agitazione termica delle particelle che lo costituiscono
(nel caso di un solido è maggiore l’ampiezza della vibrazione degli atomi attorno alla posizione
di equilibrio; nel caso di un metallo a questa si aggiunge una maggiore velocità media degli
elettroni di conduzione; nel caso dei gas è maggiore l’energia cinetica delle molecole): a causa
delle interazioni fra le particelle del sistema (atomi, elettroni) un aumento locale del moto di
agitazione termica tende a trasmettersi alle regioni adiacenti
Il flusso di calore nell’unità di tempo è:
• proporzionale alla superficie A attraversata
• inversamente proporzionale a Δx
• proporzionale alla differenza di temperatura ΔT
La quantità di calore Q che nel tempo Δt attraversa una colonna
di altezza Δx e sezione A con una differenza di temperatura ΔT
ai suoi estremi è data da:
ΔT
Q = − kT A
Δt
Δx
dT
dt
e, al limite per variazioni infinitesime: δQ = − kT dA
dx
kT è un coefficiente caratteristico del materiale, detto CONDUCIBILITA’
TERMICA, espresso in W/m K; dipende dalla temperatura
Il segno – esprime il fatto che il
calore fluisce dalla faccia calda a
quella fredda (in direzione opposta
al gradiente di temperatura)
Gli estremi di una sbarra metallica
di lunghezza L sono posti a
contatto con due termostati
Il sistema raggiunge uno stato stazionario: la
temperatura in ogni punto della sbarra ed il FLUSSO
DI CALORE (Q/Δt) sono costanti nel tempo:
Q
T − TL
= kT A H
Δt
L
Se il calore fluisce attraversando due materiali di
diversa conducibilità termica K1 e K2 posti in contatto
(stessa sezione A), si deve porre la condizione che il
flusso di calore attraverso i due (o più materiali) sia lo
stesso:
T − Tx
T −T
Q
= kT ,1 A H
= kT , 2 A x L
L1
L2
Δt
TH e TL sono le temperature alle facce esterne
delle due lastre Tx quella alla interfaccia fra i due
materiali. Ricavando Tx e sostituendo si trova:
Q
T − TL
= H
A
Δt ∑ Li kT ,i
Se invece i due materiali sono posti in parallelo fra i due termostati i
flussi si sommano (stessa lunghezza L):
Q Q1 + Q2
TH − TL
=
= ∑ kT ,i A1
Δt
Δt
L
CONVEZIONE
Avviene con spostamento macroscopico di materia in fluidi (gas o liquidi) che
sono a contatto con un corpo caldo: la porzione di fluido si scalda e si dilata, e
per effetto della spinta di Archimede tende a salire, mentre il fluido più freddo
che lo sostituisce a sua volta si scalda, creando una circolazione di fluido
convettiva
IRRAGGIAMENTO
Emissione di onde elettromagnetiche da parte di corpi caldi: ha luogo anche in
vuoto. Si dimostra che l’energia emessa da un corpo alla temperatura T è
proporzionale a T 4
IRRAGGIAMENTO
legge dello spostamento di Wien
λmaxT = costante
= 2.898 ⋅10 −3 m ⋅ K
legge di Stefan-Boltzmann
∞
4
(
λ
,
)
d
λ
=
σ
E
T
T
∫
0
σ = 5.67051⋅10 −8 Wm − 2 K − 4
Q = εσAT Δt
4
A: superficie; ε<1 in genere
ε=1 completo assorbimento
(corpo nero)