Ricerca
www.salutare.info
a cura della dr.ssa Olga Fierro - Ricercatrice presso l’Istituto
di Scienze dell’Alimentazione del CNR di Avellino
La sintesi peptidica
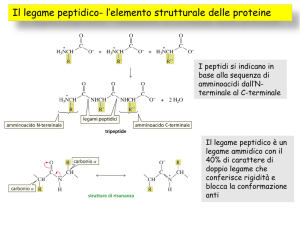
Un peptide è una molecola contenente due o più
amminoacidi (aa) in cui il gruppo carbossilico di un
amminoacido si lega covalentemente al gruppo amminico
dell’altro formando il legame ammidico o peptidico.
Nella chimica moderna, i peptidi ricoprono
un ruolo di fondamentale importanza
dovuto alla loro larga disponibilità ed
al vasto spettro di attività che svolgono
in molti processi biochimici. Sono noti
numerosi peptidi biologicamente attivi i
quali, legandosi ai corrispondenti recettori, influenzano la comunicazione tra
cellule e controllano svariate funzioni vitali
come metabolismo, difese immunitarie
e riproduzione.
Tutto ciò ha posto i peptidi al centro
dell’interesse biomedico come composti
potenzialmente utili per lo sviluppo di
nuovi farmaci. Isolarli da fonti naturali per
disporne in quantità sufficienti allo scopo
di studiarne la relazione struttura-funzione
oltre che utilizzarli nei settori biomedico
e farmacologico risulta estremamente
oneroso: la sintesi chimica è in grado di
fornire le quantità necessarie alle applicazioni richieste.
La sintesi peptidica può essere effettuata
secondo due differenti metodiche: in
fase liquida o in soluzione e in fase solida,
in entrambi i casi la strategia prevede
sempre di iniziare dalla parte carbossiterminale della molecola e allungare la
catena peptidica verso la parte ammino-terminale; inoltre, sia che si lavori in
soluzione che in fase solida, la formazione
del legame ammidico non si ottiene per
semplice “combinazione” degli aa che
costituiscono la sequenza, ma secondo
un controllo accurato della reazione di
condensazione o coupling.
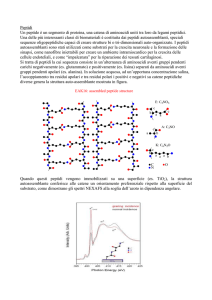
La sintesi peptidica in fase solida (SPPS),
introdotta da R. Merrifield (Nobel per la
chimica 1984), impiega un supporto solido, insolubile e inerte (resina) su cui far
crescere il peptide.
La resina viene funzionalizzata con spaziatori chimici (linkers) a cui viene ancorato
covalentemente il primo amminoacido
mediante la funzione carbossilica libera
lasciando quella amminica opportunamente protetta.
Il principio generale della SPPS è costituito
dalla ripetizione di cicli di deprotezione e
coupling: il gruppo amminico del primo
residuo ancorato alla resina via linker
viene deprotetto e fatto reagire con il
carbossile libero di un nuovo amminoacido anch’esso N-α-protetto. A sintesi
ultimata il peptide viene staccato dal6
www.salutare.info
natura polare del legame ammidico.
Pertanto, qualunque modificazione dello scheletro peptidico tende a ridurre
o ad eliminare la possibilità di degradazione proteolitica. Nel campo della
drug discovery è ormai estremamente
diffuso il concetto di pseudopeptidi e
peptidomimetici ossia di macromolecole
che mimano il peptide naturale ma che
hanno un profilo farmacologico migliore. Impiegando la SPPS e mettendo a
punto protocolli sintetici opportuni è
possibile trasformare una molecola in
una analoga parzialmente o totalmente
non peptidica.
Tra le più importanti modificazioni, oggetto
tra l’altro delle principali linee di ricerca
del nostro laboratorio, si citano:
• inserzione lungo la catena
di D-aa e di altri aa innatuSintesi peptidica in fase solida
rali per la preparazione di
analoghi peptidici lineari o
ciclici metabolicamente più
stabili;
• preparazione di isosteri
peptidici in cui il raggruppamento -CONH- del legame
ammidico naturale viene
sostituito da una funzione
avente caratteristiche strutturali simili ma chimicamente
diverse.
Generare nuovi tools molecolari
permette quindi di individuare
molecole potenti e selettive
che possono migliorare la
severamente limitato dalla loro scarsa conoscenza dei rispettivi target biologici
biodisponibilità dovuta alla loro rapida e servire come punto di partenza per lo
degradazione enzimatica legata alla sviluppo di nuovi farmaci.
la resina utilizzando specifiche miscele
chimiche acide.
Mediante la SPPS è possibile sintetizzare
in laboratorio peptidi costituiti da pochi
aa fino ad arrivare a piccole proteine, il
tutto è reso ancora più accessibile poiché il processo è stato automatizzato;
esistono sintetizzatori peptidici computerizzati grazie ai quali si possono ottenere
peptidi a lunga catena in tempi brevi
e con rese elevate; essi permettono al
chimico sintetico di intervenire in qualunque momento sulle procedure di sintesi
modificandone la strategia o i parametri
specifici (solventi e/o reagenti).
Nonostante il loro enorme coinvolgimento in molti processi biologici l’uso
dei peptidi come agenti terapeutici è
Per ulteriori informazioni:
Dr Gianvincenzo Barba - Dr Alfonso Siani
Istituto di Scienze dell’Alimentazione, CNR
Via Roma 52 AC - 83100 Avellino
Tel. 0825 299 353 - Centralino 0825 299 111
fax 0825 299 423
e-mail: [email protected] - [email protected]