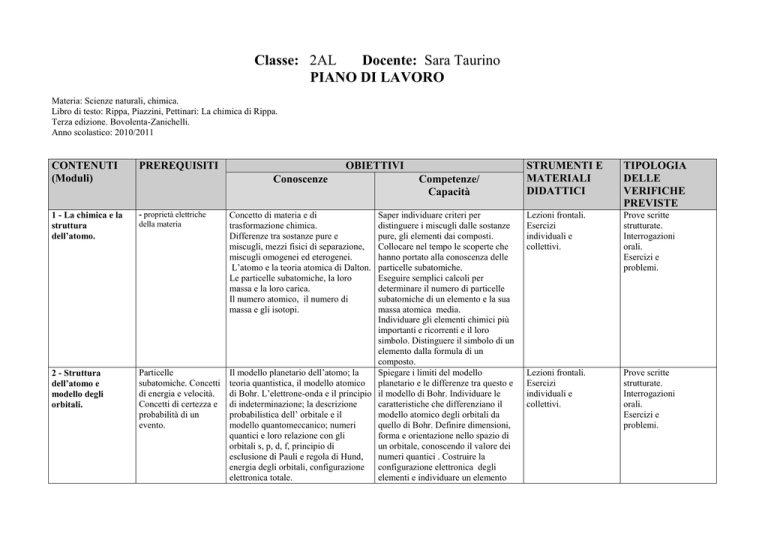
Classe: 2AL
Docente: Sara Taurino
PIANO DI LAVORO
Materia: Scienze naturali, chimica.
Libro di testo: Rippa, Piazzini, Pettinari: La chimica di Rippa.
Terza edizione. Bovolenta-Zanichelli.
Anno scolastico: 2010/2011
CONTENUTI
(Moduli)
PREREQUISITI
1 - La chimica e la
struttura
dell’atomo.
- proprietà elettriche
della materia
2 - Struttura
dell’atomo e
modello degli
orbitali.
Particelle
subatomiche. Concetti
di energia e velocità.
Concetti di certezza e
probabilità di un
evento.
OBIETTIVI
Conoscenze
Concetto di materia e di
trasformazione chimica.
Differenze tra sostanze pure e
miscugli, mezzi fisici di separazione,
miscugli omogenei ed eterogenei.
L’atomo e la teoria atomica di Dalton.
Le particelle subatomiche, la loro
massa e la loro carica.
Il numero atomico, il numero di
massa e gli isotopi.
Competenze/
Capacità
Saper individuare criteri per
distinguere i miscugli dalle sostanze
pure, gli elementi dai composti.
Collocare nel tempo le scoperte che
hanno portato alla conoscenza delle
particelle subatomiche.
Eseguire semplici calcoli per
determinare il numero di particelle
subatomiche di un elemento e la sua
massa atomica media.
Individuare gli elementi chimici più
importanti e ricorrenti e il loro
simbolo. Distinguere il simbolo di un
elemento dalla formula di un
composto.
Il modello planetario dell’atomo; la
Spiegare i limiti del modello
teoria quantistica, il modello atomico planetario e le differenze tra questo e
di Bohr. L’elettrone-onda e il principio il modello di Bohr. Individuare le
di indeterminazione; la descrizione
caratteristiche che differenziano il
probabilistica dell’ orbitale e il
modello atomico degli orbitali da
modello quantomeccanico; numeri
quello di Bohr. Definire dimensioni,
quantici e loro relazione con gli
forma e orientazione nello spazio di
orbitali s, p, d, f, principio di
un orbitale, conoscendo il valore dei
esclusione di Pauli e regola di Hund,
numeri quantici . Costruire la
energia degli orbitali, configurazione
configurazione elettronica degli
elettronica totale.
elementi e individuare un elemento
STRUMENTI E
MATERIALI
DIDATTICI
TIPOLOGIA
DELLE
VERIFICHE
PREVISTE
Lezioni frontali.
Esercizi
individuali e
collettivi.
Prove scritte
strutturate.
Interrogazioni
orali.
Esercizi e
problemi.
Lezioni frontali.
Esercizi
individuali e
collettivi.
Prove scritte
strutturate.
Interrogazioni
orali.
Esercizi e
problemi.
dalla sua configurazione elettronica
3 – La tavola
periodica degli
elementi.
Numero atomico e
numero di massa.
Configurazione
elettronica degli
elementi.
4 - I legami chimici.
Configurazione
elettronica degli
elementi, regola
dell’ottetto,
elettronegatività,
molecole, ioni.
5- Nomenclatura dei Configurazione
elettronica esterna
composti
degli elementi.
inorganici.
Molecole, ioni.
Formula molecolare e
di struttura.
Elettronegatività.
Tavola periodica degli elementi.
Sistema periodico degli elementi.
Le caratteristiche chimiche e fisiche
principali dei gruppi della Tavola
Periodica.
L’andamento periodico di alcune
proprietà (volume atomico, energia di
ionizzazione, elettronegatività, affinità
elettronica)
Assegnare gli elettroni di valenza agli
elementi di un gruppo.
Collocare un elemento dato nel
Sistema periodico, in base alle sue
proprietà.
Ricavare le proprietà di un elemento
dalla sua posizione nel Sistema
periodico. Scrivere la configurazione
elettronica totale ed esterna di un
elemento in base alla posizione
occupata nel Sistema periodico.
Legame chimico.
Rappresentare la configurazione
Formula chimica, formula molecolare elettronica esterna degli atomi con i
e di struttura, simboli di Lewis.
simboli di Lewis. Spiegare la
Legame covalente omopolare,
differenza tra legame covalente e
eteropolare, dativo. Legame sigma e π, ionico e tra composti molecolari e
doppio e triplo legame. Legame
ionici. Riconoscere un legame ionico,
ionico, legame metallico. Dipolo;
covalente eteropolare e covalente
legame intermolecolare, legame
omopolare. Riconoscere
idrogeno, molecola polare e apolare.
dall’elettronegatività di due elementi
che tipo di legame si può formare tra
di essi. Collegare le proprietà dei
metalli con il legame metallico.
Spiegare il ruolo del legame idrogeno
nel determinare le proprietà fisiche
dell’acqua. Collegare la polarità o
apolarità di una sostanza alle sue
proprietà fisiche (solubilità,
miscibilità).
Concetti di valenza e di numero di
Calcolare il numero di ossidazione di
ossidazione. Regole per il calcolo del un elemento in un composto.
numero di ossidazione di un elemento Ricavare dal numero di ossidazione
in n composto. Nomenclatura chimica, degli elementi le formule minime dei
tradizionale, IUPAC.
composti.
Nomi e formule di: ossidi basici,
Scrivere la formula molecolare di un
anidridi, idruri, idracidi, idrossidi,
composto in base al nome previsto
ossiacidi e sali. Reazione di
dalla nomenclatura tradizionale o
formazione di alcune classi di
IUPAC; assegnare il nome previsto
composti.
dalla nomenclatura tradizionale o
Lezioni frontali
interattive.
Esercizi
individuali e
collettivi.
Prove scritte
strutturate.
Interrogazioni
orali.
Esercizi e
problemi.
Lezioni frontali
interattive.
Esercizi
individuali e
collettivi.
Prove scritte
strutturate.
Interrogazioni
orali.
Esercizi e
problemi.
Lezioni frontali
interattive.
Esercizi
individuali e
collettivi.
Prove scritte
strutturate.
Interrogazioni
orali.
Esercizi e
problemi.
IUPAC data la formula molecolare del
composto.
6 - La mole e il
calcolo
stechiometrico.
Peso atomico e peso
molecolare, unità di
massa atomica,
calcolo del peso
molecolare di una
sostanza data la
formula molecolare.
7– Lo stato
aeriforme.
Massa, volume,
densità, temperatura,
pressione. Gli stati di
aggregazione della
materia. Numero di
Avogadro, mole,
massa molare.
Castiglione dei Pepoli, 8 novembre 2010.
Quantità di sostanza, mole, numero di
Avogadro, massa molare,
stechiometria.
Formula minima e formula
molecolare. Reazione ed equazione
chimica, bilanciamento di
un’equazione chimica, coefficiente
stechiometrico.
Calcolare la massa molare di un
elemento e di un composto.
Data la formula di un composto,
calcolare la quantità di un elemento
che si combina con una quantità data
di un altro elemento; dalla massa in
grammi di una sostanza ricavare il
numero corrispondente di moli e
viceversa. Calcolare il numero di
particelle (atomi o molecole)
contenute in una data quantità di
sostanza. Data la formula di una
sostanza, ricavare la composizione
percentuale; data la composizione
percentuale di una sostanza, ricavare
la formula minima. Bilanciare
semplici equazioni chimiche.
Dall’equazione bilanciata di una
reazione chimica e dalla massa di uno
dei reagenti o prodotti, ricavare la
massa di ciascuno dei reagenti o
prodotti della reazione.
Gas ideale e gas reale. Leggi di Boyle, Riconoscere le variabili che
Gay-Lussac e Charles.
determinano lo stato di un gas.
Scala della temperatura assoluta,
Distinguere il comportamento di un
kelvin. Legge di Avogadro, volume
gas reale da quello del gas ideale.
molare dei gas, equazione di stato del Applicare le leggi dei gas per
gas ideale. Gas e vapore.
calcolare le variazioni di temperatura,
pressione e volume che caratterizzano
le trasformazioni di un gas.
Interpretare lo zero asoluto della
temperatura sulla base delle leggi dei
gas. Applicare l’equazione di stato del
gas ideale per risolvere problemi
relativi alle trasformazioni dei gas
Lezioni frontali
interattive.
Esercizi
individuali e
collettivi.
Prove scritte
strutturate.
Interrogazioni
orali.
Esercizi e
problemi.
Lezioni frontali
interattive.
Esercizi
individuali e
collettivi.
Prove scritte
strutturate.
Interrogazioni
orali.
Esercizi e
problemi.












