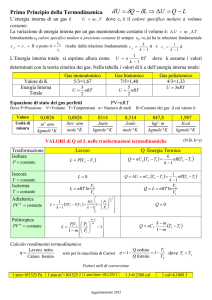
Leggi dei gas ideali
( a cura di Raffaella Gianferri e Giuliano Moretti)
(In questa prima versione non sono state inserite le foto che illustrano gli apparati
sperimentali impiegati.)
1. Derivazione dell’equazione dei gas ideali a partire dalle leggi di Boyle e di GayLussac e dall’ipotesi di Avagadro (metodo di van’t Hoff)
2. Misura del volume di un gas raccolto su acqua
3. Determinazione della massa molare di una sostanza volatile (breve commento sui
metodi di Dumas, Meyer e Hoffmann)
4. Teoria cinetica dei gas: verifica della legge di Graham
Introduzione
Con questa lezione sperimentale si mostrerà come a partire dai risultati descritti delle
leggi di Boyle e di Gay-Lussac e dall’applicazione dell’ipotesi di Avogadro si può
derivare la legge dei gas ideali
PV=nRT
(1)
Tale approccio fenomenologico utilizzato da van’t Hoff prescinde dalla teoria cinetica
dei gas sviluppata da Maxwell in una serie di lavori pubblicati a partire dal 1860.
L’equazione dei gas ideali mette in relazione pressione (P), volume (V) e temperatura
assoluta (T) del gas con la quantità di sostanza (n), per mezzo della costante molare dei
gas (R = 8.31 J mol-1K-1 = 0.0821 L atm mol-1K-1 = 0.0831 L bar mol-1K-1) descrivendo
bene il comportamento di tutti i gas a valori di pressione non eccessivamente elevati e a
temperature non eccessivamente basse.
Come applicazione pratica dell’Eq.(1) verrà misurata la quantità di idrogeno svolto dalla
reazione tra HCl(aq) e Zn(s). Inoltre verranno brevemente descritti i metodi di Dumas,
Meyer e Hoffmann per la determinazione della massa molare di un gas o vapore o di una
sostanza facilmente voporizzabile.
Come applicazione dell’equazione dei gas ideali derivata dai presupposti della teoria
cinetica verrà verificata la validità della legge di Graham che descrive la relazione tra
velocità di effusione di un gas attraverso un foro sottile e la sua massa molecolare.
Esercizio 1. A partire da R = 0.0821 L atm mol-1K-1 derivare tutti i valori di R nelle altre
unità di misura: J mol-1K-1 ; L bar mol-1K-1 ; cal mol-1K-1. Si derivi inizialmente la
relazione tra le unità atm, Torr (mmHg), Pa (Nm-2), bar e kgcm-2.
1. Derivazione dell’equazione dei gas ideali (metodo di van’t Hoff)
Nel 1887 van’t Hoff descrisse la pressione osmotica delle soluzioni diluite per mezzo
dell’analogia con la pressione esercitata da una specie gassosa alla stessa concentrazione
molare (mol L-1). Egli pose in evidenza il fatto che l’equazione dei gas ideali includendo
la legge di Boyle, la legge di Gay-Lussac e l’ipotesi di Avogadro si può facilmente
dedurre da questi enunciati seguendo un approccio fenomenologico senza intervento della
teoria cinetica dei gas.
1.1 Verifica della legge di Boyle
Preleviamo un volume V di un dato gas (la massa del gas corrispondente sarà M ) ad una
data temperatura ed alla pressione costante dell’ambiente (lettura al barometro).
Studiamo sperimentalmente come cambia il volume in funzione della pressione P, alla
temperatura dell’ambiente t (espressa in gradi Celsius, °C) costante.
Utilizziamo una siringa (con ago applicato) riempita con uno dei gas disponibili (He, N2,
O2, Ar, CO2, SF6): a pistone completamente abbassato introduciamo delicatamente l’ago
nella membrana di gomma collegata alla bombola; si lascia fluire il gas fino alla divisione
corrispondente al volume massimo; si sfila l’ago dalla membrana e si elimina l’eccedenza
di gas rispetto al volume V.
Riportiamo i risultati dell’esperimento relativo alla verifica sperimentale della legge di
Boyle per l’ossigeno. Notiamo che lo stesso risultato sperimentale si ottiene anche per
tutti gli altri gas. La legge di Boyle vale per tutti i gas a prescindere dalla loro natura
chimica.
Si chiude l’ago configgendolo delicatamente ma profondamente dentro un tappo di
gomma e si fissa la siringa verticalmente all’apposito sostegno, con l’ago rivolto verso il
basso. Si annota il volume letto sulla scala graduata della siringa (pressione ambiente P0
2
= 1.00 atm). A questo punto si adatta al pistone il piattello con asta facendo passare
quest’ultima attraverso l’anello fissato al sostegno. Si registra di nuovo il volume che
corrisponde alla nuova pressione (P1) determinata dal maggior peso che grava sul pistone
(area del pistone = πr2 = 5.52 cm2). Si aggiungono quindi tutti gli altri pesi, uno ad uno,
registrando ogni volta il volume d’equilibrio del gas nella siringa. Dopo ogni variazione
di pressione si attende sempre qualche secondo prima di registrare il volume per dar
modo al pistone di raggiungere la sua posizione d’equilibrio. Ogni lettura del volume può
essere data con l’incertezza della mezza divisione, cioè 0.5 mL. La temperatura del
laboratorio, costante per la durata dell’esperimento, era di 24 °C. La pressione esercitata
sul gas si calcola per mezzo dell’Eq.(2)
Pj = P0 + Σ j mj/(1.033x5.52)
(2)
La sommatoria va da j = 0 a j = 10: per j = 0 abbiamo il pistone sotto la pressione di 1.00
atm; quando j = 1 sul pistone abbiamo sistemato solo il piattello con l’asta; quando j = 2
abbiamo aggiunto il primo peso, etc. (masse espresse in kg). Si noti che dopo aver
aggiunto l’ultimo peso ( j = 10) si procede seguendo l’aumento del volume togliendo i
pesi dal piattello. (Eq.(2):
il fattore 1.033 (kg cm-2atm-1) permette di convertire la
pressione da kg cm-2 ad atm, vedi Esercizio 1.)
La Tab.1 riporta tutti i dati sperimentali relativi ad un volume iniziale di 60 mL di
ossigeno misurati alla temperatura costante di 24 °C ed pressione 1.00 atm. A causa
dell’attrito che il pistone incontra nel suo movimento volume il misurato aumentando la
pressione, indicato come V- , non coincide con il volume misurato dopo aver tolto i pesi
dal piattello, indicato con V+. La verifica della legge di Boyle è effettuata utilizzando la
media dei due volumi, Vmedio = (V- + V+)/2. Le Fig. 1, 2 e 3 mostrano la conferma della
legge di Boyle: per una data massa di gas è costante, a temperatura costante, il prodotto
tra la pressione del gas ed il volume da esso occupato
P V = cost (t)
(3)
Nell’Eq.(3) abbiamo indicato la costante come cost (t) per evidenziare la dipendenza di
3
tale valore dalla temperatura. Essa dipende anche dalla massa del gas presa in esame,
cioè dal numero di molecole corrispondenti alla data massa di gas.
Effettuando l'esperienza con diversi gas si scopre che la legge di Boyle risulta valida per
tutti i gas, a prescindere dalla loro natura chimica (se la temperatura non è
particolarmente bassa e la pressione non eccessivamente elevata; condizioni sperimentali
che comunque non possiamo realizzare con la nostra semplice apparecchiatura). Il valore
numerico della costante nell'Eq.(3) non dipende dal gas studiato se si preleva lo stesso
volume iniziale misurato alla stessa pressione e alla stessa temperatura. Si noti comunque
che la massa del volume prelevato, nelle stesse condizioni di temperatura e pressione,
dipende dalla natura chimica del gas
Tab.1 Verifica della legge di Boyle. Volume iniziale di 60 mL di ossigeno, temperatura
costante = 24 °C, pressione 1.00 atm. V- rappresenta il volume misurato aumentando la
pressione, V+ il volume misurato diminuendo la pressione togliendo i pesi aggiunti: i due
valori risultano diversi a causa dell’attrito che il pistone incontra nel suo movimento. La
verifica della legge di Boyle è effettuata utilizzando la media dei due volumi.
j
mj / Kg
Pj / atm
V- / mL
V+ / mL
Vmedio / mL
P Vmedio / atm mL
0
0
1.00
60.0
56.0
58.0
58.0
1
0.707
1.12
57.0
49.5
53.3
59.6
2
0.918
1.29
48.0
44.5
46.3
59.7
3
0.919
1.45
43.0
39.0
41.0
59.5
4
0.916
1.61
39.0
35.0
37.0
59.6
5
0.916
1.77
35.0
32.0
33.5
59.3
6
0.918
1.93
31.5
29.0
30.3
58.4
7
0.918
2.09
29.0
27.0
28.0
58.5
8
0.909
2.25
27.0
25.0
26.0
58.5
9
0.913
2.41
25.0
23.5
24.3
58.4
10
0.918
2.57
23.0
23.0
23.0
59.1
4
V
medio
/ mL
Verifica della legge di Boyle t = 24 °C
60
55
50
45
40
35
30
25
20
1.00
1.50
2.00
2.50
3.00
P / atm
Fig.1 Andamento del volume di gas (in questo esempio O2 ma lo stesso andamento si
osserva per tutti i gas studiati) in funzione della pressione alla temperatura costante di 24
°C.
5
PV
medio
/ atm mL
80.0
Verifica della legge di Boyle
PV = cost
t = 24°C
70.0
60.0
50.0
40.0
1.00
1.50
2.00
2.50
3.00
P / atm
Fig.2 Andamento del prodotto PV in funzione di P (in questo esempio il gas studiato è
O2, vedi Fig.1) alla temperatura costante di 24 °C.
6
PV
medio
/ atm L
80
Verifica della legge di Boyle PV = cost t = 24°C
70
60
50
40
20
30
40
50
60
V / mL
Fig.3 Andamento del prodotto PV in funzione di V (in questo esempio il gas studiato è
O2, vedi Fig.1) alla temperatura costante di 24 °C.
1.2 Verifica della legge di Gay-Lussac
Con la nostra apparecchiatura possiamo anche studiare come varia il volume occupato dal
gas
in funzione della temperatura, a pressione costante. Per questo esperimento
utilizziamo la stessa siringa contenente questa volta un minore volume di gas, dovendo
studiare la sua espansione alla pressione costante di 1.00 atm in funzione della
temperatura. Il pistone è libero di scorrere - a parte l’attrito della sua guarnizione di
7
tenuta con la parete interna della siringa - essendo la pressione del gas sempre in
equilibrio con la pressione esterna. La siringa viene completamente immersa in acqua.
La temperatura dell’acqua può essere aumentata per riscaldamento tramite una piastra
riscaldante dalla temperatura ambiente fino a oltre 90 °C.
Ad ogni temperatura,
raggiunto l’equilibrio, registriamo il volume occupato dal gas. I risultati sperimentali
sono riportati nella Tab.2.
Tab.2 Verifica della legge di Guy-Lussac alla pressione costante pari a 1.00 atm. Volume
iniziale di 40.0 mL di ossigeno, misurato alla temperatura di 20 °C ed alla pressione di
1.00 atm.
t / °C
V / mL
20
40.0
68
46.5
77
48.0
87
49.0
90
49.5
93
50.0
In Fig.4 riportiamo in grafico come varia il volume di ossigeno in funzione della
temperatura, alla pressione costante di 1.00 atm: il risultato rappresenta la legge di
Gay-Lussac
V = V0 (P) + s (P) t
(4)
I valori costanti V0 (P) e s (P) sono riportati in modo da rendere esplicito che essi
dipendono dalla pressione a cui si effettua l’esperimento, cioè dalla massa del gas
contenuto nel volume iniziale.
Anche la legge di Gay-Lussac, nei limiti per cui risulta valida la legge di Boyle, descrive
il comportamento di tutti i gas (stesso volume iniziale misurato nelle stesse condizioni di
di pressione e temperatura) a prescindere dalla loro natura chimica.
8
Verifica della legge di Gay-Lussac
P = cost = 1.00 atm
V / mL
V=V +st
0
60
50
40
V
0
30
20
10
t = -273 °C
0
-300
-250
-200
-150
-100
-50
0
50
100
t / °C
Fig.4 Andamento del volume di ossigeno V in funzione della temperatura alla pressione
costante di 1.00 atm. Tutti i gas studiati nelle stesse condizioni (volume iniziale di 40.0
mL prelevati a 20°C e 1.00 atm) vengono descritti dalla stessa retta.
9
L’Eq.(4) rappresenta una retta con intercetta V0 (il volume del gas alla temperatura
t = 0 °C) e pendenza s. Sotto un certo valore della temperatura la legge di Gay-Lussac
non è più seguita, comunque è utile estrapolare i punti sperimentali della retta descritti
dall'Eq.(4), vedi Fig.4, per ottenere la temperatura a cui V = 0.
A prescindere dalla
natura del gas in esame, si ottiene sperimentalmente un valore molto prossimo a t = - 273
°C. Possiamo quindi scrivere
s = V0 / 273 = α V0
(5)
dove abbiamo posto α = 1/273. Dalle eqs.(4) e (5) otteniamo
V = V0 (1 + α t)
(6)
Osservando che (1 + α t) = (273 + t) / 273 possiamo definire una scala assoluta della
temperatura (unità di misura kelvin, simbolo K) mediante la relazione
T = 273 + t
(7)
L’equazione di Gay-Lussac esprime quindi la proporzionalità diretta tra volume del gas e
sua temperatura assoluta a pressione costante
V = V0 T / 273
(8)
Dalle equazioni (6) e (8) ricaviamo che tutti i gas a comportamento ideale e a pressione
costante hanno lo stesso coefficiente d’espansione: α = (1/ V0) ∂V/∂t = (1/ V0) ∂V/∂T =
1/273.
1.3 Ipotesi di Avogadro
L’ipotesi di Avogadro pone in relazione diretta il volume di gas misurato a temperatura e
pressione costanti, con il numero di molecole presenti (che ovviamente dipendono dalla
massa del gas e dalla sua natura chimica) :
10
V = cost (P, T) N
(9)
Il numero delle molecole N è legato alla massa totale del gas (Mi ) ed alla massa della
singola molecola (mi)
N = Mi / mi
(10)
A questo punto è possibile combinare le Eq.(3, 8 e 9), cioè la legge di Boyle, la legge di
Gay-Lussac e l’ipotesi di Avogadro ed ottenere la “legge dei gas ideali” :
PV = kB TMi / mi
(11)
Con kB abbiamo indicato una costante indipendente dalla natura del gas studiato (costante
fondamentale di Boltzmann). Considerando una data massa di gas costante dall’Eq.(11)
appare evidente che: 1) a temperatura costante il prodotto PV è costante (legge di Boyle);
2) a pressione costante il volume risulta proporzionale alla temperatura assoluta (legge di
Gay-Lussac); 3) a pressione e temperatura costanti il volume del gas è direttamente
proporzionale al numero delle molecole. Tale relazione ci permette di ottenere la
relazione tra la costante molare dei gas e la grandezza fondamentale dei chimici, la
quantità di sostanza, e la sua unità di misura, la mole.
Misuriamo la massa degli atomi e delle molecole relativamente ad una massa di
riferimento, in particolare oggi il riferimento ufficiale è rappresentato da (1/12) della
massa dell’isotopo di carbonio
12
C, quindi la massa atomica relativa del gas è data da
mi/(1/12)m12C = 12mi/m12C = Mi .
Moltiplichiamo numeratore e denominatore dell’Eq.(11) per 12/m12C
PV = kB (12/m12C) [Mi /(12mi/m12C)] T
(12)
La costante di Avogadro è definita dall’equazione
11
NA = 12/ m12C
(13)
rappresentando il numero di atomi presenti in 12 grammi esatti dell’isotopo 12C ( 1/ m12C
rappresenta il numero di atomi contenuti in un grammo di isotopo 12C).
Quindi
PV = kB NA [Mi /(12mi/m12C)] T
(14)
che possiamo riconoscere come equivalente all’Eq.(1)
PV = R (Mi /Mi ) T = n R T
(15)
dove Mi = 12mi/m12C = mi NA rappresenta qui la massa molare del gas espressa in gmol-1.
La mole (simbolo mol) è definita nel SI come la quantità di sostanza che contiene tante
entità elementari (atomi, molecole, ioni, elettroni, altre particelle o gruppi specificati di
tali particelle) quanti sono gli atomi
contenuti in 12 grammi esatti dell’isotopo
12
C,
cioè il valore della costante di Avogadro, NA = 6.022 1023 mol-1.
Data una certa massa di sostanza (Mi in g), conoscendo la massa di una singola molecola
(mi in g) possiamo scrivere
n = N / NA
= (Mi /mi) / NA
= Mi / (mi NA)
= Mi / Mi
(16)
Nella Tab.3 seguente riportiamo la massa di un volume di 50.0 mL di ogni gas utilizzato
per la verifica delle leggi di Boyle e di Gay-Lussac, secondo le modalità sopra esposte. Si
noti che l’accuratezza della bilancia tecnica (centesimo di grammo) non permette di
misurare la massa di 50.0 mL di He misurati a temperatura ambiente (t = 20°C, T = 293
K) ed alla pressione dell’ambiente (1016 hPa = 1.003 atm): la massa della siringa vuota e
la massa della siringa riempita con He danno lo stesso valore (precisione ± 0.01 g).
12
Esercizio 2. Per approfondimenti storici relativi alla determinazione della costante
universale dei gas vedi il contributo “La legge dei gas ideali – la costante molare R”
disponibile su http://www.chem.uniroma1.it/moretti (materiale didattico).
Esercizio 3. Considerando l’aria come una miscela di ossigeno , azoto e argon al 20% ,
79% e 1% in volume (frazioni molari %) usare l’equazione dei gas ideali per definire e
calcolare la massa molare media dell’aria. (Risposta: Maria = 28.9 g mol-1)
Esercizio 4. Un pallone pieno d’aria pesa 39.50 g, lo stesso pallone vuoto pesa 37.90 g e
riempito con il gas in esame pesa 39.45 g. Aria e gas in esame sono misurati nelle stesse
condizioni di pressione e temperatura. Determinare la massa molare del gas. (Risposta:
M = 28.0 g mol-1)
Tab.3 Massa di 50.0 mL dei gas disponibili in laboratorio per la verifica delle leggi di
Boyle e di Gay-Lussac (T = 293 K, P = 1.00 atm).
Gas
M /gmol-1
ΔM/ gmol-1
(50.0 mL, 293 K, 1.00 atm)
Δ M /g
rispetto alla siringa vuota
He
4.003
0
< 0.01
N2
28.02
24.02
0.04
O2
32.00
28.00
0.05
Ar
39.95
35.95
0.07
CO2
44.01
40.01
0.08
SF6
146.1
142.1
0.29
I dati in Tab.3 possono essere utilizzati per verificare l’Eqs.(1) e (15), come mostrato nel
grafico di Fig.5. La differenza tra la massa molare di un dato gas rispetto alla massa
molare dell’elio preso come riferimento deve risultare una funzione lineare della
differenza tra la massa di 50.0 mL del gas rispetto alla massa dello stesso volume di elio.
La relazione si ottiene a partire dalla massa molare del gas riportata in funzione di P,T,V
ed m usando l’equazione dei gas ideali. Nella figura la linea tratteggiata rappresenta la
retta teorica calcolata in base ai valori V = 50.0 mL, T = 293 K, P = 1.00 atm ed R =
0.0821 L atm mol-1 K-1. (Si noti che effettivamente la massa del volume di 50.0 mL di He
13
non è apprezzabile con una bilancia tecnica essendo M He < 0.01 g).
(M - M ) / gmol-1
He
(M-M ) = (RT/PV)(M - M ) = 481.1(M - M )
150
He
He
He
SF
6
100
50
N
0
0
O
CO
2
Ar
2
2
0.05
0.10
0.15
0.20
0.25
0.30
0.35
(M - M )/ g
He
Fig.5 Verifica della legge dei gas ideali, Eq.(1), effettuata utilizzando per i diversi gas a
disposizione i dati riportati in Tab.3. La linea tratteggiata rappresenta la retta teorica La
retta teorica descrive abbastanza bene i dati sperimentali e potrebbe essere utilizzata per
stimare la massa molare di un gas dal valore sperimentale di ΔM = (M – M He).
14
I dati in Tab.3 permettono anche di stimare la densità del gas in esame a 293 K e 1,00
atm, infatti dall’Eq.(1)
d = P M /RT ≈ (ΔM + 0.01) x1000/50 gL-1
(17)
I valori calcolati danno un valore stimato in eccesso per la densità del gas, ovviamente
per calcolare la densità dell’elio si deve considerare Δ M = 0.
Esercizio 5. Calcolare il valore della massa di 50.0 mL di He misurati a 293 K ed alla
pressione di 1.00 atm utilizzando l’equazione dei gas ideali. Utilizzando l’Eq.(17)
stimare i valori delle densità gassose per i gas studiati a 293 K e 1.00 atm. Confrontare i
dati sperimentali con i valori teorici.
Esercizio 6. Studiare nel libro di testo il capitolo dedicato all’equazione di van der
Waals utile per descrivere il comportamento dei gas reali ad alta pressione e/o bassa
temperatura.
2. Misura del volume di un gas raccolto su acqua
La reazione tra acido cloridrico e zinco metallico produce idrogeno molecolare ed una
soluzione di cloruro di zinco secondo la reazione
2 HCl(aq) + Zn(s) → ZnCl2(aq) + H2(g)
Il gas può essere raccolto entro un cilindro graduato su acqua con un sistema
sperimentale molto semplice.
Inizialmente il cilindro è riempito d’acqua, quindi
tenendolo capovolto nella bacinella, impedendo la fuoriuscita dell’acqua, viene posto in
posizione verticale e fissato ad una pinza di sostegno.
La pressione atmosferica
impedisce alla colonna d’acqua di scendere.
Il pallone di reazione contenente al suo interno lo zinco metallico (nella nostra esperienza
15
mZn = 94.5 mg) è dotato di due colli. Nel primo collo sistemiamo un imbuto da carico
contenente la soluzione di HCl (15 mL, 6 M), mentre nel secondo sistemiamo un giunto
che permette di collegare per mezzo di un tubo di gomma il pallone con il cilindro
capovolto pieno d’acqua. (Per evitare che bolle d’aria entrino nel cilindro falsando la
misura il tubo di gomma deve essere inizialmente riempito con acqua.) Il gas sviluppato
nel pallone in seguito all’aggiunta di HCl sposta un uguale volume di acqua nel cilindro
di misura. Cessato lo sviluppo di gas si legge la temperatura esterna (t = 21 °C), la
pressione esterna con il barometro a disposizione in laboratorio (Patm = 1015 hPa
equivalente a 1.002 atm) ed il dislivello dell’acqua tra interno ed esterno del cilindro
(h H2O = 63 mm).
La pressione del gas nel cilindro espressa in atmosfere vale
P = Patm – PH2O – [(hH2O dH2O/dHg)/760]
(18)
dove PH2O rappresenta la tensione di vapore dell’acqua a 21 °C in atm ( 2.4877 kPa
equivalente a 0.024552 atm). Tale valore si ottiene da tabelle che riportano coppie di
dati (PH2O, T) in un ampio intervallo di temperature e dH2O = 0.9979948 g mL-1 e
dHg = 13.59508 g mL-1 sono le densità dell’acqua a 21°C e del mercurio a 0°C (una
colonna di 760 mm di mercurio a 0°C definisce la pressione standard di 1 atm).
Le moli di zinco che hanno reagito sono uguali alle moli di idrogeno sviluppate calcolate
con l’equazione dei gas ideali dal volume di gas misurato sperimentalmente (V = 50.5
mL) alla pressione P (calcolata con l’Eq.(18)) e la temperatura di 294 K.
Esercizio 7. Confrontare la massa di zinco ottenuta applicando l’equazione dei gas ideali
(93.4 mg) con la massa effettiva utilizzata nell’esperimento e calcolare l’errore assoluto
della misura in %. (Si tenga presente, ovviamente, anche lo spostamento d’aria dovuto al
volume di HCl aggiunto.) Spiegare perché la solubilità in acqua dei gas coinvolti
nell’esperimento, cioè aria ed idrogeno, è praticamente non influente sulla misura del
volume di gas misurato. (Studiare nel manuale di riferimento il capitolo dedicato alla
solubilità dei gas nei liquidi e applicare la legge di Henry.)
Esercizio 8. Trovare nel manuale di riferimento la tabella (PH2O, T) e costruire il relativo
grafico PH2O vs T. Costruire anche il grafico ln PH2O vs 1/T e determinare quindi la
relazione analitica che lega PH2O alla temperatura T.
16
3. Determinazione della massa molare di una sostanza volatile (breve commento sui
metodi di Dumas, Meyer e Hoffmann)
Si noti per prima cosa che dall’Eq.(17) possiamo derivare il concetto di densità relativa di
un gas rispetto ad un dato gas scelto come riferimento, ad esempio H2, nelle stesse
condizioni di pressione e temperatura:
d / dH2 = M / 2.016
(19)
Il metodo di Dumas si basa sull’applicazione diretta dell’equazione dei gas ideali nella
forma dell’Eqs.(1) e (15).
Esercizio 10. Un pallone pieno d’aria pesa 45.20 g (temperatura ambiente 20°C,
pressione atmosferica 758 Torr), lo stesso pallone riempito con il vapore della sostanza in
esame pesa 46.73 g (temperatura del bagno a 100 °C, pressione atmosferica 758 Torr uguale alla pressione interna del pallone saldato alla fiamma mentre è mantenuto alla
temperatura costante del bagno e contenente solo vapore della sostanza in esame). La
massa del pallone riempito con acqua pesa 269.2 g. Determinare la massa molare della
sostanza in esame. (Risposta: 246 gmol-1)
Il metodo di Meyer prevede la vaporizzazione della sostanza ad alta temperatura e la
misura del volume d’aria spostata raccolta su acqua a temperatura ambiente.
Esercizio 11. Nell’apparecchio di Meyer vengono vaporizzati 0.360 g di una sostanza.
Il volume di aria spostata raccolta su acqua è di 48.8 mL misurato a 15°C e 750 Torr.
Sapendo che la tensione di vapore dell’acqua a 15°C è di 12.3 Torr e che l’altezza della
colonna d’acqua è di 30 cm, calcolare la massa molare della sostanza (densità H2O = 1.0
gmL-1; densità Hg = 13.6 gmL-1). (Risposta: M= 175 gmol-1)
Il metodo di Hoffmann prevede la raccolta del vapore della sostanza su mercurio alla
temperatura di vaporizzazione.
Esercizio 12. Nell’apparecchio di Hoffmann vengono vaporizzati 0.253 g di una
sostanza alla temperatura di 90°C. Il volume misurato è di 103 mL, la pressione
atmosferica vale 752.5 Torr e l’altezza della colonna di mercurio è di 413.5 mm.
(Risposta: M= 70.4 gmol-1)
17
4. Teoria cinetica dei gas: verifica della legge di Graham
L’equazione dei gas ideali può essere ricavata dalla teoria cinetica di Maxwell.
Chiaramente al primo anno, primo semestre, del corso di laurea in Chimica gli studenti
non hanno ancora a disposizione gli strumenti matematici per poter seguire lo sviluppo
della teoria che sarà sviluppata in un corso successivo di Chimica-Fisica. Si riportano e
discutono qui solo i risultati fondamentali.
La teoria cinetica mostra che
PV = (2/3) n <Ec>
(20)
dove <Ec> rappresenta l’energia cinetica media per mole di gas di massa molare M
<Ec> = (1/2) M <v2>
(21)
avendo indicato con <v2> la media dei quadrati delle velocità molecolari.
Il confronto con l’equazione dei gas ideali ottenuta con il metodo di van’t Hoff porta a
scrivere
<Ec> = (3/2) R T
(22)
Il moto caotico delle molecole dipende dalla temperatura del gas, essendo teoricamente
possibili per le molecole tutte le velocità comprese tra zero e valori molto grandi. Dalle
Eqs. (21) e (22) la velocità quadratica media (la radice quadrata della media dei quadrati
della velocità) può essere calcolata con la formula seguente:
vrms = (3 RT/M)1/2
(23)
Tale velocità quadratica media è una buona misura della velocità media molecolare di un
gas, ed è anche proporzionale alla velocità di effusione del gas attraverso un piccolo foro
18
praticato nella parete del contenitore (ueff = cost vrms). Paragonando la velocità di
effusione di due gas nelle stesse condizioni di temperatura e di pressione possiamo
scrivere
ueff 1/ ueff 2 = (M2/M1)1/2
(24)
I tempi di effusione di una stesso volume di gas saranno inversamente proporzionali alle
velocità di effusione per cui
t2/t1 = (M2/M1)1/2
(25)
cioè uno stesso volume di gas effonderà attraverso un piccolo foro con un tempo
proporzionale alla radice quadrata della sua massa molare (legge di Graham).
Per la verifica della legge di Graham si fissa un tubo di vetro munito di tappo di gomma
auto sigillante ribaltabile (tappo da siero) al sostegno collegandolo alla pompa da vuoto
ad acqua (Tubo Venturi). Si riempie la siringa ogni volta con uno dei gas disponibili ed
infilando l’ago al centro del tappo da siero si misura il tempo necessario per far effondere
il gas attraverso l’ago della siringa nel vuoto: se la siringa era completamente piena si fa
scattare il cronometro (accuratezza 0.1 s) per registrare il tempo impiegato quando il
pistone passa al valore di 50.0 mL facendo fermare il cronometro al passaggio del pistone
al valore di 10.0 mL. Nel tratto registrato la velocità di effusione è costante per cui
valgono le relazioni sopra riportate.
Un grafico t vs (M)1/2 per tutti i gas studiati
dovrebbe essere rappresentato da una retta passante per l’origine; in effetti per M che
tende a zero si ottiene un valore t diverso da zero a causa della resistenza che il pistone
deve vincere a causa della forza d’attrito.
Nella Tab. 4 si riportano i risultati sperimentali e nella Fig. 6 il grafico t vs (M)1/2.
Esercizio 9. I due isotopi dell’uranio 238U e 235U si trovano in natura nelle percentuali
atomiche del 99.3% e 0.7%, in generale come minerali a base di ossidi. Nella forma di
esafluoruri di uranio sono facilmente vaporizzabili e separati per effusione. Calcolare il
fattore di arricchimento dell’esafluoruro più leggero in un singolo passaggio effusivo.
19
Tab.4 Tempi di effusione di 50.0 mL di gas (misurato a T = 293 K e P = 1.00 atm) in
funzione della massa molare: verifica della legge di Graham.
Gas
M /gmol-1
(M)1/2 /
1/2
(50.0 mL, 293 K, 1.00 atm)
t /s
-1/2
g mol
He
4.003
2.00
4.1
N2
28.02
5.29
8.0
O2
32.00
5.66
8.4
Ar
39.95
6.32
9.5
CO2
44.01
6.63
10.0
SF6
146.1
12.1
16.2
20
t/s
20
SF
6
15
10
CO
Ar
2
O
N
2
2
5
He
0
0
5
10
15
1/2
M
/g
1/2
20
-1/2
mol
Fig.6 Verifica della legge di Graham, Eq.(25), effettuata utilizzando per i diversi gas a
disposizione i dati riportati in Tab.4. Per M che tende a zero si ottiene un valore t
diverso da zero a causa della resistenza che il pistone deve vincere a causa della forza
d’attrito.
21