“Sperimenta il BioLab”
Chi è il colpevole?
Università degli Studi di Milano
Settore Didattico, via Celoria 20
laboratorio
anno scolastico 2005/2006
Indice
1. Conoscenze propedeutiche
1.1 Cosa è il DNA
1.2 Struttura del DNA
1.3 Dal DNA al cromosoma
1.4 Aploidia e diploidia
1.5 Gene, locus, alleli
1.6 Polimorfismi
1.6.1 polimorfismi allelici
1.6.2 polimorfismi di sequenza (microsatelliti)
1.7 Genotipo e fenotipo
1.8 Quadro riassuntivo: geni, alleli, polimorfismi, genotipo, fenotipo
1.9 Replicazione del DNA
p. 3
p. 3
p. 4
p. 4
p. 5
p. 5
p. 5
p. 5
p. 6
p. 7
p. 7
2. Le tecniche che utilizzeremo in laboratorio
2.1 PCR
2.1.1 termociclatori
2.1.2 Taq polimerasi
2.1.3 scelta dei primer
2.2 Elettroforesi
p. 8
p. 9
p. 9
p. 9
p. 9
3. Chi è il colpevole?
3.1 Antefatto
3.2 DNA profiling (test del DNA)
3.3 Schema dei microsatelliti utilizzati
3.3.1 esercizi
3.4 Schema dell’esperimento
3.5 Protocollo sperimentale
3.5.1 principali unità di misura in biologia cellulare e molecolare
3.5.2 strumentazione e materiale a disposizione
3.5.3 soluzioni e reagenti
3.5.4 preparazione del gel di agarosio
3.5.5 corsa elettroforetica
3.5.6 marcatore di peso molecolare di DNA utilizzato
3.6 Risultati
3.7 Interpretazione
3.7.1 domande di riepilogo
p. 10
p. 10
p. 11
p. 12
p. 15
p. 15
p. 16
p. 16
p. 17
p. 18
p. 20
p. 20
p. 21
p. 21
4. Norme generali di sicurezza in laboratorio
p. 22
5. Quiz di autovalutazione
p. 23
6. Glossario
p. 29
7. Siti web utili
p. 31
2
8. Concorso “Una settimana da ricercatore”
p. 31
3
1. Conoscenze propedeutiche
1.1 Cos’è il DNA?
DNA sta per Deoxyribo Nucleic Acid; è una complessa sostanza chimica che si trova nel nucleo di tutte le
cellule e porta l’informazione per lo sviluppo degli organismi.
Lievito
Il DNA è il materiale ereditario
Virus
27 milioni bp
responsabile delle caratteristiche degli
10.000bp
Nematode
160 milioni bp
individui e quindi delle somiglianze e
Moscerino
differenze tra gli stessi.
330 milioni
bp
Il DNA è unico per ogni individuo e diverso
da individuo a individuo, eccetto che per i
gemelli monozigotici, il cui DNA è
Batteri
Giglio 106
4 milioni bp
miliardi bp
identico.
Il DNA è visualizzato sotto forma di
cromosomi durante la divisione cellulare.
(bp=paia di basi,
base pairs)
6 miliardi
bp
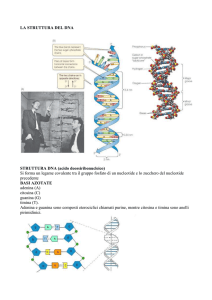
1.2 Struttura del DNA
La molecola del DNA è un polimero, ossia è un
insieme di tanti monomeri: i nucleotidi. Ogni
nucleotide è costituito da tre componenti: un
gruppo fosfato, uno zucchero (desossiribosio) e
una base azotata. La molecola di DNA è formata
da due catene polinucleotidiche avvolte l’una
intorno all’altra con andamento destrorso. Le due
catene sono antiparallele, ossia i due singoli
filamenti sono orientati uno in direzione 5’ 3’ e
l’altro 3’ 5’. Gli scheletri zucchero – fosfato si
trovano all’esterno, le basi azotate all’interno. Le
basi delle due catene sono unite tra loro mediante
legami a idrogeno. Le basi sono complementari e
il loro appaiamento è:
A=T Adenina - Timina
GC Guanina - Citosina
L’informazione genetica risiede nella sequenza di
basi.
4
1.3 Dal DNA al cromosoma
Ciascun cromosoma eucariotico contiene una lunga doppia
elica di DNA che si estende da una estremità all’altra del
cromosoma stesso. La lunghezza complessiva del DNA, che
costituisce i 46 cromosomi di una cellula umana è di circa 2
metri; ne deriva quindi la necessità di compattare (spiralizzare)
la molecola affinché la sua lunghezza sia compatibile con le
dimensioni del nucleo.
Alla molecola di DNA sono associati gli istoni (proteine
basiche), che sono essenziali per permettere l’avvolgimento e
il ripiegamento del DNA in strutture estremamente compatte,
vale a dire i cromosomi, visibili solo durante la divisione
cellulare. Il processo di spiralizzazione del DNA prevede
livelli successivi di avvolgimento (compattamento).
1.4 Aploidia e diploidia
Nel nucleo delle cellule somatiche della maggior
degli organismi, i cromosomi sono presenti in coppie
di membri morfologicamente simili, detti cromosomi
omologhi. Nel nucleo dei gameti (cellule
riproduttive, gli spermatozoi e le cellule uovo), ogni
cromosoma è invece presente in singola copia. La
condizione che si ritrova nelle cellule somatiche è
detta diploidia, quella nei gameti aploidia.
Un individuo diploide è quindi tale perché nelle sue cellule somatiche
sono presenti due copie di ogni tipo di cromosoma. Nelle cellule somatiche
umane osserviamo ad esempio 46 cromosomi, ovvero 23 paia. Un
cromosoma di ciascuna coppia di cromosomi omologhi è ereditato dal
genitore femminile e l’altro dal genitore maschile.
5
1.5 Gene, locus, alleli
Ogni cromosoma può essere immaginato come una successione
lineare di geni o loci. Il gene è l’unità ereditaria fondamentale e
consiste di specifiche sequenze di nucleotidi. Il locus è la
posizione, ovvero il sito occupato dal gene su un cromosoma. I
due termini, gene e locus, sono sinonimi.
Ogni paio di cromosomi contiene gli stessi geni nello stesso
ordine lineare, ma non necessariamente in forma identica.
Forme diverse di un gene sono dette alleli. Poiché in ogni
individuo diploide sono presenti due alleli per ogni locus, due
cromosomi omologhi possono portare alleli uguali (l’individuo
è detto omozigote) o diversi (l’individuo è detto eterozigote)
per uno stesso locus.
1.6 Polimorfismi
Il termine polimorfismo significa “esistenza di forme diverse”. In genetica, il polimorfismo può essere
analizzato a livello di proteina (polimorfismo proteico) oppure di materiale genetico (polimorfismo
genetico). In questo secondo caso, le forme diverse (ossia le varianti genetiche) possono riguardare un gene,
vale a dire un tratto di DNA codificante una proteina, oppure un tratto di DNA non codificante. Nel primo
caso, si parla di polimorfismo allelico, nel secondo caso di polimorfismo del DNA.
polimorfismo proteico
Polimorfismo
polimorfismo allelico
polimorfismo genetico
polimorfismo del DNA
1.6.1 polimorfismi allelici
Per polimorfismi allelici si intende l’esistenza di due o più alleli diversi di uno stesso gene o locus. Gli
alleli di un gene si formano uno dall’altro per mutazione, ossia per variazione della sequenza
nucleotidica di un gene. Gli alleli di un gene possono essere identificati a livello fenotipico, perché
possono determinare fenotipi diversi, ad esempio capelli neri o biondi. Se gli alleli di un gene sono due,
il polimorfismo si chiama polimorfismo biallelico. Se gli alleli sono in numero maggiore di due (come
nel sistema di gruppo sanguigno ABO), il polimorfismo è detto polimorfismo multiallelico.
1.6.2 polimorfismi di sequenza (microsatelliti)
Nel caso dei polimorfismi del DNA, contrariamente ai polimorfismi allelici, la variazione di sequenza
nucleotidica avviene in genere in un tratto di DNA non codificante, che nel suo complesso costituisce
circa il 98% del genoma. I polimorfismi del DNA sono quindi più frequenti dei polimorfismi allelici e
conseguentemente più utili nella ricerca genetica. E’ stato osservato che il DNA di due individui
differisce per circa un nucleotide ogni 500/1000.
Poiché interessano generalmente il DNA non codificante, i polimorfismi del DNA rappresentano
differenze tra individui, senza conseguenze sul fenotipo. Quindi, non è possibile rilevarli osservando le
caratteristiche fenotipiche di un individuo.
Esistono diversi tipi di polimorfismi del DNA:
1. polimorfismi di singoli nucleotidi = SNP (single nucleotide polymorphism)
2. polimorfismi di ripetizione = VNTR (V= variable, N= Number, T= Tandem, R= Repeats)
3. polimorfismi di restrizione = RFLP ( R= restrition, F= fragment, L= lenght, P= polymorphism)
6
Noi
ci
occuperemo
solo
dei
polimorfismi di ripetizione (VNTR),
vale a dire i polimorfismi dovuti alla
presenza di un numero variabile di
sequenze nucleotidiche ripetute in
tandem (in orientamento testa-coda, una
di
seguito
all'altra).
I
VNTR
comprendono i microsatelliti e i
minisatelliti, che differiscono tra loro per la lunghezza dell’unità di ripetizione. Nei minisatelliti, le
ripetizioni sono più lunghe (qualche decina o un centinaio di basi). Nei microsatelliti, le ripetizioni sono
più corte, di-, tri- o tetra- nucleotidi, ad esempio (AC)n oppure (CAG)n. Per questo motivo, i
microsatelliti sono detti anche STR (Short Tandem Repeats, ripetizioni brevi in tandem).
Per un determinato microsatellite possono di conseguenza esistere numerosi alleli diversi, che
differiscono tra loro per il numero di ripetizioni, ad esempio da 1 a 20 ripetizioni. I microsatelliti sono
quindi un esempio di polimorfismo multiallelico.
Il profilo del DNA (“DNA profiling”) serve per identificare gli individui e distinguere un individuo
dall’altro. Se due individui presentano caratteristiche simili, ad esempio hanno capelli dello stesso
colore, occhi dello stesso colore, stessa altezza, stesso gruppo sanguigno ecc. non è possibile
distinguerli. Caso estremo di individui con le stesse caratteristiche e quindi non distinguibili tra loro, è
rappresentato dai gemelli identici, monozigotici.
Ne consegue che per poter distinguere due individui,
bisogna riferirsi a caratteristiche che siano diverse nei
due soggetti. Le caratteristiche in esame nel caso del
DNA profiling sono i microsatelliti. Due individui sono
diversi tra loro, se posseggono alleli diversi dei singoli
microsatelliti in esame, e quindi posseggono due alleli
diversi dello stesso microsatellite.
E’ intuitivo che tanto maggiore è il numero di alleli che
esistono per un certo gene, tanto maggiore è la
probabilità che un individuo sia eterozigote e quindi
diverso da un altro individuo.
Dato il loro elevato polimorfismo (elevato numero di
alleli), i microsatelliti sono pertanto degli ottimi
marcatori genetici, in quanto consentono di
“marcare”, vale a dire distinguere tra loro due
individui.
I microsatelliti possono essere studiati con la PCR e
successiva elettroforesi del DNA e sono utilizzati per effettuare il test del DNA (vedi §3.2).
1.7 Genotipo e fenotipo
Il genotipo è la costituzione genetica di una singola cellula o di un singolo organismo, mentre il fenotipo è
l’insieme delle caratteristiche visibili o in qualche modo evidenziabili di una cellula o di un organismo. Ad
esempio, fenotipo è non solo il colore degli occhi, il colore della pelle o l’altezza (caratteristiche visibili), ma
anche il tipo di gruppo sanguigno (caratteristica non visibile, ma evidenziabile con saggi di laboratorio), così
pure i polimorfismi del DNA non si vedono osservando un individuo, ma possono essere evidenziati con la
PCR e successiva elettroforesi (vedi § 2.1 e 2.2). Il fenotipo non è determinato solo dai geni, ma dipende
anche dall’interazione del genotipo con l’ambiente. La statura di una persona, ad esempio, è influenzata dai
geni, tuttavia la loro espressione può essere modificata dalle interazioni con l’ambiente esterno (ad esempio,
alimentazione) o interno (ad esempio, ormoni).
7
1.8 Quadro riassuntivo: geni, alleli, polimorfismi, genotipo, fenotipo
Diploide: in ogni individuo sono
presenti due copie di ogni tipo di
cromosoma e quindi due alleli di
ogni locus
Genetica classica
Genetica molecolare
A
4 ripetizioni
a
7 ripetizioni
Alleli: forme diverse dello stesso
gene o locus
2 alleli diversi dello stesso
locus: A e a
2 tratti di DNA dello stesso locus che
differiscono per il numero di
ripetizioni di una corta sequenza di
basi
Genotipo
Aa
4,7
Fenotipo
A
nessuno
Polimorfismo: esistenza di due o
più varianti genetiche (alleli,
sequenze nucleotidiche, ecc.)
Polimorfismo
allelico
Polimorfismo di sequenza
(microsatelliti)
Come si evidenzia
Osservazione dell’individuo o
delle sue cellule, ad es: colore
degli occhi, gruppo sanguigno
PCR ed elettroforesi
1.9 Replicazione del DNA
La replicazione del DNA in tutte le cellule viventi, dai batteri all’uomo, è un processo complesso, che
richiede l’intervento di più di una dozzina di enzimi diversi. La replicazione comincia in corrispondenza di
siti detti origine di replicazione presenti ad intervalli lungo i cromosomi. In questi siti, alcune proteine
srotolano la doppia elica di DNA, rompendo i legami a idrogeno tra le basi dei due filamenti complementari.
8
L’allineamento e unione tra loro dei nucleotidi complementari avviene
per azione della DNA polimerasi che procede solo in direzione 5’3’.
La DNA polimerasi per iniziare il processo ha anche bisogno di un
innesco (detto anche primer), a cui attaccarsi e procedere con la
polimerizzazione. Durante la replicazione del DNA, il primer è
costituito da una corta sequenza polinucleotidica di RNA.
La replicazione è semiconservativa: ogni emi-elica (singolo
filamento) della molecola madre serve da stampo per la sintesi di un
nuovo filamento, per cui ogni doppia elica figlia sarà costituita da un
filamento vecchio e da un filamento nuovo. Le molecole risultanti
sono copie esatte dell’originale. Da una doppia elica madre derivano
due doppie eliche figlie uguali tra loro e uguali alla molecola madre.
2. Le tecniche che utilizzeremo in laboratorio
2.1 PCR (Polymerase Chain Reaction)
Si tratta di una tecnica innovativa che consiste
nell’amplificazione specifica di tratti di DNA
mediante reazioni a catena della DNA polimerasi.
Il principio è molto semplice. Data una sequenza di
DNA a doppio filamento e due corte sequenze
oligonucleotidiche
(primer),
di
cui
una
complementare ad un tratto di filamento ad una
estremità del DNA da amplificare (forward primer)
e l’altra complementare ad un altro tratto posto
all’altra estremità (reverse primer), in presenza di
una DNA polimerasi termostabile e di una miscela di desossinucleotidi trifosfati in appropriate condizioni di
reazione, è possibile far copiare numerosissime volte il tratto compreso tra i due primer, semplicemente
facendo variare ciclicamente la temperatura di reazione.
Infatti, raggiunta la temperatura di denaturazione (circa 95°C), la doppia elica si apre (fase di
denaturazione), rendendo disponibile lo stampo per una eventuale sintesi delle catene complementari.
Quando la temperatura si abbassa, in virtù delle loro minori dimensioni e della loro concentrazione, i primer
si legheranno (fase di appaiamento o annealing) al DNA stampo prima che si rinaturi e, in presenza di una
DNA polimerasi con un optimum di temperatura elevato (circa 72°C), inizierà la sintesi di DNA a partire dai
primer (fase di sintesi del DNA o extension), procedendo lungo i filamenti singoli.
Al termine del primo ciclo di PCR da una doppia elica di DNA se ne Numero Numero
ottengono due. Ripetendo il ciclo "denaturazione – annealing – extension" di cicli
molecole della
numerose volte (in genere da 20 a 30), si ottiene una massiccia amplificazione
sequenza di
specifica di un dato tratto di DNA che può quindi essere analizzato e studiato
DNA bersaglio
in dettaglio.
1
2
Il metodo di analisi del DNA mediante PCR presenta vantaggi molto evidenti:
2
4
è molto rapido (da 60 a 90 minuti),
3
8
la manualità è semplicissima,
5
32
è automatizzato,
10
1.024
i risultati sono visualizzabili con facilità mediante elettroforesi del
20
1.048.576
DNA (vedi §2.2)
30
1.073.741.824
Importanti ambiti di utilizzo della PCR sono la diagnosi prenatale di malattie
genetiche e le indagini di medicina legale (sia civile che penale),
9
2.1.1 termociclatori
Il successo della PCR è dovuto in gran parte alla possibilità di far avvenire
l’intero processo in modo automatico all’interno di strumenti detti termociclatori
(thermal cycler), in grado di variare ciclicamente la temperatura tra le varie
fasi di ogni ciclo di PCR. Il costo di un thermal cycler si aggira sui 10.000 euro.
Un esempio di profilo di amplificazione standard impostato mediante un
termociclatore è il seguente:
1.
denaturazione del DNA: 30 sec a 94°C
2.
appaiamento (annealing) dei primers: 30 sec a 50°-60°C
30-35
cicli
3.
sintesi (extension) di DNA: 30 sec- 5 minuti a 72°C
2.1.2 Taq polimerasi
Il successo della PCR è stato possibile grazie anche all’uso di una DNA polimerasi
termostabile estratta da batteri termofili (che vivono ad elevate temperature). Una DNA
polimerasi utilizzata nelle reazioni della PCR è la Taq polimerasi, estratta dal batterio Thermus
aquaticus. L’isolamento di DNA polimerasi termostabili ha sollevato gli operatori dall’ingrato
compito di aggiungere enzima fresco ad ogni ciclo di reazione!
2.1.3 scelta dei primer
Zona amplificata
Per ogni PCR, è necessario usare due primer (forward e reverse).
La scelta della coppia di primer è critica per una buona riuscita
della PCR, ovvero per ottenere amplificazione specifica di un
tratto di DNA.
I primer devono essere “disegnati” a livello di sequenze uniche nel
genoma (presenti una sola volta), in modo che possano appaiarsi al
DNA solo nella zona di interesse e non in altre zone.
2.2 Elettroforesi
E’ una tecnica che consente di separare in base alle loro dimensioni (peso
molecolare) molecole dotate di carica, facendole migrare su un gel in presenza
di un campo elettrico. Il gel è costituito generalmente da agarosio e può essere
immaginato come una rete tridimensionale attraverso le cui maglie migrano le
molecole sotto l’azione di un campo elettrico. Il campo elettrico è generato da
un apparecchio, detto alimentatore o power supply.
Le molecole di DNA sono cariche negativamente per la presenza di gruppi
fosfato e migrano dal polo negativo (anodo) verso il polo positivo (catodo).
Per un certo intervallo di pesi molecolari, la velocità di
migrazione è funzione del peso molecolare: tanto più
grande è la molecola, tanto minore è la velocità di
migrazione. E viceversa, tanto più piccola è la molecola
di DNA, tanto più velocemente migra. Le molecole di
DNA di diversa lunghezza vengono pertanto separate in
base alla diversa velocità di migrazione.
10
Per poter determinare la lunghezza delle molecole di DNA in esame precedentemente separate mediante
elettroforesi, viene “caricato” sul gel anche il cosiddetto marcatore di peso molecolare, ossia una miscela di
frammenti di DNA di cui è noto il peso molecolare. Confrontando la posizione dei frammenti a peso
molecolare noto con quella dei frammenti di DNA in esame, è possibile calcolare il peso molecolare di
questi ultimi, ossia la loro lunghezza.
La separazione elettroforetica dura circa 30 min - 1 ora. Al termine, i vari frammenti di DNA, essendo
incolori, possono essere visualizzati, immergendo il gel in un colorante. Il DNA delle diverse classi di peso
molecolare è visibile sotto forma di bande distinte: sono le cosiddette bande di DNA.
In genere in laboratorio le bande si visualizzano
esponendo il gel alla luce ultravioletta. Questo è dovuto
al fatto che, durante la preparazione del gel,
all’agarosio è stato aggiunto il bromuro di etidio, una
sostanza che ha la proprietà di legarsi al DNA e di
emettere fluorescenza se esposta a luce UV. Il bromuro
di etidio va maneggiato con estrema cautela in quanto è
un agente intercalante del DNA e, come tale, ha
proprieta mutagene.
3. Chi è il colpevole?
3.1 Antefatto
Gianni, un ragazzo di quindici anni, vince una gara di
bicicletta e tornando a casa si imbatte in un gruppo di
teppisti che vogliono rubargli il trofeo e la bici. Dopo una
colluttazione conclusasi con il furto del trofeo al vincitore
e la fuga dei teppisti, arriva il vigile di quartiere che
soccorre il malcapitato e lo riaccompagna a casa.
I genitori decidono di denunciare il fatto alla polizia e
dopo accurate ricerche vengono rintracciati alcuni ragazzi,
presenti durante la gara e rientrati a casa con evidenti e
sospette ferite. Anche la bicicletta di Gianni è macchiata di
sangue, così come i suoi vestiti. La polizia scientifica
inizia l’analisi del materiale biologico e decide di
identificare il colpevole, facendo il profilo del DNA.
3.2 DNA profiling (test del DNA)
E’ una nuova tecnica di genetica molecolare, utilizzata in tutti quei casi in cui è necessario effettuare
l’identificazione di un individuo. Oltre che nei laboratori di ricerca in genetica molecolare, questa tecnica è
usata nei laboratori di medicina legale di tutto il mondo.
Il DNA profiling può essere applicato all’identificazione di materiale per attribuirne l’appartenenza a vittime
o sospetti, come succede nei casi di incidenti aerei, delitti, stupri. Il test del DNA può essere applicato anche
alla determinazione di relazioni familiari come paternità, nascite conseguenti a stupri o incesti.
Un vantaggio di questa tecnica è che essa consente di analizzare il DNA di un individuo, partendo da
quantità molto piccole di materiale biologico. E’ sufficiente una piccola quantità di cellule, come un capello
o le tracce di saliva su un bicchiere o su una sigaretta per poter effettuare il test del DNA con la PCR.
Il test del DNA si basa sull’analisi dei microsatelliti (vedi § 1.6.2), dopo estrazione del DNA dal campione in
esame, amplificazione delle sequenze di DNA relative ai microsatelliti (tramite PCR) ed elettroforesi.
11
Se l’individuo è omozigote per il locus analizzato (sui due cromosomi
omologhi è presente lo stesso numero di ripetizioni), sul gel si osserverà una
sola banda, il cui peso molecolare corrisponde alla lunghezza della ripetizione.
Se invece l’individuo è eterozigote (sui due cromosomi omologhi il numero di
ripetizioni è diverso), sul gel si osserveranno due bande di diverso peso
molecolare a seconda della lunghezza della ripetizione.
3.3 Schema dei microsatelliti utilizzati
Sono stati analizzati i tre seguenti marcatori microsatelliti: i microsatelliti 1, 2 e 3, localizzati su tre
cromosomi diversi.
12
3.3.1 Esercizi
Prima di andare avanti, svolgere i seguenti esercizi.
Nota per l’insegnante: gli esercizi dal numero 2 al numero 8 cercano di familiarizzare lo studente con
l’importanza che i marcatori microsatelliti siano altamente polimorfici, vale a dire esista per ogni marcatore un
numero elevato di alleli. Però attenzione: ricordare allo studente che, anche se per un dato marcatore esistono
molti alleli, un individuo ne porta sempre e solo due, perché è diploide!
1.Si consideri un marcatore del DNA, di cui esistono due alleli (allele 1 e allele 2).
Rispondere alle seguenti domande.
a) Quanti sono i genotipi omozigoti e quali?
Numero di genotipi omozigoti: _____Genotipo: _______
b) Quanti sono i genotipi eterozigoti e quali?
Numero di genotipi eterozigoti: ____Genotipo: _______
Risposta
domanda a: i genotipi omozigoti sono 2 e precisamente: 1, 1 e 2, 2.
domanda b: vi è 1 solo genotipo eterozigote e precisamente: 1, 2.
Nota per l’insegnante: sottolineare allo studente che se il numero di alleli è piccolo, come in questo esempio, il numero di genotipi possibili
è piccolo.
2.Relativamente ai marcatori microsatelliti 1, 2, 3, sulla base dello schema riportato nella sezione 3.3, scrivere il
peso molecolare degli alleli di ciascuno dei tre microsatelliti.
Microsatellite 1
allele 1 _________
allele 2 _________
allele 3 _________
allele 4 _________
allele 5 _________
allele 6 _________
allele 7 _________
allele 8 _________
allele 9 _________
allele 10_________
allele 11_________
allele 12_________
Risposta
Microsatellite 1
allele 1: 414
allele 2: 417
allele 3: 420
allele 4: 423
allele 5: 426
allele 6: 429
allele 7: 432
allele 8: 435
allele 9: 438
allele 10: 441
allele 11: 444
allele 12: 447
allele 13_________
allele 14_________
allele 15_________
allele 16_________
allele 17_________
allele 18_________
allele 19_________
allele 20_________
allele 21_________
allele 22_________
allele 23_________
allele 24_________
allele 13: 450
allele 14: 453
allele 15: 456
allele 16: 459
allele 17: 462
allele 18: 465
allele 19: 468
allele 20: 471
allele 21: 474
allele 22: 477
allele 23: 480
allele 24: 483
Microsatellite 2
allele 1 _________
allele 2 _________
allele 3 _________
allele 4 _________
allele 5 _________
allele 6 _________
allele 7 _________
allele 8 _________
allele 9 _________
allele 10_________
allele 11_________
allele 12_________
allele 13_________
allele 14_________
allele 15_________
allele 16
Microsatellite 3
allele 1 _________
allele 2 _________
allele 3 _________
allele 4 _________
allele 5 _________
allele 6 _________
allele 7 _________
allele 8 _________
allele 9 _________
allele 10_________
allele 11_________
Microsatellite 2
allele 1: 224
allele 2: 228
allele 3: 232
allele 4: 236
allele 5: 240
allele 6: 244
allele 7: 248
allele 8: 252
allele 9: 256
allele 10: 260
allele 11: 264
allele 12: 268
allele 13: 272
allele 14: 276
allele 15: 280
allele 16: 284
Microsatellite 3
allele 1: 102
allele 2: 106
allele 3: 110
allele 4: 114
allele 5: 118
allele 6: 122
allele 7: 126
allele 8: 130
allele 9: 134
allele 10: 138
allele 11: 142
allele 12_________
allele 13_________
allele 14_________
allele 15_________
allele 16_________
allele 17_________
allele 18_________
allele 19_________
allele 20_________
allele 21_________
allele 12: 146
allele 13: 150
allele 14: 154
allele 15: 158
allele 16: 162
allele 17: 166
allele 18: 170
allele 19: 174
allele 20: 178
allele 21: 182
13
3. Relativamente ai marcatori microsatelliti 1, 2, 3, sulla base dello schema riportato nella sezione 3.3, quanti
sono i genotipi omozigoti e quali?
Microsatellite 1
N. genotipi omozigoti: ________
Genotipi:
______________________________
______________________________
______________________________
______________________________
Risposta
Microsatellite 1
N. genotipi omozigoti: 24
Genotipi: 414,414; 417,417; 420,420;
423,423; 426,426; 429,429; 432,432;
435,435; 438,438; 441,441; 444,444;
447,447; 450,450; 453,453; 456,456;
459,459; 462,462; 465,465; 471,471;
474,474; 477,477; 480,480; 483,483;
Microsatellite 2
N. genotipi omozigoti: ________
Genotipi:
_______________________________
_______________________________
_______________________________
_______________________________
Microsatellite 2
N. genotipi omozigoti: 16
Genotipi: 224,224; 228,228; 232,232; 236,236;
240,240; 244,244; 248,248; 252,252; 256,256;
260,260; 264,264; 268,268; 272,272; 276,276;
280,280; 284,284
Microsatellite 3
N. genotipi omozigoti: ________
Genotipi:
______________________________
______________________________
Microsatellite 3
N. genotipi omozigoti: 21
Genotipi: 102,102; 106,106;
114,114; 118,118; 122,122;
130,130; 134,134; 138,138;
146,146; 150,150; 154,154;
162,162; 166,166; 170,170;
178,178; 182,182
110,110;
126,126;
142,142;
158,158;
174,174;
4.Relativamente al marcatore microsatellite 1 sulla base dello schema riportato nella sezione 3.3, indicare
almeno 5 possibili genotipi eterozigoti. Identificare gli alleli in base al numero di ripetizioni (ad es, 5,9; vedi
§1.8).
Genotipo eterozigote 1 _______________
Genotipo eterozigote 2 _______________
Genotipo eterozigote 3 _______________
Genotipo eterozigote 4 _______________
Genotipo eterozigote 5 _______________
Risposta:
per scrivere un genotipo eterozigote, bisogna abbinare un allele con un determinato peso molecolare, ossia con un dato numero di
ripetizioni, con un altro allele di peso molecolare diverso dello stesso microsatellite, ad esempio 7,12 oppure 4,5.
5. Scrivere un possibile genotipo di un individuo eterozigote per tutti e tre i marcatori microsatelliti analizzati.
Identificare gli alleli in base al numero di ripetizioni (ad es. 5, 9; vedi §1.8).
Risposta:
marcatore microsatellite 1: due alleli diversi, ad esempio 2,9
marcatore microsatellite 2: due alleli diversi, ad esempio 4,16
marcatore microsatellite 3: due alleli diversi, ad esempio 8,15
6. Scrivere un possibile genotipo di un individuo omozigote per il marcatore microsatellite 1 ed eterozigote per i
marcatori microsatelliti 2 e 3. Identificare gli alleli in base al numero di ripetizioni (ad es. 5, 9; vedi §1.8).
______________________
Risposta:
marcatore microsatellite 1: due alleli uguali, ad esempio 3,3
marcatore microsatellite 2: due alleli diversi, ad esempio 5,10
marcatore microsatellite 3: due alleli diversi, ad esempio 1,9
7. Si consideri l’individuo il cui genotipo è stato scritto nel problema 6, ossia un individuo omozigote per il
microsatellite 1 ed eterozigote per i microsatelliti 2 e 3. Si supponga di aver prelevato un campione di cellule da
questo individuo, ad esempio un prelievo di sangue, di aver estratto il DNA, di aver tipizzato questo individuo
mediante PCR per i microsatelliti 1, 2 e 3 e di aver fatto migrare i prodotti di PCR su gel di agarosio.
Disegnare che tipo di bande di DNA ci si aspetta di osservare sul gel e in che posizione, rispetto ad un marcatore
di peso molecolare.
14
risposta
8. Si considerino tre individui, A, B e C.
Relativamente al marcatore 1, si supponga che l’individuo A sia omozigote per l’allele 6, l’individuo B
eterozigote per gli alleli 10 e 15 e l’individuo C omozigote per l’allele 11.
Relativamente al marcatore 2, si supponga che l’individuo A sia eterozigote per gli alleli 3, 8, l’individuo B
eterozigote per gli alleli 1 e 12 e l’individuo C omozigote per l’allele 4.
Relativamente al marcatore 3, si supponga che l’individuo A sia omozigote per l’allele 9, l’individuo B
eterozigote per gli alleli 10 e 12 e l’individuo C eterozigote per gli alleli 16 e 21.
Disegnare le bande di DNA che ci si aspetta di osservare sul gel e in che posizione, rispetto ad un marcatore di
peso molecolare.
risposta
15
3.4 Schema dell’esperimento
V
SC
I sospetti
Il campione di materiale biologico di Gianni è indicato con V= vittima
Il campione prelevato sulla scena del crimine è il sangue ritrovato sulla bicicletta ed è indicato con la
lettera SC
I campioni prelevati dai sospettati sono indicati con: S1, S2, S3
V
SC
S1
S2
S3
Dai campioni viene estratto il DNA, viene poi applicata la tecnica della PCR, utilizzando coppie di
primer specifiche per i tre diversi microsatelliti; successivamente si effettua l’elettroforesi e si
analizzano i risultati.
3.5 Protocollo sperimentale
3.5.1 principali unità di misura usate in biologia cellulare e molecolare
a) alcuni prefissi comuni
Prefisso
Simbolo
chilo
centi
milli
micro
nano
pico
femto
atto
k
c
m
µ
n
p
f
a
Multiplo o
sottomultiplo
103
10-2
10-3
10-6
10-9
10-12
10-15
10-18
Esempio
1 kg è 1.000 grammi
1 cm è 0.01 di un metro
1 mL è 10-3 di un litro
1 µm è 10-6 di un metro
1 ng è 10-9 di un grammo
1 pg è 10-12 di un grammo
1 fg è 10-15 di un grammo
1 ag è 10-18 di un grammo
b) unità di volume
Nell’esperimento che effettueremo, useremo per il DNA volumi molto piccoli, pari a circa 10 l e per il
tampone volumi maggiori, pari a circa 30-300 ml.
Quantità
litro
millilitro
microlitro
Abbreviazione
l
ml
µl
Equivalente
10-3 l (1 ml = 1 cm3 = 1 cc)
10-6 l (1 µl = 1 mm3)
16
3.5.2 strumentazione e materiale a disposizione
spruzzette
beuta e becker
provette eppendorf
cilindro graduato
provette 5-50 ml
portaprovette
carta
stagnola
spatola
pipettatore automatico
guanti in lattice monouso
camice
guanto da
forno
forno a
microonde
vaschetta e
pettine per elettroforesi
pipetta Pasteur
pennarelli waterproof
puntali per micropipette
micropipettatrici
P10, P20, P200, P1000
carta
pipette monouso
disposable
bilancia
analitica
vortex
timer
power supply
(alimentatore)
centrifuga per provette
eppendorf
parafilm
bolla
3.5.3 soluzioni e reagenti
• tampone TBE (Tris-Borato-EDTA) 1x. Questo tampone si prepara facendo una diluizione 1:10 della
soluzione “madre” TBE 10x, la cui composizione è:
Tris 108 gr (0,89 M)
acido borico 55 gr (0,89 M)
EDTA 9.3 gr (0,02 M) pH 8,3
H2O a 1 litro. Il pH 8,3 viene raggiunto automaticamente.
• DNA prodotti con la PCR, già pronti
• marcatore di peso molecolare (DNA del plasmide pUC8 tagliato con l’enzima di restrizione HaeIII)
• agarosio in polvere (0.6 gr)
blu di bromofenolo 0.25%
• soluzione di bromuro di etidio (1 g/ml)
xilene cianolo 0.25%
• loading dye 6x, già pronto in eppendorf e contenente:
glicerolo 30%
alcool etilico denaturato e H2O distillata
17
3.5.4 preparazione del gel di agarosio
Nota di laboratorio: la concentrazione di agarosio del gel viene scelta dal ricercatore in base alle
dimensioni dei frammenti di DNA da separare. Nel nostro caso, dovendo separare frammenti lineari
di DNA compresi tra 100 e 2.000 bp (base pairs, coppie di basi), si utilizza un gel di agarosio al 2%.
Operazioni preliminari
per chi ha i capelli lunghi: legarsi i capelli con un elastico
portare una moneta da 2 euro, che poi si recupera, per mettere il cappotto e lo zaino
nell’armadietto chiudibile a chiave
prima di cominciare a lavorare, lavarsi le mani
pulire il banco di lavoro con alcol etilico denaturato
prima di cominciare l’esperimento, lo studente verrà familiarizzato con la strumentazione che
dovrà utilizzare, in modo particolare con le micropipette
Preparazione del gel
preparare la vaschetta per elettroforesi con bordi di “nastro adesivo di carta”
verificare che il piano su cui si appoggia la vaschetta per elettroforesi sia a bolla
misurare 30 ml di tampone TBE 1x in un cilindro e versarli nella beuta di vetro pirex che
contiene già 0,6 gr di agarosio. Attenzione a non rovesciare la beuta. L’agarosio costa 600 euro
al chilo!
pesare la beuta contenente la soluzione di agarosio e segnare il peso sul protocollo: _______
leggere attentemente la “Nota di sicurezza sulla utilizzazione del forno a microonde”
sciogliere l’agarosio nel forno a microonde impostato sulla potenza indicata da una figura con tre
fiammelle ( circa 500V) per 1 minuto. Aprire poi il forno a microonde, agitare delicatamente la
soluzione con una presina, facendo attenzione a non scottarsi. Richiudere il forno a microonde e
sciogliere la soluzione per un ulteriore minuto alla stessa potenza
pesare la soluzione di agarosio (l’acqua del tampone, bollendo, è evaporata!) e riportare la
soluzione di agarosio al peso originale, utilizzando una spruzzetta con H2O distillata. Attenzione:
far cadere l’acqua delicatamente, facendola scivolare lungo i bordi della beuta, altrimenti si
formano delle bolle
aspettare 3-5 minuti, coprendo la beuta contenente la soluzione di agarosio con un pezzetto di
stagnola, per evitare l’evaporazione. L’agarosio deve raggiungere una temperatura intorno ai
60°C, altrimenti rovina il supporto di plastica della vaschetta dell’elettroforesi. Quindi versare la
soluzione di agarosio, evitando di formare bolle, nella vaschetta per elettroforesi dove è già stato
inserito il pettine, nella quale va inserito il pettine. I pozzetti si formano quando, una volta
solidificato il gel, viene tolto il pettine
lasciare solidificare a temperatura ambiente per circa 15 min. Quando è solidificato, il gel
diventa opaco
mentre si aspetta che il gel solidifica, fare delle prove di caricamento dei pozzetti del gel (12l di
loading dye 1x) su altri gel già pronti
togliere il nastro di carta dalla vaschetta e metterla nella cella
versare il tampone TBE 1x nella camera di corsa (servono circa 250 ml), evitando che si formino
bolle, fino a coprire completamente il gel. Se si formano bolle, toglierle con la punta di una
pipetta Pasteur
togliere lentamente il pettine, tenendosi perpendicolare rispetto al gel
18
3.5.5 corsa elettroforetica
scrivere su ciascuna eppendorf con un pennarello waterproof il tipo di campione che vi verrà
trasferito: V = vittima; SC = scena del crimine; S1 = sospettato 1; S2 = sospettato 2; S3=
sospettato 3; PM = marcatore di peso molecolare
prelevare 10 µl di ciascun campione di DNA e trasferirli nella eppendorf corrispondente
aggiungere 2 µl di loading dye 6x e risospendere con la micropipetta, evitando di formare bolle.
Il glicerolo presente nel loading dye serve per rendere più densa la soluzione di DNA da caricare
nel pozzetto e quindi a facilitarne l’entrata nel pozzetto
se si formano bolle, centrifugare brevemente (1 sec) in una microcentrifuga eppendorf (in gergo
di laboratorio, si dice “spinnare” da spin, centrifugare)
leggere attentemente la “Nota di sicurezza sulla utilizzazione della centrifuga”
posizionare la vaschetta per l’elettroforesi su un foglio nero, perchè sia più facile individuare i
pozzetti
caricare lentamente ciascun campione (12 µl) nei singoli pozzetti (ogni pozzetto ha un volume di
circa 15 µl), ponendosi con la punta della micropipetta in un angolo del pozzetto e perpendicolare
rispetto al gel, facendo attenzione a non bucare il fondo del pozzetto stesso e a non far uscire il
campione fuori dal pozzetto
in un pozzetto laterale, caricare il marker di DNA a peso molecolare noto
chiudere il coperchio della cella elettroforetica
leggere attentemente la “Nota di sicurezza sulla utilizzazione dell’apparato per elettroforesi”
collegare i morsetti alla camera di corsa e ai poli del generatore di corrente, detto anche power
supply; il DNA è carico negativamente e migra verso il polo positivo
fissare il voltaggio al valore costante di 100 V e lasciare procedere la corsa elettroforetica per
circa 50 min
fare attenzione che la banda del blu di bromofenolo non esca dal gel (altrimenti alcune bande di
DNA possono uscire dal gel)
osservare la migrazione del loading dye per valutare la migrazione del DNA, che, essendo
incolore, non si può vedere. Il blu di bromofenolo migra alla stessa velocità di un frammento di
DNA a doppia elica di circa 300 bp, mentre lo xilen cianolo migra alla stessa velocità di un
frammento di circa 4.000 bp. Attenzione: fermare la corsa elettroforetica quando il blu di
bromofenolo si trova a circa 1-2 cm dalla fine del gel, in modo da evitare che il DNA esca dal gel
stesso. Se dovesse succedere, si perdono i campioni di DNA!
Operazioni da svolgere alla fine della corsa elettroforetica. Questa operazione viene svolta dal
tutor:
al termine della corsa, indossare i guanti monouso “disposable”, togliere delicatamente il gel
dalla cella elettroforetica e trasferirlo in una vaschetta di plastica contenente 100 ml di colorante
etidio bromuro
lasciare in immersione il gel, completamente sommerso, per 15 min
fare un risciacquo del gel per togliere l’eccesso di colorante, trasferendo il gel in un’altra
vaschetta contenente 300 ml d’acqua a temperatura ambiente (va bene l’acqua di rubinetto)
osservare il gel al transilluminatore
documentare il risultato del gel, facendo una foto al gel (ricordarsi di portare una macchina
fotografica digitale!)
il tampone da elettroforesi TBE (Tris/Borato/EDTA) può essere riutilizzato diverse volte.
Recuperate il tampone usato e versatelo in una bottiglia con un imbuto
pulire le apparecchiature ed il banco di lavoro con acqua ed etanolo denaturato
dopo aver finito di lavorare, lavarsi le mani
leggere attentemente la “Nota di sicurezza sullo smaltimento dei rifiuti”e su “ Manipolazione
dell’etidio bromuro (sostanza mutagena)”
19
Nota di sicurezza
Utilizzazione del forno a microonde
non accendere il forno se è vuoto
non utilizzare il forno con materiali infiammabili
non utilizzare il forno con recipienti sigillati (potrebbero esplodere): svitare i tappi delle bottiglie, rimuovere i
coperchi
non utilizzare il forno con oggetti metallici o metallizzati: (es. bottiglie coperte di stagnola) e con carta d’argento
non riempire eccessivamente i recipienti: il liquido bollendo, potrebbe traboccare
proporzionare la potenza e il tempo di riscaldamento al contenuto in acqua di quanto viene riscaldato. In particolare,
nel caso di soluzioni acquose, il liquido potrebbe surriscaldarsi oltre il punto di ebollizione, senza che appaiano
bollicine. Ciò può portare al traboccamento improvviso di liquido bollente. Per prevenire questo pericolo, mescolare il
liquido prima di scaldarlo e lasciarlo riposare per qualche minuto prima di togliere il recipiente dal forno
utilizzare i guanti imbottiti per togliere i recipienti dal forno
dopo l’uso pulire il forno con carta spruzzata con detersivo per vetri
in caso di incendio del contenuto del forno, tenere chiusa la porta, spegnere il forno, staccare la spina dalla presa di
corrente lasciando che il fuoco si estingua per soffocamento
Nota di sicurezza
Utilizzazione dell’apparecchiatura per elettroforesi
assicurarsi che l’alimentatore sia spento, prima di collegare i morsetti
assicurarsi che il coperchio della vaschetta sia correttamente posizionato, prima di collegare i morsetti
prima di rimuovere il coperchio della cella elettroforetica, spegnere l’alimentatore e staccare i morsetti
Nota di sicurezza
Utilizzazione della centrifuga
chiudere accuratamente il tappo delle provette, per evitare la fuoriuscita di liquido e la formazione di aerosol
assicurarsi che il rotore sia bilanciato: provette di ugual peso devono essere inserite negli alloggiamenti
diametralmente opposti
chiudere il coperchio della centrifuga prima di avviarla
non cercare di aprire il coperchio prima del completo arresto del rotore. In caso di fuoriuscita dei liquidi dalle
provette, avvertire il personale docente
Nota di sicurezza
Smaltimento dei rifiuti
tutto il materiale monouso (puntali, provette, pipette ecc.) va messo in appositi contenitori per rifiuti
cercare di ridurre al minimo il materiale da eliminare, visto i costi elevati del loro smaltimento
Nota di sicurezza
Manipolazione dell’etidio bromuro (sostanza mutagena)
Usare i guanti disposable
Evitare di spargere il prodotto sul banco di lavoro
Terminata l’utilizzazione del prodotto o delle sue soluzioni, provvedere allo smaltimento tenendo
presente che le soluzioni di etidio bromuro, come quelle di tutti i solventi alogenati, vanno raccolte
nell’apposito contenitore
20
21
3.5.6 marcatore di peso molecolare di DNA utilizzato
Come marcatore di peso molecolare è stato utilizzato il plasmide pUC8. Si tratta di una molecola di
DNA a doppia elica, con struttura circolare, formata da circa 2.700 bp. Questo plasmide deriva, per
successive modificazioni in laboratorio, da molecole di DNA normalmente presenti nei batteri. Come
in tutte le molecole di DNA, nella sequenza nucleotidica di questo plasmide sono presenti i cosiddetti
siti di restrizione, ossia delle particolari sequenze di basi (come GAATTC oppure GGCC), in
corrispondenza delle quali particolari enzimi, detti enzimi di restrizione, tagliano la molecola di
DNA. E’ un pò come tagliare un cerchio di
corda (il DNA plasmidico) con delle forbici
(gli enzimi di restrizione) in punti specifici (i
siti di restrizione).
Se si conosce il peso molecolare del plasmide,
ossia la sua lunghezza in coppie di basi, e la
posizione dei siti di restrizione di un dato
enzina di restrizione, tagliando a pezzetti una
molecola circolare si formano frammenti
lineari di DNA a peso molecolare noto. Questi
costituiscono il marcatore di DNA a peso
molecolare noto. Nel nostro caso, il marcatore
di peso molecolare è costituito dal plasmide
pUC8, tagliato con l’enzima di restrizione
HaeIII.
3.6 Risultati
Il risultato del gel di agarosio è riportato nello schema sottostante.
22
3.7 Interpretazione
La foto del gel va osservata attentamente per stabilire quale indiziato ha lo stesso profilo del DNA di quello
prelevato dalla scena del crimine. Per avere la certezza è necessario che le bande dell’indiziato coincidano
tutte perfettamente con quelle del campione trovato, ossia presentino lo stesso profilo di DNA. Nel nostro
caso questo accade per l’indiziato 2.
Attenzione: in genetica, una rondine non fa primavera, ma neanche due! In altri termini, per poter fare il
profilo di un individuo ed ottenere risultati attendibili, bisogna analizzare secondo l’FBI almeno 13
microsatelliti. Nel nostro esperimento, abbiamo analizzato 3 microsatelliti e non 13, per motivi di tempo, di
spazio e di costi.
3.7.1 domande di riepilogo
Analizzare attentamente il risultato e rispondere alle seguenti domande.
1. Determinare il n° di ripetizioni degli alleli dei tre microsatelliti analizzati, tenendo presente lo schema
dei microsatelliti riportato nella sezione 3.3.
Microsatellite 1
Allele
N° ripetizioni
(peso mol.)
Microsatellite 2
Allele
N°
(peso mol.) ripetizioni
Microsatellite 3
Allele
N° ripetizioni
(peso mol.)
Risposta
Microsatellite 1
Allele
N° ripetizioni
(peso mol.)
Microsatellite 2
Allele
N° ripetizioni
(peso mol.)
Microsatellite 3
Allele
N° ripetizioni
(peso mol.)
483
24
284
16
182
21
465
432
414
18
7
1
272
244
224
13
6
1
154
126
102
14
7
1
2. Determinare il genotipo degli individui relativo a ciascuno dei microsatelliti analizzati, compilando la
tabella sottostante. Identificare gli alleli in base al numero di ripetizioni (ad es. 5, 9; vedi §1.8).
V
SC
S1
S2
S3
Microsatellite 1
Microsatellite 2
Microsatellite 3
Risposta
V
Microsatellite 1
Microsatellite 2
Microsatellite 3
1,18
1,16
1,14
SC
7,24
16,16
1,21
S1
1,24
16,16
7,14
S2
7,24
16,16
1,21
S3
1,18
6,13
7,21
3. Quale dei tre microsatelliti non è risultato utile per l’identificazione personale e perché?
____________________________________________________________________
____________________________________________________________________________________
Risposta
Il microsatellite 2, perchè alcuni individui (S1 e S2) sono risultati omozigoti. Come pure omozigote è risultato anche il
DNA del campione SC. Se gli individui sono omozigoti, ossia presentano in omozigosi lo stesso allele, non è possibile
distinguerli.
23
4. Norme generali di sicurezza in laboratorio
Qui di seguito sono elencate alcune norme elementari di sicurezza, che devono essere tassativamente
rispettate.
Entrando in laboratorio, individuare le vie di fuga, indicate dalla segnaletica verde.
In laboratorio indossare sempre il camice. Il camice deve essere chiuso sul davanti, con maniche lunghe e
polsini ad elastico. Al termine delle attività, prima di lasciare il laboratorio, togliersi il camice. In ogni caso,
non uscire dal laboratorio, per recarsi in altre aree (biblioteca, uffici, bar, ecc.), senza aver prima tolto il
camice.
Non introdurre in laboratorio borse, zaini o altro materiale non necessario.
Indossare guanti monouso durante la manipolazione di sangue o di materiale da esso derivato non fissato.
I guanti devono essere rimossi con attenzione e sostituiti quando sono visibilmente contaminati. I guanti si
sfilano rovesciandoli e vanno gettati negli appositi contenitori.
Gli studenti che presentano dermatiti o altre lesioni sulle mani, devono indossare guanti protettivi in tutte
le fasi di lavoro.
I guanti vanno tolti, quando si usino strumenti di qualsiasi natura (telefono, tastiera, strumenti scientifici,
maniglie, ecc.). I guanti usati non vanno riutilizzati.
Lavare le mani routinariamente, immediatamente dopo la manipolazione di materiali contaminati e, in
ogni caso, dopo la fine delle attività, anche quando sono stati indossati i guanti. Lavare sempre le mani
prima di lasciare il laboratorio.
In laboratorio è vietato mangiare, bere, fumare, portare oggetti alla bocca ed applicare cosmetici.
Non pipettare mai con la bocca, ma utilizzare le apposite propipette.
Non appoggiare recipienti contenenti liquidi biologici vicino al bordo del banco di lavoro.
Tutto il materiale biologico d'origine umana (sangue, ecc.) deve essere considerato come potenzialmente
infetto e pertanto trattato con le necessarie precauzioni.
Segnalare immediatamente al personale docente ogni spargimento di materiale biologico (ad es. schizzi di
sangue) sul piano di lavoro, affinché si provveda alla decontaminazione con un germicida chimico
appropriato (candeggina, ecc.).
Decontaminare e pulire sempre, al termine del loro utilizzo, le apparecchiature scientifiche e, al termine
della attività, i piani di lavoro.
Seguire scrupolosamente le indicazioni di sicurezza riportate nei protocolli di esperimento.
Raccogliere tutti i liquidi biologici (sangue, terreni di coltura venuti a contatto con le cellule, cellule, ecc.)
in speciali contenitori per rifiuti, che verranno successivamente eliminati previo trattamento con
candeggina al 15%.
Mettere il materiale disposable (pipette, fiasche ecc.) venuto a contatto con materiale biologico in un
sacco apposito, che verrà smaltito mediante incenerimento.
Stante i costi elevati dello smaltimento, ridurre il più possibile l’uso del materiale disposable.
Segnalare immediatamente al personale docente qualsiasi incidente o la mancanza di materiale di
protezione
24
5. Quiz di autovalutazione
1. Completa il brano, scegliendo tra i seguenti termini:
somatiche, diploidi, aploidi, poliploidi, germinali, embrione, spora, sessuali, mitosi, meiosi, gameti, cellula
uovo, spermatozoo, zigote, aneuploidi, fecondazione.
Nella maggior parte degli esseri viventi, uomo compreso, le cellule del corpo, ossia le cellule…………,
hanno un corredo cromosomico doppio e perciò sono dette cellule………….. Mediante il processo
di………………, alcune cellule cellule, dette………….danno origine a cellule riproduttive o ………………
Queste cellule si chiamano……………. e …………………, rispettivamente nel maschio e nella femmina.
Queste cellule si fondono durante il processo della ………….. e danno origine alla prima cellula del nuovo
organismo, detta………….
2. Il DNA dell’uomo è diverso da individuo a individuo, eccetto che nel caso di:
A. marito e moglie
B. fratello e sorella
C. genitori e figli
D. gemelli dizigotici
E. gemelli monozigotici
3. Questo disegno rappresenta un nucleotide.
Definisci le parti A, B e C:
A…………………………….
B ……………………………
C …………………………….
4. Le due emieliche di una molecola di DNA sono antiparallele. Questa affermazione significa che:
A. una emielica ha la direzione 5’P
3’OH e l’altra 3’OH
5’P
B. i legami chimici che tengono uniti i nucleotidi in ciascuna emielica sono diversi
C. le due emieliche sono complementari
D. una sola delle due emieliche viene trascritta
E. la replicazione del DNA è semiconservativa
5. Indicare il corretto ordine decrescente di dimensioni:
A. gene, cromosoma, nucleotide, codone
B. cromosoma, gene, codone, nucleotide
C. nucleotide, cromosoma, gene, codone
D. cromosoma, nucleotide, gene, codone
E. gene, cromosoma, codone, nucleotide
6. Gli istoni sono:
A. tratti di DNA specifici per l’attacco della polimerasi
B. proteine basiche utilizzate come marcatori nell’elettroforesi
C. proteine basiche coinvolte nella spiralizzazione del DNA nei cromosomi
D. sequenze di DNA codificante particolari proteine
E. sequenze ripetute di DNA, che determinano polimorfismo allelico
7. La denaturazione del DNA consiste nella distruzione:
A. dei legami tra nucleotidi adiacenti
B. dei legami tra zuccheroo e base azotata dei nucleotidi
C. della struttura a doppia elica
D. della sequenza nucleotidica della doppia elica
E. nessuna delle precedenti
25
8. In un organismo che produce gameti contenenti 32 cromosomi, il numero dei cromosomi contenuti
in una cellula somatica è:
A. 16
B. 32
C. 4
D. 64
E. 8
9. Al microscopio ottico è possibile osservare:
A. virus
B. ribosomi
C. proteine
D. batteri
E. molecole inorganiche
10. Definite i seguenti termini:
gene ……………………………………………………………………………………
locus ……………………………………………………………………………………
11. In questo diagramma del processo di replicazione del DNA, i quadratini neri contrassegnati da D ed
E sono:
A. RNA iniziatore (primer)
B. DNA filamento stampo (template strand)
C. frammenti di Okazaki
D. DNA polimerasi
E. filamento di DNA di nuova sintesi
12. La replicazione del DNA: (Identificare l’affermazione sbagliata)
A. è catalizzata dall’enzima DNA polimerasi
B. avviene in modo simile in tutte le cellule di tutti gli organismi
C. richiede l’intervento di numerosi enzimi
D. necessita della presenza di un innesco a RNA
E. avviene mediante aggiunta di nucleotidi in direzione 3'5'
13. La replicazione semiconservativa del DNA assicura che siano prodotte:
A. due molecole identiche di DNA, ognuna formata da una emielica già esistente e da una
emielica neo-formata
B. molte molecole di RNA, delle quali solo alcune maturano a RNA messaggeri
C. quattro molecole di DNA, delle quali solo due vengono conservate
D. due emieliche identiche di DNA, ognuna complementare al DNA stampo
E. una sola emielica di DNA, copiando uno solo dei due filamenti stampo di DNA
26
14.
Una molecola di DNA è formata da un filamento che in un certo tratto è costituito dalla
seguente sequenza nucleotidica:
5’ ATCCATTGTGTCAATT 3’.
Scrivi quella del filamento complementare, indicandone la polarità.
15.
A.
B.
C.
D.
E.
16.
La Taq polimerasi è:
un enzima che interviene nella replicazione del DNA
un enzima estratto da un batterio termofilo, usato nelle reazioni della PCR
il colorante che permette di visualizzare le bande di DNA nell’elettroforesi
l’enzima che favorisce l’annealing dei primer nei termociclatori
un marcatore di peso molecolare usato nell’elettroforesi
Gli enzimi di restrizione:
A. separano la doppia elica di DNA nei due singoli filamenti
B. copiano una porzione ristretta di DNA
C. introducono geni estranei nel DNA
D. tagliano il DNA a livello di sequenze nucleotidiche specifiche
E. eliminano tratti di DNA
17. Quale delle seguenti affermazioni riguardo all’elettroforesi del DNA su gel di agarosio è
corretta?
A. l’elettroforesi su gel separa le singole basi azotate del DNA
B. nel corso dell’elettroforesi su gel i frammenti di DNA migrano verso l’elettrodo positivo
a causa della loro carica negativa
C. i frammenti più grandi di DNA copriranno, nello stesso tempo, distanze maggiori nel gel
rispetto ai frammenti più piccoli
D. questa tecnica è usata per amplificare il DNA
E. é una tecnica che permette di tagliare il DNA in frammenti
18.
Effettuando l’elettroforesi del DNA spiegate:
a - quale carica assume il DNA e a cosa è dovuta
b - il verso di migrazione
19.
L’acronimo PCR sta per:
……………………………………
20.
La tecnica della PCR consiste di vari cicli di amplificazione della sequenza “bersaglio” di
DNA. Ogni ciclo di amplificazione, a sua volta, è costituito da tre fasi. Indicare quali.
fase 1: _______________________
fase 2: ________________________
fase 3: _________________________
21.
I primer utilizzati nella PCR:
A. sono sequenze ripetute di DNA
B. sono oligonucleotidi ritagliati dagli enzimi di restrizione
C. per essere utilizzabili devono essere presenti molte volte nel filamento di DNA
D. sono corte sequenze nucleotodiche artificiali complementari al DNA da amplificare
E. costituiscono i marcatori di peso molecolare usati come riferimento nell’elettroforesi
22.
I markers di peso molecolare usati nell’elettroforesi per individuare la lunghezza dei
frammenti di DNA sono miscele di:
A. molecole proteiche, a peso molecolare noto, che vengono fatte migrare nella cella
elettroforetica insieme ai campioni da analizzare
B. molecole di DNA, a peso molecolare noto, che vengono fatte migrare nella cella
elettroforetica insieme ai campioni da analizzare
27
C. varie molecole di DNA e proteine, a peso molecolare noto, che vengono fatte migrare
nella cella elettroforetica insieme ai campioni da analizzare
D. isotopi radioattivi usati per marcare i frammenti di DNA da analizzare
E. coloranti a peso molecolare noto che vengono fatte migrare nella cella elettroforetica
insieme ai campioni da analizzare
23.
La tecnica della PCR: (Identificare l’affermazione sbagliata)
A. necessita di elevate quantità di DNA per poterne effettuare l’amplificazione
B. consente di amplificare una regione specifica del genoma
C. si basa sull’utilizzo di due primer
D. è costituita da vari cicli di amplificazione
E. utilizza una DNA polimerasi termostabile
24.
I cromosomi omologhi
A. sono presenti nelle femmine, ma non nei maschi
B. sono diversi per forma e dimensioni, ma portano geni identici
C. sono simili nella struttura e nella posizione occupata dai geni corrispondenti
D. sono diversi a seconda che si trovino nei maschi o nelle femmine
E. sono i cromosomi sessuali, contrapposti agli eterocromosomi
25.
Osservando i risultati dell’elettroforesi su gel, quali conclusioni possiamo trarre se:
A. notiamo una sola banda per un locus analizzato
B. notiamo due bande di diverso peso molecolare per lo stesso locus
26.
I microsatelliti:
A. sono corte sequenze nucleotidiche ripetute in numero variabile nei diversi individui, che
generano polimorfismo
B. sono i punti di innesco della DNA polimerasi durante la replicazione del DNA
C. sono polimorfismi del DNA, facilmente identificabili dalle differenze nel fenotipo
D. non sono utilizzabili come marcatori genetici perché presenti diffusamente in tutti gli
individui
E. rappresentano differenti proteine codificate da alleli polimorfici
27.
Quali sono le differenze tra polimorfismo allelico e polimorfismo del DNA?
…………………………………………………………………………………
…………………………………………………………………………………
Quanti diversi alleli di un singolo microsatellite è possibile identificare con il DNA profiling in
un individuo eterozigote?
A. 1
B. 2
C. 4
D. 8
E. 6
28.
29.
I microsatelliti sono ottimi marcatori genetici perché:
A. sono frequenti in corrispondenza di loci cromosomici noti
B. sono molto rari nella popolazione e quindi facilmente riconoscibili
C. le sequenze ripetute determinano un elevato polimorfismo riconoscibile nel fenotipo
D. la variabilità connessa al numero di sequenze ripetute garantisce un elevato
polimorfismo, in particolare negli eterozigoti
E. sono facilmente identificabili dai primer forward e reverse
30.
In un caso di attribuzione di paternità, il DNA del bambino viene confrontato con quello di
due uomini indicati dalla madre quali presunti padri. Il DNA profiling della madre rivela per
un singolo microsatellite una singola banda di circa 220 bp. Il DNA del bambino rivela due
28
bande di 220 e 232 bp. Il DNA del presunto padre 1 mostra due bande di 180 e 202 bp,
mentre il DNA del presunto padre 2 rivela due bande di 202 e 232 bp. Quale uomo potrebbe
essere il padre?
A. presunto padre 1
B. presunto padre 2
C. entrambi
D. nessuno dei due
E. non si può determinare
31.
La figura riporta i DNA profiling relativi a numerosi microsatelliti effettuati su 4 coppie di
gemelli (indicate con le lettere da A a D). Indicare quali coppie sono costituite da gemelli
dizigotici.
A.
B.
C.
D.
E.
32.
33.
coppie A e B
coppie A e C
coppie A e D
coppia B e C
coppie C e D
Da una madre con gruppo sanguigno A e un padre B può nascere un figlio con gruppo
sanguigno 0? In caso di risposta affermativa, indica la percentuale di figli con gruppo
sanguigno 0 e il genotipo dei genitori.
Individua il peso molecolare totale in bp di due marcatori costituiti rispettivamente da:
- primo marcatore: un primer forward da 90 bp, un primer reverse da 50 bp, con 15 unità di
ripetizione da 2 bp
- secondo marcatore : un primer forward da 100 bp, un primer reverse da 120 bp, con 8 unità
di ripetizione da 3 bp
29
6. Glossario
Agarosio
Allele
Annealing (appaiamento)
Aploide
Basi azotate
Cellula
Cellula germinale
Cellula somatica
Cromosoma
Cromosomi omologhi
Denaturazione
Diploide
DNA
DNA polimerasi
Elettroforesi
Enzima
Enzima di restrizione
Eterozigote
Fenotipo
Gemelli monozigotici
sostanza organica estratta da alcune alghe rosse e usata come gelificante
una delle possibili forme alternative che può assumere un gene,
localizzato in uno specifico sito cromosomico
formazione di molecole ibride di acidi nucleici basata sulla
complementarietà delle basi
cellula o individuo con una sola copia (n) di ciascun cromosoma
molecole costituenti il filamento del DNA insieme allo zucchero
deossiribosio e al gruppo fosfato. Sono quattro e si classificano in basi
puriniche (A e G) e pirimidiniche (T e C)
la più piccola unità di costruzione di un organismo pluricellulare ed essa
stessa, come unità singola, un organismo elementare
cellula deputata alla riproduzione (cellula uovo o spermatozoo)
cellula destinata alla formazione del corpo (“soma”) dell’organismo e
contrapposta a quella della linea germinale, deputata alla riproduzione
struttura formata da DNA e proteine dove sono localizzati in successione
lineare i geni, e osservabile nella cellula in divisione
i membri di un paio di cromosomi, identici nella disposizione dei geni
presenti e nella loro struttura
perdita della configurazione originale di una macromolecola, dovuta ad
es. all’aumento di temperatura, a cambiamenti estremi di pH, a
trattamenti chimici o altro; generalmente è accompagnata a perdita
dell’attività biologica. Nel caso del DNA, la denaturazione consiste nella
separazione dei due filamenti della doppia elica per rottura dei legami a
idrogeno tra le basi azotate
organismo o cellula con due assetti cromosomici (2n) o due genomi
abbreviazione di acido deossiribonucleico. Il DNA constituisce il
materiale genetico di tutti gli organismi, e ha per lo più struttura a doppia
elica
enzima che sintetizza DNA unendo insieme nucleotidi e usando un
singolo filamento di DNA come stampo
tecnica che consente di separare molecole caricate elettricamente,
mediante la migrazione in un campo elettrico
proteina che accelera o catalizza una specifica reazione chimica in un
sistema vivente
detto anche forbice molecolare; enzima che taglia il DNA a doppia elica
(e non quello a singolo filamento!), in corrispondenza di sequenze
specifiche dette siti di restrizione
organismo o cellula diploide, in cui sono presenti due alleli diversi di uno
stesso gene
caratteristiche osservabili in un organismo che risultano dall’interazione
tra genotipo e ambiente
gemelli derivati dalla fecondazione di una singola cellula uovo e
successiva separazione delle cellule dopo le primisisme divisioni
mitotiche dello zigote. I gemelli monozigotici sono identici
geneticamente
30
Gemelli dizigotici
Gene
Genoma
Genotipo
Istoni
Locus
Microsatelliti (STR)
Mutazione
Nucleotide
Oligonucleotide
Omozigote
PCR
(polymerase chain reaction)
Plasmide
Polimorfismo
Polinucleotide
Primer
Profilo del DNA
(DNA profiling)
gemelli derivati dalla fecondazione indipendente di due cellule uovo con
due diversi spermatozoi. I gemelli dizigotici sono geneticamente simili
quanto due fratelli. Possono essere dello stesso sesso oppure di sesso
diverso
unità funzionale di eredità che corrisponde di solito al segmento di DNA
che codifica per una proteina
quantità totale di materiale genetico di una cellula; negli eucarioti indica
anche l’assetto aploide dei cromosomi di una specie
costituzione genetica di un organismo
proteine basiche ricche in arginina e lisina che partecipano alla
formazione del nucleosoma nei cromosomi eucariotici
posizione fissa su un cromosoma occupata da un dato gene
regione del genoma in cui segmenti identici di DNA di 2, 3 o 4 paia di
basi sono ripetuti e disposti uno di seguito all’altro in posizione testacoda (arrangiamento in tandem)
cambiamento del DNA in un particolare locus di un organismo; può
verificarsi spontaneamente oppure essere indotta da trattamenti chimici o
fisici
unità base del DNA e dell'RNA, formata da gruppo fosfato, zucchero e
base azotata
corta molecola di DNA (o RNA) a singolo filamento di poche decine di
paia di basi
organismo o cellula diploide che porta alleli identici di uno steso gene
tecnica di biologia molecolare utilizzata per amplificare in breve tempo
tratti specifici di DNA, purché se ne conosca almeno in parte la sequenza
nucleotidica
piccola molecola di DNA extracromosomico dei procarioti che ha la
possibilità di trasferirsi da una cellula all’altra previa duplicazione.
esistenza di forme diverse di: alleli (polimorfismo allelico), proteine
(polimorfismo proteico), DNA (polimorfismo del DNA)
molecola costituita da più nucleotidi uniti da legami fosfodiesterici
corta catena polinucleotidica, a DNA o RNA, alla quale vengono aggiunti
nuovi nucleotidi nel corso della sintesi di DNA. Noto anche con il
termine di innesco. Nella PCR si utilizza una coppia di primer
tecnica di genetica molecolare per identificare gli individui e distinguere
un individuo dall’altro. Si basa sull’analisi dei microsatelliti
STR (Short Tandem Repeat, corta vedi microsatellite
ripetizione in tandem)
31
7. Siti web utili
Aspetti forensi
http://www.ornl.gov/sci/techresources/Human_Genome/elsi/forensics.shtml
http://whyfiles.org/014forensic/genetic_foren2.html
http://www.laboratoriogenoma.it/indagini_paternita_come.asp
Esercizi interattivi e laboratorio virtuale
http://www.dnai.org/d/index.html
http://www.molecularlab.it/interactive/index.asp
http://www.dnalc.org/shockwave/pcranwhole.html
http://www.rvc.ac.uk/Extranet/DNA_1/7_PCR.htm
Approfondimenti
http://www.geneticorigins.org/geneticorigins/pv92/aluframeset.htm
http://www.racine.ra.it/curba/biotecnologie/index.html (in italiano)
8. Concorso “Una settimana da ricercatore”
Al termine delle attività di laboratorio, verrà distribuito agli insegnanti un quizzario con 30 domande da far
svolgere in classe e che potrà servire sia come verifica del lavoro svolto che per selezionare lo studente
migliore nella classe che avrà la possibilità di partecipare al concorso: “Una settimana da ricercatore”. Il
concorso si svolgerà in un pomeriggio del mese di aprile 2006 presso l’Università degli Studi di Milano (il
pomeriggio della prova verrà comunicato successivamente), attraverso una prova al computer, basata su test
interattivi a risposta multipla, e un colloquio per valutare gli interessi dello studente.
Per i primi cinque studenti classificati, il premio consisterà in uno stage presso un laboratorio di ricerca
dell’Università degli Studi di Milano nel campo della Genetica molecolare.
Lo stage si svolgerà al termine dell’anno scolastico, nei mesi di giugno o luglio 2006.
32
Supervisione di: Prof.ssa Maria Luisa Tenchini, Dipartimento di Biologia e Genetica per le Scienze Mediche,
Università degli Studi di Milano.
A cura di:
Prof.ssa Silvana Dolfini Faccio, Dipartimento di Biologia e Genetica per le Scienze Mediche,
Università degli Studi di Milano;
Prof.ssa Cinzia Grazioli, insegnante di Scienze delle scuole secondarie di secondo grado, distaccata
presso il Cus-Mi-Bio
Prof.ssa Anna Cartisano, Liceo Vico, Corsico
Prof.ssa Anna Cimino, IIS Leonardo da Vinci Cologno Monzese
Prof.ssa G. De Falco, IIS Lagrange, Milano
Prof.ssa R. Quarta, Liceo della formazione Agnesi, Milano
Prof.ssa G. Tabita, IIS Leonardo da Vinci Cologno Monzese
Si ringrazia la Eppendorf Italia
33



![mutazioni genetiche [al DNA] effetti evolutivi [fetali] effetti tardivi](http://s1.studylibit.com/store/data/004205334_1-d8ada56ee9f5184276979f04a9a248a9-300x300.png)
![(Microsoft PowerPoint - PCR.ppt [modalit\340 compatibilit\340])](http://s1.studylibit.com/store/data/001402582_1-53c8daabdc15032b8943ee23f0a14a13-300x300.png)