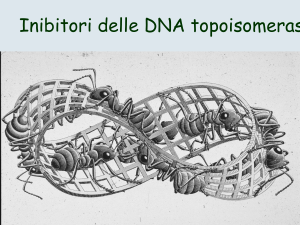
Farmaci che interferiscono con le
DNA Topoisomerasi
Caratteristiche del DNA
• Una molecola di DNA consiste di due filamenti,
avvolti in modo da formare una doppia elica,
spesso ciclizzati in forma di anello.
• Un DNA in forma rilassata è troppo lungo per
essere inserito nella cellula. Perché possa essere
introdotto, il DNA deve essere superavvolto, in tal
modo le sue dimensioni sono ridotte al minimo.
• Per la replicazione e la trascrizione i due filamenti
di DNA debbono essere almeno in parte in forma
rilassata e separati.
Chimica Farmaceutica e Tossicologica
2
La duplicazione del DNA si esplica attraverso il
meccanismo della replicazione
• I step: separazione dei filamenti complementari di
DNA mediante l’intervento della DNA elicasi.
• II step: l’intervento delle proteine destabilizzatrici
dell’elica.
• III step: le topoisomerasi operano il “taglia e cuci”.
Chimica Farmaceutica e Tossicologica
3
Funzioni delle topoisomerasi I e II
•
•
Durante la replicazione la doppia elica deve quindi svolgersi.
Le topoisomerasi sono enzimi che convertono il DNA da una forma
topologica all'altra, cioè da una forma superavvolta ad una rilassata e
viceversa.
•
Le topoisomerasi I rompono transitoriamente una sola delle catene del
DNA, la ruotano attorno a quella integra e infine riuniscono le estremità
interrotte, modificando il numero di legame (Lk) con incrementi positivi di
1. Dal momento che il DNA è superavvolto in senso destrogiro, un
incremento positivo di Lk porta in effetti ad un rilassamento della doppia
elica, un processo termodinamicamente favorevole.
Le topoisomerasi II invece, rompono entrambe le catene di DNA e
modificano Lk con incremento negativo di 2; dal momento che introduce
un ulteriore stress topologico nella doppia elica, questa reazione necessita
di energia, prodotta attraverso l'idrolisi di una molecola di ATP.
•
Chimica Farmaceutica e Tossicologica
4
Superavvolgimento del DNA
Le topoisomerasi sono enzimi che controllano il grado di superavvolgimento del DNA, dell' avvolgimento cioé dell'
asse della doppia elica del DNA su se stesso e risolvono in tal modo i problemi di aggrovigliamento e concatenazione
del DNA che possono presentarsi durante i processi di replicazione e trascrizione del DNA stesso e nel corso della
mitosi cellulare. Le topoisomerasi possono catalizzare sia superavvolgimenti positivi (destrogiri) che negativi
(levogiri). Il processo di interconversione tra forme diverse di DNA che differiscono tra loro per il grado di
superavvolgimento può avere luogo tagliando uno o entrambi i filamenti del DNA. Le topoisomerasi di tipo I
tagliano un solo filamento, quelle di tipo II entrambi i filamenti. La DNA girasi e la topoisomerasi IV sono
topoisomerasi di tipo II.
Chimica Farmaceutica e Tossicologica
5
Ruolo della topoisomerasi I
REAZIONE DI TAGLIO REVERSIBILE CATALIZZATA DA UNA DNA TOPOISOMERASI I EUCARIOTICA
L’ENZIMA FORMA UN LEGAME COVALENTE TEMPORANEO CON IL DNA IN MODO DA
PERMETTERE UNA LIBERA ROTAZIONE INTORNO AI LEGAMI COLAVELNTI DEL FOSFATO
Chimica Farmaceutica e Tossicologica
6
Ruolo della topoisomerasi II
REAZIONE DI ATTRAVERSAMENTO DELL’ELICA CATALIZZATA DALLA DNA TOPOISOMERASI II
•
RICHIEDE IDROLISI DI ATP-FORMA LEGAME COVALENTE CON ENTRAMBI I FILAMENTI
•
PERMETTE PASSAGGIO DI UNA DOPPIA ELICA ATTRAVERSO LA ROTTURA
•
RISALDA LA ROTTURA E SI DISSOCIA DAL DNA
Chimica Farmaceutica e Tossicologica
7
Modello per la formazione del legame fosfotirosinico
tra topoisomerasi e DNA
a) Topo I: l’enzima si lega covalentemente in 3’ al DNA
b) Topo II: l’enzima si lega covalentemente in 5’ al DNA
Le topoisomerasi si
legano
covalentemente al
DNA attraverso una
tirosina. Questo
legame è facilmente
scindibile.
Sostanze antitopoisomerasi
stabilizzano questo
complesso non
permettendo
all’enzima di
completare il suo ciclo
catalitico.
Chimica Farmaceutica e Tossicologica
8
Topoisomerasi II Batteriche:
DNA Girasi (GRAM -)
e
Topoisomerasi IV (GRAM +)
DNA girasi
• La DNA girasi è l’enzima, analogo della topoisomerasi
II, che regola la conformazione del DNA (svolgimento,
replicazione, trascrizione) nei batteri.
• L’enzima è costituito da due sub-unità: sub-unità A e
sub-unità B.
• La DNA-girasi può indurre circa 100
superavvolgimenti/min in una molecola di DNA chiusa,
circolare, rilassata.
• L’inibizione della DNA girasi altera la disponibilità di
DNA nel batterio e ne causa la morte.
Chimica Farmaceutica e Tossicologica
10
Formazione della sovrapposizione a spirale negativa
del DNA ad opera della DNA girasi
Idrolisi di un legame fosfodiestereo
Chimica Farmaceutica e Tossicologica
Intreccio in direzione opposta dell’elica:
superavvolgimento elicoidale negativo
11
La DNA-girasi può
introdurre
superavvolgimenti
negativi nel DNA
duplex invertendo un
superavvolgimento
positivo
Chimica Farmaceutica e Tossicologica
Mg++
12
MECCANISMO D’AZIONE DELLA DNA GIRASI
La DNA girasi è capace di alterare
lo stato topologico del DNA
introducendo avvolgimenti
negativi. L’azione dell’enzima
inizia con l’avvolgimento del DNA
attorno all’enzima. Le subunità A
scindono il DNA e ciascun
monomero A dell’enzima viene
legato covalentemente tramite un
residuo tirosinico al 5’-fosfato del
DNA tagliato con un legame
fosfotirosinico. Poi la parte integra
del DNA passa attraverso la
rottura del filamento e la subunità
GyrB salda il filamento prima
tagliato di DNA. L’enzima poi si
dissocia e ricomincia la sua azione
su un altro filamento
Chimica Farmaceutica e Tossicologica
13
MECCANISMO D’AZIONE DELLA DNA GIRASI
Chimica Farmaceutica e Tossicologica
Pagina 14
MECCANISMO D’AZIONE DELLA DNA GIRASI
Avvolgimento
Taglio di entrambi i filamenti
Passaggio del doppio filamento
integro attraverso l’ interruzione
Risaldatura
DNA superavvolto negativamente
Chimica Farmaceutica e Tossicologica
Pagina 15
Inibitori della subunità A della DNA girasi e della
topoisomerasi IV
Antibatterici Chinolonici
Meccanismo di Azione
I chinoloni agiscono inibendo
due topoisomerasi batteriche
DNA girasi (batteri Gram -) Topoisomerasi IV (batteri Gram +)
Chimica Farmaceutica e Tossicologica
Pagina 17
Meccanismo di Azione
DNA girasi
(topoisomerasi II)
DNA
DNA polimerasi
REPLICAZIONE
DNA
TRASCRIZIONE
RNA
STOP
Chinoloni
Fluorochinoloni
RNA polimerasi
Chimica Farmaceutica e Tossicologica
18
Meccanismo di Azione
O
-
O
O P
O
O P O
B
-
O
O
B
O
O
OH
Interruzione
Risaldatura
O
-
O P O
O
B
O
O
OH
-
O P O
H
N
O
N
H
CO
Tirosina 122
della Girasi
Chimica Farmaceutica e Tossicologica
DNA
O
CO
B
O
O
Pagina 19
Meccanismo di Azione
Chinoloni
Modello di legame cooperativo chinolone-DNA
nell' inibizione della DNA girasi.
Chimica Farmaceutica e Tossicologica
Pagina 20
INTERAZIONE TRA CHINOLONI, DNA E LA DNA
GIRASI
le molecole di fluorochinoloni interagiscono con determinati residui della DNA girasi, in particolare le molecole di farmaco (due o più) attraverso il sostituente
R7 formano legami a idrogeno con i residui Asp426 e Lys447 di GyrB e attraverso il sostituente R1 interagisce con i residui amminoacidici della subunità GyrA
Chimica Farmaceutica e Tossicologica
21
INTERAZIONE TRA DNA POLIMERASI IV-DNA e
CHINOLONI
• Immagine Topoisomerasi con Chinolone con Chimera
Chimica Farmaceutica e Tossicologica
22
Sviluppo dei chinoloni
• Gli antibiotici chinolonici sono un gruppo di composti di sintesi contenenti un anello 3-carbossipiridin-4one, condensato con un altro anello aromatico o eterociclico variamente sostituito.
• Il primo rappresentante della serie è stato l’acido nalidissico (1962), attivo contro i Gram- e usato quasi
esclusivamente per il trattamento di infezioni urinarie.
• Esso è il risultato di un programma di ricerca con motivazione chimica, sviluppato attraverso diverse
successive modifiche strutturali, presso la Baeyer, ove erano disponibili gli intermedi della sintesi della
clorochina.
• L’acido nalidissico è ancora utilizzato nelle infezioni urinarie ma, recentemente, sono stati sviluppati molti
analoghi fluorochinolonici, più potenti e meglio distribuiti nei differenti distretti dell’organismo.
Chimica Farmaceutica e Tossicologica
23
Sviluppo dei chinoloni
Chimica Farmaceutica e Tossicologica
24
Sviluppo dei chinoloni
• I chinoloni sono composti sintetici, che agiscono inibendo la DNA
girasi.
• In particolare, essi inibiscono la sub-unità A dell’enzima.
• La sub-unità B dell’enzima e’ inibita dalla novobiocina.
• Si parla di chinoloni di I, II, III e IV generazione, ma e’ più
opportuno suddividerli per specificità strutturali e farmacologiche.
• N. B. L’uomo usa, per dare forma al suo DNA, la topoisomerasi II,
un enzima analogo alla girasi che però non lega i chinoloni, almeno
alle dosi terapeutiche (il farmaco perciò non danneggia le cellule
dell’ospite).
Chimica Farmaceutica e Tossicologica
25
CHINOLONI (o OXACINE)
O
CO2H
B
A
X
X = CH, N
4
3
1
N
2
N
1,4 diidropiridina
R
4
anello A: acido 1,4-diidro-4-oxopiridin
- -car oss co
r
n
o
az
id
i
ili
b
pi
(
)3
anello B: aromatico o eteroaromatico
Chimica Farmaceutica e Tossicologica
3
1 N
2
N
1,4 diidropiridazina
26
Sistemi Anulari Base dei Chinoloni
O
5
4
6
3
7
2
8
1,4-diidro-4-oxochinolina
N1
norfloxacina
pefloxacina
ciprofloxacina
moxifloxacina
lomefloxacina
O
5
4
6
3
7
N2
8
N1
1,4-diidro-4-oxocinnolina
cinoxacina
1,4-diidro-4-oxo-1,8-naftiridina
acido nalidixico
enoxacina
O
5
4
6
3
7
2
8
N
N1
Chimica Farmaceutica e Tossicologica
27
Sistemi Anulari Base dei Chinoloni
O
4
5
3N
6
2
7
1
N
N8
5,8-diidro-5-oxo-pirido[2,3-d]pirimidina
acido pipemidico
X = O: 2,3-diidro-7-oxo-7H-pirido[1,2,3-de]-1,4-benzoxazina
X = S: 2,3-diidro-7-oxo-7H-pirido[1,2,3-de]-1,4-benzotiazina
ofloxacina
1,4-diidro-4-oxo-1,3-tiazeto[3,2-a]chinolina
prulifloxacina
O
8
7
9
6
10
5
N4
1X
rufloxacina
3
2
O
5
4
3
2
6
7
8
N
1
S
Chimica Farmaceutica e Tossicologica
Pagina 28
O
O
CO2 H
H3 C
O
Nalidixin, cpr
Naligram,cpr, scir
Uriflor, cps
N
N
CO2 H
O
N
Et
N
Et
Acido Nalidixico
Cinoxacina
Cinobac, cps
Cinocil, cps
Cinoxen, cps
Nossacin, cps
Noxigram, cps
Uroc, cps
Uronorm, cps
Uroxacin, cps
O
CO2 H
N
N
N
H
N
N
Acido pipemidico gener., cps
Biosoviran, cps
Cistomid, cps
Diperden, cps
Faremid, cps
Pipeacid, cps
Pipedac, cps
Pipefort, cps
Pipemid, cps
Pipram, cps
Pipurin, cps
Urodene, cps
Uropimid, cps
Urosan, cps
Urosetic, cps
Urotractin, cps
Et
Acido Pipemidico
Chimica Farmaceutica e Tossicologica
29
Chinoloni di III Generazione
(fluorochinoloni sistemici)
Norfloxacina
O
F
N
N
H
Enoxacina CH sostituito con N
Pefloxacina H sostituito con CH3
CO2 H
N
Et
Flossac, cps
Norfloxacina, gener.,
cpr
Noroxin, cpr, coll.
Renoxacin, cpr
Sebercim, cpr
Uticina, cpr
Utinor, cpr
Norfloxacina
pivaloilossimetilestere
Diperflox, os sosp., cpr
Norflox, os sosp., cpr
Utilizzati contro enterobacter, enterococcus,o Pseudomonas aeruginosa
Chimica Farmaceutica e Tossicologica
Pagina 30
Chinoloni di III Generazione
(fluorochinoloni sistemici)
O
CO2 H
F
N
H3 C
N
O
F
N
CO2 H
N
Et
N
N
N
Et
H
Pefloxacina
Enoxacina
Peflacin, iv, cpr
Peflox, iv, cpr
Bactidan, cpr
Enoxen, cpr
Chimica Farmaceutica e Tossicologica
Pagina 31
Chinoloni di III Generazione
(fluorochinoloni sistemici)
O
F
N
O
F
CO2 H
N
N
N
N
H3 C
H
Ciprofloxacina
Ciproxin, cpr, os sol., iv
Flociprin, cpr riv., iv
Oftacilox, coll.
Chimica Farmaceutica e Tossicologica
CO2 H
Ofloxacina
(Forma racema)
Exocin, coll., ung. oft.
Flobacin, cpr
Oflocin, cpr
N
O
CH3
Levofloxacina
(Isomero S)
Levoxacin, cpr riv., iv
Prixar, cpr riv.
Tavanic, cpr riv., iv
Pagina 32
Chinoloni di IV Generazione
(fluorochinoloni sistemici monodose giornaliera)
O
CO2H
F
Moxifloxacina
N
N
HN
Avalox, cpr
Octegra, cpr
OCH3
O
F
CO2 H
N
N
N
S
H3 C
Chimica Farmaceutica e Tossicologica
Rufloxacina
Monos, cpr riv.
Qari, cpr riv.
Tebraxin, cpr riv.
Pagina 33
Chinoloni di IV Generazione
(fluorochinoloni sistemici monodose giornaliera)
O
F
CO2 H
N
N
N
F
Lomefloxacina
Chimono, cpr
Lomebact, coll.
Maxaquin, cpr
Okacin, coll.
Uniquin, cpr
Et
H
CH3
I derivati fluorochinolonici, in particolare la ciprofloxacina, vengono
utilizzati contro: prostatite, infezioni delle vie respiratorie, setticemia,
endocardite stafficlococcica e da Pseudomoas, meningite, malattie
trasmesse per via sessuale (Clamidia), infezioni dell’orecchio ed
osteoartrite purulenta
Chimica Farmaceutica e Tossicologica
Pagina 34
Caratteristiche Farmacocinetiche dei Chinoloni
Chinolone
Acido Nalidixico
Cinoxacina
Acido
Pipemidico
Norfloxacina
Pefloxacina
Enoxacina
Ciprofloxacina
Ofloxacina
Moxifloxacina
Rufloxacina
Lomefloxacina
Biodisponibilità
(%)
t1/2 (ore)
Legame con le
proteine
plasmatiche (%)
80-90
1.5-2
80-93
Farmaco escreto
inalterato o
come metabolita
attivo
13-20
buona
1.6-2
63-73
50-60
250 mg/6 ore
buona
3
15
>90
400 mg/12 ore
40
3.3-5.5
15
20-40
400 mg/12 ore
90-100
7.5-10
20-30
30
400 mg/12 ore
80
3.3-5.8
35
>80
300-400 mg/12 ore
60-80
3.3-5.4
20-40
60
250-500 mg/12 ore
85-95
5-7
25
70
200-400 mg/12 ore
~90
12
50
45
400 mg/dì
buona
12
12
400 mg/dì
>98
8
80
400 mg/dì
Chimica Farmaceutica e Tossicologica
10
Dosaggio
1 g/ 6 ore
35
Caratteristiche farmacologiche dei chinoloni di I
generazione
• I chinoloni della prima generazione non erano molto
attivi. Questo ha portato ad impiego di dosi elevate, che
hanno facilitato l’insorgere di effetti secondari: disturbi
gastrointestinali e visivi, allucinazioni e insonnia.
• I recenti derivati, che incorporano un atomo di fluoro ed
eventualmente una catena laterale piperazinica sono
molto piu’ potenti e relativamente non tossici.
• L’attivita’ si rivolge in particolare verso i Gram(-), con
eccezione dello Pseudomonas.
Chimica Farmaceutica e Tossicologica
36
Caratteristiche farmacologiche dei chinoloni di II, III e
IV generazione
• I chinolonici di seconda generazione agiscono contro i batteri
Gram(-), compresi Pseudomonas e Proteus, ma sono poco attivi
verso i Gram(+). Anch'essi sono disinfettanti delle vie urinarie.
• I chinolonici di terza e quarta generazione presentano uno spettro
d'azione ancor più allargato: sono attivi verso Gram(-), Proteus,
Pseudomonas, Gram(+), e a volte anche su altri batteri (per es.
micobatteri).
• Drug-drug interaction: la somministrazione contemporanea di
teofillina potenzia l’azione di quest’ultima.
Chimica Farmaceutica e Tossicologica
37
Microorganismo
Cocchi G+
Staphylococcus aureus
Strepyococcus pyogenes
Streptococcus faecalis
Streptococcus pneumoniae
Enterobatteri
Escherichia coli
Klebsiella pneumoniae
Enterobacter cloacae
Serratia marcescens
Proteus mirabilis
Proteus vulgaris
Proteus stuartii
Providencia rettgeri
Salmonella spp.
Shigella spp.
Altri batteri GPseudomonas aeruginosa
Neisseria meningitidis
Neisseria gonorrheae
Haemophilus influenzae
Legionella pneumophila
Batteri anaerobi
Clostridium difficile
Bacteroides fragilis
Altri microorganismi
Mycoplasma pneumoniae
Chlamydia trachomatis
Ureaplasma urealyticum
MIC90 (mg/ml)
Cip
Eno
Ofl
Mox
Pruli
3.1
12.0
12.0
16.0
1.0
2.0
2.0
1.0
0.4
3.1
1.6
2.0
0.06
0.5
0.25
2.0
4.0
0.4
3.1
0.4
6.3
0.8
1.6
1.6
1.6
0.2
0.2
0.03
<0.12
<0.12
1.0
<0.12
0.12
1.0
0.2
0.03
0.2
0.2
0.2
1.0
6.3
0.2
0.1
1.0
2.0
0.5
<0.1
0.06
2.0
<0.06
0.25
0.05
2.0
0.5
<0.03
0.01
<0.02
0.5
3.1
<0.03
0.06
0.02
0.5
64
128
25
50
16
2.0
8
6.3
12
16
32
6.3
16
64
1.0
32
1.6
4.0
8.0
Nal
Nor
Pef
100
200
200
128
6.3
6.3
12.0
4.0
0.5
4.0
200
4.0
>200
25
2.0
128
16
8.0
4.0
0.12
1.6
0.4
3.1
0.1
0.4
3.1
1.6
0.06
0.03
0.25
2.0
>200
0.5
1.0
2.0
1.0
3.1
<0.12
0.06
0.02
2.0
>128
512
2.0
1.0
0.12
0.015
0.12
0.12
0.5
0.015
0.015
1.0
0.03
0.015
1
0.03
0.015
1.0
Nal: A. nalidixico; Nor: Norfloxacina; Pefl: Pefloxacina; Eno: Enoxacina; Cip: Ciprofloxacina; Ofl: Ofloxacina; Mox: Moxifloxacina; Pruli:
Prulifloxacina
Chimica Farmaceutica e Tossicologica
38
Acido nalidissico: struttura chimica
O
COOH
4
3
7
1
H3C
N
N
8
Acido 1-etil-1,4-diidro-4-oxo-7-metil-1,8-naftiridin-3-carbossilico
Chimica Farmaceutica e Tossicologica
39
Acido nalidixico: storia
• E’ stato il primo composto entrato in terapia nel 1965.
• E’ nato come sviluppo di un intermedio di sintesi della clorochina,
che manifestava attività antibatterica, operando una sostituzione
dell'anello chinolinico con quello 1,8-naftiridinico.
• E’ attivo su germi Gram(-), inclusi Eschericha coli, Proteus
mirabilis, Klebsiella pneumoniae, Enterobacter spp., Shigella spp.,
Salmonella enteritidis.
• E’ inattivo contro la Pseudomonas aeruginosa e contro i Gram (+) .
• Pur essendo ben assorbito non risulta utile nelle infezioni
sistemiche.
• La sua solubilità e la sua elevata concentrazione nelle urine ne
consigliano l'uso come disinfettante delle vie urinarie.
• Causa la sua elevata rapidità a promuovere l'insorgere di
resistenza viene usato sempre meno.
• Provoca ipersensibilità alla luce.
Chimica Farmaceutica e Tossicologica
40
Acido nalidixico: sintesi chimica
EtO2C
EtOH
CO2Et
CO2Et
D
+
N
NH2
O
C
N
N
EtO
CO2Et
EMME
H
CO2Et
N
N
EtOH
N
H
O
O
CO2Et
CO2Et
N
N
H+
O
Et
K2CO3
O
CO2Et
I
N
N
Et
Chimica Farmaceutica e Tossicologica
N
H
CO2H
-
OH
N
N
Et
Pagina 41
Norfloxacina: struttura chimica
O
F
N
COOH
N
HN
Acido 1-etil-6-fluoro-7-(piperazin-1-il)-1,4-diidro-4-oxo-chinolin-3-carbossilico.
Chimica Farmaceutica e Tossicologica
42
Norfloxacina: storia
• E’ stato il primo fluoro derivato introdotto in terapia
(1986) .
• Ha potente attività contro Pseudomonas, oltre che
contro G(-) e G(+).
• E’ attualmente uno dei derivati chinolonici più usati per
infezioni urinarie, data la sua elevata attività e
discretamente bassa tossicità.
• Dà resistenza crociata con gli altri chinoloni.
Chimica Farmaceutica e Tossicologica
43
Norfloxacina: sintesi chimica
EtO2C
EtOH
CO2Et
CO2Et
D
EtOH
+
N
Cl
NH2
O
C
Cl
N
H
CO2Et
Cl
N
N
N
Cl
EtO
CO2Et
EMME
N
H
O
O
CO2Et
CO2Et
N
N
Cl
+
H
O
Et I
K2CO3
O
CO2Et
Cl
N
N
H
CO2H
-
OH
N
Cl
Et
N
N
O
Et
CO2H
R
N
N H
N
R
HCl
Chimica Farmaceutica e Tossicologica
N
N
N
Et
R = H: norfloxacina
R = Me: pefloxacina
Pagina 44
Ofloxacina: struttura chimica
O
F
9
10
4
N
N
H3C
COOH
7
N
O
1
* 3
CH3
H
Acido 9-fluoro-3-metil-10-(4-metilpiperazin-1-il)-3,2-diidro-7H-7-oxopirido[3,2,1-d,e]benzo-1,4-oxazin-6-carbossilico.
Attivo su germi Gram(+) e Gram(-) del tratto genito-urinario e delle vie
respiratorie superiori.
Antibatterico più potente della norfloxacina.
Chimica Farmaceutica e Tossicologica
45
Ofloxacina: storia
• Levofloxacina. Isomero S della ofloxacina, da 2 a 4 volte più
potente della ofloxacina, con minori effetti collaterali. Uso: Infezioni
del basso tratto respiratorio e del tratto urinario, della prostata e
delle malattie sessuali. Ha largo spetto verso G(+) e G(-) patogeni
aerobi ed in particolare verso Enterobacteriaceae.
• Rufloxacina. Isostero dell'ofloxacina, di cui è meno attivo, ha
sostituito l'anello ossazinico con uno tiazinico. Usata nelle infezioni
urinarie e nel tratto respiratorio. Buona penetrazione tissutale con
attività protratta.
• Nadifloxacina. Potente e di largo spettro [G(+), G(-), batteri aerobi,
Pseudomonas aerugunosa]. E’ in particolare usata contro l’acne
vulgaris ad alta infezione della pelle.
Chimica Farmaceutica e Tossicologica
46
Ofloxacina: sintesi chimica
O
F
Cl
F
Na2CO3
NO2
F
F
H2, Ni Raney
F
F
NO2
O
OH
O
O
F
F
F
NH2
O
1) EMME
2) D
F
N
NH
3) AcOH/HCl
O
O
HN
N
Me
4)
O
F
CO2H
N
Me
Chimica Farmaceutica e Tossicologica
N
N
O
Pagina 47
Ciprofloxacina: struttura chimica
O
F
N
6
7
4
3 COOH
1
N
HN
Acido 1-ciclopropil-6-fluoro-7(piperazin-1-il)-1,4-diidro-4-oxo-chinolin-3-carbossilico
Chimica Farmaceutica e Tossicologica
48
Ciprofloxacina: storia
• E’ uno dei più importanti termini della serie per
ampiezza di spettro e potenza d'azione, insieme alla
fleroxacina.
• E’ più potente della norfloxacina.
• E’ attivo contro microrganismi resistenti agli antibiotici
beta-lattamici e amminoglucosidici.
• Ha largo spettro contro G(-) e G(+)
• Usato nel trattamento di infezioni del tratto urinario e del
tratto respiratorio superiore.
• Per renderlo più facilmente somministrabile viene
somministrato come cloridrato (idrosolubile) o come
lattato (i.v. nelle infezioni gravi).
Chimica Farmaceutica e Tossicologica
49
Ciprofloxacina: sintesi chimica
O
O
F
Cl
+
CO2Et
Cl
Cl
CO2Et
F
1) Mg(OEt)2
2) p TsOH
CO2Et
HC(OEt)3
Cl
Cl
O
F
Cl
O
CO2Et
Cl
NH2
OEt
F
CO2Et
Cl
Cl
O
F
Cl
NaH
NH
O
CO2Et
N
F
-
CO2H
1) OH
2) HN
N
NH
N
HN
Chimica Farmaceutica e Tossicologica
Pagina 50
Relazione struttura attività
SITO DI LEGAME AL
DNA
5
6
SITO DI LEGAME
ALL’ENZIMA
4
3
7
SITO DI LEGAME
ALL’ENZIMA
2
8
1
DOMINIO DI
AUTOASSEMBLAGGIO
Chimica Farmaceutica e Tossicologica
51
Relazione struttura-attività
•
•
•
•
Posizione 1: questa posizione è coinvolta nell’assemblaggio di due o più
molecole di farmaco. Un sostituente ciclopropilico è considerato in questa
posizione la modificazione che esalta di più la potenza, seguita dal
sostituente 2,4-difluorofenile. Altri sostituenti possono abbassare la
capacità della molecola di legarsi alla tasca dell’enzima e quindi la
potenza.
L’isomero S della ofloxacina (levofloxacina), anche se presenta una
potenza minore della molecola col gruppo ciclopropilico, grazie all’anello
che connette le posizioni 1 e 8 e crea una struttura triciclica, è un’utile
alternativa.
Posizione 2: questa posizione è molto vicino al sito di legame per la DNA
girasi o la topoisomerasi IV, così si pensa che ogni gruppo voluminoso
inibisce l’accesso al sito di legame e diminuisce l’attività. Solo uno zolfo
incorporato in un piccolo anello può rimpiazzare l’idrogeno nella posizione
R2.
Posizione 2-3: La riduzione del doppio legame in 2-3 elimina l’attività
Chimica Farmaceutica e Tossicologica
52
Relazione struttura-attività
•
•
•
Posizioni 3 e 4: queste due posizioni sul nucleo chinolonico sono
considerate critiche per il legame al DNA e ancora non ci sono sostituzioni
utili per questa posizione. Essenziali per l’attività antimicrobica sono i
gruppi 3-carbossilico e 4-carbonilico. Sono tollerati esteri della porzione
carbossilica per fare profarmaci
Posizione 5: i sostituenti in questa posizione sembrano avere la capacità
di alterare la configurazione sterica planare della molecola. Aggiunta di
gruppi di piccola grandezza come gruppi metilici, idrossilici, o amminici
possono aumentare in modo marcato l’attività in vitro. Alogenuri e gruppi
metossilici tendono a diminuire l’attività.
Posizione 6: l’addizione di un atomo di fluoro ha molto migliorato l’attività
antimicrobica dei primi agenti antibatterici chinolonici. Nuovi chinoloni
idrogenati in posizione 6 stanno dando promettenti sviluppi. Mettendo in
posizione 6 un gruppo amminico, la potenza delle molecole ottenute
dipende dai sostituenti nelle posizioni 7 e 8.
Chimica Farmaceutica e Tossicologica
53
Relazione struttura-attività
•
•
•
•
Posizione 7: questa posizione è considerata quella che direttamente agisce
con la DNA girasi o con la topoisomerasi IV. I sostituenti ottimali in questa
posizione sono gruppi che contengono, come minimo, eterocicli di 5 o 6
membri contenenti azoto, come gruppi ammonopirrolidinici (che aumentano
l’attività verso batteri gram-positivi) e piperazinici (che aumentano l’attività
verso batteri gram-negativi).
Si è osservato recentemente che un volume maggiore nella posizione R7
(Moxifloxacina) aumenta l’attività nei confronti degli anaerobi e conferisce
protezione dalle proteine del batterio che mandano fuori il farmaco,
diminuendo la resistenza batterica.
L’inserimento di gruppi piperazinici hanno allargato lo spettro di azione,
tuttavia anche l’affinità per il recettore GABA viene aumentata contribuendo
ad aumentare gli effetti sul CNS, che pero’ possono essere diminuiti
inserendo un metile o un etile silla piperazina o con gruppi molto ingombranti
su N1.
La sustituzione sull’anello piperazinico sposta l’escrezione dai reni al fegato
estendendo l’emivita e producendo chinoloni che sono utili per pazienti con
diminuite funzionalità renali.
Chimica Farmaceutica e Tossicologica
54
Relazione struttura-attività
•
•
•
•
•
Posizione 8: questa posizione influenza, come la posizione 5, la
configurazione sterica della molecola chinolonica e i cambi apportati
alterano l’accesso del chinolone alla tasca dell’enzima o ai siti di legame
sul DNA.
E’ stato osservato che specifici cambi in questa posizione alterano il
bersaglio dei fluorochinoloni. Infatti un idrogeno, come nella ciprofloxacina,
o anche un anello fuso, come nell’ofloxacina e nella levofloxacina, porta ad
una elevata attività nei confronti dell’enzima topoisomerasi IV, e ad
un’attività clinicamente poco utile nei confronti della DNA girasi.
La stereochimica del metile sull’anello fuso e’ importante, l’enantiomero S
e più attivo di 10 volte dell’R. Tuttavia il derivato metilenico e’ ancora più
attivo.
Un alogeno come F o Cl, migliora l’attività nei confronti degli organismi
anaerobi e sposta l’attività nei confronti della DNA girasi, riducendo
l’azione anti-topoisomerasica.
L’aggiunta di gruppi metossilici (aumento fotostabilità) e la sostituzione del
C con un N (aumento della biodisponibilità) migliora l’attività ed esalta la
potenza sia contro la girasi che contro la topoisomerasi.
Chimica Farmaceutica e Tossicologica
55
Relazione struttura-attività:
sostituenti ottimali
R1
5
6
4
3
1
2
7
8
NH 2
R5
CH 3
N
R7
N
H 3C
1
R8
Chimica Farmaceutica e Tossicologica
H3C
N
N
O
56
Caratteristiche chimico-fisiche dei chinoloni
• I chinoloni tendono a chelare gli ioni metallici polivalenti (Ca, Mg,
Al, Fe). I complessi che si formano sono scarsamente solubili e il
composto perde quindi di efficacia.
• L’assunzione di antiacidi, ematinici e prodotti caseari subito dopo la
somministrazione di chinoloni e’ quindi da evitare.
• Cu++ > Co ++ > Ni ++ > Zn ++ > Mn ++ > Mg ++ > Ca ++ > Ba
++
C H
2 5
M
+
O
N
O
O
O
O
O
N
M
O
O
O
C2H5
N
Chimica Farmaceutica e Tossicologica
57
Caratteristiche chimico-fisiche dei chinoloni
• Data l'elevata componente idrofobica, in genere sono
poco solubili in acqua.
• Data la presenza del gruppo carbossilico, sono solubili
in alcali.
• Provocano ipersensibilità alla luce solare.
Chimica Farmaceutica e Tossicologica
58
Caratteristiche chimico-fisiche dei chinoloni
Equilibrio acido-base nei chinoloni
O
H
O
O
H
O
N
C2 H 5
Chimica Farmaceutica e Tossicologica
O
O
N+
C2 H 5
59
Effetti collaterali dei Chinoloni
•
•
•
•
I fluorochinoloni finora commercializzati ed usati estensivamente sono farmaci ben tollerati e poco tossici. Gli
effetti collaterali che essi determinano sono di lieve entità anche se frequenti, e sono per lo più intolleranza
gastrointestinale.
Per la loro struttura chimica possono interagire con ioni metallici come Fe, Al, Ca, Mg, e possono interferire con
la farmacocinetica di altri farmaci che vengono metabolizzati dal citocromo P-450 perché i derivati con un gruppo
ciclopropilico in posizione R1 bloccano questo enzima.
Altre reazioni avverse sono: azione proconvulsivante negli epilettici, azione su SNC (allucinazioni, insonnia
mediante interferenza con il recettore del GABA), diarrea, vomito e dolori addominali. Inoltre interagiscono con
le xantine.
Sono inoltre potenzialmente rischiosi nel primo trimestre di gravidanza per possibilità di instaurarsi di acidosi
metabolica ed anemia emolitica.
•
L’unico difetto di tutti i chinoloni è la potenziale pericolosità di impiego in età pediatrica, a causa della loro
concentrazione nelle cartilagini delle ossa in accrescimento dove sono causa di artropatie.
•
Effetti collaterali gravi ma rari sono la tossicità renale, con cristalluria e nefrite interstiziale, la tossicità cardiaca,
e la epatotossicità legata a molecole come la temafloxacina e la trovafloxacina
•
Lomefloxacina, sparfloxacina, ofloxacina e trovafloxacina causano fotosensibilizzazione.
Chimica Farmaceutica e Tossicologica
Pagina 60
Metabolismo
Chimica Farmaceutica e Tossicologica
61
Metabolismo
Conversione in vivo della Prulifloxacina in Ulifloxacina
O
F
H
CO2H
Me
O
O
Me
N
N
S
O
O
H2O
N
N
O
Paraoxonasi
N
-
O
F
O
Me
Prulifloxacina
O
gruppo (5-metil-2-oxo-1,3-diossolen-4-il)metilico
F
CO2H
O
+
+
N
N
HN
S
CO2
O
F
Me
Ulifloxacina
Chimica Farmaceutica e Tossicologica
Pagina 62
CONCLUSIONI
• I chinoloni sono una classe di antibatterici di sintesi di nuova
generazione. Agiscono sulle topoisomerasi di tipo II e hanno un
meccanismo d’azione complesso perché interagiscono allo stesso
tempo con il DNA. Lo spettro d’azione è tra i più ampli e
l’insorgenza di resistenza non è ancora molto alta. Molte molecole
di questa classe sono usate per infezioni anche gravi delle vie
urinarie, dell’apparato respiratorio, dei tessuti molli, per le infezioni
polmonari acquisite in comunità.
• Alcune delle molecole più recenti pur avendo un spettro d’azione
ancora più esteso di quelle precedenti non sono entrate nell’uso
clinico per i gravi effetti collaterali che possono causare. Gli studi
futuri sono tesi ad sintetizzare molecole nuove che possano
interagire sempre meglio con i bersagli molecolari e che possano
avere caratteristiche farmacocinetiche e tossicologiche ottimali.
Chimica Farmaceutica e Tossicologica
63
Inibitori della sub-unità B della girasi
Chimica Farmaceutica e Tossicologica
64
Novobiocina
• Prodotto naturale, isolato da Streptomyces niveus, S.
spheroides, S. griseofulvus ed altri.
• E’ un derivato cumarinico, formato da tre unità:
– una unità cumarinica centrale (acido novobiocinico: 3-amino4,7-diidrossi-8-metil-cumarina)
– una unità glucidica (3-O-carbamoil-4-metilnovobiosio)
– un derivato dell'acido benzoico [acido 4-idrossi-3-(3'-metil-2'buten-1'-il)-benzoico].
• Ha diversi nomi: streptonivicina, albomicina, biotexina,
cardelmicina, cathocina, griseoflavina, inamicina,
vulcamicina.
Chimica Farmaceutica e Tossicologica
65
Struttura novobiocina
OH
H
N
CH3
4
O
O
H3CO
con anidride
Viene
O
O
CH3
1
OH
O
CONH2
Facilmente
OH
O
CH3
novobiocina
idrolizzabile con acidi diluiti al legame glucosidico
e idrolizzabile selettivamente al legame amidico
acetica. In soluzione acquosa alcalina si ha inattivazione.
usata come sale sodico.
Chimica Farmaceutica e Tossicologica
66
Proprietà novobiocina
• Manifesta proprietà batteriostatiche o battericide a
seconda della concentrazione.
• E’ attiva, soprattutto in associazione con tetraciclina,
contro batteri Gram(+), H. influenzae e Neisseria.
• Usata in passato nel trattamento delle infezioni da
stafilococchi resistenti.
• A causa degli effetti tossici elevati (discrasia ematica e
danni epatici), oggi il suo uso è limitato ad alcune
infezioni antibiotico-resistenti.
• N. B. Ha effetto sinergico con i chinoloni.
Chimica Farmaceutica e Tossicologica
67
Vinilogia
OH
H
N
CH3
4
O
O
H3CO
OH
CH3
1
O
OH
CONH2
O
O
O
CH3
novobiocina
N. B. Il nucleo 4-idrossicumarinico puo’ essere
considerato come vinilogo di un carbossile.
Chimica Farmaceutica e Tossicologica
68



![mutazioni genetiche [al DNA] effetti evolutivi [fetali] effetti tardivi](http://s1.studylibit.com/store/data/004205334_1-d8ada56ee9f5184276979f04a9a248a9-300x300.png)





![(Microsoft PowerPoint - PCR.ppt [modalit\340 compatibilit\340])](http://s1.studylibit.com/store/data/001402582_1-53c8daabdc15032b8943ee23f0a14a13-300x300.png)