Struttura cristallina
è una disposizione
ordinata a lungo
raggio degli atomi
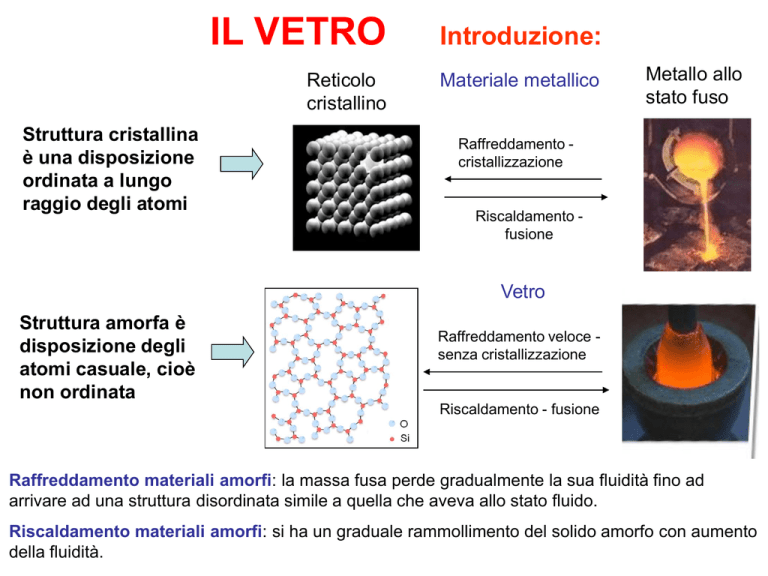
IL VETRO
Introduzione:
Reticolo
cristallino
Materiale metallico
Metallo allo
stato fuso
Raffreddamento cristallizzazione
Riscaldamento fusione
Vetro
Struttura amorfa è
disposizione degli
atomi casuale, cioè
non ordinata
Raffreddamento veloce senza cristallizzazione
Riscaldamento - fusione
Raffreddamento materiali amorfi: la massa fusa perde gradualmente la sua fluidità fino ad
arrivare ad una struttura disordinata simile a quella che aveva allo stato fluido.
Riscaldamento materiali amorfi: si ha un graduale rammollimento del solido amorfo con aumento
della fluidità.
IL VETRO
Il vetro è un materiale ceramico (prodotto da materiali inorganici mediante
riscaldamento ad elevate temperature), tuttavia si distingue dagli altri materiali
ceramici in quanto i suoi componenti vengono portati a fusione e raffreddati ad una
velocità tale da non consentire la cristallizzazione. Per questo il vetro ha una
struttura non cristallina o amorfa. La trasparenza dei vetri dipende proprio dalla
struttura totalmente amorfa.
I più comuni sono a base di silice amorfa
Temperatura di transizione vetrosa
Volume
specifico
(m3/Kg)
liquido
liquido
sottoraffreddato
solido
vetroso
Contrazio
ne dovuta
al
raffredda
mento
solido
Solido cristallino
cristall
ino
Tg1
Tm
T ( C)
Se si riduce la velocità di raffreddamento, il
passaggio da liquido a solido vetroso avviene
a Tg più basse (curva g2), e si ottiene un
vetro più denso di quello raffreddato più
velocemente (g1).
Andamento del volume specifico (inverso
della densità 1/ρ = Volume/Massa = v) in
funzione della temperatura per un materiale
cristallino e per un materiale amorfo. Un
liquido che, solidificando, forma un solido
cristallino (es. metallo puro) cristallizzerà al
suo punto di fusione (Tm) con una
diminuzione significativa del volume
specifico. Al contrario, un liquido che
raffreddandosi forma un vetro
(raffreddamento sufficientemente rapido),
non cristallizza, ma segue la linea continua,
ovvero la viscosità del liquido aumenta e fa
diminuire gradualmente il volume specifico.
La transizione da liquido (sottoraffreddato) a
solido vetroso è graduale e avviene in un
intervallo ristretto di temperatura (intervallo
di transizione vetrosa) nel quale la pendenza
della curva si riduce notevolmente. Il punto di
intersezione delle due tangenti alla curva
definisce la temperatura di transizione
vetrosa.
Composizione chimica e struttura del vetro
Le materie prime per la fabbricazione del vetro si possono distinguere:
Formatori (vetrificanti) sostanze che
possono assumere struttura vetrosa
come:
• silice (SiO2, in genere sotto forma di
sabbia);
• anidride borica (B2O3);
• allumina (Al2O3), che però può
formare strutture vetrose solo insieme
alla silice (ossidi intermedi).
Modificatori (o fondenti) vengono aggiunti
ai vetrificanti per diminuire la viscosità, in
modo che possano essere lavorati più
facilmente e per diminuire la temperatura
di rammollimento:
• ossidi di metalli alcalini (Na2O o K2O);
• ossidi di metalli alcalino-terrosi (CaO);
Si possono aggiungere anche altri componenti con finalità diverse: stabilizzazanti,
coloranti, opacizzanti, affinanti ecc.
I vetri comuni sono costituiti per circa il 75% da silice con aggiunta di fondenti per
migliorarne la lavorabilità e altre sostanze per ottenere proprietà specifiche.
IL VETRO
La silice SiO2 può solidificare: (a) struttura cristallina (la cristobalite); (b)
struttura amorfa (il vetro di silice). In ogni caso l’unità elementare ripetitiva è
sempre il tetraedro SiO44-.
Struttura cristallina dotata di anelli esagonali
Ordinamento a
lungo raggio
da Glass - Mechanics and Technology,
E. Le Bourhis, Wiley VCH, 2008.
Reticolo disordinato
IL VETRO
Le strutture cristallina (a) e amorfa (b) del vetro schematizzate sul piano.
da Glass - Mechanics and Technology,
E. Le Bourhis, Wiley VCH, 2008.
IL VETRO
Nel vetro silicatico è conservata l’unità
strutturale tetraedrica SiO44-, mentre è perso
l’ordine sulla lungo raggio. Nel tetraedro lo
ione Si4+ è legato con legame ionicocovalente a quattro atomi di ossigeno,
quindi ogni atomo di ossigeno è comune a
due tetraedri (ossigeni pontanti).
Gli atomi di ossigeno degli ossidi
fondenti (es.: Na2O o CaO) entrano nel
reticolo della silice nei punti di unione
dei tetraedri e lo rompono generando
atomi di ossigeno che sono collegati ad
un solo silicio (non pontanti). Gli ioni
Na+ e Ca2+ non entrano nel reticolo ma
rimangono negli interstizi come ioni
metallici legati ionicamente (bilanciano
gli elettroni liberi degli ossigeni non
pontanti).
Ossidi modificatori
La struttura del vetro di silice in presenza di ossidi modificatori (ossidi di
metalli alcalini): aumenta il numero di ossigeni nel reticolo, dunque alcuni non
sono pontanti
struttura più aperta rispetto al vetro di silice pura e
temperatura di lavorazione più bassa, ma minore rigidezza e maggiore
coefficiente di espansione termica.
Per ogni Na2O si formano 2
ossigeni non pontanti e due
ioni Na+ andranno a disporsi
negli interstizi del reticolo. Gli
ioni Na+ bilanciano le cariche
negative degli ossigeni non
pontanti.
da Glass - Mechanics and Technology,
E. Le Bourhis, Wiley VCH, 2008.
Ossidi intermedi
Altri ossidi come l’ossido di boro (B2O3) o di alluminio (Al2O3), se aggiunti ad un
vetro silico-sodico, funzionano come ossidi formatori di reticolo: infatti come SiO2
formano gruppi tetraedrici con boro o alluminio al centro (AlO4- e BO44-)
ogni
B3+ o Al3+ si lega a 4 ossigeni non pontanti
si riduce il numero di ossigeni non
pontanti. Poichè la valenza dell’Al e del B è +3, mentre per i tetraedri sarebbe
necessaria la valenza +4, le cariche negative libere vengono bilanciate dai cationi
degli ossidi modificatori (es: Na+).
O2- Non Pont.
Si4+
O2-
Na+
Al3+
Principali tipi di vetro
• Vetri di silice: sono costituiti solo da silice; hanno il coefficiente di dilatazione più
basso di tutti, per cui ha un’elevata resistenza agli shock termici e un’altissima
resistenza agli agenti chimici. Possono essere utilizzati fino a 1000 C infatti trovano
applicazione nelle apparecchiature da laboratorio. Il loro limite è che sono difficili da
fondere e lavorare, e quindi sono costosi.
•Vetri sodico-calcici: sono i più comuni (finestre e bottiglie); contengono un elevato
quantitativo di modificatori che ne aumenta la lavorabilità. Ma hanno una temperatura
di rammollimento bassa, che ne limita le applicazioni sopra i 300 C, e un alto
coefficiente di dilatazione termica, che li rende poco resistenti agli shock termici.
• Vetri al borosilicato: sono i Pyrex; hanno buona resistenza chimica e agli shock
termici (basso coefficiente di dilatazione termica). Per attrezzature di laboratorio e
stoviglieria resistente al calore.
• Vetri al piombo: si ottengono sostituendo l’Na2O e il CaO con PbO. Il catione Pb2+,
di solito modificatore, può prendere parte al reticolo facendo da ponte fra due atomi
di ossigeno. Il contenuto di piombo può arrivare anche al 58% in peso (vetri ad alto
Pb). Hanno temperatura di rammollimento più bassa quindi sono più facilmente
lavorabili e formabili (ma più costosi). Inoltre hanno un elevato indice di rifrazione che
li rende brillanti (cristalleria e schermi per radiazioni).
I VETRI PIU’ COMUNI
Composizione dei principali tipi di vetro (% in peso)
Applicazioni
Vetro da finestre
Vetro da bottiglie
bulbi per lampadine
I vetri allumino-silicati
Applicazioni
vetreria per uso diretto su fiamma o piastra elettrica, finestre in
aeroplani e in veicoli spaziali, ecc
Il vetro di silice
Applicazioni: strumenti ottici, industrie e laboratori chimici, materiali
elettrici isolanti per forni, elementi elettrici riscaldanti, ecc
Il vetro è un materiale a comportamento
elastico:
- segue la legge di Hooke (E ≈ 70 GPa)
- è soggetto a frattura fragile che inizia in
corrispondenza di microcricche .
Altre proprietà
- Isolante termico ed elettrico
- resistente in diversi ambienti corrosivi
- materiale isotropo (struttura amorfa)
Durabilità del vetro: fenomeni di fatica statica
La resistenza meccanica di un vetro, soggetto ad uno sforzo superiore ad un certo
valore, diminuisce nel tempo a causa di un fenomeno chiamato fatica statica. La
rottura del manufatto in vetro può avvenire anche dopo tempi molto lunghi di
applicazione del carico. La rottura avviene per corrosione sotto sforzo (o
tensocorrosione) provocato dalla diffusione del vapor d’acqua contenuto nell’aria
(umidità) verso l’apice delle microcricche presenti nel vetro.
-L’allungamento dei legami Si-O-Si all’apice della
microcricca rendono questi legami più reattivi nei
confronti dell’acqua. Ciascuna molecola d’acqua,
rompendo il legame fra due tetraedri contigui, dà
origine a due terminazioni SiOH:
- Si-O-Si + H2O
2SiOH
- Il risultato di questa reazione è un’allungamento
della microcricca.
- L’attacco procede a velocità sempre maggiore fino a
rottura di schianto.
- Il fenomeno procede più velocemente alle alte
temperature e in presenza di una maggior umidità.
Durabilità del vetro: resistenza chimica
La resistenza chimica del vetro nei confronti degli agenti atmosferici e della
maggior parte dei reagenti chimici è in genere eccellente.
L’acido fluoridrico HF attacca rapidamente il reticolo silicico dei vetri formando
fluoruri (SiF4 è un gas: SiO2 + 4 HF → SiF4 + 2H2O) del silicio a causa della
maggiore elettronegativià del fluoro rispetto all’ossigeno.
L’attacco di altri acidi avviene secondo uno
scambio tra gli ioni H+ e gli ioni Na+ (o K+). Di
conseguenza si forma uno strato superficiale
totalmente privo di ioni alcalini e l’attacco può
proseguire solo se altri di questi ioni migrano verso
la superficie. La velocità dell’attacco, quindi,
dipende dalla diffusione di tali ioni. L’introduzione di
ioni alcalino terrosi (Ca2+, Mg2+, Ba2+) porta ad un
forte aumento della stabilità chimica perché
formano legami più forti e riducono la mobilità degli Fotografia al microscopio elettronico a
scansione di una superficie di vetro
ioni Na+ e K+, costituendo un ostacolo alla loro
danneggiata.
diffusione.
Vetri di elevata resistenza chimica (neutri) si possono ottenere riducendo al
minimo il contenuto di alcali e introducendo come formatore di reticolo B2O3
(vetro borosilicato).
Durabilità del vetro: resistenza chimica
Il vetro comune resiste meno bene in presenza di soluzioni alcaline (pH > 7),
infatti gli ossidrili OH- reagiscono con il reticolo silicico spezzandone i ponti di
ossigeno:
≡Si-O-Si- + OH- → -Si-O- + HO-Si≡
Il vetro resiste ancora meno a tale attacco se contiene un’alta percentuale di
ossigeni non pontanti, inoltre l’attacco procede più velocemente all’aumentare
dell’alcalinità (soprattutto se pH > 9) e al crescere della temperatura.
L’attacco dell’acqua pura su un vetro avviene inizialmente per meccanismo di
scambio (tra H+ e ioni Na+ o K+) (I stadio della corrosione), successivamente ,
poiché il pH dell’acqua aumenta per diminuzione degli ioni H+, l’attacco diventa di
tipo alcalino (cioè a causa degli OH-). Il rapporto superficie di attacco/volume della
soluzione è molto importante: infatti se un grande volume d’acqua è in contatto
con una superficie vetrosa la concentrazione ossidrilica rimane relativamente
bassa e quindi è necessario un tempo maggiore per far crescere il pH al di sopra
di 8,5 e dar luogo al II stadio della corrosione, d’altra parte un sottile film di
condensa sulla superficie vetrosa provoca un rapido innalzamento del pH.
La pioggia provoca una situazione dinamica sulla superficie del vetro che
difficilmente consente il raggiungimento del II stadio della corrosione, il fenomeno
corrosivo è trascurabile e limitato alla lisciviazione degli ioni alcalini nelle
immediate vicinanze della superficie vetrosa.
Proprietà termiche
In assenza di elettroni liberi (materiale isolante) la conducibilità termica è dovuta
alle vibrazioni termiche del reticolo che permettono ai fononi di propagarsi dalle
zone più calde a quelle più fredde. Essendo i vetri solidi amorfi sono cattivi
conduttori di calore, perché in essi il cammino libero medio dei fononi è molto
breve (incontrano ostacoli alla loro propagazione e vengono diffusi). Sono
quindi degli isolanti termici oltre che elettrici. Tuttavia, la trasmissione di calore
attraverso il vetro avviene anche per irraggiamento (luce solare).
Il coefficiente di dilatazione termica lineare per un vetro di silice è molto piccolo
e vale circa 0,55 x 10-6 C-1. L’aggiunta di modificatori al vetro di silice fa
aumentare il coefficiente di dilatazione termica lineare, poiché questi rompono
dei legami covalenti e quindi indeboliscono la struttura. Il coefficiente di
espansione termica di un vetro sodico-calcico è di 9,1 x 10-6 C-1.
Essendo il vetro un cattivo conduttore di calore, uno sbalzo termico provocherà
in esso delle tensioni di segno opposto, fra la superficie e l’interno, tanto
maggiori quanto maggiore è il suo coefficiente di dilatazione termica. Se tali
tensioni superano la resistenza meccanica del vetro esso si rompe, se invece il
vetro le sopporta tenderanno a scomparire all’annullarsi del gradiente termico
tra superficie e interno del vetro.
Resistenza agli sbalzi termici (Shock Termico)
Per resistenza agli sbalzi termici s’intende la massima temperatura di
partenza a cui è possibile immergere un vetro in acqua a 0 C senza
frattura. Essa vale circa 50 C per un vetro sodico-calcico, 150 C per i
borosilicati e 1000 C per il vetro di silice.
Gli sbalzi termici producono degli sforzi di trazione sulla superficie del vetro.
Alle alte temperature (es. 50 C) il vetro si dilata, immergendolo
velocemente in acqua a 0 C le superfici del vetro si contraggono mettendo
in compressione la parte interna, ancora calda, mentre nelle superfici si
generano degli sforzi di trazione.
Sbalzi termici che producono un improvviso riscaldamento sono assai
meno pericolosi di un brusco raffreddamento, poiché nel primo caso sulle
superfici si generano degli sforzi di compressione.
CONDUCIBILITÀ ELETTRICA
Il vetro comune a temperatura ambiente è un buon isolante
elettrico: la resistività dei vetri varia da 1016 1022 ohm∙mm2/m.
La conducibilità elettrica è legata alla mobilità dei cationi negli
interstizi del reticolo che sono più debolmente legati.
Gli ioni mobili che danno luogo al flusso di corrente sono
sempre e solo gli ioni alcalini (Na+, K+…).
Anche la bassissima conducibilità del vetro di silice è dovuta
ai pochi ioni alcalini presenti come impurezze.
L’introduzione di modificatori bivalenti (Ca2+, Mg2+ , Pb2+ ,
Ba2+) porta ad un aumento della resistività, in quanto tali ioni,
più saldamente legati e poco mobili, occupano stabilmente
alcune cavità del reticolo, ostacolando il flusso degli ioni
alcalini.
Proprietà ottiche del vetro
La più importante proprietà ottica dei vetri è la trasparenza alla luce, cioè sono capaci di
trasmettere radiazioni del campo del visibile (da 0.4 m a 0.7 m). Tuttavia per essere
trasparente e incolore il vetro deve essere omogeneo (almeno entro una scala
confrontabile con la lunghezza d’onda della luce) e avere un basso assorbimento nei
confronti di tutte le lunghezze d’onda della luce.
Vetro eterogeneo:
• contiene delle particelle con diametro D2 circa uguale alla lunghezza d’onda della luce
• l’indice di rifrazione particelle diverso da quello della matrice
la luce non viene trasmessa ma viene diffusa, quindi il vetro non è trasparente ma opaco
(se le particelle sono poche e il vetro sottile diventa traslucido).
Proprietà ottiche del vetro
Il vetro eterogeneo è comunque trasparente se:
• particelle e matrice hanno gli stessi indici di rifrazione n1 = n2;
• le particelle hanno diametro molto minore rispetto la lunghezza d’onda della luce.
L’opacizzazione di un vetro si ottiene introducendo delle particelle finemente disperse.
Colorazione del vetro
I vetri vengono colorati incorporando ioni di metalli di transizione o di terre rare. Come:
Cu2+→ blu-verde; Co2+→ blu-violetto; Cr3+→ verde; Mn2+→ giallo; Mn3+→ rosso
La presenza di questi ioni dà luogo ad assorbimento selettivo nei confronti di
determinate lunghezze d’onda. La luce emessa dal vetro è una combinazione di
lunghezze d’onda trasmesse e riemesse che determinano il colore caratteristico.
Il tipo di colorazione dipende anche dalla composizione del vetro di partenza e
dall’ambiente in cui si produce (ambiente riducente o ossidante).
LA RIFRAZIONE
Fissata la lunghezza d’onda l’indice di rifrazione dipende
dalla composizione del vetro.
Maggiore è l’indice di rifrazione maggiore è la parte di
luce riflessa
Produzione del vetro
Macinazione dosaggio e miscelazione delle materie prime:
Le materie prime vengono pesate e quindi miscelate e inviate sotto forma di
granelli a una impastatrice rotativa. La granulometria è compresa tra 0,1 e
0,6 mm.
Fusione:
L’impasto viene fuso in forni a riverbero (riscaldati per irraggiamento).
L’impasto viene introdotto da una parte del forno (zona di fusione) e viene
prelevato dalla parte opposta (zona di lavoro). La fusione dell’impasto
avviene in genere a 1400-1500 C. Il prelievo della massa fusa viene fatto
poco al di sotto della superficie della massa fusa, per diminuire la presenza
di bolle e di impurezze.
Produzione del vetro:
ESEMPIO di FORNO (forno a rigenerazione per recupero del calore)
Produzione del vetro
Affinazione e omogenizzazione:
Per eliminare la presenza di bolle di gas e uniformare la composizione del
fuso (inconvenienti che determinerebbero la presenza di disomogeneità
ottiche), il vetro fuso viene portato a 1500 C e addizionato con degli affinanti
che durante il rimescolamento formano delle bolle di gas che portano via le
bollicine presenti nel fuso e, al tempo stesso, la massa fusa viene
omogenizzata (in alternativa si può insufflare del gas nella massa fusa).
Dopo l’affinazione e l’omogenizzazione, il vetro viene raffreddato fino alla
temperatura di formatura. Per evitare la cristallizzazione (possibile
soprattutto fra gli 800 e i 1100 C), si aggiungono delle piccole quantità di
ossidi (MgO, ZnO, BaO) che ostacolano la cristallizzazione, oppure si riduce
la velocità di cristallizzazione con piccole aggiunte di Al2O3 e MgO.
Produzione del vetro
Formatura:
La lavorazione all’uscita dal forno si effettua mediante procedimenti
differenti a seconda della forma e delle proprietà da impartire al manufatto.
I principali processi sono:
• processo di galleggiamento (o processo float): per lastre piane;
• processo di soffiatura: prodotti cavi (bottiglie o vasi artigianali);
• processo di pressatura: prodotti cavi (piatti, tazze, lenti ottiche), se i cambi
di sezione non sono troppo bruschi;
• processo di filatura: per fibre di vetro.
Processo Float (Pilkington, 1959)
1500 C forno
fusorio
1100 C
atmosfera di
azoto
Forno di ricottura
600 C
all’uscita dal
float
Si ottengono lastre perfettamente piane che non necessitano di
operazioni di lucidatura. Un nastro di vetro fuso esce dal forno e
viene fatto scorrere sulla superficie di un bagno di stagno fuso in
atmosfera chimicamente controllata. Si usa lo stagno per la sua
densità e il suo basso punto di fusione. All’uscita del bagno le
superfici sono abbastanza dure e il vetro viene fatto passare in un
forno di ricottura (Lehr) nel quale vengono rimossi gli sforzi residui.
TRATTAMENTI di FINITURA: Ricottura del vetro
Il raffreddamento rapido di un vetro dà origine a delle
tensioni permanenti tra strati adiacenti: queste tensioni se
elevate possono portare a frattura spontanea del materiale e
in ogni caso possono introdurre difetti nei vetri per ottica.
Una velocità di raffreddamento molto diversa da punto a
punto può produrre differenze nella densità fino allo 0.5% e
fino allo 0.6% nell’indice di rifrazione.
La rimozione delle tensioni interne introdotte nel vetro viene
compiuta con un trattamento termico detto ricottura, il cui
scopo è anche quello di assicurare una completa uniformità
delle proprietà fisiche in tutti i punti dell’oggetto in vetro. Ad
esempio nei vetri normali, tale trattamento si realizza
riscaldando fino a circa 600 C e raffreddando lentamente
fino a 450 C (al di sotto di questa temperatura si può
raffreddare più velocemente).
TEMPRA TERMICA (o fisica) DEL VETRO
Distribuzione parabolica
delle tensioni
E’ una tecnologia che serve per rafforzare il vetro. Consiste nel generare delle tensioni
permanenti di compressione nella superficie e di trazione all’interno. Il vetro viene
raffreddato mediante aria a partire da una temperatura superiore alla temperatura di
transizione vetrosa Tg ( per i vetri normali circa 600 C ) cioè prossima al punto di
rammollimento del vetro.
Nei primi istanti di tale operazione la superficie del vetro si raffredda più rapidamente
dell’interno e si contrae, mentre la parte interna resta calda e compensa, mediante
scorrimento viscoso, gli sforzi generati dalla variazione dimensionale delle superfici.
Successivamente, la parte interna si raffredda e, contraendosi, genera degli sforzi di
compressione sulle superfici, che sono già rigide (cioè sotto Tg). La parte interna, invece,
viene posta in trazione.
TEMPRA TERMICA DEL VETRO
La precompressione delle superfici fa aumentare, anche di 23 volte, la resistenza a trazione ottenuta da prova di flessione
e fa raddoppiare la resistenza agli shock termici. Inoltre il
vetro diventa più tenace e la frattura avviene con formazione
di moltissimi frammenti piccoli e non taglienti.
I vetri temprati non possono essere lavorati successivamente.
Il vetro temprato che si incontra più comunemente è quello
utilizzato per i finestrini laterali e posteriori delle automobili.
A volte viene utilizzato nelle cabine telefoniche.
I parabrezza moderni sono stratificati (vetri stratificati):
- Il vetro interno è temprato termicamente, quindi assorbe
una parte dell’energia dovuta all’urto, fratturandosi in
molti pezzi.
- Lo strato di polimero assorbe dell’altra energia e
protegge i passeggeri nell’abitacolo.
- Sono progettati per rompresi con sollecitazioni inferiori a
quelle che possono fratturare un cranio.
Modalità di frattura di un vetro
temprato
Tempra chimica del vetro
La tempra chimica ha il vantaggio di richiedere temperature meno elevate e quindi
non crea distorsioni nel vetro, si effettua immergendo il vetro in un bagno di sali
potassici a circa 350 C, in modo da realizzare uno scambio tra ioni Na+ della
superficie del vetro e ioni K+ provenienti dal bagno. Poiché gli ioni K+ hanno maggiori
dimensioni determinano una dilatazione dello strato superficiale del vetro. Poiché gli
strati più interni non si dilatano, generano degli sforzi di compressione negli strati
esterni. Richiede però tempi di trattamento maggiori. Si possono temprare vetri più
sottili e l’alterazione delle proprietà ottiche è minore.
Profilo degli sforzi residui a seguito della
tempra chimica del vetro
Gli sforzi di compressione indotti dalla tempra chimica sono più elevati rispetto a
quello della tempra fisica, ma lo spessore interessato è più sottile (dell’ordine di
100 µm invece di 1 mm). Si ha un miglioramento nella resistenza ai carichi
concentrati e all’abrasione, mentre il tipo di frattura grossolana che si verifica
non è adeguata all’utilizzo di questi vetri come vetri di sicurezza. Si utilizza per
lenti oftalmiche.
Vetri di sicurezza
Per migliorare le proprietà meccaniche del vetro, in particolare
ridurre la fragilità.
• Vetri armati: quando il vetro è ancora pastoso viene inserita una rete
metallica che ha la funzione di trattenere i frammenti del vetro nel caso di
urto impedendone la caduta. Ritardano anche la propagazione delle
fiamme durante un incendio.
• Vetri temprati: resistono maggiormente agli urti e si rompono in frammenti
molto piccoli e con spigoli arrotondati.
• Vetri stratificati: interponendo tra due lastre di vetro un materiale plastico
che fa da adesivo (Polivinilbutirrale PVB), il sandwich viene poi sottoposto
all’azione combinata di temperatura e pressione (in autoclave). Se
sollecitati violentemente a urto si rompono a raggiera e i frammenti
rimangono bloccati sullo scheletro di materiale plastico.
• Vetri corazzati: per applicazioni più critiche (vetri antiproiettile e
antisfondamento) si fanno molti strati di vetro alternati a fogli di materiale
plastico adesivo (vetri anche fino 4 cm di spessore).
LE VETROCERAMICHE
Sono vetri speciali nei quali mediante opportuno trattamento termico e
opportuni agenti nucleanti, si produce la crescita di piccoli cristalli. Le
vetroceramiche sono materiali policristallini. Essi per definizione devono
contenere una percentuale di materiale cristallino maggiore o uguale al
50% in volume (riduzione della fase amorfa a non più del 50%).
Produzione delle vetroceramiche
Il metodo più comune prevede la produzione della forma desiderata nello
stato vetroso. Segue il trattamento di ceramizzazione (devetrificazione
cioè la formazione di cristallo partendo da un vetro) che consiste in un
trattamento termico a due temperature diverse :
- a temperatura più bassa per la nucleazione dei cristalli
- a temperatura più elevata, per il loro accrescimento
Produzione delle vetroceramiche
LE VETROCERAMICHE
PROPRIETA’
• Hanno una tenacità, temperatura di rammollimento e resistenza chimica maggiori
rispetto ai vetri comuni.
• Facilità di produzione e di formatura anche in forme complesse, tipiche dei vetri.
• Porosità nulla.
• Il coefficiente di dilatazione può variare in un intervallo molto ampio, se è molto
basso conferisce al materiale un’elevata resistenza agli shock termici.
• Si possono produrre materiali da completamente trasparenti ad opachi. Mediante il
controllo della dimensione dei cristalli si ottengono dei vetroceramici trasparenti.
Un’importante famiglia di vetroceramiche è quella che fa riferimento a vetri
di partenza del tipo LAS e MAS (litio/magnesio allumino silicati).
La ceramizzazione viene fatta a temperature inferiori a 900 C e permette di
ottenere nanocristalli di quarzo (beta) (cristalli < 100 nm) e quindi un
materiale trasparente, dalla limitata dilatazione termica, con ottime proprietà
chimiche e meccaniche.
LE VETROCERAMICHE - APPLICAZIONI
Sono utilizzate nella produzione di:
Piani di cottura trasparenti, vasellame
Protesi dentarie
Specchi per telescopi, antenne satellitari e antenne radar
Pavimentazioni industriali
Sportello in
vetroceramica