Le cellule del sistema immunitario con
funzioni di riconoscimento
MHC = Major Histocompatibility Complex
Complesso Maggiore di Istocompatibilità
Uomo HLA; Topo H2
Complesso genico identificato perché coinvolto
nell’attecchimento dei trapianti d’organo (metà
degli anni ’30)
Negli anni ’60 e ’70 è stato scoperto che i geni di
questa regione sono di fondamentale importanza
per tutte le risposte immunitarie agli antigeni
proteici
I geni MHC controllano i trapianti di cute e le risposte
immunitarie ad Ag proteici
Esperimento di Zinkernagel e Doherty (1975)
Premio Nobel nel 1996
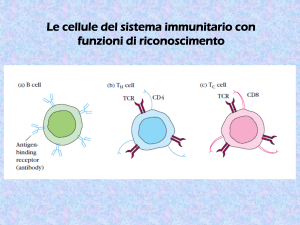
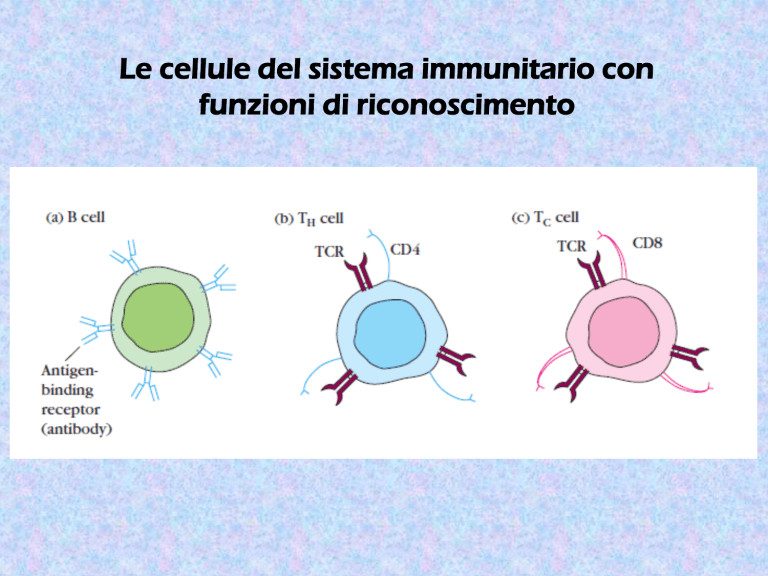
Il TCR non riconosce l’Ag isolato, ma il complesso
‘MHC-self + Ag’
Le principali molecole della regione
MHC responsabili del rigetto dei
trapianti sono state denominate
molecole MHC di classe I e di classe II
Qual è la loro funzione ?
Possono essere considerate delle navette
che portano sulla superficie cellulare i
peptidi derivati dalla proteolisi di proteine
sintetizzate dalla cellula (MHC I) o di
proteine che sono state internalizzate per
endocitosi (MHC II)
I peptidi portati in tal modo sulla superficie
cellulare vengono passati al vaglio dalle
cellule del sistema immunitario e, se
riconosciuti come ‘non self’, vengono
attivate funzioni effettrici specifiche
Molecole MHC II presentano
peptidi esogeni
Molecole MHC I presentano
peptidi endogeni
Molecola MHC di
classe I (ca. 340
aa) – Presente
sulla superficie di
tutte le cellule
nucleate
Il complesso
‘MHC I-peptide
non self’ viene
riconosciuto dai
linf TC CD8+
Molecola MHC di
classe II (2 catene,
ciascuna di 230-240
aa) – molecola di
superficie delle
cellule presentanti
l’Ag (APC) cioè di
cellule capaci di
compiere endocitosi
Il complesso ‘MHC IIpeptide non self’
viene riconosciuto
dai linf TH CD4+
Molecola MHC di classe I
Molecola MHC di classe II
Le molecole MHC presentano i peptidi ai linfociti T
(helper o citotossici)
Sinapsi immunologica al legame tra linf T e cellula target
partecipano varie molecole di adesione
I geni per le molecole MHC I e II
Rappresentazione semplificata della regione MHC in uomo e topo
Nell’uomo esistono 3 geni per le molecole MHC I (A, B e C) e 3 loci
per le molecole MHC II, ciascuno locus contiene almeno un gene per
la catena alfa e uno per la catena beta (DP, DQ e DR)
Loci MHCII
DP: 2 geni
alfa e 3
beta
DQ: 2 alfa
e 2 beta
DR: 1 alfa
e 4 beta
COMPLESSO HLA DELL’UOMO
Regione di ca. 4 Mb sul braccio corto del cromosoma 6, a densità genica molto
elevata: vi sono stati identificati centinaia di loci, 160 dei quali vengono
espressi; molti sono geni che codificano per proteine coinvolte nella risposta
immunitaria
Tutte le cellule nucleate
Tutte le cellule nucleate
espongono sulla loro
superficie molecole MHC I
Cellule APC
Le cellule APC (Antigen
Presenting Cell) espongono
sulla loro superficie sia
molecole MHC I che
molecole MHC II
I geni MHC di classe I e II sono i più polimorfici del
genoma umano
HLA A
HLA B
HLA C
varie centinaia di alleli
Per i geni di classe II il numero di alleli noti è inferiore,
ma essi presentano anche polimorfismo per numero di geni
Il numero di differenze tra alleli può essere molto
elevato (anche 20 aa)
Esiste anche polimorfismo per livelli di espressione e per
varianti di splicing
Espressione codominante
Individui eterozigoti hanno 6 diversi tipi di molecole MHC I e
10-20 diversi tipi di molecole MHCII
Nella regione MHC il tasso di
ricombinazione è molto basso, per cui
generalmente è trasmessa in blocco
(aplotipo HLA)
la probabilità di
identità tra
fratelli è del
25%, nel 25%
dei casi due
fratelli non
condivideranno
alcun allele HLA
e nel restante
50% si avrà la
condivisione di
un aplotipo
Trasmissione dell’aplotipo HLA – Eventi di
ricombinazione si verificano raramente
Genitori e figli condividono il 50% degli alleli
Qual è la ragione di questo
elevatissimo polimorfismo ?
Quali sono le caratteristiche dei peptidi che si legano alle
molecole MHC ?
MHC I legano peptidi di 8-11 aa (dimensione ottimale 9
aa), le due estremità del peptide hanno residui àncora
(conservati) che si legano con legami H a residui della tasca
La tasca è
chiusa ad
entrambe le
estremità
Sequenze di 4 peptidi eluiti dall’allele H-2Dd e di 3
peptidi eluiti dall’allele H-2Kd del topo
in azzurro i residui àncora
Molecole MHC II legano peptidi di 13-20 aa. Il legame
con i residui della tasca interessa solo 9 aa. (esistono
vari ‘registri di legame), la tasca è aperta ad entrambe le
estremità
Le differenze alleliche sono concentrate nei
domini alfa1 e alfa2 delle molecole di classe I
e nei domini alfa1 e beta1 delle molecole di
classe II, cioè nei domini che vanno a formare
la tasca di legame con il peptide
Molecole MHC (I e II) prodotte da alleli
diversi hanno la capacità di legare peptidi
diversi
Distribuzione della variabilità
allelica lungo le molecole MHC I
In rosso i residui che mostrano la maggiore variabilità allelica
L’elevato polimorfismo ha una spiegazione di
tipo evolutivo
Il grandissimo numero di alleli, oltre ad aumentare
la probabilità del singolo individuo di essere
eterozigote per i loci HLA, garantisce una grande
variabilità intra-popolazione individui con
aplotipi HLA diversi presenteranno peptidi diversi
Difficilmente potrà comparire un patogeno ‘non
presentabile’ da nessun individuo della
popolazione
L’elevato polimorfismo dei geni MHC fa sì
che il repertorio di presentazione di una
popolazione sia molto più elevato del
repertorio di presentazione dei singoli
individui
L’elevato polimorfismo garantisce la
sopravvivenza della popolazione nel suo
insieme (difficilmente un patogeno
evolverà in modo tale da risultare
‘impresentabile’ da tutti i membri della
popolazione)
Ciascun individuo ha pochi tipi di molecole
MHC (max 6 di classe I e 10-20 di classe II),
ma la capacità di presentazione di ogni
individuo è grande perché ciascuna
molecola MHC è in grado di presentare
molti peptidi differenti
Se un grande repertorio di
presentazione è una condizione
irrinunciabile per montare un’efficiente
risposta immunitaria perché nel corso
dell’evoluzione non si sono verificati
numerosi eventi di duplicazione e
diversificazione dei geni che codificano
per le molecole MHC (vedi ad es. i geni per i
Recettori Olfattivi, geni OR)?
Molte osservazioni sembrano indicare che una variabilità
intra-individuale molto elevata sia selezionata
negativamente
Nelle specie poliploidi di alcuni generi (es. Xenopus) i
geni MHC in surplus sono silenziati a differenza della
quasi totalità degli altri geni
Nell’uomo esistono 4 geni DRB funzionanti, ma non si
conosce nessun aplotipo che ne abbia più di due
Nello spinarello esiste un notevole polimorfismo per
numero dei geni delle catene beta dell’MHCII, gli
aplotipi più frequenti sono quelli con un numero
intermedio di geni. Inoltre sembra che femmine con
molti geni scelgano maschi con pochi geni
Molte osservazioni sembrano indicare che una variabilità
intra-individuale molto elevata sia selezionata
negativamente (2)
La scelta del partner è influenzata dal genotipo MHC,
e in generale viene scelto un partner con MHC diverso
dal proprio; questo non è vero quando il soggetto che
sceglie è eterozigote in molti loci MHC
I lavori che hanno studiato la scelta del partner in
relazione al genotipo MHC nell’uomo sono
contraddittori, ma potrebbero essere compatibili con
l’ipotesi che in realtà non si tenda ad avere prole con
grande variabilità intra-individuo ma con il ‘giusto’
livello di variabilità
Come mai il livello ottimale di variabilità intraindividuo non è settato su valori molto elevati ?
è necessario tenere presente che:
I linfociti T nel corso della loro maturazione
nel timo vanno incontro ad eventi di
selezione
Perché avvenga il legame tra il TCR e il
complesso (MHC,peptide) è necessario che i
due interattori si incontrino
Il legame TCR-complesso (MHC,peptide) non
è del tipo tutto o nulla
I dettagli dei processi selettivi non sono noti
ma essenzialmente consistono in eventi di:
Selezione positiva vengono ‘salvati’ i
linfociti T il cui TCR reagisce
debolmente con il complesso (MHCpeptide self)
Selezione negativa vengono
eliminati i linfociti T il cui TCR reagisce
ad alta affinità con il complesso (MHCpeptide self)
DESTINO DEI LINFOCITI T A SEGUITO DELLA SELEZIONE CHE
AVVIENE NEL TIMO
Linfociti T che non esprimono TCR morte cellulare
Linfociti T che NON riconoscono il complesso (MHC-peptide
self) morte cellulare (è probabile che questi linfociti non
sarebbero in grado di legarsi ad alta affinità al complesso
MHC-peptide, nemmeno se il peptide fosse non self)
Linfociti T che riconoscono ad alta affinità complessi (MHCpeptide self) morte cellulare
Linfociti T che riconoscono a bassa affinità complessi
(MHC-peptidi self) proseguono la loro maturazione fino
a diventare linfociti T circolanti CD4 o CD8 positivi
Un’elevata variabilità intra-individuo avrebbe i seguenti
effetti
A) Aumento del numero di linfociti selezionati
positivamente
B) Aumento del numero di linfociti selezionati
negativamente
Se B) > A) si avrebbe una diminuzione del repertorio di
linfociti
Inoltre all’aumentare del numero di peptidi presentati corrisponderebbe
una diminuzione del numero di volte in cui ciascun peptide (densità)
viene presentato e quindi un calo della probabilità di incontro tra
linfocita T con TCR ‘giusto’ e complesso MHC-peptide
La regione MHC mostra bassi livelli di ricombinazione,
possibili motivi
Bassa ricombinazione reale
Selezione a favore di particolari aplotipi
Il polimorfismo è recente
LE MOLECOLE MHC HANNO UN RUOLO IN FUNZIONI
DIVERSE DA QUELLE DEL SISTEMA IMMUNITARIO ?
1975 Thomas prima formulazione
dell’ipotesi che i geni MHC siano coinvolti nel
riconoscimento del singolo individuo
Partendo dall’osservazione che i geni MHC preservano
l’integrità dell’organismo attraverso il riconoscimento
dell’identità cellulare, ha ipotizzato che questi stessi
geni potessero conferire a ciascun individuo un odore
caratteristico.
1978 Boyse prime prove sperimentali
dell’influenza dell’MHC in alcuni
comportamenti sociali nel topo
Studi sulle preferenze di topi maschi nella scelta di
partner con MHC diversi. Triplette 1 maschio +
2 femmine
Tra la fine degli anni ’80 e i primi anni ’90 conferme
sperimentali anche rispetto alle preferenze
femminili
Conferme in questa direzione sono state ottenute anche su
popolazioni di topi più vicine alle popolazioni naturali (cioè su
popolazioni non inbred) anche se tuttora mancano prove definitive
su popolazioni selvatiche
Poiché la preferenza era per partner MHC dissimili,
questi studi indicano che:
• Esistono dei meccanismi di riconoscimento del
genotipo MHC;
• Gli schemi di accoppiamento tendono a favorire la
nascita di prole eterozigote per i geni MHC e ad
evitare l’inbreeding (fratello e sorella o genitorifigli sono mediamente più simili di individui non
correlati)
Quindi accoppiamenti tra individui diversi
per la regione MHC avranno l’effetto di
diminuire il rischio di malattie sia genetiche che
infettive
Genetiche evitare l’accoppiamento tra
consanguinei significa diminuire la probabilità
di omozigosi per discesa (anche quella per alleli
dannosi recessivi)
Infettive individui eterozigoti per geni
MHC hanno un repertorio di presentazione più
elevato
Le preferenze nella scelta del partner sono fortemente
influenzate da esperienze vissute nei primi mesi di vita
Esempio: topi maschi B6 H-2(b) preferiscono femmine
B6 H-2(k) rispetto a femmine B6 H-2(b), ma se vengono
allevati da femmine B6 H-2(k) questa scelta viene
completamente capovolta
La regione MHC è coinvolta anche nel riconoscimento
genitore-figlio in questo caso si ha un’attrazione tra MHC
simili
In che modo le molecole MHC possono influenzare
l’odore di un individuo?
Forse attraverso lo spettro di peptidi da esse
presentati alleli diversi presentano peptidi diversi,
peptidi presentati dallo stesso allele MHC I hanno
delle caratteristiche in comune (i residui àncora)
HLA e malattie – Molte malattie mostrano una forte
associazione con particolari alleli o aplotipi HLA
Malattie infettive
Malattie infiammatorie
Malattie autoimmuni
La diversa suscettibilità a malattie infettive può essere
dovuta a:
diversa capacità di presentazione dei peptidi del
patogeno
particolari molecole MHC possono funzionare da
recettori per virus o tossine batteriche
HLA e malattie – Principali malattie autoimmuni (multifattoriali =
genetica + ambiente) legate a particolari alleli HLA
Particolari alleli dei geni MHC sono anche
predisponenti a malattie allergiche: reazioni
eccessive contro Ag deboli che generalmente
non provocano una risposta immune
Sono mediate dalle IgE
Le manifestazioni patologiche sono mediate
dal rilascio di istamina
Questa associazione è causale
o casuale ?