Regulation of circulation during
exercise: Neural and mechanical
controls.
Antonio Cevese
Lo scopo del cuore e del sistema
circolatorio
durante
l’esercizio
è
di
trasportare la quantità di ossigeno richiesta
dai muscoli che lavorano, aumentando la
gittata cardiaca in maniera strettamente (e
linearmente)
correlata
al
consumo
d’ossigeno del corpo, che a sua volta
rispecchia
in
genere
l’aumento
del
metabolismo muscolare
Il principale meccanismo che produce
l’aumento della fuoruscita di sangue dal
cuore è una rapida caduta delle resistenze
nelle arteriole del muscolo scheletrico;
questo tuttavia non basta, perché il cuore
deve essere adeguatamente riempito per
produrre
e
mantenere
una
gittata
aumentata, mentre le resistenze periferiche
totali devono essere regolate per impedire
cadute della pressione arteriosa
Tutto ciò è reso possibile dal concomitante
aumento del flusso di sangue dalle vene
centrali all’atrio destro, che è innanzitutto
provocato da fattori meccanici, come
l’azione
di
pompa
delle
contrazioni
muscolari ritmiche e dall’aumento della
pressione negativa intratoracica nel corso
di inspirazioni profonde.
Ovviamente, oltre ai comandi nervosi
centrali ai muscoli attivi, la risposta
integrata all’esercizio comprende una vasta
gamma di reazioni nervose ed endocrine
che contribuiscono ad aumentare la
capacità gnenerale di compiere lavoro di
goni individuo
Non tutti i sistemi di controllo sono
indispensabili. Per esempio, il cuore può
perdere le proprie fibre nervose autonome
e rimanere in grado di assolvere al suo
ruolo e quindi di aumentare la gittata
sistolica durante l’esercizio.
In tutto il mondo, il numero di persone che
sopravvivono ad un trapianto cardiaco e
sono ancora in grado di svolgere una vita
abbastanza normale è cresciuto enormemente negli ultimi vent’anni: il cuore
trapiantato è denervato e, nella maggior
parte dei casi, non si reinnerva. Ciononostante, i cardiotrapiantati possono aumentare la loro gittata cardiaca in maniera
sufficiente a sostenere discrete quantità di
lavoro muscolare.
È peraltro vero che, anche dopo intensi
allenamenti aerobici, la loro performance
massimale non aumenta ai livelli degli atleti
d’élite; è stato, però, ripetutamente dimostrato che il fattore limitante non è la
capacità del cuore di aumentare la gittata
cardiaca, ma riguarda i muscoli ed è in
relazione alla malattia cronica che ha
portato al trapianto cardiaco.
Questo esempio è illuminante, perché dimostra
come
meccanismi
ausiliari
consentano
di
conservare una funzione perduta. Nel caso del
cuore trapiantato, il meccanismo di Starling fa si
che la gittata sistolica aumenti secondo le
necessità, mentre il nodo del seno, liberato dal
controllo nervoso autonomo, riesce ancora ad
aumentare la frequenza cardiaca, anche se più
lentamente, in risposta alle catecolamine circolanti, per sostenere la gittata cardiaca necessaria
Il primo fattore responsabile dell’adattamento
cardiovascolare all’inizio dell’esercizio è la caduta
delle resistenze arteriolari locali nei muscoli attivi.
Numerosi studi hanno dimostrato che già la
contrazione dei muscoli, a prescindere da fattori
metabolici, contribuisce ad aumentare il flusso di
sangue muscolare: dato che la contrazione
spinge il sangue fuori dai capillari, il gradiente
arterovenoso di pressione aumenta transitoriamente, facilitando il passaggio del sangue
dalle arteriole ai capillari.
È molto importante tenere presente che, mentre
il metabolismo muscolare aumenta all’improvviso, parallelamente allo sviluppo istantaneo di
forza, la funzione cardiocircolatoria, invece,
impiega un tempo reale a stabilizzarsi su nuovi
livelli più elevati.
La lista dei possibili fattori vasodilatatori è lunga
e certamente incompleta, e pertanto non
conviene rivederla. Vale la pena però di ricordare
che recentemente alla lista si è aggiunto l’ossido
nitrico (NO). È infatti evidente che il principale
stimolo fisiologico che aumenta l’attività dell’enzima e-NOS (responsabile della produzione
fisiologica di NO), cioè la forza di taglio (shear
stress) è strettamente correlato con l’aumento
del flusso e della velocità del sangue.
È interessante riportare una vecchia osservazione
secondo cui la combinazione di diversi fattori
produce effetti vasodilatatori sempre maggiori di
ciascun fattore preso da solo
Quando i muscoli cominciano a contrarsi, fattori
locali fanno cadere le resistenze vascolari,
riducendo in parte l’opposizione alla fuoruscita
del sangue dal cuore.
Questo può avere due conseguenze dirette: a
fronte di un postcarico ridotto il cuore può
aumentare la gittata; d’altra parte, la caduta
delle resistenza di per se abbas-sa la pressione
arteriosa, che è la forza che spinge il sangue
attraverso le arteriole, nei capil-lari di tutti i
tessuti.
Se l’aumento della gittata fosse compensato in
maniera esatta dalla riduzione delle resistenze, la
pressione non cambierebbe; è tuttavia ben
difficile che ciò possa avvenire senza un selettivo
sistema di controllo, che impedisce cambiamenti
pressori eccessivi.
Durante un esercizio massimale la gittata
cardiaca può aumentare da 4 a 6 volte, arrivando
a superare i 30 litri al minuto (sono stati
ipotizzati anche aumenti maggiori, ma è quasi
impossibile ottenere buone misure della gittata
cardiaca nell’uomo durante l’esercizio intenso), in
atleti di endurance ben allenati. A questo si arriva
aumentando sia la gittata sistolica sia la
frequenza cardiaca. Rimane comunque la
necessità di riempire il cuore con un’adeguata
quantità di sangue refluo dalla circolazione
sistemica e da quella polmonare.
Per comprendere di quanto possa aumentare il
ritorno venoso, bisogna ricordare che il volume di
sangue circolante può essere suddiviso fra due
componenti, peraltro non distinguibili:
Il volume di riempimento ed il volume in eccesso
La prima componente è quel volume di sangue
(tessuto liquido) che riempie completamente le
cavità del sistema circolatorio, compreso il cuore,
senza distenderne le pareti elastiche
La seconda parte è il volume di sangue spinto a
forza dentro i tubi, che si devono distendere per
accoglierlo, e così facendo generano pressione.
La pressione di distensione è stata denominata
“pressione circolatoria media”.
Se si fermasse all’improvviso il cuore e si
pompasse rapidamente il sangue dalle arterie alle
vene, la pressione scenderebbe rapidamente
nelle arterie e crescerebbe più lentamente nelle
vene; quando la pressione arteriosa fosse uguale
a quella venosa, e ogni gradiente di pressione
fosse annullato, si potrebbe misurare la pressione
circolatoria media.
Il valore generalmente attribuito alla pressione
circolatoria media in condizioni basali è pari a 7
mmHg.
È pertanto chiaro che ogni evento che modifica la
pressione circolatoria media influenza il ritorno
venoso, e quindi la gittata cardiaca, se il cuore
assolve bene alla sua funzione di pompa.
A sua volta, la pressione circolatoria media
dipende dal volume totale di sangue, dal volume
di riempimento, e dalla distensibilità (compliance)
dei vasi.
Il volume di sangue è mantenuto relativamente
costante da vari fattori neuroumorali, fra cui
ricordiamo il rene e i tessuti emopoietici.
Il controllo del volume di sangue si manifesta
lentamente, giorno dopo giorno, anche se
bisogna ricordare che il volume totale può ridursi
più o meno rapidamente a seguito di emorragia
Il rapporto fra il volume totale di sangue e
quello di riempimento, così come la
distensibilità dei vasi, sono determinati da
fattori strutturali, in particolare quelli che
accompagnano l’accrescimento corporeo.
Possono però cambiare anche rapidamente,
e sono sotto controllo neuroumorale.
Il volume totale del sangue si ripartisce in
modo ineguale fra i compartimenti arterioso
e venoso. Questo vale tanto di più per il
volume in eccesso, che è contenuto quasi
esclusivamente
nelle
vene
(rapporto
arterie/vene = 1:20).
Il nostro corpo a riposo contiene una grossa
riserva di sangue, distribuita nelle vene: essa
può essere spostata rapidamente quando è
necessario.
Quando la respirazione diventa forzata, il sangue è risucchiato attivamente verso l’atrio
destro, mentre viene pompato fuori dalle vene
addominali dalla contrazione dei muscoli della
parete che rinforza l’espirazione. La maggior
parte del sangue venoso (fino all’80%) è però
contenuta nelle piccole vene e nelle venule postcapillari, anche in quelle dei muscoli, che sono
direttamente esposte all’azione di spremitura da
parte delle fibre che si contraggono.
Tutti i vasi sono controllati da una scarica
simpatica vasocostrittrice (tono vasocostrittore),
che può essere modulata, in primo luogo, dai
riflessi cardiovascolari e, in maniera più lenta, da
molecole vasoattive circolanti, fra cui le
catecolamine.
L’effetto più scontato di ogni aumento dell’attività
simpatica è l’aumento delle resistenze periferiche
totali, che in genere provoca aumenti della
pressione arteriosa, o ne impedisce la caduta.
Anche nelle vene si manifesta un aumento
dell’attività contrattile della muscolatura liscia,
che ha importanti effetti sulla capacitanza e sulla
compliance venosa
Le conseguenze dell’aumento del tono venoso si
manifestano sia come riduzione del volume di
riempimento (una proporzione maggiore del
volume totale diventa volume in eccesso), sia
come riduzione della compliance.
Quindi, è facilitato il ritorno venoso, a causa
dell’aumento del volume di sangue messo
effettivamente in circolazione e di una maggiore
pressione venosa.
Il contributo delle vene dei vari distretti circolatori
all’aumento del ritorno venoso dovuto alla
stimolazione simpatica non è distribuito uniformemente: è prevalente nell’area splancnica e
minimo nei muscoli.
È stata introdotta l’idea di un “cuore periferico”:
al cuore centrale spetterebbe il compito di
spingere il sangue attraverso le arterie e le
arteriole; al cuore periferico il compito di
innescare la pompa centrale in maniera continua
(ed adeguata) con la maggior quantità di sangue
necessaria a far fronte a richieste metaboliche
aumentate durante la contrazione dei muscoli
scheletrici.
L’ondata di ritorno venoso che deve riempire
bene l’atrio destro per sostenere l’aumento
della gittata cardiaca è normalmente del tutto
adeguata.
Soltanto soggetti con una grave insufficienza
delle valvole venose, incompetenza autonomica
o importanti riduzioni del volume di sangue
circolante (di qualunque origine) possono
andare incontro ad un’insufficienza acuta di
questo meccanismo, con conseguente brusca
ipotensione,
annebbiamento
della
vista,
vertigini, fino allo svenimento.
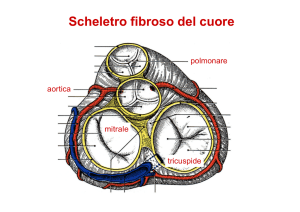
LA LEGGE DEL CUORE DI STARLING
Entro certi limiti, il cuore è in grado di
aumentare
la
gittata
in
funzione
del
riempimento diastolico, come affermato dalla
legge del cuore di Starling. Tuttavia, la reale
importanza di questo principio per il funzionamento normale del cuore nell’esercizio fisico
è stata messa in discussione, poiché si è visto
che le dimensioni diastoliche dei ventricoli
normalmente non aumentano nell’esercizio,
anzi possono persino diminuire per sforzi
lievi/moderati.
Quello che rimane cruciale è il ruolo del
meccanismo intrinseco nel mantenimento della
parità funzionale fra le metà destra e sinistra
della pompa cardiaca.
Quando si pratica un esercizio in posizione
supina, la gittata sistolica non aumenta affatto,
perché il volume pompato a riposo è già quasi
come quello che si raggiunge quando si inizia
un esercizio in piedi.
Il meccanismo che fa aumentare rapidamente
la gittata sistolica in posizione eretta è legato
alla necessità di compensare gli effetti della
gravità sul ritorno venoso e non aggiunge un
volume funzionale alla dinamica cardiocircolatoria durante l’esercizio.
IL SISTEMA NERVOSO AUTONOMO
Il sistema nervoso autonomo è evidentemente
coinvolto negli adattamenti cardiovascolari
all’esercizio. La risposta tipica consiste in un
aumento generalizzato dell’attività simpatica
sul cuore e sui vasi ed in una caduta del tono
parasimpatico sul cuore.
Questi aggiustamenti funzionali sono innanzitutto provocati dal comando centrale che
coordina le contrazioni dei muscoli dello
scheletro e riguarda anche il sistema nervoso
autonomo, sia in maniera diretta, sia indirettamente, attraverso un resetting dei sistemi di
controllo riflessi.
Il controllo riflesso del sistema circolatorio è
affidato a due ordini principali di recettori:
quelli che si trovano nei compartimenti a bassa
pressione (vene centrali, atri e vene polmonari)
e quelli che si trovano nei compartimenti ad
alta pressione (sostanzialmente, i barocettori
aortici e carotidei).
I recettori a bassa pressione sono da
considerare più precisamente recettori di
volume (si tratta comunque di meccanocettori,
stimolati dalla deformazione delle pareti),
proprio per la distribuzione disuguale del
volume di sangue di cui si è parlato. Il loro
ruolo consiste nell’aumentare la frequenza
cardiaca quando aumenta il ritorno venoso (il
ben noto riflesso di Bainbridge), ma anche
quando il cuore non ce la fa a smaltire tutto il
sangue che riceve, come accade nell’insufficienza cardiaca. La loro importanza fisiologica
è però soprattutto legata al controllo neuroumorale del volume totale di sangue.
Il volume di sangue è controllato dai fattori che
regolano l’emopoiesi e dal rene, che controlla
l’equilibrio fra assunzione e perdita di acqua e
soluti.
L’equilibrio ionico è sotto il controllo dell’aldosterone (ormone della corteccia surrenale) la
cui produzione, a sua volta, è stimolata dall’angiotensina (asse renina-angiotensina-aldosterone): presiede alla determinazione del riassorbimento facoltativo di soluti (e acqua)
L’assorbimento di acqua è regolato a livello dei
dotti collettori dall’ormone antidiuretico (ADH –
vasopressina).
L’ADH è prodotto nei nuclei sopraottico e
paraventricolare dell’ipotalamo e accumulato
nella neuroipofisi, che lo immette in circolo,
secondo i seguenti stimoli:
l’osmolarità del plasma è avvertita dalle cellule
dell’ipotalamo, dette anche “osmocettori”:
quando questa aumenta, normalmente per
eccessiva perdita di acqua, aumenta la
liberazione di ADH e il riassorbimento renale
L’attività dei nuclei sopraottico e paraventricolare è regolata anche in via riflessa da
fibre afferenti dai meccanocettori atriali
(recettori di volume). Quando l’atrio si distende
perché aumenta il ritorno venoso, la produzione
di ADH è inibita e aumenta l’escrezione di urina
diluita.
Il ritorno venoso può aumentare per mancanza
dell’accelerazione di gravità (voli spaziali,
decubito supino) o per eccessivo accumulo di
acqua.
Gli atri si distendono anche quando la contrattilità ventricolare è ridotta
LA VARIABILE CONTROLLATA
La variabile del sistema cardiovascolare
classicamente definita come controllata è la
pressione arteriosa media. Numerosi sitemi di
controllo contribuiscono al mantenimento della
pressione
arteriosa
media
su
valori
sostanzialmente stabili nel corso di una
giornata, mediante meccanismi che agiscono in
tempi rapidi, intermedi e lunghi. I meccanismi
rapidi sono quelli legati al controllo nervoso
autonomo.
Il problema, tuttora parzialmente irrisolto, è se
I barocettori continuino a funzionare durante
l’esercizio, e se sì, se il loro funzionamento si
modifichi e in quale misura.
A prima vista, si direbbe che essi sono fuori
gioco,
perché
nell’esercizio
dinamico
la
pressione arteriosa effettivamente cambia: la
diastolica tende a diminuire o rimane costante,
mentre la sistolica aumenta, raggiungendo
anche
valori
elevati
(180-200
mmHg).
Pertanto,
la
pressione
media
aumenta.
Contemporaneamente, aumenta anche la
frequenza cardiaca, raggiungendo i più elevati
valori possibili per ciascun individuo.
Evntuali rapide variazioni della pressione, però,
come quelle associate alle variazioni posturali,
rimangono efficacemente controllate: questo
indica che i barocettori continuano a regolare la
pressione, anche se su valori più elevati. È
quindi evidente che il set point dei recettori è
spostato in alto, probabilmente per effetto del
comando centrale: l’ambito operativo è
spostato a destra, ma il guadagno non cambia.
Ogni ricerca sui barocettori nell’uomo è
piuttosto difficile, perché per caratterizzare un
sistema di controllo basato su un anello a
controreazione negativo (negative feedback
loop) in teoria sarebbe necessario aprire
l’anello, com’è stato fatto tante volte in animali
da esperimento. Gli esprimenti classici, eseguiti
soprattutto su cani, si avvalevano dell’isolamento chirurgico delle biforcazioni carotideee,
per poter cambiare la pressione a livello dei
seni,
indipendentemente
dalla
pressione
arteriosa. Questo ovviamente non sarebbe
possibile nell’uomo.
Nell’uomo, Il riflesso barocettivo è stato
studiato in condizioni di anello chiuso,
analizzando i rapporti fra piccole variazioni
della pressione e del periodo cardiaco (inverso
della frequenza). Le oscillazioni spontanee di
queste variabili si possono studiare calcolando
ripetutamente la regressione lineare fra le due
variabili per pochi cicli cardiaci consecutivi,
quando cambiano nella stessa direzione, in
registrazioni di lunga durata. Si può anche
ricorrere all’analisi cross spettrale.
Si possono anche provocare rapide alterazioni
della pressione arteriosa somministrando
alternativamente un farmaco vasoconstrittore
(fenilefrina) ed uno vasodilatatore (nitroprussiato di sodio), mentre si misura il periodo
cardiaco e calcolando ancora la pendenza
della retta di regressione fra le due variabili.
Si studia il riflesso barocettivo anche in
condizioni di anello aperto applicando pressioni negative e/o positive ad un collare rigido
munito di una cuffia gonfiabile e sistemato
intorno al collo.
Non sembra che l’allenamento aerobico migliori la
funzione barocettiva, dato che si sono spesso
misurate riduzioni del guadagno del riflesso dopo
l’allenamento. È tuttavia necessario attendere il
risultato di ulteriori studi sull’argomento.
La branca efferente del baroriflesso coinvolge
entrambe le sezioni del sistema nervoso
autonomo. Considerato che il primo passo
dell’adattamento cardiovascolare all’esercizio è
rappresentato dalla caduta delle resistenze
periferiche, dovuta ad una serie di fattori locali,
potrebbe verificarsi un’ampia riduzione della
pressione arteriosa, che scarica i barocettori ed
innesca la risposta riflessa.
La scarica vagale sul cuore si riduce o cessa del
tutto, provocando un rapido aumento della
frequenza cardiaca. Con un breve ritardo,
compaiono gli effetti della stimolazione simpatica,
che aumentano ulteriormente la frequenza e
fanno crescere il tono della muscolatura liscia
vasale. Il tono arteriolare aumenta ed è
responsabile di una vasocostrizione generalizzata,
che non risparmia i vasi dei muscoli scheletrici.
Nei muscoli attivi, gli effetti vasodilatatori locali
annullano completamente la vasocostrizione
nervosa. Quest’osservazione ha fatto introdurre il
termine “simpaticolisi funzionale”, che indica la
perdita di ogni effetto vasocostrittore delle fibre
simpatiche sui muscoli attivi.
Quest’idea non è stata confermata da risultati di
ricerche successive che hanno dimostrato che la
stimolazione
del
simpatico,
come
quella
provocata dallo scarico dei barocettori, in effetti
riduce la conduttanza vascolare nei muscoli
durante l’esercizio. In tutti gli altri tessuti,
compresi in muscoli non impegnati nell’esercizio,
la resistenza aumenta e il flusso ematico è più o
meno drasticamente ridotto. Pertanto, durante
l’esercizio, ha luogo una profonda ridistribuzione
della gittata cardiaca.
Le variazioni delle scariche nervose autonome
provocano cambiamenti globali della funzione
cardiaca. Di particolare importanza l’effetto
inotropo positivo, perché la funzione di pompa
del cuore dev’essere adeguatamente sostenuta,
per permettergli di trasferire alle arterie il grosso
vlume di sangue che ritorna dalle vene centrali
durante l’esercizio e di mantenere la gittata
cardiaca richiesta.
A questo si associa un ben documentato effetto
lusitropo, che accelera e migliora il rilasciamento
del cuore, assicurando un’efficace fase di
riempimento rapido all’inizio della diastole.
Si accorcia anche la durata della sistole. La
combinazione di questi fattori migliora la
capacità del cuore sia di accogliere il ritorno
venoso aumentato, sia di trasferire più
sangue ossigenato alle arterie.
RIDISTRIBUZIONE DELLA GITTATA CARDIACA
Mentre il flusso di sangue dei muscoli attivi deve
aumentare, e pure quello delle arterie coronarie,
che servono le accresciute richieste metaboliche
del cuore, esso è drasticamente ridotto nell’area
splancnica. Altri importanti distretti vascolari
seguono le proprie regole.
La cute è vasocostretta, ma la circolazione
cutanea può aumentare per esigenze di
termoregolazione, per cui l’esercizio al caldo
umido può condurre ad un palese conflitto,
sottraendo una parte crescente della gittata
cardiaca ai muscoli attivi, che tuttavia non
possono ridurre il proprio flusso.
La termoregolazione può venirne compromessa e
si va incontro al colpo di calore.
Al contrario, la circolazione cerebrale rimane
tipicamente autoregolata.
I reni tendono ad autoregolare il proprio flusso:
la vasocostrizione renale contribuisce infatti
all’aumento
generalizzato
delle
resistenze
vascolari dei tessuti non muscolari, ma in
maniera non correlata al carico di lavoro.
L’argomento più controverso è la partecipazione
delle arteriole muscolari alla vasocostrizione
simpatica.
Il flusso ematico è scarso nei muscoli a riposo,
ma si può verificare un’ulteriore vasocostrizione,
che contribuisce a mantenere alta la pressione
arteriosa. Nei muscoli nei quali il livello del
metabolismo è elevato a causa dell’attività
contrattile ritmica, invece, il flusso non può
ridursi. È però stato dimostrato che anche i
muscoli attivi ricevono segnali vasocostrittori dal
simpatico, che limitano la grande vasodilatazione
provocata da fattori locali.
IL METABORIFLESSO
Se si blocca il deflusso venoso da un gruppo di
muscoli in contrazione (per es. un braccio), le
tipiche risposte cardiovascolari durano di più del
periodo di contrazione e rimangono segni
d’intensa stimolazione simpatica finché l’ostacolo
al deflusso venoso non viene rimosso. Questo
fatto è stato interpretato come la prova
dell’esistenza di un cosiddetto “metaboriflesso”.
Sono state riconosciute fibre di piccolo diametro
dei gruppi III e IV: le prime deriverebbero da
meccanocettori e le seconde da chemiocettori,
sebbene esista un notevole polimorfismo
Gli stimoli meccanici sono lo stiramento e la
pressione (all’interno del tessuto). Per quanto
riguarda gli stimoli chimici, si è pensato ad una
varietà di ioni o molecole generalmente rilasciati
dai muscoli in contrazione, specialmente se in
condizioni di ischemia. Però i più ovvi, come gli
idrogenioni e l’acido lattico, sono stati scartati,
mentre spesso è stato riconosciuto un ruolo
strategico agli ioni K+.
La stimolazione di fibre afferenti dai muscoli
inibisce il controllo vagale del cuore, aumentando
la tachicardia, e attiva fibre efferenti simpatiche.
L’effetto sarebbe un aumento delle resistenze
periferiche totali e della pressione. È stato
proposto che questo riflesso possa limitare
l’effetto dei vasodilatatori locali che incrementano
la conduttanza vascolare nel muscolo scheletrico
attivo.
Questo riflesso meccano-metabolico è in qualche
modo alterato nei pazienti con insufficienza
cardiaca e potrebbe essere responsabile di una
stimolazione simpatica eccessiva, con ipertensione e ridotta tolleranza allo sforzo in questi
pazienti.