Risonanza Magnetica Nucleare (NMR)
Questa tecnica analitica è da ormai 50
anni la più utilizzata nel campo della
caratterizzazione della struttura di
sostanze organiche; ha buone
potenzialità anche in campo inorganico
Le caratteristiche tecniche dell’NMR ne
fanno però uno strumento da ricerca più
che da laboratorio, per quanto alcune
applicazioni siano entrate nella routine,
per esempio nell’ambito del controllo in
campo alimentare
La tecnica si basa sull’interazione tra atomi aventi numero di
spin non nullo posti in un campo magnetico, e una radiazione
elettromagnetica nel campo delle radiofrequenze
Spettroscopia NMR
interazione tra
la componente magnetica del
campo elettromagnetico associato ad una
radiazione incidente sul campione
ed
i nuclei magnetici
(1H, 13C, 15N, 31P) contenuti nel campione
immerso in un campo magnetico esterno
Tutti i nuclei hanno una massa e una carica. Quelli
che hanno il numero di massa oppure il numero
atomico, o entrambi dispari, posseggono un
momento angolare ossia uno “spin”.
La risonanza magnetica è un fenomeno
completamente differente dalla “teoria della
risonanza”.
Qualunque nucleo che possegga uno spin può essere
studiato con l’NMR.
Il nucleo dell’idrogeno 1H è quello che fornisce il
maggior numero di informazioni, mentre l’isotopo
più comune del del carbonio 12C non compare nello
spettro NMR perché non ha uno spin nucleare.
Lo spin nucleare
Lo spin è una proprietà fondamentale come la carica e la massa. Protoni,
elettroni e neutroni possiedono uno spin. Molti nuclei atomici si comportano
come delle particelle cariche che ruotano intorno al proprio asse. Il
momento angolare o momento di spin P che ne risulta è ovviamente
quantizzato.
P=
I ( I 1)
h 2
I= numero di spin valori=0, ½, 1, e
così via fino a 6.
P è un vettore orientato lungo
l’asse della rotazione, e il
numero di spin I è un indice
dell’intensità (o modulo) di
questo momento angolare.
Poiché il nucleo atomico è carico, e ogni carica in movimento genera un
campo magnetico, ogni nucleo dotato di spin si comporterà come un
piccolo magnete, cioè sarà dotato di un momento magnetico m. Il
momento magnetico m è proporzionale al momento di spin e ne ha la
stessa direzione: quindi il suo modulo non può variare, e può assumere
solo due possibili orientazioni per un nucleo con I = ½. La costante di
proporzionalità tra il momento magnetico m ed il momento angolare
nucleare P è detta costante giromagnetica
m=gP
m
g rapporto giromagnetico
+
+
mz = g Pz = m g
m
Nuclei e numeri di spin
Alcuni esempi di specie con numero di spin nullo o non nullo
sono riportate nella tabella seguente
Numero
di protoni
pari
dispari
dispari
pari
pari
pari
dispari
Numero
di
neutroni
pari
pari
pari
dispari
dispari
dispari
dispari
Numero
di Spin
0
1/2
3/2
1/2
3/2
5/2
1
Esempi
12C, 16O, 32S
1H, 19F, 31P
11B,35Cl, 79Br
13C
127I
17O
2H, 14N
NMRattivo
no
si
si
si
si
si
no
Come funziona uno spettrometro NMR?
Quando un composto contenente idrogeno è introdotto in un forte
campo magnetico ed è irradiato con una radiazione elettromagnetica,
i nuclei di idrogeno assorbono energia.
Naturalmente, come tutti i fenomeni che avvengono su scala
atomica, anche questo assorbimento è quantizzato e si verifica solo
quando la forza del campo magnetico e la frequenza della radiazione
non raggiungono determinati valori.
Gli spettrometri NMR sono in grado di misurare tale assorbimento.
Uno spettrometro è costituito da un magnete molto potente ed è in
grado di generare un campo di radiofrequenze mediante il passaggio
di corrente elettrica in una bobina avvolta intorno al campione.
Uno spettrometro NMR è formato
da alcuni componenti fondamentali:
un magnete, che deve produrre
un intenso ed uniforme campo
magnetico nel quale deve essere
posto il campione
un generatore di radiofrequenza
un ricevitore di radiofrequenza.
Schema di uno spettrometro NMR
Per ottenere lo spettro NMR si colloca il campione all’interno
dello strumento e lo si irradia con energia elettromagnetica di
frequenza costante: la grandezza che varia è l’intensità del
campo magnetico.
Quando il campo magnetico raggiunge l’intensità appropriata, i
nuclei entrano in risonanza (cioè assorbono energia). Questo
fenomeno genera una debole corrente elettrica che viene
amplificata e trasformata in un segnale su di un foglio di carta
calibrata.
Uno spettro NMR è dato dalla registrazione del voltaggio
indotto in funzione della variazione del campo magnetico.
L’area sotto il picco dipende dal numero totale di nuclei che
hanno compiuto il salto.
Magnet giving the currently highest field (18T, 800MHz, 1H resonance frequency)
Courtesy of Oxford Instruments Ltd.
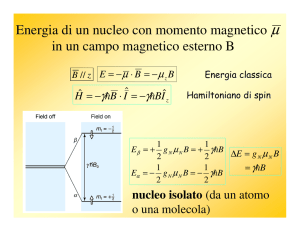
Effetto di un campo magnetico esterno (per I=1/2)
Nello stato fondamentale tutti gli spin nucleari sono disordinati e non ci sono
differenze di energia.
Applicando un forte campo magnetico esterno, gli spin si allineano con esso.
In questo stato c’è sempre un piccolo eccesso di nuclei allineati nella direzione
del campo applicato.
Livelli energetici
Il campo magnetico esterno (B0) crea una differenza di energia tra i
nuclei allineati nelle due direzioni: DE = hn0 (risonanza di spin).
L’intorno chimico influenza il
campo magnetico effettivo
presente su ogni nucleo, e
quindi anche la DE = hn0:
Beff = B0 + Blocale
Chemical shift
Gli spin nucleari, inoltre, interagiscono
magneticamente l’uno con l’altro:
Spin-spin coupling
Nonostante tutti i nuclei di
una certo tipo (per esempio
1H) siano esattamente identici,
essi risuonano a frequenze
leggermente diverse purchè si
trovino
in
intorni
chimici
differenti.
B= B0 (1-s)
Sotto l’influenza del
campo
magnetico
esterno
gli
elettroni
tendono ad assumere un
movimento rotatorio, e
ruotando generano essi
stessi
un
campo
magnetico.
Il campo magnetico generato si
oppone al campo magnetico
esterno nella zona centrale
dell’orbitale, mentre si somma
nella sua periferia. Poiché il
nucleo si trova al centro
dell’atomo, esso sarà sottoposto
ad
un
campo
magnetico
effettivo
minore
di
quello
applicato, è cioè schermato
dagli elettroni.
Misura del chemical shift
Dipende dal campo
n n TMS
6
10
n
100Hz
500Hz
6
10
106 1.66 ppm
60MHz
300MHz
Indipendente dalle condizioni
sperimentali
Perché il TMS?
dodici protoni equivalenti e molto schermati
solubile nella maggior parte dei solventi organici
facilmente allontanabile
-
Cl
C
-
Il principale fattore che dermina
il chemical shift di un protone è la
densità elettronica del relativo
idrogeno.
H
Elemento
elettronegativo
Cl
H3C
CH3
H3C
0.86
CH3F
Elemento X
F
Elettronegatività of X
4.0
3.5
3.1
2.8
2.5
2.1
1.8
4.26
3.40
3.05
2.68
2.16
0.23
0
Più
deschermati
O
CH3Br
CH3I
Cl
Br
I
CH4 (CH3)4Si
H
Si
TMS
Il potere deschermante
aumenta con
Cl
3.47
1.33
CH3Cl
H3C
Composto CH3X
Chemical shift
CH3OH
CH2
CHEMICAL SHIFTS (ppm)
R-CH3
R-CH2-R
R3CH
0.7 - 1.3
1.2 - 1.4
1.4 - 1.7
R-C=C-C-H
O
1.6 - 2.6
R-C-C-H
O
2.1 - 2.4
RO-C-C-H
O
2.1 - 2.5
HO-C-C-H
2.1 - 2.5
N C-C-H
2.1 - 3.0
R-C C-C-H
2.1 - 3.0
C-H
R-C C-H
2.3 - 2.7
1.7 - 2.7
R-N-C-H
2.2 - 2.9
R-S-C-H
2.0 - 3.0
I-C-H
2.0 - 4.0
Br-C-H
2.7 - 4.1
Cl-C-H
3.1 - 4.1
RO-C-H
3.2 - 3.8
HO-C-H
O
3.2 - 3.8
R-C-O-C-H
3.5 - 4.8
O2N-C-H
4.1 - 4.3
F-C-H
4.2 - 4.8
R-C=C-H
4.5 - 6.5
H
6.5 - 8.0
O
R-C-N-H
5.0 - 9.0
O
R-C-H
9.0 - 10.0
O
R-C-O-H
11.0 - 12.0
R-N-H 0.5 - 4.0 Ar-N-H 3.0 - 5.0
R-S-H
R-O-H 0.5 - 5.0 Ar-O-H 4.0 - 7.0 1.0 - 4.0
Per ottenere lo spettro NMR si può:
variare con continuità la frequenza della radiazione elettromagnetica e
misurare l’assorbimento per ogni frequenza (scansione della frequenza)
lasciare costante la frequenza della radiazione elettromagnetica e
variare con continuità il campo magnetico (scansione del campo):
all’aumentare del campo magnetico entreranno in risonanza protoni via via
più schermati, e si otterrà comunque uno spettro.
N
n1
RF a banda larga
Contiene un intervallo
di frequenze
(n1 ..... nn)
n2
O
CH2 C CH3
n3
S
Con un singolo impulso sono eccitati
simultaneamente tutti i protoni
Schema generale di un esperimento NMR
1. Il campione è posto in un campo magnetico B
2. L’invio di un impulso elettromagnetico perturba l’equilibrio
3. La precessione della magnetizzazione genera un segnale
elettrico noto come FID (Free Induction Decay)
4. Il FID è registrato, e quindi trasformato di Fourier, nel
dominio della frequenza: FID(t) → n ()
( rilassamento )
Ogni nucleo emette una radiazione alla propria
frequenza di risonanza, per cui quello che si
ottiene è una sovrapposizione di onde sinusoidali
a diverse frequenze.
spettro nel “dominio de tempo”
n1 + n2 + n3 + ......
tempo
Il complesso segnale del FID è trasformato nello spettro NMR
attraverso complesse operazioni matematiche
DOMINIO DEL TEMPO
Convertito in
FID
SEGNALE
COMPLESSO
DOMINIO DELLE FREQUENZE
SPETTRO NMR
FT-NMR
Un insieme di frequenze
che decadono nel tempo
n1 + n2 + n3 + ......
Frequenze individuali
Spettro NMR
Il FID è trasformato in un classico
spettro NMR
spettro nel “dominio delle fequenze”
Spettroscopia NMR
Permette di distinguere i diversi nuclei atomici
sulla base delle loro proprietà magnetiche mediate
dall’intorno chimico.
Permette di misurare distanze inter-protoniche.
Permette di misurare gli angoli diedri dei legami
covalenti.
L’altezza delle linee integrali è proporzionale al numero di H di ciascun picco
Linea
integrale
55 : 22 : 33
=
5:2:3
L’intensità di un segnale nello spettro NMR è proporzionale al
numero di protoni che lo genera.
La frequenza di risonanza di HA dipende dagli
stati di spin dei nuclei vicini
Allineato con B0
+1/2
50 % di
molecole
Opposto a Bo
-1/2
H
HA
H
HA
C
C
C
C
Bo
doppietto
50 % di
molecole
La distanza (= differenza di frequenza) tra i due segnali del doppietto
(di solito detti rami del doppietto) è detta costante di accopiamento ed
indicata col simbolo J.
Il chemical shift del protone che dà origine al doppietto è misurato al
centro del doppietto.
L’ accoppiamento spin-spin è dovuto alle interazioni tra i momenti
magnetici nucleari, che sono indipendenti dal campo magnetico
applicato B0 per cui le
costanti di accoppiamento J sono
indipendenti dal campo magnetico applicato e risultano uguali in
qualunque spettrometro.
Si misurano in Hz e non in ppm.
L’ aspetto dello
spettro varia al
variare del campo
dello spettrometro
60 MHz
200 MHz
600 MHz
Per prevedere la molteplicità
H
H
H
H
C
C
C
C
H
Due nuclei vicini
n+1 = 3
tripletto
H
Un nucleo vicino
n+1 = 2
doppietto
singletti
doppietti
tripletti
quartetti
quintetti
sestetti
septetti
X CH CH Y
CH3 CH
(x=y)
CH2 CH
X CH2 CH2 Y
(x=y)
CH3 CH2
CH3
CH
CH3
Intensità delle linee
del multipletto
1
1 1
1 2 1
1 3 3 1
1 4 6 4 1
1 5 10 10 5 1
1 6 15 20 15 6 1
1 7 21 35 35 21 7 1
singletto
doppietto
tripletto
quartetto
quintetto
sestetto
eptetto
ottetto
Br CH2CH3
O
CH3 C
H
H
CH3
C
CH3
+
N
O
O-
Costante di accoppiamento long-range.
Accoppiamento allilico (4J: CH-C=CH):
J 0-2 Hz
Accoppiamento omoallilico (5J: CH-C=C-CH):
J 0-2 Hz
Accoppiamenti meta e para in composti aromatici: Jmeta 1-3 Hz
Jpara 0-1 Hz
4J 0-7 Hz
Accoppiamento W:
H
H
C
C
H
C
per esempio:
H
HO
Molto spesso i protoni possono risuonare alla stessa frequenza perché si
trovano nello stesso intorno chimico, ossia perché sono equivalenti:
per simmetria
per rotazione libera
H
H
X
X
H
X
X
X
H
H
H
H
H
X
H
H
H
H
H
H
H
H
X
H
H
C
H
C
H
Y
NMR monodimensionale
FID = Free Induction Decay
La FT-NMR monodimensionale
rivela i chemical shift di tutti i
nuclei presenti nel campione
Altri esempi di spettri NMR-1H monodimensionali
Cellulasi (36 residui)
Etanolo
Advantages
• Can be performed in aqueous solutions
under in vivo conditions
• Does not rely on specific reporter groups or
artificially attached dyes
• Don’t need to crystallize the protein
• Large array of parameters can be extracted
from the resonance lines
Problems
• Overcrowded spectra
• Limited space available in spectrum
• Typical width of resonance line is larger for
a protein than a polypeptide so the peak
height is decreased (decreases sensitivity)
• Limited to small proteins (less than 150
residues)
The NMR spectrum of lysozyme at pH 4.0, 58ºC
H1 NMR spectrum of lysozyme
Gli spettri protonici e 13C sono grafici a due dimensioni che riportano il c. s in
funzione dell’intensità del segnale. Tuttavia li si definisce esperimenti
monodimensionali in quanto esiste una sola variabile indipendente
rappresentata dalla frequenza che deriva dall’ FT del FID. Nelle tecniche
monodimensionali classiche la sequenza degli eventi è la seguente:
Nelle tecniche bidimensionali si introduce, dopo l’impulso e prima
dell’acquisizione un periodo di evoluzione variabile t1. Ciascun FID sarà quindi
funzioni di due variabili di tempo t1 e t2
In pratica però i FID ottenuti sono sottoposti a due serie di trasformate di
FT nei due domini di tempo sfasate di 90°. Avremo quindi un esperimento in
due dimensioni n1 e n2
Esperimenti omonucleari
2D-COSY (1H-1H scalare)
HOHAHA (1H-1H scalare)
NOESY (1H-1H dipolare)
Esperimenti eteronucleri
HMQC (1H-13C diretta, 1J)
HMBC (1H-13C long-range, 2J, 3J)
Rappresentazione schematica di uno spettro NMR 2D di
due spin A e B fra loro interagenti
1
2
Rubinson and Rubinson. Contemporary Instrumental Analysis. Prentice Hall: New Jersey, 2000.
Structure Assignment
Intraresidual
coupling
Interresidual
coupling
Schema di una interazione “through-space” e del suo
relativo spettro 2D-NOESY
Esempio reale di spettro NOESY
Informazioni derivanti da spettri NMR NOESY
(a) Mediante spettri NOESY possono essere identificati i residui adiacenti nella
sequenza in una proteina.
(b) Gli spettri NOESY identificano anche gli atomi di H di residui non adiacenti
nella struttura primaria che interagiscono in regioni di struttura secondaria.
Struttura tridimensionale del dominio C-terminale della cellulasi
derivante dallo spettro bidimensionale visto precedentemente