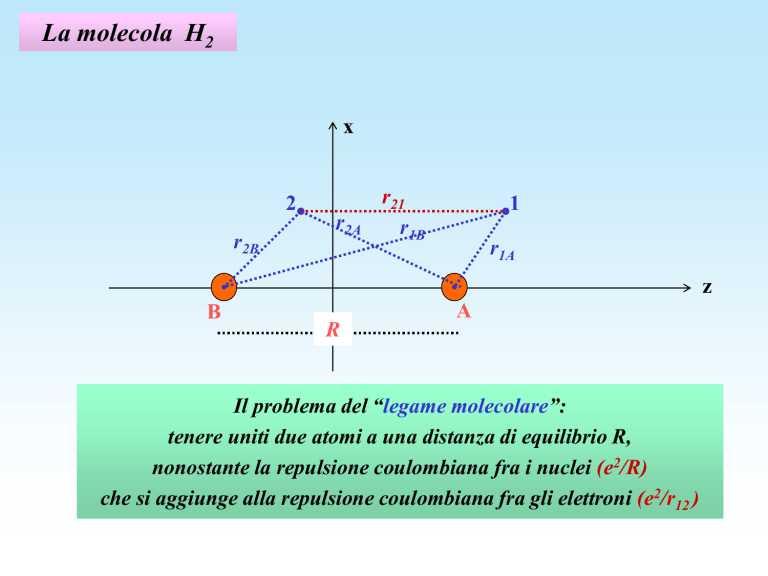
La molecola H2
x
2
r2B
r2A
r21
r1B
1
r1A
z
B
R
A
Il problema del “legame molecolare”:
tenere uniti due atomi a una distanza di equilibrio R,
nonostante la repulsione coulombiana fra i nuclei (e2/R)
che si aggiunge alla repulsione coulombiana fra gli elettroni (e2/r12 )
come si misurano
le dimensioni di una molecola
un problema analogo:
come misurare la distanza
fra i solchi di un CD dalle
“riflessioni” dei colori
R
i2
occhio
li3
d2
la differenza fra i cammini
sorgente
k
ld4
li4
ld2
ld3
h
li2
ld1
d12= li2 - li1 + ld2- ld1
interferenza costruttiva per
d12=
d34= li4 - li3 + ld4- ld3
interferenza costruttiva per
d34=
li1
a2
a2+p
a4
A
a4+p
in verde le distanze da misurare
l i 2 li1
h 2 a 22 h 2 a 2 p 2
calcolo del passo p fra i solchi
h 2 a 22 h 2 a 22 2a 2 p
sorgente
a 2 p
l i 2 l i 2 1
sen i 2 p
2
li 2
l d 2 l d1 sen d 2 p
inserendo i dati della figura
occhio
d2 45o
per il blu ( 450 nm):
d2 15o
d12= li2 - li1 + ld2- ld1
k
ld4
p |sen i2- sen d2| 0.3
p
k
i4 50o
i2 20o
li3
li4
ld2
ld3
h
li2
ld1
per il rosso ( 650 nm):
d34= li4 - li3 + ld4- ld3
a2
p |sen i4 - sen d4| 0.4
a2+p
a4
p
p 1,2 m
li1
A
a4+p
nel caso della molecola ...
d12= l2 - l1 R sen 2
l3
interferenza costruttiva per
d12= R sen 2
l4
R
sorgente
RÅ
l1
l2
Å
raggi X
2
rivelatore
l3
l4
l’3
l’4
R
l’2
l2
l1
l’1
tipico apparato
sperimentale
sorgente di
raggi X
campione da
esaminare
rivelatore
altre configurazioni
- asse della molecola non perpendicolare al fascio
d1
l1 = l + d1
l2 = l
R
l
l
d1 = R sin
fasci di elettroni o di neutroni
- energia cinetica di un elettrone con lunghezza d’onda 10-10 m :
2c
Ek in
2
2
2mc
2mc
( pc ) 2
7
( ck ) 2
12.56 10 eVm
10
10
m
2
1
2mc2
2
1
2
10
eV
106 eV
- per un neutrone Ekin 2000 volte di meno 50 meV (energie “termiche”)
x
La molecola H2
2
r2B
r2
r12
r2A
1
r1B
r1
r1A
z
B
Hamiltoniana:
R
A
p2A
pB2
e2 p12
p22 e2 e2 e2 e2 e2
H ( r1, r2 , RA, RB )
2 M N 2 M N R 2me 2me r12 r1A r1B r2 A r2 B
termini che dipendono
solo dalle coordinate
dei nuclei
termini che dipendono
solo dalle coordinate
degli elettroni
termini che “mescolano” le
coordinate degli elettroni e
quelle dei nuclei
UN NUOVO PROBLEMA: come risolvere l’equazione in presenza dei
termini che mescolano le coordinate degli elettroni e quelle dei nuclei
Approssimazioni e metodo generale di soluzione
li discutiamo per
la molecola più semplice,
la molecola ione-idrogeno H2+:
2 nuclei e 1 elettrone
x
rB
r
B
R
rA
A
equazione di Schroedinger:
H (r , RA , RB )Ψ (r , RA , RB ) EΨ (r , RA , RB )
- approssimazione di BornOppenheimer, per risolvere il
problema del moto simultaneo
di nuclei e elettroni
- metodo della Combinazione
Lineare di Orbitali Atomici
(LCAO), per scrivere la
funzione d’onda elettronica
z
x
Approssimazione di Born-Oppenheimer
r
Equazione di Schroedinger:
H (r , RA , RB )Ψ (r , RA , RB ) EΨ (r , RA , RB )
B
B
R
r
r
AA z
Il problema: variazione contemporanea della posizione dell’elettrone e dei nuclei
approssimazione: data la grossa differenza fra la massa dell’elettrone e quella dei
nuclei, è lecito trascurare la variazione delle posizioni dei nuclei nella soluzione
del moto degli elettroni e risolvere l’equazione con una funzione d’onda prodotto
della funzione d’onda nucleare per una funzione d’onda elettronica con i nuclei
fermi a una distanza R: R interviene come parametro e non come variabile
funzione d’onda elettronica con i nuclei
a distanza fissa R
funzione d’onda nucleare
Ψ (r , RA , RB ) R (r ) ( RA , RB )
R
H (r , RA , RB ) H el (r ) H nucl ( RA , RB )
hamiltoniana elettronica con i nuclei a distanza fissa R
hamiltoniana nucleare
R
H (r ) R (r ) Eel R (r )
x
R
el
Funzione
d’onda
elettronica
p
R
H el (r )
2
2
rB
r
2
e e
2me rA rB
B
rA
A
R
potenziale di
repulsione fra i due
nuclei a distanza R
potenziale coulombiano
20
10
0
energia (eV)
-10
-20
potenziale di
attrazione
elettrone-nuclei
in funzione di z
per un valore
fissato di x e y
-30
-40
-50
-60
-70
-80
-8
-7
-6
-5
-4
-3
-2
-1
0
1
z (angstrom)
2
3
4
5
6
7
8
z
La funzione d’onda molecolare |g> è scritta
come sovrapposizione lineare di funzioni d’onda
che risolvono l’equazione di Schroedinger per
l’atomo isolato:
funzione
d’onda
molecolare
g
1
1s(rA ) 1s(rB )
2
Metodo LCAO:
Linear
Combination
of Atomic Orbitals
funzioni
d’onda
atomiche
x
funzione d’onda di un elettrone
con il nucleo posto nel punto z=zA
p
e
2m rA
1s ( rA ) E1s 1s (rA )
p 2 e2
2m rB
1s ( rB ) E1s 1s (rB )
2
2
r
rA
A
z
zA
x
rB
r
funzione d’onda di un elettrone
con il nucleo posto nel punto z=zB
B
z
zB
1
g
1s(rA ) 1s(rB )
2
Metodo LCAO
rB
p
e e
H (r ) g (r )
g (r )
2me rA rB
2
2
x
2
R
el
B
R
r
rA
A
2
p 2 e2 e2
e
1s( rA ) E1s 1s( rA )
1s( rA )
2m rA rB
rB
2
p 2 e2 e2
e
1s( rB ) E1s 1s( rB )
1s( rB )
2m rA rB
rA
sommando le due equazioni:
2
2
p 2 e2 e2
e
e
1s( rA ) 1s( rB ) E1s 1s( rA ) 1s( rB )
1s( rA )
1s( rB )
2m rA rB
rB
rA
termine di
energia atomica
termini di attrazione che si
aggiungono grazie all’attrazione
da parte “dell’altro nucleo”
z
1 x 2 y 2 ( z z A )2 / ao
x 2 y 2 ( z z B ) 2 / ao
1s
e
g (r )
e
2
funzione
d’onda
“gerade”
1s (rA ) e
x 2 y 2 ( z z A ) 2 / ao
1s(r B ) e
1s - sigma gerade
5
4
x 2 y 2 ( z z B ) 2 / ao
1sg(r): la funzione è grande
nella zona fra i due nuclei dove
l’elettrone ha effetti “leganti”
x
funzione d'onda
4
rB
1s(rB)
3
3 1s (r )
g
1 x 2 y 2 ( z z A )2 / ao
x 2 y 2 ( z z B )2 / ao
e
e
1s(r
A)
2
B
r
rA
A
R
2
il calcolo di 1s(rA) e
di21s(rB) è fatto per :
– 1valori fissi di x e y
– in funzione di z
-
1
+
0
-7
-6
-5
-4
-3
-2
-1 0 1
2
z (angstrom)
3
4
5
6
7
+
z
energia della
funzione d’onda “gerade”
H
g | H | g
g | g
normalizzazione
della funzione d’onda
p 2 e2 e2
1
g H g 1s( rA ) 1s( rB )
1s( rA ) 1s( rB )
2
2m rA rB
p 2 e2 e2
1s(rA )
1s(rA ) 1s(rB )
2m rA rB
x
rB
r
B
R
rA
A
z
p 2 e2
e2
1s(rA )
1s(rA ) 1s(rB ) 1s(rA ) 1s(rA ) 1s(rB )
2m rA
rB
e2
e2
E1s 1s(rA ) 1s(rA ) 1s(rB ) 1s(rA ) 1s(rA ) 1s(rA ) 1s(rB )
rB
rA
autovalore di
(p2/2m-e2/rA) nello
stato 1s(rA)
energia di attrazione
coulombiana che l’elettrone in
1s(rA) sente verso il nucleo B
energia di “risonanza”
fra il nucleo A e il
nucleo B
H
g | H | g
g | g
energia della
funzione d’onda
“gerade”
p 2 e2 e2
1
g H g 1s( rA ) 1s( rB )
1s( rA ) 1s( rB )
2
2m rA rB
Sommando i contributi delle due funzioni d’onda atomiche:
p 2 e2 e2
1s(rA ) 1s(rB )
1s(rA ) 1s(rB ) E1s 1s(rA ) 1s(rB ) 1s(rA ) 1s(rB )
2m rA rB
energia dell’atomo isolato
energia di attrazione coulombiana
da parte dell’altro nucleo
energia di risonanza
e2
e2
1s(rA )
1s(rA ) 1s(rB )
1s(rB )
rB
rA
e2
e2
1s(rB )
1s(rA ) 1s(rA )
1s(rB )
rB
rA
energia della funzione d’onda “gerade”
termini coulombiani
C
termine atomico
1
1s( rA )
g H g E1s g g
2
1
1s( rB )
2
e2
1s( rB )
rA
e2
1s( rA ) 1s( rB )
rB
e2
1s( rA ) 1s( rA )
rB
e2
1s( rB )
rA
x
rB
Q
r
termini di “risonanza”
e2
C 1s( rA )
1s( rA )
rA
e
e2
Q 1s(rB ) 1s(rA ) e
rB
B
A
R
e2
2 x 2 y 2 ( z z A ) 2 / ao
2
2
x y ( z zB )
x 2 y 2 ( z z A ) 2 x 2 y 2 ( z z B ) 2 / ao
rA
2
dx dy dz
e2
x y ( z zB )
2
2
z
2
dx dy dz
Normalizzazione della funzione d’onda gerade
termini di “sovrapposizione”
1
1s( rA ) 1s( rB ) 1s( rA ) 1s( rB )
S
2
1
1
1s( rA ) 1s( rA ) 1s( rB ) 1s( rB ) 1s( rA ) 1s( r B) 1s( rB ) 1s( rA )
2
2
g g
1
S 1s( rB ) 1s( rA )
<g| g> = 1 + S
x 2 y 2 ( z z A ) 2 x 2 y 2 ( z z B ) 2 / ao
e
dx dy dz
H
g
g H g
g g
C Q
E1s
1 S
da ricordare che tutti i termini (C, Q, S) sono determinati
per un certo valore della distanza interatomica R
energia della funzione d’onda “gerade”
1sg(r)= N(1s(rA)+1s(rB))
x
energie
10
rB
repulsione fra i
nuclei
8
r
B
6
A
z
somma di tutti
i contributi
4
energia (eV)
R
rA
2
0
livello energetico
dell’atomo isolato
(R = infinito)
-2
energia
di
-4
dissociazione
attrazione da parte
dell’altro nucleo (C)
-6
-8
energia di
risonanza (Q)
-10
0,0
distanza
di equilibrio
1,0
2,0
3,0
distanza fra nuclei (angstrom)
4,0
5,0
Ediss
C Q
1 S
Ediss = - 2,65 eV
Requilibrio = 1,06 Ả
1su(r)= 1/2 (1s(rA)-1s(rB))
1 x 2 y 2 ( z z A )2 / ao
e
1s u ( r )
e
2
1s - sigma ungerade
8
1s(rA)
6
funzione d'onda
4
2
funzione
d’onda
x 2 y 2 ( z z B )2 / ao “ungerade”
1su(r): la funzione è nulla proprio
nella zona fra i due nuclei dove
l’elettrone avrebbe effetti “leganti”,
mentre è grande nelle zone dove ha
effetti “antileganti”
x
rB
0
r
-2
B
-1s(rB)
R
rA
z
A
-4
-
-6
-8
-4
-3
-2
-1
0
1
z (angstrom)
2
3
+4
+
energia della
funzione d’onda “ungerade”
1su(r)= 1/2 (1s(rA)-1s(rB))
<u| u> = 1 - S
energie
50
H
40
energia (eV)
30
somma di tutti
i contributi
20
E1s
C Q
1 S
repulsione fra i
nuclei
NON è uno
stato legato
10
energia di
risonanza
0
attrazione da parte
dell’altro nucleo
-10
-20
0,0
u
u H u
u u
1,0
2,0
3,0
distanza fra nuclei (angstrom)
4,0
livello energetico
dell’atomo isolato
(R = infinito)
5,0
1s - sigma gerade
“orbitali” molecolari
-1s
5
4
funzione d'onda
4
3
3
2
2
1
1
0
-7
-6
-5
-4
-3
-2
-1
0
1
z (angstrom)
2
3
4
1s - sigma ungerade
8
6
funzione d'onda
4
2
0
-2
-4
-6
-8
-4
-3
-2
-1
0
1
z (angstrom)
2
3
4
5
6
7
x
r12
2
r2B
r2
La molecola H2
r2A
1
r1B
r1A
r1
z
B
A
R
2
2
2
2
2
2
2
p
p
e
e
e
e
e
p
p
e 2e
e
e
e
H 1
H 2m 2
m r
r r
r
r
m
r2 A r2 B r12
( r2
, r ) ( r )2
m
( r ) r
1
A
/ 2 r1B
2
1
1 2
2
2
g 1
2
2
2
2
2
1A
1B
2A
2B
12
g 2
1 2
1 2
funzione d’onda:
- antisimmetrica nello scambio delle funzioni di spin
dei due elettroni,
- simmetrica nello scambio delle funzioni spaziali
( r1, r2 ) g ( r1 ) g ( r2 ) 12 12 / 2
x La molecola H
2
p12 p22 e2 e2 e2
e2 e2
H
2m 2m r1A r1B r2 A r2 B r12
H
(o )
(o )
Hm
H
,1
m,2
p12 e2 e2
(o )
H m,1
2m r1A r1B
H m( o,1)
g
H m( o, )2
g
2
r2B
2
e
r12
B
p22 e2
e2
(o )
; H m,2
2m r2 A r2 B
g(r1 ) H m( o,1) g(r1 ) E1s 2,65 eV
g(r2 ) H m( o, )2 g(r2 ) E1s 2,65 eV
r2
r12
r2A
1
r1B
r1A
r1
R
z
A
(1sg)2
2
e
(o )
(o )
H g H m,1 H m,2 g( r1) g( r2 )
g( r1) g( r2 )
r12
g
g
H g 2 E1s 4,5 eV










