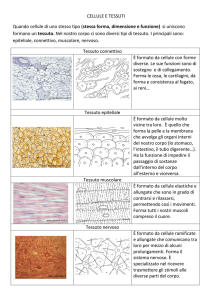
CORSO DI ISTOLOGIA
prof. Silvia Parolini
1. Introduzione
L’istologia è lo studio dei tessuti biologici. I tessuti sono insiemi di
cellule più o meno specializzate, che presentano caratteristiche
determinate a seconda della funzione che essi svolgono.
I tessuti sono convenzionalmente divisi in quattro grandi classi, a loro
volta suddivise in varie specie.
1) tessuti epiteliali
La loro derivazione è di diversa specie:
- ectodermica
- mesodermica
- endodermica (per quanto riguarda lo sviluppo dell’endotelio)
Si suddividono in due principali specie:
- epiteli di rivestimento
- epiteli secernenti (che hanno la funzione di secernere
sostanze, sono situati in ghiandole)
2) tessuti connettivi
Sono tessuti molto differenti tra loro, nonostante la loro origine sia
unica, mesenchimale:
- derivano dl mesenchima (connettivo dell’embrione) di origine
mesodermica
I suddividono in:
- connettivi propriamente detti
- tessuto adiposo
- tessuti connettivi di sostegno
- tessuti connettivi con funzione trofica (sangue o linfa)
3) tessuti muscolari
Il tessuto muscolare presenta delle caratteristiche particolari,
soprattutto a livello cellulare. A causa della sua morfologia lo si
distingue in:
- tessuto muscolare liscio
- tessuto muscolare striato
4) tessuti nervosi
Sono tessuti di origine ectodermica, che consentono la ricezione e la
trasmissione degli stimoli. Le cellule di tale tessuto sono cellule
perenni.
Dall’ectoderma dell’embrione si da origine a delle specifiche giunzioni
che connettono tutti i tessuti del corpo umano: le sinapsi.
Il differenziamento
I tessuti sono formati principalmente da cellule differenziate.
Il differenziamento consiste nello sviluppo di una cellula con particolari
caratteristiche morfo-funzionali. Questo processo, tuttavia, ha come
conseguenza la perdita della capacità proliferativa della cellula:
- per ovviare a questo fatto, nella maggior parte dei tessuti sono
presenti cellule poco differenziate che hanno il compito di
duplicarsi formando cellule differenziate: le cellule staminali.
- Il differenziamento non è un fenomeno che avviene solamente
a livello embrionale, ma prosegue per tutta la vita ad opera di
queste cellule specifiche.
2. Il tessuto epiteliale
Il tessuto epiteliale è costituito quasi esclusivamente da cellule, a
differenza del connettivo in cui vi è una larghissima dispersione di
matrice extracellulare.
1
Le cellule formano lamine cellulari, tubuli e cordoni solidi, che si
suddividono in:
- epiteli di rivestimento: sono fatti a lamine, rivestono la
superficie esterna e le superfici interne degli organi cavi
- epiteli secernenti o ghiandolari: sono formati da cellule
secernenti. Le cellule dell’epitelio secernente derivano sempre
da un epitelio di rivestimento.
Un tessuto epiteliale svolg sostanzialmente queste funzioni:
- rivestimento (es. epidermide)
- assorbimento (es. epitelio gastrico e intestinale)
- secrezione (ghiandole)
a. Epiteli di rivestimento
Sono formati da cellule strettamente unite tra di loro, con una scarsa
matrice extracellulare amorfa.
Si dispongono a lamine che poggiano su di una membrana basale,
adatte a rivestire superfici esterne o cavità interne.
Svolgono numerose funzioni:
- rivestono la superficie esterna del corpo o le cavità interne
- proteggono i tessuti sottostanti da danneggiamenti di varia
natura (chimici, fisici, meccanici, ecc..)
- proteggono dall’invasione microbica
- riducono la perdita d’acqua
- attuano cambi con l’esterno (metabolici, gassosi)
- permettono la ricezione degli stimoli sensoriali.
Ha origine da tutti e tre i foglietti embrionali primitivi:
- ectoderma: epidermide e epitelio della cornea
- endoderma: epiteli che rivestono le vie digerenti e le cavità
respiratorie
- mesoderma: epiteli delle vie urogenitali, pareti ovariche, epitelio
che tappezza le cavità sierose
Le cellule degli epiteli hanno una forma ben definita, che li caratterizza
ed è strettamente correlata alle loro funzioni:
- cellule pavimentose: sono molto appiattite, molto sottili con un
nucleo schiacciato
- cellule cubiche o isoprismatiche: sono di forma cubica, o
comunque non particolarmente disomogenea
- cellule cilindriche: sono molto più alte. Il nucleo si trova spesso
più in basso a causa di un apparato di Golgi e di un reticolo
endoplasmatico molto sviluppato.
Tutte le cellule epiteliali poggiano su una membrana basale che le
separa dal connettivo sottostante, con cui attuano scambi metabolici.
Le cellule epiteliali di rivestimento sono spesso unite tra di loro
mediante giunzioni occludenti e desmosomi, mentre legate alla
membrana basale mediante emidesmosomi.
Generalmente un epitelio è privo di vasi sanguigni:
- per gli epiteli semplici lo scambio di sostanze avviene dal
connettivo sottostante
- per gli epiteli composti lo scambio avviene mediante propaggini
epiteliali (creste) a cui si interpongono le papille connettivali.
Caratteri generali
Le cellule epiteliali hanno una forma geometrica regolare e ben
definita, si uniscono tra di loro per formare lamine cellulari di
rivestimento.
Talvolta, a seconda della funzione che svolgono, presentano
caratteristiche peculiari.
1) polarità morfo-funzionale
Alcune cellule presentano una polarità morfo-funzionale molto
spiccata, nel senso che la superficie apicale differisce sensibilmente
dalla superficie basale:
2
-
specializzazioni della membrana plasmatica
disposizione degli organuli citoplasmatici.
Queste specializzazioni sono molto evidenti negli epiteli che hanno
funzione di assorbimento o secrezione.
Sulla superficie apicale, in relazione a specifiche funzioni, possono
esservi:
- microvilli
- stereociglia
- ciglia vibratili
La superficie basale è legata alla membrana basale attraverso specifici
complessi proteici di giunzione detti emidesmosomi che talvolta sono
espansi nel citoplasma in maniera profonda con delle radichette.
Nelle cellule che tappezzano i tubuli renali, nelle ghiandole salivari e
nei dotti escretori (dove avviene il riassorbimento) sono presenti delle
profonde introflessioni della membrana plasmatica che penetrano in un
citoplasma ricco di mitocondri:
- è il labirinto basale che ha la funzione di ampliare la superficie
di contatto e di assorbimento
Per quanto riguarda gli organuli:
- nelle cellule cilindriche il complesso di Golgi si trova al di sopra
del nucleo (spesso ha funzione secretoria)
La polarità funzionale delle cellule appare meno evidente negli epiteli
stratificati (solitamente hanno pura funzione protettiva).
2) impalcatura interna
Come tutte le cellule, anche quelle epiteliali possiedono un
citoscheletro che ha tra l’altro funzione di sostegno. È costituito da:
- microtubuli: oltre a formare la forma sono anche mezzo di
trasporto per le vescicole,
-
-
filamenti intermedi: nello strato laterale sconvengono verso i
desmosomi (giunzione) e nello strato spinoso si associano
dando luogo alle tonofibrille
microfilamenti: costituiti principalmente da actina, si trovano al
di sotto della membrana plasmatica o a livello della trama
terminale
Con il termine trama terminale si intende uno strato di filamenti
addensati al di sotto della membrana plasmatica apicale:
- una parte è addensata alla periferia della cellula, formando la
fascia aderente,
- un’altra parte si estende a costituire lo scheletro dei microvilli
I microvilli (costituiti da filamenti intermedi), possono ritrarsi grazie ad
una interazione con una proteina a base di miosina presente nella
trama terminale.
3) specializzazioni della superficie libera delle cellule (apicale)
Le specializzazioni della membrana plasmatica libera sono costituite
da:
- microvilli
- stereociglia
- ciglia vibratili
- crosta
Al MO, si può osservare una cuticola ispessita sulla membrana
plasmatica di alcuni epiteli, che pare un orsetto a spazzola. Al ME si
può capire che questi sono i microvilli:
- estroflessioni digitiformi della membrana plasmatica
- è presente una forte attività ATP-asica che indica presenza di
trasporto attivo
- sulla superficie delle cellule dell’epitelio intestinale è presente
un glicocalice che ha funzioni di protezione e enzimatiche
(facilitano l’assorbimento)
- hanno un diametro compreso tra i 50 e i 100 nm e servono per
aumentare la superficie di assorbimento
3
Le strutture microvillari sono percorse da microfilamenti che si legano
alla base alla trama terminale.
Sono percorsi da 30-40 filamenti di actina, che formano un fascio,
stabilizzato da due tipi di proteine: fibrina e fascina.
Per l’ancoraggio al connettivo sottostante negli epiteli pavimentosi
pluristratificati si trovano molti emidesmosomi nello strato basale.
5) meccanismi di giunzione
Cfr. membrana plasmatica.
Le ciglia vibratili caratterizzano le cellule che rivestono le vie
respiratorie e le vie genitali femminili:
- nelle vie respiratorie servono per espellere particelle estranee
immesse insieme all’aria
- nelle vie genitali femminili facilitano la progressione della cellula
uovo verso l’utero.
Le stereociglia hanno una funzione non ancora ben definita:
- sono ciglia lunghe fino a 30 micron
- rivestono il canale dell’epididimo e il dotto deferente
- sono simili a microvilli, ma più lunghe e più sottili.
La crosta è una zona della membrana plasmatica che contiene
vescicole lenticolari:
- presente in cellule cupoliformi dell’epitelio di transizione della
vescicola urinaria,
- quando l’organo è vuoto queste vescicole si ripiegano su sé
stesse
- quando l’organo si riempie si estendono
- rappresenta una riserva di membrana plasmatica.
6) membrana basale
Le membrane basali si trovano in tutti gli epiteli tra il derma
(connettivo sottostante l’epitelio) e l’epidermide.
Si trovano anche:
- sotto singole fibrocellule muscolari lisce
- alla base dell’endotelio dei capillari
- altri tipi cellulari
Possono essere visualizzate con specifici metodi di trattamento per
matrice extracellulare, ad esempio la colorazione PAS o quella
argentica.
Al MO appare come una banda con elettrodensità variabile di spessore
di 100 nm.
Di strutture e funzioni se ne riparla.
CLASSIFICAZIONE DEGLI EPITELI DI RIVESTIMENTO.
4) specializzazione della superficie basale
Le cellule dello strato basale, presentano spesso delle introflessioni ed
un aspetto sinuoso:
- servono ad ancorarsi meglio al connettivo sottostante
- utili per aumentare la superficie di scambio
Dove è necessaria una funzione di riassorbimento queste introflessioni
si accentuano formando il labirinto basale, in prossimità del quale
sono presenti numerosi mitocondri.
La classificazione degli epiteli di rivestimento si basa su:
- morfologia cellulare
- numero di strati che compongono l’epitelio
EPITELI SEMPLICI
Si dice che un epitelio sia semplice quanto è formato da un solo
strato di cellule.
4
EPITELIO PAVIMENTOSO SEMPLICE
L’epitelio pavimentoso semplice è costituito da cellule appiattite
disposte in un unico strato.
Nelle sezioni perpendicolari alla superficie le cellule appaiono
estremamente sottili ed appiattite:
- è presente un rigonfiamento solo in prossimità del nucleo
- il nucleo sporge verso l’esterno ed è sempre sferico o ovoidale
- i limiti cellulari presentano una forma poligonale e sono ben
evidenti se colorati con sali d’argento.
L’epitelio pavimentose semplice non è più di tanto idoneo a ricevere
delle sollecitazioni meccaniche. Pertanto le sue funzioni sono:
- regolare la diffusione
- copertura
Nell’uomo sono parecchio frequenti. Si trovano infatti in prossimità di:
- presente negli alveoli polmonari dove regola lo scambio di gas
(Ossigeno e anidride carbonica)
- presente nell’apparato urinario a livello del neurone
- si trova anche in alcune parti dell’orecchio
- è il tessuto di rivestimento dei dotti escretori di alcune
ghiandole
- mesotelio, di origine mesodermica, riveste le cavità sierose
(pleura, pericardio, peritoneo)
- endotelio: deriva dal mesenchima e riveste il lume dei vasi
sanguigni e linfatici, nonché le cavità del cuore.
EPITELIO CUBICO O ISOPRISMATICO SEMPLICE.
L’epitelio cubico semplice è costituito da cellule poliedriche disposte in
un unico strato.
Nelle sezioni perpendicolari alla superficie dell’epitelio le cellule
appaiono di forma cubica.
Nelle sezioni parallele sono di forma irregolarmente pentagonale o
esagonale. I margini delle cellule sono ben evidenti (terminal bar). Il
nucleo è sferico e presente al centro della cellula.
Alcuni epiteli cubici semplici possono essere cigliati, presentando
microvilli o ciglia vibratili.
Se sono sottoposti a sollecitazioni meccaniche, alcuni di questi epiteli
possono trasformarsi in cilindrici.
Talvolta questo genere di epitelio può avere anche una funzione
secretoria:
- esempio le cellule che rivestono il lume delle vescichette
seminali.
Nell’uomo si trova in:
- superficie dell’ovaio (epitelio germinativo)
- follicoli tiroidei
- dotti escretori ghiandolari
- tubuli contorti e collettori del rene (nefrone).
EPITELIO CILINDRICO O BATIPRISMATICO SEMPLICE.
L’epitelio cilindrico semplice è costituito da un unico strato di cellule
cilindriche.
In sezione perpendicolare alla superficie dell’epitelio le cellule
appaiono alte, simili a colonne. Il nucleo situato quasi sempre in
posizione basale, comunque nella parte inferiore della cellula.
In sezione parallela l’epitelio presenta un aspetto a mosaico.
Questo epitelio è molto frequente nei dotti umani:
- nel tubo digerente, dal cardias all’ano
- nella cistifellea e nei grossi dotti biliari
- nei dotti escretori di molte ghiandole.
5
Quando questi epiteli hanno funzioni di assorbimento o di trasporto le
superfici apicali delle cellule sono fornite di microvilli o stereociglia o
ciglia vibratili.
Tra queste cellule, ad intervalli regolari, sono solitamente presenti delle
cellule caliciformi che hanno funzioni mucipare.
La forma delle cellule di questo tipo di epitelio è in relazione alle
funzioni che svolge:
- nei dotti ghiandolari sono presenti cellule dello stesso tipo
- nei dotti che hanno funzione di assorbimento o secrezione vi
sono cellule adibite all’assorbimento e cellule adibite a
secrezione.
Nel caso delle cellule dell’intestino vi sono:
- cellule cilindriche dotate di microvilli adibite all’assorbimento
- cellule secernenti muco, che serve da protezione per le cellule
intestinali.
Altri epiteli molto simili sono presenti:
- nell’esofago
- nel canale cervicale dell’utero
Un epitelio cilindrico semplice cigliato si trova:
- nell’apparato respiratorio
- nell’utero
- nella tuba uterina (unito a cellule secernenti)
I nuclei sono sfasati, non in fila, ma danno l’aspetto di un falso
epitelio stratificato:
- tutte le cellule aderiscono con porzioni più o meno grosse alla
lamina basale
- non tutte le cellule raggiungono la superficie libera
La superficie apicale, può essere munita di microvilli o ciglia:
- le cellule delle vie respiratorie possiedono sulla porzione
apicale delle ciglia vibratili
- le cellule che rivestono il canale dell’epididimo sono munite di
stereociglia
Le cellule dell’epitelio pseudostratificato sono spesso intercalate da
cellule caliciformi mucipare con funzione secretoria.
Questo epitelio si trova anche:
- nei genitali maschili
- nelle vie respiratorie (cavità paranasali)
- dotti escretori di alcune ghiandole.
EPITELI COMPOSTI
Si parla di epiteli composti facendo riferimento a quegli epiteli che
presentano più strati di cellule sovrapposte, per cui si dicono anche
pluristratificati.
Hanno solitamente funzioni di rivestimento e protezione.
EPITELIO PSEUDOSTRATIFICATO O A PIU’ FILE DI NUCLEI.
L’epitelio pseudostratificato è una variazione dell’epitelio cilindrico
poiché non tutte le cellule raggiungono la superficie libera:
- quelle che raggiungono la superficie libera si stringono
sensibilmente
- quelle che sono legate alla lamina basale hanno una struttura
molto fusata nella parte superiore e una base piuttosto larga.
In alcuni di questi epiteli composti si aprono i dotti escretori di
ghiandole esocrine presenti nel connettivo sottostante.
L’osservazione per classificare gli epiteli composti va compiuta sugli
strati superficiali, poiché nelle cellule situate alla base ve ne sono
sempre di prismatiche o cubiche.
6
EPITELIO CUBICO STRATIFICATO.
L’epitelio cubico o isoprismatico stratificato è costituito da due o più
strati di cellule sovrapposti, delle quali le superficiali sono cubiche.
Questo tipo di epitelio è sempre privo di ciglia vibratili.
È molto raro nell’organismo umano adulto:
- si trova nei dotti di alcune ghiandole esocrine
EPITELIO CILINDRICO (O BATIPRISMATICO) STRATIFICATO.
L’epitelio cilindrico o batiprismatico stratificato è un tipo di epitelio
scarsamente rappresentato.
Gli strati superficiali sono formati da cellule che appaiono cilindriche,
molto spesso provviste di ciglia vibratili. Le cellule inferiori sono
poliedriche.
Nell’organismo degli umani è riscontrabile in:
- grossi dotti escretori di ghiandole esocrine
- faringe
- laringe
- uretra del maschio
Generalmente questo epitelio si trova in zone di transizione tra epitelio
pseudostratificato e epitelio pavimentose stratificato.
Lo strato intermedio è formato da due o più strati di cellule clavate o
piriformi:
- inviano i loro prolungamenti nelle cellule dello strato sottostante
Lo strato superiore di questo tessuto è composto da cellule
cupoliformi, spesso binucleate, con una superficie libera larga e
convessa:
- sono spesso rivestite da un glicocalice formato da placche di
natura glicoproteica
Quando la vescica è piena l’epitelio si assottiglia e gli ordini di cellule
diminuiscono:
- le cellule piriformi si incuneano tra quelle dello strato basale
- le cellule cupoliformi si distendono a coprire 2-3 cellule piriformi
Dal punto di vista fisico questo tipo di tessuto presenta una elevata
plasticità e un’alta capacità di adattarsi alle modificazioni subite dai
cambiamenti di volume:
- è probabile che nel momento della distensione dell’organo,
queste cellule aumentino la propria superficie membranale a
seguito di fusione di vescicole provenienti dal citoplasma
EPITELIO PAVIMENTOSO STRATIFICATO.
È un tipo di epitelio molto diffuso nell’organismo umano, presente in
due tipologie:
- epitelio pavimentoso stratificato non cheratinizzato
- epitelio pavimentoso stratificato cheratinizzato
EPITELIO DI TRANSIZIONE O POLIMORFO DELLE VIE URINARIE.
Epitelio pavimentoso stratificato non cheratinizzato.
L’epitelio di transizione (o polimorfo delle vie urinarie) riveste le vie
urinarie ed ha una morfologia che è soggetta al cambiamento di
volume degli organi che tappezza:
- nella vescica la forma che assume è data dal grado di
estensione dell’organo
L’epitelio pavimentoso stratificato non cheratinizzato è mediamente
composto da 5-10 ordini di cellule che si dispongono in tre differenti
strati.
Nello strato basale le cellule hanno un aspetto cubico o cilindrico.
La porzione più profonda presenta molto spesso delle creste epiteliali
che si innestano nel tessuto connettivo sottostante, che forma le
papille connettivali laddove si interpone al tessuto epiteliale:
7
-
conferisce maggiore aderenza al connettivo
facilita la diffusione di sostanze trofiche dai capillari situati nel
connettivo
In alcuni epiteli stratificati pavimentosi non cheratinizzati, come ad
esempio l’epitelio anteriore della cornea non sono presenti creste
epiteliali, ma la porzione inferiore è liscia.
In profondità le cellule si presentano cubiche o cilindriche, formando un
solo ordine di cellule.
Man mano che si sale le cellule si fanno via via più appiattite:
- in superficie si trovano cellule estremamente appiattite
Le cellule dello strato basale:
- sono molto indifferenziate
- hanno un metabolismo molto attivo
- hanno attività proliferativa
- nucleo tondo e ben visibile.
Le cellule degli strati superiori:
- hanno un metabolismo lento
- perdono capacità proliferativa poiché sono estremamente
differenziate.
- Sono appiattite con un nucleo abbastanza evidente.
- Sono ricche di glicogeno a seconda dell’attività funzionale che
svolgono.
Nello strato basale le cellule sono fortemente ancorate allo strato
intermedio mediante desmosomi, mentre negli strati superiori le cellule
si distaccano facilmente.
Si suddivide in tre strati, partendo dall’osservazione dell’epitelio
dell’esofago:
- strato basale
- strato spinoso
- strato superficiale
Le cellule dello strato basale:
- sono ricche di desmosomi
- sono cellule indifferenziate,
- sono cellule staminali ed anno la funzione di riprodurre la
popolazione.
Lo strato spinoso presenta cellule ricche di desmosomi, con un ampio
sistema di tonofibrille all’interno del citoplasma.
Lo strato superficiale è caratterizzato da cellule appiattite che:
- hanno pochi desmosomi
- hanno una membrana apicale ispessita priva di microvilli
- sono ricche di glicogeno
L’epitelio stratificato pavimentoso non cheratinizzato si trova in:
- alcuni tratti dell’apparato digerente
- nella vagina
- nell’uretra
- nella superficie anteriore della cornea
- nella congiuntiva bulbare e palpebrale
Solitamente questo tessuto è affiancato a ghiandole che secernono un
secreto che funge da velo di protezione per le cellule pavimentose
superficiali.
Epitelio pavimentoso stratificato cheratinizzato (epidermide)
L’epidermide è un tipo di epitelio pavimentoso stratificato che subisce il
processo di cheratinizzazione, che consiste nella trasformazione in
lamelle cornee delle cellule desquamanti (quelle morte):
- formano una barriera protettiva che protegge da agenti
patogeni
- protegge da danni di natura chimica, fisica e meccanica
- riduce l’evaporazione di liquidi tissutali.
Come in tutti gli epiteli pluristratificati, le cellule basali fungono da
cellule staminali:
8
-
danno origine a nuove cellule che modificano la loro struttura e
risalgono in superficie
vanno a rimpiazzare le lamelle cornee che si desquamano
continuamente
portandosi in superficie esprimono la cheratina, che è un
costituente dei loro filamenti intermedi.
La cheratina è una proteina fibrosa, che nell’organismo si presenta
sotto due differenti forme:
- cheratina molle: ricopre la cute in tutta la sua estensione
- cheratina dura: è presente solamente negli epiteli che formano
annessi cutanei (peli e unghie)
Strato basale
Nello strato basale agiscono stimoli attivatori della proliferazione,
mentre le cellule degli strati superficiali (altamente specializzate) non si
riproducono più:
- lo strato corneo va incontro ad un processo di apoptosi
- queste cellule subiscono un processo di cheratinizzazione, si
desquamano e si portano in superficie.
- Le lamelle cornee appiattite (cellule desquamate) si disperdono
poi in superficie.
Il tempo normale affinché una cellula prodotta nello strato basale arrivi
in superficie è di circa 30 gg, ma può diventare enormemente breve in
seguito a traumi:
- esiste un costante equilibrio tra cellule che si desquamano e
cellule che vengono germinate nello strato basale
L’epitelio ha uno spessore medio tra 30 µm e 1,5/2 mm e varia nelle
diverse regioni del corpo.
Nell’epidermide si distinguono cinque strati:
- strato basale
- strato spinoso
- strato granuloso
- strato lucido
- strato corneo
Le cellule presenti sono:
- cheratinociti: sono le cellule che subiscono il processo di
cheratinizzazione
- melanociti: incaricati di produrre melanina
- cellule di Langerhans.
Lo strato basale è lo strato più profondo di cellule staminali che si
legano alla membrana basale che li separa dal derma.
Le cellule sono alte (cubiche o cilindriche) e hanno un nucleo ovoidale
che occupa gran parte della cellula:
- presenti moltissimi poliribosomi liberi (sintetizzano le cheratine)
- poco sviluppati il RER e l’apparato di Golgi
- presentano una rete di tonofilamenti di cheratina molto
sviluppati
Le cheratine che vengono espresse dai cheratinociti sono di tipi
differenti e ogni tipo viene espresso in un particolare stadio.
I meccanismi di giunzione:
- emidesmosomi: si legano alla membrana basale e sono sulla
superficie inferiore della cellula. Proteine della famiglia delle
integrine.
- Desmosomi: uniscono la cellula lateralmente alle altre. Proteine
della famiglia delle caderine.
Contengono parecchi grani di melanina al di sopra del nucleo.
Le cellule dello strato basale hanno funzione di cellule staminali:
- una cellula rimane nello strato basale, l’altra viene spinta a
differenziarsi
- il differenziamento inizia con la perdita delle integrine che
formano gli emidesmosomi che giuntano la cellula alla
membrana basale.
9
Strato spinoso
-
Le cellule dello strato spinoso sono cellule che sono immediatamente
al di sopra di quelle dello strato basale. Presentano una forma
poliedrica leggermente appiattita:
- nuclei rotondi
- presentano numerosi desmosomi di giunzione con le altre
cellule che gli conferiscono un aspetto spinoso (sono unite da
tonofilamenti di cheratina).
- Sono separate da ampi spazi intracellulari ove circolano liquidi
interstiziali
-
è presente negli epiteli della mano o del piede, dove lo strato
corneo è particolarmente ispessito
è uno strato sottile di cellule molto appiattite che appare come
una esile linea chiara
In queste cellule sono scomparsi gli organuli:
- sono rimasti i tonofilamenti impacchettati (ad opera della
filagrina) che si dispongono paralleli alla cute
- lo spazio intracellulare è ricco di granuli rivestiti da membrana o
cheratinosomi.
Strato corneo.
Sono cellule che hanno un carattere fortemente basico:
- presentano numerosi poliribosomi liberi nel citoplasma
- sono numerosi i granuli di melanina
Durante il processo di cheratinizzazione, già a partire dallo strato
spinoso, si nota una diminuzione di fluidità del plasmalemma, che
progressivamente si ispessisce.
Strato granuloso
Lo strato granuloso è formato da cellule che derivano dallo stato
spinoso, che salendo si appiattiscono ulteriormente:
- 2-6 ordini di cellule
- i nuclei cominciano a presentare evidenti alterazioni
- sono ricchi di granuli di cheratoialina associata a
tonofilamenti.
Viene secreta la filagrina (che è una proteina tra i maggiori componenti
della cheratoialina), che unisce i tonofilamenti di cheratina in
macrofibrille.
Strato lucido.
Lo strato lucido è uno strato che non è distinguibile in tutto
l’epidermide:
È costituito da uno strato che presenta uno spessore notevolmente
variabile a seconda della sede anatomica in cui si trova:
-
-
le cellule dello strato granuloso e lucido si sono modificate
progressivamente formando cellule lamellari molto appiattite
ormai prive di nucleo
le lamelle cornee non contengono più né nucleo né organuli
contengono filamenti impacchettati di cheratina
le membrane cellulari sono notevolmente ispessite
Lo strato superficiale dello strato corneo è detto strato disgiunto:
- strato che appare ormai staccato dall’epidermide
CELLULE NON AUTOCTONE.
Sono cellule che non nascono nell’epidermide (origine a distanza), ma
vi migrano in seguito.
Tra queste cellule, le principali sono:
- melanociti
- cellule di Langerhans
- cellule di Merkel
10
Melanociti.
-
I melanociti sono cellule che hanno origine ectodermica, nascono
nelle creste neurali, nella cute e migrano nello strato basale
dell’epidermide.
-
Sono cellule dalla morfologia caratteristica:
- presentano numerose ramificazioni citoplasmatiche
- per questo sono dette cellule dendritiche.
- Non formano desmosomi
- Non possiedono cheratina
Queste cellule producono un particolare pigmento di colore marrone
scuro, la melanina, che viene raccolta in granuli detti melanosomi:
- ha la funzione di proteggere le cellule dello strato basale dai
raggi ultravioletti
- la sua assenza (come nel caso dell’albinismo) è data
dall’incapacità di produrla, non dall’assenza di melanociti
- quando i melanociti si raggruppano in zone circoscritte hanno
origine le lentiggini o efelidi.
- Aumenta in seguito all’esposizione ai raggi solari.
Queste cellule hanno un apparato di Golgi parecchio sviluppato e un
RER molto articolato:
- producono vescicole dette melanosomi, in cui è presente una
matrice interna lamellare
- nei melanosomi avviene l’ossidazione da tirosina a melanina.
- Quando sono prodotti i melanosomi, passano nei
prolungamenti citoplasmatici e vengono trasmessi allo strato
basale
Cellule di Langerhans.
Le cellule di langerhans si trovano negli strati sovrabasali
dell’epidermide:
- hanno lunghi prolungamenti irregolari
- ha moltissimi poliribosomi liberi, un RER e un REL poco
sviluppati e un apparato di Golgi ben visibile
nel citoplasma sono presenti organuli specifici a forma di
racchetta dette cellule di Birbek.
Non presentano dispositivi di giunzione.
Sono cellule che derivano da precursori monociti/macrofagi, ed hanno
sostanzialmente una funzione di difesa.
Sono in grado di riconoscere, captare e rielaborare gli antigeni di
cellule estranee e presentarle poi alle cellule immunocompetenti:
- possono trasportarli ai linfociti T del derma ad esempio
- inibiscono gli antigeni presenti su cellule estranee
- una volta migrati ai linfonodi regionali, esauriscono il loro
compito immunitario.
EPITELI SENSORIALI
Tutti gli epiteli sono innervati da fibre nervose amieliniche di piccole
dimensioni, che sono ramificazioni terminali di fibre nervose
sensitive:
- sono generalmente considerate come recettori del dolore
- alcune possono rispondere anche a stimoli tattici e termici
In alcune sedi, tra le cellule epiteliali vi sono delle particolari cellule
dette cellule sensoriali, che sono in grado di ricevere stimoli di varia
natura:
- queste trasmettono poi gli stimoli alle cellule nervose adiacenti
- gli stimoli vengono poi convogliati ai centri nervosi
Gli epiteli sensoriali sono costituiti da cellule specializzate per la
ricezione degli stimoli che provengono dall’esterno:
- sono dette cellule sensoriali secondarie (le primarie sono quelle
periferiche)
Le cellule sensoriali secondarie sono cellule cilindriche che
presentano:
- ciglia, stereociglia e chinociglia nel polo apicale, che hanno
funzione di recepire gli stimoli
11
-
giunzioni con sinapsi o giunzioni citoneuronali al polo basale,
che servono per trasmettere gli stimoli
Intercalate alle cellule sensoriali, che hanno la funzione di recepire gli
stimoli, vi sono cellule di supporto, con il compito di sostenere sia in
termini trofico-molecolari che strutturali le cellule sensoriali.
Le cellule sensoriali comprendono le cellule:
- gustative: con il compito di recepire i sapori
- acustiche: ricevono i suoni
- dell’apparato vestibolare: percepiscono le variazioni di gravità e
accelerazione.
-
cellule a pilastro: disposte ala periferia del calice
cellule a bastoncello: disposte in stretto rapporto con le cellule
gustative.
Le cellule basali sono situate alla base del calice ed hanno funzione di
cellule staminali, per sostituire gli altri elementi.
Anche l’olfatto è dato dai calici gustativi:
- si trovano anche nella faringe nella laringe e nell’istmo
- olfatto e gusto sono strettamente collegati.
Anche le cellule olfattive presentano quindi cellule sensoriali dotate di
peli o microvilli che percepiscono gli odori e sono in stretto contatto
con fibre nervose.
CELLULE GUSTATIVE
CELLULE ACUSTICHE
La lingua è rivestita da un epitelio cheratinizzato in cui sono
intercalate numerose cellule mucipare:
- presenta delle formazioni ovoidali che hanno la funzione di
recepire lo stimolo gustativo, i calici gustativi.
Nei calici gustativi sono presenti tre tipi di cellule:
- basali
- gustative (sensoriali)
- di sostegno.
Le cellule gustative sono 4-20 nella lingua e sono elementi di forma
allungata con:
- una porzione basale rigonfia, occupata prevalentemente dal
nucleo e sede della giunzione citoneurale
- nella parte apicale il corpo cellulare è ricco di mitocondri e
presenta dei peli gustativi sulla membrana apicale.
I peli gustativi sporgono nel calice sulla superficie più esterna e sono
stimolate dalle sostanze sapide:
- percepiscono dolce, amaro, salato e acido.
Sono cellule situate nella parte interna dell’orecchio (spinale),
incaricate di recepire gli stimoli sonori.
Vengono distinte, a secoda della posizione occupata nell’organo in:
- interne
- esterne
Le cellule acustiche esterne:
- sono circa 15000 disposte su 2-3 ordini
- hanno forma cilindrica
- la porzione basale è rigonfia e contiene il nucleo
- la porzione intermedia ha scarsi organuli citoplasmatici
- la porzione apicale ha numerosi organuli e un ispessimento
cunicolare
- la superficie apicale ha 50-100 stereociglia disposte a U o a W
lunghe 1 o 2 µm (peli acustici).
Le cellule acustiche interne:
- hanno forma cilindrica, ma non sono rigonfie a livello basale
- sono circa 3500
Le cellule di sostegno sono distinte tra:
12
-
possiedono solamente 20 stereociglia, ma con la medesima
disposizione di quelle esterne
Entrabi i tipi di cellule sono in relazione a due tipi di terminazioni
sinaptiche, con le quali formano giunzioni citoneurali:
- le terminazioni del primo tipo si dicono afferenti (conducono
impulsi dalla cellula acustica alle cellule nervose del ganglio
spirale), hanno scarsi mitocondri e poche vescicole sinaptiche
le terminazioni del secondo tipo sono più grandi e formano una
coppa. Possiedono numerosi mitocondri e vescicole sinaptiche.
Sono cellule efferenti (ricevono impulsi dal tronco encefalico
per modulare l’attività delle cellule acustiche).
-
sono presenti piccole giunzioni citoneurali efferenti.
Le cellule del secondo tipo:
- hanno giunzioni citoneurali che si collegano solamente nella
porzione basale della cellula
- è presente una terminazione afferente e alcune efferenti
- hanno forma cilindrica
- sulla superficie apicale sono presenti stereociglia e il chinociglio
I peli acustici dei due tipi cellulari (stereociglia + chinociglia) sono
immersi in una matrice gelatinosa detta membrana otolitica, che è
composta da:
- proteoglicani solforati
- cristalli romboidali di carbonato di calcio detti otoconi.
CELLULE SENSORIALI DELL’APPARATO VESTIBOLARE
(ORECCHIO).
Le cellule delle macule sono stimolate dal movimento della membrana
otolitica che grava sui peli acustici.
Sono cellule sensoriali situate a livello dell’orecchio, nell’apparato
vestibolare, che ricevono impulsi a riguardo delle accelerazioni
rotazionali e gravitazionali che subisce l’organismo e le trasmettono
ai centri nervosi.
Le cellule capellute delle creste ampollari sono cellule sensoriali
dell’apparato vestibolare che presentano peli sensoriali
particolarmente lunghi:
- immersi in una sostanza gelatinosa (cupola ampollare) priva di
otoliti.
- Sono stimolate dal movimento della matrice della cupola, che si
muove a causa dei movimenti di traslazione.
Le cellule delle macule sono di due tipi:
- cellule del primo tipo: forma di fiasco, situate nella parte
centrale delle macule
- cellule del secondo tipo: sono situate in periferia rispetto alle
cellule del primo tipo. Hanno forma regolarmente cilindrica.
Le cellule del primo tipo:
- ha forma di fiasco poiché ha la porzione basale allargata dalla
presenza del nucleo
- nella parte apicale possiede un centinaio di stereociglia
- è presente un chinociglio, una struttura motoria provvista di
assonema e di corpo basale che è il principale responsabile
della ricezione dello stimolo
- possiede una giunzione citoneurale afferente, che abbraccia
quasi tutta la cellula
FOTORECETTORI DELL’OCCHIO
Anche nell’apparato visivo sono presenti cellule epiteliali modificate
chiamate fotorecettori, distinte in coni e bastoncelli:
- sono neuroni d’integrazione della retina (la retina è un epitelio
pluristratificato).
- la retina è posta sul fondo oculare.
13
EPITELI PARTICOLARMENTE DIFFERENZIATI
In alcuni casi, il tessuto epiteliale si differenzia notevolmente durante la
fase prenatale, dando origine a particolari struture che hanno funzione
specifiche:
- smalto dentario: riveste la corona del dente
- cristallino: uno dei mezzi diottici del bulbo oculare
- peli, unghie e capelli: componenti particolarmente differenziati.
SMALTO DENTARIO
Lo smalto è un secreto prodotto da particolari cellule epiteliali
dell’organo dello smalto:
- ameoloblasti: producono smalto (formato da un reticolo
cristallino metallico 97%, sostanze organiche e acqua 3%)
- costituiscono un epitelio cilindrico semplice con funzione
secretoria.
Lo smalto viene secreto nell’organo dello smalto (che forma una
specie di coppa) mediante vescicole dagli ameloblasti e va a coprire
la dentina sul dente in formazione.
La dentina è un materiale che circonda il dente ed è ricoperto dallo
smalto:
- è immersa in un tessuto connettivale che è molto ricco di
terminazioni nervose
Il cristallino ha una forma di lente biconvessa che ha la funzione di
mettere a fuoco le immagini sulla retina, mediante variazione del
proprio raggio di curvatura. È costituito da:
- epitelio cubico semplice
- fibre del cristallino
- capsula o cristalloide
Le fibre del cristallino sono strutture che percorrono tutta la
lunghezza del cristallino e hanno forma di prismi esagonali:
- nel citoplasma si intravvedono mitocondri e piccole vescicole
- i nuclei sono situati all’equatore del cristallino in una zona detta
“dei nuclei”
- le strane interdigitazioni tra le fibre sono probabilmente
meccanismi di giunzione correlati al movimento funzionale delle
fibre
Al centro del cristallino mancano invece i nuclei, che vengono perduti
dalle cellule fibrose più interne.
La parte superficiale del cristallino è ricoperta dall’epitelio cilindrico
semplice, a cui si sovrappone la capsula che è uno strato costituito
da:
- glicoproteine
- collagene
PELI
CRISTALLINO
Nel corso dello sviluppo fetale, l’ectoderma si invagina in prossimità
delle cavità oculari:
- questo tessuto si chiude in una vescicola che costituisce
l’abbozzo del cristallino
- al termine dello sviluppo si ha la formazione del cristallino.
I peli sono epiteli cheratinizzati modificati che si affondano
profondamente nella cute.
Un pelo è formato da:
- una porzione libera, detta fusto
- una porzione infissa, detta radice
- un bulbo pilifero alla cui estremità penetra una papilla
connettivale con funzione trofica e neurologica
14
Il pelo è infisso in una rientranza modificata della superficie della pelle,
a cui partecipano sia l’epidermide che il derma, il follicolo pilifero.
I peli sono costituiti da un tessuto epiteliale pavimentoso stratificato,
con le opportune modifiche:
- sono anche presenti melanociti che forniscono melanosomi al
pelo o al capello
- alla base di ogni pelo v’è una ghiandola sebacea.
Gli epiteli ghiandolari sono costituiti da cellule secernenti derivate da
lamine epiteliali. Le cellule secernenti si possono trovare in differenti
strutture:
- intercalate negli epiteli di rivestimento: ad esempio le cellule
della mucosa gastrica e delle vie respiratorie
- lamine epiteliali secernenti: sono ad esempio le cellule della
mucosa gastrica e del rivestimento uterino o della vescichetta
seminale.
- Ghiandole: sono complessi di forma e volume maggiore d
cellule secernenti. Hanno caratteristiche molto differenti.
UNGHIE
Le unghie sono placche di celle infarcite di cheratina dura che
derivano dall’epidermide:
- sono ancora provviste di nucleo picnotico (che ha subito
apoptosi)
- si fondono con lo strato lucido e con lo strato granuloso
dell’epidermide cutaneo a livello del vallo ungueale (ai lati
dell’unghia)
- al di sotto dell’unghia rimangono solamente gli strati
germinativo e spinoso dell’epidermide.
b. Epiteli secernenti (ghiandole)
GENERALITA’.
La secrezione è una delle caratteristiche più complesse delle cellule
eucariotiche:
- è l’elaborazione di particolari sostanze che, dopo essere state
immesse nel microambiente vengono utilizzate da altre cellule
o dall’organismo
Nonostante molti tipi cellulari elaborano sostanze specifiche che
vengono secrete nel mezzo circostante, il titolo di cellule secernenti va
a quelle cellule che nel corso della differenziazione si sono altamente
specializzate per la funzione secretoria.
La secrezione è un procedimento molto complesso che richiede
l’intervento di tutte le strutture interne di una cellula:
- RER e REL
- Mitocondri
- Apparato di Golgi,
- Nucleo e nucleolo
- Ribosomi
- Lisosomi
La secrezione, in base alla frequenza con cui viene emessa e al tipo di
stimolo che la attiva è distinguibile in:
- continua: il secreto viene rilasciato appena prodotto, senza
essere accumulato.
- Discontinua: il secreto, dopo essere stato prodotto, è
immagazzinato in granuli, che vengono rilasciati in seguito a
precisi stimoli ormonali o nervosi.
Le fasi della secrezione sono:
1) assunzione di materiale da liquidi interstiziali
2) elaborazione di materiale all’interno della cellula
3) rilascio del materiale elaborato.
Il secreto può essere di natura differente, a cui fa riscontro uno
sviluppo di precisi organuli all’interno della cellula secernente:
- lipidica (steroidea): presentano un notevole sviluppo del REL e
dei mitocondri
- glucidica:
15
-
glicoproteica: le cellule hanno un voluminoso complesso del
Golgi,
proteica: si ha un RER notevolmente sviluppato.
Uno dei tipi di secrezione più studiati è quello delle cellule acinose
del pancreas:
- producono i granuli di zimogeno, contenenti gli enzimi digestivi
propri del succo pancreatico
- si sono studiati con tecniche di marcatura con amminoacidi
radioattivi.
- Si è visto che in 5 minuti l’amminoacido si incorpora nella
proteina di secrezione, dopo 12 minuti viene espulso.
Membrana dei granuli di zimogeno è particolarmente ricca di
un lipide affine alla lecitina, la lisolecitina, che è in grado di
aprire dei varchi nel plasmalemma
- più granuli possono anche incolonnarsi e formare un canale,
attraverso il quale viene espulso il secreto di tutti i granuli
mediante una sola fessura nella membrana plasmatica.
ORIGINE E DIFFERENZIAMENTO
GHIANDOLE ESOCRINE
CLASSIFICAZIONE
Le ghiandole esocrine si possono classificare in base a criteri
differenti:
- numero delle cellule: ghiandole unicellulari e pluricellulari
- sede in cui si trovano: intraepiteliali o extraepiteliali, queste
divise in parietali o extraparietali
- forma dell’adenomero: tubulare, alveolari, acinose,
tubuloalveolari, tubuloacinose
- ramificazione dei dotti escretori: semplici, ramificate, composte
- modalità di emissione del secreto: olocrine, apocrina,
merocrine.
Le ghiandole merocrine possono essere classificate in base alla natura
del secreto in:
- ghiandole mucose
- ghiandole sierose
- ghiandole miste.
Le ghiandole vengono distinte in:
- ghiandole esocrine: sono provviste di un dotto escretore, che
veicola il secreto in cavità comunicanti con l’esterno.
- Ghiandole endocrine: non possiedono alcun dotto escretore,
ma rilasciano il secreto all’esterno nel microambiente, per poi
essere assorbito dai vasi sanguigni.
GHIANDOLE UNICELLULARI
Tutte le cellule secernenti di questo tipo hanno origine da cellule
epiteliali, poi differenziatesi. Le cellule differenziate si spingono nel
connettivo sottostante sottoforma di cordoni o tubuli:
- alcune restano a contatto con l’epitelio che le ha generate,
formando un tubulo che diverrà il dotto escretore
- altre perdono contatto con l’epitelio e diventano ghiandole
endocrine.
Sono dette mucipare, poiché secernono muco, il cui costituente
principale è dato dalle mucine:
- glicosamminoglicani
- glicoproteine
- proteoglicani
Sono le cellule caliciformi mucipare, che sono intercalate negli epiteli di
rivestimento delle vie digerenti o delle vie respiratorie:
- sono cellule singole, secernenti di per sé, che costituiscono da
sole una ghiandola
Il muco è un importante mezzo di protezione per le superfici
intraepiteliali.
Le cellule epiteliali differenziate in cellule secernenti costituiscono il
parenchima delle ghiandole (endocrine o esocrine).
16
La cellula caliciformi mucipare presenta una forma a calice, con un
piede più stretto della superficie apicale, la quale presenta una
sommità più ingrossata:
- alla base della cellula si trovano il nucleo, profili di RER e
mitocondri
- al di sopra del nucleo è presente un reticolo di Golgi molto
sviluppato
- nella restante porzione superiore sono presenti i granuli di
mucinogeno, disseminati tra elementi citoscheletrici.
All’uscita dall’apparato di golgi, i granuli sono più compressi, ma man
mano che salgono assorbono acqua e formano il muco, che viene
liberato all’uscita dalla cellula nella porzione apicale.
GHIANDOLE PLURICELLULARI
1) Classificazione in base alla loro sede
Raramente le ghiandole sono situate nello spessore di un epitelio di
rivestimento. Quando accade si dice che sono ghiandole
intraepiteliali:
- sono per lo più ghiandole alveolari semplici,
- sono localizzate in distretti anatomici come l’epitelio delle cavità
nasali e in alcuni tratti dell’uretra maschile
Quando le ghiandole si trovano all’esterno degli epiteli sono dette
ghiandole extraepiteliali e si distinguono in:
- ghiandole parietali: si trovano nella parete dell’organo a cui
appartengono, situate nella lamina propria o nella sottomucosa.
Sono ad esempio le ghiandole esofagee, tracheali, gastriche e
intestinali
- ghiandole extraparietali: sono ghiandole più voluminose che
non sono accolte nella parete dell’organo dove sbocca il suo
dotto escretore. È l’esempio del fegato, del pancreas e delle
ghiandole salivari maggiori.
2) Organizzazione delle ghiandole pluricellulari extraparietali
Nelle ghiandole esocrine extraparietali, la parte del cordone della
ghiandola che si immerge nel connettivo sotto l’epitelio di rivestimento
si divide in cellule secernenti che costituiscono l’adenomero, ovvero la
porzione secernente della ghiandola.
Le cellule che invece sono chiamate a convogliare gli adenomeri con
la lamina epiteliale superficiali sono cellule epiteliali di rivestimento
anch’esse, e si convogliano in un sistema di dotti che porta i secreti in
superficie.
Una ghiandola esocrina è costituita da due porzioni:
- adenomero: la porzione secernente, che forma una cavità
centrale detta lume, in cui le cellule riversano il secreto.
- Cellule di rivestimento: sono cellule epiteliali che delimitano le
superfici del lume e del sistema di dotti.
Quando una ghiandola diventa di dimensioni rilevanti non è più
sufficiente la componente epiteliale per mantenere la struttura, ma
entra in gioco anche la parte connettivale.
Le ghiandole complesse, dunque, possiedono due strutture:
- parenchima: costituito dagli elementi di origine epiteliale
(adenomeri e dotti escretori)
- stroma: elementi di origine connettivale, con funzioni trofiche e
di sostegno
Le ghiandole composte sono avvolte da una capsula connettivale, da
cui dipartono dei setti connettivali che dividono la ghiandola in vari
lobi.
Anche gli stessi lobi sono delimitati da ulteriore connettivo che lo
separano in lobuli, che sono ulteriormente divisi da connettivo fino a
rivestire i singoli adenomeri.
17
Il connettivo che delimita i lobi e i lobuli porta con sé vasi sanguiferi,
vasi linfatici e nervi, che permettono al sistema nervoso e al sistema
vascolare di essere in contatto con le cellule secernenti:
- i vasi sanguigni apportano le sostanze trofiche alle ghiandole
- i nervi regolano l’attività secretoria
L’organizzazione in lobi, lobuli e adenomeri, determina la formazione di
dotti escretori di vario genere, che sono distinguibili in base alla
morfologia degli elementi cellulari che li costituiscono.
Nelle ghiandole sierose di grosse dimensioni (pancreas e parotide)
ogni dotto che esce dall’adenomero confluisce in un dotto di
dimensioni maggiori, il quale si fonde con altri dotti e via fino ad
arrivare al dotto escretore principale della ghiandola.
3) Classificazione in base alla forma degli adenomeri
Le ghiandole extraepiteliali possono essere classificate anche in base
alla forma dei loro adenomeri:
- tubulare: l‘adenomero delimita una sorta di tubo
- acinose: le cellule formano una sorta di adenomero sferico, ma
con un lume molto ristretto.
- Alveolare: l’adenomero forma un sacculo sferico con un lume
ampio.
Quando la ghiandola è costituita da un solo adenomero è detta
semplice (alveolare, tubulare o acinosa).
Nelle ghiandole tubulari semplici se il dotto escretore è avvolto su sé
stesso si parla di ghiandola tubulo-glomerulare.
Quando due o più adenomeri (acinosi, alveolari o tubulari)
confluiscono in un unico dotto si parla di ghiandola ramificata.
Se in presenza di un solo dotto confluiscono ghiandole di tipo
differente si chiama:
- tubuloalveolare: la ghiandola in cui in un dotto confluiscono
un’adenomero tubulare e uno alveolare
-
tubuloacinosa: una ghiandola in cui in un solo dotto fluiscono
un adenomero tubulare e uno acinoso
Le ghiandole tubuloalveolari o tubuloacinose si dicono ramificate se si
è in presenza di un solo dotto escretore, composte se confluiscono in
più dotti escretori.
Anche quando adenomeri differenti con i loro dotti escretori
confluiscono in un dotto maggiore (o in più ramificazioni) si usa dire
che la ghiandola è una ghiandola composta.
Le ghiandole alveolari semplici sono tipicamente le ghiandole
cutanee degli anfibi. Nell’uomo sono presenti solo poche di queste
ghiandole nell’uretra maschile e nella mucosa nasale
Le ghiandole acinose semplici comprendono le ghiandole sebacee,
ovvero le ghiandole dei peli che elaborano un secreto di tipo lipidico.
Le ghiandole tubulari semplici sono le comuni ghiandole sudoripare
e le ghiandole intestinali e gastriche degli epiteli di rivestimento.
Le ghiandole tubulari ramificate hanno una massima
rappresentanza nelle ghiandole piloriche, ma possono essere presenti
in alcune ghiandole sudoripare.
Le ghiandole acinose ramificate sono le ghiandole sebacee e le loro
annesse ghiandole tarsali. Di questo tipo sono anche le ghiandole
salivari minori.
Ghiandole tubulari composte sono rappresentate dalle ghiandole
cardiali e duodenali di Brunner e le ghiandole sierose di Ebner,
annesse ai calici gustativi, oltre che le ghiandole lacrimali.
Le ghiandole tubuloalveolari composte sono presenti nella prostata
e costituiscono la ghiandola mammaria.
Le ghiandole tubuloacinose composte, infine, sono le ghiandole
salivari maggiori e il pancreas.
18
Il fegato ha una struttura tutta particolare, talora definita labirintica, e
produce la bile.
4) Classificazione in base alle modalità di emissione del
secreto
In base alla modalità di emissione del secreto le ghiandole si dividono
in:
- olocrine
- apocrina
- merocrine
Le ghiandole olocrine sono costituite da cellule che vengono
eliminate in toto durante la secrezione insieme al secreto. La ghiandola
viene poi ricostruita da uno strato di cellule staminali presenti sulla
membrana basale.
L’esempio più calzante di ghiandole olocrine è rappresentato dalle
ghiandole sebacee, ghiandole di tipo acinoso, semplici o ramificate:
- l’epitelio degli acini si presenta stratificato
- su una membrana basale sono presenti numerosi strati di
cellule che evolvono dalla membrana basale verso il lume
Lo strato più profondo è formato da cellule cubiche con un nucleo
sferico e centrale, ed è lo strato germinativo, in cui le cellule si
riproducono per mitosi.
Progressivamente le cellule:
- migrano verso il centro dell’acino
- aumentano di volume caricandosi di gocciole lipidiche
- presentano organuli in via di degenerazione
Infine, mentre il nucleo va in picnosi (apoptosi), le gocciole lipidiche
occupano quasi l’intero volume:
- la cellula è trasformata in una massa globosa con alto
contenuto lipidico
- viene degenerata ed espulsa
Lo strato germinativo della membrana basale assicura la presenza di
nuove cellule in superficie.
Le ghiandole sebacee:
- non sono vascolarizzate
- hanno molte terminazioni nervose.
Le ghiandole apocrina sono cellule che nel corso dell’espulsione del
secreto perdono una porzione estesa di citoplasma, ma possedendo
ancora il nucleo, vengono rigenerate.
Un esempio di ghiandole a secrezione apocrina sono le ghiandole
mammarie.
La secrezione merocrine è la più comune. Essa non comporta
l’alterazione dell’integrità della cellula.
Un particolar tipo di secrezione merocrine è la secrezione eccrina,
nella quale vengono liberate soluzioni di elettroliti, come ad esempio
nel sudore.
In base alla natura del secreto, le ghiandole merocrine vengono
classificate in:
- ghiandole sierose
- ghiandole mucose
- ghiandole miste (sieromucose)
Le ghiandole sierose sono ghiandole di tipo tubulo-acinoso ed
elaborano un secreto chiaro e fluido contenente enzimi.
Il lume dell’adenomero sieroso è poco evidente, si estende dalle
porzioni apicali delle cellule mediante canalicoli intercellulari.
La cellula sierosa presenta la forma di una piramide tronca:
- il nucleo è tondo e situato nella porzione basale della cellula
- il citoplasma è generalmente basofilo, ma presenta numerosi
granuli acidofili nella porzione apicale
19
-
-
il RER è composto da numerose cisterne parallele che
occupano l’intera porzione profonda del citoplasma
l’apparato di Golgi è al di sopra del nucleo ed è molto esteso.
Dal suo versante trans si distaccano le vescicole granulari che
contengono gli enzimi
le vescicole distaccate dall’apparato di Golgi si trasformano in
granuli di zimogeno, che fondendosi con la membrana
plasmatica estromettono il siero enzimatico nel lume dell’acino
o del tubulo.
Ghiandole sierose sono riscontrabili:
- pancreas esocrino
- ghiandole salivari maggiori
- parotide
- in alcune ghiandole mucose (gastrica, intestinale, respiratoria)
Le ghiandole mucose producono un secreto denso, la mucina, che
idratandosi costituisce il muco.
Le cellule mucose delimitano un lume più ampio rispetto alle sierose e
sono caratterizzate da:
- nucleo schiacciato, piccolo, scuro localizzato nella porzione
basale della cellula
- citoplasma chiaro e vacuolizzato
- la basofilia è molto meno intensa rispetto alle cellule sierose.
La morfologia delle cellule mucose varia notevolmente in relazione alle
fasi in cui una cellula si trova. Il RER, ad esempio:
- è molto sviluppato nelle cellule che stanno preparando il
secreto
- è pressoché assente o molto rimpicciolito nelle cellule che
contengono granuli di secrezione.
Lo stesso avviene per l’apparato di Golgi:
- sviluppato e attivo nella fase secretoria
- molto ristretto quando la cellula è piena di granuli.
La maggior parte dei granuli mucosi è composta da una matrice
omogenea, talvolta con un materiale flocculare pi o meno denso.
Quando sono presenti i microvilli sulle superfici apicali delle cellule
sono sparsi e molto piccoli.
Le ghiandole miste sono ghiandole propriamente sieromucose, in
cui talvolta predomina la parte mucosa e altre volte quella sierosa.
Sono frequenti particolari strutture in cui le cellule sierose si
dispongono all’esterno delle cellule mucose formando una semiluna
detta semiluna di Giannuzzi:
- in realtà le cellule sono disposte a coppa
- il secreto delle cellule sierose passa attraverso le superfici di
contatto delle cellule mucose.
L‘emissione del secreto delle cellule mucose e sierose avviene
nella modalità con cui avviene la secrezione negli acini pancreatici,
ovvero con la formazione di granuli di zimogeno o di muco che si
possono incolonnare tra loro e secernere il contenuto mediante la
rottura del plasmalemma.
Le cellule sierose sono implicate nella sintesi, nel trasporto e
nell’accumulo di sostanze proteiche, in molti casi enzimi o
glicoproteine.
Le cellule mucose, producono per lo più glicosamminoglicani (GAG) o
proteoglicani, sintetizzati a livello del Golgi.
5) Cellule mioepiteliali
In alcuni tipi ghiandolari, si trovano, tra lo strato epiteliale e le cellule
secernenti dell’adenomero, delle cellule che sono molto simili ad
elementi muscolari lisci, dette cellule mioepiteliali o a canestro:
- i loro prolungamenti formano una specie di canestro che
avvolge gli elementi secernenti.
- Talvolta si trovano anche in presenza dei dotti escretori
20
-
Il loro compito è quello di favorire la progressione del secreto
verso i dotti escretori
Sono cellule diposte con il loro asse maggiore parallelo a quello del
condotto escretore, collegate tra loro mediante desmosomi, e alla
lamina basale mediante emidesmosomi.
In prossimità del nucleo l’apparato del Golgi è poco sviluppato, mentre
sono presenti notevoli miofilamenti che corrono nella parte più
profonda:
- sono presenti microtubuli perpendicolari ai miofilamenti
- la contrazione delle cellule mioepiteliali accelera il flusso del
secreto e il suo scorrere nei dotti
Nell’uomo si trovano:
- associate agli adenomeri delle ghiandole sottomandibolari,
delle parotidi, sottolinguali
- nei dotti delle parotidi e delle ghiandole sottomandibolari
- nelle ghiandole salivari minori
- nelle ghiandole sudoripare
- nelle ghiandole mammarie.
Nelle ghiandole mammarie, le cellule mioepiteliali risultano più spesse
ed attive, creando una rete contrattile molto funzionale in sede di
allattamento.
Gli ormoni sono di natura:
- oligopeptidica
- proteica
- glicoproteica
- steroidea
- lipidica
- amine biogene o catamine
Gli ormoni di natura proteica hanno i recettori sulla membrana delle
cellule bersaglio.
Gli ormoni steroidei hanno invece recettori presenti nel citoplasma,
meccanismo che permette al complesso ormone/recettore di entrare
nel nucleo e influenzare l’attività genica.
La concentrazione plasmatica degli ormoni è molto bassa e si aggira
intorno a 10-7/8M.
Una volta raggiunto l’organo bersaglio, un ormone può agire in
maniera differente, tra cui:
- può indurre la produzione di proteine o enzimi
- può indurre la produzione di altri ormoni (sono detti
tropoormoni)
Ad esempio l’ormone ipofisario THS, una glicoproteina ipofisaria che
stimola tireociti alla produzione di T3 e T4, i due principali ormoni
ipofisari.
GHIANDOLE ENDOCRINE
Le ghiandole esocrine non possiedono dotti escretori e riversano il
secreto (gli ormoni) nel torrente circolatorio:
- gli ormoni agiscono su organi situati anche a notevole distanza
dalla ghiandola, detto organi bersaglio
- sono capaci di regolare l’attività metabolica dei vari organi.
L’apparato endocrino è costituito da organi o gruppi di cellule che
hanno la capacità di sintetizzare ormoni.
Mentre alcuni ormoni (es. quelli tiroidei) agiscono su larga parte
dell’organismo, altri hanno solamente pochi organi bersaglio.
Per dare una precisa descrizione morfologica, le ghiandole endocrine
possono essere classificate in base a:
- organizzazione strutturale della ghiandola
- organizzazione ultrastrutturale delle popolazioni cellulari che
prendono parte.
21
ORGANIZZAZIONE STRUTTURALE.
Nelle ghiandole endocrine che costituiscono organi distinti, le cellule
secernenti endocrine sono organizzate in:
- cordoni solidi o gruppi cellulari (nidi), come nel caso dell’ipofisi,
della parotide, del surrene, epifisi
- vescicole chiuse come ad esempio i follicoli tiroidei.
-
ampliare la superficie di contatto con la rete vascolare
conservare gli ormoni steroidei in un deposito.
IPOFISI
L’ipofisi, o ghiandola pituitaria è una piccola ghiandola situata
all’interno del cranio nella fossa ipofisaria dell’osso sfenoide.
Nel contesto di altri organi o ghiandole esocrine possono trovarsi sotto
forma di:
- gruppi ben delimitati in una ghiandola esocrina (isole di
Langerhans nel pancreas)
- cellule singole o a piccoli gruppi immerse nel connettivo
(ghiandola interstiziale del testicolo o dell’ovario)
- cellule endocrine singolarmente disperse in tessuti epiteliali di
rivestimento o secernenti esocrini (sistema endocrino diffuso).
Produce ormoni che stimolano le più disparate funzioni e influenzano
le attività di molte altre ghiandole endocrine.
Le ghiandole a cordoni solidi presentano cordoni o nidi di adenomeri
con una esile trama connettivale e riccamente vascolarizzati:
- il tessuto connettivo di basso spessore assicura la coesione e
l’interazione tra le cellule secernenti con una sottile rete di fibre
reticolari
- la vascolarizzazione avviene con numerosi capillari sinusoidali,
che differentemente dai normali capillari ramificati, presentano
un andamento sinuoso, un lume ampio e un endotelio
fenestrato.
L’adenoipofisi consiste di:
- pars distalis (o lobo anteriore): formata da tipi celluladi di
diversa specie che producono ormoni prevalentemente tropici
(regolano l’attività di altri ormoni)
- pars intermedia: nell’uomo è una porzione particolarmente
ridotta, costituita da poche cavità cistiche rivestite di epitelio
prismatico.
- Pars tuberalis: è l’estensione nel cranio del lobo anteriore lungo
il peduncolo ipofisario, composta da pochi strati di cellule
cromofobe.
La rete vascolare si adegua all’andamento delle ghiandole:
- queste possono raggrupparsi in glomeruli
- decorrere parallele
- formare reti tridimensionali
Nelle ghiandole a follicoli chiusi, gli elementi secernenti si
dispongono in un’unica fila, formando la parete di vescicole
tondeggianti, che contengono al loro interno una sostanza chiamata
colloide.
L’ipofisi è una ghiandola suddivisa in due compartimenti:
- adenoipofisi: ghiandola endocrina a cordoni e nidi cellulari di
derivazione ectodermica
- neuroipofisi: formazione neurosecretoria derivata dal
mesoderma encefalico.
1) Adenoipofisi
I vari tipi cellulari sono stati classificati, a seconda delle risposte ai
trattamenti istologici in cellule:
- cromofile
- cromofobe
Le cellule cromofile si suddividono a loro volta in cellule acidofile o
basofile a seconda della colorazione assunta dai loro granuli.
Questa organizzazione è una soluzione che permette di:
22
Le cellule acidofile sono ricche di granuli con un secreto di natura
proteica (PAS-), mentre le cellule basofile sono caratterizzate da un
secreto glicoproteica (PAS+). Le cellule cromofobe sono prive di
granuli.
Le cellule basofile sono rappresentate da differenti popolazioni
cellulari:
- celle gonadotrope (o beta)
- cellule tireotrope
- cellule corticotrope
Cellule acidofile.
Le cellule acidofile costituiscono circa il 40% delle cellule dell’ipofisi,
hanno un diametro di 15-20 µm e contengono granuli acidofili piuttosto
voluminosi.
Sono rappresentate da due principali famiglie di cellule:
- cellule somatotrope o STH cell: cellule di forma tondeggiante
con nucleo sferico e RER e Golgi molto sviluppati. Secernono
l’ormone della crescita (STH) detto somatotropo. I granuli sono
presenti in numero variabile, maturi hanno un diametro di circa
400 nm.
- Cellule mammotrope (LTH cell): Sono elementi oblunghi, che
rappresentano il 15-10% delle cellule ipofisarie. Contengono
cisterne parallele del RER, un grande nucleo e un complesso di
Golgi esteso. Possono avere grandi dimensioni e una forma
piuttosto irregolare.
Le cellule mammotrope, durante la gravidanza, o di trattamento con
estrogeni, le cisterne del RER si ampliano e si riscontra la maggiore
presenza di granuli immaturi.
Infatti, le cellule mammotrope secernono l’ormone luteototropo (LTH) o
prolattina (PRL), che ha come effetto principale la produzione del latte
materno, stimolando la ghiandola mammaria.
Le cellule gonadotrope sono principali responsabili delle
gonadotropine, ovvero degli ormoni FSH e LH. Producono granuli di
piccole dimensioni che contengono sia FSH che LH, il cui rapporto è
regolato da vari steroidi presenti negli apparati anatomici bersaglio.
Nei maschi:
- FSH stimola le cellule del Sertoli alla spermatogenesi
- LH stimola la produzione di testosterone da parte delle cellule
interstiziali di Leyding
Nella donna:
- FSH promuove l’accrescimento del follicolo ooforo e la
produzione di estrogeni
- LH stimola l’ovulazione e la produzione del corpo luteo.
Le cellule tireotrope sono cellule che rappresentali il 5% del totale.
Presentano granuli molto più piccoli rispetto alle altre cellule (100-150
nm) e producono l’ormone TSH.
L’ormone TSH è il principale stimolatore delle cellule dei follicoli tiroidei
degli ormoni T3 e T4.
Le cellule corticotrope o cellule gamma, contengono piccoli granuli
con distribuzione prevalentemente periferica. Rappresentano circa il
20 % delle cellule presenti nell’ipofisi.
Cellule basofile.
Le cellule basofile rappresentano circa il 10-15% delle cellule ipofisarie
e presentano dimensioni maggiori rispetto alle cellule acidofile (20-25
µm) con scarsi granuli basofili e PAS positivi.
Il principale prodotto delle cellule corticotrope è dato dall’ormone
ACTH, che stimola il corticosurrene a produrre ormoni glicoattivi.
Le cellule corticotrope secernono anche più di un ormone, che
appartiene ai derivati dalla sintesi della proteina POMC, prodotta nella
pars intermedia e nella pars distalis:
23
-
MSH, stimolatore dei melanociti
CLIP (peptide corticotropinio-simile)
-lipotrofina
-endorfina.
Cellule cromofobe.
Le cellule cromofobe, nell’ipofisi, sono cellule che non presentano
riscontro a livello immunocitochimico e non assumono colorazioni:
- si ritiene che siano cellule indifferenziate di riserva.
Attività endocrina dell’adenoipofisi.
L’attività endocrina dell’adenoipofisi è regolata da ormoni RH (relasing
ormons) o da prostimoline libere che agiscono sul’adenoipofiis
stimolando al produzione di particolari ormoni.
Si possono anche produrre ormoni inibitori (IH) capaci di interrompere
l’attività di topine ipofisarie.
Questi ormoni sono sintetizzati dai neuroni dell’ipotalamo, migrano
lungo gi assoni in vescicole secretorie e raggiungono il peduncolo della
neuroipofisi.
Raggiunto il lobo posteriore dell’ipofisi vengono liberati ei pressi dei
capillari.
Alcuni granuli neurosecretori possono essere orrevati anche al
microscopio ottico, come ad esempio il corpo di Herring.
Entro i granuli di secrezione, le vasopressine e ossitocine sono legate
a proteine vettrici neurofisine.
La neuroipofisi contiene:
- fibre nervose (assoni amielinici che terminano in prossimità dei
capillari)
- stroma connettivale (connettivo lasso ricco di capillari).
PARATIROIDI
Questi ormoni di attivazione sono prodotti dai neuroni dell’ipotalamo,
inviati tramite l’assone alle giunzioni del circolo portale ipotalamoipofisario, ove vengono rilasciati per neurosecrezione e possono
raggiungere gli adenomeri dell’adenoipofisi.
2) neuroipofisi
La neuroipofisi è un derivato mesodermico. È il territorio di secrezione
degli ormoni sintetizzati da neuroni ipotalamici.
Gli ormoni ipofisari sono:
- ossitocina: stimola le contrazioni della muscolatura uterina al
momento del parto
- vasopressina: ha una azione vasocostrittrice e stimola
l’assorbimento di acqua a livello del rene (funzione diuretica). Il
diabete insipido è dato dalla sua mancata produzione.
Sono ghiandole di piccola dimensione poste sulla parte inferiore e
superiore dei due lobi della tiroide, in posizione posteriore rispetto alla
tiroide stessa.
Sono organizzate in nidi e cordoni, separati da un connettivo lasso
contenente un discreto numero di adipociti. La componente lipidica
aumenta durante lo sviluppo, in modo che i cordoni si presentino in
gruppi cellulari dissociati tra loro.
Le paratiroidi sono formate da due gruppi principali:
- cellule principali: sintetizzano il paratormone
- cellule ossifile: cellule di ruolo non noto con un piccolo nucleo
eterocromatinico e un citoplasma acidofilo ricco di glicogeno.
Le cellule principali si presentano in maniera differente a seconda del
loro stato di attività.
24
Quando le cellule principali sono nella forma in attiva:
- hanno un RER e un apparato di Golgi poco sviluppati
- ricche di glicogeno e lipofuscine citoplasmatiche
Nella forma attiva le cellule presentano elevati profili di RER e del
complesso di Golgi e numerose vescicole di secrezione:
- l’attività delle cellule principali è regolata dagli ioni calcio
presenti in ambiente extracellulare
- la cellula può andare incontro ad un ciclo di attività che
comporta la sintesi e l’esocitosi di paratormone.
Il paratormone agisce su cellule bersaglio che presentano recettori di
membrana localizzate:
- nel tessuto osseo: produce un riassorbimento da parte degli
osteoclasti e una elevazione della calcemia
- a livello del rene: stimola la produzione del 1,25diidrossicalciferolo, metaboliti attivo della vitamina D, che
facilita l’assorbimento del calcio a livello intestinale.
GHIANDOLE SURRENALI
Le ghiandole surrenali sono costituite da due ghiandole endocrine
con origine e funzione differente:
- corticale
- midollare.
Le cellule della zona glomerulare della parte corticale del surrene sono
di piccole dimensioni, poliedriche con membrane interdigitate e unite
tra loro da giunzioni tipo macula adhaerens:
- citoplasma ricco di poliribosomi liberi e profili di REL
- mitocondri con creste di aspetto lamellare
La zona glomerulare è implicata nella produzione di ormoni
mineralcorticoidi (aldosterone), che controllano il metabolismo salino.
La zona fascicolata è la zona più voluminosa della corticale del
surrene, occupa circa l’80%.
Le cellule sono organizzate in cordoni paralleli che presentano ampie
sinusoidi.
La cellula della zona fascicolata ha:
- abbondanti gocciole lipidiche nel citoplasma
- mitocondri tubulari o vescicolari
- REL assai sviluppato
- Membrana plasmatica che presenta introflessioni microvillose
La zona reticolare presenta cordoni cellulari molto ristretti, con celule
più piccole.
Il citoplasma delle cellule della zona corticale reticolare è
maggiormente colorabile rispetto a quello delle cellule di altre zone,
poiché contiene molti granuli di lipofuscine.
Parte corticale.
La corticale del surrene è organizzata in tre zone concentriche,
costituite da cordoni cellulari organizzati diversamente:
- zona glomerulare
- zona fascicolata
- zona reticolare.
La zona glomerulare è la parte più esterna, costituita da cellule
organizzate in cordoni ad anse o a gomitolo, rivestiti da una membrana
basale.
Sia la zona reticolata che quella fascicolata sono atti a produrre:
- ormoni glicocorticoidi (controllano il metabolismo glucidico)
- ormoni sessuali.
Parte midollare.
La parte midollare del surrene occupa a parte centrale della ghiandola
surrenale ed è circondata dalla corticale.
25
È organizzata in cordoni e nidi di cellule, separati da esili stralci di
stroma connettivale reticolare, con numerosi capillari e ampie vene
postcapillari.
Le cellule che compongono la parte midollare sono di due tipi:
- cellule simpatiche gangliari
- cellule cromaffini
Le cellule cromaffini sono innervate da terminazioni simpatiche
pregangliari.
Le cellule della parte midollare del surrene sono di due tipi e
secernono mediante granuli:
- adrenalina.
- Noradrenalina (convertita a partire dalla dopamina tramite
l’enzima dopamina beta-idrossidasi o DBH, contenuto nei
granuli di noradrenalina).
Il rilascio dei granuli avviene per esocitosi in seguito all’impulso
nervoso. I granuli hanno un contenuto di:
- catecolamine (adrenalina e noradrenalina)
- DBH
- Cromatogranine
- ATP
Il sangue che circola nei vasi del surrene, già particolarmente dilatati, è
già carico di glicocorticoidi poiché passa prima attraverso la corticale.
EPIFISI
L’epifisi è una ghiandola il cui parenchima è di origine neuroepiteliale,
organizzato in strutture cordonali.
È costituita di cellule dette pinealociti, che hanno una struttura
dendritica, con prolungamenti che terminano nelle vicinanze dei
capillari.
I pinealociti ricevono stimolazioni dale fibre simpatiche
noradrenergiche, ed in seguito a queste secernono la melatonina.
La melatonina è una proteina che deriva dalla serotonina per ossimetilazione e acetilazione. La sintesi della melatonina è in relazione ai
cicli di luce-buio e sembra possa regolare le ore di sonno:
- in presenza di luce, la retina rallenta la stimolazione dei neuroni
del GCS e quindi la stimolazione dei pinealociti ovvero la
produzione di melatonina
- al contrario, il buio, stimola la produzione di melatonina.
Il rilascio di melatonina avviene:
- sia nel torrente circolatorio
- sia nel liquido cerebrospinale
ISOLE DI LANGERHANS
Le isole di Langerhans sono ammassi di cellule endocrine immerse nel
parenchima esocrino del pancreas.
Le cellule delle isole di Langerhans sono piccole e si presentano in
cordoni separati tra loro da una rete di capillari:
- ogni singolo elemento è disposto in modo tale da essere in
contatto con un vaso.
- Le caratteristiche delle cellule sono proprie di quelle a sintesi
polipeptidica (RER e Golgi ben sviluppati)
L’aspetto caratteristico dei differenti tipi cellulari è dato dai granuli di
secrezione:
- negli isolotti pancreatici sono presenti quattro tipi differenti di
cellule che secernono ormoni diversi
Le cellule alfa sono circa il 20% delle cellule delle isole di Langerhans:
- contengono granuli insolubili in alcol (soluzioni polari) di forma
sferica
- piccoli mitocondri
- poco reticolo endoplasmatico
- apparato di Golgi ben sviluppato
26
Le cellule alfa secernono il glucagone, che eleva la glicemia
aumentando la glicogenolisi epatica.
Le cellule beta sono circa il 70 % delle cellule degli isolotti e
presentano granuli molto variabili per forma e specie:
- nell’uomo e in altre specie i granuli contengono cristalli
romboidali molto elettrodensi
- il reticolo endoplasmatico è meno esteso di quello delle cellule
alfa
- il complesso di Golgi è molto sviluppato
- mitocondri di maggiori dimensioni
Le cellule beta producono l’insulina, una proteina che abbassa la
glicemia aumentando la permeabilità cellulare al glucosio,
specialmente nelle cellule muscolari, adipose e negli epatociti.
Un deficit di insulina può provocare il diabete mellito.
Le cellule delta sono solamente il 10-15% e posseggono granuli di
maggiori dimensioni rispetto alle cellule alfa.
Il prodotto di secrezione delle cellule delta è a somatostatina, che
modula il funzionamento delle cellule alfa e beta.
Le cellule F (PF) sono rare e possono trovarsi anche all’esterno delle
isole.
Hanno granuli elettrodensi con un alone lucido all’esterno, infatti
secernono un polipeptide pancreatico che regola la secrezione di
enzimi da parte delle cellule esocrine del pancreas.
GHIANDOLA INTERSTIZIALE DEL TESTICOLO
Le cellule di Leyding sono cellule che nell’adulto posseggono oltre 20
µm di diametro, con forma generalmente poliedrica, ma talvolta fusata
o allungata:
- sempre in stretto contatto con i capillari sanguiferi
- si trovano in gruppi
le caratteristiche delle cellule interstiziali comprendono:
- le membrane plasmatiche delle cellule di Leyding presentano
piccoli microvilli
- il nucleo è ovale o sferico e presenta uno o più nucleoli
- eccezionalmente possono esservi due nuclei
- citoplasma acidofilo e granulare
- presenza di REL costituito da tubuli ramificati
- in periferia le membrane del REL si dispongono a circolo
intorno a goccioline lipidiche,
- complesso di Golgi esteso
- poco RER e mitocondri con creste tubulari
- sono presenti anche granuli di pigmento e gocciole lipidiche
Le membrane del REL contengono gli enzimi necessari alla sintesi di
androgeni, di natura steroidea:
- testosterone: indispensabile per lo svolgimento della
spermatogenesi e per il mantenimento del differenziamento del
carattere seccale maschile
- FSH: indispensabile per la spermatogenesi, poiché influisce
nelle cellule del Sertoli sulla produzione di una proteina ABP
(action binding protein) che si lega al testosterone e induce la
spermatogenesi
- LH
Sono presenti nelle cellule di Leyding dei cristalli di Reinke, formazioni
particolari di cui non se ne conosce il significato. Aumentano con
l’avanzare dell’età.
La ghiandola interstiziale del testicolo è formata dalle cellule di
Leyding, organizzate a piccoli gruppi disposti nell’interstizio tra i tubuli
seminiferi.
27
TIROIDE
-
È un tipico esempio di ghiandola follicolare, avvolta da una capsula di
connettivo da cui partono innervature che penetrano la ghiandola
trasportando vasi e nervi:
- Dai tronchi principali si distaccano vasi che formano un sistema
linfatico e vascolare nei singoli follicoli.
-
I follicoli hanno un diametro notevolmente variabile e sono costituiti da
epitelio cubico o cilindrico semplice che poggia su una membrana
basale:
- all’interno della cavità follicolare è presente la colloide,
costituita da tireoglobulina.
La parete del follicolo è costituita da due popolazioni cellulari:
- cellule parafollicolari o cellule C
- tireociti.
Le cellule parafollicolari (cellule C) sono una popolazione molto
meno numerosa dei tireociti:
- cellule grandi con nucleo ovale
- contengono granuli densi rivestiti da membrana
- sono a ridosso della lamina basale
- non entrano in contatto con la colloide.
Le cellule C secernono tireocalciotonina, che provoca un
abbassamento della calcemia aumentando il deposito di calcio nelle
ossa (azione opposta a quella del paratormone).
I tireociti hanno nell’uomo una forma appiattita o cubica e presentano
una notevole polarizzazione morfologica:
- Il RER si trova in posizione basale e li inizia la sintesi della
tireocalciotonina.
- La tireocalciotonina viene poi glicosilata all’interno delle
cisterne
- La glicosilazione della tireocalciotonina si completa
nell’apparato di Golgi, posto al di sopra del nucleo
Dal Golg viene rilasciata in vescicole di secrezione che
vengono poi rilasciate nel lume del follicolo
Sul versante apicale della membrana plasmatica si verifica la
iodinazione dei residui di tirosina sulle molecole di calciotonina
La cavità centrale del follicolo è la sede di aumulo della tireoglobulina
iodinata. L’interazione con l’ormone ipofisario TSH porta a una serie di
processi che conducono alla formazione dei 2 ormoni derivati dalla
tireoglobulina:
- tiroxina (T4)
- triiodiotironina (T3)
Il processo che porta alla formazione di T3 e T4 è molto complesso:
- il tireocito fagocita ampie porzioni di colloide
- i fagosomi si incontrano con vescicole lisosomiale contenenti
enzimi che eliminano dalla tireoglobulina gli amminoacidi
iodinati
- il fagolisosoma si sposta dalla regione apicale della cellula a
quella basale
- i due prodotti (triiodiotironina e iroxina) sono rilasciati nello
stroma connettivale da cui entrano nei vasi, quindi in circolo nel
sangue.
Gli ormoni tiroidei hanno ampie funzioni soprattutto in ambio di:
- effetti sullo sviluppo e differenziamento
- effetti metabolici
Tra gli effetti del metabolismo si deve ricordare:
- gli effetti sul consumo di ossigeno nei mitocondri (metabolismo
basale)
Per quanto riguarda lo sviluppo e il differenziamento:
- regolano e controllano le sintesi proteiche influenzando il
tasso di accrescimento istologico
- nell’embrione, la mancata produzione di T3 e T4 comporta un
mancato sviluppo
28
ATTIVITA’ ENDOCRINA DEL RENE
ATTIVITA’ ENDOCRINA DELLE GONADI FEMMINILI.
Oltre alla principale funzione del rene, ovvero la secrezione e
l’elaborazione dell’urina, il rene provvede alla produzione di importanti
ormoni che riguardano:
- eritropoiesi
- regolazione della pressione arteriosa.
I principali responsabili della attività endocrina a livello della gonade
femminile sono:
- i follicoli ovarici, che si trasformano in corpi lutei dopo
l’ovulazione.
- Cellule interstiziali, cellule sparse nello stroma ovarico
Regolazione della pressione osmotica
Nel corso della maturazione, attorno il follicolo è costituito da:
- oocito bloccato nel diplotene della seconda fase meiotica
- le cellule della granulosa circondano l’oocito
- lo stroma connettivale si organizza in teca interna e teca
esterna.
I reni intervengono in maniera molto determinante nella regolazione
della pressione arteriosa:
- quando si verifica un abbassamento della pressione sanguigna
i reni producono un enzima, la renina.
- La renina agisce sull’angiotensiogeno, una proteina plasmatica
prodotta dal fegato, normalmente presente nel sangue.
- L’angiotensinogeno viene così trasformato in un decapeptide,
denominato angiotensina I.
- A livello dei polmoni si trasforma in un octipeptide, chiamato
angiotensina II.
- L’angiotensina II agisce sulla ghiandola surrenale
determinando un aumento della secrezione e della liberazione
dell’aldosterone.
Il rilascio di aldosterone da parte della corticale del surrene permette il
riassorbimento di sodio e di acqua nei tubuli distali del rene:
- consegue un aumento di volume del sangue, quindi un
innalzamento della pressione sanguigna.
Funzione eritropoietica.
I reni intervengono anche nella regolazione della formazione di globuli
rossi (eritrociti) con la produzione di una proteina detta eritropoietina:
- immessa nella circolazione giunge al midollo osseo
- stimola la produzione di eritrociti (eritropoiesi).
La teca interna è formata da cellule che presentano attività endocrina:
- sono stimolati a proliferare dall’ormone FSH, che viene
prodotto a livello della neuroipofisi
- le cellule della teca interna sono stimolate dall’FSH a produrre
ormoni estrogeni, in particolare estradiolo.
L’estradiolo viene sintetizzato in compartecipazione tra le cellule della
teca interna e quelle della granulosa:
- Sotto lo stimolo dell’LH le cellule connettivali della teca
producono testosterone, che però non viene messo in circolo
- Il testosterone è assunto dalle cellule della granulosa, che sotto
la stimolazione dell’FSH lo trasformano, per aromatizzazione,
in estradiolo.
In sintesi la produzione di estradiolo è favorita dalla presenza di
recettori sulle cellule:
- recettore per LH sulle cellule della teca
- recettore per FSH sulle cellule della granulosa.
L’estradiolo controlla:
- sviluppo e mantenimento dei caratteri sessuali femminili
secondari
- sviluppo della ghiandola mammaria
29
-
regolazione del ciclo uterino, inducendo la fase rigenerativa e
proliferativa della mucosa uterina dopo lo sfaldamento della
mestruazione.
Quando il follicolo ovarico è giunto al massimo del suo accrescimento
l’ormone ipofisario LH induce le cellule della granulosa a produrre il
progesterone:
- è uno steroide che provoca la maturazione dell’oocita e quindi
dell’ovulazione
Una volta avvenuta l’ovulazione, le cellule delle teche e della
granulosa formano un corpo endocrino transitorio detto corpo luteo:
- capace di produrre grandi quantità dei estrogeni e
progesterone
Se non è avvenuta la fecondazione:
- il corpo luteo regredisce (corpus albicas) e smette di produrre
ormoni
Se, invece, è avvenuta la fecondazione, il corpo luteo diventa corpo
luteo gravidico e continua la sua attività di secrezione:
- è sostenuto e stimolato dalle gonadotropine croniche della
placenta o HCG
- il progesterone mantiene rilassata la muscolatura uterina e
favorisce il mantenimento dello stato gravidico.
CARATTERI CITOLOGICI DELLE GHIANDOLE ENDOCRINE
Pur con la varietà delle cellule, si possono riconoscere due modelli per
le cellule con secrezione endocrina, a seconda della natura del
secreto:
- polipeptidica
- steroidea
Nelle cellule a secrezione polipeptidica/amminoacidica, si nota:
- sviluppo considerevole del RER
- il complesso di Golgi assume un ruolo importante sia
nell’elaborazione e nel deposito dell’ormone sia nello stabilire la
polarità morfofunzionale alla cellula.
- Presenza di granuli di secrezione estesi.
Nelle cellule con secrezione steroidea si nota:
- notevole sviluppo del REL
- il REL, spesso, si dispone in modo concentrico intorno a
gocciole lipidiche.
- polarità della cellula molto meno evidente
- non si notano depositi apprezzabili dell’ormone
- numerosi mitocondri
- glicocalice e introflessioni microvillose della membrana
plasmatica.
MECCANISMO D’AZIONE DEGLI ORMONI.
All’inizio della gravidanza, il corpo luteo gravidico produce:
- relaxina: ormone che inibisce la contrattilità del miometrio, la
muscolatura liscia uterina
- progesterone: che in questa fase agisce sull’endometrio
(mucosa uterina) per indurre le condizioni ottimali per
l’annidamento della cellula uovo fecondata.
Anche la placenta è un organo endocrino di notevole importanza:
- dopo un certo periodo il corpo luteo gravidico regredisce
- la placenta assume il ruolo di produrre il progesterone.
Gli ormoni sono messaggeri chimici. Per agire o stimolare un
determinato complesso hanno bisogno di legarsi ad un recettore che
può trovarsi:
- sulla membrana plasmatica della cellula bersaglio
- nel citoplasma della cellula bersaglio, che sia capace di
traslocare nel nucleo
I recettori di membrana, quando si legano al ligando, per traslocare il
segnale attivano dei secondi messaggeri all’interno del citoplasma
che siano capaci di regolare l’attività genica o la risposta funzionale.
30
I recettori ormonali generalmente traducono il segnale attraverso
fosforilazione del secondo messaggero, ma possono anche essere
legati a meccanismi di interazione ionica.
Gli ormoni steroidei, invece, passano attraverso la membrana:
- si legano a dei recettori intracitoplasmatici capaci di entrare nel
nucleo
- i recettori stimolati influiscono su determinate sequenze
geniche, agendo come fattori trascrizionali.
Uno dei meccanismi più noti è quello legato alla via cAMP-mediata:
- quando gli ormoni si legano a determinati recettori di
membrana, tramite proteine G si attiva l’enzima adenilatociclasi
- l’enzima converte l’ATP in adenosinmonofosfato ciclico
(cAMP).
- Il cAMP agisce da secondo messaggero, attivando enzimi della
classe delle proteinchinasi, capaci di attivare vie chiave del
metabolismo cellulare.
SISTEMA NEUROENDOCRINO DIFFUSO
L’apparato endocrino e il sistema nervoso sono fondamentali per
l’integrazione funzionale di tutto l’organismo.
Sebbene a livello morfologico e funzionale siano relativamente
indipendenti, presentano delle caratteristiche comuni.
Le peculiarità (differenze) di ogni sistema sono soprattutto a livello
quantitativo, mentre a livello qualitativo si presentano delle
caratteristiche comuni:
- sono entrambi capaci di elaborare e accumulare dei secreti
- le sostanze che secernono sono destinati a cellule bersaglio
sugli stessi o su altri distretti anatomici.
I veicoli utilizzati distinguono il tipo di secrezione:
- emocrina: il secreto viene trasportato nel sangue, caratteristica
delle ghiandole endocrine
- sinaptocrina: il secreto viene trasportato nello spazio
intersinaptico (assone)
- paracrina: modalità con cui il secreto viene recepito da cellule
vicine, dello stesso distretto anatomico.
La secrezione paracrina presenta caratteristiche comuni sia alle cellule
nervose che alle cellule del sistema endocrino soprattutto per la natura
del secreto:
- peptidi e amine biogene
I peptidi e queste ammine sono utilizzate come:
- neurotrasmettitori per le cellule nervose
- ormoni per le cellule endocrine
- ormoni locali per le cellule paracrine
Alcune cellule che, pur non essendo veri e propri neuroni presentano
sia le capacità recettoriali che quelle di secrezione endocrina sono
dette paraneuroni, caratterizzate da:
- presenza di granuli simili a vescicole sinaptiche o di tipo
neurosecretorio
- capacità sia recettoriali che secernenti
- secrezione di neurosecreto e/o peptidi attivi.
Queste cellule, che fanno parte del sistema neuroendorino, sono il
punto di collegamento tra i due sistemi, che rappresentano gli opposti
tra i due sistemi.
Le differenze quantitative riguardano:
- relazioni spazio-temporali nella trasmissione de segnale alle
cellule bersaglio
31
3. Tessuto connettivo
I connettivi con funzione di sostegno sono:
- tessuto osseo
- tessuto cartilagineo
INTRODUZIONE
La peculiarità del tessuto connettivo rispetto a quello epiteliale è
l’elevato contenuto di matrice extracellulare in cui le cellule si trovano
disperse.
È un tessuto di origine mesenchimale, foglietto che nell’embrione
deriva principalmente dal mesoderma ma anche in piccola parte
dall’entoderma e dall’esoderma:
- le cellule mesenchimali presentano movimenti ameboidi
- migrano tra i tessuti epiteliali e si instaurano nelle cavità degli
organi
- le cellule mesenchimali hanno una notevole potenzialità per
quanto riguarda lo sviluppo di tutti i tessuti che ne derivano
Questi tessuti di origine mesenchimale sono denominati connettivi o
tessuti con funzione trofomeccanica, poiché hanno particolari
funzioni, tra cui:
- connettono i vari tessuti tra cui si interpongono
- costituiscono strutture di sostegno per l’intero organismo
- hanno funzioni trofiche
I tessuti connettivi si differenziano in:
- connettivi propriamente detti
- connettivi di sostegno
- connettivi a funzione trofica.
I connettivi propriamente detti sono:
- tessuto connettivo mucoso
- connettivo fibrillare lasso
- connettivo fibrillare denso
- tessuto reticolare
- tessuto elastico
- tessuto adiposo
I connettivi a funzione trofica sono rappresentati da:
- sangue
- linfa
Nonostante l’aspetto morfologico, fisico-chimico e funzionale dei vari
connettivi sia estremamente svariato, questi sono strettamente
correlati, tanto da potersi sostituire uno con l’altro nel corso della
morfogenesi.
In un tessuto connettivo sono quindi sempre identificabili:
- una componente cellulare
- una componente extracellulare.
La componente cellulare è composta da cellule che sono in grado di
sintetizzare la matrice extracellulare, suddivisibili in:
- cellule autoctone: sono cellule che hanno origine nel connettivo
e regolano l’omeostasi del connettivo stesso. Hanno attività
difensive per il connettivo e protettive per il tessuto osseo.
- Cellule non autoctone: cellule che non hanno origine nel
connettivo, ma vi migrano per potenziare le attività di difesa
delle cellule autoctone.
La matrice extracellulare (o sostanza amorfa) è costituita da
molecole eterogenee a seconda del tipo di tessuto ed è composta da
due parti:
- componente fibrillare: con macromolecole organizzate in
strutture filamentose, con una alta resistenza alla trazione,
sono le responsabili della struttura plastica finale dell’organo.
- Componente amorfa (sostanza fondamentale): costituita da
macromolecole fortemente eterogenee a seconda del tipo di
tessuto. Presenta una ottima resistenza alla pressione
32
Le caratterstiche di resistenza alla trazione e alla pressione delle due
componenti extracellulari rendono il tessuto connettivo privilegiato per
le funzioni di protezione e rivestimento dei tessuti degli organi:
- perfetto per essere innervato e vascolarizzato
- può avvolgere le fibre muscolari e unirle nei tendini.
- Deve preservare le popolazioni cellulari che riveste da
eventuali modificazioni irreversibili.
SOSTANZA FONDAMENTALE.
LA MATRICE EXTRACELLULARE DEL TESSUTO CONNETTIVO.
La sostanza fondamentale non presenta al microscopio ottico una
struttura tridimensionale ben definita, ma essa è una rete di
proteoglicani.
Le cellule del tessuto connettivo sono in contatto con una complessa
matrice extracellulare, che è in grado di regolarne le attività. La matrice
è in contatto anche con altre cellule in strutture fondamentali, come ad
esempio la membrana basale.
La matrice extracellulare comporta la coesistenza di due sottostrutture:
- proteine fibrose
- gel acquoso contenente glicosamminoglicani (GAG).
Le proteine fibrose sono le responsabili della resistenza alla trazione
del tessuto e della sua elasticità. Sono rappresentate da:
- collagene
- laminina
- fibronectina
- condronectina
- entactina
- osteonectina/SPARC
La sostanza fondamentale, consente la diffusione dei metaboliti dal
sangue alle altre cellule e delle sostanze di rifiuto delle cellule nel
sangue.
I componenti della matrice sono prodotti dalle cellule del connettivo e
anche da fibrocellule muscolari lisce, dalle cellule dello strato basale
degli epiteli di rivestimento e dalle cellule endoteliali.
La sostanza fondamentale è in complesso sistema colloidale
multifasico di consistenza gelatinosa, formato da:
- una fase disperdente acquosa in cui sono disciolti elettroliti
- una fase dispersa, contenente glicoproteine non strutturali e
proteoglicani
I proteoglicani sono lunghe catene costituite da un filamento proteico
i cui si innestano numerose catene polisaccaridiche, i GAG o
glicosamminoglicani.
Le molecole di proteoglicani sono in grado di formare dei lattici
tridimensionali gelatinosi, la cui presenza di gruppi alcolici e acidi dei
glicosamminoglicani permette la solubilità in acqua:
- il risultato è un gel che ha una forte plasticità, ma anche una
considerevole resistenza alla pressione.
- Si forma una rete tridimensionale capace di legare acqua e
ioni, con la creazione di spazi detti spazi esclusi o domini.
- Si ha quindi la possibilità di regolare gli scambi osmotico con le
cellule degli epiteli.
La rete che si forma funziona come un setaccio molecolare, che
permette il passaggio solamente di molecole di piccole dimensioni:
- la simmetria e la carica di una molecola sono determinanti nella
sua posizione nella sostanza fondamentale
- i fenomeni di diffusione nel liquido dipendono dallo stato
chimico-fisico in cui si trova la sostanza fondamentale.
Le sperimentazioni spiegano infatti che la sostanza fondamentale è un
gel tixotropico, capace di passare da uno stato di gel a uno di sol a
seconda delle sollecitazioni fisiche che riceve, per poi ritornare allo
stato gelatinoso.
33
I vari GAG sono:
- acido ialuronico
- condriotinsolfato
- epron-solfato e eparina
- cheratonsolfato.
L’acido ialuronico ha spesso il compito di legare tra loro queste
proteine:
- è un eteropolimero costituito da residui acidi
- forma legami O-glicosidici di tipo beta con molecole che gli
stanno vicino.
- Controlla la diffusione di sostanze nel tessuto connettivo,
impedendo il passaggio a batteri e sostanze tossiche
- Costituisce il maggior componente dei GAG.
Tutti gli altri GAG devono essere legati ad un core proteico.
SOSTANZA FIBRILLARE
La sostanza fibrillare è composta di proteine che si organizzano in
strutture filamentose.
Queste proteine sono le principali responsabili della resistenza alla
trazione e dell’elasticità della sostanza fibrillare all’interno della matrice
extracellulare del tessuto connettivo.
Il principale componente della sostanza fibrillare è il collagene, una
famiglia di proteine strutturali correlate tra loro. La famiglia delle
proteine collagene è la famiglia di proteine più numerosa della matrice
extracellulare.
Le altre proteine fibrose sono:
- elastina
- fibrillina
- fibronectina
- laminina
Le fibre collagene.
Le proteine collagene sono le proteine più abbondanti negli organismi
dei vertebrati, rappresentando quasi 1/3 delle proteine totali.
I fasci formati da queste fibre di collagene sono distinguibili ad occhio
nudo, anche se hanno dimensioni differenti a seconda del tessuto che
occupano.
Sono fibre molto resistenti alla trazione, con allungamenti
trascurabili.
Il collagene viene rinnovato ciclicamente in un organismo e nella sua
vita può assumere stadi differenti.
Il collagene differisce fortemente dalle altre fibre proteiche per la
grande concentrazione di:
- glicine
- prolina
- idrossiprolina
Il collagene è formato da un insieme di fibrille, ognuna delle quali è
formata da una unità fondamentale detta tropocollagene:
- ogni molecola di tropocollagene è costituita da tre catene con
un migliaio di amminoacidi ciascuna
- gli amminoacidi che formano le catene di tropocollagene sono
un susseguirsi della tripletta glicine-prolina-idrossiprolina per
333 volte.
Si distinguono 2 differenti catene che formano il tropocollagene:
- 1
- 2
Due molecole alfa-1 e una di alfa-2 avvolte a tripla elica formano una
molecola di tropocollagene.
34
Le fibre collagene sono unioni di fibrille che presentano un diametro
compreso tra 1 e 12 µm, a seconda del numero di microfibrille che la
costituisce.
Le fibrille di collagene hanno un diametro di circa 0,2-0,5 µm e
formano le fibre di collagene disponendosi in modo parallelo e
allineandosi secondo la polarità testa-coda.
Le fibre di collagene presentano una bandeggiatura regolare,
chiamata periodo che rappresenta la particolare disposizione
spaziale delle molecole di tropocollagene.
I tipi di collagene.
Esistono tipi differenti di molecole che vengono attribuite alla famiglia
del collagene, che devono tuttavia rispondere a determinate
caratteristiche:
- nello stato nativo deve possedere almeno un dominio a tripla
elica.
- La proteina deve essere in grado di dar vita a strutture
sovramolecolari (fibrille, filamenti, reti filamentose)
- La proteina deve contribuire all’integrità della matrice
extracellulare.
- Deve dunque avere un ruolo strutturale.
Il collagene può essere distinto in differenti famiglie e in tipi differenti.
Il collagene I è la struttura più presente nella matrice, rappresentando
il 90% delle proteine collagene:
- le fibrille sono strutture a tripla elica con parti molecolari legate
covalentemente
- presenta il caratteristico bandeggio
- presente ne tendini, nei legamenti e nell’osso
Il collagene II è composto da fibre di calibro minore, con scarsi legami
nella sostanza fondamentale:
- presente nella cartilagine ialina
Il collagene III è la struttura di supporto degli organi parenchimatosi:
- ha una struttura reticolare
- supporta gli organi linfoidi secondari e il fegato e lo stroma delle
ghiandole.
Il collagene IV è privo di fibre bandeggiate ed è molto differente dai
collageni fibrillari:
- polimerizza formando delle reti che sono di sostegno alle
membrane basali.
- Stabilisce rapporti con la laminina, con il nidogeno (o entactina)
e con i proteoglicani.
Il collagene V è privo di fibre e rappresenta le fibrille del muscolo liscio
e scheletrico.
Assemblaggio e sintesi del collagene.
Il collagene viene principalmente prodotto da cellule chiamate
fibroblasti:
- sono in grado di formare con la sintesi proteica le molecole di
tropocollagene
- il tropocollagene, una volta rilasciato all’esterno polimerizza.
- Si ritiene che il fibroblasto possa intervenire sulla
polimerizzazione delle varie molecole di tropocollagene,
benché questa avvenga al di fuori della cellula.
Anche altre cellule di origine mesenchimale possono produrre delle
molecole di tropocollagene:
- osteoblasti
- condroblasti
- cellule interstiziali di Leyding del testicolo (in età avanzata)
I tempi e le modalità di sintesi del collagene possono essere
sintetizzate in cinque passaggi:
1) trascrizione e traduzione: a livello ribosomiale viene sintetizzato
un precursore del collagene, nominato procollagene.
35
2) Idrossilazione: i residui di prolina e lisina del procollagene
vengono idrossilati in idrossiprolina e idrossilisina.
3) Glicosilzione: l’idrossilisina viene glicosilata all’interno del RER
e terminata nell’apparato di Golgi con formazione di legami
glicosidici
4) Secrezione: il procollagene viene secreto all’esterno della
cellula mediante una vescicola elaborata dall’apparato di Golgi
5) Scissione peptidica: il procollagene viene, all’esterno della
cellula, privato delle estremità peptidiche da entrambi i lati,
giungendo così alla molecola di tropocollagene. I peptidi che
sono rimossi sono detti peptidi di registro e hanno la funzione di
non far polimerizzare il collagene all’interno della cellula.
6) Assemblaggio: si formano i legami specifici tra le varie
molecole di tropocollagene.
La laminina è uno dei componenti principali delle membrane basali
nonché il principale responsabile del legame tra le cellule e la
membrana basale. Si lega a molecole quali:
- integrine (desmosomi)
- collagene di tipo IV
- aparansolfato
FIBRE RETICOLARI.
Sono fibre riconoscibili al microscopio ottico con imprecazione
argentica o sali di metalli pesanti.
Sono fibre di un diametro di circa 0,2-1 µm, formate da fibrille
affiancate del diametro di circa 70 nm, con una periodicità tipica del
collagene.
Le altre proteine fibrose.
L’elastina è il principale componente proteico delle fibre elastiche. Si
presenta in due forme:
- striata
- rilassata
L’elastina è frequentemente presente:
- nel derma insieme al collagene
- nelle fibre elastiche insieme alla fibrillina.
La fibronectina è una molecola complessa che si presenta in tre
forme:
- come proteina plasmatica circolante.
- Adesa transitoriamente alle cellule
- Come fibrille insolubili (aggregati) uniti da ponti disolfuro.
I recettori per la fibronectina sono integrine presenti sulla membrana
plasmatica di alcune cellule.
Infatti, queste fibrille sono costituite da tropocollagene di tipo alfa-1 che
si arrotola a tripla elica. Le eliche si aggregano lateralmente influendo
sull’organizzazione molecolare.
Queste fibre formano reti tridimensionali nello spazio del connettivo e
rivestono tessuto nervoso o ghiandole.
Nello sviluppo embrionale, sono poi destinate a trasformarsi in
collagene di tipo III.
FIBRE ELASTICHE.
Le fibre elastiche sono fibre che si trovano spesso nel tessuto
connettivo associate al collagene. Sono spesso presenti in:
- legamenti
- pareti dei vasi sanguiferi
- nella cute
- nei tendini
- nel tessuto connettivo lasso.
36
Dal punto di vista fisico hanno una notevole elasticità e una
resistenza alla trazione elevata, potendosi allungare fino al 150% della
loro lunghezza riprendendo la forma originaria con deformazione
pressoché trascurabile.
Esteticamente, mentre le fibre collagene presentano una
bandeggiatura periodica, le fibre elastiche non hanno motivi che
permettono di riconoscerle caratteristicamente.
Si possono trovare in varie forme:
- isolate
- in reti
- a lamine: le pareti dei vasi sanguigni sono spesso formate da
lamine di fibre reticolari che si presentano come fenestrate, per
cui son anche dette membrane fenestrate.
Sono resistenti ai succhi gastrici, resistono alle alte temperature e
all’azione di altri agenti chimici:
- l’enzima che permette di digerirle è detto elastasi.
Le fibre elastiche sono formate principalmente da:
- matrice amorfa: che contiene una sostanza enzimatica e
soprattutto elastina, proteine che si legano covalentemente tra
loro a formar reticoli estensibili
- fibrillina: riveste i nodi di elastina e contiene all’interno la
matrice amorfa.
Questi connettivi fibrosi elastici sembrano essere prodotti dai
fibroblasti, tuttavia non è ancora chiaro chi possa produrre fibre
elastiche all’interno di vasi:
- può darsi che l’elastina e la fibrillina siano sintetizzato dalle
cellule muscolari lisce che rivestono i vasi.
MEMBRANA BASALE.
La membrana basale è uno strato sottile di matrice extracellulare che
si trova al di sotto der tessuti epiteliali a cui si legano le cellule non
connettivali.
Tale strato si può trovare:
- nel punto di contatto tra epidermide e derma della cute
- alla base di tutti gli epiteli che tappezzano le cavità interne
(intestinale, digerente, respiratorio, genitale e urinario)
- al di sotto degli endoteli dei capillari
- attorno alle cellule muscolari, alle cellule di Schwann
La membrana basale è costituita da tre strati:
- lamina lucida
- lamina densa
- lamina reticolare (non presente in tutti gli strati basali).
La lamina lucida è una struttura continua, spessa, di aspetto
finemente fibrillare.
La lamina densa è rappresentata da uno strato spesso 30-300 nm
formata da esili filamenti immersi in una matrice amorfa.
Sia la lamina lucida che la lamina densa contengono:
- collagene di tipo IV
- proteoglicani
- GAG
- Laminina
- Entactina
- Fibronectina
- Eparinsolfati
La laminina consente l’ancoraggio delle cellule epiteliali, mentre fibrille
di collagene di tipo VII stabiliscono una connessione con il connettivo
sottostante.
37
La lamina reticolare è uno strato contenente prevalentemente
collagene III, senza la presenza di proteoglicani. È uno strato che già
appartiene al connettivo, non è prodotto dall’epitelio.
Le funzioni principali della membrana basale sono:
- meccaniche di sostegno
- impalcatura in caso di danni all’epitelio
- filtrazione attiva (glomerulare) delle sostanze trofiche immesse
dagli epiteli
- controllo della permeabilità dei vasi sanguigni.
LE CELLULE DEL CONNETTIVO.
Nel connettivo sono presenti differenti tipi di cellule, alcune sono
costantemente presenti, altre vi migrano portate dai vasi sanguigni.
Si possono quindi distinguere:
- cellule autoctone: cellule prodotte e di sede nel tessuto
connettivo
- cellula non autoctone: sono celle di passaggio, trasportate dai
vasi.
Tra le cellule autoctone le principali sono:
- fibroblasti
- macrofagi
- mastociti
- plasmacellule
Vi è presente, normalmente in piccola quantità, anche una cellula che
pare un fibroblasto ma ha estreme capacità contrattili, chiamata
miofibroblasto:
- il miofibroblasto è una cellula che in caso di lesioni si riproduce
e si presenta in gran numero per operare la cicatrizzazione.
Le cellule che invece hanno attraversato le pareti dei vasi sanguiferi
sono:
- cellule adipose
-
linfociti
granulociti neutrofili
granulociti eosinofili
Tutte le cellule che si possono trovare nei tessuti connettivi hanno
origine mesenchimale, derivano ovvero da una cellula
mesenchimale, per poi differenziarsi.
La cellula mesenchimale ha caratteristiche peculliari:
- presenta una forma stellata o fusata
- ha numerose espansioni citoplasmatiche che le permettono di
entrare in contatto con cellule adiacenti e formare maglie di
cellule
- ha capacità fagocitarie
- presenta movimenti ameboidi.
FIBROBLASTI
Sono cellule del connettivo propriamente detto che hanno la capacità
di sintetizzare:
- la matrice fibrillare extracellulare
- alcune molecole della sostanza amorfa (GAG; proteoglicani,
ecc…)
Sono, come tutte le cellule del connettivo, di derivazione
mesenchimale, direttamente dalle cellule del mesenchima.
Una volta che hanno terminato di sintetizzare la matrice extracellulare
perdono l’aspetto basofilo e vengono imprigionate nella matrice
fibrillare, parallelamente alle fibre collagene e elastiche, divenendo
fibrociti.
La morfologia di queste cellule è particolarmente irregolare:
- forma stellata o fusata
- presenti delle introflessioni di membrana
- RER sviluppato e ben visibile
- Mitocondri di grosse dimensioni con creste molto accentuate
38
-
Apparato di Golgi molto ristretto in posizione perinucleare
Lisosomi poco numerosi.
Il nucleo appare ovale e fortemente eucromatico, con
frequentemente un nucleolo ben distinguibile in posizione
centrale.
Si è già affermato che i fibroblasti sono molecole presenti solamente a
livello del connettivo propriamente detto, poiché all’interno degli altri
connettivi vi sono altre cellule specializzate:
- osteoblasti
- condroblasti
- fibrocellule muscolari lisce (formano il tessuto reticolare sulle
pareti dei vasi).
MACROFAGI
I macrofagi sono cellule non autoctone del connettivo, poiché
derivano da una popolazione di leucociti circolanti, detti monociti.
Nel corso del passaggio da monocita (migrato in tessuti connettivi dai
vasi), si ha:
- aumento di volume del citoplasma
- estrusione di espansioni della membrana plasmatica
I macrofagi presentano attività fagocitarie:
- se il macrofago è attivato da un processo infiammatorio ritira i
prolungamenti citoplasmatici e migra nel sito infiammato per
fagocitare varie sostanze
Il loro aspetto può essere molto differente a seconda dello stadio
funzionale:
- se il macrofago è in fase attiva il nucleo è in posizione centrale
e ha forma tondeggiante, con presenza di spiccata
eucromatina. Il Golgi e il RER sono estremamente sviluppati e
si nota la forte presenza di vescicole lisosomiali, la presenza di
microtubuli, filamenti intermedi e microfilamenti di actina.
- Se il macrofago è in fase di quiescenza, non differisce molto
da un fibroblasto.
Se i recettori presenti sulla membrana (opsonine, della famiglia di
fattori del complemento o delle Ig-G) incontrano un batterio
opsonizzate lo fagocitano.
La fagocitosi avviene anche per materiale distrutto, poiché i
fagolisosomi che si vengono a creare possiedono vari enzimi:
- proteasi
- lipasi (non presenti nei granulociti)
- nucleasi
- carboidrasi
I macrofagi possiedono altri tipi di recettori:
- per il mannosio: serve per indicare la necessità di fagocitare
globuli rossi invecchiati.
- Per la fosfatidilserina: la fosfatidilserina è espressa sulle cellule
che sono andate incontro ad apoptosi.
A livello del sistema immunitario, cooperano con i linfociti T e NK nella
produzione di sostanze attivatorie (si stimolano vicendevolmente).
PLASMACELLULE.
Le plasmacellule sono una popolazione non autoctona del tessuto
connettivo, ma la loro presenza frequente è indice dei processi
difensivi che vi si sviluppano.
Le plasmacellule appaiono grandi con:
- nucleo eccentrico con il nucleolo posto al centro
- il materiale cromatinici si dispone a grosse zolle
- il RER è fortemente sviluppato, con cisterne a volume variabile
- l’apparato di Golgi si presenta in una forma più chiara a ridosso
del nucleo.
Lo sviluppo del RER e la continua e sviluppata sintesi proteica fa si
che il citoplasma della plasmacellula sia fortemente basofilo.
39
Le plasmacellule sono cellule impegnate nella sintesi delle
immunoglobuline:
- le immunoglobuline sono una famiglia di glicoproteine dette
anche anticorpi.
- Vengono sintetizzate nel reticolo endoplasmatico rugoso (RER)
- La glicosilazione inizia nel RER e termina nell’apparato di Golgi
- Sono racchiuse in vescicole all’interno della cellula e secrete
alla necessità
Le plasmacellule derivano dai linfociti B:
- per la difesa immunitaria, quando un linfocita B incontra una
sostanza estranea e potenzialmente dannosa per l’organismo,
si trasforma in un plasmablasto.
- In 5 giorni il plasmablasto va incontro a successive mitosi per
almeno otto generazioni, con un RER sempre più sviluppato.
- Le cellule nate per mitosi son le plasmacellule, che hanno la
possibilità di produrre le immunoglobuline
- Quando hanno prodotto abbastanza Ig, cessano la sintesi.
Ogni clone di plasmacellula è in grado di produrre un solo anticorpo
specifico.
MASTOCITI
I mastociti, o cellule granulose basofile, sono cellule ampiamente
distribuite nel tessuto connettivo, spesso situate in prossimità di vasi
sanguiferi.
Sono molto frequenti in:
- Cute e peritoneo
- mucose (canale digerente e respiratorio)
Sono invece scarsamente rappresentati:
- nel sistema nervoso,
- nel tessuto osseo e cartilagineo
Il loro aspetto è fortemente granulare, con granuli molto eterogenei
per forma, dimensioni, densità e molto basofili.
Il RER e il REL sono molto sviluppati, i mitocondri sono frequenti e il
complesso di Golgi è di dimensioni più ridotte. Il nucleo, solitamente
ovoidale, è coperto quasi totalmente dai granuli basofili.
I granuli contengono diverse sostanze, le più importanti sono:
- eparina: è un polisaccaride solfato, legato ad un filamento
proteico. Si presenta come molecola singola. Ha una forte
azione anticoagulante.
- Istamina: è un amminoacido (istidina) decarbossilato da uno
specifico enzima decarbossilasi presente nelle membrane dei
granuli. Ha un forte effetto vasodilatatore, comporta cioè un
aumento della pressione.
- Fattore chemiotattico per eosinofili: producono segnali per
produrre risposte antinfiammatorie anche per i granulociti
eosinofili
- Proteasi neutre.
La funzione dei mastociti è legata alla risposta infiammatoria, con la
liberazione delle sostanze contenute nei granuli:
- la secrezione avviene per complessazione dei granuli (non per
semplice esocitosi), che si incanalano un dietro l’altro a liberare
il proprio secreto.
La degranulazione può essere indotta da stimoli:
- aspecifici
- specifici: è la risposta più frequente, ed avviene in seguito al
riconoscimento di determinati antigeni da parte delle IgE
presenti sulla superficie del mastocita.
Le immunoglobuline E sono prodotte dalle plasmacellule, per poi
legarsi a specifici recettori sulla membrana del mastocita.
I granuli rilasciano:
- eparina: molecola in grado di avere effetto anticoagulante
40
-
-
istamina: vasodilatatore rilasciato dal mastocita in seguito
all’aumento del calcio intracellulare, dovuto all’attivazione
dell’IgE
prostaglandine e leucotrieni: sintetizzati dai fosfolipidi della
membrana plasmatica, hanno un effetto antinfiammatorio
interleuchine: sostanze allergeniche.
Fattori chemiotattico: sono capaci di attivare anche cellule
differenti da altri mastociti, ad esempio i granulociti eosinofili.
CELLULE ENDOTELIALI.
Le cellule endoteliali hanno origine nel mesenchima primitivo, dove
nascono sottoforma di foglietti a rivestire i primi vasi circolatori.
Sono cellule molto appiattite, senza particolari specializzazioni, con un
nucleo posto al centro e a sua volta appiattito.
Queste particolari cellule rivestono i lumi dei vasi sanguigni:
- nei capillari una sola cellula può coprire l’intero diametro,
- in vasi con maggiori dimensioni, più cellule tra loro interdigitate
possono rivestire il vaso.
I capillari fenestrati hanno fessure nel citoplasma che permettono il
passaggio di molecole di piccole dimensioni:
- rivestono i capillari adiacenti a ghiandole endocrine
- quelli del tubo digerente sottodiaframmatico
- nel fegato sono presenti delle fenestrature disposte in gruppi.
Nelle cellule endoteliali sono presenti numerose vescicole di pinocitosi,
che permettono il passaggio di molecole da parte a parte.
In prossimità delle giunzioni vi sono fessure larghe pochi nm, talvolta
riempite da materiale amorfo:
- è permesso il passaggio di piccole molecole
- non è permesso il passaggio a macromolecole
Le cellule endoteliali non rappresentano solamente la barriera che
contiene il flusso sanguigno, ma hanno un significato biologico molto
importante:
- controllano alcuni fenomeni (aggregazione delle piastrine,
fuoriuscita dei leucociti o diapedesi)
- adesione di particolari elementi figurati alle pareti vasali
- sintesi di alcune macromolecole della matrice connettivale.
In virtù del tipo di disposizione delle cellule possiamo distinguere:
- capillari continui: il citoplasma non presenta alcuna
discontinuità, se non dove vi è l’interdigitazione per la giunzione
- capillari fenestrati: il citoplasma è molto sottile, con alcune
sovrapposizioni che danno vita a fessure di piccolo diametro,
spesso separate da diaframma.
Nei capillari continui si possono osservare cellule con un citoplasma
di spessore costante, tranne che nell’interdigitazione a livello della
junction:
- sono i capillari dei polmoni, dei tessuti muscolari, del sistema
nervoso centrale.
41
4. tessuto connettivo propriamente detto
TESSUTO MUCOSO MATURO
MESENCHIMA
È un tessuto che deriva direttamente dal mesenchima e ne ha
morfologia simile.
Il mesenchima può essere considerato l tessuto connettivo
embrionale. Differisce notevolmente dai tre foglietti embrionali
(mesoderma, ectoderma, endoderma) poiché:
- mesoderma, ectoderma, endoderma sono costituiti
prevalentemente di tessuti epiteliali
- il mesenchima è costituito da cellule immerse in una
abbondante matrice extracellulare.
Le cellule del tessuto mucoso maturo hanno un aspetto stellato, piatto
o fusato, immerse in una matrice extracellulare:
- l’abbondante matrice extracellulare è composta da proteoglican
e GAG
- sono rare le fibre elastiche e le fibre collagene sono molto esili.
Il mesenchima primitivo (o a cellule fitte) era un tessuto di cellule fitte
immerso in scarsa matrice extracellulare, che lui stesso produce, fino a
giungere al mesenchima secondario:
- il mesenchima secondario è detto anche a cellule lasse, poiché
è ricco di matrice extracellulare amorfa
- le fibrille compaiono solo in un secondo tempo.
Le cellule mesenchimale presentano una forma stellata, con
prolungamenti citoplasmatici che permettono la formazione di reti con
le cellule adiacenti:
- possiede mitocondri lunghi
- il nucleo è vacuolare,
- il citoplasma è scarso.
- Possono avere ampie possibilità di differenziamento e anche
una grande capacità proliferativa.
Il mesenchima è un tessuto molle e gelatinoso che occupa gli spazi
interstiziali tra gli organi primitivi:
- ha funzione trofica e di sostegno
La struttura di questo tessuto varia a seconda della localizzazione
morfo-funzionale:
- polpa dentaria: si trova all’interno del dente, ricco di fibrociti
(fibroblasti che hanno completato la sintesi della matrice)
immersi in una matrice con scarse fibre elastiche e scarse fibre
collagene
- uomor vitreo: il tessuto mucoso maturo di trova nell’occhio
- nel funicolo ombelicale: le fibre collagene sono maggiori e
immerse in una matrice abbondante con qualche mastocita e
parecchi fibroblasti di forma allungata.
TESSUTO CONNETTIVO FIBRILLARE LASSO.
Il tessuto connettivo fibrillare lasso è il tessuto connettivo più diffuso
nell’organismo:
- costituisce lo stroma di molti organi
Avvolge la parte parenchimatosa degli organi e ne forma anche la
capsula esterna, formando un telaio in cui l’organo si possa disporre.
Le sue caratteristiche fisiche gli conferiscono flessibilità e elasticità,
che permette agli organi e le altre formazioni anatomiche che lo
sostengono di spostarsi l’una rispetto all’altra.
42
Il tessuto connettivo fibrillare lasso è componente stromale di molti
organi:
- è disposto nello strato sottocutaneo, permettendo una mobilità
ai muscoli e alle porzioni scheletriche sottostanti.
- È posizionato all’esterno del tubo digerente, nell’esofago
- Costituisce la tonaca sottomucosa di alcune porzioni delle vie
respiratorie
- È presente nello stroma degli organi ghiandolari
- Riveste le tonache dei vasi.
- Ecc..
Il tessuto connettivo fibrillare lasso è formato da:
- fibre collagene: decorrono in fascetti intrecciati in maniera
variabile, con uno spessore dai 2 ai 10 µm.
- fibre elastiche: hanno un corso flessuoso, sono meno
abbondanti del collagene
- sostanza fondamentale: è la componente amorfa detta anche
liquido interstiziale. Appare come un gel viscoso, contenente
prevalentemente acido ialuronico.
- Cellule del connettivo: presenta praticamente tutti i tipi cellulari
che possono esservi nel connettivo, oltre ai globuli bianchi che
possono provenire dal sangue.
Le funzioni sono molte:
- sostegno e protezione: le fibre del connettivo contribuiscono
alla resistenza alla trazione e all’elasticità. Avvolgono gli organi
in capsule protettive. Possono anche contenere cellule
adipose, capaci di accumulare lipidi, che hanno una funzione
meccanica protettiva per l’organo attorno al quale si
dispongono.
- Trofica: nel liquido interstiziale e nel reticolo fibrillare si
dispongono i capillari, che penetrano nello stroma degli organi
portando ossigeno e sostanze trofiche e allontanando quelle di
rifiuto. Nel liquido interstiziale passano anche numerose fibre
nervose capaci di portare gli stimoli
- Di difesa: attività aiutata dai mastociti (producono eparina e
istamina) che permette la facogitosi (macrofagi) di sostanze
pericolose e la produzione di anticorpi (plasmacellule)
-
Di riparazione. Contribuisce alla riparazione dei tessuti in
organi in cui le capacità rigenerative dei tessuti sono basse o
nulle. In zone lese, i fibroblasti producono fibre di collagene che
si sostituiscono al connettivo lasso, alle cellule e ai vasi
(sclerosi).
TESSUTO CONNETTIVO FIBRILLARE DENSO O COMPATTO.
Il tessuto connettivo fibrillare denso (o compatto) è costituito
prevalentemente da fibre collagene:
- la matrice amorfa è scarsa
- le cellule sono poche, prevalentemente fibrociti.
La prevalenza della componente fibrosa (collagene) rende il tessuto
particolarmente adatto a resistere alle sollecitazioni meccaniche.
Non sempre il connettivo fibrillare compatto è rivestito da quello lasso:
- si assiste a zone di transizione frequenti e visibili tra i due
tessuti, soprattutto a livello delle tonache proprie e delle
sottomucose degli organi cavi
Il derma della cute rappresenta un caso particolare per quanto
riguarda il connettivo fibrillare compatto:
- il collagene si organizza in fibre di varie dimensioni intrecciate
in vari modi
- vi è la presenza delle fibre elastiche,
- i fasci di collagene continuano direttamente quelli dello strato
sottocutaneo.
Il tessuto connettivo fibrillare denso viene classificato in funzione della
disposizione delle fibre collagene in:
- connettivo fibroso a fibre parallele
- connettivo fibroso a fasci incrociati
- connettivo fibroso capsulare
- connettivo fibroso lamellare.
43
TESSUTO CONNETTIVO FIBROSO A FIBRE PARALLELE.
TESSUTO CONNETTIVO FIBROSO A FASCI INCROCIATI.
Nel tessuto fibroso a fibre parallele, le fibre collagene decorrono tutte
parallele tra di loro:
- ottima resistenza alla trazione e allo sforzo meccanico
applicato parallelamente alle fibre
- Si trova infatti nei tendini e nei legamenti.
Nel tessuto fibroso a fasci incrociati il collagene forma delle lamelle,
costituite di fibre parallele tra loro, che si dispongono incrociate a vari
strati:
- i fibrociti hanno una forma allungata e appiattita, sono disposti
preferenzialmente nel punto in cui le cellule si incontrano.
- Il tessuto fibroso a fasci incrociati è caratteristico dello stroma
corneale.
I tendini sono avvolti da un connettivo denso irregolare che contiene
scarse fibre elastiche:
- dal connettivo fibroso partono piccoli settori di connettivo lasso,
in cui decorrono i vasi e i fascetti nervosi
- le cellule presenti sono i fibrociti, i quali si dispongono in
maniera parallela alle fibre collagene e in fila tra loro.
Presentano delle espansioni citoplasmatiche che si infiltrano
negli interstizi (sono dette cellule alate).
- I tendini hanno una discreta capacità di rigenerazione.
TESSUTO CONNETTIVO FIBROSO CAPSULARE.
Questo tessuto è formato da una trama irregolare di fibre collagene
che avvolge, formando capsule connettivali, gli organi:
- ha caratteristiche simili al tessuto fibroso a fasci intrecciati
(resistenza alla trazione e alla pressione)
- prosegue con il connettivo lasso negli interstizi degli organi.
TESSUTO CONNETTIVO FIBROSO A FASCI INTRECCIATI.
TESSUTO CONNETTIVO FIBROSO LAMELLARE.
Il tessuto fibroso a fasci intrecciati è composto da fibre di collagene
che si intrecciano in tutte le direzioni:
- questa disposizione conferisce sia la resistenza alla trazione
che alla pressione
- sono immersi in una sostanza fondamentale in cui vi sono
anche fibre elastiche
- i fibrociti sono schiacciati o fusati, con prolungamenti.
Il tessuto fibroso lamellare, è formato da fibre di collagene disposte
circolarmente, a formare delle lamelle concentriche:
- immerso in una matrice amorfa in cui sono presenti fibre
elastiche
- è il tessuto caratteristico della capsula di sostegno dei
corpuscoli di Pacini.
La differente orientazione dei fasci di collagene è in relazione alla
direzione dello sforzo che il tessuto compie. In prossimità dei muscoli, i
tendini formano fasci intrecciati per poter resistere alle varie
sollecitazioni in diverse direzioni.
TESSUTO CONNETTIVO ELASTICO.
Sono presenti:
- nel derma cutaneo
- nella tonaca sottomucosa di viscere
- nella sclera ()
- nella tonaca albuginea del testicolo
Il tessuto elastico, connettivo formato prevalentemente da fibre
elastiche. Si riscontra:
- nei legamenti gialli delle vertebre e in quelli vocali
- nel legamento sospensore del pene
- nella parete delle arterie e delle vene
- nella tonaca media delle arterie di grosso calibro.
44
Nelle arterie di grosso calibro, dette anche arterie elastiche, vi sono
lamine di tessuto elastico disposte parallelamente e unite da fasci di
fibre elastiche a decorso obliquo:
- la componente elastica è mista con fibrocellule muscolari lisce
- l’arteria può stringersi e dilatarsi a piacere.
Nei legamenti elastici, le fibre elastiche si dispongono in fasci molto
spessi paralleli tra loro, lungo la direzione di allungamento:
- sono contenute in una trama di collagene che limita
l’allungamenti prima del punto di rottura
- tra loro vi sono poche cellule e scarsi vasi sanguigni.
TESSUTO RETICOLARE.
Il tessuto reticolare è composto essenzialmente da:
- fibre reticolari: sono fibre di collagene di tipo III
- cellule reticolari: posseggono prolungamenti che si agganciano
alle fibre.
Questo tessuto è presente:
- storma di numerosi organi ghiandolari
- stroma di organi linfoidi e midollo osseo
- contribuisce alla formazione dell’interfaccia tra connettivo e
tessuti epiteliali.
Al di sotto degli epiteli, la lamina reticolare (collagene III e collagene I)
è sempre presente tra la lamina basale e il connettivo sottostante di
natura compatta.
Le cellule di questo tessuto sono della famiglia dei fibroblasti:
- elaborano e secernono i materiali che compongono le fibre
reticolari
- scarsa sostanza fondamentale nel tessuto
- ampie ramificazioni citoplasmatiche con le quali avvolgono le
fibre reticolari, a cui sono addossate.
TESSUTO ADIPOSO.
Normalmente, piccole cellule lipidiche solitarie o a gruppetti si possono
trovare nel connettivo lasso. Tuttavia, quando si ha una gran quantità
di cellule adipose organizzate in lobuli si parla di un tessuto
connettivo speciale, quello adiposo.
Il tessuto adiposo ha numerose funzioni:
- isolamento termico
- riserva di materiali energetici
- protezione meccanica
- sostegno e forma di alcune parti del’organismo.
Circa il 50% del tessuto adiposo dell’organismo umano è posto nel
pannicolo sottocutaneo, poiché ha una funzione:
- termoisolante
- protettivo-meccanica.
Il 45% si trova nella cavità addominale, dove forma il tessuto adiposo
interno, mentre il restante 5% è il grasso d’infiltrazione nel tessuto
muscolare, che agevola lo spostamento dei muscoli.
Il tessuto adiposo, in vista della funzione va distinto in:
- tessuto adiposo di deposito: è soggetto all’alimentazione
dell’individuo
- tessuto adiposo di sostegno: è meno soggetto a variazioni
quantitative. Non scompare mai, ma può diminuire in relazione
al dimagrimento.
Nei mammiferi, la classificazione istologica prevede la distinzione in:
1) tessuto adiposo uniloculare o bianco o giallo: è il grasso
dell’uomo adulto, così come della maggior parte dei mammiferi.
2) Tessuto adiposo multiloculare o bruno: è il tessuto adiposo che
è presente nei neonati, quindi è frequente nei bambini e
scompare quasi totalmente in età adulta.
45
TESSUTO ADIPOSO UNILOCULARE (BIANCO O GIALLO)
-
Il tessuto adiposo bianco è costituito da cellule a stretto contatto tra
loro, interposte da una scarsissima matrice extracellulare.
-
Il citoplasma degli adipociti bianchi è pressoché nullo, schiacciato da
un’unica gocciola lipidica di grandi dimensioni:
- il nucleo è posto in posizione periferica e si presenta
schiacciato!
- La membrana plasmatica ha uno scheletro glicoproteico.
- Al di fuori delle cellule la matrice presenta una scarsa
componente amorfa in cui sono immerse fibre reticolari.
tuttavia è contenuta in una rete a canestro formata da filamenti
intermedi di vimentina, che ne regola l’espansione.
Sembra sia il citoscheletro il responsabile del trasporto delle
particelle lipidiche all’interno della gocciola centrale.
Gli adipociti hanno dimensioni molto ampie, con diametri di circa 150
µm, che possono anche essere maggiori.
Si dispongono a formare ei lobuli, divisi da sepimenti connettivali in cui
fluiscono alcuni vasi sanguigni, ma in quantità minore di quanti ve ne
siano nel tessuto adiposo bruno.
Istofisiologia del tessuto adiposo bianco.
Organizzazione morfologica dell’adipocito.
Le cellule del tessuto adiposo richiedono una notevole plasticità, per
poter resistere alle variabili sollecitazioni meccaniche.
Le proteine di membrana si legano al rivestimento glucidico, il quale
permette agli adipociti di aderire alle fibre reticolari e di sostenere i
capillari sanguiferi.
Gli elementi cellulari sono presenti in misura caratteristica e in
relazione al gocciolone lipidico:
- RER: poco rappresentato e ha piccole cisterne nel citoplasma
- REL: abbastanza sviluppato, specialmente nelle cellule che
producono glicogeno.
- Ribosomi: ne sono presenti alcuni liberi tra le membrane del
reticolo endoplasmatico.
- Apparato di golgi: è molto piccolo e presente a fianco al nucleo
- Mitocondri: non sono numerosi ed hanno un aspetto
filamentoso. Si localizzano il più possibile vicino al nucleo.
La goccia lipidica tende sempre ad espandersi a spese del
citoplasma:
- è apparentemente priva di organizzazione interna e
rivestimento esterno
L’organismo umano assume i grassi sottoforma di acidi grassi nel
duodeno:
- la bile organizza in micelle i grassi, che poi vengno attaccati
dagli enzimi lipasi
- Vari enzimi (lipasi pancreatica, colesterolo-esterasi, fosfolipasiA, ecc…) idrolizzano i lipidi a semplici acidi grassi, i quali
vengono assorbiti per micropinocitosi dagli enterociti del
duodeno, che li riconverte in trigliceridi.
- I trigliceridi vengono rivestiti da una proteina e formano i
cilomicroni.
- I chilomicroni si spostano alla base degli enetrociti e vengono
riversati nei vasi linfatici dei villi intestinali.
- Dai vasi linfatici raggiungono il sistema venoso, in cui sono
lipoproteine a densità molto bassa (VLDL)
Nei capillari sanguigni, agiscono le lipasi lipoproteiche, che scindono
gli acidi grassi dai trigliceridi e utilizzano una parte di questi per
l’energia.
I trigliceridi non utilizzati sono assunti dal tessuto adiposo:
- la cellula adiposa è in stretto contatto con la rete vasale.
- Riceve sia i lipidi esogeni, quelli assunti con la dieta,
provenienti dalla demolizione dei trigliceridi alimentari, che i
lipidi endogeni, cioè i lipidi sintetizzati dal fegato.
46
TESSUTO ADIPOSO MULTILOCULARE (O BRUNO).
Gli acidi grassi che entrano nelle cellule adipose sono trasportati dalla
proteina carrier albumina, che funge da trasportatore degli acidi grassi
a livello citoplasmatico.
All’interno dell’adipocita, si ha la riconversione in trigliceridi degli acidi
grassi, sintetizzati dal REL.
La demolizione dei trigliceridi accumulati sottostà ad un importante
controllo ormonale:
- l’attivatore delle lipasi è il cAMP, che viene sintetizzato a partire
da ATP dietro l’attivazione delle adenil-ciclasi di membrana
- le adenil-ciclasi sono attivate a loro volta da precisi segnali di
natura ormonale e neuronale (ormoni ipofisari e noradrenalina)
- anche le ghiandole surrenali, rilasciate epinfrenina e
norepinrenina sono in grado di attivare la lisi dei trigliceridi
degli adipociti.
Il controllo degli adipociti, tra la litogenesi e la lipolisi, è attuato dalla
leptina, una molecola che è in grado di:
- modulare l’appetito
- interferisce tra il legame tra l’insulina e i suoi recettori sugli
adipociti, innalzando il dispendio di energia.
L’adipocito può sintetizzare lipidi anche a partire da carboidrati o da
amminoacidi, in particolari situazioni di carenza energetica:
- l’insulina, regola negli adipociti, l’entrata del glucosio, quindi
l’accumulo di trigliceridi a livello plasmatico.
In sintesi, un adipocito può:
- sintetizzare e scindere trigliceridi
- rispondere in maniera selettiva a stimoli ormonali e nervosi.
- Sintetizzare lipidi a partire da glucosio e amminoacidi in
situazioni di estrema necessità energetica.
Il tessuto adiposo multloculare, a differenza di quello bruno, è
costituito da cellule molto più piccole rispetto al tessuto adiposo
uniloculare. Le cellule si distribuiscono in maniera più o meno diffusa.
Nell’uomo adulto, la presenza di questo tessuto è limitata, si trova
soltanto in alcune zone:
- regioni interscapolari
- sulla regione posteriore del collo
- in zona ascellare
- nei reni.
I raggurppamenti di cellule brune sono riccamente vascolarizzati e
presentano numerose terminazioni nervose (fibre amieliniche
simpatiche).
Le gocciole lipidiche sono piccole e tante (non ve n’è una unica),
disperse in tutto il citoplasma. Il nucleo è in posizione più o meno
centrale, ma comunque mai a ridosso della membrana plasmatica.
I mitocondri sono molto numerosi e possiedono citocromi colorati, che
conferiscono alla cellula un colore bruno. Sono piuttosto luminosi, con
ampie creste regolari.
La membrana mitocondriale interna possiede una specile proteina,
detta termo-genina, che ha la capacità di far entrare i mitocondri
senza che debbano forzatamente passare dal complesso ATPsintetasi:
- si ha un disaccoppiamento della fosforilazione ossidativa
(sintesi di ATP) e la scissione degli acidi grassi.
- L’energia che proviene dal ciclo di Krebs viene convertita in
calore e non in ATP.
Il calore viene ceduto al sangue, che circola nella zona in cui sono
presenti gli adipociti bruni, e da esso, viene diffuso in tutto il corpo.
47
Il neonato ha una maggiore quantità di cellule adipose brune rispetto
all’adulto, che fungono da regolazione termica nei primi mesi di vita.
5. tessuto cartilagineo
INTRODUZIONE
ISTOGENESI DEL TESSUTO ADIPOSO.
Sebbene anche i fibroblasti abbiano capacità di accumulare lipidi, gli
adipociti hanno modi e tempi differenti. Si suggerisce quindi la
provenienza degli adipociti da cellule mesenchimale precursori:
- lipoblasti: inizialmente sono molto simili ai fibroblasti, con
aspetto fusato e poche gocciole lipidiche.
- in seguito si ha la scomparsa del RER, lo sviluppo del REL e
l’accumulo di glicogeno.
- Pian piano le cellule diventano globose e le vescicole
contenenti lipidi si fondono per formarne un’unica, grazie ai
movimenti citoscheletrici, propria dell’adipocita.
La cartilagine, nei mammiferi, è il primo abbozzo di scheletro fetale,
che nello sviluppo viene sostituito dal tessuto osseo per la quasi
totalità.
Rimane cartilagine, nell’uomo, in alcune zone di transizione:
- dischi intervertebrali
- giunzioni intraarticolari (dischi e menischi)
- parte delle coste
- padiglione auricolare
- organi dell’apparato respiratorio.
Il tessuto cartilagineo è costituito da:
- condrociti: cellule del connettivo cartilagineo
- matrice extracellulare.
Il tessuto cartilagineo non è né innervato né vascolarizzato:
- è solitamente rivestito da una capsula detta pericondrio,
formata da connettivo fibroso non particolarmente
vascolarizzato
- il pericondrio manca solamente nella cartilagine articolare.
La matrice extracellulare può essere scarsa o abbondante:
- se è scarsa si hanno tessuti analoghi alla cartilagine, detti
tessuto condroide e tessuto coroide.
- Se è abbondante si ha la cartilagine con le proprietà fisiche che
la caratterizzano.
Tenendo conto della composizione della matrice extracellulare si
distinguono tre tipi di cartilagine:
- ialina
- elastica
- fibrosa.
48
Questi tre tipi di cartilagine possono passare da uno all’altro, con la
presenza di zone di transizione.
CELLULE CARTILAGINEE.
Le cellule del tessuto cartilagineo sono i condrociti, che sono immersi
nella matrice extracellulare, la quale forma una capsula attorno al
condrocita.
Essi hanno una distribuzione e una morfologia differente a seconda di
dove sono situati:
- nella zona profonda: hanno un aspetto globoso e sono
raggruppate in gruppi di 3-5 cellule, derivanti da una sola, detti
gruppi isogeni, o nidi.
- Nella zona subpericondriale: nella zona appena sotto il
pericondrio le cellule si fanno più appiattite e smettono di
raggrupparsi in gruppi isogeni.
La matrice extracellulare è scarsa in prossimità del pericondrio e molto
abbondante nelle zone profonde della cartilagine.
Nelle zone profonde si possono distinguere:
- aree territoriali: sono le aree attorno ai gruppi isogeni
- aree interterritoriali: aree che si interpongono alle territoriali.
Queste due differenti aree sono distinguibili poiché hanno differenti
affinità tintoriali:
- la capsula che avvolge ciascun condrocito è intensamente
basofila. Attorno ai gruppi isogeni si forma quindi un’area
basofila e metacromatica
- le aree interterritoriali sono, nella maggior parte dei casi,
debolmente acidofile.
La lamina che avvolge i condrociti è detta capsula pericellulare, è
molto sottile e costituita d collagene dei tipi IX, X, XI.
La cartilagine è costituita prevalentemente di collagene di tipo II.
I condrociti sono cellule molto idratate, possono essere binucleate e
contengono gocciole lipidiche o di glicogeno:
- la membrana plasmatica ha numerose frastagliature
- RER e poliribosomi liberi sono più o meno sviluppati in
relazione al differenziamento (le cisterne sono più grandi
quando i condrociti sono giovani)
- Il complesso di Golgi è particolarmente sviluppato nei condrociti
giovani
- I mitocondri possono contenere alcuni sali e granuli minerali
- Sono talora dimostrabili lisosomi e altri corpi densi
- È presente un citoscheletro sviluppato di microfilamenti e
microtubuli.
MATRICE CARTILAGINEA.
La matrice extracellulare del tessuto cartilagineo è costituita da:
- fibre collagene II
- componente amorfa di proteoglicani e glicoproteine, con una
piccola porzione di lipidi e lipoproteine
Il grado di idratazione della matrice extracellulare è sempre elevato,
ma varia con l’avanzare dell’età.
Nei tessuti a funzione meccanica il collagene II risulta scarso (38,2%
del peso secco):
- le fibre collagene risultano poco visibili poiché sono coperte
dall’abbondante componente amorfa
- sono sottili e non riunite in fasci
- non presentano il caratteristico periodo
- sono molto sottili e delimitano ampi spazi in cui è presente una
componente amorfa
Il collagene di tipo II presente nella cartilagine non è formato da due
catene alfa 1 e una alfa 2, ma da tre catene alfa 1 di tipo II, poiché
differiscono dalle molecole di tropocollagene presenti nel tipo I:
- è stato riscontrato anche nei vertebrati primitivi un collagene di
tipo simile,
49
-
probabile che il collagene della cartilagine sia rimasto inalterato
nel corso dell’evoluzione.
Il fatto che il reticolo sia sottile è funzionale agli scambi metabolici di
cui necessitano i condrociti, poiché la cartilagine non è vascolarizzata.
L’abbondante componente amorfa è formata da proteoglicani e
glicoproteine, e in quantità minore, da glicolipidi:
- i GAG presenti sono il condroitin-4 solfato e il condroitin-6solfato e l’acido ialuronico.
I proteoglicani (GAG legati ad un asse proteico) si associano mediante
proteine di legame ad una molecola di acido ialuronico, formando
complessi di grandi dimensioni:
- queste macromolecole sono notevolmente idrofile, quindi
regolano l’idratazione del tessuto
- formano un reticolo che funge da spugna molecolare per lo
scambio ionico
- sono responsabili della resistenza meccanica e dell’elasticità.
Questa matrice amorfa si interpone alle reti formate dalle fibre
collagene:
- i proteoglicani appaiono come granuli tondeggianti o stellati, ma
la forma è data da artefatti del processo di inclusione, poiché
questi sono molecole lineari
- hanno un aspetto realmente filamentoso
-
Cartilagine ialina da inoltre sostego ad alcuni organi delle vie aeree:
- naso
- laringe
- trachea
- bronchi
Nel corso dello sviluppo embrionale e dell’individuo si può riscontrare:
- negli abbozzi scheletrici che diventano ossa lunghe e ossa
brevi
- l’accrescimento avviene per la moltiplicazione dei condroblasti
dal pericondrio, cosicché la forma si mantine quella
predeterminata
Nelle sedi in cui svolge specifiche funzioni, la cartilagine mostra
caratteristiche particolari.
CARTILAGINE ARTICOLARE
La cartilagine articolare, è formata da lamine molto levigate in
superficie:
- sono prive di pericondrio, poiché devono consentire lo
scorrimento delle articolazioni senza attriti
I condrociti hanno una forma differente a seconda dello strato in cui si
trovano:
Sia i proteoglicani che il collagene di tipo II sono dei prodotti dei
condrociti.
-
CARTILAGINE IALINA
-
La cartilagine ialina è un tessuto di aspetto traslucido e colore
bianco-azzurro, molto diffusa nel corso dello sviluppo pre e postatale,
ma presente solo in alcuni settori anatomici dell’adulto:
- coste
- setto nasale
cartilagini articolari
-
strato tangenziale: è lo strato confinante con la superficie
libera. I condrociti si dispongono in maniera tangenziale alla
superficie e hanno forma ovoidale
strato intermedio: segue in profondità lo strato tangenziale. I
condrociti si dispongono ad arco, assumendo una forma
globosa
strato radiale: i condrociti hanno ancora una forma globosa, ma
si dispongono in gruppi isogeni perpendicolarmente all’osso.
Strato calcificato: si forma con il progredire dell’età e presenta
una calcificazione della matrice in profondità.
50
CARTILAGINE METAFISARIA.
Ultrastruttura dello strato tangenziale:
- presenti brevi prolungamenti citoplasmatici dei condrociti
- RER e Golgi poco sviluppati
- Rari mitocondri
- Mancanza di filamenti citoplasmatici e di glicogeno.
Ultrastruttura degli strati intermedio e radiale, che corrisponde a quelli
propri della cartilagine ialina:
- frastagliature citoplasmatiche,
- mitocondri visibili
- RER e Golgi più sviluppati.
La cartilagine metafisaria (o di congiunzione o di accrescimento) si
trova nelle ossa lunghe per tutta la durata del loro accrescimento in
lunghezza:
- ha forma di disco interposto tra epifisi e diafisi.
Le fibre collagene si dispongono a rete tridimensionale, che sorregge i
proteoglicani.
Procedendo dalla epifisi alla diafisi si possono scorgere differenti zone:
1) zona delle cellule a riposo: i condrociti hanno uno scarso indice
mitotico e non presentano una orientazione ben definita
2) zona di proliferazione: Le cellule vanno incontro a continue
mitosi e si dispongono in colonne parallele all’asse maggiore
dell’osso. Tra le colonne si ha abbondante matrice
extracellulare. I condroblasti hanno forma appiattita e sono
separati da scarsa matrice.
3) Zona delle cellule ipertrofiche: sono cellule che non proliferano
più, ma iniziano un processo di calcificazione. A differenza
dell’osso, la calcificazione della cartilagine metafisaria ha un
significato di degenerazione
4) Zona delle cellule in degenerazione: è diretto verso il fronte dell
diafisi, presenta cellule in cui la matrice è calcificata.
Le resistenze meccaniche non sono da attribuire al collagene, bensì ai
proteoglicani:
- i proteoglicani si legno all’acqua e possono riprendere la forma
dopo aver subito modificazioni meccaniche;
- con l’età più avanzata diminuiscono acqua e proteoglicani,
quindi la resistenza alla deformazione diminuisce e alcune
deformazioni diventano permanenti.
I condroblasti, a seconda della zona della cartilagine ialina metafisaria
posseggono differenti caratteristiche citologiche, ma anche variazioni
metaboliche:
- l’indice mitotico diminuisce
- aumenta il volume
- sparisce il glicogeno
- compaiono numerosi enzimi
Gli scambi metabolici della cartilagine ialina articolare si realizzano
con:
- liquido sinoviale
- vasi dell’osso subcondrale.
Anche la matrice extracellulare si presenta differente nelle varie zone:
- le fibre collagene diminuiscono con la mineralizzazione
(scompaiono nelle cellule ipertrofiche)
- con l’aumentare delle cellule calcificate si ha un aumento dei
glicosamminoglicani (GAG), che sono in grado di regolare la
deposizione dei sali.
- In prossimità della capsula delle cellule si ha una alta presenza
di matrix vescicle.
Nella matrice extracellulare si rivelano delle differenze che dipendono
dal’età:
- nel feto è presente molta acqua e il collagene II è scarso
- con l’età diminuisce l’acqua, vi è maggiore mineralizzazione e
si ha un aumento delle fibre collagene.
51
CARTILAGINE ELASTICA.
La cartilagine elastica è una cartilagine simile alla cartilagine ialina,
che si presenta di colore bianco-giallastro.
La componente fibrillare della matrice è composta da fibre elastiche e
fibre collagene, che si intrecciano a formare una rete tridimensionale:
- le fibre elastiche sono molto spesse, poiché si intravedono
cordoni di fibre che contengono materiale amorfo.
È presente:
- nel padiglione auricolare e nelle vie uditive esterne
- nelle trombe di Eustachio
- costituisce alcune cartilagini laringee
- costituisce le cartilagini dei bronchioli distali.
La componente amorfa è composta per lo più come nella cartilagine
ialina, con proteoglicani e GAG.
La differenza dalla cartilagine ialina risiede nella matrice extracellulare:
- sono presenti anche fibre elastiche, evidenziabili mediante
colorazioni con orceina
- la percentuale delle fibre elastiche varia in relazione alla sede
in cui si trovano.
La cartilagine fibrosa è di colore biancastro e presenta aspetti
eterogenei a seconda della sede in cui si trova:
- dischi intervertebrali
- labbri glenoidei
- dischi e menischi intrarticolari
- sinfisi pubica
- quando un tendine o un legamenti si inseriscono sulla
cartilagine.
Le fibre elastiche, sottili e scarse nella zona subpericondriale, sono
abbondanti nelle zone profonde:
- si anastomizzano tra loro, formano reti che circoscrivono i
condrociti senza intaccare la capsula
- talvolta possono associarsi in fasci di grandi dimensioni o in
lamine.
Anche la componente amorfa della matrice della cartilagine elastica
è scarsa:
- la basofila si riscontra solamente in prossimità della capsula
che riveste i condrociti
I condrociti sono molto simili a quelli della cartilagine ialina:
- hanno un aspetto globoso e sono avvolti dalla capsula
- sono raggruppati in gruppi isogeni di pochissimi elementi
- le mitosi sono molto rare
- nel citoplasma sono rare le vescicole provenienti dal Golgi
contenenti proteoglicani e precursori delle fibre (es. elastina o
tropocollagene)
CARTILAGINE FIBROSA.
Le fibre collagene della cartilagine fibrosa formano fasci grossolani,
osservabili anche a fresco quando la matrice non è troppo presente,
anche se generalmente è scarsa.
I fasci di fibre collagene sono disposti in maniera differente a seconda
delle necessità meccaniche:
- nei dischi intervertebrali sono disposti in lamelle concentriche
che circondano un setto di tessuto cordoide
- in altre sedi sono intrecciati in maniera irregolare.
Le fibre di collagene sono sostanzialmente formate da collagene di
tipo I, come quelle del tessuto connettivo denso:
- frequentemente il t.conn. denso e la cartilagine fibrosa sono in
continuità.
Nella cartilagine fibrosa non vi è alcun rivestimento pericondrale, a
differenza della cartilagine elastica e di quella ialina (esclusa quella
articolare).
52
I condrociti sono poco numerosi, frequentemente isolati e circondati da
una capsula basofila. Hanno generalmente aspetto globoso, ma sono
presenti anche elementi cellulari simili ai fibroblasti.
CARTILAGINE CELLULARE, TESSUTO CORDOIDE E TESSUTO
CONDROIDE.
La cartilagine cellulare, il tessuto cordoide e il tessuto condroide sono
tessuti assimilabili alla cartilagine per determinate caratteristiche, ma
differiscono da essa per la scarsa matrice extracellulare.
Con la cartilagine hanno i comune:
- mancanza di vasi
- attitudine a svolgere funzioni meccaniche.
Il tessuto cordoide costituisce la corda spinale dei vertebrati, ma nei
mammiferi vi è solamente una scarsa presenza a livello dei dischi
intervertebrali.
Il tessuto condroide, ha caratteristiche molto simili a quello cordoide,
ma presenta cellule molto piccole, turgide, contenenti lipidi e
glicogeno.
Nei mammiferi, il tessuto condroide è permanso solamente:
- in alcuni menischi
- in tessuti di cartilagini minori.
6. tessuto osseo
INTRODUZIONE.
Le funzioni meccaniche, non sono dunque svolte dalla matrice
extracellulare, bensì dalle cellule:
- forma sferica
- aspetto vescicoloso e grandi dimensioni
- sono molto turgide.
Il turgore delle cellule è dato da:
- accumulo di glicogeno non metabolizzabile
- il glicogeno è in grado di trattenere acqua, quindi di conferire
rigidità e plasticità alle cellule
- talvolta al turgore contribuiscono anche lipidi accumulati.
Anche la cartilagine ialina passa, nel suo stadio di differenziamento,
attraverso uno stadio i cui la matrice è molto scarsa:
- nella maggior parte dei casi si trasforma in cartilagine ialina,
poiché i condroblasti producono la matrice
- talvolta invece rimane nello stadio cellulare e viene chiamata
cartilagine cellulare.
Il tessuto osseo è una particolare varietà di connettivo, quindi ha la
componente cellulare e la matrice extracellulare (fibrillare e amorfa).
La peculiarità che differenza il tessuto osseo dagli altri tessuti
connettivi, è data dal fatto che il tessuto osseo presenta un alto grado
di mineralizzazione, che gli conferisce una particolare durezza:
- ha un altissimo grado di resistenza alla pressione
- anche alta resistenza alla trazione e alla flessione.
Il colore del tessuto osseo è giallo-biancastro ed è il principale
costituente delle ossa, che nel loro insieme costituiscono un
impalcatura che sostiene tutto il corpo.
In casi patologici, il tessuto osseo si può formare in sedi anatomiche
non proprie, per metaplasia di altri tessuti connettivi.
All’esame microscopico ha differenti consistenze:
- tessuto osseo compatto
- tessuto osseo spugnoso
53
-
tessuto osseo lamellare.
Le funzioni del tessuto osseo non si limitano a quelle di sostegno
meccanico e protezione:
- il tessuto osseo partecipa all’omeostasi del calcio.
- È un tessuto dinamico e plastico poiché, anche al termine del
suo sviluppo è in grado di modificare la propria struttura.
- È anche sede del midollo osseo, che in parte ha anche
funzione emopoietica.
Esternamente, l’osso è rivestito da connettivo fibroso a fasci incrociati,
il periostio, a eccezione delle cavità articolari che sono rivestite si
cartilagine.
Nel caso delle diafisi delle ossa lunghe, il connettivo fibroso è più
scarso, chiamato endostio.
Gli elementi chimici e strutturali dell’osso sono talmente compenetrati
tra loro che la perdita di una delle componenti non influisce sulla forma
dell’osso.
Gli osteociti, gli osteoblasti e le cellule di rivestimento derivano dalla
cellula mesenchimale, mentre gli osteoclasti nascono dalla cellula
progenitrice monocito-macrofago.
La componente organica della matrice ossea è formata da:
- fibre collagene I
- glicoproteine
- proteoglicani
- lipidi
- enzimi.
La componente minerale è formata da:
- fosfato di calcio sotto forma di cristalli di idrossiapatite, (85%)
- da carbonato di calcio (10%)
- altri sali come fosfato di Mg e fluoruro di Ca
- tracce di Na, K, Sr, Mn, Zn, Cu, ecc…
Il rapporto Ca/P varia durante la vita dell’individuo, ma anche in
relazione alle differenti zone di uno stesso osso.
ORGANIZZAZIONE GENERALE
Nella matrice extracellulare mineralizzata sono presenti delle lacune
da cui partono dei canalicoli (ramificati e non) in cui si trovano osteociti
con i loro prolungamenti.
Come in tutti i tessuti connettivi, ance nell’osso è presente una
componente cellulare e una matrice extracellulare:
- la particolarità dell’osso è che la matrice extracellulare risulta
fortemente mineralizzata
Sono presenti anche altre cavità più ampie un cui passano:
- vasi
- nervi
- midollo osseo.
Nella matrice dell’osso non sono presenti solamente componenti
organiche (fibrille e matrice amorfa di GAG, proteoglicani, ecc…), ma
sono presenti anche delle componenti inorganiche.
A seconda della disposizione in lamelle o meno della matrice
extracellulare ossea si distingue:
- tessuto osseo non lamellare
- tessuto osseo lamellare.
La componente cellulare dell’osso vede differenti tipi di cellule:
- osteoblsti
- osteociti
- osteoclasti
- cellule di rivestimento
54
TESSUTO OSSEO NON LAMELLARE.
Il tessuto osseo non lamellare, a seconda della disposizione delle fibre
collagene può presentarsi:
- a fibre intrecciate
- a fibre parallele.
Il tessuto osseo non lamellare a fibre intrecciate è solitamente lo
scheletro primitivo dei mammiferi (sostituito nello sviluppo da quello
lamellare) e quello definitivo dei vertebrati inferiori.
Nell’uomo adulto permane in alcune zone:
- quando il periostio aderisce strettamente all’osso
- al livello delle inserzioni di legamenti e tendini
- in prossimità di superfici articolari
- ogni volta che si forma nuovo tessuto osseo (per poi diventare
nuovamente lamellare).
Una particolare varietà di questo tessuto è dato dal cemento del dente.
Nel tessuto osseo a fibre intrecciate, vi sono lacune globoso,
mediamente di dimensioni maggiori di quelle del tessuto osseo
lamellare:
- le cavità sono delimitate da trabecole in cui si intersecano fasci
di fibre collagene I che si diparte in varie direzioni
- le cavità contengono vasi, nervi e midollo osseo.
Il tessuto osseo a fibre parallele è presente nei mammiferi in maniera
transitoria:
- persiste nelle zone di inserzione dei tendini, traendo origine
dalla mineralizzazione del tessuto connettivo che li forma
(fibrosa)
- le fibre collagene sono raggruppate in fasci che decorrono con
andamento parallelo
- i fasci lasciano lacune ovoidali in cui si situano gli osteociti ed i
loro prolungamenti
-
sono presenti ampie cavità (dove le lacune confluiscono)
percorse da vasi e nervi.
TESSUTO OSSEO LAMELLARE
Il tessuto osseo lamellare è i tessuto più presente nella vita postatale
dell’uomo.
Le sue proprietà meccaniche sono date da:
- proprietà fisiche della matrice extracellulare
- tendenza della matrice a disporsi in lamelle.
La disposizione delle lamelle è tale da consentire all’osso di avere la
massima resistenza (alla trazione, alla compressione e alla rotazione)
con il minimo impiego di materiale.
In ogni lamella le fibre collagene I decorrono parallele e formano un
angolo con quelle della lamella adiacente. Due lamelle sono unite da:
- fibre collagene prospicenti
- matrice mineralizzata in cui passano le fibre.
Le lacune che si vengono a formare sono di forma ellissoidale con tre
assi:
- sull’asse maggiore, viene a disporsi un osteociti
I canalicoli in cui sono presenti i prolungamenti degli osteociti aprono
la loro strada tra le lamelle, terminando:
- a fondo cieco
- sulle superfici vascolarizzate
- confluendo con altri canlicoli.
Le lamelle, a seconda della loro disposizione, formano tipi di tessuto
osseo lamellare differenti:
- tessuto osseo compatto: le lamelle si dispongono in modo da
formare osteomi concentrici
- tessuto osseo spugnoso: le lamelle costituiscono trabecole che
si intrecciano e si anastomizzano.
55
TESSUTO OSSEO COMPATTO
La differente disposizione delle lamelle dipende dalla necessità di far
confluire gli osteociti in prossimità dei vasi.
TESSUTO OSSEO SPUGNOSO.
Il tessuto osseo spugnoso costituisce:
- la maggior parte delle ossa brevi
- l’estremità delle diafisi
- le epifisi
- la diploe delle ossa piatte
L’orientamento delle trabecole di cui è formato è tale da opporsi, in
ogni formazione ossea, alle sollecitazioni meccaniche cui sono
prevalentemente sottoposte.
Il tessuto osseo spugnoso è formato da strati di lamelle associate in
trabecole e variamente legate tra loro, poste a delimitare spazi
intercomunicanti denominate cavità midollari in quanto occupate da
midollo osseo, vasi e nervi.
Gli osteociti e le lacune presentano una variabilità dimensionale e
topografica:
- dipende dalle differenti velocità di deposizione degli osteoblasti
- il tessuto osseo spugnoso è estremamente irregolare.
Sulle superfici delle trabecole, quindi a tappezzare le cavità midollari,
sono presenti cellule di rivestimento:
- alcuni ritengono che possano anche avere potenzialità
emopoietica.
Il tessuto osseo compatto, forma:
- tavolato profondo e tavolato superficiale delle ossa piatte
- strato superficiale delle ossa brevi e delle epifisi di quelle
lunghe
- diafisi delle ossa lunghe.
L’architettura del tessuto osseo spugnoso è funzionale ad assicurare le
sostanze trofiche a tutte le cellule che compongono tale tessuto, quindi
alla vicinanza dei vasi:
- gli osteociti si dispongono in lamelle concentriche attorno ai
vasi
- vi sono le lacune ossee e i canalicoli
- vi sono veri e propri canali vascolari, che nelle ossa lunghe
hanno andamento parallelo all’asse dell’osso (canali di
Havers) o un andamento trasversale o obliquo (canali di
Volkmann).
La disposizione delle lamelle all’interno del tessuto compatto, sono un
esempio della perfetta organizzazione della struttura in funzione dello
scopo.
In sezione trasversale si possono distinguere vari sistemi di lamelle:
- sistema concentrico (di Havers): è il sistema di lamelle disposte
in modo concentrico a formare l’osteone.
- Sistema delle lamelle interstiziali: disposte negli interstizi tra i
vari osteomi
- Sistema delle lamelle circonferenziali: si può distinguere in
interno (a ricoprire la cavità midollare) ed esterno (sulla
superficie esterna dell’osso).
L’osteone ha una forma pressoché cilindrica, di un’altezza compresa
tra 0,9 e 1,2 mm. È formato da lamelle concentriche che ciscondano
una cavità interna detta canale di Havers, un canale contenente:
- vasi sanguiferi
- fibre nervose amieliniche
56
Le lamelle sono generalmente 10-15, ma vanno da un minimo di 4 ad
un massimo di 24:
- generalmente circoscrivono completamente il canale di Havers
- talvolta però possono avere una forma a semiluna o di falce,
poiché sono rimaneggiate.
Da alcune lamelle si dipartono canalicoli orientati in varie direzioni:
- pochi si spingono tra le lamelle e sono generalmente a fondo
cieco
- i canalicoli che attraversano le lamelle sono lunghi, ramificati e
anastomizzati con altri provenienti da altre lacune.
All’esterno, l’osteone è rivestito da una linea cementante, più
mineralizzata del tessuto che si trova all’interno.
Il sistema di canalicoli e di lacune è sempre in contatto più o meno
diretto con il canale di Havers:
- i canalicoli più vicini terminano direttamente nel canale di
Havers
- i canalicoli più distanti dal centro dell’osteone sono in
connessione con canali che terminano nel canale di Havers.
La lamella ciclica più interna è la più giovane, mentre quelle esterne
sono le più vecchie.
Sulla base di osservazioni al microscopio ottico e quello a luce
polarizzata si può descrivere l’andamento delle fibre di collagene
secondo una teoria tradizionale:
- ogni lamella ha delle fibre inclinate, generalmente di 45°
rispetto all’asse dell’osso che si avvitano ad elica
- la lamella adiacente ad una con andamento destrorso ha un
avvolgimento sinistrorso
- le fibre delle lamelle si incrociano generalmente formando un
angolo di circa 90°
Tuttavia vi possono essere andamenti particolari:
- fibre piane: il collagene si dispone formando un angolo di circa
90° dall’asse dell’osso
- fibre ripide: le fibre sono pressoché parallele all’asse dell’osso.
Si ha anche un modello più recente secondo cui le fibre collagene si
orientano in due direzioni sempre:
- la differenza di colore al microscopio a luce polarizzata sarebbe
data da zone lasse (poche fibre) e zone dense (con più fibre).
Gli osteociti hanno sede sia intralamellare che interlamellare:
- hanno forma di ellissoidi a tre assi, il cui maggiore è parallelo
alle fibre collagene I.
- quello intermedio è parallelo alle superfici delle lamelle
- quello minore è perpendicolare alle lamelle.
Questa particolare connessione favorisce:
- scambi trofici degli osteociti con il canale di Havers
- limitazione della grandezza dell’osteone, poiché le cellule
periferiche ricevono solo per via indiretta, tramite alri canalicoli,
le sostanze provenienti dal canale centrale.
Le lamelle del sistema interstiziale colmano gli spazi che si
interpongono tra gli osteoni e sono tendenzialmente parallele, ma il
loro orientamento può essere differente a seconda dei casi:
- sono rivestite anche loro da una linea cementante
Nella parte esterna e in quella interna alle diafisi non sono presenti le
lamelle del sistema interstiziale, come nella parte intermedia, bensì
sistemi di lamelle concentrici all’asse della diafisi, dette:
- lamelle circonferenziali interne
- lamelle circonferenziali esterne.
Nell’osso, in sezione longitudinale, si può osservare un altro sistema di
canali: i canali di Volkmann. Questi canali hanno un calibro minore di
quelli di Havers e non sono delimitati da alcuna struttura osteonica.
I canali di Volkmann passano anche attraverso la linea cementante
degli osteoni andando a connettersi con i canali di Havers, e hanno un
numero alquanto variabile all’interno di un osso.
57
Solitamente si aprono in presenza del periostio e dell’endostio o dele
cavità midollari. Contengono:
- tessuto connettivo
- vasi sanguigni
I canali del Volkmann hanno un diametro regolare:
- possono presentare ramificazioni
- di frequente si anastomizzano tra di loro
- sono in continuità con i canali di Havers
- terminano a fondo cieco in corrispondenza dell’inserzione con
in tendini.
Il grado di mineralizzazione del tessuto osseo è generalmente
variabile anche nel medesimo segmento:
- di norma le lamelle più vecchie (solitamente quelle interstiziali)
sono le più mineralizzate.
Le tre proprietà fisiche principali di un osso dipendono da differenti
fattori:
- durezza: dipende dalla componente minerale dell’osso
- resistenza alla trazione, flessione e pressione: dipendono
dall’organizzazione lamellare e dalle fibre collagene.
La differente organizzazione delle lamelle (fibre collagene
differentemente orientate immerse in una matrice minerale) permette
di sollecitare ogni lamella con una forza differente, la gran parte delle
quali si scompone per la legge del parallelogramma.
ULTRASTRUTTURA DEL TESSUTO OSSEO: LE CELLULE
Le cellule che compongono il tessuto osseo sono:
- osteoblasti (cellule progenitrici che andranno a costituire le
cellule di rivestimento e gli osteociti)
- osteociti
- cellule di rivestimento
- osteoclasti
OSTEOBLASTI
Gli osteoblasti sono cellule molto voluminose, di forma generalmente
cubica posizionate sulla superficie per ossea (del periostio):
- svolgono una intensa attività osteogenetica
- producono i componenti organici della matrice ossea
- regolano la deposizione della componente inorganica
Nelle sedi in cui l’attività osteogenetica è molto intensa gli osteoblasti
sono frequenti e voluminosi, mentre dove questa non è molto intensa
sono più rari e più piccoli.
Gli osteoblasti hanno un nucleo sferoidale spostato nella porzione
opposta all’area di deposizione:
- nel citoplasma sono presenti numerosi granuli di natura
proteica addossati verso al superficie di deposizione
- il citoplasma è fortemente basofilo.
- Sono frequenti e allineate le cisterne del RER
- Numerosi i poliribosomi liberi
- L’apparato di Golgi è localizzato in sede paranucleare ed è
parecchio sviluppato
- Dall’apparato di Golgi si distaccano delle vescicole che si
fondono tra loro e vengono rilasciate all’esterno della cellula.
Probabilmente contengono i componenti della matrice (matrix
vescicle).
- Numerosi mitocondri
- Un centriolo
- Microfilamenti e microtubuli
- Granuli di glicogeno
- Presentano molti prolungamenti dal citoplasma.
Man mano che si ha la diminuzione della osteogenesi, si assiste alla
diminuzione della basofilia, riduzione dell’apparato di Golgi e riduzione
dei granuli.
Una volta che hanno prodotto tutta la matrice rimangono murati in essa
e si trasformano in osteociti. Quando sono però rivolti verso il periostio
o verso l’endostio si trasformano in cellule di rivestimento.
58
OSTEOCITI
CELLULE DI RIVESTIMENTO
Gli osteociti assumono una forma differente a seconda del tessuto
osseo in cui si trovano:
- nel tessuto osseo spugnoso hanno una forma globoso
- nel tessuto osseo compatto hanno una forma ad ellisse a tre
assi in cui l’asse maggiore segue la direzione delle fibre
collagene.
Le cellule di rivestimento sono cellule che derivano dagli osteoblasti
che si sono inattivati sulle superfici ossee esterne e interne:
- sono fusiformi
- hanno la funzione di mediare gli scambi metabolici di sangue e
liquido interstiziale con i canalicoli e le lacune.
Il corpo cellulare risiede in cavità della matrice denominate lacune
ossee, da cui partono dei sottili canalicoli ramificati, contenenti i
prolungamenti degli osteociti:
- alcuni canalicoli vanno ad anastomizzarsi con quelli di altri
osteociti
- normalmente alcuni canali sfociano in presenza dei vasi,
poiché devono assicurare l’apporto di sostanze trofiche agli
osteociti immersi nella matrice altamente mineralizzata.
- le estremità dei prolungamenti degli osteociti sono uniti
mediante gup junctions (giunzioni comunicanti).
OSTEOCLASTI
Il nome osteoclasti deriva dalla funzione che questo tipo di cellule
ha, poiché gli osteoclasti sono cellule destinate alla degradazione della
matrice ossea.
Sono cellule di notevoli dimensioni, con aspetto debolmente basofilo e
talvolta acidofilo per la maggior parte dei casi polinucleate.
Sono localizzati sulle superfici ossee in via di riassorbimento, spesso
poste in cavità di erosione dette fossette di Howship.
Rispetto agli osteoblasti, gli osteociti risultano possedere meno RER e
un apparato di Golgi molto ristretto, oltre a non possedere più granuli:
- il citoplasma è appena basofilo.
- Il volume è correlato a quello dell’osteoblasto da cui deriva
L’attività di queste cellule avviene in seguito a stimoli locali o sistemici,
che inducono l’adesione ossea.
La membrana plasmatica degli osteociti non è immersa nella matrice
mineralizzata:
- è rivestita da uno strato di fibre sottili di collagene e
glicoproteine,
- si ritiene che le glicoproteine debbano regolare gli scambi con il
liquido interstiziale.
La morfologia della cellula varia notevolmente in relazione al momento
funzionale in cui essa si trova:
- quando è a riposo presenta degli pseudopodi lamellari sulla
membrana plasmatica a cui corrispondono dei microtubuli
all’interno della cellula
- quando sono attivi e raggiungono la superficie ossea,
ritraggono gli pseudopodi e la membrana plasmatica presenta
numerose invaginazioni.
Gli osteociti non vanno incontro a mitosi:
- l’aumento di dimensione di un segmento osseo avviene
solamente per deposizione della matrice ossea
- non si ha mai accrescimento di tipo interstiziale.
Gli organuli, internamente, hanno una disposizione casuale, ma
quando vengono attivati la cellula assume una notevole polarità:
- in sede di erosione (sulla superficie che aderisce all’osso)
presentano una membrana plasmatica ad orsetto a spazzola,
con numerose introflessioni citoplasmatiche
59
In realtà, l’aggancio di un osteoclasto alla matrice, avviene a livello
delle invaginazioni da strutture particolari dette podosomi:
- molecola di F-actina circondata da una guaina di vincolina
- la vincolina prende contatto con un’altra proteina detta talina.
- Possono essere considerati delle placche di adesione poiché
sono il luogo in cui si ha l’adesione alla matrice extracellulare.
Nella zona apicale, ovvero dove agiscono i podosomi, sono presenti
numerose vescicole lisosomiali che riversano il contenuto enzimatico
all’esterno per erodere la matrice ossea.
In zona basolaterale si concentrano i nuclei, il complesso di Golgi (ben
sviluppato), i mitocondri e i poliribosomi. Il RER non è particolarmente
sviluppato.
L’attività osteoclastica si espleta in due fasi:
1) degradazione della matrice minerale ad opera di ioni H+,
prodotti dalla dissociazione dell’acido carbonico
2) proteolisi della matrice organica, operata da enzimi
lisosomiali collagenasi. L’orletto a spazzola è in grado di
riassorbire tutti gli amminoacidi derivanti dalla proteolisi della
matrice ossea.
DIFFERENZIAMENTO CELLULARE
Il differenziamento di osteoblasti, osteociti ed osteoclasti è importante
per comprendere i fenomeni che riguardano la omeostasi del sistema
scheletrico e alcune patologie.
Le cellule osteoprogenitrici sono situate nel periostio e nell’endostio
o presso i canali di Havers:
- manifestano una fervida attività mitotica
- in rapporto alle esigenze locali si differenziano in osteoblasti o
rimangono in quiescenza.
Gli osteoblasti hanno sulla loro superficie i recettori per il PTH, che
induce la secrezione di:
- ligando per la osteoprotogerina (OPGL)
- fattore di stimolazione per gli osteoclasti, necessario per la loro
attivazione e per il loro differenziamento.
Gli osteociti, derivati dagli osteoblasti, secernono fattori capaci di
stimolare l’attività osteodepositrice degli osteoblasti:
- osteocalcina
- IGF1
Gli osteociti sono anche in grado di assorbire localmente gli ioni Ca++
e di riportarli in circolo.
Gli osteoclasti derivano da una cellula progenitrice monocitamacrofago (GM-CFU), che in risposta a OPGL si fonde con altre GFCFU.
L’osteoprotogerina è in grado di inibire l’attività di assorbimento
dell’osso e la capacità di differenziarsi da parte delle cellule
osteoprogenitrici. È solitamente presente nell’osteoide mineralizzato e
viene liberata durante l’osteolisi.
L’equilibrio che si stabilisce tra osteogenesi e osteolisi è regolato dagli
osteoblasti, che regolano i comportamenti degli osteoclasti in risposta
a stimoli ormonali:
- PTH: induce l’osteolisi
- Tireocalcitonina: induce l’osteogenesi.
MATRICE OSSEA
La matrice ossea, a differenza delle matrici degli altri connettivi, è
costituita da:
- componente organica
- componente inorganica.
60
La componente organica è costituita da fibre collagene del tipo I, che
occupano per il 95% la matrice. La restante componente organica è
matrice amorfa, costituita da:
- glicoproteine associate al collagene.
- GAG (condrotinsolfato-A per la maggior parte, ma anche
cheratansolfato e acido ialuronico).
Recentemente sono state descritte altre glicoproteine particolari del
tessuto osseo e prodotte da osteoclasti e osteoblasti:
- osteocalcina
- osteonectina
- sialoproteina (BSP).
Tuttavia, le percentuali di composizione sono relativamente mutevoli in
relazione a:
- tipo di tessuto osseo
- età
- dieta
- specie
Ad eccezione della matrice perossea (quella neodeposta), la matrice
ossea risulta generalmente acidofila.
La componente minerale può presentare anch’essa variazioni e
aumenta con l’avanzare dell’età:
- la componente salina può raggiungere il 65% del peso secco
- è presente anche acqua.
I cristalli di idrossiapatite, al microscopio elettronico possono
presentarsi in varie forme:
- hanno generalmente un aspetto aghiforme e, di norma in
rapporto con le fibre collagene sono disposti con una certa
regolarità rispetto alle bandeggiature periodiche
- possono presentarsi sottoforma di cristalli tondi
- si trovano anche associati parallelamente tra loro a costituire
fibre allungate.
Gli aggregati cristallini sono frequentemente associati strettamente al
collagene:
- sono presenti in prossimità dell’osteoide (luogo di presenza
degli osteoblasti)
La matrice perossea o osteoide è quella matrice ossea, basofila e
metacromatica, che si interpone tra gli osteoblasti e la matrice già
mineralizzata:
- costituita da sottili fibre collagene
- solo parzialmente mineralizzata
- gli spazi tra le fibre e i cristalli sono riempiti da sostanza amorfa
- sono presenti degli elementi delimitati da membrana,
probabilmente di origine cellulare, che contengono granuli e
sali che sono state implicate nella deposizione iniziale di
materiale inorganico.
PERIOSTIO ED ENDOSTIO
La superficie esterna dell’osso è rivestita da una membrana di tessuto
connettivo fibroso, detta periostio.
Il periostio è strettamente aderente al tessuto osseo ed è possibile
distinguere due strati:
- strato fibroso: relativamente povero di cellule, quello più
esterno
- strato osteogenico: lo strato più profondo, sicco di capillari e di
cellule, alcune delle quali sono osteoblasti, quindi hanno
capacità generativa.
Dal periostio dipartono fasci piuttosto consistenti di fibre collagene
dette fibre perforanti o di Sharpey:
- sono poco o per nulla mineralizzate
- si spingono in profondità tra le lamelle dell’osso per garantire
un ancoraggio più robusto.
Il canale midollare è rivestito da una sottile lamina di connettivo,
chiamata endostio.
61
L’endostio ha capacità cellulari evolutive di differente tipo:
- emopoietico
- osteogenetico
Il sistema vascolare del tessuto osseo comunica in più punti con quello
del periostio e del midollo:
- nella parte superficiale del periostio arterie e vene hanno
differenti orientamenti e formano reti poligonali di capillari
- nella parte profonda vi sono capillari paralleli all’asse diafisario.
CEMENTO
Il cemento è uno dei costituenti del dente, ed è molto simile al tessuto
osseo non lamellare a fibre intrecciate:
- differisce da questo per la mancanza di vasi
- non presenta rimaneggiamenti
- i cementoblasti continuano a produrre cemento per tutta la vita,
cosicché il cemento aumenta di spessore negli anni
Si possono distinguere due tipi di cemento:
- cemento cellulare
- cemento acellulare
Il cemento cellulare si trova nella parte apicale della radice, con
lacune e canalicoli molto simili a quelli del tessuto osseo. Le cellule
somigliano a osteociti in fase di quiescenza.
Il cemento acellulare si trova nella parte coronale del dente e risulta
demarcato dalla dentina:
- costituito da voluminose fibre collagene
DENTINA
La dentina è un tessuto simile al tessuto osseo primitivo, formata da
cellule chiamate odontoblasti, cellule specializzate che sono immerse
in una matrice mineralizzata e presentano scarsi prolungamenti (fibre
di Tomes).
Le fibre di Tomes, immerse nella matrice mineralizzata non sono
direttamente in contatto con essa ma sono rivestiti da una guaina di
Neumann, basofila e metacromatica (corrisponde alla matrice
preossea dell’osteone).
Gli odontoblasti sono di origine mesenchimale, dal mesenchima
pulpare, inglobato nell’organo dello smalto:
- sono strettamente legati dal punto di vista funzionale agli
adamantoblasti (o ameloblasti, cellule che producono lo smalto)
- ameloblasti e odontoblasti svolgono una funzione di induzione
reciproca.
Dopo il differenziamento gli odontoblasti si dispongono in una linea in
prossimità dell’organo dello smalto, verso cui rivolgono il loro unico
prolungamento:
- in prossimità di questo prolungamento viene deposta la matrice
mineralizzata
- il corpo cellulare degli osteoblasti rimane quindi in sede pulpare
e non si immerge nella matrice mineralizzata.
La matrice viene prodotta in continuazione, per tutta la vita, verso la
cavità pulpare, creando uno strato detto di dentina secondaria, che va
a ridurre il lume in cui si trova la polpa.
La produzione di dentina durante l’accrescimento produce un costante
aumento di spessore, così anche la matrice mineralizzata, che inizia
con matrix vescicle ma continua negli anni.
La composizione della matrice inorganica prevede:
- cristalli di idrossiapatite
- sali (carbonati, fosfato vari, solfati, ecc…)
- presenti anche tracce di ioni metallici
La componente organica è prevalentemente costituita da collagene.
62
OSSIFICAZIONE.
Nel corso dell’ontogenesi, nel mesenchima dei Vertebrati, si
susseguono una serie di fenomeni stimolatori che consentono il
differenziamento in:
- tessuto osseo
- cartilagine
- connettivo fibroso.
Nelle sedi dove si formerà tessuto osseo si osserva una proliferazione
di cellule che danno vita ad un blastoma che può evolvere secondo
due linee:
1) un connettivo ricco di fibre e di vasi andrà incontro ad
ossificazione diretta
2) la cartilagine ialina forma un abbozzo dei segmenti scheletrici a
cui poi si sostituirà tessuto osseo, mediante ossificazione
indiretta.
OSSIFICAZIONE DIRETTA.
L’ossificazione diretta è un tipo di ossificazione, a partire dal
mesenchima, che è propria delle ossa piatte.
Nel mesenchima del connettivo in cui si abbozzano i centri di
ossificazione si osserva, inizialmente:
- neoformazione di vasi
- incremento della mitosi e della fibrillogenesi
Dove si dispone la matrice nei primi centri di osteoblasti si formano
delle trabecole disposte in maniera irregolare, tra le quali rimangono
ampi spazi contenenti mesenchima vascolarizzato:
- lungo la superficie delle trabecole si dispongono gli osteoblasti,
allineati come cellule epiteliali
- gli osteoblasti sulle lamelle cominciano a depositare matrice e
sali di calcio.
- La matrice preesistente viene inglobata e si forma un tessuto
del tipo a fibre intrecciate
- Gli osteoblasti vanno incontro a mineralizzazione e diventano
osteociti.
- Gli ampi spazi tra le trabecole si riducono per apposizione di
nuova matrice.
- Le cavità si trasformano in canali attraversati da vasi e si
generano gli osteoni primari.
Gli osteoni primari sono riassorbiti da osteoclasti, che vanno a
formare delle cavità secondarie in cui viene deposto tessuto osseo
lamellare.
Si hanno così continui fenomeno di sintesi e di erosione, che
permettono la formazione di tessuto osseo nella forma definitiva, con
la possibilità di un rimodellamento.
Il mesenchima si addensa sulle superfici dell’osso neoformato e forma
il periostio, che presenta due strati:
- esterno, ricco di fibre collagene
- interno, contenente numerosi vasi e altri osteoblasti.
in seguito si differenziano cellule osteoprogenitrici che:
- si riuniscono in gruppi
- aumentano di volume
- assumono le caratteristiche degli osteoblasti (intensa basofilia,
nucleo eccentrico, complesso di Golgi ben evidente)
Nell’ossificazione diretta, fibre collagene, tendini, legamenti in
presenza del periostio vengono inglobate nell’osso e vanno a formare
le fibre di Sharpey.
Queste cellule neodifferenziate presentano dei prolungamenti rivolti
verso l’osteoide che iniziano a depositare dalla parte opposta a quella
del nucleo.
Una particolare ossificazione diretta è l’ossificazione mantellare:
- avviene a livello delle ossa del corpo della mandibola, del
vomere, delle ossa nasali e delle ossa lacrimali
- l’ossificazione si svolge su un blastema che ha come linea
guida una porzione di cartilagine ialina.
63
-
La cartilagine viene riassorbita una volta terminata
l’ossificazione.
Alcune porzioni di cartilagine possono rimanere all’interno
dell’osso e andare incontro ad ossificazione endocondrale
OSSIFICAZIONE INDIRETTA
L’ossificazione indiretta o per sostituzione di un modello cartilagineo, si
verifica nello ossa brevi e nelle ossa lunghe.
L’abbozzo del segmento scheletrico che ha origine dal mesenchima è
costituito da materiale cartilagineo, di cartilagine ialina.
La formazione dell’osso su modello cartilagineo ha due modalità:
- ossificazione pericondrale: ha luogo sulla superficie della
cartilagine
- ossificazione endocndrale: avviene all’interno della cartilagine
Secondo fenomeno
All’interno dell’abbozzo osseo, la cartilagine va incontro a
modificazioni:
- i condrociti diventano ipertrofici, accumulano glicogeno
- la matrice extracellulare si riduce a sottili sepimento che
calcificano
- i condrociti non possono più realizzare scambi metabolici nella
matrice calcificata e muoiono.
Dal manicotto osseo pericondrale che si è formato nel primo processo
si hanno dei vasi che penetrano in profondità:
- si accrescono e proliferano
- dalle cellule dell’avventizia nascono degli osteoclasti che
assorbono la matrice cartilaginea
- ampliano le cavità, le quali tendono a confluire.
OSSIFICAZIONE ENDOCONDRALE
Sono necessarie entrambe per l’allungamento della diafisi di ossa
lunghe, mentre le ossa brevi e le epifisi delle ossa lunghe avvengono
solo per ossificazione endocondrale.
Ossificazione pericondrale.
Osservando un abbozzo scheletrico cartilagineo, si può notare come le
prime modificazioni di verificano nella parte esterna della diafisi, in cu
si osservano due fenomeni distinti che avvengono in contemporanea:
primo fenomeno
A livello della parte fibrosa del pericondrio (membrana che avvolge la
cartilagine, formata da connettivo fibroso vascolarizzato) si ha un
processo di ossificazione intramembranosa (diretta):
- si forma un anello di tessuto osseo che circoscrive la parte
centrale della diafisi
- all’esterno dell’anello osseo è ancora presente connettivo
fibroso.
Nonostante l’attività degli osteoclasti, non tutta la cartilagine viene
asportata:
- i sepimenti di cartilagine ialina calcificata rimangono inglobati
nel tessuto osseo neodeposto di tipo non lamellare a fibre
intrecciate.
- Queste porzioni cartilaginee fungono da stampo per la
deposizione di nuova matrice ossea.
- Le trabecole di cartilagine verranno erose in seguito
Gli spazi tra le trabecole contengono midollo osseo primitivo, che è
formato da:
- vasi
- cellule staminali mesenchimale (in pare indifferenziate e in
parte osteoblasti)
- dalle cellule indifferenziate nasceranno gli organi emopoietici
I vasi nel periostio confluiscono in unico tronco, al centro dell’abbozzo
osseo, che in seguito darà vita all’arteria nutritizia dell’osso definitivo:
64
-
in prossimità del tronco la arteria si biforca dando origine a due
rami che seguono l’asse dell’osso, uno in direzione prossimale
e l’altro distale
-
L’ossificazione endocondrale si diffonde, con le modificazioni della
cartilagine già citate, verso le epifisi:
- nel frattempo, al centro della diafisi gli osteoclasti provvedono
all’erosione della cartilagine e alla canalizzazione della diafisi
- si vengono a identificare due fronti di avanzamento
dell’ossificazione (distale e prossimale, in senso divergente)
La cartilagine vicina al fronte di ossificazione assume un aspetto
peculiare per la propria situazione:
- i condrociti sono ipertrofici e accumulano glicogeno
- la matrice è calcificata con grandi cavità
- questo aspetto si accentua quando i fronti di ossificazione
raggiungono la zona prossima alle epifisi (la metafisi).
In prossimità delle metafisi, i condrociti assumono una configurazione
particolare:
- si dispongono in colonne parallele separate da matrice
extracellulare
- vanno incontro a continue mitosi
- verso il fronte di ossificazione sono molto ipertrofici.
Si deve tenere presente che il manicotto che si estende con
ossificazione pericondrale precede sempre il fronte di ossificazione
endocondrale:
- l’allineamento in colonne longitudinali è dato da una costrizione
del manicotto osseo che si forma sui bordi
- nel frattempo, dalla tonaca avventizia dei vasi si dipartono
cellule condroblasti che erodono la zona di cartilagine delle
metafisi.
Negli spazi che si formano dall’erosione della cartilagine si formano i
vasi:
dall’avventizia dei vasi si differenziano osteoblasti che
cominciano a deporre matrice ossea
il canale midollare si ampia conferendo all’osso l’aspetto di una
colonna cava
nella cavità midollare si viene a formare quindi il midollo osseo
giallo, ricco di cellule adipose.
Anche nell’osso adulto e completamente formato rimangono residui di
cartilagine calcificata a livello di:
- punto di contatto tra tessuto osseo endocondrale e
pericondrale
- tra le trabecole del tessuto osseo endocondrale
- il tessuto osseo pericondrale non possiede alcuna traccia di
cartilagine residua.
Anche nelle epifisi avviene infine il processo di ossificazione:
- avviene per la formazione di nuclei di ossificazione
- è solamente di tipo endocondrale.
Quando la parte profonda delle epifisi è quasi formata, con modalità
analoghe a quelle per la diafisi endocondrale, i vasi raggiungono il
nucleo di calcificazione/ossificazione dell’epifisi e le loro tonache
avventizie:
- rilasciano osteoclasti che ampiano le cavità preesistenti
- rilasciano osteoblasti, che depongono tessuto osseo
endocondrale avvalendosi delle trabecole di cartilagine come
substrato.
Il nucleo di ossificazione dell’epifisi si espande poi radicalmente in
direzione centrifuga:
- in direzione delle epifisi raggiunge il disco di cartilagine
metafisaria di accrescimento che è destinato a scomparire
- si assiste alla fusione tra epifisi e diafisi, con i vasi dell’epifisi
che si fondono e si reticolano con quelli della diafisi.
A livello delle epifisi si forma il tessuto osseo per sostituzione della
cartilagine in tutti i punti, tranne in quelli in cui c’è la necessità di
movimento, in cui permane la cartilagine articolare.
65
Nel frattempo, dal centro della diafisi, ad opera di osteoclasti, si ha
l’inizio del riassorbimento dell’osso endocondrale, il quale rimane solo
in prossimità della cartilagine metafisaria.
La cartilagine ialina che precede la deposizione del tessuto osseo
endocondrale ha quindi un duplice ruolo:
1) funge da modello per l’osso definitivo
2) serve da intermediario per l’accrescimento in lunghezza (nella
diafisi) e in larghezza (nell’epifisi).
OSSIFICAZIONE PERIOSTALE.
Avviene per apposizione dopo che è avvenuta l’erosione nel canale
midollare delle diafisi:
- a differenza della cartilagine, il tessuto osseo non può
accrescersi diametralmente in maniera trasversale per
accrescimento interstiziale a causa della matrice mineralizzata.
- La diafisi aumenta di diametro e il canale midollare si ampia,
poiché l’ossificazione periostale procede preferenzialmente
verso l’esterno dell’osso.
Nello strato profondo del periostio dalla proliferazione dei vasi nascono
cellule mesenchimali, che si differenziano in osteoblasti:
- questi sintetizzano lamelle (circonferenziali esterne) che poi
verranno sostituite
- si sostituiscono, a seguito dell’erosione da parte degli
osteoclasti, dei vasi e del midollo osseo.
- Dal connettivo che rimane incluso nelle cavità scavate dagli
osteoclasti si differenziano gli osteoblasti, che iniziano a
deporre la matrice aderente alla cavità scavata dagli
osteoclasti.
Con questo processo si formano le lamelle concentriche che
costituiscono gli osteoni, ed al centro, i vasi, che attraversano i
neoformati canali di Havers:
-
all’interno delle lacune tra le lamelle concentriche gli osteoblasti
si trasformano in osteociti, immersi e imprigionati nella matrice
ossea
Gli osteoni che si formano sono anche questi soggetti ad erosione
parziale da parte degli osteoclasti:
- la parte non erosa andrà a formare le lamelle del sistema
interstiziale
- i nuovi osteoni che si formano (osteoni secondari) sono
circondati dalla linea cementante, e sono facilmente
distinguibili.
- I nuovi osteoni si formano ovviamente per cellule mesenchimali
che si differenziano in osteoblasti (in seguito in osteociti) a
partire dai canali di Havers.
Questo fenomeno, detto di rimaneggiamento, continua per tutta la vita,
anche se con minor intensità progressivamente:
- a 30 anni: si forma un sistema irregolare di lamelle dato dalla
non completa degradazione degli osteoni preesistenti e le
lamelle circonferenziali esterne tendono a rimanere solo in
superfici limitate
- in tarda età: gli osteoni sono più regolari e cominciano i
processi regressivi. Inizia la osteoporosi senile, le cavità sono
colmate solo in parte.
RIMODELLAMENTO, OMEOSTASI SCHELETRICA E MINERALE.
Le ossa, attraverso distruzione e rideposizione, si modificano per tutta
la vita, con un ritmo e una estensione variabili ovviamente in relazione
all’età.
La volta cranica si modella con l’ampliamento dell’encefalo, così anche
le diafisi e le epifisi delle ossa lunghe si allargano e si modellano a
seconda nelle necessità, senza tuttavia cambiare forma.
Le diafisi delle ossa lunghe, si modificano ampliando il canale
midollare e allungandosi a livello della metafisi. Nel primo caso, vi è la
necessità di:
66
-
erosione a livello dell’endostio
apposizione in zona periostale
Questo processo, che per nuova deposizione e per erosione modella
le ossa a seconda delle esigenze, si chiama rimodellamento:
- questo processo prosegue per tutta la vita
- se le ossa sono sottoposte a carichi e forze particolari, possono
mutare di forma
Risulta tuttavia difficile capire come le cellule del tessuto osseo,
inglobate nella matrice mineralizzata, possano attivarsi ed essere
stimolate in seguito a sollecitazioni meccaniche:
- è stata avanzata l’ipotesi che i cristalli salini possano produrre
correnti a basso voltaggio, ovvero che la sollecitazione
meccanica sul sale abbia un effetto piezoelettrico
- questi segnali elettrici fungerebbero da stimolo per osteoclasti e
osteoblasti
Si chiama omeostasi scheletrica l’equilibrio che si instaura per tutta
la durata della vita tra:
- struttura e architettura di un osso
- modificazioni in seguito a sollecitazioni meccaniche.
La plasticità del tessuto osseo, in cui vi sono molti sali minerali, lo
rende disponibile a cedere o a ricevere sostanze inorganiche in modo
da mantenere inalterata la concentrazione di queste sostanze a livello
ematico:
- in questo modo la concentrazione di sali nel sangue non
dipende più di tanto dall’alimentazione
- è molto importante questo meccanismo di omeostasi minerale
soprattutto per la calcemia (concentrazione del calcio nel
sangue), poiché dal calcio dipendono le più importanti funzioni
dell’organismo (fagocitosi, contrazione muscolare, rapporti tra
cellule adiacenti ed eventuale fusione, trasporto assonico e
trasmissione sinaptica)
La quasi totalità di tutto il calcio presente nell’organismo è concentrata
nell’apparato scheletrico, solamente l’1% si trova in forma di soluzione.
Nel tessuto osseo, i sali di calcio non sono uniformemente distribuiti:
- il calcio si concentra in zone prossime ai vasi (al centro degli
osteoni)
- le componenti ossee più distanti dal torrente sanguigno hanno
una componente minerale meno solubile.
La componente minerale che può essere solubilizzata ha una
concentrazione molto bassa:
- serve solamente per l’ordinaria amministrazione
- per far fronte a necessità particolari dell’organismo, in
mancanza di calcio si rende necessario un complesso
processo di erosione della matrice ossea per liberare il Ca++
necessario.
La costanza della calcemia in sostanza, dipende dal riassorbimento
del tessuto osseo da parte degli osteoclasti. Questo meccanismo è
regolato per via endocrina dalle paratiroidi, che producono ormoni
specifici:
- paratormone
- 1,25-diidrossicolecalciferolo
- calcitonina
Le paratiroidi hanno un parenchima sensibile alle variazioni ematiche
del calcio:
- quando il calcio è sotto una certa soglia (ipocalcemia): le
paratiroidi secernono paratormone, che inibisce l’azione degli
osteoblasti, i quali attivano gli osteoclasti
- quando il calcio supera una certa soglia (ipercalcemia): le
paratiroidi smettono di produrre paratormone e permettono agli
osteoblasti di deporre nuova matrice ossea.
È molto probabile che, per dare una risposta metabolica immediata, il
paratormone abbia anche degli effetti complementari:
- può influenzare l’attività renale incrementando l’assorbimento
del calcio a livello dei tubuli renali
- può indurre la produzione di 1,25-diidrossicolecalciferolo, che
favorisce l’assorbimento del calcio a livello intestinale
67
Anche la calcitonina, prodotta dalle cellule parafollicolari della tiroide
svolge un ruolo importante nell’omeostasi minerale:
- agisce in modo opposto al paratormone
- quando la concentrazione del calcio è troppo elevata la
calcitonina blocca l’azione degli osteoclasti.
Vi sono anche qui differenti teorie sulla natura dei catalizzatori del
processo di mineralizzazione:
- per alcuni i catalizzatori sono le fibre collagene.
- Per altri il processo inizia all’interno delle cellule con la
formazione di matrix vescicle, contenenti cristalli di
idrossiapatite e quindi l’agente nucleante.
IL PROCESSO DI MINERALIZZAZIONE
Le matrix vescicle vengono riversate negli spazi interfibrillari e si può
notare, al ME, una cristallizzazione aghiforme per apposizione a questi
cristalli.
Il processo di mineralizzazione non interessa soltanto la cartilagine e il
tessuto osseo, bensì anche altri substrati:
- dentina
- smalto
- calcoli renali (condizioni patologiche)
- calcificazioni ectopiche che si verificano in qualsiasi tessuto
(condizioni patologiche)
La deposizione delle componenti organiche della matrice prevede
sempre la deposizione iniziale di alcuni sali, soprattutto fosfato di
calcio, in forma amorfa o cristallina.
Questo processo non è ancora stato chiarito completamente, sono
ancora aperte due ipotesi.
L’ipotesi prevalente è la teoria della nucleazione:
- presuppone la creazione di nuclei cristallini
- presenza di una sostanza nucleante
Si avrebbe quindi:
- fenomeno chimico che trasforma alcuni componenti della
matrice in cristalli di idrossiapatite
- successivamente, la parte cristallizzata si accresce per
apposizione.
Nei tessuti animali, l’energia di attivazione per il processo è molto alta,
quindi la cristallizzazione non avviene in soluzioni pure, ma i è la
necessità di catalizzatori.
Nella matrice adiacente all’osteoblasta, ove l’orletto intorno all’osteoide
non è ancora mineralizzato, si osservano matrix vescicle molto simili a
quelle descritte per la cartilagine:
- sono circoscritte da membrana
- gemmano dai prolungamenti citoplasmatici degli osteoblasti o
dai condrociti ipertrofici della cartilagine.
Nella matrice non mineralizzata, s riscontrano aggregati cristallini
aghiformi localizzati tra le fibre collagene, con cui non hanno rapporti
preferenziali:
- si ritiene che vi siano altre strutture filamentose oltre al
collagene all’inizio del processo di mineralizzazione, dette fibre
assili (proteine con componente polisaccaridica)
- alle matrix vescicle e alle fibre assili si da molta importanza.
Le strutture assili con i cristalli di idrossiapatite sono inversamente
proporzionali alla compattezza dell’osso:
- sono molto presenti nel tessuto osseo primario
- sono poco presenti nel tessuto osseo secondario (ad osteoni),
in cui le fibre collagene sono numerose e i cristalli sono in
relazione con il periodo delle fibre.
In sintesi, il processo di mineralizzazione si può schematizzare con:
1) iniziazione da parte degli osteoblasti, che depongono le
componenti organiche della matrice, formano le matrix vescicle
e regolano il flusso degli ioni Ca++ all’interno del flusso
sanguigno
68
2) realizzazione nella matrice: avviene attraverso fenomeni
complessi e in rapida successione, quali
a. deposizione di sostanze inorganiche nelle matrix
vescicle
b. diffusione dei cristalli minerali nella matrice circostante
c. disposizione dei minerali in rapporto alle bade
periodiche del collagene.
7. il sangue e la linfa
INTRODUZIONE
Il sangue è formato da:
- elementi figurati 45%: piastrine, eritrociti, leucociti
- plasma 55%: componente liquida.
In un adulto di 70 kg circa, il sangue occupa 1/12 della massa
corporea, ovvero 5 o 6 litri.
Il rapporto tra la componente plasmatica e quella figurata è detto
ematocrito, e valuta la massa circolante di eritrociti in condizioni
normali.
Gli elementi figurati del sangue hanno una vita relativamente breve,
vengono continuamente prodotti all’interno degli organi emopoietici:
- sacco vitellino fegato e midollo osseo nell’adulto per il feto e
l’embrione
- solamente nel midollo osseo per l’adulto.
Al termine del loro ciclo, vengono degenerati dagli organi
ematocateretici, presenti principalmente nella milza.
Le concentrazioni degli elementi figurati nel sangue sono le seguenti:
eritrociti
4,5-5 106 per mm3
Leucociti
6000-9000 per mm3
piastrine
200000-300000 per mm3
Gli eritrociti svolgono la loro funzione all’interno dei vasi sanguiferi:
- hanno il compito di trasportare ossigeno alle cellule di tutto il
corpo e di riportare l’anidride carbonica ai polmoni
I leucociti appartengono al tessuto linfoide e svolgono la loro funzione
immunitaria nel connettivo perivasale
69
Le piastrine (o trombociti) svolgono la loro funzione quando il sangue
esce dai vasi, formando il coagulo:
- al processo di coagulazione, oltre alle piastrine operano anche
molecole proteiche di fibrinogeno.
Quando la coagulazione di un campione di sangue viene inibita (con
fattori anticoagulanti come eparina o citrato di sodio) si assiste ad una
sedimentazione degli elementi figurati del sangue:
- la velocità di eritrosedimentazione è la velocità con cui avviene
questo processo.
- Questa velocità (VES) può notevolmente aumentare nel corso
di malattie infiammatorie e infettive.
Il plasma sanguigno contiene numerosissime sostanze con solubilità,
peso molecolare e proprietà fisiche differenti:
- ha una fluidità tale da consentire gli scambi metabolici
attraverso le pareti dei capillari.
Il pH del sangue è mediamente di 7,3, leggermente basico:
- la pressione osmotica è determinata dal contenuto di elettroliti
nel sangue
- la pressione oncotica o colloidosmotica è legata al
contenuto proteico del plasma sanguigno.
- Queste due pressioni sono regolate dagli organi
osmoregolatori, quali reni, ghiandole sudoripare.
Il peso specifico oscilla da 1048 a 1066 g/l.
Le funzioni del sangue sono:
- trasporto di ossigeno e anidride carbonica
- trasportare e cedere ai vari tessuti le sostanze nutritizie
- raccogliere le sostanze di rifiuto trasportandole negli organi che
prevedono l’eliminazione (ghiandole sudoripare, reni, intestino).
- Trasporto di cellule immunocompetenti.
PLASMA SANGUIGNO
Una delle principali funzioni del plasma sanguigno è quella di
trasportare le sostanze nutritive e l’osigeno assorbite a livello
dell’intestino e dei polmoni:
- la composizione proteica e ionica devono assicurare pressioni
osmotiche e oncotiche adatte per attuare questi scambi di
acqua e metaboliti con i tessuti circostanti
Il plasma è un fluido leggermente alcalino con un colorito giallo chiaro:
- peso specifico di 1030 g/l circa
- viscosità di 1,8/2 volte superiore a quella dell’acqua distillata
- il pH è leggermente alcalino (7,3).
Il plasma è costituito prevalentemente di acqua (per il 90%) e per il
10% di sostanza secca, che comprende:
- 9% di sostanze organiche
- 1% di sali minerali sottoforma di ioni disciolti.
Per quanto riguarda gli ioni riscontrabili a livello del plasma i principali:
- cloruro
- sodio
- ioni bicarbonato
- K+
- Ca++
- Fosfato
- Solfato
- magnesio
- Ferro, però insieme a glicoproteine
La componente organica comprende:
- glucidi: glucosio,
- lipidi: acidi grassi, colesterolo, trigliceridi, fosfolipidi, lecitina
- proteine, lipoproteine e glicoproteine: albumina, globulina,
fibrinogeno
- ormoni: tutti gli ormoni riversati da ghiandole endocrine.
- Composti azoto (azotemia): acido urico, urea, amminoacidi,
creatina e creatinina.
70
EMOPOIESI.
Tutti gli elementi figurati del sangue derivano da una cellula staminale
pluripotente, che è in grado di produrli tutti con diverse strade di
differenziamento molto complesse.
Nel corso dello sviluppo, al sede degli organi emopoietici varia:
- sacco vitellino nei primi tre mesi
- nel fegato dal 3° al 7° mese
- nel midollo osseo dal 7° mese in poi
Dalla cellula staminale pluripotente derivano sostanzialmente due
linee cellulari staminali:
- linea mieloide: progenitrice delle piastrine, dei globuli rossi, dei
monociti e mastociti, dei granulociti.
- Linea linfoide: è la cellula progenitrice dei linfociti (B, T, NK).
Il differenziamento è reso possibile grazie a fattori di crescita della
famiglia delle citochine.
ERITROCITI O GLOBULI ROSSI.
I globuli rossi hanno un diametro di 6,5-7,5 µm e sono meno spessi
nella parte centrale:
- si colorano con coloranti acidi (acidofili)
- Il citoplasma è omogeneo, privo di granuli e altri organuli
citoplasmatici
- L’assenza degli organuli citoplasmatici è data dal fatto che le
emazie contengono quasi esclusivamente emoglobina.
Gli eritrociti non presentano la struttura citoscheletrica classica
delle cellule nucleate:
- il citoscheletro, responsabile della forma è dato dalla
membrana plasmatica stessa.
- Le strutture citoscheletriche sono annesse alla membrana
plasmatica stessa.
- Il carattere di elasticità e plasticità che i globuli rossi hanno nei
vasi è dovuto all’organizzazione della membrana plasmatica
stessa.
L’analisi chimica della componente proteica interna al plasmalemma
eritrocitario rivela che:
- 75% delle proteine è dato dal tetrametro spectrina
- il restante 25% da altre proteine quali actina, tropomiosina,
anchirina, e altre che non hanno nemmeno un proprio nome.
MORFOLOGIA E STRUTTURA
Gli eritrociti, o emazie, o globuli rossi, sono gli elementi corpuscolari
più numerosi nel sangue (concentrazione pari a 5 x 106):
- hanno la funzione di trasportare l’ossigeno e parte dell’anidride
carbonica
- hanno forma di una lente biconcava,
- sono, nei mammiferi, privi di nucleo.
La forma biconcava di un disco eritrocitario permette di ampliare la
superficie, mentre l’assenza del nucleo permette maggiori molecole di
emoglobina:
- in questo modo è migliorata e facilitata la diffusione
dell’ossigeno all’interno della cellula.
La struttura risulta una rete sottomembranosa di spectrina, rinforzata a
livello dei nodi da molecole di actina e di tropomiosina.
Sulla membrana sono presenti glicoproteine come la glicoforina A e
la glicoforina C.
Sono presenti sulla membrana esterna degli specifici recettori che
fungono da antigeni di istocompatibilità, come per esempio il fattore
ABO o il fattore Rh.
71
CARATTERISTICHE FISIOLOGICHE DELL’ERITROCITO.
CICLO VITALE E CARATTERISTICHE BIOLOGICHE
DELL’ERITROCITO.
La membrana plasmatica dell’ertrocito presenta spiccate proprietà
osmotiche, con una permeabilità selettiva ad alcuni ioni come il sodio e
il potassio.
Si è potuto dimostrare, con marcatori radioattivi, che i globuli rossi
hanno una vita media di 120 giorni:
- al termine della loro vita vengono sequestrati dal sistema
reticoloendoteliale e fagocitati da macrofagi
- la fagocitosi delle emazia invecchiate avviene inizialmente nella
milza e viene completata nel fegato dalle cellule di Kupfer e dai
sinusoidi epatici.
L’ambiente interno del globulo rosso ha la medesima pressione
osmotica del plasma sanguigno (isotonici):
- se il plasma aumenta la concentrazione ionica l’eritrocita cede
acqua e si raggrinzisce
- se il plasma si presenta ipotonico (minore concentrazione
ionica del citoplasma eritrocitario) gli eritrociti si gonfiano di
acqua fino a scoppiare (processo di emolisi).
L’ossigeno molecolare, a livello dei polmoni, diffonde atraverso la
membrana degli eritrociti e si lega labilmente ad una molecola di
emoglobina.
L’anidride carbonica solo per il 20% si lega alla coda N-terminale delle
globine:
- l’80% viene trasportata nel plasma sotto forma di carbonati.
RETICOLOCITI
Sono i globuli rossi neosintetizzati, poiché:
- possiedono ancora ribosomi liberi che stanno sintetizzando
emoglobina
- si colorano con coloranti basici vitali (blu brillante di cresile) che
evidenziano all’interno dei granuli basofili uniti a dei filamenti.
- Nell’arco di 24 ore questi diverranno eritrociti maturi a tutti gli
effetti.
La presenza di granuli e filamenti basofili è dovuta a RNA e ribosomi
liberi nel citoplasma.
Con la scomparsa dei ribosomi, l’eritrocito perde la capacità di
sintetizzare le proteine:
- hanno inizio progressive alterazioni che terminano con la
distruzione della cellula
è molto importante la porzione oligosaccaridica della glicoforina della
membrana degli eritrociti:
- la carica negativa presente sulle catene contenenti acido sialico
impedisce ai globuli rossi di agglomerarsi e coagulare
- gli eritrociti alla fine del ciclo vitale contengono porzioni molto
inferiori di acido sialico
Il meccanismo che permette ai macrofagi di riconoscere le emazie
invecchiate, prevede l’esposizione di galattosio per la rimozione
dell’acido sialico dalla superficie dell’eritrocita.
EMOGLOBINA.
L’emoglobina è una molecola proteica contenuta nei globuli rossi in
grandi quantità:
- vi sono circa 280 milioni di molecole di emoglobina per ogni
globulo rosso.
- Costituisce il 95% delle proteine citoplasmatiche di un eritrocita
L’emoglobina è formata da:
- un gruppo prostatico (non proteico) detto gruppo eme, che
conferisce il colore rosso al sangue
72
-
4 catene polipeptidiche uguali a due a due, avvolte su se
stesse a formare le globine.
Ciascuna globina è associata ad un gruppo eme.
La funzione dell’emoglobina è quella di legare labilmente ossigeno
molecolare:
- ne assume la massima quantità possibile a livello degli alveoli
polmonari
- la cede tutta ai tessuti
Il legame dell’ossigeno ad un gruppo eme favorisce il legame di
ossigeno agli altri tre gruppi della molecola: è un legame cooperativo.
Sono esistenti differenti emoglobine:
- nell’adulto: si ha per la totalità emoglobina A, costituita da due
catene e da due catene
- nel feto: si ha emoglobina F (HbF), formata da due catene e
due catene .
Sono frammenti di citoplasma che derivano dalla frammentazione dei
megacariociti, cellule che si trovano negli organi emopoietici:
- Hanno dimensioni di 2-4 µm
- Sono prive di nucleo
- Nei vasi integri hanno forma tondeggiante.
Con i normali metodi di fissazione, al microscopio ottico si presentano
con forma grossolanamente stellata, presentando:
- Una zona centrale granulare
- Una zona esterna quasi ialina.
A livello ultrastrutturale:
- la membrana plasmatica presenta numerose introflessioni che
formano un sistema canalicolare aperto
- la MP è rivestita da proteoglicani e lipoproteine costituenti i
fattori piastrinici e plasmatici della coagulazione
- sotto la MP vi è una fitta rete di microtubuli, che formano una
impalcatura che conferisce alla piastrina la particolare forma.
- La proteina citoplasmatica di gran lunga maggiore è l’actina,
talvolta complessata con la profilina.
PIASTRINE
MORFOLOGIA E STRUTTURA
Le piastrine sono elementi figurati del sangue che si specializzano in
particolari funzioni appartenenti ai processi che impediscono la perdita
di sangue in caso di lesioni vasali.
Prendono parte al processo di coagulazione del sangue.
Le piastrine sono piccoli elementi figurati che si trovano nel sangue ed
hanno una vita media di 10 gg.
La loro concentrazione, a meno di casi patologici, è di 200’000300'000 unità per mm3.
Nella piastrina sono presenti:
- mitocondri
- granuli di glicogeno
- ribosomi
- Granuli densi
- Granuli ,
- RNA
- ATP
- Lisosomi.
La piastrina presenta delle sviluppate attività metaboliche, la cui
principale è quella di sviluppare energia, che viene utilizzata per
l’attività contrattile.
La caratteristica morfologica saliente, è data dalla presenza di
numerosi granuli delimitati da membrana, il cui contenuto viene
riversato all’esterno quando le piastrine sono stimolate.
73
Il primo tipo di granuli è costituito dai Granuli , che contengono:
- fibrinogeno
- fattore IV piastrinico (antieparinico)
- fattore VIII/von Willerbrandt
- trombospondina
- PDGF
I granuli densi, sono meno numerosi e presentano al loro interno:
- serotonina
- ioni calcio
- ADP
- ATP
RUOLO FUNZIONALE DELLE PIASTRINE.
Quando il sangue viene esposto all’aria, dopo una decina di minuti si
forma il coagulo, una massa gelatinosa.
Dopo un’ora dal coagulo esce un liquido giallognolo detto siero:
- è estromesso tramite il fenomeno di retrazione del coagulo,
che avviene ad opera delle piastrine
Il composto che solidifica è il fibrinogeno, che viene trasformato in
fibrina grazie all’enzima trombina:
- la trombina è già presente a livello plasmatico nelle piastrine
sottoforma di protrombina, che viene attivata alla formazione
del coagulo
- la rete di filamenti di fibrina trattiene globuli rossi e bianchi e
piastrine
- successivamente le piastrine si contraggono e si ha la
retrazione del coagulo.
In vivo, quando si ha la rottura di un vaso, si assiste al processo di
emostasi, cioè all’arresto del sanguinamento che avviene nelle
seguenti tappe:
1) rottura del vaso
2) si ha una vasocostrizione
3) si forma un tappo piastrinico, grazie all’apposizione
temporanea delle piastrine
4) si forma un coagulo rosso
5) si ha la retrazione del coagulo, con la conseguente
eliminazione del siero
6) si ha la fibrinolisi, ovvero la scissione delle fibrine
7) in seguito può iniziare la ricostruzione del vaso.
Quando il vaso viene leso le piastrine si aggregano al collagene
esposto:
- questa interazione scatena una serie di reazioni a catena.
- Altre piastrine aderiscono a quelle che si sono legate al
collagene (aggregazione piastrinica)
- Le piastrine liberano granuli ma mantengono la loro membrana
e la loro forma, con dei prolungamenti dendritici
- L’aggregazione forma il tappo emostatico
Il tappo emostatico viene poi consolidato dai filamenti di fibrina, grazie
all’interazione di protrombina e fibrinogeno.
LEUCOCITI O GLOBULI BIANCHI
INTRODUZIONE
I leucociti, o globuli bianchi, sono cellule incaricate alla difesa
dell’organismo contro l’attacco di eventuali agenti patogeni.
La difesa si attua su due livelli:
- immunità naturale o aspecifica: mediata da granulociti e
monociti e lincofiti NK
- immunità adattativi o specifica: i responsabili sono i linfociti B e
T
I globuli bianchi sono prodotti negli organi emopoietici ed hanno una
vita piuttosto breve:
- muoiono per apoptosi al di fuori del circolo sanguigno.
74
Nel sangue sono normalmente presenti con una concentrazione pari a
5000-7000 unità per mm3:
- un aumento del loro numero è detto leucocitosi
- una diminuzione rispetto alle condizioni normali è detto
leucopenia.
I leucociti sono distinti in due grandi categorie:
- granulociti: detti anche leucociti polimrfonucleati (PMN) sono
cellule caratterizzate dalla presenza di granuli nel citoplasma.
Comprendono i granulociti neutrofili, eosinofili e basofili.
- Agranulociti: sono anche dette cellule mononucleate hanno un
nucleo tondeggiante o reniforme. Comprendono i leucociti e i
monociti.
Le loro percentuali relative nel sangue umano costituiscono la formula
leucocitaria, con i seguenti valori:
granulociti neutrofili
Granulociti basofili
Granulociti eosinofili
Linfociti
Monociti
50-70 %
0,5-1 %
2-4 %
20-40 %
3-8 %
GRANULOCITI POLIMORFONUCLEATI (PMN)
I granulociti PMN sono cellule caratterizzate dalla presenza di granuli
nel citoplasma, e vengono classificati in base alle affinità tintoriali
acido-base di questi granuli:
- eosinofili: i granuli si colorano con coloranti acidi (eosina)
- basofili: i granuli assumono colorazioni basiche (ematossilinablu di Metilene)
- neutrofili: I granuli non assumono alcun colorante e rimangono
di colore grigio chiaro.
Una seconda caratteristica dei granulociti è quella di avere un nucleo
polilobato:
- le lobature sono unite da ponti di cromatina
- i neutrofili hanno lobi più numerosi
Per quanto riguarda i granuli si notano differenze tra i neutrofili ed
eosinofili e basofili:
- neutrofili: granuli più piccoli e sparsi uniformemente nel
citoplasma
- basofili e eosinofili: hanno granuli di maggior dimensione e
sono distribiti nel citoplasma in maniera meno omogenea.
I granulociti sono cellule differenziate allo stadio terminale, quindi
hanno perso la capacità di dividersi, per svolgere le loro funzioni:
- fagocitosi per quanto riguarda gli eosinofili e i neutrofili
- secrezione per quanto riguarda i basofili
Al contrario, i linfociti hanno ancora la capacità di proliferare e dividersi
quando la loro funzione è stimolata.
1) Granulociti neutrofili
I granulociti neutrofili sono cellule tondeggianti con un diametro di 9-10
µm e sono i più frequenti componenti della popolazione leucocitaria
(50-70%).
Hanno un nucleo lobato le cui lobature sono unite da ponti
eterocromatinico:
- la cromatina si presenta nella forma addensata
(eterocromatina)
- i granulociti neutrofili di sesso femminile hanno un cromosoma
X visibile come un distaccamento di una lobatura dal nucleo,
detto corpo di Barr.
Alle colorazioni d Giemsa-Wright il citoplasma non si colora molto e i
granuli assumono un aspetto grigio chiaro.
75
I granuli presenti nel citoplasma dei granulociti neutrofili sono:
1) granuli primari: sono detti anche granuli azzurrofili ed hanno
una grandezza media di 0,5 µm. Contengono idrolasi acide, ßgalattosidasi, proteasi,collagenasi, elastasi ecc… poiché sono
granuli di tipo lisosomiale, e rappresentano il 15% dei granuli
totali.
2) Granuli secondari o specifici: hanno dimensioni inferiori rispetto
ai primari e forma ovoidale. Non sono granuli di tipo lisosomiale
e contengono sostanze battericide (lisozima, fagocitina,
fosfatasi alcalina, catalasi)
3) Granuli terziari: hanno un diametro molto piccolo e sono la
classe più numerosa. Appartengono ad un’unica classe dal
punto di vista funzionale.
I granuli azzurrofili (primari) e in parte anche quelli secondari
contengono numerose perossidasi, che svolgono un ruolo
fondamentale negli eventi iniziali della fagocitosi.
Il citoplasma contiene anche:
- piccolo complesso golgiano
- piccolo RER
- mitocondri
- accumuli di glicogeno.
Dal punto di vista funzionale, i granulociti neutrofili svolgono un ruolo
fondamentale nei processi di infiammazione:
- se un corpo estraneo o un agente infettivo o uno stimolo fisico
colpiscono una regione del corpo e nel tessuto connettivo si
sviluppa una infiammazione, i granulociti vengono subito
richiamati dal circolo interstiziale al tessuto
- I granulociti, tramite il processo di diapedesi, si fanno strada
nell’endotelio e giungono nel connettivo in cui è presente
l’infiammazione.
- L’emissione di uno pseudopodio, che rende possibile il
movimento è dovuta alla presenza nella zona infiammata di
sostanze chemiotattiche, prodotte localmente da linfociti e
monociti, che prendono il nome di chemiochine.
-
Il movimento e l’emissione dello pseudopodio è dovuto alla
presenza di un citoscheletro microtubulare composto da actina
e miosina con altre proteine regolatrici.
Il movimento ameboide dipende da:
- actina: permette l’emissione dello pseudopodio
- proteine accessorie e miosina: permettono la contrazione dei
microfilamenti e quindi il movimento ameboide.
Una volta che giunge nel focolaio infiammatorio, il granulocita
neutrofilo esplica la propria funzione fagocitando il materiale
estraneo.
La fagocitosi, è mediata da numerosi recettori sulla membrana del
granulocito:
- FcR: recettore per la porzione Fc delle IgG
- Recettori CR1 e CR2 per il complemento: favoriscono la
fagocitosi di batteri opsonizzati.
Il processo di fagocitosi avviene nelle seguenti tappe:
1) adesione: inizialmente la fagocitosi inizia con l’adesione della
particella alla superficie del granulocito. Se la particella o il
batterio sono stati opsonizzati con specifici anticorpi o proteine
del complemento l’adesione è favorita dalla presenza dei
recettori sulla membrana plasmatica del granulocito
2) internalizzazione: la particella viene fagocitata e internalizzate
con la formazione del fagosoma.
3) Formazione dei fagolisosomi e digestione: i fagosoma si
fondono con i granuli azzurrofili e con i granuli specifici.
Avviene la digestione del materiale fagocitato mediante gli
enzimi litici e le sostanze antibatteriche.
La vita media di un granulocito è di 6-7 ore, per cui, vengono prodotti
ad altissima velocità da parte del midollo osseo.
La morte avviene per apoptosi all’interno dei tessuti.
76
2) Granulociti basofili
I granulociti basofili sono cellule tondeggianti di dimensioni simili a
quelle degli altri granulociti (10-12 µm) e raramente presenti negli
strisci di sangue, poiché sono solamente l’1-0,5% della popolazione
leucocitaria.
-
-
Il nucleo ha una forma irregolare con due o tre lobi connessi da ponti di
cromatina:
- è quasi completamente mascherato dalle granulazioni
specifiche che lo circondano
- non sono visibili nucleoli.
Il citoplasma appare intensamente basofilo, con la colorazione di
Giemsa o di Wright:
- granuli voluminosi a contenuto acido
- i granuli contengono una porzione granulosa e una
membranosa e sono circondati da una membrana unitaria.
Si è dimostrato che il contenuto solubile dei granuli dei basofili è
prevalentemente di:
- eparina: è un glicosamminoglicano a carattere polianionico
- istamina: potente vasodilatatore che aumenta la permeabilità
dei capillari. È rilasciato nel focolaio infiammatorio con la
degranulazione.
Sono molto simili ai mastociti del tessuto connettivo:
- identico contenuto dei granuli
- identica funzione
Come i granulociti neutrofili, anche i granulociti basofili e i mastociti
(che contengono eparina e istamina) possono essere causa di gravi
conseguenze per l’organismo:
- le IgE sono una particolare classe di anticorpi prodotti dalle
plasmacellule in seguito alla stimolazione di linfociti B da parte
di determinati antigeni.
- le IgE si localizzano sui recettori presenti sulla membrana di
mastociti e granulociti basofili.
Se nell’organismo viene introdotto il medesimo antigene che ha
portato i linfociti B a stimolare le plasmacellule a produrre le
IgE, questo si lega al complesso anticorpale (recettore-IgE)
presente sulle membrane dei mastociti e dei granulociti basofili.
Ciò causa una degranulazione con rilascio massivo di
istamina,
Il rilascio di istamina causa una vasodilatazione che comporta
una caduta della pressione sanguigna molto rapida causando
lo shock anafilattico.
3) Granulociti eosinofili
I granulociti eosinofili sono granuli tondeggianti con dimensioni
comuni a quelle degli altri granulociti.
Il nucleo si presenta plurilobato con meno lobature rispetto ai neutrofili
(in genere 1,2 o 3).
Il citoplasma si colora, con metodi di Giemsa-Wright con la porzione
acidofila:
- i granuli di grosse dimensioni (0,4-0,7 µm) hanno un contenuto
di proteine basiche.
- I granuli sono ricoperti da membrana singola e presentano al
loro interno un cristalloide, che a livello substrutturale ha una
periodicità lineare di 3 o 4 nm.
Nel citoplasma si possono osservare:
- granuli di glicogeno
- microtubuli e microfilamenti al di sotto della MP
- maggiori mitocondri rispetto ai neutrofili
- complesso di Golgi di dimensioni discrete
La matrice dei granuli contiene:
- per ossidasi
- enzimi lisosomiali
Il cristalloide, invece, è formato da:
- proteina basica maggiore (MBP)
77
-
proteina cationica degli eosinofili (ECP)
entrambe queste proteine del cristalloide hanno funzione tossica per
agenti patogeni e parassitari.
In condizioni normali, i granulociti eosinofili sono il 2-4% della
popolazione leucocitaria:
- in caso di malattie allergiche e infestazioni di parassiti si ha un
aumento degli eosinofili, quindi una eosinofilia.
I granulociti eosinofili compiono movimenti ameboidi, per portarsi sui
siti di infiammazione dove:
- fagocitano il complesso antigene-anticorpo
- secernono sostanze tossiche (ECP e MBP) per gli agenti
patogeni
L’azione degli eosinofili è modulata da fattori che agiscono sulla
maturazione, sulla produzione e secrezione di fattori eosinofili e
eosinofilotattici:
- il loro accumulo nei tessuti è dovuto al rilascio di sostanze
chemiotattiche prodotte da linfociti, granulociti basofili e
mastociti.
LEUCOCITI MONONUCLEATI.
1) Linfociti
I linfociti sono cellule che popolano:
- sangue
- organi e tessuti linfoidi
- linfa
Nel sangue sono nella forma inattiva, presentandosi come cellule di
piccole dimensioni, con elevato rapporto nucleo/citoplasma.
I linfociti dei tessuti linfoidi sono invece nella forma attiva, e sono
attivati da:
-
linfochine, sostanze attivatici prodotte dai linfociti stessi
stimolazione antigenica
I linfociti attivati presentano:
- dimensioni maggiori
- modificazione della cromatina
- modificazione nella struttura e nella distribuzione degli organuli.
Nel sangue, i linfociti rappresentano il 20-40% dei leucociti circolanti.
Hanno una forma tondeggiante con un diametro di circa 7-8 µm.
Il nucleo dei linfociti è tondeggiante e talvolta presenta una in
dentatura che gli conferisce la classica forma “a fagiolo”:
- la cromatina si trova fortemente allo stato condensato ed è
intensamente colorata
- il nucleo occupa gran parte della cellula
Il citoplasma presenta, al MO, granuli azzurrofili molto scarsi, che
formano un orletto intoro al nucleo.
Nel piccolo linfocita, al ME si possono osservare:
- membrana plasmatica irregolare con presenza di alcuni
microvilli
- nucleo compatto con contorni irregolari
- rari mitocondri
- centrioli ben visibili
- complesso di Golgi poco sviluppato
- RER quasi assente
- Pochi lisosomi
- Parecchi poliribosomi liberi.
Nei grandi linfociti si può osservare:
- nucleo con in dentatura più accentuata
- ingrandimento delle cisterne del RER
- apparato di Golgi più sviluppato
- numero maggiore di mitocondri e lisosomi
78
I linfociti non sono cellule differenziate al loro ultimo stadio:
- possiedono la capacità proliferativa
- possono differenziarsi in elementi effettori e produrre cellule
dotate di memoria che possono persistere per decenni.
Si è dimostrato che esistono differenti tipi di linfociti:
- linfociti B
- linfociti T
- linfociti NK
I linfociti T sono cellule che possiedono antigeni cellulari, mentre i
linfociti B possiedono antigeni solubili:
- queste due classi sono responsabili dell’immunità specifica o
acquisita.
I linfociti B e T, quando incontrano l’antigene:
- si attivano e iniziano a moltiplicarsi
- possono dare origine a cellule-memoria
I linfociti NK, (natural killer), sono cellule con attività citotossica, che
appartengono all’immunità naturale, o aspecifica:
- non sono cellule capaci di memoria
- hanno solo attività citotossica aspecifica.
I linfociti NK rappresentano generalmente il 20% della popolazione
linfocitaria, contro il 10% dei linfociti B e il 70% dei linfociti T.
I linfociti NK esocitano vescicole lisosomiali che uccidono la cellula
bersaglio tramite:
- perforine (proteine che perforano la membrana plasmatica)
- enzimi che uccidono la cellula.
Il modo con cui un NK aggredisce una cellula dipende dalla presenza
di eventuali recettori o meno. Vi sono quindi due modalità:
1) antobody dependent cellular cytotoxicity (ADCC): il linfocita NK
riconosce il recettore per l’Fc
2) natural cytotxic receptor (NCR): riconosce recettori che attivano
ligandi sulle cellule tumorali.
Sulla membrana della cellula NK sono presenti numerosi recettori di
istocompatibilità:
- se il linfocita NK riconosce gli antigeni di istocompatibilità sulla
cellula bersaglio non la distrugge
- se non vi sono antigeni di istocompatibilità, la cellula bersaglio
viene distrutta.
Le cellule tumorali tendono generalmente a alterare la composizione
degli HLA (Ag di istocompatibilità), quindi sono riconosciute come
dannose dagli NK.
2) Monociti
I monociti sono cellule di grandi dimensioni che sono presenti nel
sangue:
- sono i precursori dei macrofagi del tessuto connettivo
- sono il 3-8% della popolazione leucocitaria
- hanno dimensioni maggiori rispetto ai linfociti, benché la
morfologia sia simile
- il diametro è di 14-17 µm
- hanno forma variabile,
- spesso hanno contorni irregolari per la presenza di pseudopodi
che gli permettono i movimenti ameboidi.
Dal punto di vista morfologico, se colorati con la colorazione GiemsaWright presentano:
- citoplasma abbondante colorato in grigio-azzurro
- contengono numerosi granuli azzurrofili
- nucleo con un aspetto reniforme o di forma irregolare ed è
unico.
I granuli presentano positività a perossidasi e a fosfatasi acide, quindi
sono stati considerati come lisosomi.
I monociti sono prodotti dal midollo osseo e immersi nel flusso
sanguigno:
79
-
rimangono nel sangue per 24/72 h massimo
dopo essere stati in circolo migrano nei tessuti divenendo
macrofagi.
Nei tessuti circostanti i vasi vi risiedono per mesi.
In presenza di un focolaio infiammatorio migrano nel tessuto
infiammato divenendo macrofagi e iniziano una intensa attività
fagocitarie:
- giungono successivamente rispetto ai granulociti neutrofili.
Molti monociti che si sono trasformati in macrofagi risiedono
stabilmente in alcuni tessuti e sono detti macrofagi residenti:
- assumono un nome particolare a seconda del tessuto in cui
risiedono.
L’attività fagocitarie dei macrofagi non è l’unica funzione, ma questi
svolgono anche una importante attività secretoria:
- secernono proteasi neutre e idrolasi acide, capaci di attaccare
anche proteine extracellulari
- secernono anche citochine, che modulano l’attività di altre
cellule nella risposta immunitaria.
La membrana del macrofago è attrezzata per interagire con numerosi
complessi differenti al di fuori della cellula. Presenta inoltre un vasto
corredo di recettori, tra cui:
- recettori per la porzione Fc delle IgG
- recettori per il mannosio (PRR), che permettono di riconoscere
i globuli rossi invecchiati e fagocitarli
- recettori per la fosfatidilserina, che viene esposta sulle cellule
apoptotiche.
- Recettori per le chemiochime
LINFA
La linfa è un liquido trasparente, alcalino, che circola nei vasi linfatici:
- la velocità di circolazione è molto bassa, poiché il motore della
circolazione linfatica sono le contrazioni muscolari
- una contrazione determina una notevole spremitura, operando
un maggiore smaltimento dei prodotti di metabolismo a livello
tissutale.
La linfa si forma per il drenaggio del liquido presente negli spazi
interstiziali negli organi e nei tessuti vari:
- il liquido converge in capillari linfatici, solitamente a fondo
cieco, passando attraverso una parete molto sottile che
circonda il vaso
- l’entrata del liquido è regolata dalla pressione osmotica.
- I vari capillari si anastomizzano e retificano tra loro
convergendo in canali di dimensioni maggiori detti collettori
linfatici.
- Lungo i collettori linfatici sono presenti delle stazioni di
filtrazione detti linfonodi.
Tutti i collettori linfatici che incontrano i linfonodi, si accrescono
convergendo tra loro, anastomizzandosi tutti nel dotto toracico:
- attraverso questo, la linfa viene immessa nel torrente
circolatorio.
La linfa è formata da:
- porzione liquida
- porzione corpuscolata
La componente liquida contiene:
- pochi sali
- colesterolo
- lecitina
- anidride carbonica
- piccole quantità di ossigeno
- altri prodotti del ricambio tissutale
80
I composti organici presenti nella componente liquida dipendono dalla
zona in cui si formano.
La linfa contiene fibrinogeno, quindi può coagulare.
A livello dell’intestino, dopo il pasto, vengono confluiti nei vasi linfatici
dei corpuscoli lipidici detti chilomicroni.
La componente corpuscolare è formata quasi esclusivamente da
linfociti:
- vengono immessi a livello dei linfonodi
- poi vengono immessi nel torrente circolatorio.
8. tessuto linfoide
-
MALT (tessuto linfoide associato alle mucose)
Milza
Al MALT appartengono:
- i vari ordini di tonsille,
- le placche di Peyer dell’intestino
- l’appendice ileo ciecale
Negli organi linfoidi primari, si assiste alla fase in cui i linfociti si
differenziano a partire dalle cellule staminali appartenenti alla linea
linfoide:
- questa tappa è detta fase antigene-indipendente poiché i
linfociti non necessitano dello stimolo esterno
Negli organi linfoidi secondari i linfociti svolgono la loro funzione dopo
essere stati attivati dall’incontro con l’antigene:
- questa è la fase antigene-dipendente.
INTRODUZIONE
FASE ANTIGENE-INDIPENDENTE.
Il tessuto linfoide è una varietà di tessuto connettivo che si
caratterizza per a ricchezza di linfociti, che insieme ad altre linee
cellulari si trovano immersi nello stroma formato da fibre reticolari.
Gli organi emopoietici danno vita a due linee cellulari differenti:
- mieloide: è la linea che produce elementi figurati quali gli
eritrociti, i granulociti, le piastrine e i monociti
- linfoide: è la linea che produce tutti i linfociti
Il principale organo mieloide è il midollo osseo, mentre gli organi
linfoidi primari, ovvero i principali siti in cui vengono differenziati i
linfociti, sono due:
- il midollo osseo: in cui si differenziano i linfociti B,
- il timo; in cui si differenziano i linfociti T.
Vi sono anche degli organi linfoidi secondari o periferici, in cui i
linfociti maturi migrano e svolgono la loro funzione:
- linfonodi
Negli organi linfoidi primari si genera la diversità immunologia:
- nascono cellule dotate di recettori in grado di riconoscere tutti
gli antigeni esistenti
Alla fine del differenziamento negli organi linfoidi primari si ottengono i
linfociti maturi vergini:
- sono linfociti che sono pronti a ricevere l’antigene, ma non lo
hanno ancora incontrato
- sono allo stato inattivo
- migrano verso gli organi linfoidi periferici.
Ogni linfocita maturo vergine ha una specificità antigenica propria,
ovvero può riconoscere un antigene differente rispetto a quella degli
altri antigeni.
FASE ANTIGENE-DIPENDENTE.
Questa fase avviene negli organi linfoidi periferici:
81
-
inizia dall’incontro con l’antigene con la cellula linfocitaria che
possiede il recettore specifico per quell’antigene
IMMUNITA’ UMORALE
La risposta umorale colpisce prevalentemente agenti estranei come i
batteri, le tossine e i parassiti.
DIVERSITA’ E FUNZIONI DEI LINFOCITI.
I linfociti sono i costituenti principali del sistema immunitario, il quale è
un sistema presente nei Vertebrati che è in grado di difendere
l’organismo dall’attacco di agenti patogeni.
Ogni sostanza estranea all’organismo è definita come antigene (Ag):
- il sistema immunitario è in grado di riconoscere gli antigeni
- può distinguerne milioni di tipi differenti
- può anche avere una memoria di un dato antigene per avere
una risposta immunitaria più rapida e efficace all’eventuale
incontro successivo.
Il sistema immunitario, inoltre, è in grado di:
- regolare l’attività di alcune cellule emopoietiche
- sorvegliare contro i tumori
- scatenare reazioni che portano al rigetto di organi dopo il
trapianto.
Il sistema immunitario è quindi in grado di riconoscere ciò che è
proprio dell’organismo, da ciò che è estraneo:
- in questo modo si evita un’aggressione nei confronti dei
costituenti propri dell’organismo
- se questa aggressione contro i propri costituenti si verifica, si
parla di autoimmunità.
La presenza di due sedi di generazione dei linfociti sottintende anche
la produzione di linfociti differenti, con differenti risposte immunitarie:
- risposta umorale, o anticorpo-mediata: effettuata dai linfociti B
- risposta cellulare o cellula-mediata: effettuata dai linfociti T.
I linfociti B sono gli effettori della risposta umorale, che comporta la
secrezione di glicoproteine, della famiglia delle immunoglobuline, gli
anticorpi (Ab, antibody) in seguito alla penetrazione di organismi
patogeni.
Ogni anticorpo si lega ad una particolare regione della molecola
antigenica, detta determinante antigenico o epitopo:
- ogni anticorpo è specifico per ciascun epitopo.
I recettori per gli Ag delle cellule B sono le immunoglobuline,
glicoproteine che hanno dei siti che possiedono la specificità per nun
determinante antigenico e vengono prodotte dalle cellule B nel corso
delle risposte umorali:
- le Ig di membrana sono formate da 4 catene glicoproteiche
uguali a due a due
- vi sono due catene pesanti (H) e due catene leggere (L).
- il sito combinatorio per l’antigene è composto da un centinaio
di amminoacidi nell’estremità N-terminale
- ogni Ig possiede due siti combinatori per l’antigene. È cioè una
molecola bivalente.
Alle immunoglobuline, all’interno della cellula B si legano due molecole
che traducono il segnale all’interno della cellula in caso di legame:
- Ig e Ig.
IMMUNITA’ CELLULARE
L’immunità cellulare, operata dai linfociti T, attua la sua difesa contro
delle cellule, che presentano all’esterno della loro membrana degli
antigeni.
La risposta cellulare avviene contro cellule tumorali, cellule infettate da
virus, cellule trapiantate non istocompatibili.
82
La risposta cellula-mediata avviene anche in assenza di anticorpi, con
l’interazione diretta tra la cellula T e l’antigene e la successiva
uccisione della cellula.
Le cellule T possono produrre altri effetti al riconoscimento
dell’antigene:
- possono produrre e secernere fattori regolatori solubili detti
linfochine, che attivano o disattivano altre cellule
- possono dare reazioni di ipersensibilità in ritardo.
Il recettore per l’antigene delle cellule T (TCR), è generalmente un
eterodimeri costituito da due catene e , che è presente sul 95%
delle cellule T.
A livello delle mucose è possibile riscontrare un altro tipo di TCR,
formato da due catene e
Ogni TCR è sempre legato ad un complesso glicoproteico denominato
CD3, che ha la funzione di tradurre il segnale di attivazione all’interno
della cellula.
RISPOSTA DEI LINFOCITI NK.
La terza popolazione lifocitaria è quella dei linfociti NK (Natural killer):
- questi linfociti non presentano recettori, quindi svolgono
funzioni di difesa indipendentemente dal riconoscimento
dell’antigene
- sono la popolazione filogeneticamente più antica.
La loro capacità di uccidere le cellule si porta contro:
- cellule opsonizzate (ricoperte da anticorpi)
- cellule infettate da virus
- cellule neoplastiche.
Un’altra funzione delle cellule NK è quella di produrre una varietà di
fattori che regolano la produzione di altre cellule emopoietiche come
eritrociti e granulociti.
La funzione citotossica dei linfociti NK si svolge attraverso le seguenti
tappe:
1) aggancio tra la cellula NK e la cellula bersaglio (target)
2) attivazione dell’NK
3) rilascio di perforane, che perforano la membrana plasmatica
della cellula attaccata
4) introduzione di enzimi litici nei pori che permettono la morte
della cellula infetta.
MARCATORI DEI LINFOCITI UMANI.
Un marcatore è un segno d’identità che contraddistingue un linfocita
nell’ambito di una popolazione.
Marcatori, nel caso dei linfociti, sono i recettori per l’antigene, ma ora
sono anche disponibili dei marker genici, che individuano cioè una
sequenza di geni che codificano per i recettori di membrana.
I marcatori possono trovarsi in differenti località all’interno della cellula:
- sulla membrana plasmatica
- nel nucleo
- nel citoplasma
Questo tipo di marcatori, usati per i linfociti, sono detti marcatori
fenotipici, e servono per:
- indicare l’appartenenza di un linfocita a una data popolazione
- definirne il livello maturativi e lo stato di attivazione.
I marcatori specifici per le cellule B e T sono i RECETTORI PER
L’ANTIGENE, espressi sulla membrana plasmatica.
Esistono tuttavia anche atri tipi di recettori specifici sulla loro
membrana.
83
MARCATORI PER I LINFOCITI T
MARCATORI DELLE CELLUE NK.
I marker inequivocabili per i linfociti T sono dati da:
- TCR, recettore di membrana
- CD3+, complesso che trasduce il segnale all’interno della
cellula T
I linfociti NK non esprimono recettori per antigeni, e sono il 10-20%
dei linfociti nel sangue.
Cellule che possiedono questi due complessi glicoproteici (linfociti T)
sono il 60-80% della popolazione linfocitaria del sangue.
Nell’ambito dei linfociti T (CD3+ e TCR), sono individuabili altre tre
sottopopolazioni in base alla presenza di CD4+ e CD8+:
1) TCR CD3+ CD4+: sono dette T-regler, poiché hanno la
funzione regolativa su altre cellule del sistema immunitario
(altre T, B, NK, ecc..)
2) TCR CD3+ CD8+: sono cellule T-citotossiche (Tc) poiché sono
capaci di uccidere le cellule bersaglio dopo averne riconosciuto
lo specifico antigene.
3) TCR CD3+: sono cellule che non possiedono né CD4 né
CD8 e il loro TCR non ha le catene alfa/beta, ma quelle
gamma/delta. Queste cellule hanno la capacità di riconoscere
solamente alcune conformazioni glucidiche presenti sui batteri.
MARCATORI PER I LINFOCITI B.
I marcatori principali per le cellule B sono le immunoglobuline
(smIg), ma vi possono esistere altri tipi di marcatori:
- antigeni di istocompatibilità di classe II (HLA)
- recettori per i componenti del sistema del complemento (C3b
o CR1 e C3D o CR2)
- l’antigene CD20
Le cellule B rappresentano il 10-15% della popolazione linfocitaria, e i
più comuni sono quelli che esprimono le IgM e le IgD. Altre cellule
possono esprimene IgG, IgA, IgE:
- le varie classi delle immunoglobuline differiscono per il tipo di
catena pesante (H) che si combina con quella leggera.
Il più attendibile marcatore sulle cellule NK è il recettore per la
porzione Fc delle immunoglobuline, detto FcR:
- è la parte opposta al sito di legame con l’antigene
- è la porzione delle due catene pesanti che va dalla cerniera alla
parte C-terminale della Ig.
Attraverso gli FcR, i linfociti NK possono riconoscere i batteri e altre
cellule che sono state opsonizzate da linfociti di altro tipo (linfociti B).
Un altro marcatore è il CD56, che è un recettore per l’HLA di classe II,
ovvero per gli antigeni di istocompatibilità:
- questo recettore permette ai linfociti NK di riconoscere le cellule
dell’organismo affinché non vengano distrutte.
ATTIVAZIONE DEI LINFOCITI.
Il sistema immunitario ha una organizzazione clonale:
- i recettori di membrana presenti sui linfociti B e T portano a
generazioni di cellule che esprimono recettori di membrana
capaci di riconoscere gli antigeni in maniera specifica.
Un clone è un insieme di cellule che presentano recettori per il
medesimo antigene:
1) al termine dell’ontogenesi delle cellule B e T si formano dei
cloni differenti senza la presenza di antigeni (fase antigeneindipendente)
2) le cellule immunocompetenti mature passano dal sangue, ove
vengono riversate dagli organi linfoidi primari, e giungono negli
organi linfoidi secondari, dove incontrano l’antigene.
L’incontro con l’Ag porta all’attivazione del linfocita, con l’innesco di
numerosi processi:
84
1- si ha una espansione clonale data dalla proliferazione
massiva delle cellule attivate (quelle con il medesimo antigene)
2- si ha la generazione di cellule effettrici, ovvero cellule che
sono attivamente coinvolte nella risposta immunitaria
3- nascono così cellule memoria: cellule in grado di avere una
risposta più efficiente in caso di un nuovo incontro con lo
stesso Ag.
LINFOCITI T
Gli effettori T sono cellule simili ai linfociti T che si sono modificati
divenendo linfoblasti T:
- possono essere granulari o agranulari
- hanno attività citotossica Ag-specifica (a differenza degli NK
che la hanno aspecifica)
- contengono perforine simili a quelle presenti negli NK
L’attivazione delle cellule T porta anche alla produzione di fattori che
stimolano modificazioni nei linfociti T inattivi:
- sono in grado di produrre IL2 (interleuchina 2) che viene
riconosciuta dai recettori presenti sui linfociti T a riposo
I linfociti T vengono attivati in seguito al riconoscimento da parte
dell’antigene del complesso TCR/CD3.
LINFOCITI B
La caratteristica peculiare dell’attivazione dei linfociti T è quella del
riconoscimento associativo:
- i linfociti T non riconoscono antigeni in forma solubile o isolati,
ma solo Ag che gli sono presentati da altre cellule, dette APC
(antigen presenting cells)
- le APC possiedono l’antigene in una tasca della molecola HLA
(antigene di istocompatibilità).
- La cellula T si lega all’antigene mediante il complesso
TCR/CD3, mentre nel frattempo si lega con un’altra
glicoproteina di membrana (molecola di adesione) per
stabilizzare il legame.
I linfociti T di classi differenti si legano ad HLA di tipo differente:
- le cellule Th si legano con HLA di classe II (HLA-DR)
espresse sull’APC
- i linfociti Tc si legano ad antigeni infossati in HLA di classe I
(HLA-A, B, C).
Quando si ha il riconoscimento dell’Ag, si avvia una serie di fenomeni
di attivazione che portano a:
- generazione di cellule effettrici
- amplificazione del clone Ag-specifico.
I linfociti B, a differenza dei linfociti T, rispondono ad antigeni
solubili.
L’attivazione dei linfociti B segue due differenti percorsi si
differenziazione:
- generano cellule terminali, le plasmacellule, che durante la
loro breve vita (dura pochi giorni) secernono anticorpi con
specificità identica a quella delle smIg dei linfociti B che li
generano
- generazione di cellule B memoria, che sono elementi con
lunga vita che si localizzano in centri germinativi secondari, per
assicurare una risposta più rapida nel caso in cui si ripresenti lo
stesso Ag.
Poiché le plasmacellule sono elementi terminali, con la loro morte, la
quale avviene dopo pochi giorni dal loro differenziamento, comporta la
perdita di numerosi cloni immunocompetenti:
- questa perdita, al ripresentarsi dell’Ag specifico è compensata
dalle cellule B memoria.
- Queste cellule si differenziano e producono nuove
plasmacellule
85
Dal punto di vista morfologico, una plasmacellula vede ampliare gli
apparati sintetici delle cellule B:
- si amplia il RER
- i sistemi di trasporto e di secrezione di immunoglobuline
- si amplia l’apparato di Golgi
- si sviluppano numerose vescicole lisosomiali che contengono
idrolasi acide
L’attivazione delle cellule B comporta anche:
- comparsa di immunoglobuline citoplasmatiche nella
plasmacellula
- ogni plasmacellula presenta un solo tipo di Ig
- vengono espressi sulla membrana i marcatori di attivazione
- compaiono i recettori per i fattori di crescita e di
differenziamento
Tuttavia, con l’attivazione si ha la scomparsa dei recettori per le
proteine del complemento e per quelli della porzione Fc delle Ig (FcR).
LINFOCITI NK.
L’attivazione delle cellule NK avviene con due differenti modalità:
1) stimolazione mediante molecole solubili
2) attivazione in seguito all’interazione con la cellula bersaglio
La stimolazione mediante fattori solubili, come ad esempio IL2 o
interferoni aumenta l’attività citotossica:
- promuove la granulogenesi
- significa che prepara i fattori citotossica all’interno dei granuli
pronti ad essere rilasciati.
L’attivazione derivante dall’interazione con la target cell comporta
una riorganizzazione di tutto il citoscheletro:
- la cellula NK cambia forma e facilita il rilascio dei granuli
- vengono rilasciati i granuli contenenti perforine e poi quelli con
enzimi litici.
La cellula NK citotossica si svuota completamente dei granuli ed è in
grado di ripristinare il proprio contenuto in meno di un giorno.
ORGANI LINFOIDI PRIMARI.
Gli organi linfoidi primari sono:
- midollo osseo, in cui vengono differenziati, dalla linea linfoide
della staminale pluripotente, i linfociti B
- timo, in cui vengono differenziati i linfociti T.
TIMO
Il timo è un organo impari costituito da due lobi localizzato nel
mediastino anteriore in posizione retrosternale:
- ha derivazione ectodermica (la parte corticale) e endodermica
(la parte midollare)
- ciascun lobo, è diviso in lobuli da sepimenti di tessuto
connettivo.
La maturazione dei linfociti T dipende dall’interazione tra:
- linfociti T immaturi, detti anche timociti
- cellule epiteliali stremali del timo (macrofagi, cellule dendritiche,
ecc…)
Un linfocita T deve possedere due caratteristiche fondamentali:
- devono avere delle restrizioni per MHC autologo, ovvero i
recettori per gli HLA presenti sulla membrana del linfocita T
devono avere affinità intermedia per quelli presenti sulle cellule
epiteliali e stremali della corticale del timo
- devono avere tolleranza per il SELF, ovvero non devono
riconoscere gli Ag del proprio organismo per non distruggere
cellule self.
Per questo, ad opera delle cellule epiteliali del timo e dei macrofagi
avviene:
86
-
una selezione positiva: che mantiene i linfociti con MHC
compatibili
una selezione negativa: che distrugge i linfociti i cui recettori
riconoscono antigeni self.
La maturazione dei linfociti T avviene con il riarrangiamento dei geni
del TCR.
Nel timo, i linfociti T possono avere due destini:
- diventare alfa/beta, quindi andare incontro a selezione positiva
e negativa
- diventare gamma/delta e quindi non andare incontro ad alcuna
selezione.
I linfociti T vanno incontro a due differenti fenomeni differenziativi:
1) maturazione intratimica: in cui il progenitore linfoide entra nel
timo a livello corticale e esce dalle arterie della midollare per
andare agli organi linfoidi periferici
2) maturazione extratimica: data dall’incontro con l’antigene, per
dare una risposta efficace contro lo stesso Ag.
ORGANI LINFOIDI SECONDARI.
Gli organi linfoidi periferici sono costituiti da:
- linfonodi
- milza
- tessuto linfoide associato alle mucose (MALT).
In questi tessuti migrano i linfociti in seguito alla maturazione antigeneindipentente:
- negli organi linfoidi secondari possono avere l’occasione di
incontrare l’antigene e andare incontro all’attivazione.
- Vi sono zone distinte a seconda della linea cellulare che li
colonizza (T dipendente e B dipendente).
- Sono organi interconnessi con il sistema di vasi sanguigni e
linfatici
LINFONODO
È un tipico ograno linfoide periferico. Si possono distinguere i esso tre
zone, procedendo dalla periferia all’ilo:
- zona corticale: è una zona B-dipendente, organizzata in follicoli
linfoidi primari e secondari.
o I follicoli primari: presentano linfociti B maturi che non
hanno ancora incontrato l’Ag
o I follicoli secondari sono costituiti da due regioni. Una
regione scura (mantello) e una regione chiara, detta
centro germinativo (ricca di cellule B memoria che poi si
accumulano nel mantello).
- Paracortex: è una zona intermedia, ricca di linfociti T-helper.
- Midollare: è ancora un’area B-dipendente, organizzata in
cordoni di cellule separati da seni linfatici, che convergono
verso l’ilo del linfonodo. Nei cordoni della midollare sono
presenti cellule B attivate e plasmacellule.
Il linfonodo è una delle sedi in cui i linfociti possono andare incontro ad
attivazione da parte del proprio antigene:
- giungono al linfonodo tramite i vasi linfatici afferenti e si
posizionano nei follicoli della corticale (linfociti B) e nella
paracortex (linfociti T).
- in queste zone i linfociti possono incontrare il proprio antigene
- quando avviene l’incontro, queste si attivano e proliferano
- i linfociti lasciano il linfonodo dopo alcuni giorni come cellule
effettrici o plasmacellule.
Se non avviene l’incontro con l’Ag, i linfociti ritornano in circolo tramite i
vasi efferenti.
MILZA
La milza è un organo che è presente nell’ipocondrio sinistro, con un
peso di alcune centinaia di grammi
È un organo specializzato nel catturare Ag presenti nel sangue:
87
-
un’arteria perfora la capsula si ramifica via via in sinusoidi che
poi fanno fuoriuscire il sangue attraverso la vena splenica.
La milza è un organo linfoide secondario particolare:
- ha una struttura emo-linfatica
- infatti rispechia le sue due funzioni.
Nell’uomo, la funzione della milza è:
- funzione linfopoietica: è luogo in cui si ha espansione dei
cloni di cellule T e B in seguito a stimolazione antigenica (gli Ag
provengono dal sangue)
- funzione emocateretica: distrugge gli elementi figurati
invecchiati (eritrociti e piastrine).
Dal punto di vista strutturale, la milza si distingue in:
- polpa bianca
- polpa rossa
Nella polpa bianca il sangue arriva attraverso l’arteria splenica, la
quale si suddivide in numerose collaterali all’interno del parenchima
della milza.
-
Terminano a fondo cieco.
La polpa rossa è formata da un parenchima e da sinusoidi venosi:
- il parenchima è costituito da capillari rivestiti da macrofagi e
cellule del sangue che hanno abbandonato i capillari e non
sono ancora rientrati nei seni venosi
I seni venosi sono rivestiti da particolari cellule endoteliali:
- vi sono ampi spazi tra la lamina basale e le cellule endoteliali
- convergono poi nelle vene spleniche.
I macrofagi splenici hanno il compito di fagocitare gli eritrociti
invecchiati, mediante l’interazione tra:
- recettore per il mannosio esposto sulla superficie del
macrofago splenico
- mannosio esposto sulla membrana dell’eritrocito per la perdita
dell’acido sialico.
Sia nella polpa bianca che in quella rossa sono presenti linfociti NK.
MALT
Le diramazioni più piccole sono dette arterie centrali e sono
circondate da un manicotto cilindrico di linfociti detto rivestimento
periarteriolare linfoide (PALS):
- contiene numerosi linfociti T helper CD4+
- è circondato da una zona follicolare
I follicoli che circondano il PALS rappresentano un’area B-dipendente:
- in caso di incontro con l’antigene, si sviluppano nei follicoli dei
centri germinativi con mantello annesso
Nella zona più esterna, sono presenti numerosi linfociti T.
Dalle arterie centrali si distaccano le arteriole peniciliari, che si
suddividono in capillari rivestiti:
- questi sono la sede del primo filtraggio del sangue,
- sono rivestiti da macrofagi.
Il tessuto linfoide aggregato alle mucose è distribuito:
- lungo il tratto gastroenterico, in zone come le tonsille, le
placche intestinali di Payer, l’appendice.
- In piccola parte anche lungo l’albero bronchiale.
Negli aggregati alle mucose, sono presenti follicoli che possono avere
dei centri germinativi simili a quelli dei linfonodi:
- in questi aggregati vi sono cellule B e T capaci di riconoscere
l’antigene e cellule accessorie che lo presentano.
- A livello delle mucose sono prodotte tutte le classi di anticorpi,
con prevalenza delle IgA, che sono secrete associate ad una
proteina altamente glicosilata che li protegge da enzimi
proteolitici.
88
L’epitelio che riveste i MALT, è altamente specializzato nel selezionare
gli antigeni contenuti nel lume intestinale, agendo come un vaso
linfatico afferente.
9. il tessuto nervoso
INTRODUZIONE
I vasi linfatici associati al malt sono solo di tipo efferente e drenano nei
linfonodi regionali assieme ai vasi linfatici degli altri tessuti.
Il tessuto nervoso è formato da una rete di cellule comunicanti tra loro
che sono le unità strutturali e funzionali del sistema nervoso. Questo
sistema è diffuso in tutto l’organismo.
CIRCOLAZIONE DEI LINFOCITI.
I linfociti B e T maturi escono dagli organi linfoidi primari:
- vanno nel sangue
- giungono agli organi linfoidi secondari
Dagli organi linfoidi secondari, posson prendere due vie:
- quella linfatica
- quella ematica.
Negli organi linfoidi, i linfociti non sono statici, ma hanno un profondo
dinamismo, che li porta completamente in circolo attraverso i due
sistemi di vasi.
La rotta ematica:
- i linfociti raggiungono la milza tramite l’arteria splenca
- attraversano la polpa bianca e la polpa rossa
- escono dalla milza per via venosa
La rotta linfatica prevede l’arrivo agli organi linfoidi secondari per via
arteriosa:
- dagli organi linfoidi secodari i linfociti possono uscire attraverso
dei vasi linfatici dette vene ad endotelio alto
- raggiungono il tessuto linfoide
- passano in vasi linfatici afferenti che via via confluiscono nel
dotto toracico
- dal dotto toracico si riversano nel flusso sanguigno.
Le principali funzioni del tessuto nervoso sono:
- la comunicazione
- la secrezione endocrina.
Per quanto riguarda a comunicazione:
- il tessuto nervoso mette in comunicazione tutte le parti
dell’organismo e l’ambiente esterno
- riceve stimoli dall’interno e dall’esterno ed è in grado di
rielaborarli e stimolare risposte appropriate e coordinate tra i
vari organi
La funzione endocrina è attuata da cellule nervose che in partocolari
zone producono e rilasciano ormoni.
Il sistema nervoso è la sede dei fenomeni psichici.
CLASSIFICAZIONE DEL SISTEMA NERVOSO.
Negli umani il sistema nervoso viene distinto in due componenti con
funzione differente:
- sistema nervoso cerebro-spinale o somatico, detto anche
della vita di relazione
- sistema nervoso autonomo o simpatico, detto anche della
vita vegetativa.
Il sistema nervoso cerebro-spinale, controlla la muscolatura
volontaria ed è formato da due tipi di sistemi tra loro collegati:
Si calcola che i linfociti B e T soggiornino per 6 ore in un linfonodo e
completino il circolo in un giorno.
89
-
sistema nervoso centrale (SNC): costituito dall’encefalo
(cervello+cervelletto) e da parte del midollo spinale.
Sistema nervoso periferico (SNP): costituito dai nervi (cranici,
spinali, ramificazioni e gangli)
Le cellule nervose si situano:
- nell’SNC
- nei gangli
I gangli sono complessi formati da neuroni con altre cellule satelliti,
che fungono da supporto.
I nervi sono i prolungamenti delle cellule nervose sottoforma di fibre,
che hanno conduzione centrifuga o centripeta.
Il sistema nervoso autonomo o simpatico controlla le contrazioni
involontarie della muscolatura liscia ed è formato da:
- sistema nervoso simpatico: situato in posizione tronco-lombare,
che causa reazioni di eccitazione
- sistema nervoso ortoimpatico: è situato nella zona craniosacrale, ha funzioni maggiormente inibitorie.
Gli organi nervosi sono formati da differenti tessuti:
- tessuto nervoso
- tessuto della nevroglia
- tessuto vascolare.
Le cellule della glia e il microcircuito sono di fondamentale appoggio ai
neuroni, cosicché gli organi nervosi sono dei veri e propri complessi
pluritissutali.
IL NEURONE
Il sistema nervoso è formato da due tipi di cellule:
- i neuroni,
- le cellule della glia, che hanno funzioni di sostegno.
Il neurone è l’unità fondamentale e funzionale per l’espletamento della
mansione deputata al sistema nervoso:
- la ricezione, la conduzione e la trasmissione dell’impulso.
Le principali caratteristiche attribuite ai neuroni sono:
- irritabilità: capacità di reagire agli stimoli e di trasformarli in
impulsi nervosi
- conducibilità: capacità di trasmettere gli stimoli
- polarizzazione funzionale: l’impulso si propaga secondo
direzioni preferenziali
L’impulso nervoso è permesso dal passaggio di ioni Na+ e K+
nell’ambiente intra o extracellulare in modo da creare una differenza di
potenziale:
- la differenza di potenziale che si trasmette causa il rilascio di
neurotrasmettitori a livello delle sinapsi, giunzioni particolari
tipiche del tessuto nervoso.
- Vengono trasmessi alle cellule effettrici o ad altri neuroni.
Le componenti morfologiche principali di u neurone sono:
1) il pirenoforo: detto anche corpo o soma, rappresenta il corpo
cellulare del neurone
2) i dendriti: sono prolungamenti citoplasmatici solitamente
ramificati e numerosi.
3) Il neurite o assone: è un unico lungo prolungamento
citoplasmatico
4) La fibra nervosa: è un prolungamento degli assoni rivestita da
involucri. Può avere una distanza notevole, fino a superare il
metro di lunghezza.
All’inizio del Novecento, Camillo Golgi scoprì il metodo di indagine
dell’impregnazione argentica, che consentiva di osservare un
numero limitato di neuroni:
- Cajal, riuscì a scoprire la dottrina del neurone, in cui affermava
che questi formano reti complesse tra loro rimanendo unità
indipendenti e giungendosi attraverso particolari giunzioni,
chiamate sinapsi.
90
-
-
Con lo sviluppo delle tecniche, si riuscì a seguire le molecole
che fluivano negli assoni e a determinare i circuiti che vi sono in
essi.
Con l’impiego di tecniche immunocitochimiche ed
immunoistochimiche si è riuscito a comprendere le modalità
con cui il neurone svolge la propria funzione.
Infine si è potuto dimostrare che il neurone non è solamente una pura
unità morfologica:
- esso è un’unità secernente, capace di elaborare secreti
specifici, attivi, di molteplice natura e funzione
- si è così dimostrata l’esistenza di un sistema endoneuronale
secernente.
In definitiva, si è storicamente ampliato il concetto di
neurosecrezione, che ora intende una modalità operativa con cui i
neuroni comunicano tra loro e con le cellule effettrici, secernendo:
- messaggeri chimici specifici con meccanismo neurocrino: i
neurotrasmettitori e le proteine di adesione.
Ormoni, con vere e proprie funzionalità endocrine, detti
neurormoni,
- proteine sinaptiche, con funzionalità autocrine.
NUMERO E FORMA DEI NEURONI
Secondo la concezione di Bizozzero i neuroni sono elementi perenni:
- si sviluppano con fenomeni mitotici molto presto durante il
differenziamento embrionale
- giungono nell’adulto ad un numero approssimativo di 1011,
Nonostante si fosse creduto che i neuroni fossero elementi
sostanzialmente immobili, oggi si deve prendere un concetto come
vero, la neuroplasticità:
- i neuroni possono modificare alcune caratteristiche
morfofunzionali (forma, dimensioni, struttura citoscheletrici e
giunzioni sinaptiche) in relazione a sollecitazioni di varia natura
- anche in fase di riparazione si può osservare la neuroplasticità.
Le forme sono molto eterogenee, ma la più classica è quella di un
pirenoforo triangolare a cui si legano i vari prolungamenti dendritici.
LA MEMBRANA DEL NEURONE
La membrana del neurone, costituisce lo strato limite periferico che
circonda il neurone e i suoi prolungamenti dendritici e assonico.
In corrispondenza delle sinapsi, la membrana assume strutture
particolari.
La membrana è la responsabile della trasmissione dell’impulso
intraneuronale.
Nella membrana sono presenti tre tipi di proteine intrinseche degne di
nota:
- proteine canali
- proteine pompa
- proteine recettori
Talvolta le funzioni di un complesso proteico possono anche essere
unificate: ad esempio un recettore può essere legato ad una proteina
canale.
Le proteine recettoriali, sono siti scaglionati nella membrana pre e
postsinaptca:
- ancorano neurotrasmettitori e ormoni.
Le proteine canale attraversano tutta la lunghezza degli assoni e le
membrane pre e postsinaptiche:
- consentono il passaggio di ioni Na+, K+, Ca2+ e Cl- sono qualificate come canali ionici e attivate da stimoli di natura
differente.
Le proteine canale ioniche sono costituite da:
- più subunità
91
-
ogni subunità è formata da 6 catene ad alfa-elica
ogni elica possiede delle regioni ad ansa che sporgono verso
l’esterno e verso l’interno della membrana con funzione di
riconoscimento e trasduzione
Secondo la natura degli stimoli che possono attivare le proteine canale
si possono distinguere:
1) canali ionici voltaggio-dipendenti: l’apertura e la chiusura dei
canali è regolata da differenze di potenziale che si instaurano
lungo la membrana dell’assone
2) canali ionici attivati da ligando chimici: possiedono un sito
recettoriale che aggancia dei neurotrasmettitori o degli ormoni
3) canali ionici attivati da pressione o stiramento: indotto da
filamenti citoscheletrici che ancorano la proteina canale in
corrispondenza del poro sul versante endocellulare.
La membrana assonico è polarizzata:
- vi è una differenza di potenziale di -70 mV tra l’interno
dell’assone e l’esterno
- La concentrazione di ioni K+ è dieci volte maggiore all’interno
rispetto all’esterno
- La concentrazione di ioni Na+ è circa 10 volte maggiore
all’esterno.
- La differenza di potenziale è mantenuta da una proteina
ATPasica detta pompa sodio/potassio, che pompa il sodio
all’esterno e il potassio all’interno dell’assone.
La trasmissione dell’impulso lungo l’assone è data da un’oda di
depolarizzazione che si innesta a livello del pirenoforo:
- a livello del pirenoforo si abbassa la differenza di potenziale e
si ha l’apertura dei canali del sodio
- il sodio fluisce all’interno abbassando il potenziale. Si ha una
doppia reazione, ovvero quella di aprire i canali del sodio
successivi e di aprire quelli del potassio in loco, facendo
ristabilire localmente la ddp con la fuoriuscita di potassio
- alle spalle del fronte dell’onda di depolarizzazione le pompe
sodio/potassio ristabiliscono la situazione originaria e
impediscono la propagazione retrograda dell’impulso.
Nelle fibre amieliniche il processo di depolarizzazione è piuttosto
lento, poiché l’attivazione consequenziale delle pompe e l’espulsione
degli ioni comporta spreco di tempo e di energia:
- le velocità di propagazione è di circa 1-2 m/s.
Nelle fibre mieliniche le proteine canale sono disposte solamente a
livello dei nodi di Ranvier:
- si ha una propagazione dell’impulso con conduzione
saltatoria, poiché le aperture dei canali avvengono
discontinuamente solo a livello dei nodi di Ranvier
- questo permette anche risparmio energetico, poiché vi è meno
sodio da riportare all’esterno e meno potassio da reintrnalizzare
da parte delle pompe
- la velocità di conduzione dell’impulso è molto più alta, fino a
120 m/s, e varia in funzione alla larghezza della guaina
mielinica.
In sintesi, le proteine canali voltaggio-dipendenti e le proteine pompa
sono le responsabili della conduzione dell’impulso nervoso
intracellulare.
IL PIRENOFORO.
Il pirenoforo è il centro trofico de neurone, ed è costituito da un
citoplasma, detto pericarion che circonda il nucleo, in cui sono immersi
i vari organuli:
- RER
- Mitocondri
- Complesso di Golgi
- Lisosomi
All’interno del pirenoforo, si osservano due componenti che sono
caratteristiche dei neuroni:
- sostanza tigroide
- neurofibrille
Il nucleo ha notevoli dimensioni e forma sferica:
92
-
-
presenta cromatina finemente dispersa (eucromatina)
è poco colorabile
è solitamente unico e disposto al centro (ad eccezione delle
cellule di Purkinje che sono tetraploidi e le gangliari simpatiche
che possono essere binucleate)
il nucleolo è ben evidente e colorabile al centro del nucleo
La sostanza tigroide è una formazione morfologica visibile in seguito
a colorazione con coloranti basici:
- è molto presente nei grandi neuroni,
- poco presente nei piccoli neuroni sensitivi
- è costituita da cisterne di RER unite a numerosi poliribosomi
liberi
Il RER, oltre ad essere presente nel pericarion sotto forma di sostanza
cromofila (tigroide) è anche presente nei dendriti di grandi dimensioni,
ma è assente negli assoni.
Il REL è abbondante:
- si estende anche nei dendriti e nell’assone
- appare sottoforma di tubuli e vescicole di profilo irregolare.
Il complesso di Golgi è presente in tutte le cellule nervose:
- molto sviluppato
- costituito da pile di cisterne appiattite attorno al nucleo
I mitocondri sono molto frequenti e di piccole dimensioni:
- hanno forma a bastoncello
- si interpongono tra le varie cisterne
- sono molto presenti lungo i dendriti e gli assoni disponendosi in
maniera ordinata.
- Contengono enzimi legati ai processi di ossidoriduzione e altri
processi indispensabili per la vita del neurone
I lisosomi sono ben presenti in tutti i tipi di neuroni:
- svolgono le funzioni correlate al ricambio degli organuli
citoplasmatici
- contengono sostanze litiche per degradare materiale di rifiuto
In tutto il pirenoforo si possono osservare delle reti di filamenti sottili e
numerosi, dette neurofibrille:
- sono aggregati di neurofilamenti, filamenti intermedi di
diametro di circa 10 nm costituiti da differenti tipi di proteine
- sono strutture che dal pirenoforo decorrono anche lungo gli
assoni e i dendriti
- terminano a livello delle sinapsi
- sono molto abbondanti negli assoni di grosso calibro.
Oltre alle neurofibrille formate da neurofilamenti, sono presenti anche
dei microtubuli (neurotubuli) che si estendono con regolarità
all’interno del neurone:
- sono osservati in quantità maggiore negli assoni di piccolo
calibro
- sono frequenti nei dendriti.
I neurotubuli e i neurofilamenti sono presenti in quantità differenti a
seconda del tipo di neurone, tuttavia, sono maggiori i neurofilamenti
negli assoni e maggiori i neurotubuli nei dendriti.
I microfilamenti, sono associati a numerose proteine e svolgono le
seguenti funzioni:
- stabilizzano le proteine transmembrana fornendogli un sito di
attacco
- regolano il posizionamento delle vescicole presinaptiche
- sono responsabili della mobilità dei coni di crescita e del
posizionamento assonico.
- Intervengono nella rigenerazione delle fibre nervose.
DENDRITI
I dendriti sono prolungamenti citoplasmatici che si staccano,
solitamente in un numero elevato, da pericarion e sono rivestiti da
membrana plasmatica.
Sono prolungamenti di calibro ampio e possono presentare
ramificazioni con un angolo inferiore a 90°.
93
I dendriti sono prolungamenti relativamente corti, la cui lunghezza non
supera mai i 700 µm, si assottigliano man mano che si allontanano dal
corpo cellulare:
- non posseggono rivestimenti particolari (al contrario degli
assoni, es. la guaina mielinica)
- la struttura e le ramificazioni dei dendriti caratterizzano i vari tipi
di neuroni.
La struttura citoplasmatica dei dendriti varia in funzione del loro calibro
e della distanza dal pirenoforo:
- la composizione è essenzialmente uguale a quella del
citoplasma
- compaiono vescicole di REL
- scompare quasi totalmente il RER con l’aumentare della
distanza dal pericarion
- i mitocondri sono orientati e presentano una periodicità nella
lunghezza del dendrite.
- Sono ricchi di microtubuli che si orientano paralleli all’asse
dendritico.
La superficie dei dendriti appare irregolare ed è ricoperta da molte
estroflessioni ovoidali, dette spine:
- sono di dimensioni e altezza variabile da 1 a 5 µm
- sono costituite da un collo e da un bulbo allargato con forma
ovoidale
- sono zone di contatto sinaptico con gli assoni di altre cellule
nervose.
- Non sono presenti strutture citoplasmatiche all’interno, ma si ha
solamente l’apparato della spina, costituito da tre o quattro
cisterne allargate e con disposizione parallela.
La superficie dei dendriti rappresenta, con le sue numerose giunzioni
sinaptiche con altri neuroni (sinapsi asso-dendritiche) una struttura
fondamentale per un neurone nell’interazione con informazioni
provenienti da più fonti.
In determinate condizioni, i dendriti sono anche in grado di trasmettere
degli impulsi oltre che riceverli:
-
si stabiliscono delle sinapsi dendro-dendritiche che possono
influenzare neuroni adiacenti
Il numero dei dendriti varia con l’età, ovvero diminuisce con
l’invecchiamento:
- si pensa che possano essere la struttura per cui si abbia
l’apprendimento e la memoria
- è stato dimostrato che la fosfatidilserina riduce la perdita delle
spine dendritiche indotta dall’invecchiamento cerebrale.
ASSONE O NEURITE
L’assone o neurite è il prolungamento del neurone che conduce gli
impulsi dal pirenoforo a distanze anche considerevoli:
- ha un notevole sviluppo in lunghezza
- la larghezza varia da 1 µm a 20 µm e influisce sulla velocità di
trasmissione dell’impulso.
- Terminano con formazioni specializzate dette bottoni terminali
sinaptici.
Gli assoni possono presentare un rivestimento quale:
- la guaina mielinica
- il neurilemma.
Ogni cellula ha un unico neurone:
- generalmente diparte dal pirenoforo
- può accadere che inizi da un dendrite
L’assone ha un contorno liscio e può, ad una certa distanza dal nucleo,
emettere delle diramazioni che si assottigliano:
- le diramazioni permettono ad un neurone di influire su più
cellule
Gli impulsi nervosi percorrono l’assone in direzione centrifuga.
L’impulso può essere condotto tramite:
- sinapsi: giunge e si collega ad un altro neurone
94
-
giunzioni citoneurali: si può connettere con ghiandole, cellule
muscolari, fibre muscolari striate, fibrocellule lisce, ecc…
La membrana dell’assone è denominata assolemma.
Il citoplasma dell’assone è denominato assoplasma e include:
- mitocondri
- neurofilamenti
- microtubuli
- microfilamenti di actina
- vescicole delimitate da membrane lisce.
I neurofilamenti sono la componente principale del citoscheletro
dell’assoplasma, ma in prossimità delle ramificazioni i microtubuli
diventano la componente principale.
Non sono presenti anche numerosi filamenti di actina.
Il REL è scarso e disorganizzato, ma sono presenti vecicole ricoperte
da membrane lisce che si situano tra i microtubuli e i microfilamenti.
FLUSSO ASSONICO.
Al’interno degli assoni, il citoscheletro ha differenti elementi con
specifiche funzioni:
- neurofilamenti: funzione meccanica di sostegno
- microtubuli: hanno la funzione di trasporto
Nell’assone, lungo i microtubuli vi è un flusso bidirezionale di
vescicole:
- le sostanze che l’assone utilizza alla sua terminazione gli
devono giungere da pirenoforo
- il materiale endocitato e le membrane da riciclare ritornano
tramite un flusso anterogrado al pirenoforo.
Si è potuto dimostrare che esistono due livelli di velocità a seconda del
materiale da trasportare. Si individuano quindi:
- flusso assonico lento
- flusso assonico veloce.
Il flusso assonico rapido è in grado di trasportare vescicole con una
velocità costante di 50-400 mm al giorno.
Il RER è del tutto assente.
I mitocondri appaiono sottili e allineati orizzontalmente, in maniera
parallela all’asse del neurite:
- sono più frequenti in zone presinaptiche.
Il punto in cui l’assone emerge dal pirenoforo è detto cono di
emergenza:
- presenta microtubuli con un aspetto fascicolato
- è sprovvisto di sostanza tigroide.
Il primo tratto dell’assone, in cui non è ancora ben presente la guaina
mielinica, prende il nome di segmento iniziale:
- ha una soglia di eccitabilità inferiore al pirenoforo
- presenta uno strato di materiale elettrodenso che è
riscontrabile anche in prossimità dei nodi di Ranvier.
Questo flusso rapido coinvolge il trasporto di:
- vescicole contenenti neurotrasmettitori chimici
- sostanze implicate nella funzione neurosecretoria
- costituenti di ricambio della membrana plasmatica.
Il flusso rapido è bidirezionali e comprende:
- movimento anterogrado: avviene dal pirenoforo alla
terminazione dell’assone. Vede il trasporto di vescicole con
neurotrasmettitori e organuli
- movimento retrogrado: avviene nel senso opposto. Riporta al
pirenoforo le membrane da riciclare e organuli destinati ad
essere degradati dai lisosomi.
Il flusso assonico lento si attua in due differenti velocità:
- 5 mm al giorno: riguarda componenti citosolici come la clatrina,
l’actina, la calmodulina, ecc..
95
-
1 mm al giorno: è il trasporto che comprende il riciclaggio dei
materiali del citoscheletro.
Le modalità con cui avviene il trasporto assonico rapido sono legate
all’azione di specifiche proteine motrici con attività ATPasica:
- il trasporto anterogrado avviene grazie alla chinesina, che
possiede due catene avvolte con due teste in cui si lega ATP e
si legano i microtubuli
- il trasporto retrogrado avviene grazie ad una classe di dineine
che, sempre con attività e teste ATPasiche, permettono il
movimento in senso inverso sui microtubuli.
Per quanto riguarda le modalità del trasporto assonico lento non si
hanno dei dati sperimentali precisi.
CLASSIFICAZIONE DEI NEURONI.
Le principali tipizzazioni dei neuroni sono fatte:
- in base al comportamento dell’assone
- in base alle modalità delle ramificazioni dei prolungamenti e
alla direzione dell’impulso.
In base al comportamento dell’assone si possono distinguere:
1) neuroni del 1° tipo di Golgi: l’assone è relativamente lungo e
mantiene la sua unicità a notevole distanza dal pirenoforo.
2) Neuroni del 2° tipo di Golgi: con un neurite corto, che a breve
distanza si ramifica in maniera complessa, perdendo molto
presto la propria individualità.
In base alle modalità di ramificazione dei prolungamenti, al loro
numero, alla direzione degli impulsi, con una classificazione più
recente, si posson distinguere:
1) neuroni unipolari: sono i neuroni embrionali e i neuroni sensitivi.
Presentano un solo prolungamento che trasmette l’impulso in
maniera centrifuga.
2) Neuroni bipolari: sono forniti di entrambi i tipi di prolungamenti,
un assone e un solo dendrite che si generano ai poli opposti
del pirenoforo
3) Neuroni pseudounipolari: sono neuroni che sembrano forniti da
un solo tipo di prolungamento, ma in realtà i due prolungamenti
sono confluiti in un solo ramo che fuoriesce dal pirenoforo e si
apre a T per dividersi in due prolungamenti. Sono i neuroni dei
gangli cerebrospinali.
4) Neuroni multipolari: hanno un assone e molti dendriti. Sono i
neuroni più frequenti.
FIBRE NERVOSE
Molto spesso gli assoni sono rivestiti da guaine che li avvolgono per
quasi tutta la lunghezza:
- la fibra nervosa è l’insieme morfofunzionale dell’assone e del
suo rivestimento
- collegano le varie parti del sistema nervoso e conducono gli
stimoli
- sono strutture filamentose che possono raggiungere anche
notevoli lunghezze.
CLASSIFICAZIONE DELLE FIBRE NERVOSE
L’assone, in base al suo tipo di rivestimento forma differenti tipologie di
fibre nervose:
- fibre mieliniche: il mesassone delle cellule gliali si avvolge
ripetutamente sul neurite
- fibre amieliniche: non si ha un rivestimento costante da parte
delle cellule della glia
- assone nudo: non presenta alcun tipo di rivestimento.
96
FIBRE NERVOSE MIELINICHE.
Le fibre nervose mieliniche si trovano sia nel sistema nervoso
periferico che in quello centrale.
Le fibre nervose mieliniche del SNP presentano una guaina
mielinica fornita dalle cellule di Schwann e formano i nervi di:
- nervi spinali
- nervi encefalici
Le fibre nervose mieliniche del SNC hanno una guaina costituita
dagli oligodendrociti, cellule che, a differenza delle cellule di Schwann
avvolgono più di un assone. Queste fibre nervose costituiscono:
- sostanza banca
- radici dei nervi periferici.
Le cellule gliali che avvolgono gli assoni formando fibre nervose
presentano un citoplasma scarso, che si riscontra nelle porzioni
esterne e in prossimità dei nodi di Ranvier.
A differenza delle fibre nervose del SNP, quelle del sistema nervoso
centrale non sono circondate da tessuto connettivo, ma sono in
rapporto con altre cellule della neuroglia.
FIBRE NERVOSE AMIELINICHE
Le fibre nervose amieliniche sono fibre nervose prove di guaina
mielinica.
Nel sistema nervoso periferico sono circondate soltanto dal citoplasma
della cellula di Schwann:
- sono assenti i nodi di Ranvier
- le cellule di Schwann formano un rivestimento continuo lungo
l’assone
- appaiono pallide o grige poiché non hanno il classico colore
della mielina
Nel sistema nervoso centrale si trovano numerose fibre amieliniche,
che però mancano della guaina di Schwann (o neurilemma):
- sono assoni privi di avvolgimenti specifici
- sono in rapporto con le cellule gliali circostanti formando un fitto
intreccio.
L’assone si presenta nudo all’origine dell’assone e a livello delle
terminazioni.
NEURILEMMA
Nelle fibre del sistema nervoso periferico le cellule di Schwann
forniscono il rivestimento dell’assone e insieme alla loro lamina basale
costituiscono la guaina di Schwann o neurilemma:
- nelle fibre mieliniche il neurilemma è posto al di sopra della
guaina mielinica
- nelle fibre amieliniche la guaina di Schwann riveste
direttamente l’assone.
Le cellule di Schwann sono le principali cellule non eccitabili del
tessuto nervoso periferico:
- avvolgono in cilindri l’assone,
- si dispongono a file allineate con regolarità
- ogni segmento di fibra in cui vi è una cellula di Schwann si
chiama segmento internodale
- il tratto di fibra tra un internodo e l’altro si chiama nodo di
Ranvier.
GUAINA MIELINICA
Le fibre mieliniche appaiono al microscopio ottico come tubuli
omogenei, traslucidi e rifrangenti:
- la guaina mielinica conferisce colore e lucentezza caratteristici
alla sostanza bianca dell’encefalo e nel midollo spinale
- la guaina si colora in maniera differente a seconda delle
colorazioni che si attuano.
97
Una guaina mielinica riveste la maggior parte delle fibre del SNC e
del SNP.
La mielina rappresenta un ottimo isolante elettrico:
- l velocità di trasmissione degli impulsi nervosi aumenta con
l’aumentare del diametro della fibra
La guaina mielinica riveste gli assoni in maniera discontinua, formata
da una successione di segmenti internodali:
- tra due segmenti internodali sono presenti delle strozzature che
formano i nodi di Ranvier.
- A livello dei nodi, l’assone è rivestito solamente dalle cellule di
Schwann e dalla loro membrana basale.
Nelle fibre del SNP la guaina mielinica presenta incisore a forma di
imbuto tra le lamelle disposte a distanze regolari, chiamate incisure di
Schmidt-Lantermann.
La guaina mielinica è costituita da strati concentrici di lamelle
lipoproteiche che presentano una alternanza di linee scure e chiare
secondo un modello periodico.
Una cellula di Schwann, avvolgendosi forma un segmento internodale
o internodo di mielina:
- il nucleo rimane situato, insieme ad una porzione di citoplasma,
all’esterno della fibra
- il nucleo si pone circa a metà dell’internodo
La regione in cui le estremità dei processi delle cellule di Schwann si
unisce ad una porzione della membrana della cellula stessa è
denominata mesassone.
Le fibre mieliniche sono quindi formate da un avvolgimento di
citoplasma delle cellule di Schwann, che può arrivare fino a 50 giri.
Le fibre amieliniche, invece, sono date dall’avvolgimento di più assoni
da parte di una sola cellula di Schwann:
- in questo caso, il nucleo si pone pressoché centralmente e le
porzioni citoplasmatiche formano solamente dei mesassoni con
un'unica inclusione citoplasmatica.
- Anche nel caso delle fibre amieliniche, le cellule di Schwann si
dispongono in serie.
FORMAZIONE DELLA GUAINA MIELINICA
NODI DI RANVIER
La mielina è costituita dalla membrana plasmatica della cellula di
Schwann o degli oligodendrociti.
I nodi di Ranvier sono dei restringimenti periodici della guaina
mielinica livello delle fibre nervose:
- l’avvolgimento elicoidale della mielina si interrompe
- si formano due cupole a livello degli avvolgimenti mielinici che
formano delle sacche contenenti enzimi, vecsicole e
microtubuli.
Il processo di avvolgimento della membrana plasmatica segue le
seguenti modalità:
1) inizialmente l’assone è circondato dalla cellula di Schwann,
2) le estremità della cellula di Schwann si incontrano e formano il
mesassone.
3) Il mesassone si allunga e si avvolge a spirale sull’assone
4) Man mano si ha l’avvolgimento il citoplasma viene espulso
5) L’assone si trova formato da due anelli addossati di membrana
plasmatica
6) L’avvolgimento continua fino a numerosi giri, in cui la
membrana plasmatica si giustappone continuamente.
Nel nodo di Ranvier, la cellula di Schwann non si interrompe, ma va a
ricoprire le parti in cui non v’è più mielina formando interdigitazioni con
la cellula accanto:
- in quei bulbi che si vengono a creare, vi sono ampie porzioni di
citoplasma delle cellule di Schwann, contenenti RER, ribosomi,
glicogeno e microtubuli.
98
-
Si forma un collare circolare, dato da una strozzatura della
cellula di Schwann in prossimità dei nodi.
Sebbene la mielina, a livello dei nodi, si interrompe, l’assone non resta
mai nudo:
- è rivestito da processi citoplasmatici delle cellule di Schwann
che si interdigitano tra loro.
INCISURE DI SCHMIDT-LANTERMANN
Le incisure di Schmidt-Lantermann sono delle fessure imbutiformi
che si presentano a livello internodale nella guaina mielinica:
- in queste tasche è presente un residuo di citoplasma della
cellula di Schwann che ha formato la guaina mielinica
- questo residuo di citoplasma permette la comunicazione tra i
vari strati della cellula
- le tasche che formano le incisure non contengono solitamente
degli organuli
Al ME è visibile questa struttura in sezione longitudinale, ed appare
come una incisura:
- in quella zona, la mielina resta lassa.
Durante i tratti di bilayer fosfolipidico e sfingomielinico, non sono
presenti proteine canale per ioni:
- la continuità dello strato lipidico permette un notevole
isolamento elettrico
La componente proteica prevede:
- un gruppo di proteine basiche della mielina (MBP)
- una glicoproteina specifica associata alla mielina (MAG), con
funzione di adesione e ancoraggio nel processo di
mielinizzazione
Negli oligodendrociti, si può trovare prevalentemente una proteina
caratteristica detta proteolipide (PLP).
Nelle fibre periferiche mature so trovano altre proteine di adesione che
sono implicate nella mielinizzazione:
- P0 o MPZ
- PMP22, presente nella membrana delle cellule di Schwann.
Le alterazione dei geni che codificano per le proteine mieliniche
portano a sindromi molto gravi, spesso con difficoltà deambulatorie.
NERVI PERIFERICI
COMPOSIZIONE CHIMICA DELLA MIELINA
La mielina ha una composizione molto simile a quella delle altre
membrane plasmatiche (lipidi e proteine), tuttavia presenta delle
caratteristiche proprie.
Le percentuali in peso dei componenti sono:
- lipidi al 70 %
- proteine circa al 30 %
La componente lipidica presenta una particolarità data dalla
presenza di sfingomieline e cerebrosidi.
Le fibre nervose, nel tratto che diparte dal corpo cellulare alle loro
terminazioni in strutture periferiche, si raggruppano in fasci e formano i
nervi periferici.
Le fibre connesse con il midollo spinale formano i nervi spinali, che
fuoriescono dai dischi intervertebrali.
Le fibre nervose connesse con l’encefalo formano i nervi cranici, che
escono dai fori situati alla base del cranio.
Nei nervi possono passare sia fibre efferenti, connesse a neuroni
motori verso la periferia, sia fibre afferenti, che dai neuroni sensitivi si
muovono verso i neuroni del sistema nervoso centrale.
99
ORGANIZZAZIONE DEI NERVI PERIFERICI.
Dall’epinevro dipartono setti connettivali che suddividono i fascetti di
fibre nervose. Queste emanazioni di connettivo sono dette perinevro.
Il ganglio è delimitato da una capsula di connettivo denso che è in
continuità con l’epinevro e il perinevro:
- trabecole di tessuto connettivo formano una rete in cui si
inseriscono gli elementi cellulari, inframezzati dalle fibre
nervose
- le cellule nervose sono ricoperte da cellule della glia dette
cellule satelliti, che sono in stretta continuità con il tessuto
connettivo
Le singole fibre, sono avvolte da connettivo lasso detto endonevro:
- forma una rete di fibre reticolari e materiale glicoproteico
(proteoglicani e GAG) attorno alle cellule di Schwann, in
continuità con la loro membrana basale
- nell’endonevro sono anche presenti numerosi capillari
sanguiferi, che risultano ben isolati
Le cellule nervose a livello dei gangli sono neuroni pseudounipolari:
- dal corpo cellulare diparte un solo prolungamento che si divide
in due rami
- un ramo trasmette l’impulso dalla periferia al centro senza
passare attraverso il corpo cellulare
- il corpo cellulare ha solamente funzione trofica.
Il liquido interstiziale dell’endonevro è isolato dal perinevro, che non ne
permette la fuoriuscita.
SINAPSI
Il perinevro forma attorno ai fascetti di fibre un manicotto di spessore
variabile, formato da cellule appiattite unite da giunzioni strette (Tight
junctions):
- all’esterno e all’interno del perinevro è presente una lamina
basale che permette il passaggio di macromolecole.
I neuroni, mantenendo la propria individualità morfologica, sono messi
in contatto tra loro in modo da poter trasmettere e ricevere impulsi:
- ogni neurone ha la possibilità e la capacità di discriminare tra i
vari impulsi e elaborare la risposta adeguata
In tutti i nervi, sia le fibre mieliniche che quelle amieliniche sono
avvolte da una guaina esterna di tessuto connettivo denso detta
epinevro.
GANGLI
I gangli sono raggruppamenti di cellule nervose disposte lungo il
percorso dei nervi:
- i gangli sensitivi sono associati a nervi spinali e, più raramente,
ai nervi cranici.
Ogni ganglio comprende:
- cellule nervose
- tessuto connettivo
- fibre nervose
- vasi sanguiferi
Il contatto tra la terminazione assonica di un neurone e un altro
neurone (a livello dei dendriti o del pirenofoto) prende il nome di
sinapsi o giunzione sinaptica:
- la propagazione dell’impulso attraverso una sinapsi è
unidirezionale
- un neurone può ricevere un numero variabile di terminazioni
afferenti, a seconda della sua morfologia e localizzazione (si
arriva a centinaia di migliaia nelle cellule di Purkinje)
Esistono due tipi di sinapsi lungo gli assoni:
- bottoni sinaptici terminali: è posto alla porzione terminale di un
assone ed assume una forma grossolanamente tondeggiante.
100
-
Boutons en passant: sono rigonfiamenti presenti lungo gli
assoni. Normalmente sono presenti solo su fibre amieliniche,
anche se è possibile riscontrarli a livello di alcuni nodi di
Ranvier.
La fibra nervosa, a livello della giunzione sinaptica, perde il
rivestimento mielinico e presenta una espansione che forma il bottone
terminale.
-
Asso-assoniche
Dendro-dendritiche: si ritiene possano essere reciproche,
poiché si rinvengono polarità opposte alla stessa interfaccia
giunzionale.
Altri tipi di giunzioni particolari esistono, ma sono poco frequenti.
ZONA PRESINAPTICA
La morfologia generale della sinapsi comprende tre zone:
- zona presinaptica: porzione terminale della cellula afferente,
comprendente la membrana a contatto con l’elemento cellulare
che riceve l’impulso e parte del citoplasma contenuto nel
bottone
- zona postsinaptica: è la zona della cellula ricevente in cui si
lega il bottone sinaptico dell’assone della cellula afferente.
- Fessura sinaptica: è lo spazio che intercorre tra le due
membrane.
A livello dei bottoni, è possibile osservare numerose vescicole
sinaptiche e un materiale elettrodenso adeso alle facce pre e
postsinaptiche delle due membrane.
In base alle quantità del materiale elettrodenso si distinguono:
- sinapsi asimmetriche o di tipo I: il materiale adeso alla
membrana postsinaptica è maggiore di quello della
presinaptica. Si ritiene che siano sinapsi di tipo eccitatorio.
- Sinapsi simmetriche o di tipo II: la quantità di materiale
elettrodenso è identica su entrambe le membrane. Si ritiene
che siano di tipo inibitorio.
Le sinapsi sono di vario tipo anche a seconda degli elementi che si
uniscono:
- asso-dendritiche: sono le sinapsi più comuni, possono essere
asimmetriche o simmetriche
- asso-somatiche: si formano per la giunzione di assone e
pirenoforo. Sono solitamente simmetriche
- sinapsi asso-spinose: si formano tra l’assone e le spine.
La zona presinaptica è caratterizzata dalla presenza di:
- vescicole sinaptiche
- mitocondri
- corpi multivescicolari
- elementi di REL
Nelle vescicole, ricoperte da membrana unitaria, sono contenuti i
mediatori chimici o neurotrasmettitori che vengono liberati all’arrivo
dell’impulso nervoso:
- le dimensioni e il carattere elettrodenso della vescicola
dipendono dal tipo di neurotrasmettitori che essa contiene
Nella maggior parte delle sinapsi del SNC e nelle giunzioni
neuromuscolari, nelle vescicole sono contenuti:
- acetilcolina
- amminoacidi (glutammato, GABA, ecc…)
Altri bottoni terminali contengono una famiglia di neurotrasmettitori che
comprendono:
- noradrenalina
- serotonina
- dopamina
La membrana presinaptica, presenta sul versante citoplasmatico una
formazione geometrica regolare che viene indicata come griglia
presinaptica:
101
-
-
vi sono delle protuberanze che delimitano canali di circa 20 nm
attraverso i quali le vescicole vengono direzionate nelle zone
attive.
Le vescicole riversano il materiale nella fessura sinaptica
attraverso le zone attive per esocitosi
La griglia presinaptica e le vescicole sono tutte in collegamento
con una fitta rete di filamenti di actina.
FESSURA SINAPTICA
La fessura sinaptica è uno spazio di altezza 25-30 nm tra le membrane
pre e post-sinaptiche:
- si nota la presenza di materiale filamentoso
- sono presenti molecole e matrice extracellulare coinvolte nella
formazione e nella stabilizzazione della sinapsi.
ZONA POSTSINAPTICA
L’elemento strutturale che caratterizza funzionalmente la zona
postsinaptica è la membrana postsinaptica:
- presenta numerose glicoproteine che fungono da recettori per i
mediatori chimici che si riversano nella fessura sinaptica.
Al di sotto di tale membrana si trova un complesso elettrodenso e
filamentoso che ha funzione strutturale detto apparato
sottosinaptico.
Si possono pertanto distinguere:
- piccole vescicole agranulari (SAV): contengono mediatori come
l’acetilcolina
- piccole vescicole granulari (SGV): sono caratterizzate dalla
presenza di un alone tra il core del granulo e la membrana
limitante. Sono sede di accumulo di amine biogene, come ad
esempio le catecolamine e la serotonina
- ampie vescicole granulari (LGV): hanno diametri compresi tra
100 e 200 nm. Non presentano alcun alone tra il core e la
membrana limite. Contengono neurotrasmettitori purinici e
peptidici.
MECCANISMO DI FUNZIONAMENTO DELLE SINAPSI.
Il segnale elettrico che raggiunge la terminazione presinaptica è
convertito in segnale chimico:
- il neurotrasmettitori attraversa la fessura sinaptica e si lega al
recettore sulla membrana postsinaptica
- a livello della membrana postsinaptica il segnale ricevuto dai
recettori si riconverte in segnale elettrico
- si crea una onda di depolarizzazione a partire dalla
membrana postsinaptica.
Quando in prossimità della membrana presinaptica arriva l’impulso
elettrico, si aprono dei canali ionici che liberano ioni Ca2+, che sono i
responsabili primari dell’ativazione del processo di esocitosi:
- la quantità di calcio liberata dipende dalla durata dell’impulso
elettrico, che mantiene aperti i canali ionici
VESCICOLE SINAPTICHE
Le vescicole sinaptiche sono il luogo di deposito temporaneo del
neurotrasmettitori (mediatore chimico).
Le vescicole contengono una quantità costante di materiale da
esocitare, cosicché, si riversa nella fessura sinaptica sempre una
quantità discreta di neurotrasmettitori.
Le dimensioni e le caratteristiche di tali vescicole dipendono dal
mediatore chimico in esse contenuto.
Le vescicole si dispongono in gruppi, i cui componenti vescicolari sono
uniti da filamenti proteici.
102
La proteina che è implicata in queste connessioni è la sinapsina I:
- lega tra loro le vescicole
- lega i cluster vescicolari ad una proteina che emana dalla
faccia citoplasmatica detta fondrina.
Prima del citoplasma è presente una rete di microfilamenti di actina
che impediscono alle vescicole di fluire nelle zone attive.
Con l’arrivo dell’impulso nervoso la membrana presinaptica si
depolarizza e si ha il rilascio massivo di ioni calcio:
1) gli ioni Ca2+ si legano alla calmodulina, formando dei
complessi che iniziano a fosforilare la sinapsina I.
2) la sinapsina I perde affinità per le vescicole e per la fondrina e
le rilascia
3) le vescicole si portano verso le zone attive, ma sono trattenute
dal reticolo di filamenti di actina
4) la massiccia presenza di ioni calcio rende possibile l’attivazione
delle actin-severing protein, che creano delle fessure nella
rete di filamenti actinici.
5) Le vescicole possono raggiungere la membrana ed essere
esocitate.
Nelle sinapsi eccitatorie il legame con il mediatore chimico determina
l’apertura di canali con ioni positivi:
- si ha il rilascio di ioni positivi all’interno del citoplasma
dendritico
- si crea un’onda di depolarizzazione nel neurone postsinaptico
- è il caso dell’acetilcolina per le giunzioni neuromuscolari.
Nelle sinapsi inibitorie invece si aprono canali di ioni negativi come
quelli per Cl-:
- il potenziale di membrana viene mantenuto ad uno stato
polarizzato o viene accentuata la polarizzazione opposta
- si impedisce l’insorgenza del potenziale d’azione
- si blocca l’impulso e il neurone rimane inibito.
È inoltre dimostrata l’esistenza a livello postsinaptico di secondi
messaggeri di natura chimica, rilasciati con il legame di un
neurotrasmettitore con il recettore:
- nucleotidi ciclici
- diacil-glicerolo
- fosfatidil-inositolo.
La membrana della vescicola che in zona presinaptica si è fusa con la
membrana dell’assone viene riassorbita per endocitosi e può essere
riciclata, tramite il moto retrogrado.
I mediatori chimici che si trovano all’interno della fessura sinaptica
hanno vita breve, poiché una volta esaurita la loro funzione possono:
- essere degradati da enzimi litici
- essere riassorbiti dalla membrana presinaptica.
A livello della membrana postsinaptica il neurotrasmettitori si lega a
recettori che convertono il segnale chimico in segnale elettrico:
- i recettori sono canali ionici a controllo di ligando, che si
attivano all’arrivo del neurotrasmettitori
- il rilascio di ioni permette di modificare il potenziale della
membrana postsinaptica.
I mediatori chimici possono essere:
- acetil colina
- amine biogene (moradrenalina, istamina, dopamina,
serotonina)
- amminoacidi (acido aspartico, acido glutammico, GABA)
- neuropeptidi
Le risposte di un neurone all’arrivo dell’impulso da parte di una sinapsi
possono essere eccitatore o inibitorie, quindi si distingono:
- sinapsi eccitatore
- sinapsi inibitorie.
è ancora irrisolto il dubbio a proposito delle possibilità di conduzione di
un solo tipo di neurotrasmettitore per ogni neurone:
- generalmente ogni neurone secerne solo un neurotrasmettitori
- è possibile che alcuni neuroni secernano anche un altro
neuropeptide oltre al proprio mediatore specifico
103
Esistono anche delle sinapsi che non utilizzano mediatori chimici, ma
conducono direttamente l’impulso elettrico. Sono membrane unite da
giunzioni serrate per lo più sinapsi dendro-dendritiche:
- possono condurre l’impulso in due sensi
- la velocità di conduzione è maggiore
- sono scarsi nei mammiferi.
PLACCA MOTRICE
Le fibre muscolari scheletriche si contraggono in riposta a stimoli
provenienti dal SNC, che giungono ai muscoli mediante l’assone di
una fibra nervosa:
- una fibra nervosa serve numerose fibre muscolari
- l’insieme del neurone, dell’assone e delle fibre muscolari
costituisce l’unità motoria.
TERMINAZIONI NERVOSE SENSITIVE
Le terminazioni nervose sensitive possono:
- stabilire giunzioni sinaptiche con altri neuroni
- essere in rapporto con organi effettori
- ricevere stimoli che vengono condotti ai centri nervosi
Le vie afferenti del Sistema Nervoso sono connesse a un sistema di
recettori specifici adibiti alla captazione di stimoli:
- esterocettori: captano gli stimoli dal mondo esterno
- enterocettori: captano gli stimoli all’interno dell’organismo
- propriocettori: ricevono gli stimoli dai muscoli, dai tendini e dalle
articolazioni
La classificazione dei recettori in base al tipo si stimoli prevede:
- meccanorecettori
- chemiorecettori
- termorecettori
- fotorecettori.
Le modalità con cui le fibre terminano a livello dei recettori sono
svariate e molto complesse.
Si possono distinguere le varie arborizzazioni dei terminali dei recettori
in:
- terminazioni libere, le quali sono scoperte nei tessuti
- terminazioni sensitive capsulare, che hanno una capsula di
speciale tessuto connettivo.
Le ramificazioni della fibra nervosa terminano sulla fibra muscolare in
punti specifici detti giunzioni neuromuscolari o placche motrici:
- l’assone perde la guaina mielinica
- la membrana basale dell’assone è in continuità con quella della
fibra muscolare
- la regione priva di miofibrille in cui si innestano le ramificazioni
è detta suola della placca motrice.
- Sono presenti numerosi nuclei, detti nuclei di arborizzazione
che appartengono alle cellule di Schwann
- Il citoplasma della suola è ricco di mitocondri, RER e ribosomi
liberi.
Nelle giunzioni neuromuscolari le fibre nervose terminano con una
serie di espansioni bottoniformi, che si accolgono in invaginazioni del
sarcolemma, dette docce sinaptiche:
- resta tra la membrana dell’assone e la fibra muscolare uno
spazio di 25 nm
- in corrispondenza delle docce sinaptiche il sarcolemma si
ripiega ulteriormente, formando delle fessure sinaptiche
secondarie.
Le fessure secondarie si dispongono parallelamente tra loro, formando
un sistema di pieghe:
- si forma un sistema di creste e gronde, con spessori della
membrana differenti
- sono state individuate 5 proteine differenti associate alle creste
e alle gronde
104
Associate alle creste si possono trovare recettori per l’acetilcolina e
una actin-binding protein.
TESSUTO GLIALE O NEVROGLIA.
INTRODUZIONE
Associate alle gronde si riscontrano:
- anchirina
- proteina canale del sodio
- distrofia
In prossimità della membrana delle creste vi è uno spessore che, si
suppone sia rappresentato da giunzioni aderenti con proteine come:
- vincolina
- talina
- alfa-actinina
- filamina
Nella terminazione presinaptica (dell’assone), si riscontrano:
- numerosi mitocondri
- vescicole contenenti acetilcolina.
La propagazione avviene nel modo seguente:
1) il segnale elettrico proviene dal neurone e dalla doccia viene
rilasciata acetilcolina
2) questa si lega ai recettori specifici sul sarcolemma,
determinando un aumento di permeabilità degli ioni
3) nel sarcolemma si genera un’onda di depolarizzazione, che
induce alla contrazione tutte le miofibrille.
L’azione della acetilcolina è brevissima:
- questa viene subito inattivata dall’enzima acetilcolinesterasi
- viene scissa la colina, che è poi recuperata dagli elementi
presinaptica e riutilizzata per la sintesi di nuova acetilcolina.
La nevroglia o glia è un tessuto cellulare che rappresenta l’85% dei
citotipi presenti nel tessuto nervoso:
- nonostante la maggioranza numerica, le cellule della glia sono
considerate cellule di supporto ai neuroni
Queste cellule hanno, nel rendere il loro sostegno ai neuroni, funzioni
molto importanti:
- funzione trofica
- funzione di riparazione
- protezione
- sostegno
La nevroglia è classificata in base al luogo in cu si situa a cui
corrispondon citotipi differenti:
- del sistema nervoso centrale
- periferica
NEVROGLIA DEL SISTEMA NERVOSO CENTRALE.
All’interno del sistema nervoso centrale si presenta una glia composta
da citotipi molto eterogenei, ognuno con una funzione differente.
Si riscontrano:
- ependimocito
- astrocito
- oligodendrociti
- microgliocito
Ciascuno di essi rappresenta un vero e proprio tessuto, tra cui si
individuano:
- ependima
- macroglia
- oligodendroglia
105
-
microglia
L’ependima costituisce il rivestimento delle cavità definitive scavate
nello spessore del nevrasse:
- canale centrale del midollo spinale
- ventricoli cerebrali
L’ependima è costituito da un epitelio cubico-cilindrico monostratificato
che riveste le cavità midollari e i ventricoli cerebrali:
- sono strettamente ravvicinati gli uni agli altri
- non presentano giunzioni occludenti, quindi è permesso il
passaggio di macromolecole.
Un tipo di ependima modificato è quello delle cellule dei plessi
coroidei, detti anche taniciti:
- sono complessi di cellule ripiegate su se stesse
- hanno funzione secernente (secernono il liquido cefaloarachidonico)
- possiedono microvilli.
- Sono unite tra loro da giunzioni aderenti, quindi non lasciano
passare i costituenti plasmatici attraverso l’endotelio fenestrato
dei capillari coroidei
- I capillari coroidei fungono da membrana basale a queste
cellule
La macroglia ha origine ectodermica ed è la forma di glia più
distribuita nel nevrasse:
- le sue cellule sono gli astrociti, cellule dal corpo molto piccolo
con molte espansioni citoplasmatiche ramificate che gli danno
un aspetto stellato
- i bracci degli astrociti si collegano tra i pirenofori dei neuroni e i
capillari dell’encefalo, poiché attuano scambi metabolici tra il
flusso sanguigno e i neuroni
- sono le cellule gliali più numerose nella sostanza grigia
(astrociti a brevi raggi).
-
-
formata da oligodendrociti, che sono presenti sia nella sostanza
grigia a contatto con i neuroni, sia in quella bianca a contatto
con gli assoni
gli oligodendrociti hanno funzione trofica nei confronti dei
neuroni
gli oligodendrociti sono i responsabili della mielinizzazione a
livello del SNC. Una di queste cellule può rivestire più assoni
presentano anche attività di sintesi di ormoni steroidei.
La microglia è formata da cellule che hanno origine mesenchimale e
presentano esili espansioni citoplasmatiche che si connettono ai
pirenofori a loro prossimi:
- la loro derivazione embrionale prevede la funzione di
macrofagi, poiché giunti nel processo di vascolarizzazione del
sistema nervoso
- la loro funzione è quella di ripulire e riparare le giunzioni
assoniche o dendritiche lese.
GLIA DEL SISTEMA NERVOSO PERIFERICO
Nel sistema nervoso periferico la nevroglia è rappresentata da una
notevole varietà di cellule:
- cellule capsulare o satelliti: avvolgono in modo più o meno
completo i pirenofori dei neuroni pseudounipolari dei gangli
sensitivi cerebrospinali e del sistema nervoso autonomo
- cellule di Schwann: mielinizzano assoni periferici
- cellule lemmali: formano il rivestimento capsulare dei recettori
nervosi periferici
- cellule di teloglia: avviluppano le terminazioni nervose motrici
- cellule di sostegno: sono presenti insieme alle cellule sensitive
secondarie nelle papille gustative.
L’oligodendroglia ha origine ectodermica e rappresenta il 40 % della
glia del SNC:
106
BARRIERA EMATOENCEFALICA.
Il rapporto tra il tessuto nervoso e il sangue circolante è
completamente differente da quello che si trova negli altri organi:
- vi è una barriera alla diffusione del sangue verso i neuroni
- la barriera è data dall’endotelio vasale e dalla sua membrana
basale
I capillari del tessuto nervoso hanno un endotelio continuo,
caratterizzato da:
- giunzioni strette: tight junctions formate da proteine di
membrana quali l’occludina e la clausina.
- giunzioni aderenti: formate da caderine
E’ dimostrato che queste giunzioni giocano un ruolo importante nel
realizzare una barriera funzionale che può ostacolare il passaggio di
farmaci e batteri, come di altre macromolecole.
Si ritiene che gli astrociti, i quali espandono i loro terminali sui capillari,
possano:
- indurre la formazione di giunzioni serrate.
- Interagire nella rimozione dell’eccesso di sodio nel
microambiente perineuronale.
La barriera ematoencefalica è permeabile a:
- ossigeno
- anidride carbonic
- farmaci liposolubili
-
è assente nelle zone circumventricolari (in prossimità delle
ghiandole cerebrali come l’ipofisi) per permettere regolazioni
endocrine.
10. il tessuto muscolare
INTRODUZIONE
La contrattilità è propria di ogni cellula, ma solamente la cellula
muscolare, grazie all’ordinata disposizione del materiale contrattile, si
ha la massima resa funzionale.
La funzione contrattile richiede la capacità di trasformare energia
chimica sottoforma di ATP in energia meccanica.
Il tessuto muscolare è tradizionalmente distinto in base alla sua
capacità di offuscare la luce, che riflette la disposizione delle fibre, in:
- tessuto muscolare striato
- tessuto muscolare liscio
Il tessuto muscolare striato è caratterizzato dalla presenza regolare
di bande chiare e scure. Può essere ulteriormente distinto in:
- scheletrico
- cardiaco
Tramite proteine recettoriali possono essere trasportati:
- glucosio
- nucleotidi
- vitamine
Il tessuto muscolare striato scheletrico ha funzione contrattile
volontaria:
- è riccamente innervato con fibre che provengono da neuroni
motori
- gli impulsi che guidano il movimento giungono dal sistema
nervoso centrale
Tuttavia, la barriera ematoencefalica non è presente in tutte le zone
cerebrali:
Il tessuto muscolare striato cardiaco si contrae autonomamente:
- non si contrae a seguito di stimolazione nervosa
107
-
il sistema nervoso involontario contribuisce solamente alla
regolazione della frequenza.
Il tessuto muscolare liscio è caratterizzato dall’assenza di strutture
caratteristiche visibili:
- è riccamente innervato dal sistema nervoso vegetativo
- si contrae indipendentemente dalla volontà
Le cellule mioepiteliali sono cellule associate agli adenomeri delle
ghiandole salivari e ai loro dotti intercalari e agli adenomeri della
ghiandola mammaria:
- sono cellule che presentano una organizzazione del
citoscheletro e dei miofilamenti simili ad elementi lisci.
TESSUTO MUSCOLARE STRIATO SCHELETRICO
INTRODUZIONE
Il tessuto muscolare striato scheletrico costituisce:
- tutti i muscoli scheletrici dell’organismo
- lingua
- palato molle
- faringe,
- segmento craniale dell’esofago
- muscoli mimici
- muscoli di occhi e orecchie
- porzione terminale del retto.
L’unità morfologica di tale tessuto è la fibra muscolare striata,
caratterizzata dall’alternanza lungo l’asse di bande chiare e bande
scure:
- all’interno della fibra, vi sono le miofibrille, elementi filamentosi
di piccole dimensioni che formano una striatura longitudinale
all’asse
Le fibre muscolari striate sono sincizi, ovvero cellule polinucleate
derivate dalla fusione di mioblasti.
Le fibre hanno un diametro variabile a seconda della corporatura,
dell’esercizio fisico e dell’alimentazione che generalmente è compreso
tra 10 e 100 µm, mentre la lunghezza può giungere a parecchi
centimetri.
ORGANIZZAZIONE GENERALE
In un muscolo, le fibre sono unite da tessuto connettivo fibrillare:
- epimisio: è la capsula connettivale che avvolge il muscolo
- perimisio: sono sepimenti che dipartono dall’endomisio a
delimitare fasci di fibre di minor dimensione
- endomisio: sono le fibre reticolar di connettivo che circondano
ciascuna fibra. Presenta cellule connettivali e vasi sanguigni
La vascolarizzazione del muscolo è data da un’arteria che perfora
l’epimisio e si dirama nei due sensi del muscolo in un rete di capillari:
- i capillari hanno andamento sinuoso che gli permette di
allunarsi durante il rilassamento e comprimersi nelle contrazioni
- dalla rete capillare fuoriescono vene di piccolo calibro che
confluiscono in una delle vene che fuoriesce dall’epimisio.
Anche il nervo misto perfora l’epimisio e si ramifica connettendo alle
varie fibre le terminazioni motrici e sensitive.
Nel perimisio sono presenti anche i vasi linfatici.
Il tessuto connettivo del perimisio e dell’epimisio possono formare:
- stroma del muscolo che permette l’apporto di ossigeno e
sostanze trofiche
- il punto di attacco del muscolo con altri tessuti, per esempio nei
tendini.
Nei tendini le fibre muscolari terminano a forma di cono ed il connettivo
è in continuità con quello del tendine:
108
-
il sarcolemma vede connesse a sé tutte le fibre in prossimità
delle estremità
il tessuto muscolare si immerge nel connettivo
FIBRA MUSCOLARE STRIATA SCHELETRICA
Ogni fibra muscolare è delimitata da una membrana plasmatica
chiamata sarcolemma, che circonda e racchiude una massa di
citoplasma (sarcoplasma) in cui sono immersi gli organuli e le
miofibrille.
Il sarcolemma è rivestito al suo esterno da una lamina basale, che è in
continuità con l’endomisio (fibre reticolari):
- è molto elastico e resistente
- alla sua superficie citoplasmatica si appone una proteina
chiamata distrofina, che si connette alla rete di filamenti
sarcoplasmatici per aumentare la resistenza.
La fibra muscolare è un sincizio che contiene numerosi nuclei, che
possono raggiungere un numero di diverse centinaia a seconda della
lunghezza della fibra:
- sono situati immediatamente sotto la membrana
sarcoplasmatica
- presentano un voluminoso nucleolo
- sono ravvedibili ammassi di cromatina
Alla periferia della fibra si trovano cellule satelliti:
- hanno un nucleo allungato
- sono avvolte dalla stessa membrana basale
- sono mioblasti quiescenti che hanno anche capacità
rigenerative
Il maggior volume è occupato dalle miofibrille, lunghe strutture
particolari con forma cilindrica impacchettate su loro stesse:
- presentano una bandeggiatura ortogonale all’asse
- si riscontra anche una striatura parallela al’asse data
dall’impacchettamento delle fibre
La porzione del sarcoplasma rimanente contiene i vari organuli:
- piccoli complessi di Golgi
- gruppi di mitocondri disposti in fila tra le miofibrille
- gociole lipidiche
- granuli di glicogeno
- mioglobina, una proteina simile all’emoglobina che trattiene
l’ossigeno.
Le miofibrille sono circondate da un REL molto esteso detto reticolo
sarcoplasmatico.
MIOFIBRILLE
Le miofibrille sono la sede del fenomeno contrattile:
- si dispongono orientate secondo l’asse maggiore della fibra
- hanno diametro compreso tra 1 e 3 µm
Si presentano come una successione di bande scure e chiare, che
sialternano con regolarità:
- bande A: sono le bande più scure, in cui si rivela una intensa
attività ATPasica
- bande I: sono tratti chiari, divisi da una stria detta stria Z.
La banda A è attraversata da una sottile banda chiara dai contorni
irregolari detta banda H, la quale è a sua volta attraversata da una
linea molto stretta detta stria M.
L’unità funzionale contrattile delle fibre è data dal tratto compreso tra
due linee Z, ed è detta sarcomero.
Ogni fibra parallela presenta i vari sarcomeri allineati
longitudinalmente, secondo una disposizione detta a registro.
In sezione trasversale, una miofibrilla si presenta come una
formazione tondeggiante con i nuclei posizionati in periferia.
109
MIOFILAMENTI
Le miofibrille sono a loro volta costituite da unità più piccole, dette
miofilamenti, i quali sono disposti longitudinalmente all’asse della
fibra l’uno accanto all’altro.
I miofilamenti sono di due tipi:
- miofilamenti spessi: costituiti prevalentemente da miosina
- miofilamenti sottili: costituiti da actina, con tropomiosina e
troponina.
I miofilamenti spessi sono filamenti proteici del diametro di 10-12 nm
e lunghi circa 1,5 µm:
-
-
posti uno acanto all’altro ad una distanza di 45 nm
costituiscono la banda A
hanno dei prolungamenti laterali di circa 13 nm detti ponti, che
permettono il contatto con i miofilamenti sottili durante la
contrazione muscolare
hanno un diametro maggiore nella parte centrale formando la
banda H
sono collegate tra loro da espansioni oblique allineate al centro
della banda H
I miofilamenti sottili sono filamenti di diametro 5-7 nm e lunghezza 1
µm, situati nella banda I e penetranti nella banda A:
- si ancorano a livello della stria Z
- sono disposti a formazioni esagonali
- penetrano nella banda A fino all’inizio della zona chiara
delimitata dalla banda H.
I costituenti molecolari principali
L’attività contrattile è data dall’interazione ATP dipendente tra l’actina
e la miosina:
- l’elevata efficienza dell’attività contrattile delle fibre muscolari è
data dalla precisa morfologia strutturale con cui si dispongono
queste molecole.
I filamenti spessi sono costituiti da miosina, uniti al centro del
filamento:
- la miosina II è quella più frequente nei muscoli
- è costituita da due catene leggere e da due catene pesanti
- le due catene pesanti si dispongono a livello dell’estremità Cterminale a formare la coda, formata da un lungo tratto lineare
in cui le catene si avvolgono a doppia elica
- le due catene pesanti si dispongono a livello dell’estremità Nterminale a formare due strutture globoso, dette teste, in cui si
concentra l’attività ATPasica.
- Le due catene leggere si dispongono a coppie, in cui si ha una
coppia per testa. Solo una molecola della coppia presenta
attività ATPasica, ed è detta essenziale, l’altra è un peptide
regolatrice.
I filamenti sottili, che formano le bande I, sono risultanti dalla
polimerizzazione di:
- G-actina
- Tropomiosina e troponina che si presentano a intervalli regolari
L’actina dei muscoli è l’actina sarcomerica, ovvero un avvolgimento di
due alfa-actina.
A livello degli intervalli presenti nell’elica di actina, nei filamenti sottili si
presenta un doppio filamento di tropomiosina:
- formato da dimeri uniti a catena lineare avvolti a elica
spiralizzata
- nei muscoli a riposo la tropomiosina impedisce il contatto tra
l’actina e la miosina
- solamente l’attività calcio-dipendente della troponina fa si che il
filamento di tropomiosina si sposti per permettere l’incontro tra
actina e miosina.
La troponina è una proteina formata da tre subunità:
- I: inibisce la tropomiosina
- C: lega gli ioni calcio
- T: si lega alla tropomiosina
110
Le due subunità periferiche si legano all’actina e alla tropomiosina,
mentre la subunità centrale, C, è altamente affine agli ioni calcio,
potendone legare 4 in siti specifici:
- al legame avvenuto con gli ioni calcio si innescano una serie di
mutamenti strutturali che coinvolgono tutta la molecola.
- La troponina scivola nel fondo del solco dell’elica di actina,
liberando i siti di legame dell’actina per le teste della miosina.
Citoscheletro delle fibre muscolari.
La stabilità e la disposizione ordinata della struttura sarcomerica e
l’ancoraggio dei miofilamenti è dovuto ad un preciso sistema
scheletrico proteico di supporto:
- mantiene ordinato e integro il sarcomero
- ottimizza le prestazioni meccaniche
Il sistema filamentoso endsarcomerico mantiene la continuità delle
miofibrille, grazie alle connessioni di due molecole:
- connettina: ha un dominio elastico e un dominio rigido. Si
connette dalla stria Z alla stria M
- nebulina: è un polimero ad alfa elica che è responsabile del
controllo della polimerizzazione dell’actina, alla quale si adagia
partendo dalla stria Z.
La stria Z è formata da filamenti di alfa-actinina che si dispongono a
formare dei ponti tasversali:
- hanno un andamento a zig-zag
- legano in maniera sfasata i filamenti di actina a polarità
opposta.
- Ai margini sono presenti molecole di desmina, che permettono
di mantenere in registro differenti miofibrille
Le strie M sono ponti trasversali che si formano in centro alle bande H
che servono a tenere insieme i vari miofilamenti spessi miosinici. Sono
formate da:
- creatin-chinasi, un enzima che contribuisce a costruire alcuni
elementi strutturali del citoscheletro
-
proteina M costituisce ponti proteici tra sarcolemma e linee M
miomesina
schelemina.
RETICOLO SARCOPLASMATICO
Il REL della fibra scheletrica prende il nome di reticolo
sarcoplasmatico, il quale si presenta molto sviluppato ed ha molte
caratteristiche peculiari:
- formato da strutture regolari che circondano ogni miofibrille
- sono disposti a tubuli longitudinali all’asse della fibrilla, con
anastomizzazioni e fusioni evidenti a livello della banda H, dove
costituiscono la cisterna fenestrata
- a intervalli regolari, si formano le cisterne terminali, in cui i
tubuli longitudinali confluiscono. Nei mammiferi si trovano
nell’intersezione tra le bande I e le bande A.
- attorno alle cisterne terminali si avviluppano dei tubuli detti
tubuli T,
I tubuli T non sono parte integrante del REL e nono entrano in
contatto con esso:
- sono invaginazioni estremamente regolari del sarcolemma che
pergiungono all’interno della fibra.
- Al loro interno circola liquido della matrice extracellulare
La struttura associata di reticolo sarcoplasmatico e tubulo T prende il
nome di triade:
- nei mammiferi sono presenti due triadi per ogni sarcomero, a
livello delle intersezioni bande A-I
La funzione del reticolo sarcoplasmatico è principalmente quella
dell’accumulo e rilascio di Ca2+:
- il calcio viene immagazzinato nelle cisterne terminali e legato
ad una proteina chiamata calsequestrina
- sulla membrana del reticolo sarcoplasmatico sono presenti
numerose pompe del calcio ATPasiche che lo portano
all’interno contro gradiente di concentrazione
111
Il tubulo T, direttamente connesso al sarcolemma, ha la principale
funzione di portare alle cisterne del reticolo l’impulso nervoso:
- con l’arrivo dell’impulso nervoso avviene l’apertura dei canali
del calcio e il rilascio all’interno dei sarcomeri
- l’arrivo di Ca2+ è il primo processo che da origine alla
contrazione muscolare.
MECCANISMO DELLA CONTRAZIONE
Quando si ha una contrazione, al ME si può notare:
- accorciamento del sarcomero
- scomparsa del disco H
- riduzione delle bande I
- banda A immutata
Se invece si osserva un muscolo durante stiramento:
- il sarcomero si allunga
- la banda A resta costante
- la banda I si espande così come la banda H
Questo avviene poiché non si ha un allungamento delle componenti,
bensì uno scorrimento tra i filamenti di actina (sottili e legati alle
strie z) e quelli di miosina (spessi).
I filamenti di actina scorrono sui filamenti d miosina grazie all’azione
delle teste della miosina:
- la direzione del moto è unica e dettata dalla polarità dei
filamenti di actina (la pointed end è sempre rivolta verso il
senso di moto)
- la formazione di legami trasversali è un fenomeno ciclico, che
richiede l’attivazione da parte del calcio e l’energia dall’idrolisi
di ATP.
1) in condizioni di riposo la testa della miosina è a 45° dal
filamento di actina, ma appena arriva lo stimolo degli ioni calcio
la testa della miosina diviene capace di idrolizzare ATP,
2) l’energia liberata dall’idrolisi è sfruttata per portare la testa della
miosina a 90° dall’actina, con un cambiamento
conformazionale
3) la testa della miosina si aggancia al filamento di actina e
rilascia ADP + P, che aveva ancora legati
4) nel rilasciare l’adenosindifosfato e il fosfato, la testa della
miosina annulla il cambiamento conformazionale e, siccome è
legata all’actina, trascina questa con se per un percorso di 100
nm circa in direzione da barbed end a pointed end.
Una volta completato questo ciclo, la testa della miosina rimane legata
a 45° con l’actina, con un legame a basso contenuto energetico, detto
complesso di rigor:
- per scindere il complesso è necessario l’intervento di una
nuova molecola di ATP
TESSUTO MUSCOLARE STRIATO CARDIACO.
Il tessuto muscolare striato cardiaco costituisce il miocardio, il
muscolo responsabile della contrazione del cuore.
Questo tessuto, a differenza del tessuto scheletrico, è costituito da
cellule morfologicamente distinte, unite con particolari sistemi di
giunzione, detti dischi intercalari.
Questo tipo di tessuto è innervato dal sistema nervoso vegetativo, che
ha soltanto il compito di regolarne la frequenza:
- l’impulso proviene da cellule specializzate
- la propagazione avviene attraverso il sistema di conduzione.
Il processo può essere riassunto in quattro tappe:
112
STRUTTURA E ULTRASTRUTTURA DEL CARDIOCITO.
Anche le cellule della muscolatura cardiaca, detti cardiociti, sono
caratterizzate dall’alternanza di dischi chiari e dischi scuri lungo il loro
asse maggiore:
- tuttavia non sono organizzati in miofibrille
- la sostanza contrattile è una massa estremamente discontinua
a causa dei numerosi e voluminosi mitocondri.
Nelle sezioni normali istologiche per la microscopia elettronica i
cardiociti appaiono come elementi allungati, talvolta con delle
biforcazioni:
- presentano delle interdigitazioni ai loro margini, attraverso cui si
connettono alle altre cellule tramite i dischi intercalari.
- Il nucleo ha forma allungata e si trova in centro alla cellula
- Sono presenti spesso due nucleoli
- Presente un piccolo apparato di Golgi a livello paranucleare
- Sono presenti in quelle zone anche numerosi granuli di
glicogeno e gocciole lipidiche
- I mitocondri sono di forma pressappoco cilindrica, disposti in
fila lungo i miofilamenti
Il sarcolemma è rivestito anche da una sottile lamina basale:
- presenta tubuli T più ampi ma meno numerosi rispetto ai sincizi
scheletrici
Il reticolo sarcoplasmatico differisce notevolmente da quello del
tessuto striato scheletrico:
- non si osservano cisterne fenestrate e terminali
- vi sono sarcotubuli, di piccolo diametro a decorso longitudinale,
che formano una rete tridimensionali attorno alle colonne di
miofilamenti
- il tubulo T è posto a livello della stria Z, si mette in contatto con
piccole espansioni di sarcotubuli
Alle appendici degli atri del cuore, si trovano delle cellule contrattili
particolari, dette cellule mioendocrine, caratterizzate dalla presenza
di piccoli granuli di secreto nel citoplasma.
Questi granuli di secreto contengono un ormone peptidico, detto
ormone natriuretico striale, che provoca vari effetti:
- vasodilatazione (quindi ipotensione) arteriosa
- aumento della diuresi
- escrezione di Na+ a livello renale
DISCHI INTERCALARI
I dischi intercalari sono particolari zone di giunzione specializzate tra
due cellule miocardiche (cardiociti):
- sono localizzati sempre a livello di linee Z da entrambi i lati
- sono presenti in quei punti delle strutture giunzionali quali
o desmosomi
o fasce aderenti
o giunzioni serrate
i desmosomi sono disseminati lungo la porzione orizzontale e
longitudinale delle strie intercalari:
- in prossimità delle placche sono presenti filamenti di desmina
- la loro funzione è di ripartire in modo equilibrato le forze che si
sviluppano durante le contrazioni
Le fasce aderenti hanno sempre un decorso trasversale e ancorano i
filameli sottili terminali, sostituendo una stria Z:
- nella zona in cui giungono i filamenti sottili sono state
dimostrate molecole di alfa-actinina e vincolina,
- nello spazio tra due sarcolemmi vi sono molecole di adesione,
tra cui placoglobina e L-CAM, della famiglia delle caderine.
Le gup junction o giunzioni serrate sono disseminate lungo il tratto
trasversale delle strie scalariformi:
- i sarcolemma sono molto ravvicinati
- la vicinanza e il diretto accoppiamento delle membrane
permette l’accoppiamento elettrico
- permettono ai cardiociti di comportarsi come un tuttuno dal
punto di vista funzionale.
113
SISTEMA DI CONDUZIONEDEL CUORE
La muscolatura cardiaca si contrae in modo autonomo, senza cioè il
bisogno di essere eccitata da fibre esterne:
- vi sono particolari zone in cui sono presenti dei cardiociti
modificati, che sono specializzati nell’autoeccitabilità e nella
conduzione dell’impulso
- queste cellule si comportano come un pace-maker
Questo insieme di strutture miocardiche che può autoeccitarsi e
condurre l’impulso al resto della muscolatura si chiama sistema di
conduzione, ed è formato da:
1) nodo seno-atriale
2) nodo atrio-ventricolare
3) fascio comune atrio-ventricolare di His.
La frequenza dello stimolo è regolata da diversi settori del sistema
nervoso vegetativo:
- sistema ortosimpatico: per quanto riguarda l’aumento di
frequenza
- sistema parasimpatico: diminuisce la frequenza
Queste fibrocellule si possono riscontrare:
- isolate o in piccoli gruppi in seno a tessuti connettivi (muscolo
erettore del pelo)
- affiancate tra loro in lamine o fascetti costituiscono le tonache
degli organi cavi,
- si trovano nella parete delle arterie e delle vene di maggior
dimensione e nei vasi linfatici
- rivestono i grossi dotti ghiandolari
Nel rivestire gli organi cavi, le fibrocellule possono disporsi:
- strato circolare
- strato longitudinale
- a doppio strato, sia longitudinale che circolare.
Nei casi in cui si ha il doppio strato o in altre situazioni, le fibrocellule
sono sempre separate da uno strato di connettivo lasso.
Il tessuto muscolare liscio è innervato dal sistema nervoso
vegetativo:
- non può esservi controllo volontario sulla muscolatura liscia.
STRUTTURA E ULTRASTRUTTURA DELLE FIBROCELLULE
MUSCOLARI LISCE.
TESSUTO MUSCOLARE LISCIO
Il tessuto muscolare liscio è costituito da unità morfologicamente
distinte, le fibrocellule muscolari lisce:
- forma allungata e prive di striature trasversali
- rivestite da una lamina basale.
Le fibrocellule muscolari lisce sono generalmente di forma fusata:
- il centro è rigonfio per la presenza del nucleo
- il nucleo è ovoidale
- la cellula è estremamente assottigliata alle estremità
- ha una lunghezza variabile a seconda del settore anatomico e
della necessità funzionale
La fibrocellule muscolare liscia ha la maggior parte degli organuli
concentrati in sede perinucleare:
- i mitocondri sono allungati e voluminosi
- vi è un piccolo apparato di golgi attorno al nucleo
- molti ribosomi liberi
- goccie lipidiche
- granuli di glicogeno
- microtubuli
Sono presenti profili di REL in prossimità di invaginazioni
sarcolemmatiche, dette caveole, che svolgono il ruolo dei tubuli T nel
muscolo striato:
- sono numerose a ridosso della membrana
114
-
è stata riscontrata, a livello delle caveole, presenza di
distrofina.
Nelle cellule lisce che costituiscono la muscolatura delle viscere
(condotti interiori) sono state riscontrate tra le cellule delle gup
junction, che riducono la membrana basale a soli 2 nm.
Nelle fibrocellule che rivestono i vasi, invece, sono state evidenziate
delle particolari adesioni dette giunzioni mioendoteliali:
- sono allungamenti delle cellule endoteliali che stabiliscono
contatti con le fibrocellule più prossime a loro
Per quanto riguarda i filamenti, sono presenti:
- filamenti spessi di miosina, in cui le teste sono disposte lungo
tutto il filamento e la contrazione avviene solo se le catene
leggere delle teste sono fosforilate
- filamenti sottili di actina, molto più numerosi di quelli di miosina
- filamenti intermedi
- corpi densi intrasarcoplasmatici, sui quali si inseriscono i
miofilamenti di actina, che terminano da un lato all’altro del
corpo denso con polarità opposte. Hanno funzione analoga a
quella delle strie Z.
I corpi densi sono anche il luogo in cui si interseca il citoscheletro con
le fibre:
- sono presenti dei corpi densi a ridosso della membrana
plasmatica (sarcolemma), in cui sono state riscontrate talina e
vincolina,
- i filamenti di actina si legano alle molecole dei corpi densi ed
hanno decorso obliquo rispetto alla membrana plasmatica
CONTRAZIONE DEL MUSCOLO LISCIO
La fibrocellule muscolare liscia presenta delle contrazioni più lente e
durature rispetto al muscolo striato. Esistono due tipi di contrazione:
- contrazione peristaltica: contrazione lenta che si protrae a
lungo nel tempo, tipica della muscolatura liscia viscerale
- tono muscolare: è una soglia minima di contrattilità
permanente, tipica delle pareti dei vasi sanguigni.
Il tono muscolare può essere regolato da alcuni ormoni presenti nel
sangue:
- la noradrenalina e la vasopressina hanno un’azione
vasocompressiva, ovvero contraggono le fibrocellule del vaso
- le prostaglandine, la brachidina e altri ormoni determinano una
vasodilatazione, con conseguente rilassamento del tono
muscolare.
Nel muscolo liscio sono presenti actina e miosina, ma queste
differiscono in minima parte da quelle della fibra muscolare striata:
- l’actina ha sequenze amminoacidiche differenti
- la miosina presenta un’attività ATPasica molto inferiore
- la miosina interagisce con i filamenti di actina solamente se è
fosforilata.
I filamenti spessi, miosina, sono osservabili solamente al momento
della contrazione:
- a riposo la miosina presenta una forma compatta, in cui è
ripiegata su sé stessa
- solo quando vengono fosforilate si distendono nella forma
lineare
manca il complesso troponina/tropomiosina, quindi anche la
risposta alla concentrazione di ioni Ca2+ è differente:
- la risposta è mediata da una proteina simile alla troponina C, la
calmodulina
- con l’arrivo dell’onda di depolarizzazione aumenta la
concentrazione del calcio nel citoplasma
- il calcio si lega alla calmodulina
115
-
-
il complesso Ca2+/calmodulina attiva delle chinasi delle catene
leggere, la quale induce la fosforilazione della miosina e la sua
conseguente distensione
la miosina attiva si può legare con altre 15-20 molecole di
miosina a formare un filamento spesso.
La fosforilazione sulle teste della miosina modifica il sito ATPasico,
quindi rende possibile l’interazione con le molecole di actina:
- si ha la lenta contrazione, in cui i filamenti sottili sono tirati l’uno
verso l’altro dalla miosina
- la fibrocellule viene ad assumere quindi una forma
tondeggiante.
La contrazione delle fibrocellule lisce può essere attivata anche da
altri stimoli:
- mediatori chimici dell’impulso nervoso, come ad esempio
l’acetilcolina e la noradrenalina
- ormoni: quali ossitocina, vasopressina
- amine biogene, come ad esempio istamina e serotonina.
L’impulso si propaga in maniera differente a seconda del tipo di
fibrocellule:
- muscoli viscerali: l’impulso si propaga da cellula a cellula
attraverso i nexus
- muscoli multiunitari: l’impulso alla contrazione è determinato da
innervazioni su ogni singola fibrocellula.
Con questo, finisce anche l’istologia….
116