I macronutrienti sono molecole complesse. Per poterli
utilizzare l’organismo deve ridurli in composti semplici ed
inernalizzarli. Quindi, trasformarli in anidride carbonica ed
acqua (ossidarli) con liberazione di energia o,
eventualmente, utilizzarli per la sintesi dei suoi
componenti strutturali…
Digestione
riduzione in composti semplici
Assorbimento internalizzazione
Metabolismo
utilizzazione a scopo
energetico o/e plastico
• Il grado di utilizzazione di un nutriente che tiene
conto di tutti e tre questi processi prende il nome di
biodisponibilità…
Digestione, assorbimento e metabolismo si sono evoluti
nell’arco di centinaia di migliaia di anni per utilizzare al
meglio le fonti alimentari a disposizione. Nell’uomo,
l’apparato digerente e il sistema di regolazione
metabolica sono il frutto di questa evoluzione tesa a
massimizzare l’utilizzazione di energia e nutrienti da
fonti poco biodisponibili…
Il risultato è che la capacità del “sistema” è
sovrabbondante rispetto alle necessità attuali
Due ormoni chiave: Insulina e Glucagone
Fase postprandiale insulina
Fase postassorbitiva (digiuno) glucagone
Attiva
Deposito di lipidi
Deposito di glucosio
Ossidazione del glucosio
Sintesi di trigliceridi
L’insulina :
Inibisce
- Mobilizzazione di lipidi
- Mobilizzazione di glucosio
Il glucagone (e le catecolamine):
Attiva
Mobilizzazione di lipidi
Mobilizzazione di glucosio
Sintesi del glucosio
Ossidazione di trigliceridi
Inibisce
- Deposito di lipidi
- Deposito di glucosio
L’evoluzione ci ha attrezzati ad utilizzare al meglio risorse
alimentari scarse, grezze ed erratiche. I vantaggi di una
alta digeribilità sono un mito da sfatare..
E in effetti, se la benzina fosse sempre meglio del
gasolio, la userebbero anche i motori diesel…
Nelle cellule, le singole reazioni enzimatiche fanno parte
di sequenze a più tappe chiamate vie metaboliche.
In una via metabolica, il prodotto di una reazione funge
da substrato nella reazione successiva.
Si definisce metabolismo l’insieme di queste vie
metaboliche.
Le vie metaboliche vengono classificate in:
- cataboliche (demolitive)
- anaboliche (sintetiche).
Le reazioni cataboliche disgregano le molecole complesse
(proteine, polisaccaridi, lipidi) producendo poche molecole
semplici come CO2, NH3 ed H2O.
Servono a catturare, sotto forma di ATP, l’energia chimica liberata
dalla degradazione di molecole combustibili.
La liberazione di energia nella degradazione di molecole
complesse avviene in 3 stadi:
I) l’idrolisi delle molecole complesse
II) conversione dei monomeri in molecole più semplici
III) ossidazione dell’acetil CoA
Il catabolismo è un processo convergente (una grande varietà di
molecole si trasforma in pochi prodotti finali comuni).
Champe et al., Le basi della biochimica, Ed. Zanichelli
Partendo da precursori semplici (p.es. amminoacidi) si
ottengono prodotti terminali complessi (p.es.
proteine).
Richiedono energia, generalmente fornita dalla
degradazione dell’ATP in ADP e Pi.
Molte reazioni comportano una riduzione chimica,
nella quale spesso il potere riducente è fornito dal
donatore di elettroni NADPH.
L’anabolismo è un processo divergente, pochi
precursori formano una varietà di prodotti complessi.
Champe et al., Le basi della biochimica, Ed. Zanichelli
Uno dei legami più importanti tra reazioni cataboliche ed
anaboliche è l’energia.
Le reazioni anaboliche richiedono energia (reazioni
endoergoniche)
Le reazioni cataboliche producono energia (reazioni
esoergoniche)
L’energia prodotta durante i processi esoergonici viene
conservata sotto forma di composti ad alto contenuto
energetico, per poi essere riutilizzata nei processi
endoergonici
L’esempio più noto di composto ad alto contenuto energetico
è l’ATP (adenosina trifosfato)
E’ un nucleoside trifosfato costitito da Adenina, Riboso e 3
radicali fosforici
Il primo radicale fosforico è legato al C 5’ del Riboso con legame
estereo (reaz. tra un alcool ed un acido)
I due restanti fosfati sono uniti con legami anidridici e sono
legami ad alta energia di idrolisi
Nell’ATP, la presenza di cariche dello stesso segno causa una
repulsione elettrostatica che riduce la sua stabilità
In generale, l’elevata energia libera di idrolisi dei composti ad
alto contenuto energetico è dovuta alla maggiore stabilità dei
prodotti di reazione rispetto ai reagenti; i prodotti sono
stabilizzati da fenomeni di ionizzazione, isomerizzazione o
risonanza
Champe et al., Le basi della biochimica, Ed. Zanichelli
Tra tutti i composti ad alto contenuto energetico l’ATP occupa
una posizione unica
Larga parte dell’energia utile ai fini biologici prodotta dalle
reazioni cataboliche viene convogliata nell’ATP e da questo
distribuita per le varie forme di lavoro cellulare
La maggior parte dei legami ad alta energia di idrolisi si forma
nella catena respiratoria durante la riossidazione dei coenzimi
ridotti NADH e FADH2 ad opera dell’O2
Nella catena respiratoria l’energia libera delle reazioni
ossidoriduttive viene utilizzata per formare ATP da ADP e Pi
(fosforilazione ossidativa)
NB. Legami ad alta energia libera di idrolisi si formano anche al di fuori
della catena respiratoria, direttamente sui substrati che vanno incontro
alle trasformazioni cataboliche (fosforilazione a livello del substrato)
Champe et al., Le basi della biochimica, Ed. Zanichelli
Le vie metaboliche devono essere coordinate in modo
che la produzione di energia o la sintesi dei prodotti
finali rispondano ai reali bisogni delle cellule.
Le singole cellule non lavorano isolatamente ma fanno
parte di una comunità di tessuti interagenti.
I segnali regolatori comprendono: ormoni,
neurotrasmettitori, disponibilità di nutrienti.
I segnali che si generano all’interno di una cellula
(segnali intracellulari) producono risposte rapide e
regolano istante per istante il metabolismo.
La segnalazione tra cellule (intercellulare) produce
risposte più lente. La comunicazione più importante è
quella mediata da ormoni o neurotrasmettitori.
Il legame di un ormone o di un neurotrasmettitore ad un
recettore innesca una serie di reazioni che hanno come
risultato finale una specifica risposta intracellulare. I
secondi messaggeri fanno parte di questa cascata di
eventi.
Il sistema dell’adenilato ciclasi è particolarmente importante
nella regolazione delle vie del metabolismo intermedio.
Il legame di ormoni o neurotrasmettitori ai recettori specifici
innesca un aumento o una diminuzione dell’attività
dell’adenilato ciclasi.
L’adenilato ciclasi è un enzima legato alla membrana che
converte l’ATP in 3’,5’-adenosina monofosfato (AMP ciclico o
cAMP).
I recettori che agiscono attraverso l’adenil ciclasi hanno:
a) una regione extracellulare, che riconosce il ligando
b) 7 eliche transmembranali
c) un dominio intracellulare che interagisce con le proteine G.
Sono proteine trimeriche localizzate nella membrana
cellulare, associate ai recettori.
Sono così chiamate perché legano i nucleotidi
guanosinici (GTP e GDP).
Sono il primo degli anelli di comunicazione tra
recettore di membrana ed adenilato ciclasi.
Normalmente sono in forma inattiva (proteina G
legata al GDP).
Il recettore attivato (dal legame con un ormone o
neurotrasmettitore) interagisce con le proteine G
scambiando il GDP col GTP (proteina G attiva).
La proteina G attivata si dissocia nella subunità a e
nel dimero bg.
La subunità a si sposta verso l’adenil ciclasi,
attivandola.
Per ogni molecola di recettore attivato si formano
molte molecole di proteina G attiva.
L’azione del complesso proteina G-GTP è di breve
durata.
Le proteine G hanno un’attività GTPasica intrinseca,
che provoca l’idrolisi del GTP in GDP con
conseguente inattivazione della proteina G e
dell’adenilato ciclasi.
Champe et al., Le basi della biochimica, Ed. Zanichelli
La capacità di un ormone di stimolare o inibire l’adenilato
ciclasi dipende dal tipo di proteina G che si trova legata al
recettore.
La famiglia delle proteine Gs è specifica per l’attivazione
dell’adenilato ciclasi mentre la famiglia designata Gi
provoca l’inibizione dell’enzima.
Il complesso “proteina G-GTP” ha una breve durata: le
proteine G hanno attività GTPasica intrinseca
idrolisi del GTP in GDP
inattivazione della
proteina G e dell’adenilato ciclasi.
Il cAMP attiva una famiglia di enzimi chiamati proteina chinasi
cAMP dipendenti .
Essi catalizzano il trasferimento del fosfato dall’ATP a specifici
residui di serina o treonina di substrati proteici.
Le proteine fosforilate possono agire direttamente sui canali ionici
della cellula oppure, se sono enzimi, possono essere attivati o
inattivati.
N.B. Non tutte le proteina chinasi dipendono dal cAMP (p.es. la
proteina chinasi C).
DEFOSFORILAZIONE DELLE PROTEINE
Le variazioni delle attività enzimatiche indotte dalla fosforilazione delle
proteine non sono permanenti.
Le proteina fosfatasi, enzimi che idrolizzano gli esteri fosforici, rimuovono
i gruppi fosfato aggiunti dalle proteina chinasi.
IDROLISI DEL cAMP
Il cAMP è idrolizzato rapidamente a 5’-AMP dalla cAMP fosfodiesterasi,
che rompe il legame fosfodiestere ciclico 3’-5’ (il 5’-AMP non è una
molecola di segnale).
N.B. La fosfodiesterasi è inibita da derivati della metilxantina (teofillina e
caffeina).
FASE DI ASSORBIMENTO
2-4 ore successive all’assunzione di un pasto.
E’ caratterizzata da un transitorio della concentrazione ematica di glucosio,
amminoacidi e trigliceridi.
Il pancreas risponde con:
della secrezione di INSULINA
della secrezione di GLUCAGONE
L’elevato rapporto INSULINA/ GLUCAGONE e la disponibilità di substrati porta
ad un della sintesi di trigliceridi, glicogeno e proteine.
Durante questa fase praticamente tutti i tessuti utilizzano il glucosio come
fonte di energia.
Il flusso di intermedi lungo le vie metaboliche è controllato da 4
meccanismi:
1) disponibilità di substrati
2) attivazione o inibizione allosterica di enzimi
3) modificazioni covalenti di enzimi (p.es. fosforilazione o defosforilazione)
4) induzione o repressione della sintesi di enzimi
(p.es. l’ di insulina produce un della sintesi di enzimi chiave del
metabolismo anabolico).
Nelle condizioni di apporto alimentare, tali meccanismi garantiscono che i
nutrienti disponibili siano trattenuti sotto forma di glicogeno, trigliceridi e
proteine.
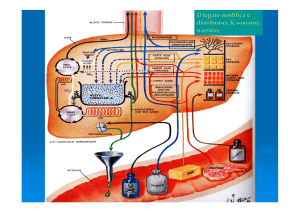
Occupa una posizione strategica per l’elaborazione e la distribuzione dei nutrienti di
provenienza alimentare.
Ha infatti il ruolo di attenuare le fluttuazioni dei nutrienti a disposizione dei tessuti
periferici.
************
Il sangue che il fegato riceve dopo un pasto (v. porta) è ricco di nutrienti e contiene
un elevato livello di insulina.
Durante il periodo dell’assorbimento intestinale, il fegato assume carboidrati, lipidi e
gran parte degli amminoacidi *
Questi nutrienti saranno poi:
(a) metabolizzati e conservati
oppure
b) instradati verso altri tessuti.
*gli AA a catena ramificata, leucina, isoleucina e valina, sfuggono al metabolismo epatico
Normalmente il fegato produce glucosio piuttosto che consumarlo.
Dopo un pasto contenente carboidrati, il fegato trattiene
60% degli zuccheri presenti nel sangue portale e li utilizza per le sue
attività.
Il metabolismo epatico del glucosio attraverso diversi meccanismi:
(1) fosforilazione del glucosio (glucochinasi)
(2) sintesi del glicogeno (attivazione della glicogenosintasi)
(3) attività della via dei pentosi
(4) glicolisi (la conversione del glucosio in acetil CoA è stimolata dal
rapporto elevato Insulina/Glucagone; L’Acetil CoA è utilizzato nella sintesi degli Ac.
Grassi o per generare energia nel Ciclo di Krebs)
(5) gluconeogenesi (scarsa attività della piruvato carbossilasi e
inibizione di altri enzimi della via)
sintesi degli Ac. Grassi
Il fegato è il tessuto principale nel quale avviene la sintesi ex novo degli
acidi grassi.
La sintesi degli Ac. Grassi è favorita dalla disponibilità di substrati (acetil
CoA e NADPH) derivanti dal metabolismo del glucosio.
sintesi dei Trigliceridi
E’ favorita dalla disponibilità di acetil CoA (proveniente sia dalla sua
sintesi ex novo sia dall’idrolisi dei trigliceridi presenti nei remnants dei
chilomicroni).
Il fegato introduce i trigliceridi nelle VLDL, secrete nel sangue ed utilizzate
di tessuti extraepatici (soprattutto t. adiposo e t. muscolare)
della degradazione degli AA(*)
la disponibilità di AA è necessità delle cellule
gli AA eccedenti sono:
(1) liberati nel sangue e usati da altri tessuti (sintesi proteica)
(2) deaminati scheletri carboniosi piruvato, acetil CoA
o altri intermedi del ciclo di Krebs ossidazione o sintesi Ac. Grassi
(*) N.B. Gli AA a catena ramificata (leucina, isoleucina e valina) sfuggono al
metabolismo epatico e sono assunti dal tessuto muscolare.
della sintesi proteica
sostituzione di proteine degradate nel periodo precedente
Dopo il fegato, il tessuto adiposo è secondo per capacità di distribuire
molecole di combustibile.
In un uomo di 70 kg, rappresenta il 20% circa.
Negli individui obesi, può costituire fino al 70% della massa corporea.
Metabolismo dei carboidrati
del trasporto del glucosio (sensibile alla [insulina] nel sangue)
della glicolisi (fornisce il glicerolo fosfato per la sintesi dei trigliceridi)
della via dei pentosi (producendo NADH necessario per la sintesi dei
grassi)
Metabolismo dei grassi
della degradazione dei trigliceridi (inibizione della lipasi ormone- sensibile)
della sintesi dei trigliceridi
L’innalzamento della glicemia e dell’insulinemia favoriscono l’accumulo di
trigliceridi.
Gli Ac. Grassi esogeni (chilomicroni e VLDL) si liberano per azione della
lipoproteina lipasi (legata alle pareti dei capillari sanguigni, spt del t. adiposo e
muscolare).
Il glicerolo 3-P per la sintesi dei trigliceridi proviene dal metabolismo del glucosio
poiché gli adipociti non contengono la glicerolo chinasi.
della sintesi degli Ac. Grassi
N.B. La sintesi ex novo a partire dall’Acetil CoA è molto limitata, tranne nei casi di
alimentazione dopo un periodo di digiuno. La maggior parte degli Ac. Grassi deriva
dai grassi della dieta (chilomicroni) ed una piccola quantità dalle VLDL.
Il consumo di O2 a riposo è circa il 30% del consumo corporeo totale ma può
arrivare al 90% durante un esercizio fisico intenso.
Il muscolo scheletrico è pertanto un tessuto ossidativo (benchè abbia la
potenziale capacità di utilizzare per un periodo transitorio la glicolisi
anaerobica).
N.B.
Il muscolo cardiaco differisce da quello scheletrico per 3 aspetti:
(1) è in continua attività mentre i muscoli si contraggono in maniera intermittente
(2) ha un metabolismo completamente aerobico
(3) contiene riserve energetiche (glicogeno e lipidi) in quantità trascurabile.
Le sostanze da cui ricava energia sono il glucosio libero, gli Ac. Grassi ed i corpi chetonici.
Ne consegue che una condizione di ischemia provoca rapidamente la morte dei cardiomiociti.
Metabolismo dei carboidrati
del trasporto del glucosio (sensibile alla [insulina] nel sangue), che verrà
fosforilato e poi metabolizzato.
sintesi del glicogeno, soprattutto se le scorte sono state esaurite in
precedenza in seguito ad esercizio fisico.
N.B. Il glucosio è il principale combustibile nella fase di apporto di nutrienti!
Metabolismo degli Ac. Grassi
Gli Ac. Grassi si liberano dai chilomicroni e dalle VLDL per azione della
lipoproteina lipasi.
N.B. Nel periodo di apporto di nutrienti gli Ac. Grassi sono combustibili di secondaria
importanza!
Metabolismo degli Amminoacidi
sintesi proteica (sostituzione di proteine catabolizzate nella fase precedente)
uptake di AA a catena ramificata (sfuggono al metabolismo epatico), usati
come fonte energetica e per la sintesi proteica.
L’encefalo consuma il 20% (a riposo) dell’ossigeno utilizzato
dall’organismo, benchè contribuisca solo per il 2% alla massa corporea di
un adulto.
L’encefalo consuma energia a ritmo costante
I substrati, per poter essere utilizzati, devono superare la “barriera
emato-encefalica”
Il glucosio normalmente funge da combustibile primario
I corpi chetonici, in quanto combustibili, svolgono un ruolo significativo
nei periodi di digiuno.
N.B. Se la glicemia crolla ad un livello 30 mg/100ml (V.N. 70-90 mg/100 ml) la funzionalità
cerebrale è compromessa.
Metabolismo dei Carboidrati
L’encefalo dipende completamente dalla disponibilità del glucosio ematico
in quanto non contiene scorte significative di glicogeno.
Nelle condizioni di apporto di nutrienti, l’encefalo utilizza esclusivamente
il GLUCOSIO come combustibile (ne ossida completamente circa 140
g/die a CO2 ed H2O).
Metabolismo dei Grassi
L’encefalo non contiene scorte significative di trigliceridi
Gli Ac. Grassi presenti nel sangue non attraversano con efficienza la
barriera emato-encefalica.
CAUSE
1) impossibilità di reperire del cibo
2) desiderio di perdere peso rapidamente
3)impossibilità ad alimentarsi in seguito ad un trauma, ad un intervento chirurgico, ad una
neoplasia ecc.
EFFETTI
I livelli plasmatici del Glucosio, degli Amminoacidi e dei Trigliceridi tendono a
La secrezione di INSULINA mentre quella del GLUCAGONE
Il periodo di digiuno è un periodo CATABOLICO, caratterizzato dalla degradazione di
Trigliceridi, Glicogeno e Proteine.
S’ innesca uno scambio di substrati tra FEGATO, Tessuto Adiposo, Tessuto Muscolare ed
Encefalo, sotto la spinta di due priorità:
1) mantenere costante la glicemia
2) mobilizzare Ac. Grassi dal Tessuto Adiposo ed attivare la sintesi dei Corpi Chetonici.
Le scorte energetiche (in un adulto di 70 Kg di peso corporeo)
Costituite soprattutto da trigliceridi (20% circa del peso)
Proteine (8,5% circa del peso).
N.B. Solo 1/3 circa delle proteine corporee può essere utilizzato per la produzione
di energia senza compromettere le funzioni vitali poiché ciascuna proteina ha una
propria funzione (p.es. enzima, componente strutturale etc.)
Glicogeno (0,3% circa del peso)
I cambiamenti enzimatici nel digiuno
Nel digiuno, il flusso di intermedi lungo le vie del metabolismo intermedio è
controllato dagli stessi meccanismi che intervengono nelle condizioni di
apporto di nutrienti:
1) disponibilità di substrati
2) attivazione o inibizione allosterica di enzimi
3) modificazioni covalenti di enzimi (p.es. fosforilazione).
La maggior parte è nello stato fosforilato ed è inattiva.
4) induzione o repressione della sintesi di enzimi
N.B. Molte modificazioni sono opposte rispetto all’apporto di nutrienti.
Il fegato ha un ruolo primario nel metabolismo energetico,
che consiste nella sintesi e nella distribuzione di molecole di combustibile ad altri
organi.
Metabolismo dei Carboidrati
(1) della glicogenolisi
L’aumentato rapporto tra glucagone ed insulina provoca una rapida mobilizzazione delle
scorte epatiche di glicogeno.
E’ una risposta transitoria che avviene nella prima fase del digiuno.
Il glicogeno epatico (100 g circa) è quasi esaurito dopo 10-18 ore di digiuno.
(2) della gluconeogenesi
La gluconeogenesi inizia da 4 a 6 ore dopo l’ultimo pasto e raggiunge la massima attività
quando le scorte di glicogeno sono esaurite.
Ha un ruolo essenziale nel mantenimento della glicemia sia ne digiuno notturno sia in
quello prolungato.
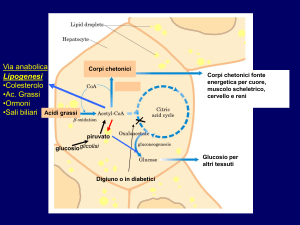
Metabolismo dei grassi
dell’ossidazione degli Ac. Grassi provenienti dal tessuto adiposo (è la principale
fonte di energia per il fegato durante la fase di post-assorbimento)
della sintesi dei corpi chetonici
E’ una prerogativa del fegato!
Gli acidi Acetoacetico e b-idrossibutirrico sono trasportati dal sangue ai tessuti,
dove potranno essere riconvertiti in acetil CoA che sarà ossidato nel ciclo di Krebs.
L’acetone non è metabolizzabile.
N.B.
1) Il fegato, essendo privo dell’enzima tioforasi, non può utilizzare come combustibile i corpi chetonici!
2) La disponibilità di corpi chetonici in circolo è importante perché riducendo il bisogno di sintetizzare
glucosio attraverso la gluconeogenesi a partire daglischeletri carboniosi di AA, rallenta la perdita di
proteine essenziali.
Metabolismo dei Carboidrati
Il trasporto del glucosio negli adipociti ed il suo successivo
metabolismo sono depressi (per il basso livello d’insulina) ridotta
sintesi di Ac. Grassi e di Trigliceridi.
Metabolismo dei Grassi
idrolisi dei Trigliceridi di deposito (per dell’Adrenalina e
soprattutto della Noradrenalina, che stimolano l’attività della lipasi
sensibile agli ormoni).
liberazione degli Ac. Grassi in circolo.
Legati all’albumina, essi raggiungono un molteplicità di tessuti e
sono utilizzati per produrre energia.
Il glicerolo prodotto dalla degradazione dei trigliceridi è utilizzato
dal fegato come precursore gluconeogenico.
assunzione degli Ac. Grassi. L’attività della lipoproteina lipasi è
bassa pertanto i trigliceridi, presenti in circolo nelle lipoproteine,
non si rendono disponibili.
Il muscolo a riposo utilizza gli Ac. Grassi come fonte principale di
energia.
Il muscolo in esercizio inizialmente utilizza le scorte di glicogeno
(durante uno sforzo intenso, il glucosio 6-P è convertito in lattato
con la glicolisi anaerobica); successivamente la fonte principale
diventano gli acidi grassi liberi (derivanti dalla mobilizzazione dei
trigliceridi del t. adiposo).
Metabolismo dei Carboidrati
Il trasporto del glucosio all’interno delle fibre è depresso (basso
livello d’insulina)
Metabolismo dei lipidi
Durante le prime due-tre settimane di digiuno, il muscolo utilizza sia Ac. Grassi che
Corpi Chetonici. Successivamente utilizza quasi esclusivamente Ac. Grassi.
N.B. La utilizzazione dei Corpi Chetonici da parte del muscolo provoca un della
loro [plasmatica], cui fa seguito una loro utilizzazione da parte dell’encefalo.
Metabolismo delle proteine
Durante i primi giorni, si ha una rapida demolizione delle proteine muscolari,
per fornire al fegato AA da utilizzare per la gluconeogenesi (spt. Alanina e
glutammina).
Dopo varie settimane di digiuno, la velocità della proteolisi diminuisce, poiché
l’encefalo ha iniziato ad utilizzare i corpi chetonici come fonte di energia.
Durante i primi giorni, l’encefalo utilizza a scopo energetico
esclusivamente glucosio (ottenuto grazie alla gluconeogenesi).
Nel digiuno protratto (oltre 2-3 settimane), i corpi chetonici
raggiungono livelli significativamente elevati e l’encefalo li utilizza
come combustibili, in aggiunta al glucosio.
In tal modo si riduce la richiesta di un catabolismo proteico per
alimentare la gluconeogenesi.
Da Champe et al. - Le basi della Biochimica- Zanichelli
Profilo
glicemico
costante,
giornaliero
nonostante
la
normale
~
discontinuità
di
introduzione del glucosio con l’alimentazione,
per la capacità del fegato di utilizzare glucosio
nei periodi di glicemia elevata e produrre
glucosio
quando
viene
meno
l’apporto
alimentare.
glicemia 70-110 mg/100 ml siero
Dopo l’assorbimento a livello intestinale, i
monosaccaridi, prima di pervenire nella
circolazione sistemica, passano attraverso il
fegato attraverso il circolo portale.
Alcune attività funzionali del fegato
tendono a far diminuire la quantità di
glucosio
immessa
nella
circolazione
sistemica:
• la trasformazione del glucosio in glicogeno
(glicogenosintesi) e suo deposito nel fegato;
• l’utilizzazione del glucosio da parte del
fegato (ossidazione) per la produzione di
energia;
• l’utilizzazione del glucosio per la sintesi di
altri composti, come acidi grassi, aminoacidi,
ecc.
Altre funzioni del fegato, invece, tendono
a far aumentare la quantità di glucosio
nella circolazione sistemica:
• la trasformazione in glucosio del fruttosio
o del galattosio da parte degli epatociti;
• la trasformazione del glicogeno epatico in
glucosio (glicogenolisi);
• la sintesi di glucosio nel fegato a partire
da sorgenti diverse (gliconeogenesi) come
aminoacidi, glicerolo, acido lattico, ecc.
Schema del metabolismo del glucosio
Ossidazione
Energia
Apporto
nutrizionale
GLUCOSIO
Deposito/
Interconversione
Glicogeno
Amminoacidi
Acidi grassi
Cervello
Cuore
Muscoli
Eritrociti
Eccetera
OMEOSTASI DELLA GLICEMIA
La concentrazione del glucosio nel sangue (glicemia)
viene mantenuta entro limiti abbastanza ristretti.
Il meccanismo omeostatico è mediato da diversi
ormoni; tra questi l’insulina tende ad abbassare la
concentrazione del glucosio ematico, mentre altri
ormoni tendono ad aumentarla, come l’ormone della
crescita GH e il glucacone (in condizioni normali), e
i glicocorticoidi e l’adrenalina (nel digiuno
protratto e nello stress).
I meccanismi attraverso cui questi ormoni sono in
grado
di
controllare
la
glicemia
possono
coinvolgere varie vie metaboliche (glicogenosintesi,
glicogenolisi, neoglucogenesi, utilizzazione alternativa
di altre fonti energetiche). L’effetto degli ormoni sulla
omeostasi glicemica non dipende solo dalla loro
concentrazione assoluta, ma soprattutto dai rapporti
di concentrazione (bilanciamento) con gli ormoni che
esercitano un effetto opposto (ormoni antagonisti).
Quando il digiuno si protrae oltre le 4 ore, il tasso
insulinemico diminuisce notevolmente e diventano
allora preminenti gli effetti degli ormoni antagonisti
che stimolano la produzione di glucosio da parte
del fegato attivando la glicogenolisi e la glucogenesi.
Nella situazione di digiuno protratto, il 60% circa del
glucosio prodotto dal fegato serve al metabolismo
cerebrale, mentre il rimanente viene utilizzato dagli
eritrociti e dai muscoli.
L’altro effetto degli ormoni antagonisti, glucocorticoidi
e GH, è rappresentato dallo stimolo della lipolisi, con
aumento in circolo degli FFA che vengono utilizzati a
scopo energetico soprattutto dal tessuto muscolare,
con risparmio di glucosio;
si ha però un aumento nella concentrazione di acetilCoA che, trovandosi in eccesso, tende a dar luogo alla
formazione dei corpi chetonici.
Se poi la glicemia si abbassa a valori
inferiori al normale (ipoglicemia), entra in
funzione un meccanismo di emergenza
addizionale, costituito dalla secrezione di
adrenalina, che attiva ulteriormente la
glicogenolisi e stimola la produzione di
ACTH, con successivo aumento degli
ormoni corticosteroidi e attivazione della
gluconeogenesi.
In ultima analisi, una funzionalità corretta
e bilanciata delle isole del Langerans,
dell’adenoipofisi, della corteccia e della
midollare
del
surrene,
consente
di
mantenere l’omeostasi glicemica in modo
rapido e efficiente.
Ormoni che controllano la glicemia
Organo
Pancreas
Surrene
Ipofisi
Tiroide
Ormone
Azione
Effetto
su glicemia
Insulina
Ingresso glucosio (tranne fegato, cervello,
RBC)
glicolisi, glicogenosintesi epatica e sintesi
ac. grassi
Lipolisi e gluconeogenesi
Glucagone
glicogenolisi e gluconeogenesi epatiche
Lipolisi
Somatostatina
rilascio di insulina, glucagone e ormoni
ipofisari
(impedisce oversecrezione)
Adrenalina
Glicogenolisi muscolare e lipolisi
Cortisolo
Gluconeogenesi da aa.
Antagonista dell’insulina
ACTH
Rilascio di cortisolo e lipolisi
GH
Antagonista dell’insulina
Tiroxina
Glicogenolisi e gluconeogenesi epatica
Assorbimento intestinale di zuccheri
Modifica i processi di permeabilità della
membrana cellulare, favorendo l’ingresso del
glucosio nella cellula.
Modifica l’attività di alcuni enzimi cellulari,
favorendo l’utilizzazione e inibendo la
neosintesi di glucosio.
Di conseguenza, previene l’accumulo di
glucosio nel sangue, che invece si verifica in
carenza o per ridotta funzionalità dell’insulina.
Processo
Trasporto glucosio
Glicolisi
Glicogenosintesi
Lipogenesi
Protidosintesi
Gluconeogenesi
Lipolisi
Azione
Tessuto(i)
+
+
+
+
+
-
Muscolare/Adiposo
Muscolare/Adiposo/
Epatico
Muscolare/Epatico
Adiposo/Epatico
Muscolare/Epatico
Epatico
Adiposo
Principali cause di iper- (>120 mg%) e ipo-glicemia (<50
mg%)
Iperglicemia
Ipoglicemia
Transitoria Stress emotivo/fisico acuto
Shock
Infarto miocardio
Convulsioni
Epatopatia grave
Feocromocitoma
Farmaci (salicilati, b bloccanti)
Alcolismo
Sepsi
Epatopatia grave
Glicogenosi
Persistente
Insulinoma
Glicogenosi tipo I
Diabete mellito
Sindrome di Cushing
(iperattività surrene)
Acromegalia (ipersecrez.
GH)
Ipertiroidismo
Obesità
Un gruppo eterogeneo di malattie caratterizzate da un
metabolismo anormale dei CARBOIDRATI, causato
da un DEFICIT DI INSULINA assoluto (tipo 1) o
relativo (tipo 2), che provoca IPERGLICEMIA.
Diabete mellito (classificazione eziologica)
I.
Diabete di tipo 1 (caratterizzato da distruzione delle b-cellule,
solitamente comportante un deficit assoluto di insulina)
A. Immuno-mediato
B. Idiopatico (LADA)
II.
Diabete di tipo 2 (può variare da predominantemente insulinoresistente e relativamente insulino-deficente, a predominantemente
insulino-deficente e relativamente poco insulino-resistente)
III.
Altri tipi specifici
A. Difetti genetici della funzionalità b-cellulare
B. Difetti genetici dell’azione insulinica
C. Malattie del pancreas esocrino
D. Endocrinopatie
E. Malattie indotte da farmaci o sostanze chimiche
F. Infezioni
G. Rare forme di diabete immuno-mediato
H. Altre sindromi genetiche a volte associate al diabete
IV. Diabete mellito gestazionale
Diagnosi
glicemia a digiuno/occasionale
glicemia da carico
Sorveglianza (del compenso metabolico)
glicemia
proteine (emoglobina) glicate
Complicanze
Microangiopatia: (micro)albuminuria
Aterosclerosi: lipidi e lipoproteine
Chetoacidosi: chetonuria, emogasanalisi
La diagnosi si pone se:
Coesistono sintomi clinici (poliuria, polidipsia) ed un
valore glicemico “casuale” (ossia non
necessariamente a digiuno o dopo carico) >200
mg/dL
oppure se:
La glicemia a digiuno risulta >126 mg/dL (in due
diverse determinazioni)
oppure se:
La glicemia a 2 ore da un carico orale di 75g di
glucosio risulta >200 mg/dL
Principio: in un ambiente contenente
glucosio, questo si lega stabilmente alle
proteine, che risultano “glicate”.
L’entità della glicazione è proporzionale
all’integrale della concentrazione di glucosio
per il tempo di contatto
La glicazione è un processo lento: l’entità è
limitata dalla vita media della proteina
L’emoglobina glicosilata rappresenta il prodotto di una
reazione non enzimatica tra una molecola di glucosio e il
gruppo amino-terminale della valina della catena b
dell’emoglobina. Ciò avviene in due fasi: la prima
reversibile, che conduce alla formazione di una base di
Schiff (aldimina), e una seconda irreversibile con la
formazione di un prodotto di Amadori, la chetoamina. La
formazione di HbA1c avviene durante tutto il periodo di vita
del globulo rosso e dipende anche dall’età cellulare. Un
incremento transitorio della glicemia può produrre la
formazione di una notevole quantità di aldimine, reazione
comunque reversibile con la normalizzazione dei valori
glicemici. La persistenza di iperglicemia, tuttavia, rende tale
reazione irreversibile, per cui la molecola di emoglobina
resterà “glicata” sino alla morte del globulo rosso.
La relazione tra valore glicemico medio e percentuale di Hbglic è stata dimostrata. Generalmente, ogni aumento di 1%
dell’Hb-glic corrisponde ad un aumento della glicemia pari a
35 mg/dl di glucosio plasmatico medio.
Hb glicata: reazione di glicazione
reversibile
irreversibile
veloce
lenta
HbA1c
labile
HbA1c
stabile
Reazione non enzimatica di condensazione tra il gruppo aldeidico del
glucosio e il gruppo amminico N-terminale delle catene b della Hb.
Formazione della Hb glicata
• Processo non enzimatico, si realizza durante
tutta la vita degli eritrociti, irreversibile.
• La formazione della Hb glicata dipende principalmente
dalla concentrazione di glucosio e la sua eliminazione
avviene con la degradazione degli RBC.
• Vita media degli eritrociti circa 120 giorni.
• La quantità di Hb glicata è proporzionale alla glicemia
media delle 6-12 settimane precedenti.
Hb glicata: significato clinico
• Parametro di elezione per la valutazione
retrospettiva del grado di controllo glicemico
nei soggetti diabetici: è stabile e non risente
di improvvise variazioni della concentrazione
glicemica.
• Importante nel monitoraggio dei pazienti
diabetici sia di tipo 1 che 2.
• Utile per valutare l’efficacia della terapia e
per predire lo sviluppo delle complicanze.
Glicemia (mg/dL)
glicoHb (%)
65
4,0
101
5,0
137
6,0
172
7,0
208
8,0
244
9,0
279
10,0
315
11,0
350
12,0
In un dato momento, l’entità della glicazione
misurabile è una misura retrospettiva dell’integrale
“concentrazione di glucosio su tempo”, per un
intervallo di tempo dipendente dalla vita media della
proteina
Per le proteine più utilizzate l’intervallo di tempo è
dell’ordine di:
emoglobina del sangue 6-12 settimane;
proteine (albumina) del siero 3-5 settimane
La glicazione della emoglobina viene stimata
misurando la percentuale glicata ed espressa
come come percentuale della Hb totale
(%Hb)
La glicazione delle sieroproteine (albumina)
viene misurata come “fruttosammina” ed
espressa in mmol/L
Emoglobina glicata:
Limiti di riferimento: 4-6%
Limite decisionale (obiettivo terapia): <7%
Limite decisionale per rivalutazione terapia: >8%
Albumina glicata (come fruttosammina)
Limiti di riferimento: 204-285 mmol/L
Metodo cinetico-colorimetrico per la determinazione
delle fruttosamine
Principio
Le fruttosamine del siero in ambiente alcalino sono
presenti sotto forma idrossilaminica.
Il gruppo idrossilaminico riduce il nitroblutetrazolio
(NBT) rendendo evidente la produzione di
formavano.
La reazione che si sviluppa è direttamente
proporzionale alla concentrazione delle fruttosamine
nel siero
La misura della Hb glicata è maggiormente
standardizzata analiticamente e validata
clinicamente: è largamente usata in tutto il mondo
Si può utilizzare in sostituzione la fruttosammina
quando:
E’ necessaria una informazione relativa ad un periodo
precedente più breve (per es. valutazione degli effetti di
variazione terapeutica)
Esistono ragioni biologiche (es. anemia emolitica) od
analitiche (es. presenza di varianti emoglobiniche) che
rendono inaffidabile la misura della Hb glicata
Il controllo glicemico può essere valutato anche con la
determinazione di altre proteine soggette a glicosilazione
(chetoamine) quali la fruttosamina (test della fruttosamina).
È stata dimostrata una buona correlazione tra il test della
fruttosamina e dell’HbA1c, ma è necessario tenere in
considerazione
che:
1) le variazioni biologiche soggettive della fruttosamina sono
maggiori
rispetto
all’HbA1c;
2) il turnover dell’albumina rispetto all’emoglobina è più breve
(circa 28 gg. vs 120 gg. rispettivamente) e per cui il test delle
fruttosamina fornisce indicazioni sul controllo glicemico delle
ultime 2 settimane;
3) il risultato deve essere corretto in base alla concentrazione
ematica
di
albumina;
4) valori falsamente bassi possono essere riscontrati in
condizioni di aumentato turnover proteico, quali le enteropatie
proteino-disperdenti e la sindrome nefrosica;