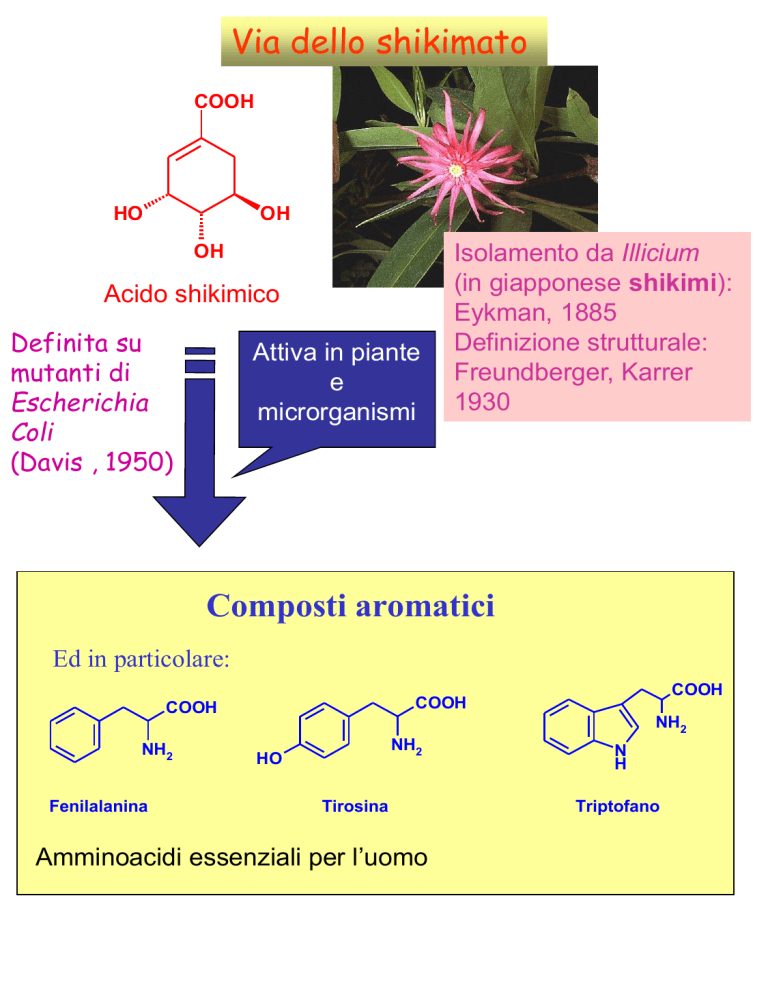
Via dello shikimato
COOH
HO
OH
OH
Acido shikimico
Definita su
mutanti di
Escherichia
Coli
(Davis , 1950)
Attiva in piante
e
microrganismi
Isolamento da Illicium
(in giapponese shikimi):
Eykman, 1885
Definizione strutturale:
Freundberger, Karrer
1930
Composti aromatici
Ed in particolare:
COOH
NH2
Fenilalanina
COOH
COOH
NH2
NH2
HO
Tirosina
Amminoacidi essenziali per l’uomo
N
H
Triptofano
La via biogenetica
ciclo del
pentoso fosfato
GLUCOSIO
glicolisi
CHO
CO2H
OH
H2C
C
OH
OP
Fosfoenolpiruvato (PEP)
CH2OP
D-eritrosio-4-fosfato
COOH
HO
OH
OH
Acido Shikimico
COOH
HO
O
OH
CH2
C
COOH
Acido Corismico
HOOC
Acido Protocatechico; Acido Salicilico
Acido Gallico
Acido p-Idrossibenzoico;
Acido p-Amminobenzoico;
Acido Antranilico
Triptofano
CH2COOH
OH
Acido Prefenico
Fenilalanina;
Tirosina
Biosintesi dell’acido shikimico
CO2H
P
O
PO
PO
H
OH
H+ O
NAD+
HO
OH
CO2H
CO2H
O
OH
O
OH
OH
OH
Acido shikimico
OH
Acido
3-deidroshikimico
-H2O
Acido
3-deidrochinico
-H2
CO2H
HO
HO
CO2H
CO2H
-H2O
NADPH
OH
HO
OH
OH
OH
Acido D-Arabino-eptulosonico-7-P
D-Eritrosio-4-P
HO
-HOP
O
H
HO
O
HO
CO2H
CO2H
PEP
CO2H
HO
OH
Acido protocatechico
OH
OH
Acido gallico
HO
OH
OH
Acido chinico
Dall’acido shikimico all’acido corismico
CO2H
EPSP :acido 5-enolpiruvil
shikimico 3-fosfato
CO2H
CO2H
P
O
PEP
ATP
CO2H
H+
H2
C
EPSP sintasi
OH
HO
OH
PO
OH
PO
OH
Acido Shikimico
CO2H
OP
OH
Acido Shikimico-3P
H
O
-HOP
Dal greco
cwrizw
dividere
CO2H
CO2H
H
-HOP
O
CO2H
PO
OH
Acido Corismico
CO2H
OH
Acido 5-enolpiruvil
shikimico-3-fosfato
C
A
O
B
CO2H
CO2H
HO2C
CH2COCO2H
CO2H
OH
OH
OH
Acido protocatechico
CO2H
NH2
OH
HO
Acido p-idrossibenzoico
OH
Acido Prefenico
NH2
Acido p-amminobenzoico
NH2
CO2H
CO2H
CO2H
CO2H
NH2
OH
Acido antranilico
Acido salicilico
OH
Acido gallico
Fenilalanina
OH
Tirosina
La via biosintetica C: acidi o/p idrossi-, amminobenzoici.
CO2H
CO2H
CO2H
CO2H
OH2
OH
OH
-PEP
-PEP
O
O
OH
H+
Acido
4-Idrossibenzoico
CO2H
OH
Acido Corismico
NH3
Acido Isocorismico
CO2H
NH2
CO2H
O
-PEP
CO2H
CO2H
Acido 2-ammino2-deossiisocorismico
-PEP
CO2H
NH2
NH2
Acido p-Amminobenzoico
(PABA)
Acido Folico
Acido Antralinico
Triptofano
CO2H
OH
NH2
Acido 4-ammino4-deossicorismico
Acido Salicilico
NH3
CO2H
O
CO2H
CO2H
OH
NAD+
OH
OH
Acido
2,3 diidrossibenzoico
Biosintesi del triptofano
CO2H
CO2H
CO2H OH
OH
H
NH
NH2
HO
O OH
H+
Acido fosforibosil
antranilico
CH2OP
PPO
HO
O OH
fosforibosil PP
H
O
OH
+
N
H
CH2OP
Acido antranilico
OP
O
OH
OH
CO2H
HO
O
OP
OP
OH
OH
N
H
N
H
-CO2
OP
HO
OP
HO
-H2O
HO
OH
OH
N
H
N
H
indol-3-glicerolo P
CO2H
HO
OP
O
NH2
L-Ser
OH
H
gliceraldeide-3-P
CO2H
NH2
N
H
L-Trp
Metabolismo del triptofano
CH2COOH
NH2
HO
N
H
N
H
Acido Indolacetico (auxina)
Serotonina
NH2
N
H
Triptammina
NH2
COOH
Alcaloidi
N
H
Triptofano
NH2
COOH
O
NHCH=O
N-Formilchinurenina
NH2
COOH
O
NH2
Chinurenina
Metabolismo ossidativo della chinurenina:
Gli ommocromi i pigmenti degli occhi degli artropodi
NH2
NH2
COOH
COOH
O
O
O
NH2
NH2
OH
3-Idrossichinurenina
Chinurenina
O
H2N
COOH
O
H2N
HO
COOH
COOH
O
HO
COOH
N
N
H
N
N
O
O
O
O-G
Xanthommatina
Rhodommatina
Butenadt, A., Beckmann, R.
Ommochromes. VI. Genesis of rhodommatin and ommatin C.
Hoppe Seylers Z Physiol Chem. 1955, 301, 115-117
La via biosintetica A: l’acido gallico ed i tannini
OH
OH
O
O
COOH
HO
HO
OH
O
HO
Acido Gallico
O
OH
Acido Ellagico
I tannini sono in grado di legarsi
stabilmente alle proteine (es.
cheratina) ed anche ad altri
biopolimeri come cellulosa e
pectina fungendo da cross linkers
e modificandone quindi le
proprietà meccaniche e chimiche.
In passato i tannini erano
impiegati per la concia delle pelli.
ROCH2
O OR
RO
OR
O
C=O
OH
HO
OOC
OH
OH
OH
OH
OOC
Gallotannino
OH
I tannini si suddividono in:
Tannini non idrolizzabili: la cui struttura è ancora poco nota;
Tannini idrolizzabili: esteri dell’acido gallico, di acidi poligallici e di
altri dimeri derivanti dall’acido gallico (es acido ellagico) con il
glucosio.
Metabolismo ossidativo del pirogallolo:
la PURPUROGALLINA
HO
HO
-2H+, -2e-
HO
O
OH
O
HO
O
O
Pirogallolo
H2O
HO
HO
O
O
O
O
O-
O
O
O HO
O
COOH
HO
-2H+, -2e-
HO
HO
-CO2
HO
OH
OH
OH
OH
O
OH
Purpurogallina
La via biosintetica B: dall’acido corismico a Phe
e Tyr via acido prefenico.
COOH
HOOC
CH2
O
OH
CH2COCOOH
Trasposizione di Claisen
COOH
Corismato mutasi
OH
H+
Acido Prefenico
Acido Corismico
-H2O
-CO2
O
O
a
HOOC
CH2COCOOH
COOH
O
Acido Fenilpiruvico
Transaminazione
PLP
-CO2
O
COOH
NH2
COOH
Fenilalanina
OH
Acido p-Idrossifenilpiruvico
Transaminazione
PLP
NH2
COOH
OH
Tirosina
Metabolismo Phe e Tyr in piante e microorganismi
COOH
COOH
PAL
PAL (TAL): Phenylalanine (Tyrosine)
Ammonia Lyase
Acido Cinnammico
-NH3
NH2
Fenilalanina
Citocromo P450
O2, NADPH
COOH
NH2
HO
COOH
TAL
-NH3
(solo graminacee)
Tirosina
O
HO
CH2OH
HO
Alcol p-Cumarilico
Acido p-Cumarico
O
COOH
HO
HO
Acido Caffeico
SAM
CH3
COOH
CH3O
HO
HO
Alcol Coniferilico
Acido Ferulico
SAM
CH2OH
CH3O
O
CH3
COOH
CH3O
HO
CH2OH
CH3O
HO
OMe
Acido Sinapico
OMe
Alcol Sinapilico
Metabolismo acidi cinnamici
Precursori e metaboliti delle lignine
O
CH3O
CH2OH
HO
CH2OH
OH
CH3O
OMe
O
HO
OMe
OH
Isolariciresinolo
Antimitotico,
antitumorale
Pinoresinolo
OH
H
O
O
HO
O
O
O
H
MeO
O
OMe
OH
OMe
Podofillotossina
Enterolattone
Nelle radici
del podofillo
Un fitoestrogeno prodotto
dalla microflora intestinale.
Protegge da tumori indotti da
ormoni e da malattie
cardiovascolari
Biosintesi di lignani e lignine
OH
OH
OH
.
-H+
-e-
MeO
MeO
OH
x2
MeO
.O
O
x2
Alcol Coniferilico
O
OMe
CH3O
CH2OH
O
CH2OH
CH3O
O
OH
HO
OMe
CH3O
CH2OH
HO
CH2OH
O
OMe
OH
O
OMe
H
O
O
CH3O
CH2OH
HO
CH2OH
H
OMe
OMe
OH
OH
(+)-Pinoresinolo
(+) -Isolariciresinolo
Metabolismo acidi cinnamici
Le cumarine
COOH
COOH
O
HO
Acido Cinnammico
Acido p-Cumarico
O
O
COOH
COOH
HO
OH
OH
Acido o-Cumarico
Glucosilazione
Glucosilazione
COOH
COOH
HO
OG
Isomerizzazione
cis-trans
COOH
OG
Isomerizzazione
cis-trans
HO
Idrolisi
5
OG
COOH
OG
Idrolisi
4
6
3
2
7
8
O
1
HO
O
O
O
Umbelliferone
Cumarina
Sbiancanti ottici
in detergenti,
tessuti, carta,
plastica, pitture
Filtro
solare
O
HO
HO
O
Esculetina
O
Il dicumarolo: un potente anticoagulante
Causa di emorragie mortali
in animali alimentati con
Melitotus officinalis
OH
OH
O
O O
O
Dicumarolo
Meccanismo di formazione del dicumarolo
Unità "C1" da processi di fermentazione
H+
O
OH
H
O
OH
OH
O
O
H
O
-H2O
4-idrossicumarina
H+
O
OH
O
O
O
OH
OH
O
O
O O
O
Oggi usato come anticoagulante del sangue per il
trattamento delle trombosi.
Analoghi sintetici come la
warfarina usati come rodenticidi.
OH
O
O
Gli psoraleni
1. La biosintesi
OPP
+
DMAPP
..
HO
O
O
O
HO
umbelliferone
O
demetilsuberosina
O2
NADPH
HO
O2
NADPH
HO
HO
O
O
O
O
O
O
marmesina
-CH3COCH3
O2
NADPH
O
O
O
O
O
OH
psoralene
O2
NADPH
xantossolo
SAM
OH
O
O
O
bergaptolo
O
O
O
OMe
SAM
xantossina
(8-metossipsoralene)
OMe
O
O
O
O
bergaptene
(5-metossipsoralene)
Gli psoraleni
2. Le proprietà biologiche
Si intercalano al DNA formando addotti
O
O
HN
O
O
O
N
O
h
O
HN
OMe cicloaddizione
fotoindotta
O
O
N
O
OMe
8-MOP
addotto psoralene-DNA
O
H
h
N
N
O
Timina nel DNA
La duplicazione del DNA è
inibita, la velocità della
divisione cellulare è ridotta
O
O
O
HN
O
Effetti tossici nella
manipolazione di piante
N
O
OMe
di-addotto psoralene-DNA
ricche di psoraleni
Ruta graveolens
Heracleum mantegazzianum
(pacace gigante)
Gli psoraleni
3. Le proprietà farmacologiche e cosmetiche
Promuovono la pigmentazione cutanea e
l’abbronzatura. L’olio di bergamotto è
usato come abbronzante.
Utilizzati anche per il trattamento della
vitiligine e psoriasi
Terapia PUVA : somministrazione
orale 8-metossipsoralene seguita da
irradiazione con luce UV-A









