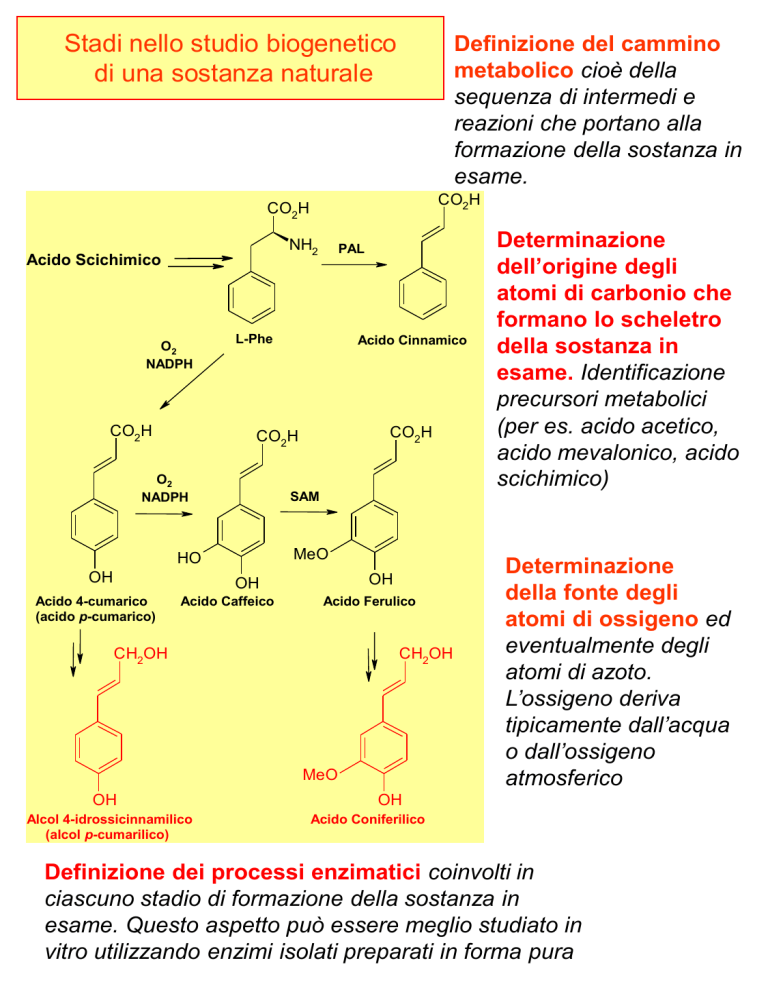
Stadi nello studio biogenetico
di una sostanza naturale
Definizione del cammino
metabolico cioè della
sequenza di intermedi e
reazioni che portano alla
formazione della sostanza in
esame.
CO2H
CO2H
NH2
Acido Scichimico
O2
NADPH
CO2H
PAL
L-Phe
Acido Cinnamico
CO2H
CO2H
O2
NADPH
SAM
MeO
HO
OH
OH
OH
Acido 4-cumarico
(acido p-cumarico)
Acido Caffeico
Acido Ferulico
CH2OH
CH2OH
MeO
OH
Alcol 4-idrossicinnamilico
(alcol p-cumarilico)
Determinazione
dell’origine degli
atomi di carbonio che
formano lo scheletro
della sostanza in
esame. Identificazione
precursori metabolici
(per es. acido acetico,
acido mevalonico, acido
scichimico)
Determinazione
della fonte degli
atomi di ossigeno ed
eventualmente degli
atomi di azoto.
L’ossigeno deriva
tipicamente dall’acqua
o dall’ossigeno
atmosferico
OH
Acido Coniferilico
Definizione dei processi enzimatici coinvolti in
ciascuno stadio di formazione della sostanza in
esame. Questo aspetto può essere meglio studiato in
vitro utilizzando enzimi isolati preparati in forma pura
PRINCIPALI APPROCCI USATI
NELLO STUDIO DELLA BIOSINTESI
1.
RIFLESSIONE E SPECULAZIONE SULLA
STRUTTURA CHIMICA
2.
ANALISI SEQUENZIALE
3.
METODI CHE IMPIEGANO MUTANTI
4.
USO DI INIBITORI SPECIFICI DI ALCUNI PROCESSI
ENZIMATICI
5.
METODI CHE IMPIEGANO TRACCIANTI ISOTOPICI
A: isotopi radioattivi
B: isotopi stabili
Possiamo
distinguere tra:
Metodi che provocano forti alterazioni sul sistema in
esame
Inibizione enzimatica
Uso di mutanti
Metodi di osservazione diretta con minima interferenza
Analisi sequenziale
Incorporazione di precursori marcati isotopicamente.
1
RIFLESSIONE E SPECULAZIONE SULLA
STRUTTURA CHIMICA
C12
OH
O
O
O
O
Plumbagina
OH
7-Metiljuglone
COOH
OH
OH
O
[H]
O
O
O
O
OH
O
6 x C2
O
AcetilCoA
ANALISI SEQUENZIALE
2
Valutazione del contenuto di determinati metaboliti di un
organismo in vari momenti del suo sviluppo.(es. se B si
accumula nel tempo mentre A scompare, probabilmente A è
precursore di B)
N
N
H
1
2
-Coniceine
Coniine
Variazione del
contenuto di alcaloidi
nei frutti della cicuta
(Conium maculatum)
100
50
2
4
Settimane
6
Il successo di questa tecnica dipende da:
•
LENTA CRESCITA DELL’ORGANISMO
•
LENTO METABOLISMO
•
METODO EFFICACE DI ANALISI QUANTITATIVA
DEI METABOLITI
3
METODI CHE IMPIEGANO MUTANTI AUXOTROFI
1) è impiegato nello studio della biosintesi su microrganismi
2)
il metodo consiste nel modificare il carattere genico
dell’organismo da studiare per mezzo di mutageni (es.
luce ultravioletta). Si isola quindi il microrganismo che
manca di un enzima implicato in un certo processo
biosintetico.
3)
se la via biosintetica è:
A
B
C
D
X
Y
e la cellula manca dell’enzima che trasforma C in D si
avranno i seguenti effetti:
A)
La cellula auxotrofa non è in grado di crescere sul
terreno di cultura su cui cresceva la cellula originaria
(cellula vegetativa);
B)
Se si fornisce D o X al terreno di cultura la cellula
continua a crescere e si avrà accumulo di C, se C è un
intermedio obbligatorio nella biosintesi di X
3
METODI CHE IMPIEGANO MUTANTI AUXOTROFI
Esempio: Biosintesi ommocromi in drosofila
TRIPTOFANO X Y OMMOCROMI
Un mutante privo dell’enzima che regola la conversione X Y
presenta accumulo di X identificato come chinurenina.
Un altro mutante presenta accumulo di triptofano: per
somministrazione di chinurenina si ha biosintesi di ommocromi.
INIBIZIONE ENZIMATICA
4
Consiste nell’uso di un inibitore di un enzima del processo
biosintetico.
Possono essere anche usati agenti chimici che bloccano
selettivamente un enzima trasformandone selettivamente
alcuni residui.
Enzima-SH + I-CH2COO-
Enzima-S- CH2COO- + HI
(Gliceraldeide-3-fosfato deidrogenasi) (enzima carbossimetilato; inattivo)
O
CH
HC
H2C
gliceraldeide-3-fosfato
deidrogenasi
O
OH + HO
P
OP
O-
gliceraldeide-3-fosfato
O
OP
+
O + NAD
HC
OH
H2C
OP
+ NADH + H+
E’ possibile anche:
Somministrazione contemporanea di un inibitore
enzimatico e un precursore marcato.
Esempio: dopo somministrazione a piante di tabacco di
acido mevalonico marcato e un inibitore, si osserva
accumulo di 2,3-epossisqualene radioattivo.
Ac. Mevalonico 2,3-epossisqualene Steroli
In assenza di inibitore si isolano steroli marcati .
5
METODI CHE IMPIEGANO TRACCIANTI ISOTOPICI
1. Viene immesso nel pool metabolico un metabolita marcato
ovvero un composto in cui uno o più atomi sono stati
sostituiti con i corrispondenti isotopi stabili o radioattivi.
2. Si assume che enzimi e membrane cellulari non riescano a
distinguere tra molecole che differiscono soltanto per la
sostituzione isotopica.
3. Seguendo la “traccia” è possibile isolare i prodotti di
biotrasformazione del metabolita, se gli atomi marcati non
sono stati perduti.
METODI CHE IMPIEGANO TRACCIANTI ISOTOPICI
A: isotopi radioattivi
Traccianti isotopici radioattivi più comunemente usati.
3H
b emittente t 1/2 12,35 anni
emax 0.0185 mev
29,2 Ci/mg atomo
14C
b emittente t ½ 5730 anni
Emax 0,156 Mev
62,4 mCi/mg atomo
b emittente t ½ 14,45 giorni
Emax 1,7 Mev
12
( 1 Ci = 2,22 x 10 disintegrazioni per minuto (dpm)
32P
Metodo di rivelazione: scintillazione in fase liquida
dpm= cpm /z
riferimento)
z = efficienza dello strumento per un
particolare isotopo (0.5-0.9) (si determina
mediante conta di campioni di
dpm= disintegration per minute
cpm= counts per minute
E’ possibile distinguere tra due radionuclidi (per es. 3H e 14C) contando la
radioattività di ciascun nuclide su due diverse finestre di energia (canali) dello
scintillatore.
COMPOSTI MARCATI CON RADIOISOTOPI
Un composto marcato con un radioisotopo (in particolare 3H
e 14C) può essere:
1.
Generalmente marcato (G): quando la distribuzione
media del radioisotopo nelle varie posizioni della
molecola è irregolare. Per es. D,L-[G-3H]fenilalanina i
protoni su ciascuna posizione sono parzialmente
sostituiti da atomi di trizio in maniera casuale. Questo
tipo di marcatura è statistica e le molecole marcate
differiscono nel numero e nelle posizioni dei radioisotopi.
2.
Uniformemente marcato (U): quando la distribuzione
media del radioisotopo è circa la stessa in tutte le
possibili posizioni della molecola. Per es. se isoliamo
come CO2 gli atomi di carbonio delle varie posizioni della
L-[U-14C]fenilalanina, la stessa abbondanza di 14C verrà
trovata in ciascun campione di CO2
3.
Specificamente marcato: quando i radioisotopi sono
localizzati in alcune, ben definite posizioni con ben
definite abbondanze relative (% dell’abbondanza totale
specifica in 3H o 14C). La marcatura specifica può essere
singola, doppia o multipla asseconda del numero di
posizioni marcate. Per es. D,L-[1-14C]fenilalanina in cui
tutta la radioattività del 14C è concentrata sul gruppo
carbossilico (C-1).
Alcune regole da seguire in un esperimento con
precursori marcati con radioisotopi.
1.
II precursore marcato deve essere somministrato alla
più alta radioattività specifica e purezza chimica
possibile e alla più bassa concentrazione possibile.
2.
I prodotti isolati devono essere purificati rigorosamente
preferibilmente per ricristallizzazione a radioattività
specifica costante.
3.
La posizione dell’atomo marcato ( o degli atomi
marcati) nel prodotto deve essere localizzata a mezzo
di degradazioni chimiche specifiche. Bisogna inoltre
verificare l’assenza di “randomizzazione”.
BIOSINTESI GRISEOFULVINA
.
.
CH3 COOH
14
C= C
CH3O O
O
non radioattivo
O
CH3O
Cl
OH
CH3O
OH
COOH
OH
CH3O
H3C
Cl
OH
HNO3
OMe
OH
CH3O
NO2
O2N
CO2
(CH3)2CO + Li2CO3
Ba(OH)2
Cl
OH
H3C
NO2
HCl
BaCO3
NO2 BaCO3 + CBr3 NO2
O2N
HNO3
OH
CHl3 + BaCO3
Ba(OBr)2
OH
OH
HO
CO3/H2SO4
CH3COOH
OH
+
(Kahn-Roth)
(non radioattivo)
OH
HO
NO2
Ba(OBr)2
BaCl3 + CBr3 NO2
(non radioattivo)
BaCO3
(non radioattivo)
DOPPIA MARCATURA
1.
Durante esperimenti di incorporazione quando si
desidera seguire il destino di particolari atomi di idrogeno
si ricorre spesso a precursori marcati sia 3H che con
14C.
2.
Se si parte da un composto con un certo rapporto 3H/14C
il valore di questo rapporto nei metaboliti finali dà
informazioni sulla perdita o il trasferimento di atomi di
idrogeno. Rimane valido il principio che la marcatura
deve essere localizzata con metodiche degradative
appropriate.
3.
Generalmente il precursore da somministrare è una
miscela di molecole marcate solo con 3H e di molecole
marcate solo con 14C.
4.
La marcatura intramolecolare (3H e 14C nella stessa
molecola) è difficile da realizzare e può essere usata solo
quale precauzione rispetto a possibili discriminazioni
biologiche fra composti aventi la stessa struttura e
soltanto differenze isotopiche (EFFETTO ISOTOPICO)
DOPPIA MARCATURA
w = 3H/14C
x = 3H/14C
w = precursore
x= prodotto
w > x
T
COO
T
T
T
+
NH3
Ephedra distachya
(-C2N)
T
14C
+C2N) T
T
D,L-fenilalanina
T
n
+
NH3
Efedrina
Nessun 14C
COOH
CH2OH
Iosciamina
T
14C
D,L-fenilalanina
3H:14C 6.5 :1
COO
T
~~
COO
Datura metel
NH3
+
T
T
T
T
T
w ~ x
OH
T
T
Acido Tropico
3H:14C 6.9 :1
EFFETTO ISOTOPICO
1.
PRIMARIO: VARIAZIONE DELLA VELOCITÀ DI
REAZIONE DOVUTA ALLA ROTTURA O ALLA
FORMAZIONE DI LEGAMI CON DIFFERENTI ISOTOPI,
ES. ROTTURA DEL LEGAME C-T INVECE DEL LEGAME
C-H
2.
SECONDARIO: EFFETTI CINETICI DOVUTI ALLA
SOSTITUZIONE ISOTOPICA SU ATOMI VICINI
COINVOLTI IN UNA REAZIONE CHIMICA. È UN
EFFETTO QUANTITATIVAMENTE MOLTO PIÙ PICCOLO
DEL PRIMARIO
3.
UN ENZIMA PUÒ MOSTRARE DIVERSA AFFINITÀ PER
SUBSTRATI CON SOSTITUZIONE ISOTOPICA. EFFETTI
ISOTOPICI CINETICI (SPECIALMENTE PRIMARI)
VENGONO OSSERVATI QUANDO UN SUBSTRATO
REAGISCE NEL SITO ATTIVO DELL’ENZIMA.
Esempio:
O
OH
H
alcol deidrogenasi
H
k1
H
O
OH
D
D
alcol deidrogenasi
k2
k1/k2=1.8
H
5
METODI CHE IMPIEGANO ISOTOPI STABILI
B. Isotopi stabili
1. Si effettuano esperimenti di incorporazione con precursori marcati
con isotopi stabili (13C, D, 15N) e si analizza il destino della
marcatura nei prodotti mediante NMR o spettrometria di massa.
2. A causa della scarsa sensibilità delle tecniche di rivelazione, si
deve avere un arricchimento isotopico non inferiore all’1%.
3. Il vantaggio di questa tecnica consiste:
a)nell’assenza di pericoli dovuti alla radioattività.
b) nell’assenza di contaminazione da parte di prodotti estranei al
pathway metabolico presenti anche in piccole quantità;
c) nella possibilità di localizzare la marcatura mediante analisi
spettroscopica (NMR) o spettrale (massa) senza dover far uso
metodi degradativi.
METODI DI SOMMINISTRAZIONE DEI
SUBSTRATI AD ORGANISMI VIVENTI
1.
Somministrazione attraverso l’alimentazione: per
animali, per es. insetti.
2.
Iniezione: intravenosa, intraperitoneale, intramuscolare.
3.
Perfusione: un organo è mantenuto in condizioni di
normale attività metabolica con un opportuno liquido
circolante.
4.
Diffusione: Il substrato è disciolto o sospeso in mezzo
acquoso in cui si trovano piccole parti di un organo o
cellule.
5.
Metodo dello stoppino d’ovatta: Inserito nel tronco o
stelo di un vegetale. Basato sull’azione capillare
dell’ovatta.
6.
Metodo del taglio dello stelo: Lo stelo tagliuzzato alla
base è immerso in soluzione acquosa contenente il
precursore.
7.
Metodo della spazzola: Una sospensione del precursore
in olio di silicone è spazzolata sulle foglie delle piante.












