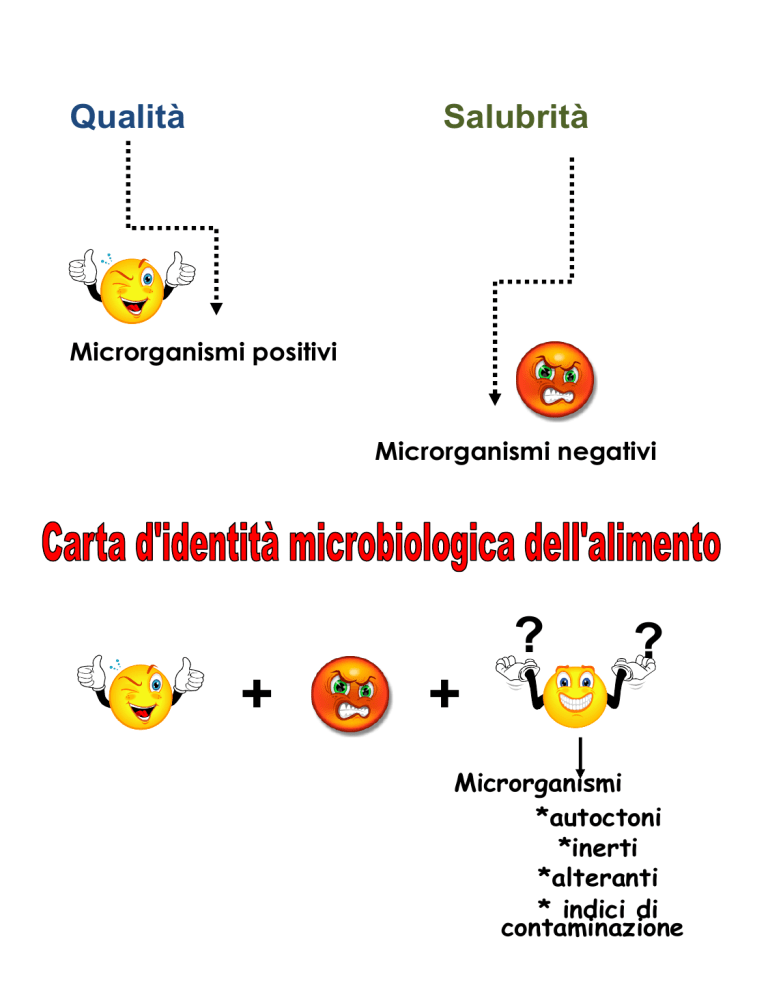
Qualità
Salubrità
Microrganismi positivi
Microrganismi negativi
?
+
?
+
Microrganismi
*autoctoni
*inerti
*alteranti
* indici di
contaminazione
Qualità
microrganismi positivi
Sono protagonisti del
processo produttivo
Contribuiscono alla
tipicità dell’alimento
BATTERI LATTICI: Lactobacillus helveticus, L.
bulgaricus, Lactococcus lactis, L. cremoris,
Streptococcus thermophilus
LIEVITI: Saccharomyces cerevisiae
MUFFE: Penicillium roqueforti, P. camemberti
Indicatori della qualità tecnologica
autoctoni
non dannosi, presenti
nelle materie prime,
dove non
contribuiscono
all’ottenimento e/o
conservazione del
prodotto finito
non dannosi ma in grado di
causare, se presenti in alto
numero, alterazioni
organolettiche, incidendo
sulla conservabilità del
prodotto
(Pseudomonadaceae,
micrococchi, lieviti, muffe)
indici di contaminazione
alteranti
non patogeni, ma ma con lo stesso
habitat e caratteristiche dei
patogeni
(più numerosi e più facilmente
rilevabili: stafilococchi, coliformi
fecali
Escherichia coli)
Salubrità
microrganismi negativi
patogeni
Salmonella spp.
Shigella spp.
Staphylococcus aureus
Listeria
monocytogenes
Bacillus cereus
Clostridium botyulinum
E. coli
enteropatogeno
Vibrio cholereae
Presenza
nell’alimento o
nell’organismo
(carica e
suscettibilità
dell’ospite)
Produzione di
tossine nell’alimento
o nell’organismo
(carica)
Identificazione dei microrganismi
Isolamento da matrici complesse
*Terreno complesso
*Terreno selettivo
*Terreno di arricchimento
*Condizioni colturali
Mantenimento in coltura coltura pura
Studio
*Conta totale
*Conta selettiva
*Riconoscimento
Analisi microbiologiche di matrici alimentari
Matrice liquida
Campionamento
Matrice solida
Prelievi in punti diversi
(superficie, interno, centro,
etc.)
Determinazione della
carica microbica
Diluizioni successive e piastramento in
terreno solido
1.
Scelta del metodo di conta
2.
Scelta e preparazione del
diluente
3.
Scelta e preparazione dei
terreni nutritivi
Impiego di terreni complessi per la carica
totale (sterilizzazione ¾ x 20):
PCA per conta batterica (30 °C, 3 gg,
aerobiosi/anaerobiosi)
YGC per conta di eumiceti (30 °C 3-7 gg,
aerobiosi)
Impiego di terreni selettivi per la ricerca di
gruppi microbici: ad esempio
MRS per conta lattobacilli (30 °C, 3 gg,
anaerobiosi)
M17 per conta cocchi lattici (30 °C, 3 gg,
anaerobiosi)
4.
Preparazione del campione
Prelievo di una aliquota da matrice
liquida: 1 ml (t.q.)
Soluzione fisiologica sterile : 9 g/l
NaCl; sterilizzazione 1/2x1/2
Prelievo di una aliquota da matrice solida: in
sacchetti sterili per Stomaker, determinazione
del peso, aggiunta di 10 vol. di diluente,
omogenizzazione, prelievo di aliquota: 1 ml
(10-1)
5.
Analisi
Diluizioni successive , piastramento per
inglobamento, incubazione, rilevazione
risultati, espressione della carica in UFC/gr
o ml)
Isolamento in coltura pura
Preservazione della coltura
pura
Prelievo dalle piastre di conta di colonie
rappresentative mediante ansa; risospensione di
ciascuna colonia selezionata in soluzione
fisiologica sterile; diluizioni e piastramento;
selezione di una colonia; determinazione delle
caratteristiche macromorfologiche; prelievo e
trasferimento in terreno di mantenimento (solido:
striscio su slant per aerobi, infissione per anaerobi)
Trapianto settimanale in terreno fresco per colture
che devono essere utilizzate ; conservazione delle
colture per lungo tempo mediante liofilizzazione o
preparazione di brodocolture glicerinate a – 20 °C
Coltura pura = ceppo microbico
IDENTIFICAZIONE A LIVELLO DI SPECIE
La specie batterica è l’unità tassonomica di base. E’ costituita
da un insieme di ceppi che possiedono:
Un FENOTIPO
simile
Un GENOTIPO
simile
Una storia FILOGENETICA
correlabile
Fenotipo simile = caratteristiche comuni alla specie + caratteristiche
secondarie legate all’adattamento dei singoli ceppi
Genotipo simile = 70 % omologia genetica >DNA/DNA
Storia filogenetica correlabile = omologia di sequenza del gene
codificante per l’rRNA 16 S > 97-98%
Criteri di identificazione tradizionale
Macromorfologia
Fenotipo
Micromorfologia
Reazione di Gram
Metabolismo energetico
Esigenze nutrizionali
Esigenze colturali
Pattern enzimatico
Caratteristiche
strutturali
Genotipo
Omologia
DNA/DNA
Criteri di identificazione innovativa
Impiego di tecniche di indagine
genetica, basate sulla possibilità di
amplificare in breve tempo, regioni
specifiche del cromosoma batterico
PCR (Polymerase chain
reaction)
Studi filogenetici e genetici
Appartenenza alla specie in tempi ridotti ed in
modo specifico, anche per un numero elevato di
isolati da identificare
Le caratteristiche fenotipiche vengono studiate in un secondo
tempo, solo sugli isolati di interesse, per permetterne il
riconoscimento a livello di biotipo
Il codice genetico
64 possibili triplette
Codone
AA
Codone
AA
UUU
Fenilalanina
ACU
Treonina
UUC
Fenilalanina
ACC
Treonina
UCU
Serina
ACG
Treonina
UCC
Serina
ACA
Treonina
UCG
Serina
GGU
Glicina
UCA
Serina
GGC
Glicina
CCU
Prolina
GGG
Glicina
CCC
Prolina
GGA
Glicina
CCG
Prolina
CAU
Istidina
CCA
Prolina
CAC
Istidina
Alcuni AA sono specificati da più di
un codone
DEGENERAZIONE DEL CODICE
GENETICO
per minimizzare gli
effetti delle mutazioni
GENE
OPERONE
INIZIO ATG GTG TTG CTG
STOP
TAA TAG TGA
Promotore della trascrizione
Un gene è una sequenza di nucleotidi delimitata da una tripletta
di inizio e di fine, che codifica per un prodotto. La sua trascrizione e
regolazione avviene ad opera di una regione promotrice e
regolatrice , situata a monte della sequenza genica.
Ogni gene possiede un proprio sito promotore e regolatore.
Un operone è un insieme di geni, ognuno codificante un diverso
prodotto, ma regolati e trascritti da un unico promotore e regolatore,
a monte del primo gene dell’operone. In questo modo la cellula
risparmia…in un operone sono raggruppati geni che codificano per
prodotti di cui la cellula ha bisogno nello stesso momento
Estrazione e purificazione dalle cellule
batteriche
Raccolta e lavaggio delle cellule
Risospensione in tampone + saccarosio (6%)
Aggiunta di agente litico: lisozima (pH 7-8, 37°C
per 30 min)
Aggiunta di tensioattivo: SDS al 20%
Deproteinizzazione mediante estrazione con solventi:
fenolo, CHF/isoamilico
Centrifugazione e raccolta del surnatante
Fase acquosa contenente il DNA
Interfase
Solvente
Ulteriore deproteinizzazione e raccolta del
surnatante
Trattamenti enzimatici con RNAsi e Proteinasi
Precipitazione del DNA con 2 vol. di EtOH
Scioglimento del DNA in tampone
Quantificazione e visualizzazione
spettrofotometrica
Il DNA ha un massimo di
assorbimento a 260 nm
1 OD260nm = 50 µg/ml
Il DNA si denatura per effetto
del calore = si rompono i legami
H e si separano i due filamenti
Per l’EFFETTO IPERCROMICO delle
basi nucleotidiche, all’aumentare
della separazione dei due filamenti
aumenta la OD260nm
Visualizzazione per via elettroforetica
una molecola carica posta all’interno di un campo
elettrico migra in direzione del polo di carica
opposta
in
un gel costituito da un polimero organico
molecole di dimensioni diverse (ma di uguale carica)
migrano con velocità diverse, perché le molecole di
dimensioni maggiori incontrano maggiore resistenza
tra le maglie di un gel
È così possibile visualizzare il DNA facendolo
migrare all’interno di un supporto solido (gel) e
colorandolo opportunamente
I REAGENTI DELL’ELETTROFORESI:
Tampone : crea continuità nella vaschetta
AGAROSIO: polimero che costituisce il gel
Indicatore DI CORSA: permette di visualizzare la corsa
ed aumenta la densità della soluzione di DNA da inserire
nelle taschine del gel
BROMURO di ETIDIO: si intercala tra le basi azotate
delle molecole di DNA e lo ‘colora’
LA STRUMENTAZIONE
DELL’ELETTROFORESI:
1) ALIMENTATORE:
crea la differenza di
potenziale
2) VASSOIO e
VASCHETTA
ELETTROFORETICA:
vi si alloggia il gel, vi
si instaura il campo
elettrico
Il caricamento del gel
IL RISULTATO DI UNA CORSA
ELETTROFORETICA
frammenti di lunghezza
maggiore
POLO
] bande di DNA
frammenti di lunghezza
minore
POLO
+
VISUALIZZAZIONE MEDIANTE TRANSILLUMINATORE
A LUCE ULTRAVIOLETTA (254-312nm)
La replicazione in vivo
INTERVENGONO PER LA
FORMAZIONE DELLA
FORCELLA =
DENATURAZIONE
SINTETIZZANO I PRIMERS
20
La replicazione in vitro: Amplificazioni di
porzioni specifiche del cromosoma
PCR
Polymerase chain reaction
5’
3’
3’
5’
5’
3’
3’
5’
Separazione dei filamenti
mediante DENATURAZIONE
(95°C 3-5 min)
Oligonucleotidi (INIZIATORI
o PRIMERS) di 15-20bp
+
5’
3’
3’
5’
+
DNA totale estratto dalle
cellule = DNA stampo o
templato (in opportuno
tampone di reazione
FASE DI APPAIAMENTO = T
di appaiamento per 30-60 ‘’
T app. =Tm (primer) – 3°C
Tm = 4 x (G+C) + 2 x (A+T)
=DNA polimerasi termostabile
+
= dNTP
5’
3’
3’
5’
FASE DI ALLUNGAMENTO =
T di AZIONE DELL’E = 7275°c per 30-60 ‘’
Fase di denaturazione
Fase di appaiamento
1 ciclo
Fase di allungamento
25-30 cicli = 106-107 copie
5’
3’
3’
5’
Verifica dell’avvenuta amplificazione:
•gel elettroforesi
•Controllo negativo
Costruzione dei primers
5’ TAATACTTTTT------------------------GAGATGTT 3’
1° FORWARD 5’ TAATACTTTTT 3’
2° REVERSE
5’GAGATGTT3’
3’CTCTACAA5’
5’ AACATCTC3’
APPAIAMENTO
5’ TAATACTTTTT--------------GAGATGTT3’
3’CTCTACAAA5’
5’ TAATACTTTTT3’
3’ ATTATGAAAAA---------------CTCTACAA5’
Se una specie batterica possiede nel suo cromosoma
un gene o una regione specifici, allora posso
costruire una
•Devo conoscere la sequenza nucleotidica
agli estremi del gene o regione specifica
•Devo costruire i primers idonei
•Devo estrarre il DNA batterico totale dal
campione in cui devo ricercare la presenza
di quella determinata specie
•Devo condurre una amplificazione speciespecifica
•Devo conoscere il PM dell’amplificato che
mi aspetto e l’eventuale numero di copie
presenti lungo il cromosoma
Gene his Lactococcus lactis
16S rDNA
lacZ
(933 bp) e
Lactococcus garvieae
cremoris
(1100 bp)
Streptococcus thermophilus
(950 bp)
Enterococcus faecium
(650 bp)
reg. conserv.
Gene ddl (Ala- Enterococcus faecalis (940 bp)
Ala ligasi)
lactis
(933 + “n” 59)
Se non conosco la sequenza, e non ho indicazioni
sull’appartenenza a una determinata specie:
.
devo avvalermi di primers UNIVERSALI
Geni conservati in tutti i procarioti
Gene 16S rRNA
il sequenziamento del gene 16SrDNA
Il sequenziamento viene generalmente condotto da tecnici
specializzati e fornito sotto forma di cromatogramma. Una
sequenza parziale delle prime 500 bp del gene, può essere
sufficiente per determinare la specie di appartenenza del ceppo
allo studio, tramite comparazione in banca dati con le sequenze
note riportate.
Ricordiamo che due ceppi appartenenti alla stessa specie devono
possedere una % omologia 16S rDNA >97-98%
Il gene 16S rRNA si trova all’interno
dell’OPERONE RIBOSOMALE
P
T
16S
23S
Regione spaziatrice
Posso usare sempre Primers Universali
La RS è la parte più variabile dell’operone
ribosomale
posso distinguere generi e
specie diverse in funzione del numero e del
peso molecolare degli amplificati ottenuti
Ci possono essere sul
cromosoma più operoni
ribosomali
La lunghezza della RS può
essere differente sia
nell’ambito dello stesso ceppo
che tra ceppi diversi
1 2 3
4 5a 5b 5c 5d M
RSA
nell’ambito lattiero-caseario:
1
380 bp
L. lactis
2
410 bp
L. garvieae
3
350 bp
S. thermophilus
4
500 bp ??
5
a) b) c) d) 2 amplificati 300500 bp
Enterococcus spp.
E. sulfureus
E. gallinarum
E. avium
Enterococcus sp.
E. faecium
E. durans
E. faecalis
I risultati vanno verificati con sonde speciespecifiche o con riassociazione molecolare
DNA/DNA o con il sequenziamento del gene 16S
rRNA.

![(Microsoft PowerPoint - PCR.ppt [modalit\340 compatibilit\340])](http://s1.studylibit.com/store/data/001402582_1-53c8daabdc15032b8943ee23f0a14a13-300x300.png)

![mutazioni genetiche [al DNA] effetti evolutivi [fetali] effetti tardivi](http://s1.studylibit.com/store/data/004205334_1-d8ada56ee9f5184276979f04a9a248a9-300x300.png)
![ESTRAZIONE DNA DI BANANA [modalità compatibilità]](http://s1.studylibit.com/store/data/004790261_1-44f24ac2746d75210371d06017fe0828-300x300.png)







