Prof. ZANGARI NATALE
ATOMO
Il mondo intorno a noi
L’idea dell’atomo
Quali particelle sono fondamentali?
Le dimensioni dell’atomo
L’elettrone
Il protone
Il neutrone
ATOMO
Prof. ZANGARI NATALE
ATOMO
Il mondo intorno a noi
L’idea dell’atomo
Quali particelle sono fondamentali?
Le dimensioni dell’atomo
L’elettrone
Il protone
Il neutrone
ATOMO
MENÙ PRINCIPALE
Il mondo intorno a noi
Prof. ZANGARI NATALE
Il mondo intorno a noi e l'intero Universo sono popolati da una grande diversità di
materiali e forme di materia
Sorprendentemente questa grande varietà di materia è composta da pochi e
relativamente semplici mattoni fondamentali.
La parola fondamentale e/o elementare sarà una parola chiave lungo tutto il
nostro percorso di esplorazione dell'infinitamente piccolo.
Per mattoni fondamentali intendiamo oggetti privi di una struttura interna, ovvero
oggetti che a loro volta non possono essere scomposti in entità più piccole.
ATOMO
sommario
L’idea dell’ Atomo
Prof. ZANGARI NATALE
L'idea dell'esistenza di tali entità
fondamentali risale al tempo dell'antica
Grecia, ai filosofi greci Leucippo e
Democrito nel V secolo avanti Cristo. Essi
credevano che tutta la materia dell'Universo
fosse fatta di piccolissimi mattoni indivisibili
(che essi chiamarono atomi che in greco
significa appunto non divisibile) separati dal
vuoto.
Aristotele invece sosteneva che "la natura
aborre il vuoto" e immaginava che la
materia fosse indefinitivamente divisibile in
parti sempre più piccole. L'opinione di
Aristotele prevalse, e l'ipotesi dell'atomo fu
quasi completamente dimenticata per più di
duemila anni.
Atomi di
silicio al
microscopio
elettronico
Democrito
Aristotele
La teoria della materia secondo Aristotele prevedeva l’esistenza di quattro elementi fondamentali e di
quattro qualità. Ciascun elemento era caratterizzato da due qualità, così la terra è secca e fredda,
l’acqua è fredda e umida, l’aria è umida e calda ed il fuoco è caldo e secco. Un elemento può
cambiare se cambiano le sue qualità. La trasformazione è più facile tra elementi con qualità in
comune: la terra (fredda e secca) si trasforma in acqua quando il secco si trasforma in umido.
ATOMO
Per più di duemila anni l'idea di Aristotele
ebbe la meglio, ma a partire dal
diciottesimo secolo gli scienziati, con una
serie di scoperte che hanno dato origine
alla chimica moderna, hanno dimostrato
che tutte le sostanze sono scomponibili in
piccolissimi costituenti corpuscolari, troppo
piccoli per essere osservati con le tecniche
dell'epoca. Seguendo la tradizione greca i
chimici chiamarono tali costituenti atomi.
Questa denominazione ebbe successo. I
vari elementi chimici vennero catalogati in
gruppi che mostravano proprietà simili da
cui derivò
La Tavola Periodica degli Elementi
In seguito i fisici dimostrarono che gli
atomi identificati dai chimici erano
divisibili. Nelle decadi tra Ottocento e
Novecento diversi brillanti esperimenti
mostrarono che gli atomi sono composti
da un piccolo e denso nucleo centrale di
carica elettrica positiva intorno al quale
sono in costante moto particelle di carica
elettrica negativa chiamati elettroni .
Prof. ZANGARI NATALE
Dmitrij Ivanovich
Mendeleev
Tobolsk 1834
Pietroburgo 1907
ATOMO
In seguito i fisici dimostrarono che gli atomi identificati dai chimici
erano divisibili. Nelle decadi tra Ottocento e Novecento diversi
brillanti esperimenti mostrarono che gli atomi sono composti da un
piccolo e denso nucleo centrale di carica elettrica positiva intorno al
quale sono in costante moto particelle di carica elettrica negativa
chiamati elettroni.
Nuclei ed elettroni si combinano in diversi modi, tali da determinare le
diverse proprietà chimiche osservate.
Per un certo tempo i fisici pensarono che gli elettroni e il nucleo
fossero gli atomi dei greci, le particelle elementari di cui tutta la
materia è composta. Avevano solo parzialmente ragione. Mentre
l'elettrone è ancora oggi ritenuto indivisibile, nuovi
esperimenti mostrarono che il nucleo atomico non è una particella
fondamentale
Prof. ZANGARI NATALE
1. Mano
2. Pelle della mano
3. Cellula della pelle
4. Atomo
5. Nucleo dell’atomo
ATOMO
sommario
Quali particelle sono fondamentali?
Il nucleo atomico è una particella fondamentale?
No, anche il nucleo ha una struttura interna, è composto di
particelle con carica elettrica positiva chiamate protoni e di
particelle prive di carica elettrica chiamate neutroni. Protoni
e neutroni sono genericamente chiamati nucleoni
Allora i protoni e i neutroni sono particelle fondamentali ?
No. Protoni e neutroni sono composti di particelle ancora più
piccole chiamate quark. Negli anni 60 un esperimento
eseguito a SLAC (Stanford Linear ACcelerator) e una serie
di esperimenti eseguiti in Italia nei Laboratori di Frascati
presso l'acceleratore ADONE , dimostrarono infatti che
neanche i protoni e i neutroni sono elementari . Protone e
neutrone sono ognuno composti di tre particelle più
piccole alle quali è stato dato il nome di quark su proposta
del fisico Murray Gell-Mann, che ne aveva già ipotizzato
l'esistenza prima della scoperta
Per quanto ne sappiamo fino ad ora i quark insieme agli
elettroni sono particelle fondamentali quindi non possono
essere ulteriormente scomposte in entità più piccole
ATOMO
Prof. ZANGARI NATALE
nucleo
neutrone
protone
sommario
Le dimensioni dell'atomo
Prof. ZANGARI NATALE
La diapositiva a lato mostra atomi di silicio
a)
ripresi con un microscopio ad effetto tunnel
b)
ripresi con um microscopio elettronico
Per avere una idea del diametro di un
atomo dobbiamo prendere un metro
dividerlo in un miliardo di volte e poi
ancora in dieci parti! Per indicare
questa misura si scrive 10-10 m ( cioè
un metro diviso 10˙000˙000˙000)
Le dimensioni dei nuclei sono 10-4
volte più piccole (cioè diecimila volte
più piccole) di quelle dell'atomo.
Insomma tra i diametri del nucleo e
dell’atomo c’e un rapporto pari a quello
fra la capocchia di uno spillo e la
cupola della basilica di san Pietro a
Roma.
ATOMO
Le dimensioni dell'atomo
Prof. ZANGARI NATALE
ATOMO
Le dimensioni dell'atomo
Se in proporzione il nucleo di un
atomo avesse un diametro equivalente
al cerchio di centrocampo dello stadio
Olimpico in Roma, gli elettroni più
vicini si troverebbero ad orbitare ad
una distanza che li porterebbe sopra lo
stadio di San Siro a Milano
E poiché tutto sulla terra è fatto di
atomi, ciò significa che il nostro corpo
e la sedia su cui siamo seduti, sono
composti da una quantità di spazio
vuoto, un milione di milioni di volte
maggiore dello spazio occupato dalla
materia.
Prof. ZANGARI NATALE
Aristotele aveva veramente torto: la materia è essenzialmente composta dal vuoto !! L'unica ragione per cui
il nostro corpo, e la sedia su cui siamo seduti, ci sembrano cosi solidi e impermeabili, è perché tali quantità
infinitesime di materia sono tenute insieme da forze che agiscono come invisibili ma potentissime molle.
ATOMO
sommario
L’elettrone
Prof. ZANGARI NATALE
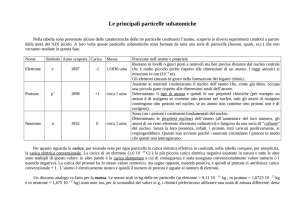
Delle tre particelle che costituiscono gli atomi, l'elettrone è di gran lunga il più leggero ed il più
piccolo. Per avere un idea del suo peso dobbiamo pensare che ci vorrebbero dieci miliardi di
miliardi di miliardi di elettroni per fare un grammo di materia !! La sua massa è infatti:
me = 9.11 × 10-31 kg
Mentre il raggio dell'elettrone è così piccolo che non si è ancora riusciti a misurarlo; per
questo diciamo che è puntiforme. Sappiamo inoltre che è privo di struttura interna, cioè è una
particella fondamentale in quanto non composta da altre più piccole.
Nell'uso comune, l'elettrone viene abbreviato con il
simbolo e-
La sua carica elettrica per convenzione è negativa.
La carica dell'elettrone qe viene identificata come carica
elementare. In questo modo la carica di tutte le altre
particelle viene riferita a quella dell'elettrone: la carica
elettrica di una particella è sempre un multiplo intero o una
frazione, segno a parte, della carica elementare qe.
ATOMO
sommario
Il protone
Prof. ZANGARI NATALE
Il protone è insieme al neutrone, uno dei 2 costituenti dei nuclei atomici.
Il protone è molto più pesante dell'elettrone, la sua massa è infatti circa 2000 volte quella
dell'elettrone.
mp = 1.673 × 10-27 kg
Il raggio del protone è rp = 1 fm (1 fm = 10-15 m)
Questa grandezza viene chiamata fermi (fm) dal nome del grande fisico italiano Enrico Fermi ed è
spesso usata per le misure atomiche e subatomiche. Per ottenere un fermi dobbiamo dividere un
metro in un miliardo di parti poi dividere quanto ottenuto in un milione di parti!!
Comunemente il protone viene abbreviato
con il simbolo p.
La carica elettrica del protone è uguale a quella
dell'elettrone ma ha segno opposto,
cioè è positiva: qP = + e
ATOMO
sommario
Il neutrone
Prof. ZANGARI NATALE
Il neutrone è insieme al protone, uno dei 2 costituenti dei nuclei
atomici.
Il neutrone ha massa dello stesso ordine del protone, la sua
massa è infatti circa mn = 1.675 × 10-27 kg
Comunemente il protone viene abbreviato
con il simbolo n.
Il neutrone non ha carica elettrica
ATOMO
sommario
Prof. ZANGARI NATALE
Le particelle
nell’atomo
ATOMO
sommario