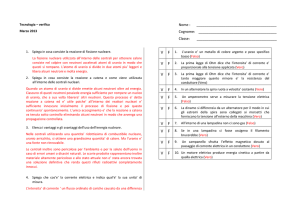
URANIO
La seguente lezione si articola in due parti:
• Descrivere le proprietà chimico-fisiche e la reattività dell’uranio
• Applicazioni di questo elemento: Energia Nucleare e Armi Nucleari
I destinatari sono studenti di un secondo anno di un ITIS
Prerequisiti:
Linguaggio chimico: simboli, formule chimiche, peso atomico e molecolare
Struttura atomica: particelle dell’atomo, numero atomico, numero di massa e isotopi.
Tavola periodica: proprietà periodiche degli elementi, elementi metallici e non metallici nella tavola
periodica. Numeri di ossidazione degli elementi.
Composti chimici-idruri: ossidi, idrossidi e alogenuri e sali.
Bilanciamento delle reazioni
Legami chimici
Elementi di radioattivita’
Nozioni di scienze della terra
URANIO
Obiettivi:
•Comprensione delle proprietà chimico-fisiche dell’uranio e delle
sue svariate applicazioni
•Comprendere la reazione di fissione nucleare dell’uranio e il suo
impiego per uso civile e militare
•Comprendere distinzione tra uranio impoverito ed arricchito
• Comprendere la tossicita’ dell’uranio e dell’uranio impoverito
•Comprendere come a seconda delle intenzioni umane, uno stesso
elemento chimico puo’ essere sfruttato o per scopi benefici o per
scopi bellici!
URANIO
Gli ATTINIDI: L’URANIO
ATTINIDI:
• Stato di ossidazione +3, come i lantanidi, non è sempre lo stato di ossidazione più
stabile: per esempio U3 + si ossida facilmente favorendo gli stati di ossidazione più alti. La
chimica dell’U, Np, Pu, Am è molto simile, infatti formano composti nello stato di
ossidazione +6 (MF6 e diossoione MO22+ )
•Gli attinidi sono metalli argentei; i loro punti di fusione sono moderatamente alti, ma più
bassi di quelli degli elementi di transizione
•Proprietà chimiche analoghe con i lantanidi, ma hanno densità molto maggiori.
•Sono metalli reattivi: reagiscono con H2O e si ossidano all’aria formando uno strato di
ossido
• Reagiscono facilmente con HCl, ma le reazioni con altri acidi sono lente
Un po’ di storia……
•L'uso dell'uranio, sotto forma del suo ossido, risale ad almeno al 79 AC;
risalgono ad allora alcuni manufatti in ceramica colorati di giallo per
aggiunta dell'1% di ossido di uranio rinvenuti in scavi nella zona di Napoli.
•Scoperto nel 1789 dal chimico tedesco
Martin Heinrich Klaproth, in un campione di
pechblenda e prese nome dal pianeta Urano
•Il termine uranio deriva del tedesco
Uran=Urano, nome scelto perché questo
elemento fu individuato poco tempo dopo la
scoperta del VII pianeta del sistema solare,
chiamato Urano dalla divinità greca che
personifica il cielo
Un po’ di storia……
Solo nel 1841 Péligot ne mutò il nome in uranium (da cui il simbolo chimico),
secondo la classica consuetudine adottata per gli elementi metallici di
finire con il suffisso -ium. ed è del 1850 il primo impiego industriale
dell'uranio nel vetro, sviluppato dalla Lloyd & Summerfield di Birmingham,
nel Regno Unito.
Le proprietà radioattive dell'uranio vennero scoperte nel 1896 dal fisico
francese Antoine-Henri Becquerel.
Becquerel stava facendo ricerche su diversi tipi di “radiazione” usando dei sali di
uranio, che erano noti per dare fenomeni di fluorescenza se esposti alla luce del
sole, e aveva lasciato casualmente i sali a contatto con delle emulsioni
fotografiche. Egli scoprì che le emulsioni si erano annerite, anche senza che i
sali fossero stati esposti al sole e ne diede la causa a qualche strana
“radiazione” emessa dall’uranio, che venne chiamata “radiazione uranica”.
Disponibilita’
In natura l'uranio non si trova allo stato libero, ma solo
sotto forma di ossido o sale complesso, in minerali
come la pechblenda:
•PECHBLENDA
U3O8 ossido
misto in cui l’uranio
presenta sia lo stato di ossidazione +3 che +2 (il
minerale più ricco di uranio, si trovano principalmente
in Canada, Congo e Stati Uniti)
•URANITE approssimabili alla formula
UO2
•CARNOTITE o VANADATO DI URANIO
K2(UO2)2(VO4)2·3H2O
Dove si trova?
L'uranio è un elemento che si trova in natura, in basse concentrazioni,
praticamente in tutte le rocce, in tutti i terreni e nelle acque.
•Viene considerato più abbondante del
cadmio, dell’oro, del mercurio, dell’argento,
del tungsteno; ha circa la stessa
abbondanza dell’arsenico e del molibdeno.
•Si ipotizza che la principale fonte del calore
che mantiene liquido il nucleo della Terra e il
soprastante
mantello
provenga
dal
decadimento dell'uranio e dalle sue reazioni
nucleari con il torio nel nucleo della terra,
generando così la tettonica a zolle.
Proprieta’
•L'uranio fonde a circa 1132 °C, bolle a 3818 °C,
ha densità relativa 19,05 kg/dm3 alla
temperatura di 25 °C, e peso atomico 238,029
uma.
Simbolo atomico:
Numero atomico:
Massa atomica:
Numeri di ossidazione:
U
92
238.029
+6 ,+5,
+4, +3
•Esiste in tre diverse forme cristalline: una
forma stabile a temperatura ambiente; una
forma modificata, caratterizzata da densità
leggermente minore e da cristalli duri e fragili;
ad alta temperatura una forma facilmente
lavorabile e plastica, resa stabile mediante
l'aggiunta di piccole quantità di molibdeno.
•L'uranio è solubile in HCl e HNO3, ma insolubile
negli alcali; reagisce con le soluzioni dei sali di
mercurio, argento, rame, stagno, platino e oro.
Proprieta’:uno sguardo alla densita’
L’Uranio metallico ha un colore bianco-argento, è molto denso, duttile, malleabile,
radioattivo (emivita: 4 500 000 000 anni).
dU = 19 kg/dm-3
dH2O= 1 kg/dm-3
dPb = 12 kg/dm-3
Composti dell’Uranio
I principali composti dell’Uranio sono gli ossidi, idruri e i fluoruri. I più stabili sono
i composti dell’Uranio esavalente, meno stabili quelli dell’Uranio tetravalente.
I più importanti sono elencati di seguito:
Ossidi
UO2
Biossido di Uranio (Uranite)
UO3
Triossido di Uranio (Ossido di Uranile)
U3O8
Ottaossido di Triuranio
Idruri
UH3
Triidruro di Uranio
Fluoruri
UF6
Esafluoruro di Uranio
UF4
Tetrafluoruro di Uranio
UO2F2 Fluoruro di Uranile
TOSSICITA’DELL’URANIO
•L’uranio metallico possiede proprietà piroforiche, soprattutto se finemente
suddiviso; ciò significa che può incendiarsi spontaneamente a temperature
intorno ai 600 - 700°
•E’ solido a temperatura ambiente e se esposto all’aria si ossida lentamente
assumendo inizialmente una colorazione giallo oro per poi diventare sempre più
scuro fino ad avere un colore nero dopo tre o quattro settimane.
•I composti solubili, facilmente assorbiti dalle mucose interne, vengono
incorporati nel flusso sanguigno e agiscono negativamente a livello renale
determinando vari effetti che regrediscono al termine dell’esposizione
•I composti insolubili non pongono molti problemi da un punto di vista
tossicologico poiché, se ingeriti, possono essere facilmente espulsi mediante i
normali processi fisiologici. Per contro, qualora venissero inalati, potrebbero
rimanere negli alveoli per lunghi periodi di tempo (mesi o addirittura anni) con
effetti nocivi dovuti alle proprietà radiologiche dell’ 238U.
Caratteristiche degli ossidi dell’Uranio
Ottaossido di Triuranio U3O8
È un minerale dal colore verde oliva, chiamato Pechblenda. È la forma
più stabile dell’Uranio ed è la forma principale con cui l’Uranio si
trova in natura.
Biossido di Uranio UO2
È un minerale dal colore bruno, chiamato Uranite. È la forma in cui
l’Uranio è più comunemente usato come combustibile nucleare. Può
essere travato in natura come minerale, ma più spesso viene prodotto
per trasformazione della pechblenda.
Triossido di Uranio UO3
È un minerale dal colore variabile tra l’arancione ed il giallo. È più
stabile del biossido e meno dell’ottaossido. Non ha applicazioni
pratiche.
I fluoruri dell’Uranio
L’interesse dei fluoruri dell’Uranio consiste nel loro utilizzo al fine
di produrre combustibile nucleare.
Di particolare importanza è, in tale ambito, l’ Esafluoruro di
Uranio (UF6)
L’Esafluoruro di Uranio è prodotto industrialmente mediante il
seguente sistema di reazioni :
1) UO2 + 4HF => UF4 + 2H20
2) Cl2 + 3F2
=> 2ClF3
3) 3UF4 + 2ClF3 => 3UF6 + Cl2
ISOTOPI
L'uranio in natura è una miscela di tre isotopi:
238U
238U
99.282%
235U
0.712%
234U
0.006%
è il più abbondante!
Questi tre isotopi sono RADIOATTIVI:
Il più stabile è :
238U
(emivita: 4,5 *109 anni)
235U (7 *108 anni)
234U (2,5*105 anni)
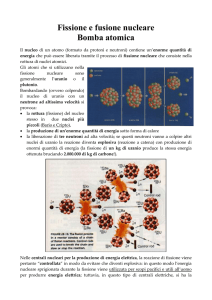
FISSIONE NUCLEARE
L’atomo di Uranio è fissile, cioè, può essere spaccato in altri atomi più piccoli se
bombardato con neutroni. Il processo è chiamato fissione nucleare e libera una
GRANDE QUANTITÀ DI ENERGIA
FISSIONE NUCLEARE
La fissione nucleare procede in maniera autosostenuta (reazioni a catena)
quando dalla rottura degli atomi si liberano, in media, 2-3 neutroni:
U
238
92
n U
imm
239
92
e
Np
23min
239
93
e
Pu
56 h
239
94
FISSIONE NUCLEARE
L’isotopo dalla cui fissione si liberano più neutroni è il
235,
che perciò è
detto isotopo più FISSILE, e che è presente in un campione naturale di U
soltanto per circa lo 0,7 %. Per poter sfruttare la fissione nucleare è perciò
necessario ARRICCHIRE l’Uranio naturale del suo isotopo più fissile,
portando il contenuto di
235U
ad almeno il 3%.
U235 emissione di 2.5 neutroni
(Pu239
3 neutroni)
ARRICCHIMENTO DELL’URANIO
L’ARRICCHIMENTO DELL’URANIO È UN PROCESSO CHE SEPARA DUE
DIVERSI ISOTOPI DELL’URANIO CHE SI TROVANO NELL’URANIO NATURALE
L’uranio naturale, quello che viene estratto dalla miniera e purificato, contiene il
99,3% di uranio 238, ovvero uranio il cui nucleo è formato da 92 protoni e 146
neutroni, e lo 0,7% di uranio 235, il cui nucleo ha tre neutroni in meno.
I due isotopi dell’uranio hanno comportamento chimico identico e massa solo
lievemente diversa, ma hanno un comportamento totalmente diverso quando
vengono irraggiati da neutroni.
ARRICCHIMENTO DELL’URANIO
•Quando un nucleo di uranio 235 viene colpito da un neutrone, infatti, ha circa
il 90% di probabilità di dividersi in due, emettendo un’energia di 200 milioni di
volte superiore a quella di una tipica reazione chimica.
•Se un nucleo di uranio 238 viene colpito da un neutrone, invece, lo assorbe, e
si trasforma dopo un po’ in plutonio 239, che, come l’uranio 235, fa fissione.
AUMENTARE LA CONCENTRAZIONE DELL'ISOTOPO 235U RISPETTO AL
PIÙ COMUNE E MENO RADIOATTIVO 238U È UN COMPITO
ESTREMAMENTE DIFFICILE:
Non è possibile separarli per via chimica, e l'unico modo è sfruttare la
piccolissima (meno dell'1,5%) differenza di peso
IMPIEGHI DELL’URANIO
•L'uranio acquistò importanza sulla scena
politica mondiale durante il Progetto
Manhattan, teso a realizzare la prima bomba
atomica durante gli anni della seconda guerra
mondiale.
Dal Progetto Manhattan nacquero gli ordigni
che vennero successivamente sganciati sulle
città di Hiroshima e Nagasaki nell'agosto del
1945. Gli altri ordigni nucleari prodotti
successivamente utilizzarono plutonio come
materiale fissile, anch'esso prodotto a
partire dall'uranio.
•Nel settore civile il principale impiego
dell'uranio è l'alimentazione dei reattori
delle centrali elettronucleari, dove viene
usato un uranio arricchito al 2-3% di 235U.
Esistono anche reattori come il CANDU
che possono essere alimentati da uranio
naturale non preventivamente arricchito.
IMPIEGHI DELL’URANIO
Tra gli altri usi si annoverano:
•Inclusione di sali di uranio nelle
ceramiche e nei vetri, per colorare le
prime e impartire una fluorescenza gialla
o verde ai secondi
•Datazione delle rocce ignee ed altri
metodi di datazione geologica quali la
datazione uranio-torio e uranio-piombo
attraverso
la
misura
della
concentrazione di 238U, la cui emivita è di
circa 4,51 miliardi di anni
VANTAGGI ENERGETICI DELL’URANIO
Dopo la scoperta della fissione nucleare, l'uranio divenne un metallo di
importanza strategica, utilizzato principalmente per la produzione di:
•ENERGIA NEI REATTORI NUCLEARI
•NELLE ARMI NUCLEARI
Durante le tre conferenze internazionali per gli usi pacifici dell'energia nucleare tenute a
Ginevra nel 1955, 1958 e 1964, si discussero le applicazioni pacifiche di questa fonte
energetica.
Impianti tradizionali producono 60.000 kW di elettricità con 18 milioni di kg di
carbone al mese, impianto nucleare usa solo 7 kg di uranio !
Tuttavia, problemi di scarsità dell'uranio, di sicurezza degli impianti e l'accumulo dei
rifiuti radioattivi di uranio e plutonio pongono seri interrogativi, e hanno bloccato la
conversione degli impianti tradizionali in impianti nucleari in diversi paesi europei.
ORIGINE DELL’URANIO
IMPOVERITO
CICLO DEL COMBUSTIBILE NUCLEARE:
Processo di arricchimento dell’Uranio
Uranio impoverito
Punta pesante
per proiettili
Uranio arricchito
Combustibile per
Impianti nucleari
URANIO IMPOVERITO
•Come conseguenza del processo di arricchimento di contenuto di 235U, come
prodotto di scarto, l’uranio “impoverito”, che contiene solo più una frazione di
meno dello 0,2% di 235U
•L'UI sostanza radioattiva e tossica è principalmente costituita dall'isotopo 238U
e contiene una piccola percentuale dell'isotopo fissionabile 235U. Anche se la sua
radioattività è il 40% in meno dell'uranio fissile, è sempre ben 60 volte più
radioattivo del materiale che si trova in natura
URANIO IMPOVERITO
•I danni provocati dell'UI, o meglio dalle radiazioni da questo emesso,
sono di tipo cancerogeno, mutagenico-genotossico. Se bruciato, durante
un incendio, si formano i diossidi di uranio, i cui effetti sulla popolazione
sono evidenti in Irak, dove sono state bruciate 300 tonnellate di uranio
(ammesse ufficialmente), leucemie, tumori, malformazioni genetiche, e
non solo sulla popolazione locale.
•Durante la Guerra del Golfo del 1991, fra
aerei e carri armati inglesi e americani, sono
state sparate qualcosa come 340 tonnellate di
UI, si tratta, tanto per usare un termine di
paragone, di una quantità cento volte maggiore
di quella rilasciata durante l'incidente di
Cernobyl (dove la vita media è passata da 67
anni a 42).
COSA SUCCEDE QUANDO UN
PENETRATORE AL DU IMPATTA
SUL BERSAGLIO?
DISTRUZIONE BERSAGLIO
INCENDIO: OSSIDAZIONE E POLVERIZZAZIONE
DISPERSIONE IN ATMOSFERA
DEPOSITO AL SUOLO: ANCHE A GRANDI DISTANZE
CONTAMINAZIONE