La glicolisi
Introduzione
• Una via metabolica molto antica (il nome, dove
avviene e perché)
• Glucosio + 2 NAD+ + 2 ADP + 2 Pi → 2 piruvato
+ 2 NADH + 2 H+ + 2 ATP + 2 H2O
• Universale
• Specifica di alcuni organismi e di alcuni tessuti
• Classica via catabolica, ma alcuni suoi intermedi
partecipano ad altre vie metaboliche
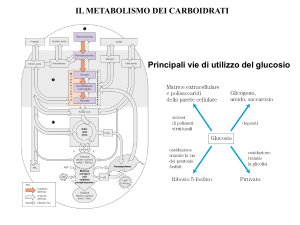
METABOLISMO CELLULARE
METABOLISMO CENTRALE DEL CARBONIO
Glicolisi
Metabolismo ossidativo
Gluconeogenesi
10 reazioni
2 FASI:
fase preparatoria,
reazioni 1-5
fase del recupero
dell’energia,
reazioni 6-10
Krebs
O2
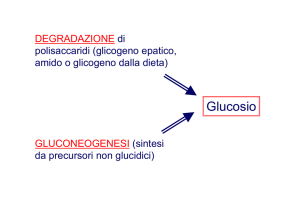
METABOLISMO GLUCIDICO
I prodotti finali della digestione dei carboidrati nel tubo
digerente sono quasi esclusivamente glucosio, fruttosio e
galattosio tra i quali il primo rappresenta circa l’80%.
Dopo l’assorbimento intestinale quasi tutto il galattosio e
buona parte del fruttosio è trasformato in glucosio.
Più del 95% dei monosaccaridi presenti nel sangue sono
rappresentati dal glucosio.
METABOLISMO GLUCIDICO
Il glucosio, con peso molecolare di 180, non potrebbe
attraversare le membrane cellulari (max 100), ma penetra
comunque tramite diffusione facilitata, secondo un
gradiente di concentrazione e utilizzando diversi carriers
come trasportatori. Non c’è quindi in questo caso
accoppiamento con il sodio e dispendio quindi energetico.
Solo nelle cellule epatiche e cerebrali il glucosio entra in
quantità sufficiente al fabbisogno, nelle altre è la presenza
di insulina a permetterne un ingresso quantitativamente
utile.
LA RESPIRAZIONE CELLULARE
La respirazione è un processo di ossidoriduzione nel quale i riducenti sono
molecole organiche altamente ridotte e ricche di energia e gli ossidanti
sono molecole inorganiche come O2
Il glucosio è il principale combustibile per la maggior parte degli
organismi.
Il bilancio generale
dall'equazione:
della
C6H12O6 + 6 O2 = 6 H2O + 6 CO2
respirazione
con
DG
può
essere
riassunto
= -686 kcal/mole di glucosio
La respirazione avviene in tre stadi principali (stadi della respirazione
cellulare); diverse sono anche, per i tre stadi, le sedi della respirazione.
Il primo stadio, detto glicolisi, avviene in tutti gli organismi ed è
indifferente alla presenza di ossigeno.
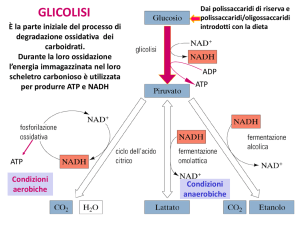
LA GLICOLISI
La Glicolisi, detta anche via Embden-Meyerhof (Warburg), è il meccanismo
più importante di liberazione di energia dal glucosio.
Nelle cellule eucariotiche avviene nel CITOPLASMA.
Consiste nella scissione di una molecola di glucosio in 2 molecole di acido
piruvico (piruvato) con la contemporanea produzione di 4 molecole di ATP, ma
una resa netta finale di 2 molecole di ATP.
Glucosio + 2ADP + 2NAD+ + 2Pi --> 2 Piruvato + 2ATP + 2 NADH + 2H+
Il processo consiste nella sequenza di 10 reazioni
catalizzate da altrettanti enzimi, per ciascuno dei
quali il substrato è costituito dal prodotto della
reazione precedente. Gli enzimi sono localizzati nel
citoplasma, dove sono trattenuti perché in forma
fosforilata
impermeabile
alla
membrana,
i metaboliti intermedi.
PRODOTTI: piruvato, ATP, NADH
Il piruvato ha generalmente tre destini diversi
Destino del piruvato
Per gli organismi anaerobici la glicolisi
costituisce il processo energetico
fondamentale,
il
piruvato
viene
trasformato in acido lattico o alcool
etilico
Per gli organismi aerobici la glicolisi
costituisce la fase anaerobica
citoplasmatica preliminare alla fase
aerobica mitocondriale in cui l’acido
piruvico viene ossidato in CO2
e H2O con la produzione
della maggior quota di energia
Anche per gli organismi aerobi
in assenza di ossigeno la
glicolisi rappresenta il solo
processo di utilizzazione del
glucosio prodotto terminale acido
lattico
Affinché la glicolisi avvenga il glucosio deve entrare nella cellula
Nella maggior parte delle cellule di mammifero, la
concentrazione di glucosio è controllata da TRASPORTATORI
DI MEMBRANA
soggetti a regolazione (Insulina per Miociti, Adipociti e
Neuroni) ed è inferiore alla sua concentrazione ematica 5mM
(80-130 mg/100ml)
Al contrario il glucosio entra liberamente nelle cellule del
Fegato e Pancreas ed in esse la sua concentrazione è simile a
quella ematica.
Trasportatore di glucosio nei mammiferi
I trasportatori di glucosio sono membri di una superfamiglia di
trasportatori detta superfamiglia dei facilitatori maggiori (MF), che
trasportano zuccheri in organismi molto diversi, come Escherichia coli,
Trypanosoma brucei (che causa la Tripanosomiasi africana o malattia del
sonno africana) e la specie umana.
La famiglia dei trasportatori di glucosio
Nome
Localizzazione cellulare
Km
Commenti
GLUT1
Tutti i tessuti dei mammiferi
1mM
Captazione basale del glucosio
GLUT2
Fegato e cellule del pancreas 15-20 mM Nel Pancreas svolge un ruolo di regolazione
dell’insulina
Nel Fegato rimuove dal sangue il glucosio in
eccesso
GLUT3
Tutti i tessuti dei mammiferi
plasmatiche
5 mM
La quantità presente nelle membrane
delle cellule muscolari aumenta in risposta
all’esercizio fisico protratto
GLUT5
Intestino tenue
1mM
GLUT4
Tessuto muscolare e cellule adipose
Captazione basale del glucosio
---
Principalmente un trasportatore di Fruttosio
La Glicolisi
Stadio 1
Stadio 2
Stadio 3
LE TAPPE DELLA GLICOLISI
STEP 1: Fosforilazione del glucosio
DG < 0
ESOCHINASI
DG’°= -16,7 KJ/mol
Il glucosio-6-P (G6P) può tuttavia formarsi anche dal glucosio-1-P prodotto di
degradazione del glicogeno
Esocinasi
Mg++
ΔG'°=-16,7 kJ/mole
ΔG=-33,4 kJ/mole
Conformazione inattiva
L’esochinasi mostra proprietà che
cambiano con il legame del
substrato (induced fit ): il
legame del glucosio al sito attivo
causa variazioni conformazionali.
glucoso
Conformazione attiva
E’ inibita allostericamente
dal suo prodotto glucoso-6-P
Se il gluc-6P non viene consumato
con la stessa velocità con cui è prodotto,
inibisce l'esochinasi fino a quando l'eccesso non sia consumato
Esochinasi è
presente in tutte
le cellule
Glucochinasi è
presente nel
fegato
Attraverso la
fosforilazione il
glucosio si
mantiene
all’interno della
cellula non
riuscendo ad
oltrepassare la
membrana
citoplasmatica
STEP 2: Isomerizzazione del glucosio6P in fruttosio6P
E’ una reazione di
isomerizzazione
reversibile
Fosfoglucosio
isomerasi
DG’°= 1,7 KJ/mol
L’isomerizzazione attiva il
C-3 per la scissione nella
successiva reazione
catalizzata dall’aldolasi
Fosfoglucoso isomerasi
ΔG'°=+1,7 kJ/mole
ΔG=-2,5 kJ/mole
STEP 3: Fosforilazione del fruttosio-6-P
DGo’ = -14,2 kJ/mol
Reazione irreversibile
Fosfofruttochinasi 1
Fosfofruttocinasi 1
Mg++
ΔG'°=-14,2 kJ/mole
ΔG=-22,2 kJ/mole
FOSFOFRUTTOCHINASI (PFK)
Enzima oligomerico formato da 4 protomeri,
a loro volta costituiti da varie subunità
ADP
Fru 1,6bisphoaphate
Due subunità
del tetramero
Regolazione allosterica dell’attività enzimatica della PFK
FOSFO FRUTTOCHINASI
+
+
-
Fruttosio 2,6 bifosfato
ATP
AMP
ADP
Citrato
Fruttosio 1,6 bifosfato
Pi
PFK l’attività quando lo stato energetico è basso
PFK
l’attività quando lo stato energetico è ALTO
FOSFOFRUTTOCHINASI (PFK)
Per la molteplicità degli effettori chimici l’enzima è denominato: enzima
allosterico plurivalente. Infatti il sito allosterico cui si lega il citrato è
distinto da quello per ATP, per cui l’effetto dei due effettori è additivo.
Nel fegato la fosfofruttochinasi 1 è inibita anche dagli acidi grassi liberi.
Mantenendo [fruttoso 6P] cost. la curva
di velocità di sintesi del fruttoso
1,6bifosfato
in
funzione
della
concentrazione di ATP mostra un rapido
decremento dopo aver raggiunto un
valore limite.
Quando la [ATP] supera un valore critico
si ha INIBIZIONE dell’enzima
Curva di saturazione della PFK in funzione
della concentrazione di ATP
FOSFOFRUTTOCHINASI (PFK)
A basse concentrazioni l’ATP si lega al
SITO CATALITICO (> affinità) in forma
di complesso con Mg2+
Ad alte concentrazioni si lega al SITO
ALLOSTERICO diminuendo l’attività
dell’enzima per il fruttoso 6P (< affinità)
Ad alte concentrazioni di ATP la
cinetica della fosfofruttochinasi
muta da iperbolica a sigmoidale
A LIVELLO EPATICO il più potente
attivatore della PFK è il fruttosio 2,6bifosfato, la cui azione si manifesta a
concentrazioni basse anche 10 volte
inferiore
agli
altri
regolatori
(ATP;AMP,citrato..)
STEP 4: Demolizione dell’esoso in triosi
La reazione è
reversibile e
all’equilibrio è
favorita la
DGo’ = -23,9 kJ/mol
formazione di
fruttoso 1,6bifosfato
(89% rispetto all’11%
dei 2 triosi).
Affinché la reazione
possa procedere da
sinistra a destra uno
dei 2 triosi deve
essere rapidamente
rimosso.
Aldolasi
ΔG'°=+23,8 kJ/mole
ΔG= -1,3 kJ/mole
Condensazione Aldolica
Aldolasi
della classe 1
C6 trasformato in 2 C3
(DHAP, Gly-3-P)
Le aldolasi degli animali
sono della classe I
Queste aldolasi formano
basi di Schiff intermedie
legate
covalentemente
tra il substrato e una
lisina nel sito attivo
dell’enzima
STEP 5: Isomerizzazione dei triosofosfati
Diidrossiacetone fosfato e gliceraldeide 3 fosfato
interconvertibili, in una reazione di isomerizzazione
sono
Una reazione redox
intramolecolare con
meccanismo eno-diolo
(chetoso)
96%
(aldoso)
4%
La reazione procede comunque verso la G3P, in quanto questa ultima viene
rimossa molto velocemente dalla reazione successiva.
Da 1 molecola di fruttoso1,6 bifosfato, mediante reazioni sequenziali di
Aldolasi e triso fosfato isomerasi, si ottengono 2molecole di G3P
Trioso fosfato isomerasi
L’enzima è costituita da un nucleo centrale di otto foglietti e otto a- elica con regioni di connessione.
Questo motivo strutturale, chiamato barile a, è stato
riscontrato anche in uno dei domini della piruvato chinasi
Regioni di connessione
-foglietto
a-elica
Triosofosfato isomerasi
ΔG'°=+7,5 kJ/mole
ΔG= + 2,5 kJ/mole
STEP 6: ossidazione della gliceraldeide 3 fosfato
Ossidazione (deidrogenazione) seguita da fosforolisi
DGo’ = +6,3 kJ/mol
Legame ad alta energia
tra l’acido fosforico e il
gruppo carbossilico legame
da anidride mista
Acil fosfato
La reazione si dice accoppiata in quanto l’energia
derivante
dall’ossidazione
dell’aldeide
viene
utilizzata per la formazione del leg.fosfo-anidridico
Gliceraldeide-3-fosfato
deidrogenasi
ΔG'°=+12,6 kJ/mole
ΔG=-3,4 kJ/mole
La gliceraldeide 3fosfatodeidrogenasi è un tetramero che puo’ legare 4
molecole di NAD+ una per subunità
La sua attività è dipendente dalla
integrità di un gruppo –SH in
corrispondenza
di ogni sito
attivo
REAZIONE
DI ADDIZIONE (1):
il gruppo aldeidico
della G3P forma
con il gruppo SH
dell’enzima un
TIOSEMIACETALE che viene
ossidato dal NAD+ legato
all’enzima formando un
TIOESTERE (ricco di en.) (3)
FOSFOROLISI:
Si libera l’acil-fosfato e
l’enzima ripristina la sua
conformazione iniziale(5)
Un residuo di cisteina è coinvolto nella
catalisi
fosforolisi
deidrogenazione
Struttura della Gliceraldeide 3-fosfato
deidrogenasi
Il primo
dominio
lega il NAD+
Il polipeptide si ripiega in due
domini distinti:
Il secondo
dominio lega
la gliceraldeide 3P
Dominio a cui si lega
la Gliceraldeide - 3 - fosfato
Subunità dell’enzima Gliceraldeide - 3 - fosfato
deidrogenasi
STEP 7: 1° Fosforilazione dell’ADP
Sebbene l’equilibrio sia
termodinamicamente
spostato verso dx, la
reazione è tuttavia
reversibile consentendo la
generazione di ATP nel
processo glicolitico:
tuttavia quando viene
richiesta la sintesi del
glucoso (gluconeogenesi)ha
luogo la formazione del
1-3BPG a spese di ATP
DGo’ = -18,9 kJ/mol
Fosforilazione a livello del substrato
STEP 8: Trasferimento intramolecolare del
radicale fosforico
Scambio
reversibile di un
gruppo fosfato tra
il C-2 e il C-3 del
glicerato
FOSFOGLICERATO
MUTASI
Mg++
Mutasi: enzimi che catalizzano il trasferimento di un raggruppamento da una
parte all’altra della molecola che conserva la propria identità
Isomerasi:catalizzano una modificazione di identità del substrato.
FOSFOGLICERATO
MUTASI
Il 2-3 bifosfoglicerato
cede all’enzima il Pi in
posizione 3, formando 2
fosfoglicerato
(reazione 3)
Questo gruppo Pi si lega
temporaneamente ad un
residuo di istidina (His)
dell’enzima (generando
la forma attiva dell’enz.)
per essere poi ceduto al
3 fosfoglicerato
( il substrato della
reazione) che si
converte in 2,3
bifosfoglicerato
e così via
Fosfoglicerato cinasi
Mg++
ΔG'°=-37 kJ/mole
ΔG =+ 2,7 kJ/mole
Il gruppo P scambiato è trasportato
temporaneamente da un residuo di His
dell’enzima
Fosfoglicerato mutasi
ΔG'°=+8,8
kJ/mole
ΔG= +1,6
Mg++
La fosfogliceromutasi
richiede quantità
catalitiche del 2-3bifosfoglicerato
Gli ERITROCITI hanno un
contenuto di 2,3 bifosfoglicerato
(4mM) più elevato delle altre,
perché lo utilizzano non solo come
cofattore nella glicolisi, ma anche
come modulatore dell’affinità
dell’emoglobina per l’ossigeno.
Per questo ricavano il 2,3 BFG dal
1,3 BFG per azione di una
MUTASI(bifosfoglicerato mutasi)
1,3 BFG
2,3 BFG
Il 2,3 BFG può essere defosforilato in 3-fosfoglicerato dalla 2,3
bifosfoglicerato.
La trasformazione del 1,3 bifosfoglicerato in 3 fosfoglicerato per azione
successiva di mutasi e fosfatasi implica l’abolizione di formare ATP nella
reazione catalizzata dalla fosfoglicerato chinasi. Infatti in base alla
richiesta maggiore di ATP o di 2,3-bisfofoglicerato, gli eritrociti
utilizzano la normale via metabolica della glicolisi, oppure questo bypass
metabolico..
G3P
1,3 bifosfoglicerato
ADP
ATP
CHINASI
3 fosfoglicerato
MUTASI
2,3 bifosfoglicerato
FOSFATASI
Pi
STEP 9:Formazione del fosfoenolpiruvato (PEP)
composto ad alta energia
DGo’ = 1,8 kJ/mol
DG0’ per l’idrolisi del fosfato varia da –17.6 kJ/mol nel 2PG a –
61.9 kJ/mol nel PEP.
STEP 10: 2° Fosforilazione dell’ADP
Piruvico Chinasi
Forma
Enolica
La seconda fosforilazione
dell’ADP a livello del substrato
Forma
chetonica
STEP 10: 2° Fosforilazione dell’ADP
LA PIRUVICO CHINASI
è inibita da alti livelli di ATP(meccanismo allosterico)
è attivata da parte del fruttosio-1,6-bifosfato
(attivazione feedforward). In tal modo si assicura
che il carbonio che fluisce attraverso la glicolisi
completi il suo passaggio e non si abbia accumulo di
intermedi
è inibita dall’acetil-CoA (inibizione da prodotto).
Questa inibizione permette di ridurre il flusso
attraverso la glicolisi qualora sia disponibile un
substrato non zuccherino
LA PIRUVICO CHINASI
E’ presente nei tessuti in tre forme isoenzimatiche:
la M nel muscolo e cervello
La L nel fegato che è influenzata dalla dieta e dagli ormoni.
Il digiuno, condizione che favorisce la gluconeogenesi, ne diminuisce
la quantità e il GLUCAGONE che pure stimola la gluconeogenesi, ne
diminuisce l’attività stimolando la fosforilazione dell’enzima
(Forma fosforilata è meno attiva)
L’insulina fa aumentare per induzione,la quantità dell’enzima
AZIONE ANTAGONISTA DEL GLUCAGONE E DELL’INSULINA
Glucagone +
Insulina
La A negli altri tessuti
-
Sito attivo e regolazione della
Piruvico chinasi
Attivato allostericamente
da AMP e Fru-1,6-bisP
Inibito allostericamente da
ATP e acetil-CoA
GLUCOSIO
2 ATP
2 NAD+
2 ADP
2- Gliceraldeide -3- PO4
2 NADH + 2H+
4 ADP
2 molecole di PIRUVATO
La glicolisi genera:
4 ATP
2 molecole di ATP e 2 NADH + 2 H+
2 ATP vengono usati per aggiungere gruppi fosfato al glucosio e
al fruttosio -6-P
(- 2 ATP)
4 ATP si generano per trasferimento diretto
Glucosio + 2 ADP + 2 Pi + 2 NAD+
(+ 4 ATP)
2piruvati + 2 ATP + 2 NADH + 2 H+
Gli enzimi glicolitici possono formare
complessi multienzimatici nelle cellule
Quando le proteine sono purificate da estratti di
cellule lisati in soluzioni diluite, le interazioni nonconvalenti possono essere distrutte
Evidenze cinetiche e fisiche suggeriscono che gli
enzimi della glicolisi possono assemblarsi in
complessi multienzimatici, dove i prodotti
intermedi sono incanalati direttamente da un
enzima ad un altro, senza entrare nelle soluzioni
acquose, un fenomeno chiamato “substrate
channeling”.
Gli enzimi glicolitici molto
probabilmente formano
complessi multienzimatici.
REGOLAZIONE DELLA GLICOLISI
Solitamente le reazioni della glicolisi sono facilmente reversibili, eccetto
quelle catalizzate dall'esochinasi, dalla fosfofruttochinasi (PFK) e dalla
piruvatochinasi (PK), che fungono da punti di regolazione della glicolisi.(DG
< 0 e grande)Il tasso di glicolisi nei mammiferi è controllato proncipalmente a
livello della PFK, e parzialmente a livelli dell’esochinasi e della PK.
La fosfofruttochinasi, principale elemento
di controllo della glicolisi, catalizza una
reazione esoergonica irreversibile che
permette al glucosio di entrare nella via
glicolitica (escludendo il ciclo dei pentosifosfati), è attiva quando è necessario
produrre energia oppure precursori, ma
viene inibita da alte concentrazioni di ATP
e di citrato, (CIA)
La piruvatochinasi, altro sito di controllo, è
inibita allostericamente da Acetil CoA.
Altri substrati della glicolisi
Metabolismo del fruttosio
Il fruttosio
Il fruttosio (o levulosio) è un monosaccaride contenuto normalmente nella
frutta. Presenta basso potere cariogeno, fornisce 4 Kcal /g, e il suo potere
edulcorante, circa 1,5 volte superiore a quello del saccarosio, consente un
risparmio calorico minimo. Sebbene il metabolismo del fruttosio sia
indipendente dall'insulina, quando viene superata la quantità di 40 g/die
esso viene trasformato in glucosio. Per questo motivo le persone diabetiche
non devono oltrepassare il limite massimo di assunzione giornaliera di 40 g
di fruttosio; in questo calcolo va tenuto presente anche la quota presente
negli alimenti specifici per diabetici, spesso molto elevata.
In quantità elevate il fruttosio può causare diarrea, dolori addominali e
flatulenza. Trattandosi di una sostanza naturale, è perfettamente innocua
(motivo per cui non ne è stata stabilita la DGA), ma deve essere usato con
precauzione nelle persone con alterata funzione renale e gravi disturbi al
fegato.
Assorbimento del fruttosio
L’assorbimento del fruttosio avviene per
diffusione facilitata ed è mediato dal
trasportatore GLUT-5.
Il fruttosio viene rapidamente rimosso dal
lume intestinale, tuttavia elevati carichi
alimentari possono superare la capacità
del trasportatore con conseguente
incompleto assorbimento e rapida
Fermentazione
Metabolismo del galattosio
Metabolismo del mannosio
DESTINO DEL PIRUVATO…..
Il piruvato è anche
un precursore in
molte reazioni
anaboliche.
Quando l’ossigeno sarà disponibile,
questo debito sarà pagato con la
riossidazione del Lattato a Piruvato e con
la completa ossidazione di quest’ultimo.
L’acido piruvico rappresenta un composto centrale del metabolismo
Ha numerosi destini alternativi specie nelle cellule e nei Microorganismi
anaerobi. In tutti i casi, è il substrato di eccellenza da ridurre per
smaltire l’eccesso di NADH prodotto dalla glicolisi
Lieviti
Eucarioti superiori
Pathways del Piruvato
In condizioni ANAEROBIE il piruvato
è convertito in acido lattico o etanolo
Fermentazione Lattica
Rigenerazione del NAD+
quando manca O2
(la glicolisi continua comunque)
Il NADH proviene dall’OX della G3P
Nei muscoli,globuli rossi e
nei lattobacilli è molto
attiva.
Se O2 è disponibile invece, NADH è
Ossidato nel trasporto elettronico,
producendo ATP nell’ossidazione
fosforilativa.
I lattobacilli fermentano il Glucosio trasformandolo in acido lattico.
Il batterio Lactobacillus è anche un componente della flora batterica umana
normale del tratto urogenitale
dove, grazie alla sua capacità di generare un ambiente acido, impedisce la
crescita di batteri nocivi.
La straordinaria efficienza della
GLICOLISI ANAEROBIA delle Cellule Embrionali e Tumorali
spiega la loro capacità a sopravvivere e moltiplicarsi anche in condizioni di
scarso apporto di ossigeno.
Fermentazione alcolica
Presente solo negli organismi
alcool fermentativi
Presente in molti organismi,
tra cui l’uomo
La rigenerazione del NAD+ (nella fermentazione lattica
o etanolo) mantiene così il flusso di Glicolisi in condizioni
anaerobiche
Da ox della
G3P
EFFETTO PASTEUR
Quando le cellule, capaci di metabolizzare il glucoso sia
anaerobicamente che aerobicamente, sono mantenute in condizioni
aerobiche, consumano meno glucoso e formano meno acido lattico di
quando sono in condizioni anaerobiche. L’osservazione di tale fenomeno
oggi spiegabile dalla maggior resa energetica della glicolisi aerobica
rispetto a quella anaerobica e dal fatto che in presenza di ossigeno il
piruvato non viene ridotto a lattato ma ossidato a CO2 portò Pasteur
ad enunciare che “L’OSSIGENO INIBISCE LA GLICOLISI”
In condizioni aerobiche la fosforilazione ossidativa mitocondriale del
piruvato produce una elevata quantità di ATP. Se si considera che
l’aumento di ATP e la concomitante diminuzione di ADP inibisce
l’attività della fosfofruttocinasi 1 si comprende come in condizioni
aerobiche il flusso glicolitico abbia a diminuire.
DESTINO AEROBICO DEL PIRUVATO
PIRUVATO
DEIDROGENASI
DECARBOSSILAZIONE OSSIDATIVA
Il piruvato prodotto dalla glicolisi o dall’ox del lattato passa nei mitocondri
attraverso la membrana mitocondriale interna in forma protonata tramite carrier
specifico.
La PIRUVICO DEIDROGENASI è un complesso enzimatico sito nella porzione più
interna della membrana mitocondriale interna e costituito da3 unità: piruvato
deidrogenasi, deidrolipoil acetiltransferasi, deidrolipoil deidrogenasi
PIRUVATO DEIDROGENASI
E1 = piruvato deidrogenasi cui si lega al tiamina pirofosfato (TPP)
E2 = deidrolipoil acetiltransferasi cui è legato l’acido lipoico
E3 = deidrolipoil deidrogenasi cui è legato il FAD
Destino del piruvato…….
Il piruvato entra nel
mitocondrio grazie
ad una proteina
trasportatrice,per
essere
decarbossilato ad
Acetil CoA ed
entrare nel ciclo di
krebs
ΔG'°=-33,4 kJ/mol
REGOLAZIONE DELLA PDH
La PDH è controllata mediante inibizione feedback
dai suoi prodotti di reazione (acetilCoA e NADH);
questo può essere razionalizzato pensando che
l’enzima funzioni in modo da produrre acetil-CoA e
NADH
in
modo
che
vengano
utilizzati
immediatamente.
L’enzima è stimolato da PEP, presumibilmente per segnalare la necessità di
degradare il piruvato velocemente ed evitare un intasamento del flusso
glicolitico.
PDH è stimolata anche da AMP, il cui accumulo indica carenza di ATP.
REGOLAZIONE DELLA PDH
Forma fosforilata
INATTIVA
Forma defosforilata
ATTIVA
PYA= piruvato
FOSFORILAZIONE ad opera di una CHINASI
Acetil CoA
ADP
Mg++
Piruvato
NADH
NAD+
ATP
TPP
+
-
DEFOSFORILAZIONE ad opera di una FOSFATASI
Ca++
NADH
Mg++
Acetil CoA
INSULINA
+
-
Funzioni tessuto-specifiche
della glicolisi negli animali
Globuli rossi
Esclusivamente per energia
Muscoli scheletrici
Fonte di energia, soprattutto durante lo sforzo
intenso
Tessuto adiposo
Fonte di glicerolo-P per la sintesi di trigliceridi
Fonte di acetil-CoA per la sintesi di acidi grassi
Fegato
Fonte di acetil-CoA per la sintesi di acidi grassi
Fonte di glicerolo-P per la sintesi di trigliceridi
IL CICLO DI CORI
Nei vari tessuti animali la glicolisi e la gluconeogenesi si svolgono in modo
differenziato, nel senso che in alcuni tessuti la glicolisi è molto attiva
mentre la gluconeogenesi molto poco.
Questo è il caso del muscolo scheletrico.
Nel fegato la situazione è opposta. Quando il
muscolo lavora in
anaerobiosi il lattato formato va in circolo e giunge al fegato dove viene
convertito in glucosio, che tramite il circolo giunge al muscolo.
I prodotti della glicolisi anaerobica
• 2 molecole di piruvato
• 4 molecole di ATP (meno le due usate per
l’attivazione del glucosio)
• 2 molecole di NADH
Destino del piruvato
• In presenza di ossigeno: il piruvato entra nel
mitocondrio, viene trasformato in acetil-CoA che,
a sua volta, entra nel ciclo di Krebs.
L’ossidazione continua poi in catena
respiratoria.
• In assenza di ossigeno (anossia): nel citoplasma
il piruvato può essere convertito in molteplici
prodotti finali a seconda degli enzimi presenti;
tutte queste reazioni hanno comunque lo scopo
di riossidare il NADH, coenzima della
Gliceraldeide-3-PDH.