Tensione di vapore delle soluzioni
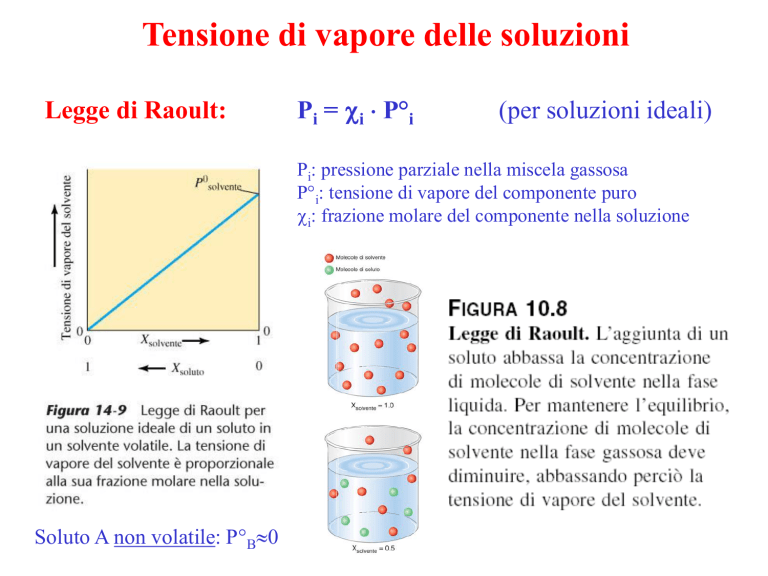
Legge di Raoult:
Pi = i P°i
(per soluzioni ideali)
Pi: pressione parziale nella miscela gassosa
P°i: tensione di vapore del componente puro
i: frazione molare del componente nella soluzione
Soluto A non volatile: P°B0
Soluzioni ideali a due componenti (volatili)
P = PA + PB
(legge di Dalton)
PA = A P°A; PB = B P°B (legge di Raoult)
P = A P°A + B P°B
Soluzione ideale: le forze
attrattive A-B devono essere simili
alle forze attrattive A-A e B-B
(es. benzene-toluene)
Soluzioni non ideali con deviazioni positive
Le forze attrattive A-B sono più deboli delle forze attrattive A-A e
B-B (Teb più bassa; es. acqua-etanolo; etanolo-benzene)
Processo endotermico
Soluzioni non ideali con deviazioni negative
Le forze attrattive A-B sono più forti delle forze attrattive A-A e
B-B [Teb più alta; es. acqua-acido (legami idrogeno); acetonecloroformio]
Processo esotermico
Soluzioni reali diluite si avvicinano al comportamento ideale
Distillazione (miscele ideali)
l+v
vapore
liquido
0,45
0,73
Teb(toluene): 110,6°C
Teb(benzene): 80,1°C
Distillazione frazionata
0,2
Alla fine: benzene quasi puro come distillato
e toluene quasi puro come residuo
Distillazione frazionata
Distillazione (miscele non ideali)
Raoult:
dev. positive
Raoult:
dev. negative
Da sinistra: etanolo quasi puro come
residuo e azeotropo come distillato
Da destra: benzene quasi puro come
residuo e azeotropo come distillato
Da sinistra: cloroformio quasi puro come
distillato e azeotropo come residuo
Da destra: acetone quasi puro come
distillato e azeotropo come residuo












