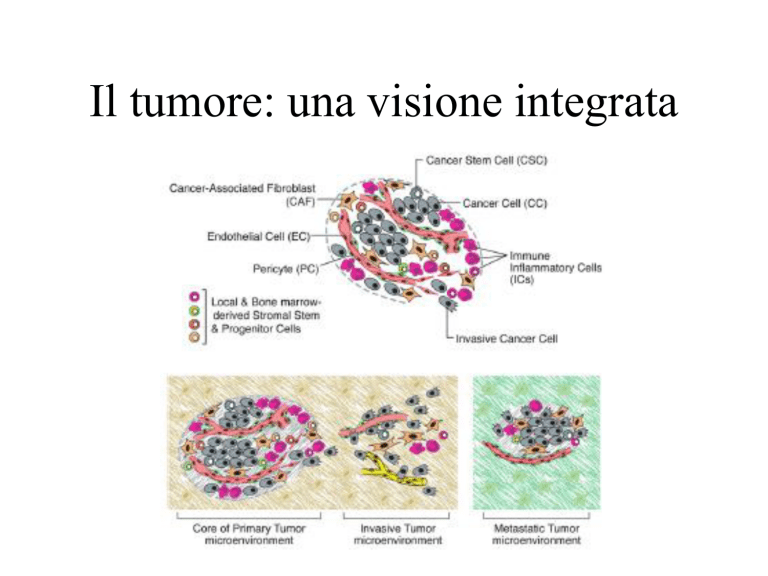
Il tumore: una visione integrata
La cellula tumorale acquisisce
queste caratteristiche mediante
mutazioni
alterazioni epigenetiche
La resistenza delle cellule umane
alla trasformazione tumorale
• Le nostre cellule hanno una serie di
meccanismi/checkpoints formidabile per arrestare
il processo di trasformazione tumorale
• Nelle nostre cellule si accumulano moltissime
mutazioni, ma la trasformazione tumorale rimane
un evento raro
• Singole mutazioni sono quindi insufficienti per la
trasformazione tumorale:
– modello “multi-step” della trasformazione tumorale
I checkpoint sono una barriera
fisiologica al processo di trasformazione
tumorale
La senescenza cellulare è un evento
comune di risposta anti-tumorale
• Nei:
– Mutazione della chinasi BRAF:
• Attivazione di segnali di crescita incontrollati
– Replication stress
– Attivazione di DnaDamageResponse (DDR)
– Senescenza cellulare (documentata in vivo nella
cute umana)
• Quanti altri casi???
La progressione tumorale
• Il tumore rappresenta un’entitá dinamica
nelle sue stesse fondamenta genetiche
• La semplice descrizione delle anomalie
genetiche perció é insufficiente per farci
capire come “funziona”
• Occorre una visione “integrata” della storia
naturale del tumore, nei vari stadi della sua
progressione
Teoria della selezione clonale
• In base a questo modello, la tumorigenesi si puó
considerare come l’espansione seriale di cloni successivi di
cellule, caratterizzati dall’acquisizione di mutazioni che
conferiscono un vantaggio selettivo di crescita nei
confronti delle popolazioni cellulari circostanti
• Per arrivare ad un fenotipo tumorale maligno, é necessaria
una serie di alterazioni. Una sola alterazione genetica di
per sé puó essere controllata da meccanismi di risposta
cellulari
• Le alterazioni sono prevalentemente genetiche, ma
alterazioni “epigenetiche” e quindi stabilmente ereditabili
di pattern di espressione genica sono anch’esse importanti
Emergenza sequenziale di subcloni. Un processo di selezione
competitiva fra I subcloni coesistenti porta all’emergenza del
subclone maligno “vincente”, che peró puó acquisire nel tempo
nuove alterazioni genetiche dando origine ad eterogeneitá
genetica
Progressione lineare o “caotica”?
• Nella visione classica, mutazioni emergono
che portano via via all’emergenza di cloni
con maggiore malignità
• Nella visione che tiene conto di alcuni
risultati più recenti, più cloni (derivati da
una unica cellula di origine del tumore, ma
caratterizzati da eterogeneità genetica)
possono coesistere contemporaneamente
nella massa tumorale
Modelli di progressione tumorale
Modello
monoclonale
Modello
policlonale
I vantaggi dell’eterogeneità
clonale
• La presenza di più cloni fornisce la capacità
di esplorare il “paesaggio di fitness” (fitness
landscape) con maggiore efficienza
– Uno dei subcloni può trovarsi in vicinanza di
uno dei picchi di fitness, e quindi avvicinarsi ad
esso mediante un numero di eventi mutazionali
basso
– Dopo terapia, uno dei subcloni –ancora- può
trovarsi vicino ad uno dei nuovi picchi di
fitness imposti dai farmaci
A: condizioni di base
B: dopo terapia
Un esempio: recidiva di leucemia
• Sequenziamento completo del genoma di cellule
leucemiche all’esordio, e dopo la prima recidiva: uno dei
subcloni diventa il clone dominante, acquisendo nuove
mutazioni
Selezione clonale e cellule staminali tumorali
Patogenesi molecolare dei tumori
Mutazioni ed instabilitá
genomica
• Alcuni numeri “agghiaccianti”:
– 1014 cellule/uomo;
– 1016 divisioni cellulari/durata della vita media;
– 10-6/10-7 frequenza di mutazioni/gene/divisione
cellulare
Ogni gene umano é mutato 10 miliardi di volte
durante la nostra vita!!!
• La maggior parte di queste mutazioni non sono trasmissibili
perché non avvengono nelle cellule germinali
Geni associati alla trasformazione
neoplastica
• Oncogeni: l’”acceleratore” bloccato
• Oncosoppressori: I “freni” malfunzionanti
• Instabilitá genomica: guida in stato di
ubriachezza
Modelli teorici di soppressione
tumorale
• L’inattivazione di un gene il cui prodotto funge da
mediatore in un pathway lineare dá come risultato
l’inattivazione dell’intero pathway.
• In questo caso, l’inattivazione successiva di un altro
componente dello stesso pathway non conferirebbe
ulteriori vantaggi selettivi alla cellula che presenta la prima
mutazione, e quindi la mutazione successiva non sarebbe
osservabile nel tumore emergente.
Visione integrata di oncogeni ed
oncosoppressori
• Aldilá del singolo gene, quello che occorre considerare é la
necessitá per la cellula tumorale di raggiungere
l’inattivazione di un determinato pathway
• Tale inattivazione si puó raggiungere per attivazione di un
oncogene, o per inattivazione di un oncosoppressore
• Questa visione ci consente di classificare I geni in base al
pathway cui appartengono: geni appartenenti a pathway
diversi (p.es. Rb e p53) sono spesso mutati nella stessa
cellula tumorale
Analisi di geni in tumori
In ognuno dei tre maggiori pathway oncosoppressori, l’inattivazione di
Un componente preclude l’inattivazione degli altri componenti.
Riarrangiamenti cromosomici nelle
leucemie acute e nei tumori solidi
• Nei tumori del sistema ematopoietico, vi sono caratteristici
riarrangiamenti cromosomici associati a determinati tipi di
leucemie;questi riarrangiamenti sono direttamente
coinvolti nella patogenesi del tumore;
• Nei tumori solidi, le anomalie cromosomiche sono molto
piú eterogenee,e non sempre chiaramente associate alla
patogenesi del tumore;
Conseguenze delle traslocazioni
cromosomiche
• Alterazioni nel pattern di espressione
• Alterazioni di sequenza aminoacidica
(proteine di fusione)
Amplificazione
• Per amplificazione genica si intende un
aumento nel “copy number” (>6 copie per
genoma diploide) di una specifica regione
subcromosomica (1-2Mb o meno)
• Apparenza citogenetica:
– Extracromosomale, come piccoli corpi di
cromatina (double-minute bodies)
– Integrata cromosomalmente, con la formazione
di un HSR (homogeneously stained region)
Conseguenze dell’amplificazione
genica
• Aumentati livelli di espressione di uno o piú geni
• Teoricamente, l’iperespressione di tali geni deve conferire
un vantaggio selettivo per la crescita della cellula tumorale
• In pratica, I geni coinvolti sono di due tipi:
– Oncogeni
– Geni per la resistenza a determinati chemioterapici
• Altri geni amplificati: c-erbB2 nei tumori della mammella,
cyc-D, L-myc.
Nuove informazioni sulla rilevanza
dell’amplificazione genica nei tumori
• Costituzione di vari consorzi internazionali
(> importante: TCGA) per il
sequenziamento massivo di tumori
• Questi studi dimostrano che “copy number
variation” (quindi amplificazioni-delezioni)
sono il fenomeno > frequente (> mutazioni)
nella maggior parte dei tumori
Quanti sono i geni mutati in un
tumore ?
Next Generation Sequencing
• Progresso delle tecnologie di sequenziamento del
DNA e riduzione dei costi
– sequenziamento del genoma umano (3,000,000,000 di
basi) negli anni ’90-inizio 2000: >5 anni, $300,000,000
– L’ALTRO IERI (2010): sequenziamento del genoma
umano di J. Watson in 1-3 mesi, $350,000!!!
– IERI (2011): sequenziamento di 1 genoma in 1
settimana, 50,000$
– OGGI: 1-10,000 genomi/anno
– DOMANI: 1 genoma in 4..... MINUTI per < $1,000!!!
How was this achieved?
• Integration (Think about sequencing pipeline)
• Parallelization
• Miniaturization
Same concepts that revolutionarized integrated
circuits
Massively parallel sequencing
• Sequenziamento tradizionale: regioni di DNA
vengono isolate, clonate in plasmidi (o simili),
amplificate mediante crescita in batteri e quindi
cloni individuali vengono sequenziati
• Sequenziamento parallelo: il DNA da analizzare
viene frammentato e (senza essere clonato) viene
immobilizzato su una superficie solida (un vetrino,
p.es.), quindi viene amplificato via PCR e poi ogni
singolo frammento viene sequenziato
contemporaneamente
Sequenziamento sistematico del
DNA dei tumori
• Prima analisi completata nel 2007: circa 20
tumori (colon e mammari)
– Sequenziamento degli esoni trascritti (non
dell’intero genoma) per circa 20,000 geni dal
tessuto normale e dal tumore
• Geni mutati nel tumore rianalizzati in altri 25
pazienti per avere una idea della frequenza di
mutazioni riscontrate per quel gene nei tumori
– I più interessanti sono sequenziati in altri 100 pazienti
Alcuni conti
• Identificate in media ≈ 80 mutazioni/tumore
• Le mutazioni interessano geni diversi in
tumori di tipo diverso (colon vs mammari)
Il paesaggio “mutazionale” dei
tumori
Considerazioni
• Pochissimi sono i geni mutati
frequentemente in molti tumori (5):
– “MONTAGNE”
• La maggior parte dei geni identificati sono
mutati raramente in alcuni tumori:
– “COLLINE”
Due tumori del colon:
praticamente due diverse malattie
Chi conta di più?
• Le ricerche si sono concentrate in passato
sulle “montagne”, che sono state scoperte
prima con le tecnologie disponibili
• In realtà le “colline” rappresentano la
situazione più frequente
– Le “colline” sono molto numerose, ma il
numero di “pathways” colpito è minore (più
colline appartengono allo stesso pathway)
Il primo tumore umano
interamente sequenziato
AML con cariotipo normale
(100,000,000,000bp sequenziate!!!)
Variazioni o mutazioni?
Mutazioni “driver” (che portano a variazioni
funzionali importanti per il fenotipo tumorale)
vs mutazioni “passenger” (neutrali, dovute
all’instabilità del genoma delle cellule
tumorali)
La progressione tumorale “da
vicino”
Sequenziamento di tumori
primari/mestastasi dallo stesso
paziente
Mutazioni in tumori pancreatici
metastatici
• Due tipi di mutazioni
– Founder (presenti sia
nel tumore primario
che in tutte le
metastasi)
– Progressor (presenti
solo in una o più
metastasi)
La geografia della progressione
tumorale
• Le cellule che danno
inizio a metastasi hanno
già accumulato le
mutazioni “progressor”
nel tumore primario
• Diverse cellule (con
diverso spettro di
mutazioni progressor)
danno origine a diverse
metastasi
Il sequenziamento di
diverse regioni del
tumore/metastasi
rivela uno spettro di
mutazioni: comuni a
tutte
le
lesioni
tumorali,
comuni
solo
al
tumore
primario,
comuni
solo alle metastasi,
“uniche”
per
ciascuna
regione
sequenziata.