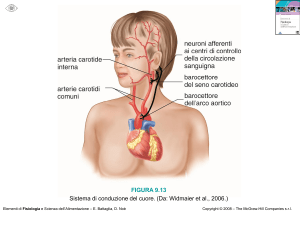
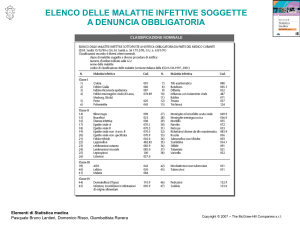
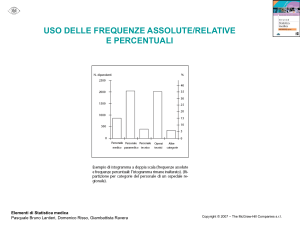
Fondamenti di chimica organica
Janice Gorzynski Smith
University of Hawai’i
Capitolo 20
Acidi carbossilici e i loro derivati – La sostituzione nucleofila acilica
Prepared by Rabi Ann Musah
State University of New York at Albany
Copyright © The McGraw-Hill Companies, Inc. Permission required for reproduction or display.
Fondamenti di chimica organica
Janice Gorzynski Smith
1
Copyright © 2009 – The McGraw-Hill Companies srl
Acidi carbossilici e i loro derivati
Derivati degli acidi carbossilici :
Fondamenti di chimica organica
Janice Gorzynski Smith
2
Copyright © 2009 – The McGraw-Hill Companies srl
Acidi carbossilici e i loro derivati
Derivati degli acidi carbossilici :
Fondamenti di chimica organica
Janice Gorzynski Smith
3
Copyright © 2009 – The McGraw-Hill Companies srl
Acidi carbossilici e i loro derivati
Derivati degli acidi carbossilici —Introduzione
Tipi di anidridi:
Tipi di ammidi:
Fondamenti di chimica organica
Janice Gorzynski Smith
4
Copyright © 2009 – The McGraw-Hill Companies srl
Acidi carbossilici e i loro derivati
Derivati degli acidi carbossilici —Introduzione
Nitrili:
Fondamenti di chimica organica
Janice Gorzynski Smith
5
Copyright © 2009 – The McGraw-Hill Companies srl
Acidi carbossilici e i loro derivati
Nomenclatura—Cloruri degli acidi
• Per i cloruri degli acidi acilici: cambiare il suffisso –ico
dell’acido carbossilico progenitore con il suffisso –ile; oppure
• Quando il gruppo –COCl è legato ad un anello: cambiare il
termine acido carbossilico nel termine –carbonil cloruro.
Fondamenti di chimica organica
Janice Gorzynski Smith
6
Copyright © 2009 – The McGraw-Hill Companies srl
Acidi carbossilici e i loro derivati
Nomenclatura—Anidridi
• Le anidridi simmetriche sono nominate cambiando il nome
dell’acido progenitore con il termine anidride.
• Le anidridi miste, che derivano da due acidi carbossilici diversi,
sono nominati invece mettendo in ordine alfabetico il nome dei
rispettivi acidi carbosilici progenitori e cambiando la parola
acidi nel termine anidride.
Fondamenti di chimica organica
Janice Gorzynski Smith
7
Copyright © 2009 – The McGraw-Hill Companies srl
Acidi carbossilici e i loro derivati
Nomenclatura—Anidridi
Fondamenti di chimica organica
Janice Gorzynski Smith
8
Copyright © 2009 – The McGraw-Hill Companies srl
Acidi carbossilici e i loro derivati
Nomenclatura—Esteri
• Nominare R’ come gruppo alchilico. Questo diventa la prima
parte del nome.
• Nominare il gruppo acilico cambiando il suffisso ico
dell’acido carbossilico con il suffisso –ato.
• Gli esteri sono spesso scritti come RCOOR’, dove il gruppo
alchilico (R’) è scritto dopo. Quando si nomina l’estere però,
il gruppo R’ appare all’inizio del nome.
Fondamenti di chimica organica
Janice Gorzynski Smith
9
Copyright © 2009 – The McGraw-Hill Companies srl
Acidi carbossilici e i loro derivati
Nomenclatura—Ammidi
• Tutte le ammidi 1° sono nominate rimpiazzando i suffissi ico, -oico, o -ilico con il suffisso ammide.
Fondamenti di chimica organica
Janice Gorzynski Smith
10
Copyright © 2009 – The McGraw-Hill Companies srl
Acidi carbossilici e i loro derivati
Nomenclatura—Ammidi
• Nominare il gruppo (o i gruppi) alchilici legati all’atomo N
dell’ammide. Usare il prefisso “N-” davanti al nome di ogni gruppo
alchilico per evidenziare che è legato ad un atomo di azoto. Questo
diventa la prima parte del nome.
• Per le ammidi 3°, usare il prefisso di- se i due gruppi alchilici sull’N
sono uguali. Se i due gruppi alchilici sono differenti, elencarli in ordine
alfabetico. Un “N-” è necessario per ogni gruppo alchilico, anche se
entrambi i gruppi R sono identici.
• Nominare il gruppo acilico sostituendo i suffissi –ico, -oico, o –ilico
con il suffisso ammide.
Fondamenti di chimica organica
Janice Gorzynski Smith
11
Copyright © 2009 – The McGraw-Hill Companies srl
Acidi carbossilici e i loro derivati—La sostuzione
nucleofila acilica
Nomenclatura—Nitrili
• In contrasto con i derivati degli acidi carbossilici, i nitrili sono
nominati come derivati degli alcani.
• Trovare la catena più lunga che contiene il CN ed
aggiungere la parola nitrile al nome dell’alcano
corispondente. Numerare la catena mettendo il CN al C1,
ma omettere questo numero dal nome.
• I nomi comuni dei nitrili sono derivati dai nomi degli acidi
carbossilici che hanno lo stesso numero di atomi di carbonio
sostituendo il suffisso –ico dell’acido carbossilico con il
suffisso –onitrile.
• Quando il CN è nominato come un sostituente viene
12
chiamato guppo ciano.
Fondamenti di chimica organica
Janice Gorzynski Smith
Copyright © 2009 – The McGraw-Hill Companies srl
Acidi carbossilici e i loro derivati—La sostuzione
nucleofila acilica
Nomenclatura—Nitrili
• Nel nominare un nitrile, il carbonio del CN è un carbonio
della catena più lunga. CH3CH2CN è il propanonitrile,
non etanonitrile.
Fondamenti di chimica organica
Janice Gorzynski Smith
13
Copyright © 2009 – The McGraw-Hill Companies srl
Acidi carbossilici e i loro derivati—La sostuzione
nucleofila acilica
Fondamenti di chimica organica
Janice Gorzynski Smith
14
Copyright © 2009 – The McGraw-Hill Companies srl
Confronto fra composti carbonilici (aldeidi
chetoni) e derivati degli acidi carbossilici
e
• La presenza o l’assenza di un gruppo uscente sul
carbonio carbonilico determina il tipo di reazioni che
questi composti subiscono.
Fondamenti di chimica organica
Janice Gorzynski Smith
15
Copyright © 2009 – The McGraw-Hill Companies srl
Confronto fra composti carbonilici (aldeidi
chetoni) e derivati degli acidi carbossilici
e
I composti carbonilici reagiscono con nucleofili.
Fondamenti di chimica organica
Janice Gorzynski Smith
16
Copyright © 2009 – The McGraw-Hill Companies srl
Confronto fra composti carbonilici (aldeidi
chetoni) e derivati degli acidi carbossilici
e
Aldeidi e chetoni reagiscono con nucleofili per formare
prodotti di addizione attraverso un processo a due stadi:
attacco nucleofilo, seguito da protonazione.
Fondamenti di chimica organica
Janice Gorzynski Smith
17
Copyright © 2009 – The McGraw-Hill Companies srl
Confronto fra composti carbonilici (aldeidi
chetoni) e derivati degli acidi carbossilici
e
• Il risultato finale è che si rompe il legame , si formano
due nuovi legami , e l’idrogeno H e il nucleofilo Nu
sono addizionati al legame .
Fondamenti di chimica organica
Janice Gorzynski Smith
18
Copyright © 2009 – The McGraw-Hill Companies srl
Confronto fra composti carbonilici (aldeidi
chetoni) e derivati degli acidi carbossilici
e
I composti carbonilici legati a gruppi uscenti reagiscono con i
nucleofili per formare prodotti di sostituzione attraverso un
processo a due stadi: attacco nucleofilo, seguito dalla perdita del
gruppo uscente.
Il risultato finale è che il Nu sostituisce Z (reazione di sostituzione
nucleofila). Questa reazione è spesso chiamata sostituzione
nucleofila acilica.
19
Fondamenti di chimica organica
Janice Gorzynski Smith
Copyright © 2009 – The McGraw-Hill Companies srl
Confronto fra composti carbonilici (aldeidi
chetoni) e derivati degli acidi carbossilici
e
• L’addizione nucleofila e la sostituzione nucleofila acilica hanno
quindi il primo stadio in comune (l’attacco nucleofilo al carbonio
carbonilico, elettrofilo) per formare un intermedio tetraedrico.
• La differenza fra le due reazioni è quello che accade nella
successiva reazione dell’intermedio.
• Le aldeidi e i chetoni non possono dare sostituzione perchè non
hanno un gruppo uscente legato al carbonio intermedio ibridato
sp3, appena formatosi.
Questo è invece possibile nei derivati degli acidi in cui Z
è in ogni caso un buon gruppo uscente, con le seguenti considerazioni:
20
Fondamenti di chimica organica
Janice Gorzynski Smith
Copyright © 2009 – The McGraw-Hill Companies srl
Ordine di reattività:
Fondamenti di chimica organica
Janice Gorzynski Smith
21
Copyright © 2009 – The McGraw-Hill Companies srl
Ordine di stabilità
• Tre strutture di risonanza stabilizzano i derivati degli acidi
carbossilici (RCOZ) attraverso la delocalizzazione della
densità elettronica.
• Più le strutture di risonanza 2 e 3 contribuiscono all’ibrido,
più stabile risulta RCOZ.
Fondamenti di chimica organica
Janice Gorzynski Smith
22
Copyright © 2009 – The McGraw-Hill Companies srl
Acidi carbossilici e i loro derivati
• Poichè la basicità di Z determina la stabilità relativa dei
derivati degli acidi carbossilici, ne risulta il seguente ordine
di stabilità:
• Riassumendo, come la basicità di Z aumenta, la stabilità di
RCOZ aumenta a causa dell’aumento della stabilizzazione
che deriva dalla risonanza.
Fondamenti di chimica organica
Janice Gorzynski Smith
23
Copyright © 2009 – The McGraw-Hill Companies srl
Acidi carbossilici e i loro derivati
Fondamenti di chimica organica
Janice Gorzynski Smith
24
Copyright © 2009 – The McGraw-Hill Companies srl
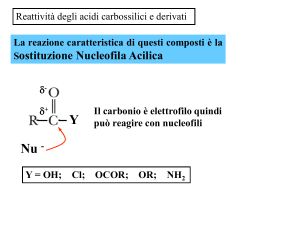
La sostituzione nucleofila acilica
• La sostituzione nucleofila acilica è la reazione caratteristica
dei derivati degli acidi carbossilici.
• Questa reazione avviene sia con
negativamente che con nucleofili neutri.
Fondamenti di chimica organica
Janice Gorzynski Smith
nucleofili
carichi
25
Copyright © 2009 – The McGraw-Hill Companies srl
La sostituzione nucleofila acilica
• Nucleofili che partecipano a questa reazione sono:
Fondamenti di chimica organica
Janice Gorzynski Smith
26
Copyright © 2009 – The McGraw-Hill Companies srl
La sostituzione nucleofila acilica
Per disegnare il prodotto di ogni sostituzione nucleofila
acilica:
[1] Trovare il carbonio ibrido sp2 con il gruppo uscente.
[2] Identificare il nucleofilo.
[3] Sostituire il nucleofilo al posto del gruppo uscente. Con un
nucleofilo neutro, un protone deve essere eliminato per
ottenere un prodotto di sostituzione neutro.
Fondamenti di chimica organica
Janice Gorzynski Smith
27
Copyright © 2009 – The McGraw-Hill Companies srl
La sostituzione nucleofila acilica
In base a questo ordine di reattività, i composti più reattivi
possono essere convertiti nei meno reattivi. La reazione inversa è
di solito molto più difficoltosa.
Fondamenti di chimica organica
Janice Gorzynski Smith
28
Copyright © 2009 – The McGraw-Hill Companies srl
La sostituzione nucleofila acilica
Reazioni dei cloruri degli acidi
• I cloruri degli acidi reagiscono prontamente con i
nucleofili per formare prodotti di sostituzione
nucleofila.
• Come sottoprodotto si forma generalmente HCl.
• Una base debole come la piridina viene aggiunta alla
miscela di reazione per rimuovere l’acido forte (HCl),
formando un sale di ammonio.
Fondamenti di chimica organica
Janice Gorzynski Smith
29
Copyright © 2009 – The McGraw-Hill Companies srl
La sostituzione nucleofila acilica
Reazioni dei cloruri degli acidi
I cloruri acilici reagiscono con nucleofili ossigenati per
dare anidridi, acidi carbossilici ed esteri.
Fondamenti di chimica organica
Janice Gorzynski Smith
30
Copyright © 2009 – The McGraw-Hill Companies srl
La sostituzione nucleofila acilica
Reazioni dei cloruri degli acidi
• I cloruri acilici reagiscono anche con ammoniaca ed ammine 1°
e 2° per formare rispettivamente ammidi 1°, 2° e 3°.
• Si usano due equivalenti di NH3 o di ammine.
• Un equivalente agisce come nucleofilo per sostituire il Cl,
mentre l’altro reagisce come base con l’HCl che si forma dando
un sale d’ammonio.
Fondamenti di chimica organica
Janice Gorzynski Smith
31
Copyright © 2009 – The McGraw-Hill Companies srl
La sostituzione nucleofila acilica
Reazioni dei cloruri degli acidi
• Per esempio, la reazione di un cloruro acilico con
dietilammina forma l’ammide 30 N,N-dietil-m-toluammide,
comunemente nota come DEET.
• DEET è il principio attivo nei repellenti dgli insetti che
sono attivi contro mosche e zanzare.
Fondamenti di chimica organica
Janice Gorzynski Smith
32
Copyright © 2009 – The McGraw-Hill Companies srl
La sostituzione nucleofila acilica
Reazioni dei cloruri degli acidi
Fondamenti di chimica organica
Janice Gorzynski Smith
33
Copyright © 2009 – The McGraw-Hill Companies srl
La sostituzione nucleofila acilica
Reazioni delle anidridi
• L’attacco nucleofilo avviene ad uno dei gruppi
carbonilici, mentre l’altro diventa parte del gruppo
uscente.
Fondamenti di chimica organica
Janice Gorzynski Smith
34
Copyright © 2009 – The McGraw-Hill Companies srl
La sostituzione nucleofila acilica
Reazioni delle anidridi
• Oltre ai soliti passaggi dell’addizione nucleofila e
dell’eliminazione del gruppo uscente, il meccanismo
prevede anche il trasferimento di un protone.
Fondamenti di chimica organica
Janice Gorzynski Smith
35
Copyright © 2009 – The McGraw-Hill Companies srl
La sostituzione nucleofila acilica
Reazioni delle anidridi
• Le reazioni che portano al trasferimento di un gruppo
acetile sono note come acetilazioni.
Fondamenti di chimica organica
Janice Gorzynski Smith
36
Copyright © 2009 – The McGraw-Hill Companies srl
Acidi carbossilici e i loro derivati—La sostuzione
nucleofila acilica
Reazioni degli acidi cabossilici
• Trattamento di un acido carbossilico con cloruro di
tionile (SOCl2) fornisce un cloruro acilico.
Fondamenti di chimica organica
Janice Gorzynski Smith
37
Copyright © 2009 – The McGraw-Hill Companies srl
La sostituzione nucleofila acilica
Reazioni degli acidi cabossilici
• Benchè gli acidi carbossilici non possano essere
facilmente trasformati in anidridi, gli acidi dicarbossilici
possono essere convertiti in anidridi cicliche per
riscaldamento ad alte temperature.
• Questa è una reazione di disidratazione dal momento
che l’acido perde una molecola di acqua.
Fondamenti di chimica organica
Janice Gorzynski Smith
38
Copyright © 2009 – The McGraw-Hill Companies srl
La sostituzione nucleofila acilica
Reazioni degli acidi cabossilici
• Trattamento di un acido carbossilico con un alcol in
presenza di un catalizzatore acido per formare un estere.
• Questa reazione è detta esterificazione di Fischer.
• La reazione è un equilibrio, e può essere sostata a destra
usando un eccesso di alcol o per rimozione dell’acqua
che si forma.
Fondamenti di chimica organica
Janice Gorzynski Smith
39
Copyright © 2009 – The McGraw-Hill Companies srl
La sostituzione nucleofila acilica
Reazioni degli acidi cabossilici
Fondamenti di chimica organica
Janice Gorzynski Smith
40
Copyright © 2009 – The McGraw-Hill Companies srl
La sostituzione nucleofila acilica
Reazioni degli acidi cabossilici
• L’esterificazione di un acido carbossilico avviene in
presenza di un acido ma non in presenza di base.
• La base rimuove un protone dall’acido carbossilico,
formando l’anione carbossilato, che non reagisce con un
nucleofilo elettron-ricco.
Fondamenti di chimica organica
Janice Gorzynski Smith
41
Copyright © 2009 – The McGraw-Hill Companies srl
La sostituzione nucleofila acilica
Reazioni degli acidi cabossilici
• Gli acidi carbossilici non possono essere convertiti in
ammidi per reazione con NH3 o con un’ammina perchè le
ammine sono basi, e danno una reazione acido-base per
formare un sale di ammonio prima che avvenga la
sostituzione nucleofila.
• Comunque, riscaldamento del sale di ammonio ad alte
temperature (>100°C) disidrata il sale per formare
un’ammide, anche se con basse rese.
Fondamenti di chimica organica
Janice Gorzynski Smith
42
Copyright © 2009 – The McGraw-Hill Companies srl
La sostituzione nucleofila acilica
Reazioni degli acidi cabossilici
• La conversione di RCOOH a RCONH2 richiede due
passaggi:
1] Reazione acido-base di RCOOH con NH3 per formare
un sale di ammonio.
[2] Disidratazione ad alte temperature (>100°C).
Fondamenti di chimica organica
Janice Gorzynski Smith
43
Copyright © 2009 – The McGraw-Hill Companies srl
La sostituzione nucleofila acilica
Reazioni degli esteri
• Gli esteri sono idrolizzati con acqua in presenza sia di
acidi che di basi per formare acidi carbossilici o anioni
carbossilato rispettivamente.
• Gli esteri reagiscono con NH3 ed ammine per formare
ammidi 1°, 2°, or 3°.
Fondamenti di chimica organica
Janice Gorzynski Smith
44
Copyright © 2009 – The McGraw-Hill Companies srl
La sostituzione nucleofila acilica
Reazioni degli esteri
Fondamenti di chimica organica
Janice Gorzynski Smith
45
Copyright © 2009 – The McGraw-Hill Companies srl
La sostituzione nucleofila acilica
Reazioni degli esteri
• L’idrolisi alcalina di un estere è detta saponificazione.
• L’idrolisi è promossa dalla base, non catalizzata dalla base, perchè la base
(OH–) è il nucleofilo che si addiziona all’estere e forma parte del prodotto.
Partecipa alla reazione e non viene rigenerato successivamente.
Fondamenti di chimica organica
Janice Gorzynski Smith
46
Copyright © 2009 – The McGraw-Hill Companies srl
La sostituzione nucleofila acilica
Reazioni degli esteri
• L’anione carbossilato è stabilizzato per risonanza, e
questo sposta l’equilibrio in suo favore.
• Una volta che la reazione è completa e si è formato
l’anione, può essere protonato con un acido forte per
formare un acido carbossilico neutro.
Fondamenti di chimica organica
Janice Gorzynski Smith
47
Copyright © 2009 – The McGraw-Hill Companies srl
Acidi carbossilici e i loro derivati—La sostuzione
nucleofila acilica
Idrolisi dei lipidi
Ricodare che:
Fondamenti di chimica organica
Janice Gorzynski Smith
48
Copyright © 2009 – The McGraw-Hill Companies srl
Acidi carbossilici e i loro derivati—La sostuzione
nucleofila acilica
Idrolisi dei lipidi
• Il primo passaggio nel metabolismo dei triacilgliceroli è
l’idrolisi per formare glicerolo e tre acidi grassi. Questa
reazione è semplicemente l’idrolisi di un estere.
• Nelle cellule, questa reazione è catalizzata dalla lipasi.
Nota: i tre legami del triacilglicerolo disegnati in rosso
vengono scissi per idrolisi.
Fondamenti di chimica organica
Janice Gorzynski Smith
49
Copyright © 2009 – The McGraw-Hill Companies srl
Acidi carbossilici e i loro derivati—La sostuzione
nucleofila acilica
Idrolisi dei lipidi
• Il sapone viene preparato per idrolisi basica o saponificazione di
un triacilglicerolo. Il riscaldamento di un grasso animale o di un
olio vegetale con basi acquose idrolizza i tre esteri per formare
glicerolo ed il sale di sodio di tre acidi grassi. Questi sali sono i
saponi.
Fondamenti di chimica organica
Janice Gorzynski Smith
50
Copyright © 2009 – The McGraw-Hill Companies srl
La sostituzione nucleofila acilica
Reazioni delle ammidi
• Le ammidi sono le meno reattive tra i derivati degli acidi
carbossilici.
• Le ammidi sono idrolizzate in acidi o basi per formare acidi
carbossilici o anioni carbossilato.
• In condizioni acide, l’ammina che si forma viene protonata ad ione
ammonio, mentre in condizioni basiche, si forma un’ammina neutra.
Fondamenti di chimica organica
Janice Gorzynski Smith
51
Copyright © 2009 – The McGraw-Hill Companies srl
La sostituzione nucleofila acilica
Reazioni delle ammidi
• Il meccanismo di idrolisi di un’ammide in condizioni acide è
esattamente lo stesso del meccanismo di idrolisi acida degli
esteri.
• Il meccanismo di idrolisi di un’ammide in condizioni basiche
presenta i soliti due stadi del meccanismo generale per la
sostituzione nucleofila acilica, più un ulteriore trasferimento
protonico.
Fondamenti di chimica organica
Janice Gorzynski Smith
52
Copyright © 2009 – The McGraw-Hill Companies srl
La sostituzione nucleofila acilica
Sommario delle reazioni di sostituzione nucleofila acilica
Fondamenti di chimica organica
Janice Gorzynski Smith
53
Copyright © 2009 – The McGraw-Hill Companies srl
Nitrili
• I nitrili hanno la struttura generale RCN. Due
biologicamente attivi sono il letrozolo e l’anastrozolo.
nitrili
• I nitrili sono preparati per reazioni SN2 tra alogenuri metilici ed
alogenuri alchilici 1° non impediti con ¯CN.
Fondamenti di chimica organica
Janice Gorzynski Smith
54
Copyright © 2009 – The McGraw-Hill Companies srl
Reazioni dei nitrili—Idrolisi
• I nitrili sono idrolizzati con acqua in presenza di acidi o
basi per ottenere degli acidi carbossilici o anioni
carbossilato.
• In questa reazione, i tre legami C—N sono sostituiti da
tre legami C—O.
Fondamenti di chimica organica
Janice Gorzynski Smith
55
Copyright © 2009 – The McGraw-Hill Companies srl
Riduzioni
Generalità sulle Ossidazioni e Riduzioni
• I composti carbonilici sono reagenti o prodotti in reazioni di
ossidazione-riduzione.
Fondamenti di chimica organica
Janice Gorzynski Smith
56
Copyright © 2009 – The McGraw-Hill Companies srl
Ossidazioni e Riduzioni
Le tre reazioni più utili di ossidazione e riduzione dei carbonili
sono:
Fondamenti di chimica organica
Janice Gorzynski Smith
57
Copyright © 2009 – The McGraw-Hill Companies srl
Riduzioni
Riduzione degli Acidi Carbossilici e dei loro Derivati
• LiAlH4 è un riducente forte, che reagisce con tutti i
composti carbonilici.
• L’idruro
di
diisobutilalluminio
[(CH3)2CHCH2]2AlH,
abbreviato come DIBAL-H, ha due gruppi isobutile
ingombranti, che rendono questo reagente meno reattivo
di LiAlH4.
• L’idruro di litio tri-tert-butossialluminio,
LiAlH[OC(CH3)3]3, ha tre atomi di ossigeno elettronegativi
legati all’alluminio, che lo rendono meno nucleofilo di
LiAlH4.
Fondamenti di chimica organica
Janice Gorzynski Smith
58
Copyright © 2009 – The McGraw-Hill Companies srl
Ossidazioni e Riduzioni
• I cloruri acilici e gli esteri possono essere ridotti ad aldeidi o ad
alcoli 1° a seconda del reagente utilizzato.
Fondamenti di chimica organica
Janice Gorzynski Smith
59
Copyright © 2009 – The McGraw-Hill Companies srl
Riduzioni
Riduzione di Acidi Carbossilici e dei loro Derivati
• Nella riduzione di un cloruro acilico, Cl¯ agisce come
gruppo uscente.
• Nella riduzione di un estere, CH3O¯ si comporta come
gruppo uscente, ed è poi protonato dall’H2O per formare
CH3OH.
Fondamenti di chimica organica
Janice Gorzynski Smith
60
Copyright © 2009 – The McGraw-Hill Companies srl
Riduzioni
Riduzione di Acidi Carbossilici e dei loro Derivati
• Il meccanismo spiega perché sono possibili due prodotti diversi.
Fondamenti di chimica organica
Janice Gorzynski Smith
61
Copyright © 2009 – The McGraw-Hill Companies srl
Riduzioni
Riduzione di Acidi Carbossilici e dei loro Derivati
• Gli acidi carbossilici sono ridotti ad alcoli 1° con LiAlH4.
• LiAlH4 è un riducente troppo forte per fermare la
reazione allo stadio di aldeide, ma reagenti più deboli
non sono in grado di attaccare gli acidi carbossilici.
Fondamenti di chimica organica
Janice Gorzynski Smith
62
Copyright © 2009 – The McGraw-Hill Companies srl
Riduzioni
Riduzione di Acidi Carbossilici e dei loro Derivati
• A differenza della riduzione di tutti gli altri derivati degli
acidi carbossilici con LiAlH4, che dà alcoli 1°, la
riduzione delle ammidi con LiAlH4 dà ammine.
• Poiché ¯NH2 è un cattivo gruppo uscente, non viene mai
perso durante la riduzione, e quindi il prodotto finale è
un’ammina.
Fondamenti di chimica organica
Janice Gorzynski Smith
63
Copyright © 2009 – The McGraw-Hill Companies srl
Riduzioni
Riduzione di Acidi Carbossilici e dei loro Derivati
Fondamenti di chimica organica
Janice Gorzynski Smith
64
Copyright © 2009 – The McGraw-Hill Companies srl
Riduzioni
Riduzione di Acidi Carbossilici e dei loro Derivati
Fondamenti di chimica organica
Janice Gorzynski Smith
65
Copyright © 2009 – The McGraw-Hill Companies srl
Reazioni dei nitrili—Riduzione
• Il trattamento di un nitrile con LiAlH4 seguito dal trattamento con
H2O addiziona due equivalenti di H2 al triplo legame, formando
un’ammina 10.
Fondamenti di chimica organica
Janice Gorzynski Smith
66
Copyright © 2009 – The McGraw-Hill Companies srl