Fondamenti di chimica organica
Janice Gorzynski Smith
University of Hawai’i
Capitolo 13
Reazioni radicaliche
Prepared by Rabi Ann Musah
State University of New York at Albany
Copyright © The McGraw-Hill Companies, Inc. Permission required for reproduction or display.
Fondamenti di chimica organica
Janice Gorzynski Smith
1
Copyright © 2009 – The McGraw-Hill Companies srl
Reazioni Radicaliche
Introduzione
• Un significativo gruppo di reazioni prevede intermedi
radicalici.
• Un radicale è un intermedio reattivo con un singolo
elettrone spaiato, che si forma dall’omolisi di un legame
covalente.
• Un radicale contiene un atomo che non ha un ottetto di
elettroni.
• Per mostrare il movimento di singoli elettroni nei
processi radicalici si usano frecce a una sola punta.
Fondamenti di chimica organica
Janice Gorzynski Smith
2
Copyright © 2009 – The McGraw-Hill Companies srl
Reazioni Radicaliche
Introduzione
• I radicali del carbonio sono classificati come primari (1°),
secondari (2°) o terziari 3°.
• Un carbonio radicalico è ibridato sp2 ed è trigonale
planare, come i carbocationi ibridati sp2.
• L’orbitale non ibrido p contiene un elettrone spaiato e si
estende al di sopra e al di sotto del carbonio trigonale
planare.
Fondamenti di chimica organica
Janice Gorzynski Smith
3
Copyright © 2009 – The McGraw-Hill Companies srl
Reazioni Radicaliche
Introduzione
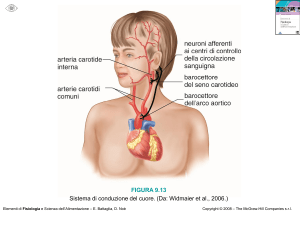
Figura 13.1
Stabilità relativa di radicali
del carbonio 1° e 2°
Fondamenti di chimica organica
Janice Gorzynski Smith
4
Copyright © 2009 – The McGraw-Hill Companies srl
Reazioni Radicaliche
• Un carbonio allilico è un carbonio adiacente a un doppio legame.
• L’omolisi del legame C—H allilico del propene genera il radicale
allilico, che ha un elettrone spaiato sul carbonio adiacente al
doppio legame.
• L’energia di dissociazione di questo processo è inferiore anche a
quella di un legame C—H 30 (91 kcal/mol).
• Questo significa che il radicale allilico è più stabile del radicale
30.
Fondamenti di chimica organica
Janice Gorzynski Smith
5
Copyright © 2009 – The McGraw-Hill Companies srl
Reazioni Radicaliche
• Il radicale allilico è più stabile di altri radicali in quanto
può essere descritto con due strutture di risonanza.
Fondamenti di chimica organica
Janice Gorzynski Smith
6
Copyright © 2009 – The McGraw-Hill Companies srl
Reazioni Radicaliche
Caratteristiche Generali delle Reazioni Radicaliche
• I radicali si formano dalla rottura di legami covalenti per
aggiunta di energia sotto forma di calore () o luce (h).
• Alcune reazioni radicaliche avvengono in presenza di un
iniziatore radicalico.
• Gli iniziatori radicalici contengono un legame
particolarmente debole che serve come sorgente di
radicali.
• I perossidi, composti con struttura generale RO—OR,
sono gli iniziatori radicalici usati più comunemente.
• Riscaldando un perossido si causa l’omolisi del debole
legame O—O, che forma due radicali RO•.
• I radicali danno due principali tipi di reazione—
reagiscono con legami bonds, e si addizionano a
7
Fondamenti
di chimica organica
legami
.
Copyright © 2009 – The McGraw-Hill Companies srl
Janice Gorzynski Smith
Reazioni Radicaliche
Reazione di un Radicale X• con un legame C-H.
• Un radicale X• strappa un atomo di idrogeno da un legame
C—H per formare H—X e un carbonio radicalico.
Reazione di un Radicale X• con un legame C=C.
• Un radicale X• si può anche addizionare al legame di un
doppio legame carbonio—carbonio.
Fondamenti di chimica organica
Janice Gorzynski Smith
8
Copyright © 2009 – The McGraw-Hill Companies srl
Reazioni Radicaliche
Due Radicali che reagiscono l’uno con l’altro
• Un radicale X•, una volta formato, reagisce rapidamente con
qualsiasi specie disponibile, di solito con un legame o
stabile.
• Due radicali reagiscono per formare un legame .
Fondamenti di chimica organica
Janice Gorzynski Smith
9
Copyright © 2009 – The McGraw-Hill Companies srl
Reazioni Radicaliche
Alogenazione degli Alcani
• In presenza di calore o di luce, gli alcani reagiscono con gli
alogeni per formare alogenuri alchilici.
• L’alogenazione è una reazione di sostituzione radicalica.
• L’alogenazione degli alcani è utilizzabile solo con Cl2 o Br2. La
reazione con F2 è troppo violenta, e la reazione con I2 è troppo
lenta per essere di utilità pratica.
• Con un alcano che possiede più di un tipo di atomi di idrogeno,
la reazione può fornire una miscela di alogenuri alchilici.
Fondamenti di chimica organica
Janice Gorzynski Smith
10
Copyright © 2009 – The McGraw-Hill Companies srl
Reazioni Radicaliche
Alogenazione degli Alcani
• Quando un singolo atomo di idrogeno, su un carbonio, viene
sostituito da un atomo di alogeno si ha la monoalogenazione.
• Quando viene usato un eccesso di alogeno, è possibile
sostituire più di un atomo di idrogeno, su un singolo
carbonio, con atomi di alogeno.
• La monoalogenazione può essere ottenuta sperimentalmente
aggiungendo alogeno X2 a un eccesso di alcano.
• Per disegnare i prodotti di alogenazione di un alcano, bisogna
disegnare solo i prodotti di monoalogenazione, a meno che
non sia indicato di fare altrimenti.
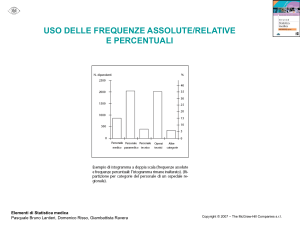
Figura 13.2
Alogenazione completa
di CH4 usando un
eccesso di Cl2
Fondamenti di chimica organica
Janice Gorzynski Smith
11
Copyright © 2009 – The McGraw-Hill Companies srl
Reazioni Radicaliche
Alogenazione degli Alcani—Meccanismo di Reazione
• L’alogenazione radicalica ha tre passaggi distinti:
• Un meccanismo (come l’alogenazione radicalica), che
prevede due o più stadi che si ripetono, è chiamato
meccanismo a catena.
• Gli stadi più importanti dell’alogenazione radicalica sono gli
stadi di propagazione, che portano alla formazione dei
12
Fondamenti
di chimica organica
prodotti.
Copyright © 2009 – The McGraw-Hill Companies srl
Janice Gorzynski Smith
Reazioni Radicaliche—Meccanismo
Fondamenti di chimica organica
Janice Gorzynski Smith
13
Copyright © 2009 – The McGraw-Hill Companies srl
Reazioni Radicaliche
Differenze fra Clorurazione e Bromurazione
•
Malgrado gli alcani subiscano reazioni radicaliche sia con
Cl2 che con Br2, la clorurazione e la bromurazione mostrano
due importanti differenze:
1. La clorurazione è più veloce della bromurazione.
2. La clorurazione non è selettiva, e fornisce una miscela di
prodotti, mentre la bromurazione è spesso selettiva, e
fornisce un prodotto principale.
Fondamenti di chimica organica
Janice Gorzynski Smith
14
Copyright © 2009 – The McGraw-Hill Companies srl
Reazioni Radicaliche
Addizione Radicalica ai Doppi Legami
• L’HBr si lega agli alcheni per formare bromuri alchilici in
presenza di luce, calore o perossidi.
• La regioselettività dell’addizione a un alchene asimmetrico è
diversa dall’addizione di HBr in assenza di luce, calore o
perossidi.
• L’addizione di HBr ad alcheni in presenza di luce, calore o
15
perossidi
avviene con un meccanismo Copyright
radicalico.
Fondamenti
di chimica organica
© 2009 – The McGraw-Hill Companies srl
Janice Gorzynski Smith
Radical Reactions
Addizione Radicalica ai Doppi Legami
Fondamenti di chimica organica
Janice Gorzynski Smith
16
Copyright © 2009 – The McGraw-Hill Companies srl
Reazioni Radicaliche
Addizione Radicalica ai Doppi Legami
•
•
Notare che nel primo stadio di propagazione
(l’addizione di Br• al doppio legame) ci sono due
possibili percorsi:
1. Il percorso [A] forma il radicale 1° meno stabile.
2. Il percorso [B] forma il radicale 2° più stabile.
Il radicale 2° più stabile si forma più velocemente, e
quindi il percorso [B] è favorito.
Fondamenti di chimica organica
Janice Gorzynski Smith
17
Copyright © 2009 – The McGraw-Hill Companies srl
Reazioni Radicaliche
Addizione Radicalica ai Doppi Legami
• Il meccanismo radicalico mostra anche perchè la
regioselettività dell’addizione di HBr dipende dalle
condizioni di reazione.
Fondamenti di chimica organica
Janice Gorzynski Smith
18
Copyright © 2009 – The McGraw-Hill Companies srl