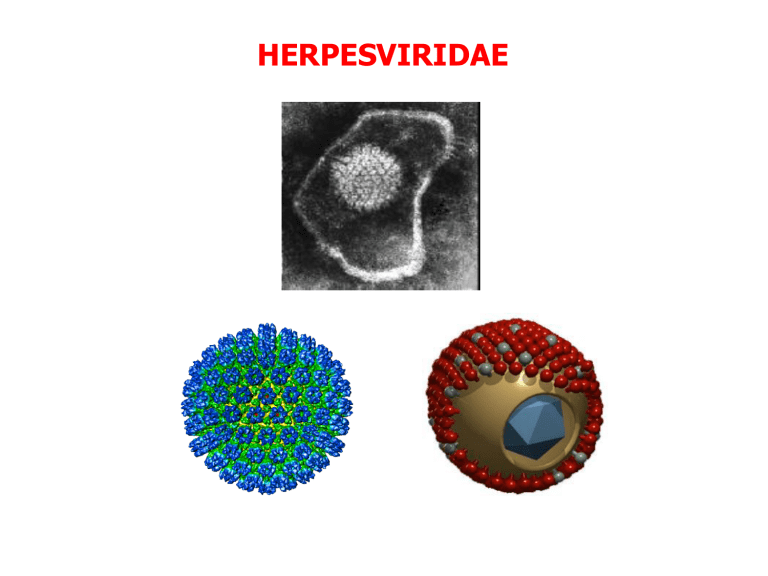
HERPESVIRIDAE
T
O
R
C
H
TOXOPLASMA
OTHERS
ROSOLIA
CMV
HSV
EBV, HBV, HCV, HIV, LISTERIA,
VIRUS INFLUENZA, TREPONEMA PALLIDUM
Caratteristiche della famiglia HERPESVIRIDAE
(da Davis e Dulbecco)
Dimensioni
100-200 nm
Simmetria del capside
icosaedrica
Capsomeri
162, 9,5 x 12,5 A
Envelope lipidico
presente
Sensibilità all’etere e cloroformio
è inattivata l’infettività virale
Biosintesi virale
nucleo
Acido nucleico
DNA a doppio filamento
Sede assemblaggio delle particelle virali
nucleo
Inclusioni
intranucleari, eosinofile
Antigeni comuni di famiglia
nucleo
Herpesvirus
Tutti gli
herpesviruses hanno
una identica morfologia.
Virus erpetico
Nucleocapside
Envelope
Struttura dei virus erpetici
DNA Virale
Glicoproteine
Envelope
Tegumento
Capside
Spikes glicoproteiche sulla superficie dell’HSV
Struttura del capside
Proteina
Gene
MW
Copie per
Capside
VP5
UL19
149,075
960
VP19c
UL38
50,260
375
VP21
UL26
45,000
87
VP23
UL18
34,268
572
VP24
UL26.5
26,618
147
VP26
UL35
12,095
952
Pentone
Esoni
Il capside è costituito da 162 capsomeri
(12 pentoni e 150 esoni) collegati in gruppi
di tre da strutture trivalenti (in verde) e
che sono costituite da VP19C and VP23 .
VP5 costituisce la subunità strutturale
dei capsomeri (esoni e pentoni).
VP26 è localizzata sulla punta distale
degli esoni.
Organizzazione genomica dei virus erpetici
VZV
HSV-1 e HSV-2
EBV
CMV
HHV-6
Mappa genetica dell’HSV-1
Il genoma codifica per circa 80 proteine. La maggior parte dei geni sono
localizzati nelle regioni uniche L ed S, e sono denominati in base alla loro
posizione genomica.
Es.: il gene US6 codifica per gD, una
glicoproteina di membrana coinvolta
nella penetrazione del virus.
UL22 è un’altra glicoproteina (gH).
UL30 codifica per una DNA
polimerasi
DNA dipendente.
L’HSV-1 codifica per proteine
coinvolte in diverse funzioni:
.
(1) Struttura del virus;
(2) Replicazione del DNA;
(3) Attivazione dell’espressione genica;
(4) Soppressione della risposta immune;
(5) Inibizione dell’espressione dei geni cellulari;
(6) Impaccamento del genoma nel capside;
(7) Latenza e riattivazione del virus;
(8) Soppressione delle risposte cellulari all’infezione (es.: apoptosi)
Replicazione dei virus erpetici
Proteine a
Proteine b
Proteine g
LATENZA
CARATTERISTICA FONDAMENTALE DEGLI HERPESVIRUS.
SUPERATA LA FASE ACUTA GLI HERPESVIRUS INSTAURANO
UNO STATO DI LATENZA CHE DURA TUTTA LA VITA E CHE
PUO’ DAR LUOGO A PERIODICHE RIATTIVAZIONI.
VIRUS
SEDE DI LATENZA
HSV 1
- GANGLI DEL TRIGEMINO
CMV
- CELLULE EPITELIALI VARIE
- MONOCITI
EBV
- LINFOCITI
VZV
- GANGLI DI NERVI SENSITIVI
B
CONF. GENOMA
CIRCOLARE
?
CIRCOLARE EPISOMICO
?
HHV 6
?
?
HHV 7
?
?
HHV 8
?
?
Herpetos (greco)
Rettile (natura strisciante)
Replicazione del virus nelle
cellule epiteliali a livello
della sede di ingresso
LATENZA
Sito di latenza
Neurone sensoriale
Trasporto retrogrado
Infezione dei neuroni
sensoriali dei gangli
Sito di latenza
RIATTIVAZIONE
Neurone sensoriale
I virus percorrono al
contrario la stessa via
Stimoli appropriati
riattivano il virus dallo
stato di latenza
Infezione ricorrente
nello stesso sito dell’infezione primaria
Infezione latente e attiva nell’ herpes labiale
Sito dell’infezione
latente
Sito dell’infezione
attiva
Infezione primaria
Latenza
Infezione ricorrente
Riattivazione
Durante la fase di latenza, il genoma è conservato intatto nei neuroni
sensoriali sede della latenza (a-herpesvirus), ma la caratteristica cascate
dell’espressione genica e produzione di proteine è completamente assente.
L’infezione latente può essere distinta in tre fasi: instaurazione,
mantenimento
riattivazione
ALCUNE PROPRIETA’ DI VIRUS DELL’UOMO APPARTENENTI
ALLA FAMIGLIA HERPESVIRIDAE
Sottofamiglie
membri
spettro d’ospite
a - herpesvirinae
HSV-1, HSV-2, VZV
b - herpesvirinae
HCMV, HHV-6, HHV-7
g-herpesvirinae
EBV, HHV-8
ampio
fibroblasti umani
linfociti
latenza in vivo
gangli sensitivi
epiteli, endoteli,
organi linfoidi
organi linfoidi
ciclo riproduttivo
in vitro (ore)
breve (8-14)
prolungato (48-96)
prolungato (3660)
Genoma (Kb)
130-160
160-240
190
G + C%
45-75%
50-60%
60%
gengivo-stomatite,
herpes neonatale,
h. genitale, varicella
asintomatica,
malattia neonatale,
VI m., m.da inclusioni
asintomatica,
mononucleosi
in vitro
infezione primaria
HSV-1 e HSV-2
• alphaherpesvirus
• Virus con envelope, DNA a doppia elica
(genoma di circa 150 kb)
• Il genoma di HSV-1 e HSV-2
condividono il 50 - 70% omologia
• Essi condividono anche diversi epitopi
cross-reattivi. Esiste anche una crossreattività con VZV.
• L’uomo è l’unico ospite naturale dell’HSV
HSV1 e HSV2 50% di omologia
• Trasmissione: contatto diretto
(soprattutto saliva per HSV1 e secrezioni
genitali per HSV2)
• Lesioni mucocutanee localizzate al volto
(HSV1) o alle zone genitali (HSV2)
• Infezione primaria
latenza
recidive
INFEZIONI DA HSV 1 e HSV 2
Infezioni Orofaringee (sono dovute soprattutto ad HSV1)
Asintomatiche negli adulti. Nei bambini sintomatiche,sintomi :febbre
lesioni ulcerose e vescicolose ,edema e gengivostomatite.
Primaria: primi anni di vita: faringite e faringostomatite
Recidiva: tutta la vita: herpes labiale
Infezioni genitali ( sono dovute soprattutto a HSV2).
Lesioni vescicolo-ulcerative apparato genitale.
Primaria: inizio dell’ attività sessuale: sintomatica severa
Recidiva: tutta la vita: sintomatologia meno severa
Infezioni neonatali: rare (1-10/100.000 nati), ma gravi con
localizzazioni muco-cutanee e viscerali causate da HSV2 e acquisite in
utero,durante la nascita (passaggio attraverso il canale del parto), o
dopo la nascita.
Infezione materna primaria: 20-30% di rischio di trasmissione
Infezione materna racidiva: 2-3% di trasmissione
Lesioni da HSV-1
Lesioni erpetiche da contatto
Eczema erpetico
Decorso clinico dell’infezione
primaria
Disseminazione del virus
Sintomi sistemici
Sintomi locali
Vesicole o
Pustole
Ulcere
Croste
Giorno
-5 -4 -3 -2 -1 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21
Contatto
Apparizione
lesioni
Fine del dolore
Immunità
• Le recidive dell’infezione da HSV-1/HSV2
si realizzano in soggetti che hanno
sviluppato una risposta immunitaria contro il
virus,anche se tale risposta risulta incapace
di prevenire totalmente la recidiva, ha
comunque un ruolo importante nel contenere
la gravità dell’infezione erpetica.
Diagnosi
• Esame microscopico diretto delle cellule
prelevate dalla lesione(stirscio di Tzanck
evidenzia corpi inclusi di Cowdry di tipo A).
• Coltura cellulare (HSV produce CPE entro
1-3 giorni in cellule HeLa ,Hep2).
• I test sierologici sono utili solo per la
diagnosi di una infezione primaria da HSV,
non sono utili per la diagnosi di malattie
ricorrenti perché in genere queste non sono
accompagnate da un significativo aumento
del titolo anticorpale.
Tutti I virus erpetici si replicano nel nucleo della cellula infetta.
L’accumulo di proteine virali conduce alla formazioni delle
caratteristiche inclusioni eosinofile intranucleari.
U’altro effetto citopatico è rappresentato dalla formazione di sincizi
Test di immunofluorescenza per gli antigeni
di HSV in cellule epiteliali
Effetto citopatico in cellule in coltura.
Notare l’effetto di arrotondamento delle cellule
Terapia
Acyclovir
– rappresenta attualmente il medicinale di scelta.
E’ disponibile in una serie di formulazioni:
• i.v. (infezioni gravi nei pazienti normali ed
immunocompromessi)
• orale (trattamento e soppressione a lungo termine
delll’herpes mucocutaneo e profilassi nei pazienti
immunocompromessi)
• pomate (infezione della cute e delle mucose)
• Formulazioni per uso oftalmico
Famciclovir e valacyclovir – solo orale, più costoso
dell’acyclovir.
Varicella-Zoster virus
• Appartiene alla sottofamiglia degli
alphaherpesvirus
• Dna a doppio filamento
• Genoma di 125 kbp
Epidemiologia
•La varicella è una delle malattie classiche
dell’infanzia, con la maggior prevalenza tra 4–10
anni
•La maggior parte della popolazione viene infettata
prima dell’età adulta, ma un 10% di giovani adulti
rimane suscettibile.
•L’herpes zoster, al contrario, è sporadico.
Virus varicella-zoster
Manifestazioni cliniche
- manifestazione sistemica esantematica
(varicella) (molto contagiosa)
- manifestazione ricorrente (zoster)
limitata al dermatomero
corrispondente sede latenza
Nei soggetti immunocompromessi la
ricorrenza può assumere andamento
generalizzato
Incubazione circa 14 gg
Comparsa ad ondate successive di lesioni
maculopapulari che si trasformano in
vascicole e successivamente in pustole
Virus varicella-zoster
VZV latentizza
nei gangli spinali
Varicella
VZV si riattiva
dopo molti anni
Zoster
INFEZIONI DA VZV
Infezione primaria: Varicella
Recidiva: Zoster
Varicella:infezione esantematica infantile. Si
contrae per via inalatoria
Incubazione
Macule
Papulette cutanee
Vescicole
Pustole
Croste e
Latenza in
gangli di nervi sensitivi
Stimoli vari
Riattivazione
ZOSTER = vescicole cutanee nella zona
di cute innervata da un nervo sensitivo
Varicella
Varicella
VARICELLA
1/3 DEI CASI
1.5/3 DEI CASI
1-4 aa
DECORSO BENIGNO
5-9 aa
NEL BAMBINO IMMUNO-DEPRESSO
RUSH EMORRAGICO
DIFFUSO
20-30% POLMONITE
1/3 DEI CASI IN GIOVANI
ZOSTER
2/3 IN ANZIANI
COMPLICANZA COMUNE
NPH
NEVRALGIA POSTERPETICA
NEGLI INDIVIDUI IMMUNO-DEPRESSI
VESCICOLE
EMORRAGICHE
SPESSO
DISSEMINATE
Lesioni zosteriformi
Multipla
Trigemino
L1
Thoracic 4th nerve(T4)
Thoracic 10th nerve(T10)
Diagnosi di laboratorio
Le manifestazioni cliniche della varicella o dello
zoster, sono così caratteristiche che raramente si
richiede la conferma in laboratorio. La diagnosi di
laboratorio può essere richiesta solo in caso di
manifestazioni atipiche, particolarmente nel caso di
pazienti immunocompromessi.
• Isolamento virale – raramente effettuato (richiede
2-3 settimane)
• Identificazione diretta – osservazione al microscopio
elettronico del fluido delle vescicole (non può
distinguere tra HSV e VZV). Immunofluorescenza
• Sierologia – la presenza di VZV IgG è indicativa di
passata infezione ed immunità. La presenza di IgM
indica un’infezione primaria recente.
Terapia
• Acyclovir
• Vaccino vivo attenuato
• Immunizzazione passiva
Citomegalovirus
• Il citomegalovirus è un β-herpesvirus
• E’ il più grande di tutti i virus erpetici dell’uomo,
con un genoma di 235 Kb
• La caratteristica istologica dell’infezione da CMV è
la cellula citomegalica ovvero cellula ingrandita che
contiene una grossa e voluminosa inclusione
intranucleare, densa basofila a “occhio di gufo”.
• Dopo l’infezione primaria (contratta nell’infanzia o
nell’adolescenza) il virus permane in forma latente
per tutta la vita.
Citomegalovirus
L’infezione è spesso asintomatica nell’individuo immunocompetente, sia nell’infezione primaria che in quelle
ricorrente.
Sindromi simil-mononucleosica: febbre, linfoadenopatia, faringite.
Grave negli immunocompromessi. Coinvolgimento di molti organi: polmonite, epatite, nefrite, retinite,
encefalite.
La sede dell’infezione primaria è multipla: cellule epiteliali delle mucose e ghiandolari, cellule linfoidi.
La sede della latenza: monociti
Farmaci efficaci:
Ganciclovir: inibitore della sintesi del DNA virale, come terminatore di catena
Foscarnet: inibitore della sintesi del DNA virale, come inibitore non competitivo
Trasmissione: secrezioni 1
sangue 2
organi 3
3
Diffusione
mediante
secrezioni
Diffusione
ematogena
2
fibroblasti,
cell muscolari
lisce
sangue
lumen
1
Trasfusione e trapianto d’organo
• La riattivazione dell’infezione da CMV assume
un’importanza clinica nei soggetti
immunocompromessi e nei trapiantati d’organo.
• La riattivazione dell’infezione latente nel paziente trasfuso e
nei trapiantati d’organo può decorrere asintomatica ma può
anche manifestarsi con forme sistemiche o a prevalente
localizzazione polmonare (polmonite interstiziale), epatica,
cerebrale ed oculare (corioretinite).
• Nei soggetti portatori di trapianto d’organo, la riattivazione
di un infezione citomegalica latente o la trasmissione
dell’infezione con l’organo del donatore, possono essere legate
a fenomeni di rigetto.
INFEZIONI DA CMV
Soggetti sani: 90% asintomatica
2-5% Mononucleosi
5-8% Febbre e rialzo delle transaminasi
Soggetti immunocompromessi:
Polmonite
Epatite
Esofagite
Colite
Febbre protratta
Donne in gravidanza: possibile trasmissione al feto, malattia da
inclusi citomagalici.
TRASMISSIONE AL FETO: 20- 40% se infezione materna
primaria 2-3% se infezione materna
recidivante
INFEZIONE MATERNA PRIMARIA
(quasi sempre asintomatica)
40% TRASMISSIONE
10-15 %
SINTOMATICI ALLA NASCITA
10%
NESSUN
ESITO
90%
SEQUENZE
TARDIVE
85-90 %
ASINTOMATICI ALLA NASCITA
5-15 %
SEQUENZE
TARDIVE
85-95 %
NESSUN ESITO
3/1000 NEONATI HANNO PROBLEMI CLINICI
LEGATI A CMV CONGENITO
CMV
DIAGNOSI DI LABORATORIO
ADULTI IMMUNOCOMPETENTI
INFEZIONE
LATENTE: RICERCA lgG
ACUTA: RICERCA lgM
ISOL. VIRUS URINA
PTS IMMUNOCOMPROMESSI
MALATTIA DA CMV
QUANTIZZARE IL VIRUS
NEL SANGUE
DONNE IN GRAVIDANZA
INFEZIONE PRIMARIA:
NEONATI
SIEROCONVERSIONE
lgM
lgG A BASSA AVIDITA’
INFEZIONE CONGENITA: ISOLAMENTO NEI PRIMI
10 GIORNI
Epstein-Barr virus (EBV).
1958 Burkitt descrisse un tumore nei bambini
africani nelle zone endemiche da Malaria
1964 Epstein scoprì un herpesvirus nelle colture
delle cellule tumorali.
1966 alcuni ricercatori americani scoprirono
l’associazione di questo virus con la mononucleosi, e
il carcinoma naso-faringeo.
Patogenesi
I linfociti B normali in coltura muoiono
rapidamente, mentre EBV aggiunto in coltura
trasforma una parte in linfoblasti che contengono il
genoma virale e continuano a dividersi all’infinito.
Questo processo è noto come immortalizzazione e
ha delle implicazioni per il potere oncogenico del
virus.
In vivo, una volta infettata una persona presenta
nei linfociti B il genoma del virus EBV per tutta la
vita.
INFEZIONI DA EBV
SINDROME
GRUPPO DI ETA’
OSSERVAZIONI
MONONUCLEOSI
INFETTIVA
ADOLESCENTI,
ADULTI GIOVANI
LINFOMA DI
BURKITT
BAMBINI
4-12 aa
AFRICA SUBSAHARIANA E
NUOVA GUINEA
CARCINOMA
NASOFARINGEO
ADULTI
20-50 aa
CINA
LINFOMA A
Linfociti B
BAMBINI E
ADULTI
COSMOPOLITA
IN ALCUNE
IMMUNODEFICIENZE
EBV
PRIMARIA
60% asintomatica nell’infanzia
( o modesta faringite)
TRASMISSIONE ORALE
REPLICAZIONE OROFARINGE
(EPITELIO)
REPLICAZIONE DOTTI GHIANDOLE SALIVARI
INFEZIONE LINFOCITI B
( INF. LATENTE)
Proliferazione autolimitante
CIRCOLO SANG UIGNO
VIRUS
NELLA SALIVA
40%
MI
STIMOLI
RIATTIVAZIONE
ASINTOMATICA
• L’infezione è accompagnata da un aumento degli
enzimi epatici e da linfocitosi.
• I segni clinici della MI sono causati dalla massiva
risposta immunitaria che coinvolge i linfociti T
citotossici diretti contro le cellule B infette da
EBV.
• Le cellule T limitano la crescita delle cellule B e
promuovono la latenza nelle cellule B stesse. Sono
necessarie per il controllo dell’infezione.(Guerra
civile tra cellule B infettate da EBV e cellule T ad
azione protettiva).
•
L’ infezione litica porta alla produzione di proteine
di EBV, compresi gli antigeni precoci, gli antigeni
capside virale e le glicoproteine degli antigeni di
membrana.
Diagnosi
La diagnosi si basa sui sintomi e sui dati di laboratorio che permettono di escludere
malattie da altri agenti come Toxoplasma gondii, Adenovirus e Citomegalovirus.
I test sierologici dosano le IgG e le IgM dirette contro le componenti virali.
antigeni EBV (derivati da diversi componenti del virus)
antigeni VCA (derivati dal capside virale) sono utilizzati per rilevare anticorpi
prodotti nella fase acuta dell’infezione
antigene EBNA-1 è usato per rilevare IgG prodotte nella fase di convalescenza.
antigene precoce D (early antigen D o EA-D) gli anticorpi compaiono nella fase acuta
e, in genere, si riducono a livelli non dosabili dopo 3 - 6 mesi
Stadiazione dell’infezione
nel 5-10% dei casi, IgM contro le proteine del capside virale possono persistere per
diversi mesi dopo l‘infezione.
Evoluzione degli anticorpi durante la MI da EBV
Mononucleosi infettiva diagnosi sierologica
Ig G VCA
Ig M VCA
<5
<10
<5
Si in atto
80-1280
<10
5-10
Si pregressa
40 - 640
<10
20 - 320
5 – 20
Linfoma B
320 - 2560
<10
80 - 1280
10 - 1280
Carcinoma SNF
640 - 5120
<10
160 - 2560
80 - 1280
NO
Ig G EBNA
Ig G EA
<5
5- 160
HERPESVIRUS UMANI TIPO 6 e7
HHV-6 Isolato per la prima volta nel 1986
Sembra implicato in due diverse sindromi:
Roseola infantum( forma febbrile similinfluenzale con rash cutaneo).
Linfoadenopatia negli adulti.
Diagnosi: Ricerca degli anticorpi IgG e IgM
(presenti a basso titolo).
HHV-7 Isolato da cellule mononucleari nel
sangue di individui sani.
Roseala Infantum
HHV – 6
DIAGNOSI
ISOLAMENTO IN COLTURE di PBL IN PRESENZA DI
MITOGENI E FATTORI DI CRESCITA.
PCR
per GENOMA
SIEROLOGIA
IIF usando le linee di PBL
infettate con HHV-6
HHV - 7
-ISOLATO NEL 1989 dai PBL ATTIVATI DI INDIVIDUO
SANO.
- NON E’ STATA PROVATA L’ASSOCIAZIONE CON
MALATTIE DELL’UOMO. (ISOLATO DA BAMBINI CON
SINDROMI FEBBRILI ACUTE)
- OMOLOGIA CON HHV
–6
CIRCA 30%
-CROSS -REATTIVITA’ ANTIGENICA CON HHV
sieroconversione per HHV -6
Ac
82 -93% della popolazione
– 6:
si alza anche
ac anti HHV -7
-SIEROCONVERSIONE TRA IL 1° E IL 2° ANNO DI VITA
-il virus si isola dal 75% delle salive di adulti sani
LATENZA
cellule T CD4 +
-recettore CD4 come HIV
quindi riattivazioni
molto frequenti
HHV-7 DIAGNOSI
EFFETTO CPE sui PBL SIMILE A QUELLO DI HHV-6
PCR per GENOMA VIRALE
Sono stati identificati primer molto specifici
SIEROLOGIA : non significativa
Herpesvirus umano 8 HHV-8
• 1872- Kaposi descrisse 5 casi di sarcoma idiopatico della
pelle.
• Successivamente vennero descritti casi di patologia analoga
che si manifestavano in persone prevalentemente di età
avanzata.
• Negli anni ‘70 si evidenziò una notevole frequenza di casi di
sarcoma di Kaposi in Africa centrale.
• Negli anni ’80 si evidenziò un notevole incremento di casi di
sarcoma di Kaposi negli immunodepressi, sia se sottoposti a
terapie immunosoppressive per trapianto d’organo sia soggetti
affetti da HIV.
• Nel 1994 Chang e Moore dimostrarono che frammenti di
genoma di un herpesvirus denominato HHV-8 era presente
nella quasi totalità dei casi di Kaposi.
-gennaio 97: virus isolato in vitro in colture di linfociti B
16/17 geni studiati
omologia con gammaherpesvirus
omologia con HVS
gammaherpesvirus
disordine linfoproliferativo
policlonale T fulminante
nelle scimmie
HVS
HHV8
EHV2
EBV
HHV7
HHV6
alphaherpesvirus
HSV1
HSV2
EHV1
PRV
HCMV
betaherpesvirus
VZV
HHV-8
• HHV-8 è un γ-herpesvirus e ha un genoma
di 165 Kb oggi completamente sequenziato.
•
• Il DNA virale è rilevabile nella quasi
totalità dei casi di sarcoma di Kaposi nella
lesione neoplastica, mentre è rilevabile nel
sangue periferico con PCR solo nel 50% dei
soggetti infettati.
Kaposi’s Sarcoma












