IL TESSUTO MUSCOLARE
Aspetti generali
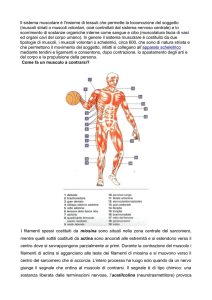
Il muscolo è l’organo che assolve alla funzione del
movimento tramite contrazione.
Mediamente, in un uomo adulto normale il tessuto
muscolare costituisce circa i 2/5 dell’intero peso
corporeo.
L’intera massa muscolare è soggetta ad un
notevole sforzo metabolico anche in condizioni di
riposo, ed è stato stimato che più dei ¾ del
metabolismo totale dell’organismo può essere
attribuito al tessuto muscolare.
Principali componenti(%):
Scheletrico Cardiaco
Liscio
Acqua
72-79
73-79
72-75
Proteine
16-20
16-20
16-20
Lipidi
7.5
8.3
8.0
Fosfolipidi
1.0
1.5
3.3
Glicogeno
0.5-1.0
0.1-1.2
0.3-0.8
Creatina+creatinina 0.3
0.19
0.42
K
0.25
0.35
0.15
Na
0.10
0.17
0.11
Ca
0.007
0.01
0.007
Mg
0.019
0.024
0.011
In base all’aspetto microscopico distinguiamo due tipi di
tessuto: striato e liscio
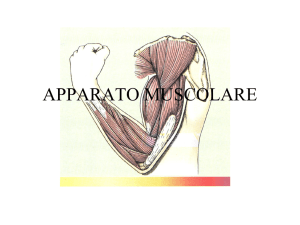
Tessuto muscolare striato
L’unità morfologica scheletrica è la fibra muscolare
striata, caratterizzata lungo l’asse maggiore
dall’alternanza di bande chiare e scure; all’interno di
ogni fibra si trovano elementi fibrillari longitudinali,
le miofibrille, che con la loro disposizione parallela
determinano le striature.
Organizzazzione generale:
Le fibre muscolari sono disposte
parallelamente e sono tenute insieme
da connettivo diviso in:
EPIMISIO: guaina connettivale molto
consistente posta esternamente
PERIMISIO: sepimenti provenienti
dalla faccia interna dell’epimisio che
rivestono più fasci di fibre
ENDOMISIO: sottili setti che si
estendono dal perimisio a circondare
le singole fibre.
Struttura della cellula muscolare:
La membrana plasmatica, il sarcolemma, racchiude il sarcoplasma. La fibra
muscolare è un sincizio contenente numerosi nuclei situati immediatamente sotto
la membrana. La maggior parte del sarcoplasma è occupata dalle miofibrille,
strutture specializzate per la contrazione. La restante porzione del sarcoplasma
contiene piccoli apparati di Golgi, gruppi di mitocondri, gocce lipidiche, granuli
di glicogeno e mioglobina. Un esteso REL, detto reticolo sarcoplasmatico,
circonda le miofibrille.
Le miofibrille:
Presentano una successione di bande scure(bande A) e bande chiare (bande I); ciascuna
banda I risulta divisa in due parti uguali da una stria detta stria Z. La banda A appare
occupata nella parte centrale da una banda più chiara, che prende il nome di banda H
attraversata a sua volta da una linea trasversale netta e sottile, la linea M. Il tratto di
miofibrilla, compreso tra due linee Z contigue, prende il nome di sarcomero e rappresenta
l’unità funzionale del tessuto muscolare striato. Ciascuna miofibrilla consta di una
successione ininterrotta di sarcomeri.
Nella fibra muscolare, le miofibrille mostrano le bande allineate esattamente allo stesso
livello.
I miofilamenti:
Le miofibrille risultano costituite a loro volta da miofilamenti
anch’essi disposti longitudinalmente e paralleli fra loro e sono
di due tipi diversi per dimensione e composizione chimica.
MIOFILAMENTI SPESSI:
Prevalentemente miosina, vanno a costituire la banda A. Tali
filamenti presentano dei piccoli prolungamenti laterali detti
ponti che permettono il contatto con i miofilamenti sottili
durante la contrazione.
MIOFILAMENTI SOTTILI:
Actina, tropomiosina e troponina. Vanno a costituire la banda I
e si ancorano al sarcomero a livello della linea Z.
Struttura tridimensionale dei miofilamenti:
Ogni filamento spesso è costituito da due fasci opposti polari di molecole di
miosina, uniti al centro del filamento. La miosina è un esamero costituito da due
catene pesanti e da due coppie di catene leggere: le due metà C terminali delle due
catene pesanti, si avvolgono tra loro a formare la coda della molecola. Le due metà
N terminali, si avvolgono separatamente a formare due teste. Nelle teste si
concentra l’attività ATPasica; associate alle teste si trovano le catene leggere.
Ogni miofilamento sottile è costituito da due filamenti elicati, risultanti dalla
polimerizzazione di G-actina; in ogni miofilamento sottile, si trovano due filamenti
di tropomiosina alloggiati in prossimità dei solchi tra le due catene intrecciate. Nel
muscolo a riposo la tropomiosina impedisce il contatto tra actina e testa della
miosina. La troponina (proteina globulare) è legata alla tropomiosina e il suo
legame con il calcio, consente la liberazione del sito di legame per le teste della
miosina situate sull’actina.
Reticolo sarcoplasmatico:
Il rel della fibra scheletrica prende il nome di reticolo sarcoplasmatico; risulta formato da una
serie di strutture globulari che circondano ogni miofibrilla in maniera regolare formando una rete.
A intervalli regolari i tubuli longitudinali confluiscono in canali orientati trasversalmente
costituenti ciascuno una cisterna terminale. Nella parte mediana della loro faccia esterna, le
cisterne terminali si associano con un altro elemento tubulare disposto trasversalmente, il tubulo
T. Il lume del tubulo T si apre a livello del sarcolemma, permettendo la comunicazione con lo
spazio extra-cellulare. La funzione del reticolo sarcoplasmatico, si evidenzia a livello della triade.
A muscolo rilasciato, nella cavità delle cisterne terminali vengono immagazzinati ioni calcio.
Nella membrana che delimita tali cavità si trova una ATPasi calcio dipendente in grado di
pompare due ioni calcio dal citosol, idrolizzando un ATP. Il lume contiene calsequestrina, in
grado di sequestrare ioni calcio.
MECCANISMI DI CONTRAZIONE DEL MUSCOLO SCHELETRICO
L’impulso nervoso che dal nervo motore giunge alla
placca neuromuscolare trasmette il potenziale d’azione alle
fibrocellule del muscolo scheletrico depolarizzando il
sarcolemma. A questo fenomeno elettrofisiologico segue la
contrazione muscolare. Per questo motivo questo processo
viene definito con il termine: ACCOPPIAMENTO
ECCITAZIONE-CONTRAZIONE.
Il processo si può dividere in 4 fasi:
-DEPOLARIZZAZIONE/RIPOLARIZZAZIONE
-RILASCIO DI IONI CALCIO
-MODIFICAZIONI CONFORMAZIONALI DELLE PROTEINE
REGOLATRICI
-CICLO CONTRATTILE
POLARIZZAZIONE E DEPOLARIZZAZIONE
La polarizzazione consiste in una
diminuzione dell’elettronegatività
all’interno della cellula a riposo.
Essa
è
seguita
poi
dalla
ripolarizzazione, cioè il ritorno del
potenziale di membrana alle
condizioni iniziali. Tale fenomeno è
dovuto ad una complessa serie di
cambiamenti nei flussi ionici
transmembrana.
Questo complesso sistema permette
di inviare un segnale elettrico alle
cisterne di ioni calcio.
RILASCIO IONI CALCIO
L’arrivo del segnale elettrico causa
l’immediata liberazione di ioni calcio, la
cui concentrazione aumenta di 100 volte. Il
calcio si accumula attorno alle miofibrille,
saturando le TnC e scatenando la
contrazione muscolare.
MODIFICAZIONI CONFORMAZIONALI
DELLE PROTEINE REGOLATRICI
La terza fase comporta la
modificazione conformazionale
delle proteine regolatrici, per cui
i siti di legame dell’actina si
rendono liberi per l’interazione
con la miosina. Non essendo più
inibita
l’actina,
il
ciclo
contrattile può avere inizio.
CICLO CONTRATTILE
Il ciclo contrattile inizia con la formazione di un
intermedio energizzato della miosina dovuto al legame
con l’ATP. La miosina poi si legherà all’actina, prima
tramite un legame semplice, poi con un legame forte, che
determinerà un “colpo di frusta” che accorcerà il
sarcomero.
Il complesso di actina e miosina è l’ACTOMIOSINA.
Terminato l’accorciamento si ha il distacco della miosina a
causa della sostituzione dell’ADP con ATP, che ricaricherà
la miosina che sarà pronta ad un altro ciclo contrattile.
IL MUSCOLO CARDIACO
Caratteristiche intermedie
tra
Muscolo liscio
Contrazioni potenti
Richiesta molta energia
Muscolo striato
Contrazioni continue
Meccanismo intrinseco
Nell’adulto il miocardio consiste in una fitta rete
anastomizzata di cellule muscolari cardiache che si
biforcano e si dispongono in strati (LAMINE)
Il connettivo tra le varie cellule è
ricco di capillari, nervi e fibre del
sistema di conduzione del cuore
Miocardiocita
FORMA: cilindrica
NUCLEO: centrale; mono/bi-nucleata
MORFOLOGIA: estremità irregolarmente ramificate
Disposizione pseudo-striata
DIAMETRO:
5-10 µm
La metà del volume della cellula cardiaca è occupata da
MITOCONDRI
Abbondante è la quantità di GLICOGENO e TRIGLICERIDI
Alto contenuto di MIOGLOBINA
Nelle cellule atriali è contenuto il PEPTIDE NATRIURETICO
ATRIALE, che stimola il riassorbimento di acqua a livello renale
Giunzioni intercellulari
Dischi intercalari: giunzioni termino-terminali a decorso
• TRASVERSALE: numerosi desmosomi - - -> offre
continuità meccanica alle cellule
• LONGITUDINALE: gap-junctions - - -> permettono una
rapida diffusione dello stimolo contrattile da una cellula
all’altra (SINCIZIO FUNZIONALE)
Sarcomero
• Struttura identica a quella del muscolo striato (banda A
+ banda I)
• Il reticolo sarcoplasmatico forma con il tubulo T
strutture dette diadi, in corrispondenza della stria Z
Metabolismo
• Il muscolo cardiaco è il tessuto a più elevato metabolismo
aerobico
• L'attività del muscolo cardiaco può essere regolata dalle
catecolamine (si legano principalmente ai recettori β1adrenergici favorendo, tramite l'attivazione della proteina
chinasi AMPc dipendente, la fosforilazione di strutture come il
fosfolambano)
EFFETTI DELLE CATECOLAMMINE
MUSCOLO CARDIACO
CATECOLAMINE
• Dopamina
• Noradrenalina
• Adrenalina
Questi ormoni sono di origine proteica e sono sintetizzati a partire dalla
fenilalanina. La dopamina è una ammina biogena ottenuta dalla
decarbossilazione della 3,4 Idrossi – fenilalanina (DOPA). La
noradrenalina, è ottenuta per idrossilazione della dopamina. Dopamina
a noradrenalina sono intermedi della adrenalina.
GLI EFFETTI
• DOPAMINA
neurotrasmettitore sintetizzato dai gangli del simpatico
• ADRENALINA E NORADRENALINA
Sintetizzata per la maggior parte dalla midollare surrenale, in minor
parte anche da cervello e gangli del simpatico.
Le catecolamine hanno una notevole importanza perché sono in grado
di influenzare il metabolismo e la funzionalità del cuore e dei vasi. Dal
punto di vista metabolico esse sono fattori di attivazione dei siti
recettoriali di diverse tipi di cellule.
I recettori delle catecolamine sono detti adrenergici e distinti in due tipi
α e β.
RECETTORI (α) e (β) CARDIACI
• (α)
• Effetto inotropo del miocardio senza tachicardia
• (β)
• Lipolisi, effetto inotropo del miocardio con tachicardia
• Accelerazione della fase di rilassamento (fosfolambano)
STIMOLAZIONE DEI RECETTORI CARDIACI (β)
In ogni cellula miocardica si trovano parecchie migliaia di recettori
(β). La stimolazione del recettore (β) porta all’attivazione
dell’adenilato ciclasi, che determina l’aumento dei livelli di AMPc.
L’aumento del nucleotide ciclico determina l’attivazione della
proteina chiansi AMPc dipendente, che fosforila proteine coinvolte
nel meccanismo contrattile del miocardio. Tali fosfoproteine sono
presenti sia nella membrana (per modulare il flusso di ioni calcio), sia
nelle fibre (per modificare la sensibilità al calcio). Il questo modo i
canali del calcio sono più sensibili all’onda di depolarizzazione.
Il calcio, inoltre, stimola l’azione della fosfodiesterasi che inattiva il
nucleotide ciclico in AMP, interrompendo così la risposta amplificata
del segnale ormonale.
IL FOSFOLAMBANO REGOLA LA FASE DI
RILASSAMENTO MUSCOLARE
Un’altra proteina coinvolta nel meccanismo contrattile è il
fosfolambano, situato nella membrana del reticolo
sarcoplasmatico. La proteina funziona da “sensore” di ioni
calcio. Questa proteina viene fosforilata da una proteina Cdk
attivata dall’AMPc. Nella forma fosforilata non esercita più
l’effetto inibitore della pompa del calcio nel reticolo
sarcoplasmatico, accelerando così la fase di rilassamento
muscolare.
STIMOLAZIONE RECETTORI CARDIACI (α)
La stimolazione dei recettori (α) da parte delle catecolamine
genera effetti simili alla stimolazione (β) – adrenergica. Gli
effetti della (α) – stimolazione sono però più blandi.
Il legame ormone – recettore genera una risposta
amplificata che attiva la fosfolipasi C del sarcolamma,
portando alla formazione di Inositolo trifosfato (IP3) e di
Diacilglicerolo (DAG), che a sua volta attiva un proteina
chinasi che fosforila proteine che partecipano alla
contrazione del miocardio.
A differenza della muscolatura scheletrica, che
è specializzata in contrazioni relativamente
intense e di breve durata ed è sotto un fine
controllo della volontà, la muscolatura
viscerale è specializzata in contrazioni
continue, relativamente deboli, in grado di
produrre movimenti diffusi che determinano la
contrazione dell’intera massa muscolare
piuttosto che di singole unità motorie.
La contrattilità è una proprietà intrinseca della
muscolatura
viscerale,
indipendente
dall’innervazione,
con
un
andamento
peristaltico. Essa è influenzata dall’attività del
sistema nervoso autonomo, da ormoni e da
metaboliti locali che la modulano in relazione
alle differenti domande funzionali.
Le cellule del tessuto muscolare sono
relativamente piccole, con un singolo nucleo. Le
fibre, unità funzionali contrattili, sono riunite in
fascicoli irregolarmente ramificati, la cui
disposizione varia considerevolmente da un organo
all’altro, in relazione alle richieste funzionali.
Queste si presentano di forma allungata, fusiforme,
con estremità appuntita o talora biforcata, più corte
delle fibre muscolari. Nei fascicoli le singole fibre
sono disposte più o meno parallelamente le une
alle altre con la parte più spessa di una cellula
accostata alla parte più sottile di della cellula
adiacente. Le proteine contrattili del muscolo liscio
non sono disposte in miofibrille in regolare registro
come nel muscolo scheletrico e cardiaco. Tra le
singole fibre muscolari e tra i fascicoli è presente
tessuto connettivo di supporto.
Muscolatura liscia unitaria e multiunitaria
A seconda del tipo di impulso che ricevono, le cellule muscolari
lisce si possono dividere in unitarie e multiunitarie.
Nella muscolatura liscia unitaria le cellule tendono ad
autogenerare il proprio livello di contrazione ritmica il quale è
trasmesso da una cellula all’altra attraverso le giunzioni gap.
Questo tipo di muscolatura è caratterizzata da contrazioni lente ed
è detto muscolo liscio tonico.
Nella muscolatura liscia multiunitaria l’impulso nervoso
raggiunge ogni singola cellula, controllando in maniera precisa lo
stato di contrazione. Questo tipo di muscolatura è detto
muscolatura liscia fasica ed è caratterizzata da una rapida velocità
di contrazione.
Contrazione del muscolo liscio
Le proteine contrattili delle cellule muscolari lisce si ancorano ad addensamenti
all’interno del citoplasma detti addensamenti focali. La forza generata dalla
contrazione viene trasmessa dagli addensamenti alla membrana plasmatica e da
qui alla lamina esterna, facendo così lavorare una massa di cellule muscolari
lisce come una singola unità funzionale. A differenza dei muscoli striati, la
contrazione delle cellule muscolari lisce si esercita in tutte le direzioni a causa
del diverso orientamento delle fibre contrattili.
Il meccanismo della contrazione può essere così schematizzato:
I filamenti sottili di actina sono associati alla tropomiosina
I filamenti spessi sono costituiti da miosina e si legano all’actina solo se
fosforilati
Il calcio, presente nel reticolo sarcoplasmatico, in seguito a eccitamento della
membrana plasmatica, viene rilasciato nel citoplasma dove si lega alla proteina
calmodulina. Il complesso così formato stimola la formazione del legame tra
actina e miosina i quali, scorrendo fra loro, provocano la contrazione muscolare
Creatina e Fosfocreatina
A partire dal 1907 sono stati effettuati diversi studi sul metabolismo
muscolare che hanno portato a tre conclusioni fondamentali:
1-la contrazione muscolare anaerobica porta alla formazione di acido
lattico;
2-l’acido lattico deriva dal glicogeno e in anaerobiosi la quantità di
acido lattico prodotto uguaglia la quantità di glicogeno scomparso;
3-l’energia per la contrazione deriva dalla metabolizzazione del
glicogeno in acido lattico.
Intorno al 1927 l’attenzione dei
ricercatori fu attratta dai composti
fosforati e, due gruppi di questi,
indipendentemente
isolarono
dal
muscolo la fosfocreatina (PCr):
Sorprendentemente
ulteriori
analisi
condotte sui muscoli non dimostrarono
l’aspettata formazione di acido lattico. A
questo punto l’ipotesi che la contrazione
muscolare derivasse dall’energia liberata
dal processo glicolitico non poteva più
tenere. Doveva essere le scissione della
fosfocreatina a creatina e Pi la responsabile
del processo:
Fosfocreatina Pi+creatina = energia per la contrazione
A quel tempo il processo glicolitico doveva quindi essere
considerato secondario, con funzione di recupero della
creatina e fosfato prodotti a fosfocreatina. Infatti la
scissione della fosfocreatina è più rapida di quella del
gliocogeno e la risintesi della fosfocreatina avviene
quando il muscolo è a riposo, e questo tanto in anaerobiosi
che aerobiosi. Nel 1934 Lohmann dimostrò che “la
primaria operativa sostanza” nella contrazione
muscolare non è la fosfocreatina, ma l’ATP!
La fosfocreatina non è idrolizzata prima dell’ATP, la
fosfocreatina rifosforila l’ADP ad ATP secondo la
reazione (catalizzata dalla creatinacinasi):
ATP + creatina ADP + fosfocreatina
Dal Krebs si producono ATP e la fosfocreatina costituisce
una “riserva energetica” per consentire in modo costante il
mantenimento della concentrazione di ATP nelle cellule
muscolari. La fosfocreatina, che una volta scissa si
ricostruisce a spese solo dell’ATP e perciò rappresenta una
riserva temporanea di d’energia, è contenuta in quantità 3-4
volte superiore all’ATP, e questo consente di mantenere,
entro certi limiti, il normale livello di ATP.
Le iniziali sequenze metaboliche di un muscolo che si contrae
sono quindi così rappresentabili:
ATP ADP + Pi (ATPasi)
fosfocreatina + ADP creatina + ATP (creatina cinasi)
2ADP ATP + AMP (miocinasi, adenilato, cinasi)
AMP IMP + NH4+ (adenosindeaminasi).
Metabolismo Amminoacidico
nel Muscolo
Gli amminoacidi sono assunti nel muscolo scheletrico
attraverso meccanismi di trasporto che sono sotto il
controllo dell’insulina.
Una volta entrati nella cellula, essi sono utilizzati in
parte per ripristinare il pool proteico e in parte per
fornire energia.
Sintesi proteica
Amminoacidi
Fonte energetica (α-chetoacidi)
A tale scopo…gli amminoacidi
non essenziali sono degradati ad α-chetoacidi per transaminazione e
desaminazione e poi ossidati nel Krebs.
essenziali ramificati (valina, leucina, isoleucina) sono transaminati nel
muscolo stesso, ma gli α-chetoacidi che ne derivano sono metabolizzati
nel fegato.
I gruppi amminici derivati da queste reazioni sono trasferiti al
piruvato, con formazione di alanina.
PIRUVATO + AA
ALANINA + α-CHETOACIDO
L’alanina viene quindi trasferita al fegato per essere convertita
ad acido piruvico attraverso transamminazione o
desamminazione; l’acido piruvico intraprende poi la via
gluconeogenica.
Anche il muscolo cardiaco è in grado di
utilizzare amminoacidi come fonte di
energia,
tuttavia
preferenzialmente
glucosio
mancanza di esso, corpi chetonici.
utilizza
e,
in
Metabolismo energetico
del muscolo
Esistono due tipi di cellule striate muscolari: le fibre a contrazione rapida
glicolitiche e quelle a contrazione lenta ossidative.
Le fasce glicolitiche sono bianche, perché contengono una rete capillare poco
sviluppata, meno mitocondri e meno mioglobina rispetto alle fibre ossidative
lente, che appaiono rosse. Le fibre veloci hanno inoltre pochi depositi di lipidi e
un elevato contenuto di glicogeno. Il loro metabolismo impiega il glicogeno e la
glicolisi anaerobia per sostenere improvvise contrazioni, richieste da condizioni
di stress. Le fibre ossidative sono rosse perché abbondantemente perfuse con
sangue, hanno numerosi mitocondri e mioglobina. Queste fibre muscolari hanno
la capacità di sostenere sforzi, non troppo intensi, per lunghi periodi. Le fibre
ossidative lente utilizzano acidi grassi per sintetizzare ATP e quindi richiedono
la presenza di abbondanti mitocondri.
IL MUSCOLO CARDIACO
Il muscolo cardiaco, che si contrae continuamente,
possiede caratteristiche metaboliche e contrattili
molto simili alle fibre muscolari ossidative lente.
Infatti dispone di una fitta rete vascolare (seni
coronarici), è ricco di mitocondri e utilizza
maggiormente acidi grassi della circolazione.
L’ampio uso di acidi grassi avviene in presenza di
elevate concentrazioni di ossigeno, che sono
normalmente presenti nel miocardio, a scapito
della degradazione del glucosio. Questo fenomeno
viene detto “effetto Pasteur“ per inibizione della
fosfofruttochinasi (PFK) da parte sia dell’O2 ,sia
dell’ATP e del citrato.
I MUSCOLI SCHELETRICI
I muscoli scheletrici, deputati a compiere un lavoro meccanico, sono la sede del maggior
consumo d'energia. Essi possono utilizzare acidi grassi, corpi chetonici o glucosio a seconda del
grado di attività muscolare. Nel muscolo a riposo i principali nutrienti sono gli acidi grassi
forniti dal tessuto adiposo e i corpi chetonici provenienti dal fegato. In caso di moderata attività
il muscolo può utilizzare invariabilmente corpi chetonici epatici, acidi grassi o glucosio. Quando
il muscolo esegue un'attività massima, l'apporto di ossigeno e di sostanze nutrienti provenienti
dal sangue, è insufficiente ai bisogni immediati. In tal caso il muscolo, dopo aver demolito
glicogeno endogeno, demolisce il glucosio a lattato nella via anaerobica. Questo sforzo massimo
può continuare, dipendendo dall'allenamento, solo per poco tempo provocando accumulo di acido
lattico che deve essere smaltito. Dopo lo sforzo, il soggetto deve continuare in una respirazione
accelerata per un po' di tempo. La maggior parte dell'ossigeno così assunto viene utilizzato
principalmente dal fegato per produrre ATP da destinare alla sintesi conversione del lattato,
giunto dal muscolo, in glucosio (ciclo di Cori).
Durante il periodo di intensa attività il muscolo scheletrico, che contiene fosfocreatina, può
produrre ATP nella reazione catalizzata dalla creatina chinasi: fosfocreatina + ADP → creatina
+ ATP
ma durante la fase di recupero la fosfocreatina viene rigenerata tramite la reazione inversa:
creatina + ATP —→ fosfocreatina + ADP
PROVENIENZA E TRASPORTO DEGLI
ACIDI GRASSI
Gli acidi grassi, esterificati a trigliceridi (TG), sono trasportati nel
sangue per mezzo delle lipoproteine (chilomicroni e VLDL).
I chilomicroni trasportano i TG della dieta dall’intestino ai tessuti
periferici. In seguito a idrolisi dei chilomicroni, mediata dall’enzima
lipoproteina lipasi, vengono liberati gli acidi grassi, trasportati poi nel
sangue ai tessuti mediante l’albumina.
Le VLDL trasportano i TG, sintetizzati a livello epatico,
dal fegato alla periferia dell’organismo. Le VLDL
perdono i TG attraverso l’azione dell’enzima lipoprotein
lipasi, che li trasforma in IDL e successivamente in LDL.
Gli acidi grassi così liberati possono essere utilizzati dal
muscolo per scopi energetici.
METABOLISMO DELLE LIPOPROTEINE
Metabolismo degli acidi grassi
La funzione energetica dei lipidi si esplica nell’ossidazione degli
acidi grassi
La gran parte dei trigliceridi è depositata nel tessuto adiposo che,
idrolizzandoli, fornisce energia ad altri tessuti, sotto forma di acidi
grassi
Il processo di ossidazione degli acidi grassi è detta: β ossidazione
mitocondriale
La resa energetica di tale processo è molto elevata (circa 9 Kcal/g
contro le 4 Kcal/g ricavate dall’ossidazione di glucidi e proteine)
Le fonti principali di acidi grassi
per la β-ossidazione sono:
dieta (esogeni)
riserve
cellulari
(endogeni)
(essenzialmente trigliceridi negli adipociti).
• Gli acidi grassi della dieta vengono trasportati sotto
forma di trigliceridi tramite i chilomicroni, dapprima
attraverso il circolo linfatico e poi ematico, dall'intestino
agli organi, dove i trigliceridi vengono idrolizzati da
specifiche lipoprotein-lipasi ad acidi grassi e glicerolo.
• Nei tessuti epatico, adiposo e muscolare le cellule
procedono al loro utilizzo o al loro deposito.
Gli acidi grassi liberi sono trasportati agli organi
complessati all'albumina.
Giungeranno ai diversi organi, ove verranno ossidati:
muscolo scheletrico, cuore e fegato.
Attivazione degli acidi grassi
Al loro ingresso nel citosol, gli acidi grassi vengono attivati per conversione
dell’acil-CoA mediante legame tioestere con il coenzima A per azione di un
enzima acilCoA sintetasi (chiamata anche tiocinasi)
Acido grasso + ATP + HS-CoA -------> Acyl-CoA + PPi + AMP
comporta il consumo di due molecole di ATP, perchè l'intermedio di reazione è un
acil-AMP.
TRASLOCAZIONE
Il trasporto all'interno del mitocondrio avviene in forma di:
acilcarnitina
Con l'intervento di due enzimi (carnitina acil-transferasi I e II ) e di una
traslocasi (carnitina-acilcarnitina traslocasi).
La carnitina permette all’Acil-CoA di attraversare la
membrana mitocondriale interna e di entrare nella
matrice dove avviene la β-ossidazione
L’acil-CoA in eccesso può venire ritrasformato in
trigliceride
Trasporto degli acili tramite carnitina
Trasporto degli acidi grassi
attivati, tramite lo shuttle
carnitina all’interno del
mitocondrio
con
un
trasportatore di membrana.
All’interno del mitocondrio
la carnitina viene liberata
e trasportata di nuovo nel
citosol.
L’acido grasso viene unito
al Coenzima A, per
ricostituire l’AcilCoA
Carnitina
β-ossidazione
E’ la rottura ossidativa che
consente il graduale distacco
di frammenti a 2 atomi di C,
in forma di acetil-CoA,
dall’acido grasso attivato ad
acil-CoA
β-ossidazione
Il processo consta di 4
reazioni (stage 1)
L’ossidazione
completa di un acido grasso
a catena pari (n) porta alla
formazione di n/2 molecole
di acil-CoA
Le molecole di acilCoA formatesi entrano nel
ciclo di Krebs
β-ossidazione
enzimi
1. acil-CoA
deidrogenasi
2. enoil-CoA
idratasi
3. b-idrossiacilCoA deidrogenasi
4. tiolisi dell’acilCoA
β-ossidazione: tappa 1
β-ossidazione: tappa 2
β-ossidazione: tappa 3
β-ossidazione: tappa finale
OSSIDAZIONE DI ACIDI GRASSI A NUMERO
DISPARI E POLIINSATURI
La β ossidazione di acidi grassi a numero dispari di atomi di carbonio
porta alla formazione di propionil-CoA che viene convertito a succinilCoA.
Propionyl-CoA (3:0)
(S)-D-Methylmalonyl-CoA
Methylmalonyl-CoA Epimerase
(R)-L-Methylmalonyl-CoA
Succinil CoA
Gli acidi grassi poliinsaturi vanno incontro a β ossidazione,ma
richiedono l'intervento di specifici enzimi che rendono l'acido
grasso aggredibile dagli enzimi della β ossidazione.
1° caso:
β-ossidazione acidi
grassi insaturi
Problema della
configurazione cis
2° Caso
REGOLAZIONE DELLA β-OSSIDAZIONE
REGOLAZIONE A BREVE TERMINE:
1) inibizione della carnitina-aciltransferasi I da malonyl-CoA, i
cui livelli aumentano in seguito all'attivazione da parte dell' insulina
della acetil-carbossilasi.
2) Gli ormoni adrenalina e glucagone attivano la lipasi ormonosensibile del tessuto adiposo e quindi rendono disponibili gli acidi
grassi per la β ossidazione
REGOLAZIONE A LUNGO TERMINE:
1) I livelli della lipoprotein lipasi del tessuto adiposo
aumentano in seguito a stimolazione insulinica (diminuiscono,
invece durante il digiuno).
2) I livelli della lipoprotein lipasi del cuore aumentano durante
il digiuno e diminuiscono in presenza di insulina.
• Il muscolo scheletrico, in condizioni di riposo o di
moderata attività utilizza, oltre agli acidi grassi, corpi
chetonici per preservare le riserve di glicogeno per un
eventuale sforzo intenso.
• I corpi chetonici vengono sintetizzati a livello epatico
e utilizzati dalla corticale del surrene, dal muscolo
scheletrico e cardiaco, dal cervello.
I corpi chetonici sono utilizzati dai tessuti extraepatici
convertendo il beta-idrossibutirrato in acetoacetato e
l'acetoacetato in acetoacetilCoA. La prima reazione è catalizzata
dalla beta-idrossibutirrato deidrogenasi, mentre la seconda è
catalizzata dalla acetoacetato:succinil-CoA transferasi:
Acetoacetato + Succinyl-CoA <------> Acetoacetyl-CoA +
succinato
(Il fegato non possiede la acetoacetato:succinil-CoA transferasi).
L'acetoacetil-CoA viene poi convertito in due molecole di acetilCoA dalla tiolasi:
Acetoacetil-CoA + HS-CoA <------> 2 Acetil-CoA
Molto spesso si sente parlare di acido lattico nei riguardi della prestazione atletica; ad
esso spesso viene data la colpa del dolore muscolare durante l’esercizio, quindi della
fatica:
GLICOLISI ANAEROBICA
La glicolisi anaerobica può portare ad un accumulo di acido lattico che è veicolato al
fegato attraverso il flusso ematico. Nel fegato viene riconvertito a glucosio attraverso
la via gluconeogenetica e ritorna nel circolo sanguigno per raggiungere nuovamente i
muscoli. Questa serie di reazioni è detta “Ciclo di Cori”.
Semplificando si può affermare che il lattato si accumula nel citoplasma
quando la via aerobica (di cui fanno parte complesso della piruvato
deidrogenasi, ciclo di Kerbs, catena di trasporto elettronico e fosforilazione
ossidativa) situata nel mitocondrio non riesce a smaltire il piruvato prodotto;
in questo modo il piruvato interagisce con la lattico deidrogenasi e si
trasforma in lattato. Facendo un paragone si potrebbe paragonare il rubinetto
di un lavandino alla glicolisi, lo scarico alla via aerobica e il lavandino al
citoplasma; fino a quando lo scarico (via aerobica) riesce a svuotare l’acqua
che esce dal rubinetto (piruvato), questa se ne va, ma quando il flusso del
rubinetto sarà maggiore della portata dello scarico allora l’acqua (lattato) si
accumulerà nel lavandino.
Il glucosio trasformato in piruvato entra nel ciclo di Krebs
tramite la piruvato deidrogenasi(PDH),trasformando il piruvato
in acetil-coA. l’acetil-coA in eccesso blocca la PDH attivando
invece la lattico deidrogenasi(LDH)…
CH3
C=O
COOPiruvato
LDH
CH3
HCOH
COOLattato
LDH spinge la reazione verso il Piruvato,che entra nel ciclo dei
TCA,favorito da un elevato rapporto NAD+ /NADH
La lattico deidrogenasi(LDH) è un isoenzima ubiquitario, un
tetramero formato da due tipologie di monomeri:
il tipo H,maggiormente presente nel cuore,e il tipo
M,maggiormente presente nel muscolo.
Da ciò ne derivano 5 forme isoenzimatiche,che differiscono per
composizione strutturale, proprietà biochimiche e cinetiche, e per
diffusione tissutale: LDH1,LDH2,LDH3,LDH4,LDH5
LDH1 è prevalente nel miocardio e nei globuli rossi. Presente
anche nella corteccia renale e nel muscolo scheletrico.
LDH2 è prevalente nel miocardio e nelle emazie, oltre ad essere
presente in pancreas, corteccia renale, polmone e muscolo
scheletrico.
LDH3 è presente in polmoni, placenta, muscolo scheletrico e
pancreas.
LDH4 si trova nella midolla renale, muscolo scheletrico, polmone e
placenta.
LDH5 è caratteristico del fegato. Presente anche nella midolla
renale, muscolo scheletrico e pancreas
Muscolo bianco
Fibre bianche:
•Utilizza ATP prodotto per via anaerobica
•Alti livelli di enzimi glicolitici che degradano glicogeno ad acido lattico
con liberazione di energia( causa delle contrazioni brevi)
•Nella fase di riposo l’acido lattico viene ossidato nel muscolo e nel
fegato (debito d’O2)
•Basso contenuto di mitocondri
•Alto livello di fosfocreatina( riserva di energia)
o
fosfocreatina + ADP cpk
creatina +ATP DG =-11 Kcal/mol
massima velocità di formazione di ATP pH= 6-7 (condizione di
“ipossia”)
miochinasi
•Alternativa di emergenza per la formazione di ATP
2ADP
ATP
+ AMP l’AMP prodotta da questa reazione stimola allostericamente la
PFK e la glicogenolisi
•alternativa per produrre ATP durante un esercizio molto intenso:
AMP + H2O
Adenilico
deaminasi
IMP + NH3
Una diminuzione del ph cellulare,determinata dalla produzione di
acido lattico, e un’aumentata concentrazione di ADP favoriscono
questa reazione attivando la adenilico deaminasi. Gli ioni ammonio
prodotti stimolano la glicolisi,più in particolare la fosfofruttochinasi.
L’acido inosinico(IMP) può essere degradato o nuovamente
trasformatoin AMP.
•Elevata concentrazione di glicerofosfato deidrogenasi che catalizza la
reazione di riduzione del diidrossiacetonfosfato a glicerolo – 3 fosfato
con ossidazione di NADH. In questa maniera si ha un recupero di
NAD+ che viene utilizzato dalla fosfogliceraldeide deidrogenasi,
prima che lo faccia la lattico deidrogenasi. Nella fase di riposo
muscolare il glicerolo – 3 fosfato può essere riconvertito a
diidrossiacetonfosfato nel processo della gluconeogenesi o essere
utilizzato nei mitocondri per produrre FAD.
Il muscolo nell’attività sportiva
Meccanismo Anaerobico Lattacido
E’ un meccanismo di emergenza che si attiva:
• Nei primi istanti di un lavoro muscolare, prima che si attivi il
metabolismo aerobico
• Quando il lavoro muscolare aumenta fino a raggiungere la
massima prestazione, per cui la quantità di ossigeno richiesta
dalle fibre muscolari è superiore a quello che gli apparati
respiratorio e cardiocircolatorio sono in grado di fornigli
• Quando si interrompe il flusso di ossigeno, che arriva al
muscolo attraverso il torrente ematico a causa di una forza
talmente elevata che provoca la chiusura dei vasi sanguigni
Con questo meccanismo (anaerobico lattacido) il
muscolo compie la glicolisi, con necessità di
rigenerazione di NAD+ attraverso la formazione di
lattato da parte della lattato-DH. Si ha così un
accumulo di acido lattico che causa un abbassamento
del pH fino a valori incompatibili con la contrazione.
Meccanismo Anaerobico Alattacido
Con questo meccanismo si ricava ATP senza utilizzo di
ossigeno né produzione di acido lattico.
Si utilizza fosfocreatina, che viene idrolizzata a
creatina:
Fosfocreatina Pi+creatina = energia per la contrazione
Meccanismo Aerobico
L’energia derivante da questo processo è frutto della
completa demolizione degli zuccheri e dei lipidi
utilizzando O2
La massima potenza aerobica che un atleta può
sviluppare nell’unità di tempo è direttamente
proporzionale al massimo consumo di O2 nella
stessa unità. Ciò a causa dell’effetto Pasteur
DUE SPORTIVI A CONFRONTO
Il maratoneta
La maratona si può definire come una specialità
tipicamente aerobica. Ciò significa che l’atleta,
per sopportare oltre due ore di gara, attinge
energia quasi esclusivamente dal meccanismo
aerobico.
La presenza di O2, trasportato fino alle fibre,
consente alla muscolatura di privilegiare
l’utilizzo di grassi e zuccheri (glicogeno).Infatti
la
muscolatura
del
maratoneta
è
prevalentemente costituita da fibre rosse, molto
più ricche di mitocondri e mioglobina. Con
l’allenamento, l’atleta dovrà incrementare la
funzionalità ed il numero di fibre rosse, più
adatte al metabolismo aerobico.
E’ da tener presente che adottando andature troppo
elevate, le limitate scorte di glicogeno epatico e
muscolare, andrebbero ben presto incontro ad
esaurimento.
In fase di preparazione è indispensabile adottare un
allenamento che consenta di sostenere andature
elevate, con il minimo dispendio di energia di origine
glucidica. L’obiettivo è di far bruciare grassi in
percentuale maggiore rispetto agli zuccheri, per
averne una buona disponibilità nella parte finale della
gara, notoriamente più impegnativa.
Alimentazione di gara
E’ la dieta che lo sportivo deve seguire in prossimità della competizione, per
ottimizzare la performance atletica
Alimentazione pre-gara: la possibilità di mantenere a lungo
un’elevata
performance
aerobica
è
direttamente
proporzionale alla concentrazione di glicogeno muscolare
presente all’inizio della gara. Per aumentare la quantità di
glicogeno, si fa seguire una dieta ipoglucidica con
allenamento gravoso, in modo da abbassare la
concentrazionedi glicogeno muscolare, procedendo poi ad un
carico iperglicemico. Per ottenere un aumento glicogenico è
sufficiente aumentare la percentuale di carboidrati complessi
nei 3 giorni che precedono la gara, con carichi di lavoro
brevi e a bassa intensità.
Il pasto pre-gara, consumato almeno 3 ore prima,
deve essere ricco di zuccheri complessi, facilmente
digeribile, non molto abbondante e povero di fibra.
E’ opportuno, dopo il pasto pre-gara, fornire
all’atleta, a circa 30-40 min prima della
competizione, una razione d’attesa glucidico-idrica,
per prevenire il possibili rischio ipoglicemico e di
eccessiva glicogenolisi. Questo combatte anche gli
effetti dello stress pre-gara che causa secrezione di
adrenalina (effetto ipoglicemizzante).
Terminata la prova, è necessario restituire rapidamente all’organismo
acqua, sali minerali zuccheri semplici. L’alimentazione dopo la gara è
fondamentale soprattutto se l’atleta deve ripetere a breve termine la
prestazione, in quanto la velocità con cui il glicogeno muscolare si
riforma è massima nelle prime ore dopo lo sforzo fisico ed aumenta in
proporzione alla quantità di zuccheri introdotti. Si consiglia perciò di
assumere 50-100 gr di zuccheri entro i primi 30 min, fino ad un totale di
600 gr nelle prime 20 ore (8-10 gr di carboidrati per kg di peso corporeo).
DUE SPORTIVI A CONFRONTO
Il velocista
Le fibre muscolari di un
velocista sono prevalentemente
bianche, con una rete capillare
poco
sviluppata,
poca
mioglobina e meno mitocondri.
Il muscolo bianco trae energia
dall’ATP prodotto per via
anerobica.
Infatti gli alti livelli dei suoi enzimi
glicolitici, che degradano il glicogeno fino
ad acido lattico con liberazione di energia,
permettono al muscolo bianco di contrarsi
attivamente per brevi periodi. L’acido
lattico che si forma è in gran parte ossidato
nella fase di riposo. Durante i loro intensi,
ma brevi sforzi, i muscoli bianchi attingono
energia anche dal metabolismo della
fosfocreatina.
Chi pratica sport di resistenza necessita di una gran quantità di carboidrati
che garantisca un apporto di glicogeno sufficiente per garantire l’energia
durante gli sforzi prolungati. L’apporto di macronutriuneti deve essere così
suddiviso: 60% carboidrati, 15% proteine e 25% grassi. E’ possibile quindi un
abbondante consumo di pane, pasta, riso, patate, muesli, verdura, frutta fresca e
frutta secca.
Chi pratica attività di forza e di scatto necessita di un giusto apporto di
carboidrati per garantire energia immediata col minor dispendio di ossigeno. E’
molto importante anche assumere sali minerali e vitamine, quindi è consigliato
consumare molta frutta e verdura fresca, pesce, carne magra e cereali.
Chi pratica sport di forza necessità di un maggior apporto di proteine per
sviluppare la massa muscolare. Naturalmente è necessaria anche l’assunzione
di carboidrati che forniscono il giusto apporto di energia senza i quali
l’organismo è costretto ad utilizzare le riserve di proteine. L’apporto di grassi
invece deve essere moderato.
La preziosa fonte di sali minerali ed elemento essenziale che invece non deve
mancare assolutamente nella dieta di uno sportivo qualsiasi sia l’attività
praticata è l’acqua.
Eccessiva produzione di radicali liberi
L’attività sportiva aumenta i livelli di radicali liberi di
un fattore che può andare da 6 a 30 volte. Essi
ostacolano il normale metabolismo, impedendo il
ripristino delle condizioni ottimali. In molti runners la
produzione di radicali liberi durante la corsa è così alta
che i danni alle strutture cellulari vengono riparati in
2-3 giorni. La capacità di opporsi alla produzione di
radicali liberi diminuisce con l’età. Con un apporto
vitaminico elevato (vitamina E + vitamina C) si riduce
alla metà il tempo di ripristino.
La creatina (Cr) è la molecola che, arricchita da un
gruppo fosforico, diventa "fosfocreatina" (Pcr), unica
fonte di energia di pronto utilizzo per il muscolo
(sistema anaerobico alattacido). Infatti, in caso di
necessità, la liberazione del gruppo fosforico della
fosfocreatina
fornisce
energia
sufficiente
a
resintetizzare ATP, molecola a sua volta altamente
energetica; la scissione dell'ATP nelle cellule
muscolari (con perdita del gruppo fosforico) libera
l'energia necessaria alla contrazione.
Il fabbisogno giornaliero di un adulto è di 2 grammi al giorno e viene coperto da:
50% tramite sintesi endogena (che avviene nel fegato e nel rene) 50% tramite
assunzione col cibo (250 grammi di carne contengono 1 grammo di creatina)
La creatina viene poi trasportata attivamente all'interno della cellula muscolare.
I riscontri sperimentali più rilevanti sono stati sino ad ora i seguenti:
se aumenta la creatina nel muscolo aumenta anche la fosfocreatina l'enzima
responsabile della trasformazione di creatina in fosfocreatina nel mitocondrio è
"accoppiato" alla fosforilazione ossidativa: questo significa che quando questo processo è
attivo occorre una minor quantità di ADP per avviare la produzione di ATP
l'incremento del livello di Pcr nel muscolo induce un incremento delle doti anaerobiche
alattacide, ma non ha effetti né sul sistema anaerobico lattacido né sulle doti aerobiche
aumenta la risintesi di Pcr (la perdita di Creatina dal muscolo è dell'ordine del 3%), ed
in tal modo i vantaggi risultano stabili la somministrazione di Creatina diminuisce i livelli
di iperammoniemia da sforzo (minor degradazione di ATP e minor produzione di
ammonio)
La Creatina rende più "stabili" i livelli di ADP nel muscolo, in modo che non siano mai
elevati (rifosforilazione continua). Si è inoltre evidenziato un ritardo nella comparsa di
affaticamento
durante
serie
ripetute
di
esercizi
ad
alta
intensità.
Esiste tuttavia un problema pratico legato alle alti dose necessarie per raggiungere un
effetto: la creatina assunta viene infatti solo parzialmente assorbita; di quella assorbita
parte viene metabolizzata al fegato e parte arriva al muscolo; di quella che arriva al
muscolo infine solo una parte viene trasformata in fosfocreatina. Il fabbisogno dell'atleta
oscilla tra i 2 - 3 grammi al giorno.
Gli steroidi anabolizzanti sono sostanze con azione simile a quella
dell'ormone maschile testosterone. Le sostanze, come d'altra parte l'ormone,
legandosi a specifici recettori cellulari inducono modificazioni tipiche
legate alla differenziazione sessuale, principalmente un aumento della
massa muscolare e della forza. Negli steroidi di sintesi viene ridotto
l'effetto mascolinizzante mantenendo però l'effetto stimolante sul
metabolismo proteico (deposizione di matrice muscolare). Le dosi dopanti
(50-200 mg al giorno) sono dieci volte superiori a quelle consigliate per uso
terapeutico.
L'assunzione di ormoni steroidei induce un aumento della massa
muscolare e questo, a sua volta, consente di affrontare allenamenti
più pesanti e di conseguenza miglioramenti più marcati derivanti
dall'allenamento stesso nelle prove di scatto e potenza. Inoltre gli
steroidi inducono riduzione della massa grassa.
L’uso dei diuretici induce disidratazione; si tratta di una
forma di doping specificamente adottata negli sport ove
esistono categorie di peso come la lotta, il sollevamento pesi
e il pugilato: il vantaggio che ne deriva è quello di
gareggiare in una categoria inferiore sfruttando la struttura
fisica che competerebbe ad una categoria superiore. Tuttavia,
la disidratazione è causa di ridotta funzione neuromuscolare
e di difficoltà di termoregolazione in quanto il processo di
sudorazione è meno efficiente.
LA GLICOGENOLISI
Nel muscolo
Si trova sotto il controllo della
glicogeno fosforilasi
Questo enzima è presente in due forme:
• INATTIVA
fosforilasi b
• ATTIVA
fosforilasi a
Garantisce un supplemento di glucosio per il metabolismo
energetico ESCLUSIVAMENTE
a livello delle cellule
muscolari.
Infatti il glicogeno muscolare non viene mobilizzato per
ripristinare l’omeostasi del glucosio nel sangue.
Il passaggio da una forma molecolare all’altra
dipende da tre tipi di segnali:
Ormonali
Metabolici
Neuronali
Ormonali
Le catecolamine attivano l’adenilato ciclasi per produrre
AMP ciclico che a sua volta attiva una proteincinasi
specifica.
il controllo ormonale consente di superare il controllo
metabolico della fosforilasi e il glicogeno può essere
degradato a dispetto anche di normali concentrazioni di ATP
e glucoso-6-P.
Il processo è generalizzato sull’intera massa muscolare, in
quanto i recettori adrenalinici sono ampiamente diffusi, è
inoltre dispendioso in termini di consumo delle riserve
energetiche ma funzionale a risposte di emergenza.
METABOLICI
Un aumentato utilizzo di ATP durante l’attività
muscolare breve porta ad un rapido accumulo di
ADP che viene convertito in AMP, modificando il
rapporto ATP/AMP. Questo comporta la
stimolazione:
• Della fosfofruttochinasi, inducendo di conseguenza
la glicolisi
• Della glicogenolisi per attivazione allosterica della
glicogeno fosforilasi b
NEURONALI
Sono dipendenti dal Ca2+, questo intorno alle concentrazioni di 108/10-6
M esso è in grado di attivare l’ATPasi miofibrillare
(actomiosina) e dare inizio alla contrazione. Nello stesso tempo viene
stimolata la fosforilasi-b-cinasi e come risultato la fosforilasi b è
convertita in a dando inizio alla glicolisi.
Il rilassamento del muscolo è dovuto invece al trasporto del Ca2+
nuovamente nel reticolo sarcoplasmatico, processo questo richiedente
energia.
Il controllo dipendente dal calcio
della fosforilasi assume un carattere
di economicità rispetto a quello
ormonale; esso viene utilizzato
quando limitati muscoli entrano in
funzione per specifiche esigenze,
senza l’impegno dell’intera massa
muscolare.