Di cosa siamo fatti
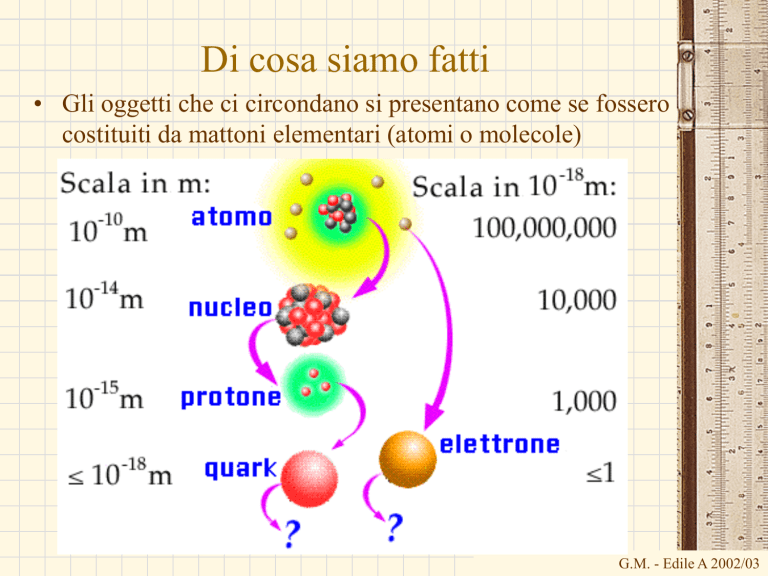
• Gli oggetti che ci circondano si presentano come se fossero
costituiti da mattoni elementari (atomi o molecole)
G.M. - Edile A 2002/03
La struttura dell’atomo
• Modello di Thomson: gli atomi sono sfere permeabili
complessivamente neutre, in cui le particelle di carica negativa
(elettroni) erano immerse in una massa gelatinosa di carica positiva
(modello dell’uva passa nel panettone).
• Esperimento di
Rutherford:
G.M. - Edile A 2002/03
I risultati dell’esperimento di Rutherford
• Conseguenze
dell’esperimento
di Rutherford
G.M. - Edile A 2002/03
Evoluzione del modello atomico
G.M. - Edile A 2002/03
Considerazioni sulla struttura atomica
• L’atomo è fatto essenzialmente di vuoto.
– Ci sono 4-5 ordini di grandezza tra le dimensioni dell’atomo (il
raggio del volume occupato dagli elettroni) e le dimensioni del
nucleo atomico.
– L’elettrone è estremamente piccolo (forse elementare)
• La massa dell’atomo è tutta concentrata nel nucleo
– Gli elettroni hanno una massa circa 2000 volte più piccola di
quella dei protoni ( o dei neutroni)
• Il nucleo atomico è costituito da protoni (carichi
positivamente) e da neutroni (particelle neutre).
– In ogni atomo ci sono tanti elettroni quanti protoni in maniera tale
che l’atomo sia complessivamente neutro.
G.M. - Edile A 2002/03
Alcune definizioni
• 92 diverse specie di atomi (altri sono stati costruiti artificialmente)
• Sostanza elementare è costituita di unità elementari formate solo da atomi
della stessa specie (Fe, H2)
• Composto se le unità elementari sono formate da atomi di due o più specie
diverse (H2O)
• Cosa distingue i vari atomi?
• NUMERO ATOMICO Z: il numero di protoni presenti nel nucelo(o di
elettroni presenti nell’atomo neutro)
• NUMERO DI MASSA A: è dato dalla somma del numero di protoni Z e del
numero di neutroni N del nucleo.
• ISOTOPI: atomi chimicamente identici (stesso Z) ma con diverso numero N di
neutroni (A diverso).
• MASSA ATOMICA: è la massa atomica assoluta in unità di massa atomica
u.m.a. (per convenzione, 1 u.m.a.= 1/12 della massa atomica di 12C cioè del
carbonio con A=12).
G.M. - Edile A 2002/03
Alcune proprietà degli atomi
• Carica dell’elettrone (o del protone):1,6 x 10-19C
(Coulomb). Quantizzata.
• Ione: si possono strappare cariche elettriche negative (elettroni) agli
atomi; ciò comporta una notevole spesa di energia E.
• Energia di prima ionizzazione: l’energia occorrente per
strappare il primo elettrone all’atomo.
• Energia di seconda ionizzazione: l’energia occorrente
per strappare il secondo elettrone all’atomo.
• Affinità elettronica: l’energia rilasciata dall’atomo neutro
quando acquisisce un elettrone in più.
• Elettonegatività: capacità di un atomo in una molecola di attirare
elettroni di un altro atomo, impegnato in un legame comune. Se la
differenza di elettronegatività è molto alta, gli atomi sono praticamente
in forma ionica (NaF).
G.M. - Edile A 2002/03
La tavola periodica
G.M. - Edile A 2002/03
Energia di prima ionizzazione
G.M. - Edile A 2002/03
Periodicità
G.M. - Edile A 2002/03
I numeri quantici
• Il numero quantico principale n
(enne) riguarda la quantizzazione della energia
n=1,2,…
• Il numero quantico secondario o
azimutale l (elle) è relativo al momento
totale Etot.
angolare (grandezza vettoriale).
l=0,1,2,...,(n-1)
• Il numero quantico magnetico m
(emme) è relativo alla quantizzazione "spaziale"
del momento angolare
m= - l, - l +1, ...-1, 0, 1, ... l -1, l
• Il numero quantico di spin ms.
ms= ± 1/2
G.M. - Edile A 2002/03
Orbitali tipo s
1s
Più è grande l’energia maggiore è la distanza
dell’elettrone dal nucleo
4s
G.M. - Edile A 2002/03
Orbitali tipo p e d
2px
3px
G.M. - Edile A 2002/03
Costruzione della configurazione
elettronica degli atomi.
• il Principio di minima energia: ogni elettrone occupa
l'orbitale disponibile a energia più bassa.
• il Principio di Pauli: in un atomo non possono esistere 2
elettroni con i 4 numeri quantici eguali; perciò, nello stesso
orbitale, possono esserci 2 soli elettroni purché con ms,
momento di spin, diverso;
• Regola di Hund o della massima molteplicità: se due o più
elettroni occupano orbitali degeneri (cioè a eguale energia),
gli elettroni occupano il maggior numero possibile di
questi orbitali, e a spin paralleli .
G.M. - Edile A 2002/03
• Le proprietà dell’atomo
dipendono dal numero
di elettroni sull’ultima
shell.
• Lo strato più esterno al
massimo può avere 8
elettroni.
• Gas nobili hanno
l’ottetto compelto.
Sono poco reattivi, non
si combinano con altri
atomi.
• Le altre specie tendono,
con i loro legami, a
portarsi, cedendo od
acquisendo o mettendo
in comune, l’ottetto
completo.
G.M. - Edile A 2002/03
La tavola periodica
G.M. - Edile A 2002/03
Gruppi di atomi
• Gas nobili
– Hanno l’ottetto completo, non si combinano con
altri atomi
• Metalli alcalini
– Un solo elettrone nel guscio più esterno,
facilmente ionizzabili
• Metalli alcalino terrosi
– Due elettroni nel guscio più esterno
• Gli alogeni
– Hanno bisogno di un elettrone per portarsi nella
configurazione del gas nobile che li segue, e
quindi tendono a completare il loro ottetto.
G.M. - Edile A 2002/03
Gli atomi emettono luce
• Una volta assegnati gli elettroni agli orbitali della
configurazione di minima energia è possibile
– Eccitare l’atomo
• Spostare un elettrone da un livello ad un altro di maggiore energia
– Ionizzare l’atomo
• Liberare l’elettrone e creare quindi uno ione.
• Come si realizzano questi processi?
– Attraverso l’assorbimento di quanti di luce
– Mediante urti con altri atomi o con elettroni liberi (lampade
fluorescenti)
• Cosa succede ad un atomo eccitato?
– Dopo un po di tempo il livello lasciato libero dall’elettrone
scalzato (di bassa energia) viene rioccupato dallo stesso o da altri
elettroni (passaggio da stati ad energia più alta a stati di energia più
bassa.
– L’energia in eccesso viene ceduta sotto forma di luce fotoni. G.M. - Edile A 2002/03
Eccitazione e diseccitazione dell’atomo
E h
h costante di Planck
frequenza del fotone
G.M. - Edile A 2002/03
I legami più importanti
• Legame ionico: è possibile solo tra atomi diversi:
–
il primo atomo è caratterizzato da una bassa energia di ionizzazione (per
es. un alcalino)
– l’altro da una elevata affinità elettronica che gli consente di catturare
l’elettrone dell’altro atomo (per es. un alogeno).
– Il legame è dovuto alla forza elettrostatica attrattiva tra lo ione positivo e
quello negativo
• Legame covalente: quando due atomi hanno circa la stessa
elettronegatività.
– è costituito da una coppia di elettroni condivisi fra i due atomi.
– si può pensare come la sovrapposizione di due degli orbitali atomici dei
due atomi, contenenti ognuno un elettrone, che da luogo a un orbitale di
legame, esteso a tutta la molecola, nel quale si collocano i due elettroni
condivisi.
G.M. - Edile A 2002/03
Stati di aggregazione della materia
• Solido atomi e molecole sono legati da forze sufficientemente intense tali che il
moto termico, sempre presente, salvo che allo zero assoluto, non è in grado di
modificare permanentemente le mutue posizioni.
– La forma ed il volume sono praticamente definiti;
• Liquido i legami interatomici e intermolecolari hanno una minore intensità,
permettendo così una certa mobilità di atomi e molecole, ma non
l'allontanamento definitivo.
– il volume resta perciò praticamente definito, mentre non lo è più la forma;
• Gassoso: le particelle, avendo una energia termica molto superiore all'energia
di interazione interatomica e intermolecolare, tendono ad allontanarsi l'una
dall'altra e praticamente non si influenzano tra loro.
– si ha perciò la massima espansione nello spazio disponibile.
• I cambiamenti di stato
di aggregazione
G.M. - Edile A 2002/03
Reticoli cristallini
• Spesso, quando un gran numero di atomi si uniscono per formare un
solido, si sistemano in una situazione di equilibrio, disponendosi in
maniera ordinata per formare un reticolo cristallino.
• Gli atomi sono tenuti insieme dalle forze interatomiche (forze residue):
Queste forze sono molto intense:
– è difficile cambiare la posizione degli atomi,
– i solidi cristallini sono, pertanto, poco deformabili
• Gli atomi sono in continua oscillazioni a causa dell’agitazione termica
– L’ampiezza delle oscillazioni è dell’ordine di 10-11 m (1 decimo del
diametro atomico) ed aumenta all’aumentare della temperatura.
– La frequenza delle oscillazioni dell’ordine di 1013 Hz (dipende dalla
temperatura)
• Solidi non cristallini si dicono amorfi (vetro).
G.M. - Edile A 2002/03
Esempio di reticoli cristallini
Cloruro di sodio NaCl
G.M. - Edile A 2002/03
G.M. - Edile A 2002/03
La mole
• Le proprietà dei corpi macroscopici sono legate alle
proprietà degli atomi o delle molecole che li costituiscono.
• Per mettere in evidenza le somiglianze o le differenze di
comportamento di differenti specie atomiche, dato è
difficile lavorare con i singoli atomi, conviene confrontare
quantità che si riferiscono allo stesso numero di atomi o
molecole.
• La mole si definisce come quella quantità di sostanza
contente esattamente lo stesso numero di costituenti
(atomi) contenuti in 12g (0.012 kg) di 12C.
G.M. - Edile A 2002/03
Il numero di Avogadro
• E’ il numero di unità (atomi o molecole) contenute in una
mole:
NA = 6,022169 x 1023 mol-1
• Massa molare: corrisponde alla massa di un NA elementi
(atomi o molecole).
– La massa molare, quando è espressa in grammi, numericamente
coincide con la massa atomica espressa in u.m.a.
• Se si misura il volume di una mole di un elemento solido,
questo volume, diviso per NA, dà circa il volume di un
atomo di quell'elemento.
G.M. - Edile A 2002/03
Alcune masse atomiche
Esempio: massa molare dell’ossigeno:
• Molecola biatomica O2
• Massa molecolare = due volte la massa atomica
2x16 u.m.a. = 32 u.m.a.
• Massa molare = 32 g
G.M. - Edile A 2002/03
All’interno degli atomi:
i nuclei
Tabella dei nuclidi naturali
stabili (non radioattivi)
• Protoni e neutroni (circa
•
•
•
•
lo stesso numero con una
prevalenze di neutroni ad
alto Z)
massa dell'elettrone
9,1093897 x 10-31 Kg =
0.000548579903 u.m.a.
Massa del neutrone n:
1.6749286 x10-27kg =
1.008664904 u.m.a.
Massa del protone p:
1.6726231 x10-27kg =
1.007825 u.m.a.
1 u.m.a. = 1,6605402 x 10-27
kg
G.M. - Edile A 2002/03
Energia di
legame
• La differenza di massa si
ritrova sotto forma di
energia secondo la formula
di Einstein
E=mc2
G.M. - Edile A 2002/03
Fissione dei nuclei pesanti
G.M. - Edile A 2002/03
La radioattività
• Non tutti i nuclei sono stabili.
G.M. - Edile A 2002/03
All’interno dei nucleoni
G.M. - Edile A 2002/03
I mattoni fondamentali al momento
attuale
carica di colore
• Sei quark
Q
– Carica frazionaria
– Colore
2/3
• Sei leptoni
-1/3
– Tre cariche e tre neutri
– I neutrini hanno massa piccola
(per molto tempo si è pensato fosse
nulla)
• I mattoni possono essere
raggruppati in famiglie
• La materia ordinaria è costituita
solo da elementi della Ia famiglia
0
1
carica di sapore
G.M. - Edile A 2002/03
Le interazioni
G.M. - Edile A 2002/03
L’interazione gravitazionale
• La forza gravitazionale è probabilmente
la forza che ci è più familiare (peso).
• La gravità agisce su ogni cosa, è una
forza molto debole quando non ha a che
fare con grandi masse.
• Anche se non hanno ancora scoperto la
particella mediatrice di forza per la
gravità, i fisici ne hanno previsto
l'esistenza e l'hanno già battezzata
"gravitone".
G.M. - Edile A 2002/03
La forza elettromagnetica
•
•
•
Le forze che sperimentiamo ogni giorno, come la
forza che il pavimento esercita sui nostri piedi per
sostenerci, sono dovute alle interazioni
elettromagnetiche nella materia, che si
oppongono allo spostamento degli atomi dalla
loro posizione di equilibrio in un materiale.
E' necessario avere ben chiaro in mente che la
carica elettrica (positiva/negativa) e il
magnetismo (nord/sud) sono diverse facce di una
stessa interazione, l'elettromagnetismo. Oggetti
con cariche opposte, per esempio un protone e un
elettrone, si attirano, mentre particelle con la
stessa carica di respingono.
La particella mediatrice dell'interazione
elettromagnetica è il fotone. In base alla loro
energia, i fotoni sono distinti in raggi gamma,
luce, microonde, onde radio, etc.
G.M. - Edile A 2002/03
Perché i nuclei sono stabili?
•
Cosa tiene insieme il nucleo? Ci
si aspetterebbe che il nucleo di un
atomo esplodesse per via della
repulsione elettromagnetica tra i
protoni, che hanno cariche uguali.
Invece la maggior parte dei nuclei
atomici è molto stabile!
G.M. - Edile A 2002/03
L’interazione forte
•
E' stato stabilito che alcune particelle (i
quark e i gluoni) hanno una carica che
non è di tipo elettromagnetico; questa
carica è stata chiamata carica di colore.
Tra particelle dotate di carica di colore
l'interazione è molto forte, tanto da
meritarsi il nome di interazione forte.
Dato che questa interazione tiene insieme
i quark a formare gli adroni, la sua
particella mediatrice è stata chiamata
gluone: è così brava a "incollare" (in
inglese "glue") i quark l'uno all'altro!
•
E' importante precisare che ad avere
carica di colore sono solo i quark e i
gluoni. Gli adroni (tra cui i protoni e i
neutroni) sono neutri di colore, e così i
leptoni. Per questo motivo, l'interazione
forte agisce soltanto a livello di quark.
G.M. - Edile A 2002/03
L’interazione debole
•
C'è ancora una interazione da spiegare: l'interazione debole.
•
Ci sono 6 tipi di quark e 6 tipi di leptoni. Ma tutta la materia stabile dell'universo è
composta dai 2 tipi meno massivi di quark (up e down) e dal leptone carico meno
massivo (elettrone): perché?
Tutta colpa dell'interazione debole: è responsabile del fatto che tutti i quark e tutti i
leptoni di massa maggiore decadono per produrre quark più leggeri ed elettroni. Una
particella che decade sparisce, e al suo posto appaiono due o più particelle. La somma
delle masse delle particelle prodotte è sempre inferiore alla massa della particella di
partenza. Questo è il motivo per cui la materia stabile che ci circonda contiene solo
elettroni e i quark più leggeri (up e down).
•
•
•
•
Quando un quark o un leptone cambia tipo (per esempio un muone diventa un
elettrone), si dice che cambia sapore. Tutti i cambiamenti di sapore sono dovuti
all'interazione debole.
Le particelle mediatrici dell'interazione debole sono i bosoni W+, W-, Z. Le particelle
W hanno carica elettrica, mentre Z è neutra.
Un tratto molto interessante del Modello Standard è che l'interazione elettromagnetica e
quella debole sono congiunte in un'interazione unificata, chiamata elettrodebole.
G.M. - Edile A 2002/03










