GLICOLISI e
CATABOLISMO degli ESOSI
pH= 7.0
Digestione dei polisaccaridi
Amilasi salivare e pancreatica = endoglucosidasi
Digestione degli oligosaccaridi
maltosio, maltotriosio, destrine,
Saccarosio, lattosio.
Saccarasi, lattasi, maltasi, isomaltasi
dell’intestino
Deficienza congenita o acquisita delle disaccaridasi intestinali:
1. DEFICIENZA ASPECIFICA
2. DEFICIENZA DI LATTASI
nell’adulto
nel lattante (intolleranza al lattosio)
Carrier per il glucosio.
Le cellule dell’epitelio intestinale assumono il glucosio
proveniente dalla dieta mediante un simporto dipendente dal
sodio.
Modello di un trasportatore del glucosio nei mammiferi
Ciascun membro di questa famiglia è costituito da una
singola catena polipeptidica lunga circa 500 residui
Km= 1mM (alta affinità per il glucosio)
[glucosio]siero = 4-8mM
(insulino-indipendente)
Km= 1mM (alta affinità per il glucosio)
[glucosio]siero = 4-8mM
Nel fegato il glucosio viene assunto con un sistema insulino-indipendente realizzato dal trasportatore
Glut-2.
, pancreas
Km= 15-20mM
Il glucosio entra solo quando la [glucosio]ematico è alta.
Quando il glucosio entra nelle cellule b del pancreas lo induce a
sintetizzare insulina.
Km= 5mM
GLUT4
nel muscolo e nelle cellule adipose
L’assunzione di glucosio da
parte del muscolo e delle
cellule adipose viene
regolata dall’esocitosi
insulino-dipendente di
vescicole membranose
contenenti GLUT4.
Con la rimozione
dell’insulina, il processo si
inverte in un processo di
endocitosi
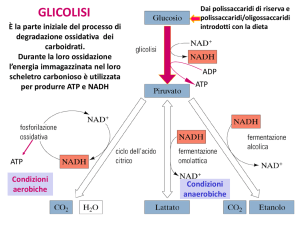
La glicolisi è la sequenza di reazioni
che metabolizza una molecola di
glucosio a due di piruvato con la
produzione netta di due molecole di
ATP. Questo processo è anaerobico
condizioni aerobiche
condizioni anaerobiche
nel lievito
Reazione irreversibile
La molecola del glucosio
induce un cambiamento
conformazionale
nell’esochinasi.
Esochinasi
Esochinasi:
inibita dal glucosio 6-P
Isoenzima tipo I: nel cervello
(attivato dal Pi)
Isoenzima tipo II: nel muscolo
Deficienza ereditaria di esochinasi
(anemia emolitica)
Nel fegato sono presenti
entrambi gli enzimi.
Glucochinasi
1. Presente nel fegato
2. Specificità per il glucosio
3. Bassa affinità
4. Inducibile (dieta, insulina)
Il metabolismo glucidico è importante per gli eritrociti
• nel deficit di esochinasi
le concentrazioni di tutti
gli intermedi glicolitici
sono basse e di
conseguenza la
concentrazione di 2,3bifosfoglicerato è
anch’essa diminuita
mentre l’affinità
dell’emoglobina per
l’ossigeno risulta
aumentata (curva verde)
• nel deficit di piruvato
chinasi si ha un aumento
nella concentrazione di 2,3bifosfoglicerato con
diminuzione dell’affinità
dell’emoglobina per l’ossigeno
(curva blu)
SEGUE
Isomerizzazione di un esosio in un chetosio
Fosfoglucosio isomerasi
II tappa di utilizzo dell’ATP (reazione irreversibile)
Fosfofruttochinasi
Svolge un ruolo centrale nel controllo della glicolisi
Demolizione dell’esoso in triosi
Aldolasi
Gliceraldeide 3-P e diidrossiacetone fosfato sono interconvertibili
Trioso fosfato isomerasi (enzima perfetto, mantiene le
concentrazioni in equilibrio).
Reazione accoppiata: l’energia derivata dall’ossidazione dell’aldeide è
utilizzata per la formazione del legame fosfo-anidridico.
(Primo intermedio ad alta energia)
Gliceraldeide 3-P deidrogenasi
1 molecola di glucosio è stata trasformata in
2 molecole di GAP.
Sono stati consumati 2 ATP (investimento di energia).
Ia fosforilazione dell’ADP
Fosfoglicerato chinasi
Trasferimento intramolecolare del radicale fosforico
Fosfoglicerato mutasi
Formazione del PEP
Enolasi
Reazione irreversibile
II fosforilazione dell’ADP
Piruvato chinasi
Glucosio + 2 NAD+ + 2 ATP + 2 Pi
2 piruvato + 2 NADH + 2 ATP + 2 H2O + 4 H+
1. ATP. Per ogni molecola di glucosio: investimento di 2 ATP (fase I)
sintesi di 4 ATP (fase II)
Resa netta 2 ATP
2. NADH. Fonte di energia libera che può essere recuperata mediante
successiva ossidazione. In condizioni di aerobiosi:
NADH (e-)
trasportatori di e-
Sintesi di ATP (fosforilazione ossidativa
Rigenerazione di NAD+
3. PIRUVATO
O2
Fermentazione: il destino anaerobico del del piruvato
In condizioni aerobiche:
piruvato
CO2 + H2O
In condizioni anaerobiche:
piruvato
Via della fermentazione
Fermentazione omolattica (muscolo)
COO-
NADH + H+
COO-
NAD+
HO
O
CH3
Acido piruvico
lattico deidrogenasi
H
CH3
Acido lattico
Il lattato ottenuto può essere riconvertito in glucosio
dal fegato nella fase di recupero dopo lo sforzo
Fermentazione alcolica
I
lieviti
(saccharomyces
cerevisiae)
e
altri
microorganismi fermentano il glucosio ad etanolo e
CO2 invece che a lattato, grazie alla presenza della
piruvato decarbossilasi e dell’alcol deidrogenasi
COO-
O
CO2
NADH + H+
O
CH3
H3C
piruvato
decarbossilasi, TPP
H
NAD+
CH3CH2OH
alcol deidrogenasi
cellule di
saccharomyces
cerevisiae in
gemmazione
Le due reazioni della fermentazione alcolica
Tiamina pirofosfato
Meccanismo di reazione della piruvato decarbossilasi
Deficienza di tiamina (vit. B1):
beriberi
1. Attacco nucleofilo
della TPP al carbonio
carbonilico del
piruvato.
2. Rilascio di CO2
(TPP=trappola per gli
elettroni)
3. Protonazione del
carbanione
4. Eliminazione della
TPP e rilascio del
prodotto.
Bilancio energetico della glicolisi:
TAPPA
ATP
1) Glucosio
G-6-P
-1
2) F-6-P
F-1,6-dP
-1
3) 1,3 BPG
3-PG
+2
4) PEP
Piruvato
+2
______
netto + 2
Efficienza della glicolisi aerobica
TAPPA
ATP
1) Glucosio
2 Piruvato
+2
2) 2 Piruvato
6 CO2
+ 30
3) 2 NADH (H+)
2 NAD+
Glicolisi citoplasmatica
Processi mitocondriali
+6
______
netto + 38
La velocità del processo è
regolata da 2 enzimi:
fosfofrutto chinasi (PFK-1)
piruvato chinasi
Entrambi gli enzimi sono regolati
allostericamente
La 6-fosfofrutto-1cinasi è il principale sito di regolazione della glicolisi
E’ un enzima tetramerico
caratterizzato da due stati
conformazionali, R e T.
L’ATP si comporta sia da
substrato sia da inibitore
allosterico
Ogni subunità della PFK ha due
siti di legame per l’ATP:
Uno è il sito per il substrato
(con eguale efficienza in
entrambe le conformazioni)
Il sito dell’inibitore lega l’ATP
esclusivamente nello stato T .
L’ altro substrato della PFK, il F6P, si lega allo stato R.
Un’alta concentrazione di ATP agisce da inibitore allosterico,spostando
l’equilibrio T
R verso T con diminuizione dell’affinità della PFK per il F6P.
PFK
Attivatori:
AMP, F2,6P
Inibitore: ATP,
pH acido, citrato
La glicolisi è stimolata quando la carica energetica diminuisce (ATP/AMP)
ADP + ADP
ATP + AMP
AMP: segnale per lo stato a bassa energia
adenilato chinasi
Regolazione particolarmente sensibile da parte dell’AMP
[ATP] + [ADP] + [AMP] = K
[ATP]
[ADP]
[ADP]
[AMP]
Amplificazione:
Piccole variazioni nella [ATP] generano grandi variazioni nella [AMP]
Regolazione allosterica della fosfofruttochinasi da parte dell’ATP
pH
La sensibilità della 6PFK agli ioni H+ è un meccanismo di difesa
contro l’acidosi lattica (diminuizione del pH ematico) insieme al
simporto acido lattico-H+
Citrato
Un’elevata concentrazione di citrato indica che i precursori
biosintetici sono abbondanti e non deve essere degradato altro
glucosio (indispensabile per il cervello).
PFK2
FBP2
Struttura dei domini dell’enzima bifunzionale fosfofruttochinasi 2
PFK2 e FBPasi sono presenti in una singola catena polipeptidica
2
3
1
Sequenza amminoacidica dell’enzima
Regolazione della sintesi e della degradazione del fruttosio 2,6-bisfosfato
(isoforma L, epatica)
[glucosio]
Una diminuzione del glucosio ematico
segnalato dal glucagone, determina la
fosforilazione dell’enzima bifunzionale
con coseguente diminuzione del
fruttosio 2,6-bifosfato. Unaumento
della concentrazione di fruttosio 6fosfato accelera la formazione di
fruttosio 2,6.bifosfato facilitando la
defosfrilazione dell’enzima
bifunzionale
2
o
1
Fegato e cuore contengono differenti isoenzimi dell’enzima
bifunzionale PFK/FBPasi che danno differente risposta allo stesso
ormone (adrenalina).
adrenalina
glucagone
Fegato:
(inibizione della glicolisi)
Cuore:
(attivazione glicolisi)
Anche la piruvato cinasi è un enzima glicolitico soggetto a regolazione
Piruvato chinasi
- ATP
- Alanina e precursori biosintetici
+ F1,6BP
2 isoenzimi: L (nel fegato) ed M (nel muscolo).
Piruvato cinasi (tipo L) è soggetto a regolazione mediante
fosforilazione (per impedire al fegato di consumare glucosio quando
l’encefalo e i muscoli hanno maggiore necessità di questo composto).
1
Le principali caratteristiche della regolazione della glicolisi
Alterazione dell’espressione genica nei tumori
causata dall’ipossia
Le cellule cancerose crescono più rapidamente
dei vasi sanguigni che le nutrono
• in assenza di ossigeno l’ HIF-1 ( fattore di trascrizione
inducibile dall’ipossia ) aumenta l’espressione della maggior
parte decli enzimi glicolitici e dei trasportatori del
glucosio GLUT-1 e GLUT-3
• la captazione del glucosio è collegata alla aggressività
del tumore
• l’HIF-1 stimola la crescita di nuovi tumori aumentando
l’espressione delle molecole segnale, come il fattore di
crescita vascolare endoteliale ( VEGF ), che facilita la
crescita dei vasi sanguigni
Oltre al glucosio molti altri carboidrati possono
entrare nella via glicolitica e subire degradazioni
che liberano energia; i più importanti sono:
• polisaccaridi (amido, glicogeno)
• disaccaridi (maltosio, lattosio, saccarosio)
• altri monosaccaridi (fruttosio, mannosio, galattosio)
Entrata nella glicolisi di
altri esosi
Punti d’ingresso
nella glicolisi per
galattosio
e
fruttosio
GLUCOSIO
(via gluconeogenesi)
Glicerolo fosfato
deidrogenasi
ACIDO
LATTICO
(via fruttolisi)
Grassi
Diidrossiacetonfosfato
L’uomo consuma considerevoli quantità di fruttosio
sotto forma di saccarosio ( glucosio+fruttosio)
Gran parte del fruttosio ottenuto nell’intestino tenue
dall’idrolisi del saccarosio è convertito in glucosio
La carenza di fruttochinasi è responsabile dell
FRUTTOSURIA ESSENZIALE una anomalia
metabolica benigna
La carenza del fruttosio 1-fosfato-aldolasi è
responsabile della INTOLLERANZA EREDITARIA AL
FRUTTOSIO
Metabolismo del galattosio
galattosemia
GALATTOSEMIA
•
Gli individui che hanno questo difetto sono incapaci di
metabolizzare il galattosio proveniente dal lattosio
(zucchero del latte ) a metaboliti del glucosio, spesso
con conseguente formazione di:
cataratta
arresto dell’accrescimento
ritardo mentale
eventuale morte da danno epetico
• Il disturbo genetico è causato da una carenza
cellulare di galattocinasi con disordine lieve, o di
galattosio 1-fosfato uridiltrasferasi che causa la
malattia più grave.
FINE