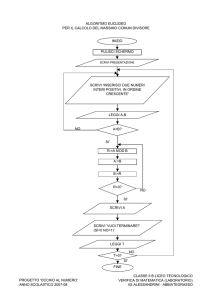
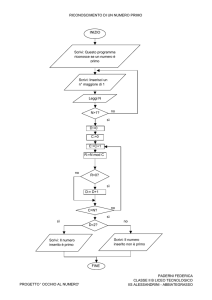
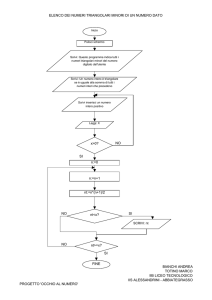
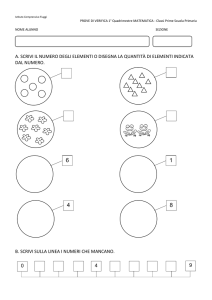
VERIFICA DI FINE MODULO “Sistema Periodico”
Definire e indicare le principali proprietà atomiche e le principali proprietà fisiche e chimiche degli elementi, predire gli andamenti
delle proprietà periodiche e classificare gli elementi, correlare il comportamento chimico dell’elemento alla struttura elettronica
esterna.
¡¡¡ Trattandosi di una verifica finale non è prevista alcuna forma di collaborazione, pena l’annullamento della prova !!!
1. Scrivi la formula di un idruro di un elemento del gruppo VA.
[1]
2. Scrivi la formula di un ossido del gruppo IIIA e stabilisci se è acido o basico.
[2]
3. Scrivi la formula e il nome di un sale binario di un elemento del gruppo VIA con un metallo alcalino.
[1]
4. Individua l’elemento X che forma un ossido avente formula XO2, avente configurazione elettronica esterna
ns2np2 e capace di ossidarsi più facilmente dello Stagno.
[2]
5. Scrivi la formula dell’idrossido dell’elemento E, il cui ossido ha formula EO.
[1]
6. Per il composto Li2SO4 scrivi gli ioni che lo compongono, e indica la carica complessiva positiva e negativa
dell’unità – formula e il nome.
[2]
7. Calcola il volume molare del rubidio conoscendo la sua densità (1,532 g/cm3) e il p.a. (85,5)
[1]
8. Spiega come mai il molibdeno e il tungsteno hanno atomi all’incirca dello stesso volume, ma il tungsteno ha
densità quasi doppia.
[1]
9. Perché il volume degli atomi diminuisce lungo un periodo nonostante essi contengono un crescente numero
di elettroni?
[1]
10. Scrivi lo schema per la reazione tra lantanio e acqua.
[2]
11. Disponi i seguenti elementi in ordine di comportamento metallico crescente Ca, Rb, Al, Si. L’andamento è
correlato a quale proprietà?
[2]
12. Qual è la carica nucleare efficace approssimativa dei seguenti elementi? Ca; Al; C; O.
[2]
tempo a disposizione 50 minuti; sufficienza 9 punti.