PROTOCOLLO SPERIMENTALE
Introduzione
L'equilibrio tra la produzione di nuove cellule e l' eliminazione delle cellule "vecchie"
è uno degli obiettivi principali di ogni organismo pluricellulare.
Si conoscono due modalità principali mediante cui le cellule possono essere
eliminate: la NECROSI e l’APOPTOSI. Nel primo caso la cellula va incontro a
rigonfiamento, rottura della plasmamembrana, e lisi, rilasciando il proprio contenuto
nell’ambiente esterno. Nel secondo caso, invece, la cellula si ‘condensa’ e
successivamente si frammenta in vescicole, dette corpi apoptotici, che sono rapidamente
digerite dai macrofagi. A differenza delle cellule necrotiche, i corpi apoptotici sono ancora
circondati da membrana, quindi il materiale che contengono non può raggiungere
l’ambiente esterno. Questa distinzione è estremamente importante dal momento che i
materiali contenuti all’interno di una cellula possono essere dannosi per le cellule vicine.
Lo studio della morte cellulare per apoptosi viene generalmente effettuato
utilizzando linee cellulari, che si possono mantenere in coltura mediante procedure
standardizzate.
In questo esperimento verranno utilizzate cellule L929, una linea di fibroblasti
murini. Queste cellule crescono in ‘monostrato’, hanno cioè bisogno di ancorarsi ad un
substrato, e smettono di crescere quando arrivano a ‘toccarsi’ (inibizione da contatto,
confluenza). Il terreno di coltura contiene, fra le altre cose, carboidrati, aminoacidi, lipidi,
sodio bicarbonato, ed è addizionato di siero, la componente fluida del sangue, allo scopo
di arricchirlo di nutrienti. Il colore rosso è dovuto alla presenza del rosso-fenolo, un
indicatore di pH. Perché le cellule possano moltiplicarsi, devono essere mantenute nel loro
terreno di coltura in appositi incubatori in un’atmosfera contenente il 5% di anidride
carbonica (CO2).
Scopo del lavoro
L’esperimento proposto ha lo scopo di valutare se le cellule L929 vanno incontro a
morte per apoptosi in seguito al trattamento con il farmaco anti-tumorale ‘etoposide’
(anche indicato con la sigla VP-16).
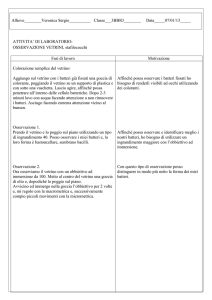
Esecuzione
I giorno
osservare le piastre Petri al microscopio
cambiare il terreno (2,5 ml/piastrina)
aggiungere in una delle 3 Petri 10 μl/ml di etoposide [1 mM], arrivando ad una
concentrazione finale di 10 μM
mettere le Petri nell’incubatore per 24 ore
II giorno
-osservare le piastre al microscopio
-prelevare il vetrino contenuto nelle piastre
-lavare il vetrino in PBS (soluzione 1)
-fissare per 5 minuti in etanolo 95% (soluzione 2)
-lasciare asciugare a temperatura ambiente
-effettuare la colorazione con ematossilina-eosina secondo il protocollo seguente:
-etanolo 70% (soluzione 3)
-H2O distillata
-Ematossilina (soluzione 4)
-H2O distillata
-H2O corrente con carbonato di litio (soluzione 5)
-H2O distillata
-eosina 0,1% con goccia di CH3COOH (soluzione 6)
-H2O distillata
-etanolo 95% (soluzione 2)
-etanolo 100% (soluzione 7)
-xilene
-sintex
2 minuti
5 minuti
3 minuti
sciaquare
10 minuti
2 minuti
2 minuti
sciaquare
1 minuto
2 minuti
4 minuti
1 goccia
-coperchiare il vetrino su un vetrino portaoggetto
III giorno
-Osservare i preparati al microscopio
Reagenti utilizzati
terreno DMEM contenente gentamicina [5 mg/100 ml] e siero fetale bovino (FCS)
10%
etoposide 1 mM
etanolo 95% e 70%
ematossilina
eosina
permount
Reagenti forniti e numero di identificazione
1.
2.
3.
4.
5.
6.
7.
PBS
Etanolo 95%
Etanolo 70%
Ematossilina
Acqua corrente con carbonato di litio
Eosina 0.1% acidificata con CH3COOH
Etanolo 100%
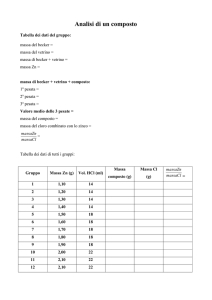
RISULTATI
I TURNO (lu-ma-mer)
cellule L929
di controllo
cellule L929
trattate con
etoposide
cellule L929
trattate con
tassolo
II TURNO (gio-ve-sa)
cellule L929
di controllo
cellule L929
trattate con
tassolo
cellule L929
trattate con
etoposide