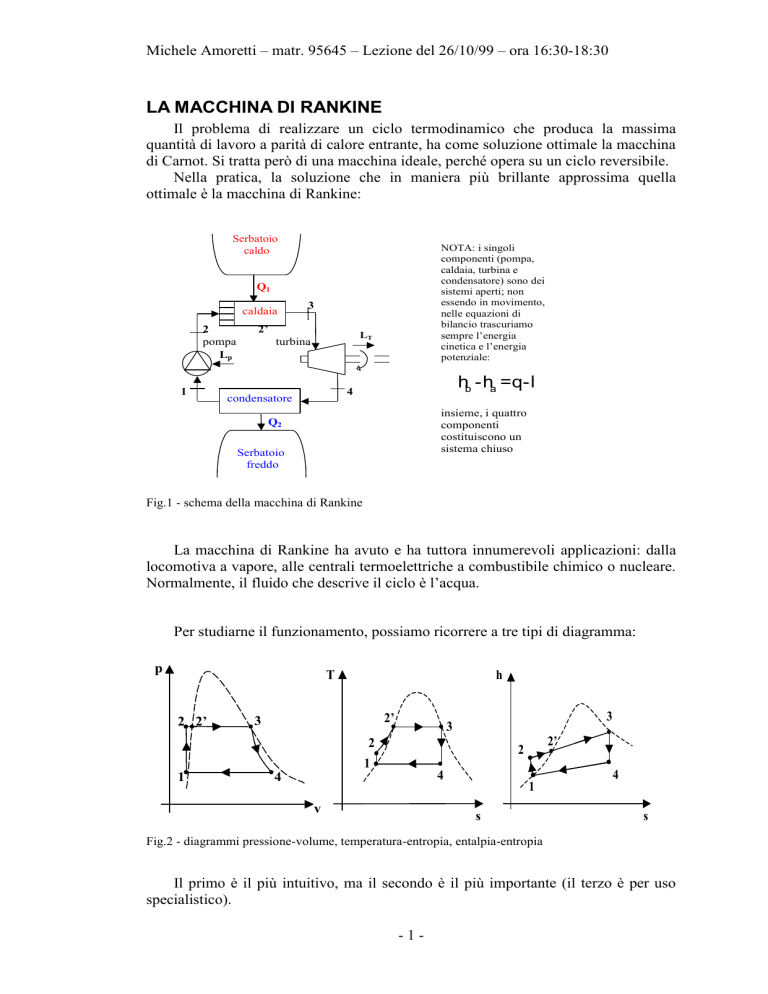
Michele Amoretti – matr. 95645 – Lezione del 26/10/99 – ora 16:30-18:30
LA MACCHINA DI RANKINE
Il problema di realizzare un ciclo termodinamico che produca la massima
quantità di lavoro a parità di calore entrante, ha come soluzione ottimale la macchina
di Carnot. Si tratta però di una macchina ideale, perché opera su un ciclo reversibile.
Nella pratica, la soluzione che in maniera più brillante approssima quella
ottimale è la macchina di Rankine:
Serbatoio
caldo
NOTA: i singoli
componenti (pompa,
caldaia, turbina e
condensatore) sono dei
sistemi aperti; non
essendo in movimento,
nelle equazioni di
bilancio trascuriamo
sempre l’energia
cinetica e l’energia
potenziale:
Q1
caldaia
2
pompa
Lp
1
3
2’
LT
turbina
hb - ha =q- l
4
condensatore
insieme, i quattro
componenti
costituiscono un
sistema chiuso
Q2
Serbatoio
freddo
Fig.1 - schema della macchina di Rankine
La macchina di Rankine ha avuto e ha tuttora innumerevoli applicazioni: dalla
locomotiva a vapore, alle centrali termoelettriche a combustibile chimico o nucleare.
Normalmente, il fluido che descrive il ciclo è l’acqua.
Per studiarne il funzionamento, possiamo ricorrere a tre tipi di diagramma:
p
T
2 2’
h
2’
3
3
3
3
2
2’
2
1
1
4
4
v
1
s
4
s
Fig.2 - diagrammi pressione-volume, temperatura-entropia, entalpia-entropia
Il primo è il più intuitivo, ma il secondo è il più importante (il terzo è per uso
specialistico).
-1-
Lezione del 26/10/99 – 16:30-18:30
Facciamo dunque riferimento al diagramma T-s e spieghiamo il ciclo passopasso:
12: il fluido, che è nella fase liquida, subisce una compressione isoentropica (s è
costante); ciò viene realizzato mediante una pompa, sistema aperto che non scambia
calore:
h 2 h 1 l p 0 l p h 2 h 1
(1)
22’, 2’3: il fluido viene prima riscaldato e poi vaporizzato, sempre a pressione
costante; si utilizza una caldaia, sistema aperto che non scambia lavoro:
h 3 h 2 q1 0
(2)
la quantità di calore q1 viene prelevata dai fumi caldi prodotti dalla combustione di
un combustibile e dell’aria comburente
34: il fluido, che ora è nella fase di vapore saturo secco, passa attraverso a una
turbina, sistema aperto che non scambia calore, e, espandendosi isoentropicamente,
compie lavoro:
h 4 h 3 l t 0 l t h 3 h 4
(3)
41: il fluido, nello fase di vapore saturo a bassa pressione, viene portato
completamente nella fase liquida, a pressione e temperatura costanti; per fare ciò, si
utilizza un condensatore, che cede la quantità di calore
h1 - h 4 q 2 0 q 2 h 4 h1
(4)
a una serpentina (serbatoio freddo)
Calcoliamo il coefficiente economico , rapporto tra lavoro prodotto e calore
assorbito netti:
lt lp
ε
(5)
q1
ossia, da (1),(2) e (3):
ε
h 3 h 4 (h 2 h 1 )
h3 h2
-2-
(6)
Lezione del 26/10/99 – 16:30-18:30
Ora, poiché in 12 il fluido è nella fase liquida:
h 2 h1 (p 2 p1 )v
(7)
dove v (= v1 = v2 , i liquidi sono incomprimibili; il valore per l’acqua è 1 dm3/kg) e
p1,p2 sono tabulate in funzione di T.
Per gli stati 3 e 4, in cui il fluido è nella fase di vapore saturo, vale la formula:
h h l rx
(8)
dove hl(p,T) è l’entalpia sulla curva limite inferiore (tabulata), r(p,T) è il calore
latente di vaporizzazione (tabulato) e x il titolo. Quest’ultimo vale 1 per lo stato 3 (la
massa di vapore coincide con la massa totale del fluido); va invece calcolato per lo
stato 4, sfruttando il fatto che la trasformazione 34 è isoentropica:
s3 s 4
(9)
r3
r
s l2 3
T3
T3
r
(11)
s 4 s l1 x 4 4
T4
s 3 s l2 x 3
s l2
x4
da cui:
r3
s l1
T3
r4
T4
(10)
(12)
dove sl(p,T) è l’entropia sulla curva limite inferiore (tabulata).
Notiamo poi che la (6) può essere così riscritta:
ε
(h 3 h 2 ) (h 4 h1 ) q1 q 2
h3 h2
q1
(13)
e che quindi:
l t l p q1 q 2
(14)
Confrontiamo il ciclo di Rankine e il ciclo di Carnot (perché ciò abbia senso,
devono operare tra le stesse temperature):
-3-
Lezione del 26/10/99 – 16:30-18:30
T
T
2’
3
2
1
4
s
s
Fig.3 - ciclo di Rankine e ciclo di Carnot, diagramma T-s
il ciclo di Rankine presenta delle irreversibilità; ad esempio, il fatto che man mano
che si prende calore dai fumi di combustione la loro temperatura diminuisca, è una
causa di irreversibilità esterna; il fluido è comunque sempre in equilibrio
termodinamico, per cui l’area del ciclo nel diagramma rappresenta la differenza tra il
calore assorbito e il calore ceduto, cioè il lavoro prodotto, come per il ciclo di
Carnot. Guardando le figure, è lecito aspettarsi che il rendimento termodinamico
ηT
ε
εc
(15)
(rapporto tra il coefficiente economico della macchina di Rankine e quello della
macchina di Carnot) assuma un valore prossimo all’unità.
Esercizio numerico
Determinare il coefficiente economico per un ciclo di Rankine con
T1 = T4 = 40 C
T2 = T3 = 250,3 C
Da (7):
h 2 h1 (p 2 p1 )v h l1 (p 2 p1 )v
167,5 (4000 7,38)0,001 171,5
kJ
kg
Da (8):
h 3 h l2 r3 x 3 1087,4 1712,9 2800,3
kJ
kg
-4-
Lezione del 26/10/99 – 16:30-18:30
Da (12):
s l2
x4
r3
s l1
T3
6,069 0,572
0,714
r4
2406,9
313
T4
Da (8):
h 4 h l1 r4 x 4 167,5 2406,9 0,714 1886
kJ
kg
Quindi, da (6):
ε
h 3 h 4 (h 2 h 1 ) 2800,3 1886 (171,5 167,5)
0,346
h3 h2
2800,3 171,5
Facciamo un confronto con il ciclo di Carnot:
εc 1
T1
313
1
0,402
T2
523,3
Quindi:
ηT
ε 0,346
0,86
ε c 0,402
(grande!)
-5-
Lezione del 26/10/99 – 16:30-18:30
MACCHINA DI RANKINE CON SURRISCALDATORE
Abbiamo visto che il vapore saturo secco in uscita dalla caldaia viene fatto
espandere utilizzando una turbina; ma poiché nello stato 4 il titolo è abbastanza
minore di 1, ci sono gocce di liquido che entrano in violento contatto con le parti
meccaniche della turbina e le erodono.
In genere si adotta la seguente soluzione:
Serbatoio
caldo
Q33’
Q1
3
serpentino riscaldatore
caldaia
2
pompa
Lp
1
2’
3’
turbina
LT
4’
condensatore
Q2
Serbatoio
freddo
Fig.4 - schema della macchina di Rankine con surriscaldatore
Il serpentino riscaldatore fa sì che il fluido in uscita dalla caldaia passi dalla fase
di vapore saturo secco in quella di vapore surriscaldato.
p
T
T3’
2 2’
1
2’
3 3’
3 3
4
3’
3
2
1
4’
4 4’
s
v
Fig.5 – diagrammi pressione-volume, temperatura entropia
E’ evidente che il valore del titolo nello stato 4’ è molto più vicino a 1.
La nuova formula per il coefficiente economico è:
ε
h 3 h 4 (h 2 h 1 )
h 3 h 2
-6-
(16)
Lezione del 26/10/99 – 16:30-18:30
Per lo stato 3’ vale la formula:
h 3 h 3 c p (T3 T3 )
(17)
da cui ricaviamo il calore specifico medio a pressione costante cp, leggendo h3’
dalla tabella del vapore surriscaldato (o viceversa ricaviamo h3’ leggendo cp dalla
relativa tabella).
Per h4’ usiamo la (8), con x4’ ricavato da:
s 3 s 4 s 3 c p ln
T3
r
s l1 x 4 4
T3
T4
(18)
dove s3 è data dalla (10).
Esercizio numerico
Determinare il cefficiente economico per un ciclo di Rankine con
surriscaldamento, date:
T1 = T4 = 40 C
T2 = T3 = 250,3 C
T3’= 500 C
Da (17):
cp
h 3 h 3 3445 - 2800,3
kJ
2,57
T3 T3
500 - 250
kgK
Da (18):
s 3 s 3 c p ln
x 4
T3
773
kJ
6,069 2,57ln
7,07
T3
523,3
kg
s 3 s l1 7,07 0,572
0,845
r4
2406,9
T4
313
Da (8):
h 4 h l1 r4 x 4 167,5 2406,9 0,845 2201,33
kJ
kg
Quindi, da (16):
ε
h 3 h 4 (h 2 h1 ) 3442,8 2201,33 (171,5 167,5)
0,378
h 3 h 2
3442,8 171,5
-7-
Lezione del 26/10/99 – 16:30-18:30
NOTA:
Per confrontare la macchina di Rankine con surriscaldatore e la macchina di
Carnot, è sbagliato calcolare t come rapporto tra i coefficienti economici con
εc 1
T1
313
1
0,595
T3
773
Si otterrebbe 0,635: apparentemente peggio rispetto al caso della macchina di
Rankine senza surriscaldatore!
L’errore sta nel fatto che si sta fornendo alla macchina di Carnot più calore di
quello dato alla macchina di Rankine con surriscaldatore:
T
T3’
T
T3’
s
s
calore convertito in lavoro
dalla macchina di Carnot
calore sfruttato in più dalla
macchina di Carnot rispetto
alla macchina di Rankine
con surriscaldatore
Fig.6 – confronto tra le quantità di calore
Bisogna guardare il diagramma che descrive l’andamento della temperatura del
serbatoio caldo (fumi prodotti bruciando combustibile e aria) in funzione della
quantità di calore da esso sottratta, e confrontare le due macchine in base alla
quantità di calore che effettivamente riescono a sfruttare (exergia):
T
Surriscaldamento (33')
To
500°
Vaporizzazione (2'3)
(caldaia)
Preriscaldamento (22')
250°
Presenza di acqua
100°
20°
q
Fig.7 – in rosso: diagramma T-q del serbatoio caldo, in nero: trasformazione 23 nel ciclo di
Rankine con surriscaldamento, in blu e celeste: due esempi di passaggi analoghi nel ciclo di Carnot
-8-
Lezione del 26/10/99 – 16:30-18:30
Concludendo, solo con un’infinita successione di cicli di Carnot si riesce ad estrarre
tutto il calore dai fumi:
T
To
q
Fig.8 – estrazione totale del calore per mezzo di infiniti cicli di carnot
La macchina di carnot sarebbe ottima se il serbatoio caldo fosse a temperatura
costante.
Esercizio numerico conclusivo
Calcolare il CUC (coefficiente di utilizzazione del combustibile = rapporto tra
l’energia utilizzata e quella disponibile in partenza) di una centrale di cogenerazione,
che funzione secondo il principio della macchina di Rankine con surriscaldatore (e
sfrutta Q2 per il riscaldamento cittadino), noti i seguenti dati:
T1 = T4 = 80 C
P3 = 40 BAR
T3’ = 700 C
distr = 95% (percentuale di Q2 effettivamente sfruttata)
comb = 90% (Q1 non è tutto il calore generato nel serbatoio caldo)
E’ facile vedere che, nel caso in esame:
CUC
Dalle tabelle, poi, leggo:
T1 = 80 C p1= 0,4736 BAR
p3 = 40 BAR T3 = T2 = 250,3 C
h1 = hl1 = 340,5 kJ/kg
r4 = 2305,4 kJ/kg
Dagli esercizi precedenti, prendo pari pari v, h3 e s3.
-9-
l t ηdistr q 2
q1 ηcomb
Lezione del 26/10/99 – 16:30-18:30
Quindi, da (17):
cp
h 3 h 3 3906,6 - 2800,3
kJ
2,46
T3 T3
700 - 250
kgK
Da (18):
s 3 s 3 c p ln
x 4
T3
973
kJ
6,069 2,46ln
7,59
T3
523,3
kgK
s 3 s l1 7,59 0,572
1
r4
2305,4
353
T4
(4’ è sulla curva limite!)
Allora, da (8):
h 4 h l1 r4 x 4 340,5 2305,4 1 2645,9
kJ
kg
Poi, da (3), (2), (4) e (7):
l t h 3 h 4 1260,7
kJ
kg
h 2 h1 (p 2 p1 )v 344,4
q1 h 3 h 2 3562,2
kJ
kg
q 2 h 4 h1 2305,4
kJ
kg
kJ
kg
E infine:
CUC
l t ηdistr q 2
q1 ηcomb
1260,7 0,95 2305,4
0,872
3562,2 0,9
Molto bene! Una centrale Enel tradizionale ha un CUC 0,4.
- 10 -
Lezione del 26/10/99 – 16:30-18:30
T
(C)
0,01
4
8
12
16
20
24
28
32
36
40
44
48
52
56
60
64
68
72
76
80
84
88
92
96
100
104
108
112
116
120
p
(BAR)
0,006112
0,008129
0,010720
0,014014
0,018168
0,023366
0,029821
0,037782
0,047534
0,059400
0,073750
0,091001
0,11162
0,13613
0,16511
0,19920
0,23912
0,28563
0,33958
0,40191
0,47360
0,55573
0,64948
0,75608
0,87686
1,01325
1,1668
1,3390
1,5316
1,7465
1,9854
hl
(kJ/kg)
0
16,8
33,6
50,4
67,1
83,9
100,6
117,3
134,0
150,7
167,5
184,2
200,9
217,6
234,4
251,1
267,8
284,6
301,4
318,1
334,9
351,7
368,5
385,4
402,2
419,1
435,9
452,9
469,8
486,7
503,7
TAB.1 – Vapore Saturo
- 11 -
r
(kJ/kg)
2501,6
2492,1
2482,6
2473,2
2463,8
2454,3
2444,9
2435,4
2425,9
2416,4
2406,9
2397,3
2387,7
2378,1
2368,4
2358,6
2348,8
2338,9
2329,0
2318,9
2308,8
2298,6
2288,4
2278,0
2267,5
2256,9
2246,3
2235,4
2224,5
2213,4
2202,2
sl
(kJ/kgK)
0
0,0611
0,1213
0,1805
0,2388
0,2963
0,3530
0,4088
0,4640
0,5184
0,5721
0,6252
0,6776
0,7293
0,7804
0,8310
0,8809
0,9303
0,9792
1,0275
1,0753
1,1225
1,1693
1,2156
1,2615
1,3069
1,3518
1,3964
1,4405
1,4842
1,5276
Lezione del 26/10/99 – 16:30-18:30
T
(C)
250
300
350
400
450
500
550
600
650
700
h
(kJ/kg)
2800,3
2962,0
3095,1
3215,7
3331,2
3445,0
3558,6
3672,8
3787,9
3906,6
s
(kJ/kgK)
6,0685
6,3642
6,5870
6,7733
6,9388
7,0909
7,2333
7,3680
7,4961
7,5947
TAB.2 – Vapore surriscaldato
(p = 40 BAR, hl = 1087,4 kJ/kg)
Tabelle più complete si trovano su:
T
(C)
300
350
400
450
500
550
600
650
700
Zemanski “Termodinamica per ingegneri”
cp
(kJ/kgK)
3,136
2,891
2,742
2,648
2,579
2,533
2,500
2,475
2,458
TAB.3 – Calore specifico medio del vapore surriscaldato
(p = 40 BAR, hl = 1087,4 kJ/kg)
- 12 -