
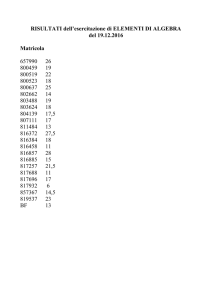
ESERCITAZIONI DI BIOLOGIA MOLECOLARE AA 2012/2013
Descrizione generale esercitazioni di laboratorio
Analisi del risultato di un clonaggio mediante elettroforesi su gel di agarosio:
1)
Preparazione di DNA plasmidico dalle colonie trasformate
2)
Analisi del DNA plasmidico su gel di agarosio
Preparazione soluzione per la digestione con enzimi di restrizione
3)
Digestione DNA plasmidico con enzimi di restrizione
Analisi spettrofotometrica del DNA preparato
4)
Analisi della digestione su gel di agarosio
Discussione dei risultati
1
2
ESERCITAZIONI DI BIOLOGIA MOLECOLARE AA 2012/2013
Esercitazione 1
1) Esercizi con le pipette Gilson (“pistole”)
-
Regolate la P20 su 10 l e la P200 su 100 l
-
Utilizzando le due eppendorf con 10 l e 100 l di acqua fare prove di
aspirazione ed espulsione (sempre nella stessa eppendorf).
2) Minipreparazione DNA plasmidico
- prendere le 3 minicolture (5 ml ciascuna) cresciute nella notte:
A= controllo, vettore senza inserto (da piastra n. 1)
B= plasmide da determinare (da piastra n. 2)
C= controllo, vettore con inserto (da piastra n. 3)
- centrifugare in centrifuga da tavolo 3 min a 3000 rpm
- eliminare il supernatante (versare nel lavandino ed eventualmente aspirare le
ultime gocce)
- risospendere i pellet batterici (A, B e C) in 200l/tubo di Soluzione 1 +
RNAsi. Trasferire in eppendorf e incubare 5 min a temp amb
- aggiungere 200l di Soluzione 2 (alcalina). Agitare rapidamente ma delicatamente
per inversione 4-5 volte
- incubare 5 min in ghiaccio
- aggiungere 200l di Soluzione 3 (3M Kacetato pH 5) e agitare delicatamente
- incubare 5 min in ghiaccio
- centrifugare 5 min in microcentrifuga da tavolo a velocità massima
- trasferire (versandolo) il supernatante nel tubo Eppendorf (preparato dagli
assistenti) contenente 200l di Mix (fenolo-cloroformio) e agitare energicamente
ATTENZIONE: LA MIX FENOLO-CLOROFORMIO PUO' PROVOCARE
USTIONI A CONTATTO COL LA PELLE. CONTROLLARE LA
CHIUSURA DEL TUBO EPPENDORF PRIMA DI AGITARE E
INDOSSARE I GUANTI DURANTE LA MANIPOLAZIONE DEL TUBO
CONTENENTE LA MIX
- centrifugare 1 min in microcentrifuga da tavolo a velocità massima
- trasferire (aspirandolo con micropipetta) la fase acquosa (superiore) in un nuovo
tubo Eppendorf
3
- aggiungere alla fase acquosa trasferita nel tubo nuovo 0,7 volumi di isopropanolo
(circa 420l) e agitare capovolgendo il tubo più volte
- incubare 5 min a temp amb
- centrifugare 10 min in microcentrifuga da tavolo a velocità massima
- eliminare il supernatante (aspirando o versando) e lasciare scolare bene
ATTENZIONE:
DOVETE
CERCARE
DI
ELIMINARE
COMPLETAMENTE L'ISOPROPANOLO DALLA EPPENDORF
PERCHE' TRACCE DI ALCOOL NEL CAMPIONE POSSONO
RENDERE DIFFCILE IL CARICAMENTO SU GEL
- risospendere il pellet in 50l di TE
- conservare i campioni come indicato dagli assistenti (tre tubi contrassegnati A
n.gruppo, B n.gruppo e C n.gruppo)
Materiali Esercitazione 1
Eppendorf da 1,5 ml vuote
2 eppendorf con 10 e 100 l d’acqua
ghiaccio
3 minicolture per miniprep
isopropanolo (1,5 ml/gruppo)
3 eppendorf con miscela fenolo-cloroformio (200 l / eppendorf)
soluzione 1 con RNAsi (circa 1 ml a gruppo)
soluzione 2 (circa 1 ml a gruppo)
soluzione K acetato 3 M pH 5 (circa 1 ml a gruppo)
TE (10 mM Tris pH 8, 1 mM EDTA) (100 l/gruppo)
Strumenti
microcentrifuga
4
ESERCITAZIONI DI BIOLOGIA MOLECOLARE AA 2012/2013
Esercitazione 2
1) Analisi qualitativa dei DNA su gel di agarosio
- Preparare i seguenti campioni da caricare su minigel di agarosio 1% (preparato dagli
assistenti)
1) DNA plasmidico A: 10l di plasmide (prelevato dai vostri campioni
dell'esercitazione 1)+ 2l colorante
2) DNA plasmidico B: 10l di plasmide (prelevato dai vostri campioni
dell'esercitazione 1)+ 2l colorante
3) DNA plasmidico C: 10l di plasmide (prelevato dai vostri campioni
dell'esercitazione 1)+ 2l colorante
4) marcatore di quantità = 10l (200ng) (fornito dagli assistenti) + 2l colorante
- DOPO AVER PRELEVATO LE ALIQUOTE CONSERVARE I TUBI A, B, C,
PER LE ESERCITAZIONE SUCCESSIVE
- Caricare il gel di agarosio secondo le indicazioni
- Finita la corsa elettroforetica verrà scattata un foto del gel tramite webcam.
L’immagine sarà disponibile su Didattica web per la discussione del risultato
2) Preparazione soluzione concentrata (10X) per la digestione con enzimi di
restrizione
Questa soluzione verrà usata (diluita 10 volte) per la reazione di digestione con
enzimi di restrizione nella prossima esercitazione.
Preparare 5 ml di soluzione :
100 mM Tris pH 7,5
100 mM MgCl2
1 M NaCl
a partire dalle soluzioni (consegnate dagli assistenti):
1) Tris-HCl pH7.5 1M
2) MgCl2 1M
e da NaCl in polvere (peso mol. 58)
- scrivete il numero del gruppo sul tubo con la soluzione e conservate per
l'esercitazione successiva
5
Materiali Esercitazione 2
Eppendorf da 1,5 ml
tubi da 5 (o 10) ml (1/gruppo) (indicare il livello 5 ml)
soluzione di caricamento su gel (Ficoll blu) (10 l a gruppo):
(Ficoll 30%,Blu di Bromofenolo 0,1%, EDTA 50 mM)
gel d'agarosio (6 gruppi/gel)
tampone elettroforesi TAE 1X
polaroid
NaCl (0,5 g/gruppo in 2-3 falcon da 50 ml)
Tris-HCl pH7.5 1M (0,7 ml/gruppo)
MgCl2 1M (0,7 ml/gruppo)
H2O per la soluzione da preparare (portare alcuni falcon da 50 ml)
Strumenti
apparati elettroforesi
bilancia
6
ESERCITAZIONI DI BIOLOGIA MOLECOLARE AA 2012/2013
Esercitazione 3
1) Digestione DNA plasmidico (B o C) con enzimi di restrizione
- Preparare la reazione di digestione con gli enzimi di restrizione EcoRI e SacI in
tubo Eppendorf (contrassegnato con "RB o RC n. gruppo scritto sul tappo"):
- Aggiungere nell'ordine:
DNA plasm B o C
soluzione 10X
EcoRI-SacI
17l
2 l
1l
tot. 20 l
- Incubare a 37°C per 1 ora
- conservare i campioni per l'esercitazione successiva
2) Analisi fotometrica del DNA
- Preparare una diluizione (che chiameremo AD) prelevando 10 l della soluzione di
DNA plasmidico A e aggiungerli a 90 l di TE inn tubo Eppendorf
- Trasferire i 100 l nella cuvetta per lettura UV (plastica speciale)
- Utilizzare la cuvetta con solo TE (messa a disposizione) come "blank" per la lettura
- Leggere il campione col minifotometro aiutati dagli assistenti:
selezionare dsDNA premendo ENTER quando sul display compare "dsDNA"
accettare il fattore di conversione proposto premendo ENTER
inserire il "blank" e premere il tasto READ BLANK
finita la lettura premere la freccia destra
inserire il campione e premere il tasto READ SAMPLE
premere il tasto 260/280 e poi il tasto PRINT e poi 1
- Utilizzare il valore di assorbanza a 260 nm per calcolare:
1. la concentrazione della soluzione AD (A diluita)
2. la concentrazione della soluzione A originale
3. la quantità di DNA contenuta nella soluzione A originale
- Prendere nota del rapporto 260/280 per poi discuterlo nella relazione
7
Materiali Esercitazione 3
Eppendorf da 1,5 ml
Ghiaccio
Cuvette per spettrofotometro
enzima EcoRI (5 l/gruppo)
TE (100 l/gruppo)
Strumenti
Bagnetto (o stufa) a 37°C
fotometro
8
ESERCITAZIONI DI BIOLOGIA MOLECOLARE AA 2012/2013
Esercitazione 4
1) Analisi qualitativa dei DNA su gel di agarosio
- Preparare i seguenti campioni da caricare su minigel di agarosio 1% (preparato dagli
assistenti)
1) DNA plasmidico lineare (vettore di clonaggio digerito con EcoRI) fornito dagli
assistenti+ 2l colorante
2) DNA plasmidico digerito RB (o RC): 10l di mix di digestione (prelevati dai
vostri campioni dell'esercitazione precedente)+ 2l colorante
- Caricare il gel di agarosio secondo le indicazioni
- Su ogni gel verra' caricato anche un marcatore di peso molecolare
- Finita la corsa elettroforetica verrà scattata un foto del gel tramite webcam.
L’immagine sarà disponibile su Didattica web per la discussione del risultato
2) stima semi-quantitativa del DNA plasmidico
- considerando l’immagine del primo gel:
a) confrontate l'intensità della banda del marcatore (200 ng) con la somma
delle bande del plasmide A
b) considerando la quantità di plasmide A caricato sul gel rispetto al totale
ottenuto
calcolare la quantità totate di plasmide A ottenuta con la preparazione
9
Materiali Esercitazione 4
Eppendorf da 1,5 ml
colorante Ficoll-Blu (10 l a gruppo)
marcatori di peso molecolare
gel d'agarosio (6 gruppi/gel)
tampone elettroforesi TAE 1X
webcam
Strumenti
apparati elettroforesi
10







![(Microsoft PowerPoint - PCR.ppt [modalit\340 compatibilit\340])](http://s1.studylibit.com/store/data/001402582_1-53c8daabdc15032b8943ee23f0a14a13-300x300.png)



