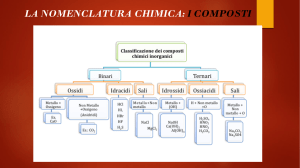
Corso Di CHIMICA GENERALE ED INORGANICA
Anno Accademico 2007/2008
Prova intercorso del 05/05/2008
(C)
1.
Bilanciare le seguenti reazioni di ossido-riduzione:
Br2 = HBr + HBrO3
[Au(OH)4]- + N2H4 = Au + N2
As2O3 + Zn + H2SO4
2.
(sol basica)
= ZnSO4 + AsH3 + H2O
Scrivere le formule di struttura, indicando le geometrie molecolari, per i seguenti composti:
nitrito di ammonio, solfito monoacido di potassio, acido perclorico
3.
Indicare quale metallo alcalino, M, è presente nel composto MBr (composto che si dissocia
completamente in M+ e Br-) sapendo che una soluzione contenente 84.0 g di MBr in 680.0
g di acqua presenta una temperatura di ebollizione di 101.30 °C. Ke di H2O = 0.56.
4.
Indicare che volume di acqua bisogna aggiungere a 400.0 mL di una soluzione di acido
solforico al 20 % in peso e con densità di 1.30 Kg/L per ottenere una soluzione a
concentrazione 1.50 M.
5.
La tensione di vapore dell’acqua a 84.0 °C è pari a 408.1 torr. Calcolare la tensione di
vapore, alla stessa temperatura, della soluzione ottenuta sciogliendo 4.149 g di NaOH in
285.0 g di acqua. (NaOH si dissocia completamente nei due ioni)