![(di densità = 0,80 g/mL) in condizioni standard a 25°C. [3,8 10 4 kJ]](//s1.studylibit.com/store/data/001951200_1-e10cab800f4a49407aacd470c2d4360d-768x994.png)
2° Test di autovalutazione
Corso di Chimica
Leggere attentamente e rispondere ai quesiti e agli esercizi per valutate la propria preparazione.
1) 17 L (100° C ed 1 atm) di una miscela di SO3 ed SO2 presentano una massa pari a 37 g. Determinare
la composizione della miscela espressa in % in volume.
[% SO3 = 84 % ; % SO2 = 16 %]
2) Calcolare il volume di biossido di zolfo, misurato in condizioni normali (0°C, 1 atm), prodotto dalla
combustione di 10 g di zolfo (S8).
[7,0 L]
3) Dal petrolio si può ottenere una miscela di gas combustibile (CO eH2) con la reazione:
C4H16 + 6 H2O
6 CO (g) + 13 H2 (g)
3
Calcolare il volume (in m ) di miscela gassosa (misurati a 25°C e 1 atm) ottenuti da 100 kg di C6H14.
[540 m3]
4) La reazione di combustione del metano è:
2C4H10 (g) + 13 O2 (g)
8 CO2 (g) + 10 H2O (l)
Quale massa di questo gas fornisce per combustione 350 kJ di calore?
H = - 5754 kJ/mole.
[7,07 g]
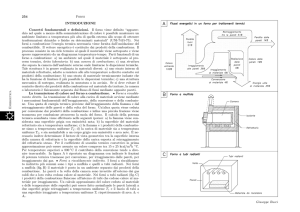
5) La benzina, sebbene sia costituita, chimicamente, da una miscela di idrocarburi, da un punto di
vista termodinamico ha proprietà simili a quelli dell’ ottano puro. Calcolare la quantità di calore
liberata dalla combustione completa di 1,0 L di benzina (di densità = 0,80 g/mL) in condizioni
standard a 25°C.
[3,8 104 kJ]
6) La densità dell’ etanolo è 0,79 g/mL. Calcolare la quantità di calore liberato dalla combustione, in
condizioni standard, di 1.0 L di etanolo a 25° C sapendo che l’ entalpia standard di combustione dell’
etanolo liquido è pari a – 1368 kJ/mole.
[2,3 104 kJ]
7) Determinare la quantità di calore (in kJ) prodotta dalla combustione di 10,0 m3 di CH4 , misurati a
20°C e 1 atm, sapendo che l' entalpia di combustione del metano è pari a -890,8 kJ/mole. Calcolare,
inoltre, il volume (in m3) di aria (80% N2 e 20% O2 in volume) misurato a 20°C e 1 atm necessario per
la combustione. (scrivere la reazione di combustione bilanciata).
[3,7 105 kJ: 100 m3]
8) Utilizzando la teoria delle bande (di Bloch) giustifica la presenza di solidi conduttori, isolanti e
semiconduttori.
9) L' alcool n-butilico e l' etere dietilico hanno la stessa formula bruta (C4H10O), ma diversa formula
di struttura:
alcool n-butilico: CH3-CH2-CH2-CH2-OH
temp. Eboll. 117 °C
etere dietilico:
CH3-CH2-O-CH2- CH3
temp. Eboll. 34,5 °C
Giustificare la diversa temperatura di ebollizione.
10) Definire l'energia di prima ionizzazione e l'affinità per l'elettrone e spiegare la loro variazione
nell'ambito del sistema periodico.
![(di densità = 0,80 g/mL) in condizioni standard a 25°C. [3,8 10 4 kJ]](http://s1.studylibit.com/store/data/001951200_1-e10cab800f4a49407aacd470c2d4360d-768x994.png)