Chimica Generale e Inorganica
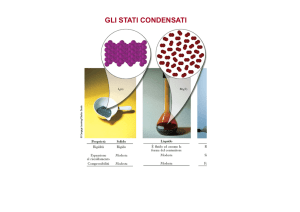
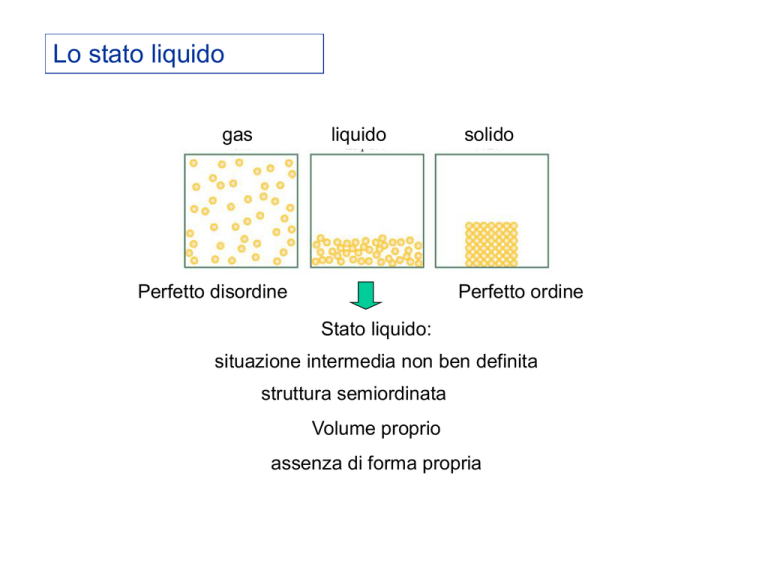
Lo stato liquido
gas
liquido
Perfetto disordine
solido
Perfetto ordine
Stato liquido:
situazione intermedia non ben definita
struttura semiordinata
Volume proprio
assenza di forma propria
Chimica Generale e Inorganica
Modello per lo stato liquido: modello del volume libero
Il liquido è un’insieme di regioni ordinate,
regioni disordinate, e spazio occupato da
molecole libere
Le particelle che si trovano nelle cavità si
comportano come nello stato gassoso
Le particelle distanti da queste cavità si
comportano come nello stato solido
Volume libero = 3% del volume
Densità gas < densità liquido (>800 volte )< densità solido (>1,2 volte)
Distanze molecolari poco maggiori di quelle dello stato solido
Bassa compressibilità (circa 3% del volume libero)
Viscosità (minore volume libero → maggiore viscosità)
Aumento del volume con la T (maggiore energia cinetica della particella nelle cavità
→ maggiore volume libero)
Diffusione: 10-6 cm2/sec, circa ¼ che nei gas
Chimica Generale e Inorganica
Tensione superficiale (g)
i liquidi possiedono una superficie che li
delimita.
Una molecola interna al liquido subisce
attrazione in tutte le direzioni.
Una molecola di superficie subisce
attrazione solo verso l’interno del liquido
Le forze attrattive
intermolecolari agiscono sul
liquido minimizzando l’area
superficiale del liquido.
Gocce di liquido di forma sferica
La creazione di nuova superficie richiede di fornire energia al sistema.
Tensione superficiale (g) è il lavoro necessario per aumentare la superficie di 1m2
Chimica Generale e Inorganica
Sulle superfici idrofiliche (bagnabili) il liquido tende a salire lungo le pareti
provocando 2 fenomeni:
Menisco superficiale (superficie curva)
Innalzamento capillare
r
h
2g
h
dgr
g = accelerazione di gravità
d = densità liquido
r = raggio di curvatura
l’innalzamento capillare dipende dal diametro del tubo: tanto
minore è il diametro tanto maggiore l’innalzamento capillare
Chimica Generale e Inorganica
Evaporazione: passaggio dallo stato liquido allo stato vapore
equilibrio dinamico
evaporazione
condensazione
v evaporaz = v condensaz
Tensione di vapore = pressione dovuta alle molecole di vapore sul
liquido all’equilibrio ed alla temperatura considerata (DG = GV - GL= 0)
Chimica Generale e Inorganica
i liquidi evaporano anche a temperature inferiori alla temperatura
di ebollizione
Tensione (pressione) di vapore = pressione che esercita il vapore in
equilibrio con il suo liquido (dipende dalla temperatura)
Temperatura di ebollizione = la temperatura a cui la tensione di vapore
eguaglia la pressione atmosferica (si formano bolle di vapore all’interno del
liquido)
Teb= H2O
100 °C a pressione atmosferica 760 mmHg
90 °C a pressione atmosferica 552 mmHg (3500 m )
Chimica Generale e Inorganica
Frazione delle molecole di liquido con energia sufficiente a passare allo stato di
vapore: curva di distribuzione di Maxwell-Boltzmann
E* energia minima per
lasciare il liquido
E’ caratteristica di ogni liquido
poiché dipende dalle forze di
interazione intermolecolari.
N E* N 0e
P k e
E*
RT
E*
RT
La pressione di vapore P dipende dal valore E*
E* = DH di evaporazione
pressione costante
se l’energia è fornita sotto forma di calore, a
Chimica Generale e Inorganica
Legge di Clausius-Clapeyron:
All’equilibrio:
vcondensazione vevaporazione
c1 P c 2 e
ΔH evap
c2
P e
c1
RT
DH ev
RT
ke
DH ev
RT
passando ai logaritmi:
ΔH ev
lnP lnk
RT
DH ev
log P log k
2,3RT
Stato a P1 e T1
Stato a P2 e T2
DH ev
log P1 log k
2,3RT1
DH ev
log P2 log k
2,3RT2
sottraendo membro a membro
DH ev 1 1
log P2 log P1
2,3R T2 T1
DH ev 1 1
P2
log
P1
2,3R T2 T1
Chimica Generale e Inorganica
Legge di Clausius-Clapeyron
DH ev 1 1
P2
log
P1
2,3R T2 T1
La tensione di vapore cresce con la temperatura (DHevap >0) ed è caratteristica
per ogni sostanza poiché dipende dal tipo di interazioni tra le particelle.
Chimica Generale e Inorganica
Curva di riscaldamento di un solido: temperatura del solido in funzione
del tempo di riscaldamento
Durante un passaggio di
stato la temperatura del
sistema è costante.
Il calore fornito serve a
rompere i legami tra le
particelle
DHevap > DHfus
Il calore specifico dipende
dallo stato di aggregazione
Chimica Generale e Inorganica
Curva di raffreddamento di liquidi
Solido amorfo
sottoraffreddamento
Chimica Generale e Inorganica
Cambiamento di stato: Diagrammi di stato
Diagramma di stato di H2O
Parametri di stato: P e T
Curve = rappresentano i
punti di equilibrio tra due
stati di aggregazione
P k e
Punto triplo = coesistono
in equilibrio i tre stati di
aggregazione
ΔH liq
RT
Pc
Punto critico = al di sopra
di Tcr e Pcr non può
esistere la fase
liquidafluido supercritico
DH ev
RT
DH sub
RT
P k e
P k e
Vsol > V liq
0°C
Chimica Generale e Inorganica
Diagramma di stato di CO2
(VL-VS) > 0
in condizioni standard CO2 è gas
1
-78,5°
Chimica Generale e Inorganica
Diagramma di stato dello zolfo
4 fasi
2 fasi solide
rombico
monoclino
curve metastabili