Chirurgia del distacco retinico
pediatrico
Giorgio Tassinari
Incidenza
• 3,2-5,6% del totale
• 0,38-0,69/100.000
• 70% maschi (trauma; sdr. X-linked)
• 30% femmine
Fivgas et Al. Retina april 2001
Haiman et Al. Arch Ophthalmology 1982
Sann-ni et Al. Retina 2006
Nan-Kai et Al. Ophthalmology 2005
Incidenza
• Si può ritenere che il 40% dei distacchi di retina
regmatogeni in età pediatrica, contro l’11% in età
adulta sia secondario ad un trauma
(Dialisi giovanili post-traumatiche (23-42%)
• La maggior parte dei casi risulta associato alla
miopia
• In minor percentuale risulta associato a sindromi o
secondario ad interventi chirurgici (34% dei casi)
Haiman et Al. Arch Ophthalmology 1982
Latikainen et Al Acta Ophthalmologica 1985
Il bulbo oculare presenta in età pediatrica rispetto all’adulto differenti
rapporti vitreo-retina periferica e quindi differenti punti di repere anatomochirurgici.
Nei primi anni di vita si verificano importanti modificazioni
nelle dimensioni del bulbo, nella lunghezza assiale del globo oculare
ed in modo particolare a livello del segmento posteriore.
Infatti mentre il segmento anteriore è all’incirca del 20% inferiore
rispetto alle dimensioni adulte, il segmento posteriore è inferiore dell’80%
circa.
Il segmento posteriore aumenta drammaticamente di dimensione nei primi
sei mesi di vita, fino a oltre il 50% (Larsen JS, 1971).
A tre anni, la lunghezza assiale è approssimativamente il 95% rispetto
all’adulto (Grignolo A, Rivara A, 1968) (Sorsby A, 1989).
I corpi ciliari presentano alla nascita una lunghezza media di 3,06 mm
nasalmente e 3,31 mm temporalmente; a 24 mesi la lunghezza dei corpi ciliari è
circa i ¾ rispetto all’occhio adulto (Aiello AL e coll., 1992).
A sei anni di età, i corpi ciliari nasali raggiungono il 90% della lunghezza da
adulto, e i corpi ciliari temporali l’85%.
Uno sviluppo simile lo presenta la pars plana, che occupa il 75%
della lunghezza totale dei corpi ciliari.
Entrambe le strutture, corpi ciliari e pars plana sono presenti e distinguibili alla
nascita.
Questi diversi rapporti spaziali dell’occhio del bambino rispetto all’adulto
condizionano le tecniche di chirurgia vitreoretinica.
L’inserzione anteriore della retina (Daicker B, 1972) ( Kwitko ML, 1979) richiede la
esecuzione delle sclerotomie in pars plicata (Maguire AM, Trese MT, 1992)
al fine di evitare rotture di retina iatrogene.
Altro problema riguarda il cristallino che nei bambini occupa una parte maggiore
della camera vitrea, con maggiori difficoltà di manipolazione degli strumenti
chirurgici per il rischio di danno meccanico al cristallino.
(Kwitko ML 1979) (Apple DJ, Naumann GOH, 1986),
Anche le correnti determinate dai fluidi di infusione in camera vitrea possono
danneggiare il cristallino.
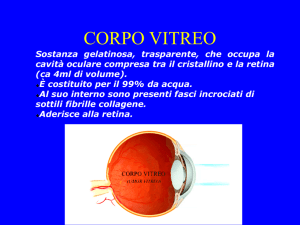
In età pediatrica, il corpo vitreo presenta aderenze molto marcate con la retina e
non è presente il distacco posteriore di vitreo (Seebag J, 1991).
Creare un distacco posteriore di vitreo durante la vitrectomia, a questa età è molto
difficile e spesso impossibile per la tenace aderenza della ialoide posteriore alla
retina.
Altra caratteristica da non sottovalutare è tendenza alla proliferazione
vitreoretinica.
E’ risaputo che la proliferazione vitreoretinica ha in età pediatrica un decorso molto
più precoce e rapido rispetto agli adulti (Bodard GE, e coll,, 1978).
Quando è necessario applicare un cerchiaggio episclerale bisogna ricordare
che le bande in silicone larghe 2 mm o 2,5 mm, a questa età possono
supportare un’ampia porzione di retina periferica, potendosi estendere
dall’ora serrata
fino all’equatore.
Con l’età, l’ingrandimento del bulbo e il rilascio delle trazioni anteriori,
può essere necessario rimuovere la banda di silicone anche per evitarne
lo scivolamento posteriore.
La scelta del sostituto vitreale come mezzo tamponante è condizionata
dalla difficoltà nell’utilizzo dei gas, relativa alla gestione postoperatoria,
sia per il posizionamento che per il monitoraggio della pressione
intraoculare,
a favore dell’utilizzo del silicone
(Rodriguez F, Lewis H, 1991).
Eziologia
•
•
•
•
Nelle anomalie congenite
Nelle m. ereditarie
DRR secondari a colobomi
DRR nelle dermatiti atopiche (3%-tarda
adolescenza
• DDR post traumatico
Capone et Al. Pediatric Retina, 2005
Eziologia
• Miopia patologica o degenerativa (>4D)
• Miopia associata a malattie non ereditarie:
Prematurità
Da deprivazione sensoriale (ptosi congenita,
cataratta, opacità corneali)
• Miopia patologica associata a sindromi
Sindrome di Stickler
Sindrome di Marfan
Sindrome di Wagner
•
•
•
•
Leucocoria
Strabismo
Bilateralità non infrequente
Frequente coinvolgimento maculare
(80% versus 56% negli adulti )
• Frequente presenza di PVR (50%)
Fivgas et Al. Retina april 2001
Winslow et Al. Opthalmology 1978
Hilton et Al. Mod Probl Ophthalmol. 1969
• Bassa età postmestruale (PMA)
• Zona I
Sono fattori di rischio per
ORGANIZZAZIONE FIBROVASCOLARE
nel vitreo
nelle due settimane successive al
trattamento Laser
(D.R. trazionale ROP st 4)
Degenerazioni vitreoretiniche familiari
Il distacco di retina in età giovanile insorge nella
maggior parte dei casi come conseguenza di :
- liquefazione del gel vitreale
- distacco posteriore di vitreo
- formazione di rotture retiniche a livello delle
aderenze vitreo retiniche
Molte condizioni determinate geneticamente si
possono associare a queste alterazioni vitreo
retiniche
DEGENERAZIONE VITREO RETINICA EREDITARIA
DI WAGNER- JANSEN- STICKLER
Descritta da Wagner nel 1938 nello studio di una
famiglia svizzera (18 persone 5 - 42 aa)
Si caratterizza per 3 peculiarità:
- cavità vitreale otticamente vuota
- membrane e strands vitreali
- degenerazione retinica a lattice
Alterazioni pigmentarie periferiche, vasi retinici
ristretti e fibrotici, atrofia ottica, cataratta.
DEGENERAZIONE VITREO RETINICA EREDITARIA
DI WAGNER- JANSEN- STICKLER
Jansen nel1962 dimostrò una maggiore incidenza
di distacco di retina ( 50- 75%)
Sticker descrisse nel 1965 la presenza di anomalie
facciali (naso piatto,glossoptosi), del palato
(palatoschisi) e scheletriche (condrodisplasia),
correlate alle alterazioni oculari.
RETINOSCHISI GIOVANILE X- LINKED
Descritta da Haas e Stabsarzt nel 1898.
Trasmissione recessiva legata ai cromosomi
sessuali maschi.
Bilaterale.
Regione maculare caratterizzata da spazi cistici con
aspetto radiale a stella che tendono ad organizzarsi
in un ampia cavità centrale.
Retinoschisi periferica che interessa più
frequentemente il quadrante infero temporale.
RETINOSCHISI GIOVANILE X- LINKED
Fori retinici dello strato interno nel 75% dei casi.
Aree di demarcazione pigmentate sul bordo
posteriore della schisi. Vasi retinici a ponte tra lo
strato retinico interno ed esterno.
Sineresi del gel vitreale, membrane vitreali con
trazione sui vasi retinici a ponte.
Possibili emorragie vitreali o interne alla schisi.
Il distacco di retina può insorgere per la presenza
di rotture retiniche su entrambi i foglietti della
schisi.
RETINOSCHISI GIOVANILE X- LINKED
RETINOSCHISI GIOVANILE X- LINKED
DEGENERAZIONE VITREORETINICA DI
GOLDMANN- FAVRE
Caratteristiche in comune con la retinoschisi
giovanile e la Wagner.
Tramissione autosomica recessiva, in genere
bilaterale e simmetrica.
Cavità vitreale otticamente vuota eccetto che per
la presenza di filamenti vitreali.
Modificazioni pigmentarie periferiche (come nella
retinite pigmentosa).
Cecità notturna, ERG ridotto o assente.
Aree di retinoschisi centrale e periferica
VITREORETINOPATIA ESSUDATIVA FAMILIARE
Descritta da Schepens nel 1969, trasmissione
ereditaria autosomica dominante.
Bilaterale, colpisce i giovani.
Classificazione in tre stadi con decadimento
visivo progressivo nel tempo
VITREORETINOPATIA ESSUDATIVA FAMILIARE
- Stadio I variazioni dell’interfaccia vitreo
retinica (distacco posteriore di vitreo, membrane
vitreali, eterotopia trazionale maculare,
degenerazione retinica cistoide e “ white withwithout pressure”)
- Stadio II alterazioni vascolari (dilatazione e
tortuosità dei vasi retinici periferici con essudati
sottoretinici e distacco di retina localizzato)
- Stadio III essudazione sottoretinica massiva
con distacco di retina totale, cheratopatia a
bandelletta, cataratta, glaucoma.
DEGENERAZIONE VITREORETINICA SNOWFLAKE
Descritta da Hirose nel 1974, caratterizzata da aree
di degenerazione “white with pressure” associata a
numerosi spot gialli, cambiamenti pigmentari e ad
obliterazioni vascolari.
Trasmissione autosomica dominante.
Aumentata incidenza di cataratta e distacco di
retina.
DEGENERAZIONE VITREORETINICA SNOWFLAKE
SINDROME DI MARFAN
Trasmissione autosomica dominnante.
Miopia assile, di almeno 7 diottrie nel 21% dei casi
Ectopia lentis , presente nel 50- 80%, in genere
bilaterale, simmetrica, supero temporale
Distacco di retina (12%) legato all’entità di miopia,
sublussazione lenticolare, afachia chirurgica.
Presenza di alterazioni degenerative vitreali
(distacco del vitreo anteriore) e degenerazione
retinica a lattice.
SINDROME DI MARFAN
OMOCISTINURIA
Errore metabolico congenito con mancanza
dell’enzima cistein sintetasi che converte
l’omocisteina in cistina.
Trasmissione autosomica recessiva.
Manifestazioni oculari e sistemiche simili alla
Marfan.
Ectopia lentis nel 90% dei casi. Bilaterale,
sublussazione della lente inferiore. In 1/3 dei casi
lussazione in C.A o C.V
Degenerazione retinica cistica, distacco di retina
nel 19% dei casi
OMOCISTINURIA
SINDROME DI EHLERS- DANLOS
Anomalia del tessuto connettivo per incapacità
delle fibrille collagene ad organizzarsi in strutture
complesse.
Cheratocono, miopia, sclera blu, distacco
posteriore di vitreo, distacco di retina
regmatogeno.
Anomalie dello sviluppo
PIT DEL NERVO OTTICO
Anomalia di sviluppo della vescicola ottica.
Localizzato in genere a livello della rima temporale
del N.O di dimensioni variabili dai 0,1 ai 0,7
diametri papillari.
Unilaterale nell’85% dei casi.
Nell’80% distacco di retina sieroso al polo
posteriore per passaggio del liquido vitreale
attraverso il pit.
Retinoschisi per rottura di ampie cisti intraretiniche
maculari.
PIT DEL NERVO OTTICO
Anomalie dello sviluppo
MORNING GLORY SYNDROME
Caratteristiche in comune con l’optic pit.
Papilla ingrandita ed escavata, con core centrale di
tessuto biancastro ed anello peripapillare con
modificazioni pigmentarie.
Distacco di retina al polo posteriore nel 38% dei
casi , presenza di rottura retinica peripapillare per
effetto trazionale del tessuto epipapillare.
MORNING GLORY SYNDROME
Anomalie dello sviluppo
COLOBOMA DEL NERVO OTTICO
Si può associare a distacco di retina (66%).
L’area del difetto comprende un optic pit con
interessamento della retina e della coroide.
Escavazione parziale o totale del canale sclerale.
Papilla ottica ingrandita (50% in più del normale)
Bilateralità > Optic pit
Possibile associazione con coloboma della retina e
della coroide.
COLOBOMA DEL NERVO OTTICO
Anomalie dello sviluppo
PERSISTENZA DEL VITREO IPERPLASTICO
PRIMITIVO
Residui della guaina fibrovascolare che avvolge il
cristallino fetale.
Forma anteriore: membrana fibrovascolare con
aspetto di massa retrolenticolare, stiramento dei
processi ciliari
Forma posteriore: coartazione del tessuto
retrolentale con trazione sulla retina peiferica
emovitreo recidivante, D.D.R trazionale
In conclusione
•Il DR in età pediatrica è un evento raro più
frequentemente associato alla alta miopia.
•Va trattato con chirurgia episclerale se non
si associa a PVR permettendo un recupero
nell’ 80% dei casi.
•Nelle forme sindromiche (Marfan, Stickler…)
va considerato il trattamento dell’ occhio
adelfo con retinopessia laser su 360° e non
focale per la possibilità di distacco da
trazione circolare su retina sana.