FONDAMENTI DI CHIMICA
INORGANICA
6.1 I composti inorganici
6.2 Nomenclatura dei composti
6.3 Classificazione e proprietà dei composti
5 • Fondamenti di chimica inorganica
6.1 I composti inorganici (la IUPAC)
La nomenclatura chimica è regolamentata dalla IUPAC (International Union for Pure
and Applied Chemistry), un'associazione internazionale che periodicamente si riunisce
per aggiornare le regole della "sintassi chimica" alla luce delle nuove conoscenze. Le
regole della nomenclatura, presentate qui e tuttora valide, sono state elaborate
durante il congresso IUPAC del 1959, basato sulle precedenti proposte di Alfred Stock.
Antoine Lavoisier, intorno al 1787, diede per primo una sistemazione alla
nomenclatura chimica rendendola simile alla moderna. I suffissi -ico -oso -ato -ito -uro,
usati ancora oggi, furono introdotti dal chimico francese. Per gli elementi, Lavoisier
propose dei simboli geometrici, poi sostituiti da John Dalton, che all'inizio
dell'Ottocento usava segni circolari.
I simboli degli elementi come li conosciamo oggi furono introdotti da Jöns Jacob
Berzelius nel 1813. La loro semplicità ha contribuito, a poco a poco, alla definitiva
affermazione di tale simbologia.
5 • Fondamenti di chimica inorganica
6.1 I composti inorganici (la valenza)
Gli atomi formano legami utilizzando gli elettroni degli orbitali esterni: condividendoli,
cedendoli o catturandoli dagli atomi vicini. Da qui deriva il concetto di valenza.
In passato, quando non era chiara la natura del legame chimico, si confrontavano le
formule
dei
composti
con
quelle
di
composti
analoghi
contenenti idrogeno oppure ossigeno.
La valenza di un elemento era data dal numero di idrogeni o dal doppio degli ossigeni
necessari per rimpiazzare l'elemento considerato. Per esempio, in AgCl
l'argento sostituisce un idrogeno di HCl, quindi Ag ha valenza 1.
Conoscere la valenza degli elementi combinati è di fondamentale importanza per
assegnare i nomi e scrivere le formule corrette dei composti. Per ricavare le valenze
dobbiamo conoscere le configurazioni elettroniche dei composti.
Analogo al concetto di valenza è quello di numero di ossidazione legato al primo dalla
relazione Valenza = Val.ass.( OX).
Esso esprime la capacità o proprietà di un atomo di cedere o acquisire uno o più
elettroni.
Così se l'ossigeno ha in quasi tutti i legami OX = -2 è perché esso ha la tendenza ad
acquisire( segno -) due elettroni.
5 • Fondamenti di chimica inorganica
6.1 Valenza e numero di ossidazione
Valenza
Numero di
ossidazione
• La valenza rappresenta il numero di
elettroni che l’atomo guadagna o
mette in comune quando si lega ad
altri atomi.
• La valenza di un atomo corrisponde in
genere al numero di legami che
l’atomo può formare.
• Il numero di ossidazione rappresenta
la carica che ogni atomo, in una
molecola o in uno ione poliatomico,
assumerebbe se gli elettroni di legame
fossero assegnati all’atomo più
elettronegativo.
5 • Fondamenti di chimica inorganica
6.1 Valenza e numero di ossidazione
5 • Fondamenti di chimica inorganica
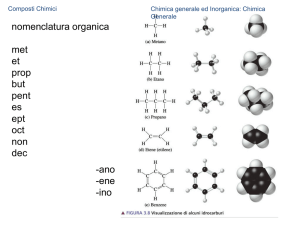
6.2 Nomenclatura dei composti chimici
Il nome di un composto binario si costruisce a
partire da quello dell’elemento scritto a
destra.
Gli indici delle formule vengono identificati
attraverso dei prefissi.
Regole pratiche
1.
2.
3.
Scriviamo i simboli con i rispettivi n.o.
nell’ordine corretto: prima l’elemento
metallico e poi l’elemento non metallico;
il n.o. del metallo diventa l’indice del non
metallo e viceversa;
se i due indici della formula hanno un
divisore comune, di solito si semplifica.
5 • Fondamenti di chimica inorganica
6.2 Nomenclatura dei composti chimici
La nomenclatura chimica permette
di identificare i composti mediante
un nome specifico, che si definisce a
partire dalla formula della sostanza.
Alcuni composti sono indicati
prevalentemente con il loro nome
comune:
sono
un
esempio
l'acqua (H2O) e l'ammoniaca (NH3).
Nella maggior parte dei casi però
per attribuire il nome ai differenti
composti si utilizzano alcune regole
codificate. Esistono diversi sistemi
di nomenclatura: la nomenclatura
tradizionale, quella IUPAC e la
nomenclatura di Stock
Elemento
Radice del nome
Idrogeno
idr-
Fluoro
fluor-
Cloro
clor-
Bromo
brom-
Iodio
iod-
Zolfo
solf-
Selenio
seleni-
Azoto
nitr-
Fosforo
fosf-
Carbonio
carb- o carbon-
Silicio
silic-
Boro
bor-
5 • Fondamenti di chimica inorganica
6.2 Nomenclatura dei composti chimici
La nomenclatura tradizionale
è basata principalmente sulla divisione degli elementi in metalli e non
metalli e tiene conto dello stato di ossidazione degli atomi che formano
la molecola.
La nomenclatura secondo la notazione di Stock
ufficializzata dalla IUPAC nel 1940, fornisce informazioni più chiare sullo
stato di ossidazione degli elementi; essa infatti indica gli stati di
ossidazione con cifre romane poste tra parentesi.
La nomenclatura IUPAC
è basata sulle regole redatte dalla IUPAC nel 1959, riviste nel 1971 e
nel 1990; essa ci consente di evidenziare, in modo chiaro e immediato, la
relazione fra il nome di un composto e la sua formula chimica.
5 • Fondamenti di chimica inorganica
6.3 Classificazione dei composti chimici
La classificazione dei composti inorganici si basa sulle loro proprietà chimiche, in
particolare sulla natura metallica o non metallica degli elementi costituenti e sulla
reattività con acqua e ossigeno.
Una prima classificazione viene fatta in base al numero dei costituenti la molecola:
I composti
binari sono
costituiti da due
soli elementi
I composti
ternari sono
costituiti da tre
elementi
5 • Fondamenti di chimica inorganica
6.3 Classificazione dei composti chimici
I composti binari si possono distinguere in ionici e in molecolari.
5 • Fondamenti di chimica inorganica
6.3 Classificazione dei composti chimici
5 • Fondamenti di chimica inorganica
6.3 Proprietà dei composti binari
Idruri: negli idruri l’idrogeno ha numero di ossidazione
–1 e si trova a destra nella formula (CH4, NH3, CaH2).
Essi possono essere
idruri metallici: composti dell’idrogeno con metalli
fortemente elettropositivi (I e II gruppo);
idruri covalenti: composti dell’idrogeno con semimetalli e
non metalli (IV, V, VI gruppo).
5 • Fondamenti di chimica inorganica
6.3 Proprietà dei composti binari
Gli idracidi sono composti formati da idrogeno e un non metallo.
Negli idracidi l’idrogeno ha numero di ossidazione +1 e si trova a sinistra nella formula.
L’ossigeno forma composti praticamente con tutti gli elementi della tavola periodica.
Con i metalli forma ossidi basici, con i non metalli dà luogo a ossidi acidi.
Negli ossidi l’ossigeno ha n.o. –2 e si trova a destra nella formula (CO2, MgO).
L’ossigeno forma anche degli ossidi particolari, detti perossidi, che contengono due
atomi di ossigeno legati tra loro.
Nei perossidi l’ossigeno ha numero di ossidazione –1 e si trova a destra nella formula
(H2O2).
5 • Fondamenti di chimica inorganica
6.3 Proprietà dei composti binari
I sali binari comprendono una parte metallica, che viene scritta per prima, e una non
metalica.
Il sale binario più diffuso in natura è il cloruro di sodio (NaCl).
5 • Fondamenti di chimica inorganica
6.3 Composti binari
Ossidi (o ossidi basici) sono i composti dell’Ossigeno con un metallo
Anidridi (o ossidi acidi) sono i composti dell’Ossigeno con un non metallo
La nomenclatura IUPAC utilizza il termine ossido preceduto dai prefissi mono-, di-, tri-,
in base al numero di atomi di ossigeno presenti nella molecola. A tale termine,
seguono di- e il nome del catione preceduto da un prefisso che specifica il numero di
atomi con cui il catione compare nella molecola.
Secondo la nomenclatura Stock, gli ossidi dei vari elementi, con numero di
ossidazione variabile, sono distinti indicando il n.o. con un numero romano posto tra
parentesi. La nomenclatura tradizionale, a differenza delle altre due, distingue gli
ossidi dei metalli (ossidi basici) da quelli dei non metalli (ossidi acidi) e utilizza regole
diverse nei due casi.
5 • Fondamenti di chimica inorganica
6.3 Principali ossidi
5 • Fondamenti di chimica inorganica
6.3 Composti binari
Ossidi (o ossidi basici) sono i composti dell’Ossigeno con un metallo
Anidridi (o ossidi acidi) sono i composti dell’Ossigeno con un non metallo
Se il non metallo
ha due numeri di
ossidazione
utilizziamo il
suffisso –osa (n.o.
minore) e –ica (n.o.
maggiore):
anidride solforosa,
anidride solforica
3
Quando il non
metallo ha un solo
numero di
ossidazione, allora
il composto prende
il nome di anidride
seguito dal nome
del catione con il
suffisso –ica:
anidride borica
2
1
Nel caso degli ossidi acidi, la nomenclatura tradizionale utilizza il termine anidride al
posto di ossido. Tale denominazione, molto comune in passato, non è più utilizzata in
chimica.
Se il non metallo
presenta più di due
numeri di
ossidazione
aggiungiamo il
prefisso –ipo (n.o.
minimo) e il
prefisso per- (n. o.
massimo)
5 • Fondamenti di chimica inorganica
6.3 Principali anidridi
5 • Fondamenti di chimica inorganica
6.3 I composti binari dell’idrogeno
Idruri salini: sono composti dell’idrogeno con metalli fortemente
elettronegativi, tipicamente i metalli del I e II gruppo. Si tratta di
composti ionici in cui l’atomo di idrogeno è presente sotto forma di
ione idruro con numero di ossidazione -1
Idruri molecolari o covalenti: sono composti dell’idrogeno con
semimetalli e non metalli; esempi di tali composti sono il metano e
l’ammoniaca. A differenza dei precedenti, questi composti sono
costituiti da molecole e sono spesso liquidi o gassosi
Idracidi: sono un piccolo gruppo di sei composti binari di natura
molecolare costituiti da idrogeno e da un non metallo. La formula si
scrive indicando per primo l’atomo di idrogeno seguito dal non metallo
: HCl, HF, HI…
5 • Fondamenti di chimica inorganica
6.3 La nomenclatura dei composti ternari
Principali
composti ternari
idrossidi
Acidi (ossiacidi)
Sali ternari
5 • Fondamenti di chimica inorganica
6.3 La nomenclatura dei composti ternari: gli idrossidi
Gli idrossidi sono composti ionici formati da un metallo e dallo ione idrossido
OH–.
Nella formula il metallo si trova a sinistra e il gruppo ossidrile a destra, come
per esempio nell’ idrossido di magnesio
Mg(OH)2
La nomenclatura IUPAC assegna a questi composti il nome idrossido preceduto
dal suffisso –mono, -di, -tri, ecc. per indicare il numero di gruppi OH
presenti nella molecola, seguito dal nome del catione, per esempio
idrossido di sodio.
5 • Fondamenti di chimica inorganica
6.3 Principali idrossidi
Formula
Nome tradizionale
Nome secondo Stock
Nome IUPAC
Ca(OH)2
Idrossido di calcio
Idrossido di calcio
Diidrossido di calcio
Fe(OH)2
Idrossido ferroso
Idrossido di ferro (II)
Diidrossido di ferro
Fe(OH)3
Idrossido ferrico
Idrossido di ferro (III)
Triidrossido di ferro
Sn(OH)2
Idrossido stannoso
Idrossido di stagno (II)
Diidrossido di stagno
Sn(OH)4
Idrossido stannico
(idrossido di stagno (IV)
Tetraidrossido di stagno
Al(OH)3
Idrossido di alluminio
Idrossido di alluminio
Triidrossido di alluminio
5 • Fondamenti di chimica inorganica
6.3 La nomenclatura dei composti ternari: gli ossiacidi
Gli ossiacidi sono composti formati da idrogeno, un non metallo e ossigeno.
Gli ossiacidi derivano dalla reazione fra un ossido acido (anidride) e una o più
molecole d’acqua.
Nomenclatura degli ossiacidi
•
IUPAC: acido + non metallo con desinenza riferita al n.o. posto fra parentesi;
•
tradizionale: acido + non metallo con suffisso relativo al n.o.
5 • Fondamenti di chimica inorganica
6.3 Principali ossiacidi
5 • Fondamenti di chimica inorganica
6.3 La nomenclatura dei composti ternari: sali ternari
I sali ternari sono composti formati da un metallo, un non metallo e l’ossigeno.
I sali ternari si formano per sostituzione degli atomi di idrogeno dell’ossiacido
corrispondente con un metallo.
Un sale derivante da un acido ipo…oso assume i
suffissi ipo…ito. Lo stesso dicasi per un acido …
oso che diventa ione …ito
• Acido ipocloroso diventa ione ipoclorito; allo ione si aggiunge
il catione derivante da un metallo opportuno
Un sale derivante da un acido …ico assume la
desinenza … ato, lo stesso dicasi per un acido
per… ico che diventa ione per…ato
• L’acido clorico diventa clorato di …
5 • Fondamenti di chimica inorganica
6.3 Principali sali
5 • Fondamenti di chimica inorganica
• Sono composti da due
diversi cationi metallici,
entrambi legati all’anione
poliatomico. La loro
denominazione segue le
stesse regole degli altri
acidi aggiungendo il
termine doppio dopo il
nome dell’anione
• Ad esempio NaK(CO3) è il
carbonato doppio di
sodio e di potassio
Sali idrati
• Gli acidi che contengono
più di un idrogeno sono
detti poliprotici. Da essi
possiamo togliere un
numero variabile di
atomi
di
idrogeno
ottenendo Sali acidi
• Ad
esempio
l’acido
carbonico H2CO3 può
originare
lo
ione
carbonato
perdendo
entrambi gli idrogeni,
oppure
lo
ione
idrogenocarbonato
perdendo
un
solo
idrogeno. Esistono anche
Sali
basici
come
CaOHPO4
fosfato
monobasico di calcio
Sali doppi
Sali acidi e Sali basici
6.3 Altri tipi di sali
5 • Fondamenti di chimica inorganica
6.3 Principali sali acidi
5 • Fondamenti di chimica inorganica
6.3 Poliacidi
I poliacidi si formano per combinazione di un ossido acido e 1, 2 o 3
molecole d’acqua e prendono rispettivamente i prefissi meta-, piro- e orto-.
5 • Fondamenti di chimica inorganica
Mappa dei composti inorganici