Enzimi come catalizzatori biologici.
Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte
le reazioni chimiche che avvengono negli organismi viventi. Essi svolgono il loro
ruolo con modalità differenti da reazione a reazione, ma in tutti i casi la catalisi
procede attraverso la formazione di complessi tra l'enzima e i reagenti. La più
semplice reazione catalizzata da un enzima può essere così rappresenta da:
E + S <====>ES <====>EP <====> E + P
L'enzima si combina con l'unico reagente S, detto substrato, per formare un
complesso enzima-substrato, ES. ES è poi trasformato in EP che si scinde in
prodotto P ed enzima libero, che è nuovamente disponibile per reagire con un'altra
molecola di S.
Il processo può avvenire in maniera estremamente rapida: in molti casi una sola
molecola di enzima è in grado di trasformare in 1 secondo migliaia di molecole di
substrato in prodotto. La velocità di una reazione catalizzata da un enzima può
essere fino a 1014 volte superiore alla velocità della stessa reazione non catalizzata.
La struttura degli enzimi.
Gli enzimi sono generalmente proteine globulari che in soluzione assumono
approssimativamente una conformazione sferica. Il loro peso molecolare può variare da
10.000 a milioni di Dalton. Nei casi più semplici la molecola enzimatica è formata da una
singola catena polipeptidica contenente un centinaio di residui amino acidicí. In quelli più
complessi,
più
catene
polipeptidiche
sono
aggregate
tra
loro.
La disposizione tridimensionale della catena polipeptidica (la cosiddetta struttura terziaria) è
alquanto specifica: i singoli residui aminoacidici si vengono a trovare in posizioni ben
definite, posizioni che sono indispensabili per l'attività biologica dell'enzima. La struttura
terziaria di una catena polipeptidica appartenente ad enzimi costituiti da più catene,
costituisce una sottostruttura, in quanto le catene non si compenetrano l'una alle altre, ma
formano delle sottounità indipendenti che si aggregano nella forma oligomerica (struttura
quaternaria).
Studi di diffrazione ai raggi X di enzimi in forma cristallina forniscono dettagliate informazioni
sulla disposizione degli atomi all'interno di una molecola enzimatica: possono essere messe
in evidenza interazioni tra gruppi polari (particolarmente frequenti i legami idrogeno) ed
interazioni tra gruppi idrofobici che sono responsabili della formazione di zone ordinate
all'interno della molecola. Oltre a ciò è possibile determinare le interazioni che si instaurano
tra l'enzima e il substrato, cosa questa che ci permette di asserire l'origine chimica
dell'effetto
catalitico.
Alcuni enzimi esplicano la loro funzione catalitica utilizzando esclusivamente la reattività
chimica dei loro residui aminoacidici. Molti enzimi richiedono invece la partecipazione di
cofattori che non sono parte della struttura proteica. Questi cofattori sono spesso legati
saldamente, anche covalentemente, all'enzima e possono essere ioni metallici o complesse
molecole organiche. Se il cofattore viene rimosso, la proteina assume il nome di
apoenzima che è privo di attività.
Flessibilità degli enzimi.
Una proprietà importante degli enzimi è che la loro struttura non è rigida ma
flessibile. L'origine di queste proprietà va ricercata nella relativa debolezza delle
interazioni idrofobiche e ioniche responsabili della specifica conformazione
spaziale delle catene polipeptídiche. L'associazione di residui idrofobici avviene in
quanto questi si sequestrano dall'ambiente acquoso rifugiandosi nelle porzioni
interne della molecola, ove i contatti con l'acqua sono minimizzati.
Le interazioni ioniche comprendono legami salini tra gruppi di carica opposta e
legami idrogeno. Quando questi ultimi sono formati tra gruppi della catena
polipeptidíca esposta all'acqua, questo va a scapito dei legami idrogeno che gli
stessi gruppi instauravano con le molecole d'acqua. I nuovi legami sono instabili e
facilmente si rompono per restaurare i legami con l'acqua. Più stabili sono invece i
legami idrogeno che si formano nelle regioni idrofobiche, ove un processo di
scambio
con
l'acqua
non
esiste.
Data la relativa instabilità dei legami in gioco nella determinazione della struttura
specifica di una proteina, è ragionevole supporre che la proteina non assuma una
singola struttura fissa, ma che esista in una miscela di forme in equilibrio tra loro
(forme tautomeriche), che sia cioè non una struttura rigida, ma flessibile.
Qualora un substrato si leghi preferibilmente con una sola di queste forme, essa
prevarrà sulle altre. Si parla in questo caso di un cambiamento strutturale indotto,
che
si
ripercuote
di
solito
positivamente
sull'attività
catalitica.
La flessibilità è importante per favorire l’accesso dei ligandi ai siti attivi con
successiva formazione di complessi con l'enzima.
Il complesso enzima-substrato.
L'idea che il meccanismo chimico della catalisi enzimatica
comprenda la formazione di un complesso enzima-substrato fu
suggerito agli inizi del secolo per spiegare il comportamento cinetico
dell' invertasi. La prova diretta dell'esistenza di un simile complesso
si è potuta avere solo con l'introduzione di tecniche spettroscopiche.
E' in questo modo che nel 1943 fu dimostrata l'esistenza di un
complesso tra perossidasi ed acqua ossigenata. Da allora tecniche
di spettrometria di assorbimento e di fluorescenza sono state
utilizzate nello studio di complessi di enzimi che usano coenzimi
nucleotidici e flavinici; mentre la risonanza magnetica è stata
utilizzata nello studio di complessi di enzimi contenenti ioni metallici.
L'isolamento di complessi enzima-substrato è stato possibile solo in
pochi casi, e solo quando il legame tra enzima e substrato è di
natura
covalente.
Per comprendere le modalità di azione di un enzima è necessario
conoscerne non solo la struttura allo stato nativo, ma anche le
strutture dei complessi con il substrato, l’ intermedio ed il prodotto.
Solo così sarà possibile studiare quali gruppi catalitici si trovino in
prossimità del substrato e quali cambiamenti strutturali si verifichino
nell’ enzima e nel substrato quando vengano tra loro in contatto.
Il sito attivo.
La maggior parte delle reazioni enzimatiche utilizza substrati che sono di
piccole dimensioni se comparati alla molecola enzimatica. Di conseguenza
solo una piccola parte della proteina enzimatica si trova a diretto contatto con
la molecola del substrato a formare il COMPLESSO ENZIMA-SUBSTRATO
(ES). Le porzioni di enzima a contatto con il substrato che giocano un ruolo
diretto nel processo catalitico costituiscono il cosidetto SITO ATTIVO (o
CATALITICO). Il resto della proteina enzimatica fornisce una specie di
scheletro strutturale che garantisce il mantenimento dei componenti del sito
attivo nella conformazione tridimensionale necessaria ad una efficiente e
specifica
catalisi.
Tutti gli enzimi presentano il fenomeno della specificità di substrato. Ai livelli
più elevati di specificità, gli enzimi non solo sono in grado di discriminare in
base all’ identità chimica del substrato, ma anche sulla base della sua
configurazione geometrica e stereochimica. Ad esempio se un enzima utilizza
come substrato la forma D di uno zucchero, ne consegue che il
corrispondente stereoisomero L non sarà oggetto di reazione, se non in
misura del tutto trascurabile. Gli enzimi possono distinguere due gruppi uguali
all'interno di una molecola simmetrica in modo da reagire sempre con lo
stesso gruppo. E' il caso dell'enzima aconitasi che catalizza la trasformazione
dell'acido citrico in cis-aconitico.
Il concetto stesso di specificità richiede che l'enzima e il substrato si
adattino l'un l'altro.
Nel 1894 Fischer propose la sua "ipotesi della serratura e della
chiave" (lock and key hypothesis) implicante una complementarietà tra
substrato ed enzima legata a rigide conformazioni molecolari.
Modello della serratura e della chiave.
Per quanto questa ipotesi sia in grado di spiegare le interazioni enzima
substrato per un gran numero di enzimi, diviene difficilmente sostenibile
quando si consideri che composti chimicamente molto simili al substrato
ma che posseggono gruppi meno voluminosi spesso non reagiscono con
l'enzima, sebbene dovrebbero facilmente adattarsi allo stampo
rappresentato
dal
sito
attivo.
Ad esempio l'enzima 5’-nucleotidasi idrolizza il ribosio 5-fosfato ad un
centesimo della velocità osservata quando lavori sul suo substrato,l’acido
adenilico.
E' sulla base di queste osservazioni che Koshland (1958) dedusse che la
più larga struttura del vero substrato è indispensabile per far funzionare
l'enzima in maniera completa, in quanto in grado di orientare i gruppi
catalitici dell'enzima nella corretta posizione nei confronti dei gruppi
reagenti
del
substrato.
L'ipotesi di Koshland va sotto il nome di "ipotesi dell'adattamento
indotto" (induced fit) e si basa su di una potenziale complementarietà
dell'enzima e del substrato, paragonabile alla complementarietà esistente
tra una mano e un guanto, più che tra una serratura ed una chiave.
A) Modello dell’ adattamento indotto: enzima e substrato si
modificano a vicenda.
B) Modello dell’ adattamento indotto: in alcune in reazioni a due substrati
solo il cambiamento conformazionale indotto nell'enzima dal legame con
il primo substrato permette al secondo substrato di legarsi.
La catalisi enzimatica
Gli enzimi sono proteine specializzate nel
catalizzare le reazioni biologiche.
Classificazione sistematica degli enzimi
secondo la “Enzyme Commission”
1
Ossidoreduttasi
Trasferimento di elettroni (ioni idruro o atomi di H)
2
Trasferasi
Trasferimento di gruppi funzionali
3
Idrolasi
Reazioni di idrolisi
4
Liasi
Addizioni a doppi legami
5
Isomerasi
Trasferimento di gruppi all’interno di una molecola
con produzioni di forme isomere
6
Ligasi
Formazione di legami mediante reazioni di
condensazione accoppiate all’idrolisi di ATP
ureasi E.C. 3.5.1.5
coenzima
Ione
biotina
Fe2+ o Fe3+ citocromo ossidasi
alcol deidrogenasi
enzima
enzima
2+
esochinasi
flavin adeninaMg
dinucleotide
catalasi
Ni2+
ureasi
nicotimammide
adenina dinucleotide
perossidasi
ioni metallici
+ cofattori
coenzimi
la Keq
Gli enzimi non cambiano
il DG°’
una reazione non spontanea in una spontanea
C6H12O6 + 6O2
→
6CO2 +6H2O
DG°’= -2870 kj
specificità
substrati
reazioni
complementarietà strutturale
mutuo riconoscimento
modulazione dell’attività
quantità di proteina enzimatica
regolazione
Richiami di Cinetica Chimica
Per la reazione
la velocità è
A P
d[A] d[P]
v
dt
dt
Reazione chimica non catalizzata
14
12
velocità
10
8
6
4
2
0
0
2
4
[substrato]
V= k [A]
6
8
Diagramma energetico di una reazione chimica
Energia libera, G
Stato di transizione
A
Stato
basale
P
Stato
basale
Coordinata di reazione
Variazione totale
dell’energia libera
della reazione
Diagramma energetico di una reazione chimica catalizzata
Energia libera, G
Stato di transizione
Coordinata di reazione
Il sito attivo
Cinetica Enzimatica
La velocità iniziale di una reazione
aumenta quasi linearmente all'aumentare
della concentrazione di substrato.
V
La
velocità
è
direttamente
proporzionale alla concentrazione
del substrato e la reazione è di
primo ordine V = k [S]
[S]
Cinetica Enzimatica
La proporzionalità fra V e [S]
progressivamente diminuisce.
Vmax
V
La
velocità
iniziale
diventa
indipendente
dalla [substrato] e la
reazione è di ordine zero
rispetto al substrato.
[S]
L'Equazione di Michaelis-Menten
E+S
k1
k-1
ES
k2
E+P
assunzione dello stato stazionario
d [ ES ]
0
dt
L'Equazione di Michaelis-Menten
E+S
k1
k-1
ES
k2
E+P
[E] = [ET] - [ES]
vf = k1([E ]-[ES]) [S]
T
vs = k-1[ES] + k2 [ES] = (k-1 + k2)[ES]
per lo stato stazionario
vf = vs
k1([E ]-[ES]) [S] = (k-1 + k2)[ES]
T
([Et] - [ES]) [S] ( k-1 k 2 )
[ES]
k1
= KM
([ET ] - [ES]) [S]
KM
[ES]
riarrangiando
poiché v = k2 [ES]
Quando [S]>>[ET]
[ET ][ S ]
[ES]
KM [ S ]
k 2[ET ][ S ]
v
KM [ S ]
[ET]=[ES] e v = Vmax
Vmaxma x S
v
KM S
Vmax = k2 [ES]
Equazione di
Michaelis-Menten
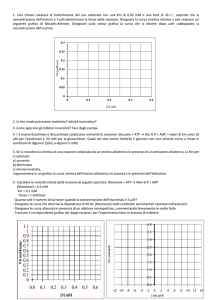
Come si ricavano Vmax e KM
velocità
Vmax =10
V/2 = 5
KM =4
La Vmax o velocità limitante
della reazione si può ricavare
sperimentalmente da una curva di
saturazione da substrato.
La KM è definita come la
concentrazione del substrato che
causa una velocità uguale alla metà
di quella massima.
[substrato]
La costante di Michaelis (KM)
kM kM
affinità
kM kM
kM kM
kM
Effetti della concentrazione dell’enzima
Vmax è direttamente proporzionale alla [E]
Km è indipendente dalla [E] e dalla [S]
Unità Internazionale
la quantità di enzima che catalizza la
formazione di una micromole di prodotto
in un minuto
kcat o numero di turnover
il numero di molecole di substrato convertite in prodotto
nell'unità di tempo da una molecola di enzima quando è
saturata con il substrato.
E+S
k1
k-1
kcat = k2
kcat
ES
k2
E+P
Vmax = kcat [ET]
kcat kcat
kcat kcat kcat
efficienza catalitica
Enzima
catalasi
kcat
40 000 000
anidrasi carbonica
1 000 000
acetilcolinesterasi
14 000
lattato deidrogenasi
chimotripsina
1 000
100
DNA polimerasi
15
lisozima
0,5
Grafico di Michaelis-Menten
V
Vmaxma x S
v
KM S
[S]
Linearizzazione dell’equazione di Michaelis-Menten
Equazione di Lineweaver-Burk
M
M
1
1
KM 1
V Vmax Vmax [S]
Grafico di Eadie-Hofstee
Vmax
V
Pendenza = -KM
Vmax
KM
V
[S]
V
V Vmax KM
[S]
TEMPERATURA
Pepsina
Velocità di reazione
pH
Velocità di reazione
Che cosa influenza la velocità della reazione?
Chimotripsina
Tripsina
Temperatura, °C
pH
Inibitori enzimatici
Irreversibili
Reversibili
Inibizione Competitiva
Inibizione competitiva per formazione di legami col sito attivo
mutuamente escludenti
Inibizione non competitiva
Inibizione competitiva per cambiamento di conformazione
mutuamente escludenti
Un inibitore competitivo
ridurrà l'affinità enzima
substrato, cioè aumenterà
il valore di Km.
Ad alte concentrazioni di
substrato la reazione non
viene rallentata e Vmax è
sempre la stessa.
Inibizione non competitiva
Il substrato non viene più convertito in prodotto
La KM rimane invariata
La Vmax diminuisce
I