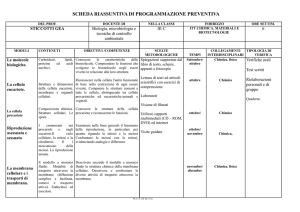
Cosa sono i microrganismi?
Le prime forme di vita comparse nel pianeta
Forme di vita unicellulari
Autonome, in grado di metabolizzare, riprodursi
differenziarsi, comunicare, evolvere
Dotate di piccole dimensioni
Visibili solo al microscopio
Classificazione
alghe
Protisti superiori (eucarioti)
protozoi
miceti
Regno dei protisti
Protisti inferiori (procarioti)
batteri
Differenze tra procarioti e eucarioti
Caratteristiche
Dimensioni
Organizzazione genetica
Nucleo circondato da membrana
DNA complessato agli istoni
Numero di cromosomi
DNA extracromosomiale
Geni
Divisione per mitosi
Citoplasma
Reticolo endoplasmico
Apparato del Golgi
Mitocondri
Lisosomi
Ribosomi
Membrana citoplasmatica
Parete cellulare
Procarioti
0,3-2μm
Eucarioti
> 5μm
Assente
Presente
Assente
Presente
Uno
Più di uno
Plasmidi
Mitocondriale
Contigui o riuniti in operoni Discontinui
Assente
Presente
Assente
Assente
Assenti
Assenti
70 S
Assenza di steroli
Formata
da peptodoglicano
Presente
Presente
Presenti
Presenti
80 S
Presenza di steroli
Se presente,
formata da
polisaccaridi
Forma dei batteri
La forma è una condizione:
• Fissa
• Geneticamente determinata
• Conferita dalla parete cellulare
Forma dei batteri
Cocchi: forma rotondeggiante
Forma dei batteri
Bacilli: forma a bastoncello
Forma dei batteri
Spirilli: forma a spirale
Forma dei batteri
Vibrioni: forma a virgola
Disposizione dei batteri
Indica il modo con il quale le cellule, riproducendosi, si
dispongono nello spazio mantenendo o meno uno
stretto rapporto di continuità.
E’ condizionata dal modo in cui si susseguono nello
spazio i diversi piani di divisione cellulare in
successive generazioni
Disposizioni più frequenti
Diplococchi (cocchi uniti a coppie)
Streptococchi (cocchi uniti a catenelle)
Cocchi
Stafilococchi (cocchi uniti in ammassi irregolari)
Tetradi (cocchi uniti in gruppi di quattro)
Sarcine (cocchi uniti in gruppi di otto, forma cubica)
Bacilli
Diplobacilli (bastoncelli uniti a coppie)
Streptobacilli (bastoncelli uniti a catenelle)
Disposizioni più frequenti
Diplococchi
Streptococchi
(alcuni esempi)
Stafilococchi
Tetradi
Diplobacilli (bastoncelli uniti a coppie)
Streptobacilli (bastoncelli uniti a catenelle)
Colorazione di Gram
• Colorazione più importante e usata in batteriologia.
• Prende il nome dal patologo danese che la mise a
•
•
•
•
•
•
punto.
Permette di distinguere i batteri in Gram+ e Gram-.
Colorazione differenziale.
Utilizzando differenti coloranti in tempi successivi,
individua differenze strutturali della cellula
batterica.
Le differenze strutturali riguardano la parete
cellulare.
I batteri Gram+ si colorano in viola.
I batteri Gram- si colorano in rosso.
Colorazione di Gram (esecuzione)
• Si allestisce il preparato
• Si versa sul preparato una soluzione di cristalvioletto
• Si allontana il colorante e si versa sul vetrino un
•
•
•
mordenzante: il liquido di Lugol (i mordenzanti sono
sostanze che formano un composto insolubile con il
colorante facilitandone l’unione col substrato)
Si tratta il vetrino con una soluzione decolorante
formata da alcool e acetone
Si applica un colorante di contrasto: la fuxina (rossa)
I batteri Gram+ trattengono il primo colorante
risultando colorati in violetto, i batteri Gram- si
decolorano assumendo la colorazione rossa di
contrasto
Colorazione di Gram (esecuzione)
Gram positivi
Gram negativi
Fissazione
Cristal violetto
Liq. di Lugol
Decolorazione
Colorazione di
contrasto
Colorazione di Gram (esempi)
Gram +
Gram -
A cosa è dovuto il diverso comportamento
dei batteri nella colorazione di Gram?
• E’ dovuto ad una diversa permeabilità degli involucri cellulari che
è maggiore (tale da consentire l’asportazione del complesso
cristalvioletto-liquido di lugol da parte del decolorante) nei
batteri Gram negativi e minore nei Gram positivi che in tal modo
trattengono il primo colorante.
• La Gram positività e la Gram negatività, dovuta alla differente
architettura molecolare della parete, è espressione di una
dicotomia evolutiva dal profondo significato clinico.
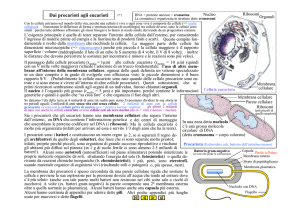
Struttura della cellula procariotica
Il carattere
citologico più
importante è
rappresentato
dalle piccole
dimensioni e
dall’assenza di
compartimenti
intracellulari
separati
da membrane.
Pilo o fimbria
Membrana
Parete
Capsula
Citoplasma
Flagello
Ribosomi
Sost. nucleare
Mesosoma
Caratteristica è la struttura cromosomica, estremamente
semplice, immersa direttamente (senza interposizione di
membrana nucleare) nel citoplasma.
Cromosoma batterico (sostanza nucleare)
• Si trova all’interno del citoplasma.
• Appare come un materiale filamentoso, costituito da DNA
•
•
•
•
•
immerso nel citoplasma non separato da alcuna membrana.
Viene considerato l’equivalente di un cromosoma (cromosoma
batterico o cromonema).
E’ fortemente raggomitolato la sua lunghezza, se disteso, supera
di 1000 volte la lunghezza della cellula.
E’ privo di estremi liberi, presenta struttura circolare con
implicazioni sulla duplicazione cellulare e sulla genetica batterica.
Non è legato ad istoni ma è complessato a proteine acide dalle
quali è facilmente dissociabile.
E’ collegato alla membrana in corrispondenza di zone
caratteristiche che rappresentano l’origine della duplicazione
durante la riproduzione cellulare.
Duplicazione del DNA
Il cromosoma batterico prende contatto
con zone particolari della membrana che
rappresentano l’origine della duplicazione.
Il processo continua da entrambi i lati e
termina al punto opposto rispetto all’origine.
Contemporaneamente al distacco delle
emieliche si ha la formazione del filamento
complementare.
Terminato il processo si formeranno due
nuovi filamenti di DNA ciascuno dei quali
sarà formato da un’elica parentale e dal
filamento complementare, assicurando la
esatta ripartizione del corredo genetico
Plasmidi: definizione
Sono elementi genetici extracromosomiali a
struttura circolare, presenti nel citoplasma
batterico, di dimensioni minori rispetto
al cromosoma, dotati di relativa autonomia
replicativa e in grado di condizionare caratteri
fenotipici importanti sotto il profilo
dell’azione patogena, della resistenza agli
antinfettivi e della sopravvivenza nell’ambiente.
Grandezza e numero dei plasmidi
• La grandezza dei plasmidi si misura in kilobasi
•
•
•
•
(lunghezza media di un gene).
Esistono plasmidi più piccoli di poche kb e plasmidi più
grandi con più di 1000 kilobasi.
I plasmidi più grandi sono presenti in un’unica copia.
I più piccoli possono essere presenti in più copie.
Tutti i plasmidi possiedono una serie di geni che
codificano gli elementi necessari e sufficienti alla loro
duplicazione e ripartizione tra le cellule figlie al
momento della divisione cellulare.
Trasferimento intercellulare dei plasmidi
• I plasmidi oltre a venir trasmessi verticalmente da cellula
•
•
•
madre a cellula figlia, possono trasferirsi orizzontalmente
tra cellule diverse.
Esistono plasmidi autotrasmissibili e non autotrasmissibili.
I plasmidi autotrasmissibili possono trasferirsi grazie al
contatto cellula-cellula e sono detti coniugativi. La
trasmissione mediante coniugazione viene controllata da
geni tra.
I plasmidi non autotrasmissibili non contengono geni tra, il
loro trasferimento per coniugazione è reso possibile dalla
presenza di plasmidi coniugativi che coabitano nella
stessa cellula.
Funzioni dei Plasmidi
Le funzioni dei plasmidi sono numerose; anche se non “indispensabili” sono utili
a garantire la sopravvivenza dei batteri in particolari situazioni o habitat
metaboliche
Utilizzazione di sostanze,produzione di pigmenti etc.
resistenza
Agli antibiotici, agli ioni, ai raggi U.V.
virulenza
Produzione di esotossine, batteriocine, polimeri adesinici
biologiche
Modificazione e restrizione di DNA estraneo
Tipi di plasmidi
Plasmide F è un plasmide coniugativo, contiene geni tra che promuovono
il trasferimento del plasmide stesso da una cellula donatrice ad una
cellula ricevente. Può integrarsi nel cromosoma batterico rendendo
possibile la mobilizzazione intercellulare di geni cromosomici.
Plasmide R è un plasmide autotrasmissibile capace di codificare per la
produzione di enzimi in grado di conferire resistenza nei confronti di
diversi farmaci antibatterici e di operare il trasferimento
interspecifico di tali resistenze.
Plasmidi batteriocinogeni codificano per la produzione di batteriocine
cioè di proteine “tossiche” in grado di uccidere batteri della stessa
specie, ma innocue per le specie che le producono. Tali sostanze
vengono espresse di prevalenza quando sia necessario ristabilire un
alterato equilibrio in particolari nicchie ecologiche.
Citoplasma
Il citoplasma batterico è estremamente semplice, privo
di molti elementi morfologici che caratterizzano il
citoplasma delle cellule eucariotiche quali:
• reticolo endoplasmico
• apparato del Golgi
• mitocondri
• lisosomi
• vacuoli
Citoplasma : composizione
•
•
•
•
H2O
Componenti inorganici: sodio, magnesio, calcio, ferro etc
Macromolecole organiche
Polimeri
Le sostanze organiche contribuiscono maggiormente a generare
una elevata pressione osmotica che contraddistingue l’interno della
cellula. Tale pressione è maggiore nei Gram+ e minore nei Gram-
Inclusioni citoplasmatiche
Occasionalmente nel citoplasma sono presenti granulazioni (inclusioni)
citoplasmatiche, di diversa composizione aventi il significato di accumuli di
materiale di riserva.
• Glicogeno
Sono costituiti da:
• Acido β-idrossi-butirrico
• Polisaccaridi
• Polifosfati
I granuli di polifosfati sono detti” metacromatici” presentano il fenomeno
della metacromasia si colorano diversamente rispetto al colore utilizzato.
Sono particolarmente abbondanti in Corynebacterium diphteriae costituendone
un carattere distintivo importante utile per l’identificazione.
Ribosomi
Rappresentano lo strumento universale delle sintesi proteiche
per qualunque tipo di organizzazione cellulare: procariotica o
eucariotica. I ribosomi procariotici, tuttavia, presentano
differenze fondamentali rispetto agli eucarioti
Caratteristiche
• Sono presenti nel citoplasma in numero elevato (fino a 15000)
• Funzionalmente identici ma strutturalmente differenti rispetto ai procarioti
• Le differenze indirizzano l’azione selettivamente tossica di alcuni antibiotici
• Hanno un coefficiente di sedimentazione 70S (80S per gli eucarioti)
• Sono costituiti da due subunità una più grande 50S e una più piccola 30S
Ribosomi
Forma
Complessivamente globulare, la subunità più piccola alloggia in una cavità presente
nella subunità più grande
Composizione
60% RNA
40% proteine
Una unità ribosomiale completa contiene: 55 proteine e tre tipi di RNA:
5S, 16S, 23S
Organizzazione strutturale
La subunità più grande contiene 34 proteine(1L, 2L etc.) e due RNA (5S, 23S)
La subunità più piccola contiene 21 proteine (1S, 2S etc. e un RNA (16S)
Membrana citoplasmatica
• Delimita esternamente il citoplasma
• Si trova al di sotto della parete cellulare
• E’ strutturalmente simile ma funzionalmente
differente rispetto alla membrana degli eucarioti
Composizione chimica
Proteine 60%
Lipidi
40%
Carboidrati tracce
Proteine
•Integrali: sono situate nello spessore della membrana
•Periferiche: sono situate superficialmente
Lipidi
assenza di steroli, presenza di fosfolipidi quali:
•Fosfatidil-glicerolo
•Difosfatidil-glicerolo
•Fosfatidil-etanolamina
•Fosfatidil-serina
•Fosfatidil-inositolo
Acidi grassi
•Assenza di acidi grassi polinsaturi
•Presenza di acidi grassi ramificati e derivati dal ciclopropano
Glicerolo
•Esterificato con aminoacidi quali: lisina, alanina, glicina, ornitina
Carboidrati
Legati ai lipidi
(glicolipidi)
Legati a proteine (glicoproteine
Struttura
Modello a mosaico fluido
I fosfolipidi formano un doppio strato continuo, con le parti apolari
rivolte verso l’interno (porzione idrofobica) e le parti polari rivolte
verso la porzione esterna idrofila.
Funzioni della membrana citoplasmatica
•
•
•
•
Delimita esternamente il citoplasma
•
partecipa al processo di riproduzione cellulare (duplicazione DNA, formazione del
setto interno di divisione)
•
•
•
•
opera il contenimento degli organi interni della cellula
presiede agli scambi
rende possibile il trasporto attraverso la cellula tramite meccanismi: attivi
(contro il gradiente di pressione osmotica), passivi (leggi dell’osmosi), facilitati
(carriers)
rende possibili i processi di respirazione cellulare in assenza dei mitocondri
promuove la formazione del setto di divisione asimmetrica nella sporulazione
partecipa alle fasi intermedie e finali del processo di biosintesi del peptidoglicano
(componente fondamentale della parete cellulare)
promuove il rilascio di enzimi implicati nella resistenza batterica agli antibiotici.
Mesosomi
Nelle sezioni ultrasottili esaminate al m.e. la membrana citoplasmatica presenta
delle invaginazioni che si approfondano nel citoplasma e possono assumere una
struttura complessa ricca di microtubuli e microfilamenti. A queste strutture più
frequenti e complesse nei Gram+, denominate mesosomi sono state attribuite
diverse funzioni in rapporto alla divisione cellulare, alla secrezione di esoenzimi e
ai processi di fosforilazione ossidativa.
In realtà i mesosomi sono risultati essere degli artefatti dei processi di
fissazione. Il fatto che essi tendano a formarsi in zone precise della
membrana suggerisce che la membrana stessa possa presentare regioni
con particolari specializzazioni strutturali e funzionali
Parete cellulare
Caratteristiche
• Struttura più importante e caratteristica dei batteri
• Delimita esternamente la cellula batterica, al di fuori della membrana
citoplasmatica
• Struttura fondamentale per garantire l’integrità cellulare
• Posseduta universalmente da tutti i batteri ad eccezione del genere
Mycoplasma (assenza di parete) e del genere Chlamidia (parete di
diversa composizione)
• Struttura esclusiva dei batteri, non ha corrispondenza negli eucarioti;
i miceti hanno parete cellulare, ma costituita da polisaccaridi e proteine
Parete cellulare
Funzioni e proprietà
•Assicura protezione alla cellula nei confronti degli agenti esterni e della lisi
osmotica
•Definisce la differente forma ai batteri con la sua struttura rigida e compatta
•Fornisce un bersaglio all’azione selettivamente tossica di alcuni antibiotici
che vanno ad interferire a vario livello nel processo di biosintesi del principale
componente della parete
Parete cellulare
Struttura
Il componente fondamentale della parete è un polimero il peptidoglicano formato
da due aminozuccheri alternati tra loro e uniti da un legame β-glucosidico
rappresentati da:
•N-acetilglucosamina
•N-acetilmuramico
Ad ogni residuo di ac. muramico è legato un tetrapeptide costituito da:
•L-alanina
•D-glutammico
•L-lisina
•D-alanina
Organizzazione strutturale della parete
La parete cellulare dei batteri risulta diversamente strutturata nei
batteri Gram+ e nei batteri Gram-.
Tale diversa organizzazione determina il differente comportamento
dei batteri alla colorazione di Gram permettendo di effettuare una
distinzione fondamentale dal punto di vista clinico.
Parete cellulare Gram positivi
Costituente fondamentale il peptidoglicano, formato da:
•N-acetilglucosamina
•Acido N-acetilmuramico
•Tetrapeptide
•Ponte trasversale formato da 1 a 5 aminoacidi uguali o diversi tra loro
Dimensioni
•80-90 mμ
Parete cellulare Gram positivi
Struttura
• Tridimensionale
• Costituita da numerose catene
lineari, parallele tra loro, per uno
spessore di 80-90 mµ dei due
aminozuccheri legati con legame
β-glucosidico
• Ogni residuo di ac. muramico lega il
tetrapeptide formato da aminoacidi
alternativamente in configurazione L
eD
• Il ponte trasversale collega due
catene tetrapeptidiche poste su
scheletri lineari adiacenti legando il 3°
ed il 4° aminoacido della catena
(L-lisina D-alanina)
Parete cellulare Gram positivi
Struttura
• Tridimensionale
Monomero costitutivo del peptidoglicano
E’ una molecola formata da: una unità di N-acetilglucosamina legata
con legame β 1-6 glucosidico ad una unità di ac. N-acetilmuramico il
quale lega il tetrapeptide ed il ponte trasversale.
Ogni monomero è legato al monomero successivo tramite un legame
β 1-4 glucosidico. Tale legame viene idrolizzato dall’enzima lisozima,
il quale pertanto ha azione depolimerizzante il peptidoglicano
scindendone cioè i vari monomeri costitutivi.
Altri costituenti la parete dei Gram+
Caratteristiche
Acidi teicoici
Lunghi filamenti che si protendono all’esterno della cellula
Composizione chimica
Esteri fosforici del
glicerolo e del ribitolo
altamente polimerizzati
con gruppi OH variamente
sostituiti
Funzioni degli acidi teicoici
Antigeni di superficie (utili per la sierotipizzazione).
Formano una fitta rete all’esterno della cellula ostacolando l’ingresso
delle sostanze a basso peso molecolare.
Con le loro cariche elettriche negative formano un “letto anionico”
capace di attrarre cationi che fungono da cofattori per taluni enzimi.
Rendono possibile l’adesione a svariate superfici (adesine)
Altri costituenti la parete dei Gram+
Proteine
Sono occasionalmente presenti in talune specie es.
Proteina A di Staphylococcus aureus (azione antifagocitaria)
Proteina M di Streptococcus pyogenes (fattore di adesività
condiziona l’invasività e la virulenza)
Lipidi
Sono presenti in alcuni generi e soprattutto in elevata quantità
nel genere Mycobacterium.
Parete cellulare dei batteri
Gram-positivi
peptidoglicano
Parete
ac. teicoico
Membrana
plasmatica
Parete cellulare GramCaratteristiche
E’ resa più complessa rispetto ai Gram+ dalla presenza di una
membrana posta esternamente ad un sottile strato di peptidoglicano
Costituenti
• Membrana parietale esterna
• Peptidoglicano
• Spazio periplasmico
• Membrana citoplasmatica
I batteri Gram- rappresentano
l’unico esempio di organizzazione
cellulare delimitata da una doppia
membrana
Il peptidoglicano dei batteri Gram• Ha uno spessore minore rispetto ai Gram positivi (10-20μm)
• E’ composto da pochi scheletri lineari paralleli tra loro dei due
aminozuccheri (N-acetilglucosamina e N-acetilmuramico).
• Il 3° aminoacido della catena tetrapeptidica legata ad ogni
residuo di acido muramico è l’acido meso-diaminopimelico (L lisina
nei Gram+).
• Le catene tetrapeptidiche per il 50% sono sciolte, per il
restante 50% sono legate tra loro con legame peptidico diretto
realizzato tra il terzo aminoacido di una catena e il quarto della
catena adiacente
• Struttura bidimensionale meno compatta rispetto ai Gram+
Parete cellulare GramMembrana parietale esterna
• Avvolge la cellula al di fuori del peptidoglicano
• Protegge la cellula batterica conferendole capacità di resistenza
verso sostanze dannose.
• Presenta maggiore densità rispetto alla membrana citoplasmatica.
• Presenta caratteristiche di permeabilità del tutto peculiari che la
rendono poco permeabile alle sostanze idrofobe e permeabile alle
sostanze idrofile a basso peso molecolare.
• E’ collegata tramite delle lipoproteine al peptidiglicano sottostante.
• Ha una struttura tipicamente asimmetrica, il foglietto fosfolipidico
più esterno è sostituito da un originale composto: il lipopolisaccaride
o LPS
Parete cellulare Gramlipopolisaccaride
Sostituisce il foglietto fosfolipidico più esterno, consiste di tre porzioni:
1) una porzione lipidica (lipide A) rappresenta l’endotossina cioè la frazione
tossica. Al lipide A è legata una porzione polisaccaridica proiettata
all’esterno della membrana e composta a sua volta da due parti:
a) una catena di zuccheri (parte centrale o core) con struttura costante
in tutti i Gram negativi appartenenti alla stessa specie
b) una lunga catena polisaccaridica di composizione differente nei batteri
appartenenti alla stessa specie con spiccate proprietà antigeniche
(antigene O)
Le catene polisaccaridiche presenti sulla superficie dei Gram- sono
strutture polari in grado di legare cationi bivalenti formanti “ponti”
che rendono la membrana assai compatta, tendenzialmente idrofila
e capace di escludere i composti idrofobici.
La permeabilità della membrana
esterna: il sistema delle porine
I batteri Gram- proteggono la cellula dalla interazione con composti idrofobici
dannosi circondandosi di polimeri idrofili (core polisaccaridico e antigene O).
La compattezza della membrana esclude tuttavia il passaggio di sostanze
idrofile essenziali al metabolismo. Per assicurare il passaggio dei metaboliti,
la membrana è dotata di canali speciali per la diffusione passiva di molecole
idrofile. Questi canali, chiamati porine, sono proteine che presentano un foro
centrale di lume limitato e che si riuniscono in coppie o in trimeri assicurando
il passaggio delle sostanze indispensabili al metabolismo.
L’organizzazione della parete cellulare dei Gram- rende
ragione della particolare resistenza di tali batteri a
taluni farmaci e della loro presenza in particolari distretti
organici (ambiente intestinale)
Periplasma o spazio periplasmico
E’ un comparto ben definito compreso tra il peptidoglicano e la
membrana citoplasmatica.
Ha la funzione di racchiudere e contenere in uno spazio delimitato
una serie di molecole proteiche che garantiscono l’esercizio di
funzioni fisiologiche importanti per il batterio.
Parete cellulare dei batteri
Gram-negativi
lipopolisaccaridi
porina
Membrana
esterna
Parete
lipoproteine
peptidoglicano
Membrana
plasmatica
Spazio periplasmico
Sintesi del peptidoglicano
La via biosintetica che conduce alla sintesi del peptidoglicano è fondamentale
per comprendere il meccanismo d’azione di numerosi antibiotici che debbono
la loro azione all’inibizione di tale sintesi in taluni momenti essenziali.
La biosintesi del peptidoglicano è il processo tramite il quale la cellula
sintetizza ciascun monomero di peptidoglicano.
Le fasi finali del processo, consistenti nella estensione dei singoli monomeri
in corti polimeri, nella formazione di legami crociati tra polimeri lineari e
nel loro inserimento nella parete deteminandone l’allungamento è catalizzata
da enzimi capaci di legare covalentemente la penicillina e gli altri β-lattamici
noti come PBP (Penicillin-binding proteins).
Sintesi del peptidoglicano
Biosintesi del peptidoglicano
(a livello citosolico)
Nel citoplasma una molecola di N-acetilglucosamina–fosfato (NAG-P) si
lega all’uridin–trifosfato con formazione di UDP-NAG e liberazione di P
UDP-NAG si lega ad una molecola di fosfoenolpiruvato in una reazione
inibita dall’antibiotico fosfomicina (analogo strutturale), formando
UDP-NAG-piruvato
Il piruvato viene ridotto ad ac. lattico con formazione di acido
N-acetilmuramico o NAM
L’ NAM legato all’UDP (UDP-NAM) funge da accettore per i seguenti
aminoacidi: L-alanina, D-glutammico, L-lisina e infine il dimero
D-alanina D-alanina (una racemasi trasforma una L-alanina in
D-alanina e una sintetasi catalizza la formazione del dimero)
L’inserimento del dimero è inibito dall’antibiotico cicloserina (analogo
strutturale) del dimero stesso
Biosintesi del peptidoglicano
(a livello della membrana)
L’NAM-pentapeptide staccato dall’UDP si lega ad un vettore lipidico
della membrana rappresentato da una molecola di bactoprenolo
All’ NAM-pentapeptide legato al vettore lipidico viene aggiunta una
molecola di N-acetilglucosamina con formazione di una unità basale
completa di peptidoglicano
Una serie di unità basali complete sono polimerizzate e legate
trasversalmente tramite l’intervento delle PBP1A e 1B che agiscono
sia da enzimi transglicosilanti (legame β 1,4 glicosidico tra
N-acetilglucosamina di una unità e NAM dell’unità adiacente) sia da
enzimi transpeptidanti (legami di transpeptidizzazione tra polimeri
lineari di peptidoglicano adiacenti
La polimerizzazione delle unità basali e la liberazione dal vettore lipidico
sono inibite dai glicopeptidi (vancomicina e teicoplanina)
Biosintesi del peptidoglicano
(a livello della parete)
I corti polimeri di peptidoglicano, liberati dal vettore lipidico, sono
trasferiti all’esterno della membrana dove viene staccata la molecola
terminale di D-alanina e l’energia liberata viene utilizzata per
l’inserimento, ad opera di altre PBP (2 e 3) dei frammenti polimerici nei
siti di allungamento della parete in corrispondenza di tagli operati dalla
PBP 4 che rappresentano le zone accettrici le molecole peptidoglicaniche
neosintetizzate.
Tutte le operazioni terminali di polimerizzazione, transpeptidizzazione e
inserimento delle unità peptidoglicaniche nella parete catalizzate dalle
PBP, risultano bloccate dagli antibiotici β-lattamici (penicilline e
cefalosporine) che agiscono legandosi alle proteine enzimatiche e dagli
antibiotici glicopeptidici (vancomicina e teicoplanina) che agiscono
legandosi al dimero D-ala D-ala impedendo la polimerizzazione.
Attivazione delle autolisine
o mureino-idrolasi
L’azione battericida dei farmaci in grado di bloccare la biosintesi della
parete non è esclusivamente dipendente dal blocco della sintesi del
peptidoglicano, quanto dall’attivazione di enzimi autolitici (autolisine) che
avrebbero il compito di rimuovere il tratto di peptidoglicano alterato.
In presenza del farmaco capace di bloccare la sintesi del peptidoglicano,
l’azione delle autolisine produce una “breccia” nella parete favorendo la lisi
osmotica e la conseguente azione battericida del farmaco.
Protoplasti e sferoplasti
Protoplasti:
derivati dei batteri Gram+, ottenibili in laboratorio,
privi di parete cellulare
Sferoplasti: derivati dei batteri Gram-, ottenibili in laboratorio,
privi di parete cellulare
Caratteristiche
• Presentano sempre forma rotondeggiante qualunque sia la forma originale
(la parete è essenziale per definire la forma)
• Perdono la capacità riproduttiva (ruolo della parete per la vitalità cellulare)
• Devono essere mantenuti in ambiente con pressione osmotica uguale alla
pressione osmotica interna per evitare la lisi
Come si ottengono i protoplasti o
gli sferoplasti in laboratorio?
I protoplasti si possono ottenere trattando i batteri Gram+ con lisozima
o con farmaci che ostacolino la sintesi del peptidoglicano (penicilline)
Gli sferoplasti, dal momento che la membrana esterna è impermeabile al lisozima,
possono essere ottenuti rendendo la membrana esterna dei Gram- permeabile al
lisozima previo trattamento con agenti chelanti i cationi come l’EDTA.
Si ottengono così forme rotondeggianti che mantengono tracce di membrana.
La fase L dei batteri
I batteri in fase L sono forme cellulari che si ottengono in vivo, prive
di parete cellulare. Tali forme vengono isolate da varie affezioni ad
andamento subacuto o cronico.
I batteri in fase L a differenza dei protoplasti sono in grado di
riprodursi contribuendo alla cronicizzazione dell’infezione.
L’eziologia batterica sostenuta da batteri in fase L influenza sia la
terapia (si escludono antibiotici che interferiscono con la sintesi del
peptidoglicano) che la diagnosi (tecniche particolari di isolamento).
Strutture polisaccaridiche esterne
Glicocalice
Il glicocalice è un complesso di sostanze per lo più polisaccaridiche che
avvolgono la cellula batterica all’esterno della parete cellulare, rappresentate
dallo “strato cristallino” o “strato S” o dalla capsula.
Il glicocalice, pur non essendo una struttura essenziale per il batterio è
presente in tutte le fasi della vita lasciando intuire un ruolo fondamentale nei
fenomeni di permeabilità selettiva e adesione della cellula batterica prerequisito
essenziale di ogni processo infettivo.
Strato cristallino o strato S
E’ uno strato formato da subunità proteiche spesso uguali tra loro, a volte
legate a carboidrati disposte con una precisa simmetria cristallina, spesso
associate in tetrameri, pentameri o esameri a formare un involucro pluristratificato
che avvolge esternamente la cellula.
Funzioni
• Rappresenta un ulteriore involucro protettivo
• Può intervenire nei fenomeni di “adesione” alle superfici mucose,
momento fondamentale di ogni processo infettivo.
Capsula
E’ un involucro mucoso e amorfo che può essere abbondantemente
presente sia nei batteri Gram+ sia nei Gram-
E’ il risultato della secrezione di materiali di alta viscosità (etero o
omopolimeri polisaccaridici) che rimangono adesi alla superficie esterna
della cellula conferendo proprietà di adesività a particolari superfici con
possibilità da parte del batterio di colonizzare specifici distretti (superfici
dei denti, mucose etc.) o peculiari nicchie ecologiche.
Composizione della capsula
Generalmente la capsula è costituita da:
polisaccaridi (levani e destrani)
polisaccaridi complessi es. Streptococcus pneumoniae
poliribitolfosfati
es. Haemophilus influenzae
poli D glutammato
es. Bacillus anthracis
Qualunque sia la sua composizione, la capsula è legata alle strutture
sottostanti, direttamente se le cariche elettriche sono di segno opposto,
altrimenti se le cariche sono dello stesso segno (-), interverranno dei
cationi che effettuerannno legami a ponte tra la capsula e la parete
cellulare
Capsula
Funzioni
• Azione antifagocitaria
impedisce la fagocitosi da parte dei fagociti dell’ospite (i batteri più
invasivi che debbono attraversare il torrente ematico per raggiungere il
bersaglio sono sempre capsulati)
• Strumento di adesione
il materiale capsulare rappresenta un efficace strumento per l’adesione
batterica alle superfici mucose o inerti dell’organismo ospite
contribuendo fortemente alla formazione di “biofilm” che favoriscono la
persistenza del processo infettivo
Come si evidenzia nei batteri
la presenza della capsula?
La presenza della capsula si evidenzia
facilmente sospendendo i batteri in
una goccia di inchiostro di china ed
osservando al microscopio.
I batteri provvisti di capsula sono
evidenti per l’alone chiaro, non
penetrato dall’inchiostro, di cui è
circondata la cellula batterica in
contrasto con il fondo scuro delle
particelle di inchiostro.
Formazione della capsula
La formazione della capsula può essere influenzata da:
1. Fattori ambientali (presenza dei precursori dei componenti capsulari)
2. Fattori genetici (presenza di geni capaci di costituire il componente
capsulare: es. capsula dello Streptococcus pneumoniae)
Che cos’è il biofilm?
Il biofilm è una formazione complessa formata da un’estesa matrice di materiale
polisaccaridico contenente numerosi batteri in grado di interagire tra loro, che
può invadere ampie zone di mucosa quali: la mucosa respiratoria (infezioni da
Pseudomonas nella fibrosi cistica), le fasce connettivali intermuscolari
(fascite necrotizzante), superfici connettivali come le valvole cardiache,
oppure superfici di materiali inerti introdotti a scopo terapeutico come fili di
sutura e vari impianti protesici (cateteri vescicali, catetere venoso centrale,
protesi vascolari, protesi valvolari cardiache).
All’interno del biofilm i batteri sono relativamente resistenti all’azione degli
effettori delle difese antimicrobiche e rappresentano un più difficile bersaglio
per i farmaci antibatterici.
La crescita all’interno del biofilm rappresenta pertanto una delle cause più
frequenti di infezioni persistenti e una delle condizioni infettive di più difficile
approccio.
Strutture appendicolari della cellula batterica
Alla superficie della cellula batterica possono essere presenti
una serie di appendici rappresentate dai flagelli e dalle fimbrie
o pili.
Si tratta di strutture proteiche filamentose formate da monomeri
capaci di autoassemblarsi a
formare strutture di varia
lunghezza, cilindriche che
si protendono all’esterno
della cellula.
Flagelli
Sono appedici molto sottili, di aspetto ondulato, con spessore
costantemente inferiore al potere di risoluzione del microscopio
ottico e assai lunghe ( più lunghe della cellula a cui appartengono)
che si protendono all’esterno della cellula batterica.
Sono organi di propulsione, permettono cioè ai batteri di muoversi.
I batteri che hanno i flagelli sono detti: “mobili”, quelli che ne sono
privi:” immobili”.
Il movimento conferito dai flagelli è un movimento “vero” più evidente
rispetto ai moti oscillatori (moti browniani) delle specie immobili.
Come è possibile dimostrare la
presenza dei flagelli?
Lo spessore dei flagelli (~120 Ǻ) inferiore al potere di risoluzione
del microscopio ottico, ne impedisce la visione all’osservazione
microscopica a meno di non usare soluzioni di sali (nitrato di argento), in
grado di depositarsi sui flagelli, ispessendoli e permettendone la visione.
La presenza dei flagelli può essere dimostrata indirettamente
apprezzando il movimento dei batteri con un metodo chiamato:
metodo della goccia pendente.
Tale metodica utilizza un particolare vetrino più spesso dei vetrini
portaoggetto con una escavazione circolare centrale, chiamato
cellula di Koch.
Movimento dei batteri: metodo della goccia pendente
Procedimento
Si pone una goccia di sospensione batterica sul
coprioggetti.
Si ungono con vasellina i bordi del vetrino allo
scopo di farlo aderire al vetrino cellula di Koch
Si prende la cellula di Koch con la concavità
rivolta verso il basso e si fanno aderire i due
vetrini.
Si capovolge il tutto, in modo che la goccia di
sospensione batterica “penderà” all’interno
della cavità. I batteri, all’osservazione micro
scopica, se mobili si muoveranno vivacemente,
assai più rispetto alle specie immobili
Dislocazione dei flagelli sulla
cellula batterica
La presenza dei flagelli, tranne rare eccezioni, è una caratteristica
esclusiva dei batteri di forma cilindrica (bacilli, vibrioni e spirilli) i
quali a seconda della zona di inserzione dei flagelli si distinguono in:
Monotrichi
un solo flagello polare
lofotrichi
un ciuffo di flagelli polari
anfitrichi
due flagelli polari
Peritrichi
flagelli lungo il contorno
Struttura del flagello
I flagelli sono formati dalla ripetizione di subunità di una particolare
proteina chiamata flagellina che si autoassemblano a formare una
struttura elicoidale. Le singole subunità vengono sintetizzate dalla
cellula, trasportate lungo l’interno cavo del flagello e depositate
all’apice determinandone l’allungamento.
Le flagelline di specie batteriche diverse, sono differenti tra loro,
sono dotate di spiccate proprietà antigeniche e rappresentano
l’antigene H dei batteri mobili
Ultrastruttura del flagello
Ogni singolo flagello è costituito da
tre parti:
• Il filamento elicoidale che
protrude dalla cellula
(“filament”)
• Un gancio tubulare che
attraversa gli strati esterni di
diametro leggermente maggiore
rispetto al filamento (“hook”)
• Un corpo basale che ancora il
flagello alle strutture cellulari e
rappresenta il “motore” del
movimento rotatorio del flagello
Ultrastruttura del corpo basale
Il corpo basale è formato da subunità di almeno 15 proteine che si
aggregano a formare una struttura tubolare chiamata bastoncello
e da una serie di anelli, quattro nei batteri Gram negativi, chiamati:
Anello L (lipopolisaccaride)
in corrispondenza della membrana esterna
Anello P (peptidiglicano)
in corrispondenza della parete cellulare
Anello S (supermembrana)
subito al di sopra della membrana
Anello M (membrana)
in corrispondenza della membrana
Nei batteri Gram+ la struttura del corpo basale è più semplice in
rapporto alla diversa organizzazione degli strati esterni e presenta
solo l’anello M e quello S.
Il movimento dei flagelli
• Il movimento dei flagelli avviene attraverso la loro rotazione in corrispondenza
del corpo basale e del gancio.
• I flagelli batterici non presentano, a differenza delle ciglia degli organismi
eucarioti, movimenti ondulatori, bensì rotatori.
• Il movimento rotatorio dei batteri può avvenire in senso orario o antiorario.
Essendo il passo dell’elica sinistrorso, il movimento orario è più disordinato,
quello antiorario risulta più direzionato.
• Il senso della rotazione (orario o antiorario) è condizionata da chemiorecettori
di superficie che rispondono a stimoli ambientali.
• L’energia che determina il movimento rotatorio è generata dal potenziale di
membrana durante il trasporto di elettroni nel corso della fosforilazione
ossidativa
Fimbrie o pili
• Sono appendici proteiche che si proiettano al di fuori degli involucri
cellulari esterni
• Sono presenti solo nei Gram negativi (circondano la cellula)
• Originano dalla membrana citoplasmatica e si estendono per 0,2 µm
all’esterno.
• Sono formate dalla ripetizione di una o due proteine (piline) specifiche
per le diverse specie batteriche, organizzate con simmetria elicoidale a
formare rigide strutture cilindriche
• Alcune proteine, presenti all’estremo libero delle fimbrie conferiscono
loro la specifica capacità di legarsi a particolari substrati (adesine).
• Una particolare classe di pili è rappresentata dai fili F o pili sessuali.
• Sono più lunghi delle fimbrie adesiniche e svolgono un ruolo
fondamentale nei processi di “coniugazione” batterica, permettendo lo
scambio di materiale genetico.
Processo di sporulazione
Le spore batteriche sono cellule peculiari per attributi morfologici
e funzionali, capaci di sopravvivere nell’ambiente esterno allo stato
di quiescenza.
Vengono prodotte da un limitato numero di specie per lo più saprofite.
Tra i batteri di interesse clinico, gli sporigeni più importanti
appartengono a due generi
Genere Bacillus
sporigeni aerobi
Genere Clostridium
sporigeni anaerobi
Processo di sporulazione
La produzione della spora non costituisce una tappa obbligata del ciclo
di sviluppo di uno sporigeno, ma si verifica in seguito a condizioni
ambientali sfavorevoli (scarsa presenza di nutrienti e di acqua).
Nel batterio sporigeno vanno perciò distinte due condizioni alternative:
Le cellule termolabili e metabolicamente attive si
l’accrescimento vegetativo dividono per scissione binaria alla massima velocità
consentita dalle condizioni ambientali
sporificazione
Vengono sintetizzati tutti i componenti peculiari
della spora
Significato della spora
La sporulazione va considerara come un processo di differenziamento
cellulare indotto dal variare delle condizioni ambientali, e rappresenta
il risultato di informazioni genetiche che, alternativamente espresse
possono consentire la formazione di due tipi cellulari tra loro
profondamente diversi:
La spora
la forma vegetativa
La spora matura
•E’ profondamente diversa dalla forma vegetativa per composizione
chimica, organizzazione strutturale, proprietà fisiologiche
•E’ termoresistente, disidratata, priva di evidente attività metabolica.
•E’ resistente a molti agenti fisici e chimici, antibiotici e solventi.
•E’ in grado, nonostante l’estrema dormienza, di rispondere a
determinati stimoli ambientali ed andare incontro al processo di
germinazione che comporta interruzione dello stato di quiescenza
e ritorno alla forma vegetativa.
La spora germinata
•
•
•
•
E’ un’entità termolabile
Idratata
Metabolicamente attiva
In presenza di nutrienti, a
concentrazioni non limitanti dà luogo ad
una cellula capace di moltiplicarsi
Proprietà delle spore
resistenza
Calore
Essiccamento
Congelamento
Agenti chimici
Radiazioni
quiescenza metabolica
disidratazione-rifrangenza
difficoltà tintoriali per scarsa assunzione del
colorante
Struttura della spora
Dall’interno:
• Protoplasto
• Membrana interna
• Parete sporale
• Corteccia sporale
• Membrana esterna
• Tunica profonda
• Tunica intermedia
• Tunica superficiale
• Esosporio
Protoplasto
• E’ assente l’RNA messaggero
• Sono assenti enzimi per la biosintesi di alcuni aminoacidi
• Sono assenti enzimi per la biosintesi dei nucleotidi
• Sono assenti enzimi per la biosintesi degli acidi tricarbossilici
• E’ presente una copia del cromosoma batterico
• Sono presenti i componenti della sintesi proteica
• Sono presenti proteine enzimatiche e strutturali
• Sono presenti proteine di riserva
• Sono presenti gli enzimi per il trasporto terminale degli elettroni
Protoplasto
(composti a basso p. molecolare)
Il protoplasto sporale è caratterizzato dalla presenza di composti a
basso peso molecolare spesso complessati tra loro quali:
• Acido dipicolinico (si forma da un intermedio della catena
biosintetica della lisina, è presente solo nella spora, ne costituisce
il 5-15% del peso secco
• Aminoacidi (lisina, arginina, ac. glutammico)
• Poliammine (spermina e spermidina)
• Ioni (Ca++)
• Acido 3 fosfoglicerico ( intermedio della glicolisi, rappresenta la
riserva energetica della spora)
Stato chimico-fisico del
protoplasto sporale
La caratteristica più saliente del protoplasto sporale è la condizione
chimico-fisica in cui si trovano i suoi componenti a causa dell’estrema
disidratazione e dell’elevato contenuto di molecole a basso peso
molecolare. In assenza di acqua tali composti favoriscono interazioni
dirette tra le macromolecole con formazione di legami polari e non
polari che portano alla formazione di un gel denso ed esteso chiamato
“matrice”o “stroma” della spora.
Le macromolecole proteiche in assenza di acqua vengono immobilizzate
tramite la formazione di legami realizzati dai composti a basso peso
molecolare, pertanto nella spora tali molecole risultano inattive ma non
denaturate.
Strato della corteccia
La corteccia è compresa tra la membrana interna e quella esterna
della spora. E’ costituita da peptidoglicano disposto in diversi strati
concentrici intorno al protoplasto.
E’ distinta in due porzioni:
• La più interna denominata parete della spora, ha struttura compatta,
presenta numerosi legami trasversi e non va incontro ad autolisi
durante la germinazione
• La più esterna è costituita da peptidoglicano più lasso
50% dei residui di ac. muramico non presentano il tetrapeptide
20% dei residui di ac. muramico legano una sola L-alanina
30% dei residui di ac. muramico legano il tetrapeptide completo
Nel 10% si formano legami trasversi tra le catene tetrapeptidiche
Strato delle tuniche (coats)
• Costituisce il 50% del volume totale della spora
• E’ formato da numerosi strati proteici, densi, compatti, rigidi e
sovrapposti.
• E’ costituito da proteine (80% delle proteine totali della spora).
• Le proteine sono ricche di: cisteina, valina, ac. glutammico e lisina.
• La cisteina favorisce la formazione di legami disolfuro intra e
inter-molecolari.
• Il risultato è una struttura rigida, poco deformabile, pluristratificata,
resistente all’azione enzimatica e a molti solventi.
Esosporio
•
•
•
•
•
E’ la struttura più esterna della spora
Non è sempre presente
E’ di tipo membranoso
La sua funzione non è chiara
E’ formata da proteine, lipidi e
polisaccaridi
Formazione della spora
Il processo di sporificazione evolve in stadi morfologici successivi ed è il
risultato di un processo di differenziamento controllato da informazioni
genetiche espresse in sequenze temporali definite.
1. Formazione del filamento assiale
In questo stadio il cromosoma si rilassa a formare un filamento assiale disposto
secondo l’asse maggiore della cellula.
2. Formazione del setto asimmetrico
nella cellula ad una estremità compare un setto che divide il protoplasto in due comparti
diseguali contenenti ciascuno un cromosoma completo, il comparto più piccolo sarà la
sede di formazione della spora.
3. Formazione della prespora
In questo stadio si ha la proliferazione delle membrane settali con formazione di una
duplice membrana che circonda il comparto cellulare più piccolo (pre-spora). Vengono
sintetizzate proteine che operano il trasporto attivo di aminoacidi e ac. dipicolinico,
permettendone l’accumulo nel protoplasto sporale
4. formazione della corteccia o cortex
Tra le due membrane viene stratificato il peptidoglicano utilizzando le stesse
vie che nelle forme vegetative operano la sintesi del peptidoglicano della
parete. Due enzimi specifici, sintetizzati allo scopo, determinano le
modificazioni strutturali del peptidoglicano corticale. Si verifica accumulo di
DPA e di Ca++ nel protoplasto e inizia acquisizione di termoresistenza
5. formazione delle tuniche o coats
Vengono sintetizzate proteine specifiche, ricche di zolfo, che vanno a
costituire il rivestimento più esterno della spora.
6. endospora matura
In questa fase si completa la formazione degli involucri sporali e la
spora viene liberata all’esterno in seguito alla lisi dello sporangio.
Germinazione
E’ il processo in cui cessa la condizione di spora e si ha il ripristino delle
attività vegetative.
La trasformazione di una spora quiscente in una forma vegetativa è il
risultato di 3 processi sequenziali:
1. Attivazione
è un processo reversibile che rende le spore pronte a germinare, se
esposte a specifici “induttori” della germinazione; questi sono sostanze
quali: aminoacidi o nucleosidi che non vengono utilizzati come substrati dalla
spora, ma piuttosto si legano a strutture recettoriali, determinandone
modificazioni in grado di attivare il metabolismo degradativo.
L’attivazione può essere indotta: dall’esposizione a temperature elevate o
a seguito di eventi naturali come l’invecchiamento e l’usura degli strati.
Germinazione
2. germinazione
È un processo irreversibile caratterizzato da una serie di reazioni
degradative che portano alla depolimerizzazione della corteccia,
con l’eccezione della porzione più interna, ad opera di un enzima
litico simile al lisozima e alla perdita di composti spora-specifici.
3. esocrescita
L’esocrescita della spora germinata si attua quando vengono forniti
nutrienti a concentrazioni non limitanti.
Durante l’esocrescita si verificano una serie di eventi che ripristinano
le condizioni metaboliche della crescita vegetativa
Riproduzione dei batteri
I batteri si riproducono per “schizogonia” o divisione semplice: una
cellula madre cioè si divide e forma due cellule figlie perfettamente
uguali tra loro, perché ciò possa avvenire è necessario che il patrimonio
genetico venga egualmente ripartito, il DNA pertanto deve potersi
duplicare. Questo processo assicura la corretta ripartizione del
corredo genetico tra le cellule figlie.
Il materiale genetico dei batteri (DNA) è
organizzato in un’unica molecola di forma
circolare. Il processo di duplicazione ha
inizio da un punto di origine posto sulla
membrana citoplasmatica e termina dal lato
opposto
Fasi della riproduzione batterica
Duplicazione del cromosoma batterico:
il materiale cromosomico, ancorato alla membrana
citoplasmatica, si duplica generando due nuovi cromosomi
ancorati ciascuno separatamente alla membrana
Accrescimento delle membrane:
si verifica l’accrescimento delle membrane batteriche e il
conseguente allungamento della cellula, partendo dalla zona
di membrana che separa le due strutture cromosomiche
Allontanamento delle strutture cromosomiche:
continuando l’accrescimento della cellula, le due strutture
cromosomiche si distanziano sempre di più l’una dall’altra
Separazione delle cellule figlie:
la separazione è causata dalla formazione di un setto che
parte dalla membrana e si approfonda nel citoplasma in
direzione centripeta
Distacco delle cellule:
all’interno del setto di membrana si forma un setto di
parete permettendo il definitivo distacco delle cellule. Se il
setto non si completa le cellule neoformate rimangono unite
in aggruppamenti spaziali caratteristici.
La curva di crescita dei batteri
I batteri, se le condizioni sono opportune per lo sviluppo, si riproducono
assai velocemente e il loro numero aumenta in breve tempo.
Misurando la quantità di batteri presenti nell’unità di volume di un terreno
liquido a diversi intervalli di tempo, si può costruire un grafico che
rispecchia la cinetica del processo replicativo della popolazione batterica
della coltura.
Il grafico ha un aspetto caratteristico, simile per tutti i batteri e può
essere suddiviso in diverse fasi.
Curva di crescita: fasi
Misurando il numero di batteri vivi presenti in
una unità di volume a vari intervalli di tempo e
riportando i valori in un diagramma ad assi cartesiani nel quale in ascisse si pone il tempo e in
ordinate il log del numero dei batteri vivi si
ottiene una curva che può essere suddivisa in 4 fasi.
1) Fase di latenza in questa fase non si ha aumento
nel numero dei batteri. La durata di questa fase può
essere molto diversa a seconda delle specie batteriche e delle condizioni di coltura; è dovuta alla necessità per i batteri di sintetizzare gli enzimi necessari
alla metabolizzazione dei substrati presenti nel terreno (fase di adattamento metabolico)
Curva di crescita: fasi
2) Fase esponenziale o logaritmica
Quando tutti i batteri hanno terminato i processi
metabolici necessari alla riproduzione, inizia la fase
esponenziale nella quale si ha un rapido incremento
nel numero dei batteri in rapporto al tempo. Questa
fase non può durare all’infinito poiché determina un
rapido esaurimento di nutrienti con allungamento
del tempo di moltiplicazione.
3) Fase stazionaria
Il numero di batteri vivi si mantiene costante, il modesto numero di batteri che ancora si dividono bilancia quelli che muoiono.
4) Fase di morte o di declino
Il numero di batteri cala progressivamente in quanto
il numero di batteri che muoiono supera quelli che
sopravvivono o ancora riescono a dividersi
Le colture continue
Normalmente si dice che una coltura è giovane, quando è in fase
logaritmica di sviluppo e vecchia quando si trova in fase stazionaria.
La distinzione tra giovane e vecchia non riguarda la cellula batterica ma è
dovuta alle condizioni del mezzo di coltura e alla disponibilità di nutrienti.
E’ possibile mantenere una coltura batterica giovane per il tempo che si
desidera utilizzando particolari sistemi di coltura (chemostati) in cui da
una parte si ha continua sottrazione di terreno invecchiato e dall’altra si
ha aggiunta di uguale quantità di terreno fresco.
In tal maniera si mantiene indefinitivamente la coltura in condizioni
ottimali, per cui si ha la moltiplicazione di tutti i batteri presenti.
La coltivazione dei batteri
Terreni di coltura:
sono dei substrati artificiali nei quali è possibile coltivare (far crescere e
moltiplicare) i microrganismi in laboratorio al di fuori degli ambienti naturali.
Coltivare i batteri è essenziale per poterli studiare, per valutare i fattori
che ne influenzano lo sviluppo, per saggiare l’attività di sostanze dotate di
attività antibatterica.
Requisiti dei terreni di coltura:
Appropriato apporto di elementi nutritivi
Opportuno grado di umidità
Opportuno valore di pH
Idoneo potenziale ossido-riduttivo
Sterilità
Classificazione dei terreni di coltura
In base alle esigenze nutritive:
Terreni minimi (contengono gli elementi essenziali per lo sviluppo)
Terreni generali (utili per quasi tutti i microrganismi)
Terreni per batteri esigenti (contengono sostanze specificatamente
richieste da taluni microrganismi
In base alla composizione:
Terreni selettivi (permettono lo sviluppo solo di taluni batteri in quanto
contengono sostanze che inibiscono lo sviluppo degli altri)
Terreni elettivi (permettono lo sviluppo di un gruppo di batteri senza
impedire lo sviluppo degli altri)
Terreni differenziali (differenziano i batteri in base al comportamento
biochimico)
Terreni selettivi e differenziali (permettono lo sviluppo solo di alcuni
batteri e li differenziano in base al comportamento biochimico
Classificazione dei terreni di coltura
In base alla consistenza
Terreni
Terreni
Terreni
Terreni
liquidi (consistenza liquida es. brodo)
solidificabili (brodo con aggiunta di 1,5-2% di agar)
semisolidi (<quantità di agar utile per la motilità batterica)
coagulati (contengono siero).
L’agar è un polisaccaride estratto dalle alghe, non è utilizzato dai batteri
come nutriente ma è usato per rendere solido un terreno liquido. L’agar
fonde alla temperatura di 100°, rimane liquido fino a 45° e solidifica a
temperatura ambiente. I terreni a base di agar:
1) assumono la forma del recipiente durante la solidificazione
2) possono essere miscelati con sostanze termolabili es. sangue
3) Offrono la possibilità di inoculare sospensioni batteriche (agar germi)
Fattori che influenzano la crescita
dei microrganismi
• Temperatura (batteri psicrofili, mesofili, termofili)
• Ossigeno (aerobi, anaerobi, facoltativi)
• Anidride carbonica (5-10% necessaria per talune
•
specie)
Fattori di accrescimento (alcuni batteri non riescono
a sintetizzare taluni metaboliti che debbono essere
loro forniti)
Principi e tecniche di sterilizzazione
Definizione
la sterilizzazione è l’operazione la quale, mediante tecniche fisiche o
chimiche, determina l’uccisione di tutti i microrganismi (patogeni e
saprofiti) presenti in un materiale
La disinfezione, invece, con l’impiego di sostanze chimiche ad azione
germicida determina l’uccisione solamente dei patogeni.
La sterilizzazione si può ottenere mediante:
calore: (fiamma diretta, calore umido, secco, vapore sotto pressione)
filtrazione
radiazioni
gas
Sterilizzazione mediante calore
Fiamma diretta
utilizza il becco Bunsen, serve per sterilizzare l’ansa e per il “flambaggio”
dei bordi dei recipienti durante le operazioni di apertura e chiusura.
Calore umido
molto efficace, uccide i microrganismi a temperature inferiori rispetto
a quelle utilizzate con il calore secco grazie alla maggiore conducibilità
termica del vapore. Si attua con:
1) liquidi caldi (acqua): bollitura, pastorizzazione
2) Vapore fluente o sotto pressione (sterilizzazione con vapore fluente,
tindalizzazione, autoclave)
Bollitura
Si ottiene utilizzando liquidi alla temperatura di 100°, uccide i microrganismi in forma vegetativa; usata per siringhe, materiali da medicazione.
Pastorizzazione
Serve per ridurre la carica batterica da un materiale ad es. il latte (prende il nome
da Pasteur).
Sterilizzazione mediante vapore fluente
Per vapore fluente si intende il vapore acqueo alla temperatura di
100°, esso possiede grande forza di penetrazione. Un sistema impiegato
per formare vapore fluente è la pentola di Koch, un recipiente a chiusura
non ermetica all’interno del quale l’acqua bolle alla temperatura di 100°.
Sterilizzazione frazionata (Tindalizzazione)
Si applica quando il materiale da sterilizzare non tollera le alte temperature (terreni contenenti proteine del latte o siero).
L’apparecchio usato è il gelatinizzatore di koch.
Tecnica
Si sottopone il materiale a tre trattamenti termici a 80° per 30’ a
distanza di 24h uno dall’altro. Si uccidono sia le forme vegetative sia le
spore e si ha solidificazione del terreno.
Sterilizzazione con vapore sotto pressione
Metodo riservato al materiale che può tollerare le alte temperature (terreni di
coltura e soluzioni stabili al calore). Apparecchio utilizzato: autoclave.
Autoclave
L’azione sterilizzante è data dalle temperature raggiunte dal vapore saturo sotto
pressione. Esiste corrispondenza tra i valori di pressione e temperatura: alla
temperatura di 121° corrisponde la pressione di 1 atm capace di permettere
la sterilizzazione del materiale in un tempo di 15-30 min.
Tecnica:
1. Porre il materiale chiuso con tappi all’interno dell’apparecchio.
2. Chiudere il coperchio dell’autoclave.
3. Accendere l’autoclave, l’acqua bollendo genera vapore che sostituisce
l’aria presente nella camera di sterilizzazione.
4. Attendere che il vapore fuoriesca dal rubinetto di scarico e chiudere il
rubinetto stesso
5. Controllare la corrispondenza tra temperatura e pressione e lasciar
agire il tempo richiesto.
6. A sterilizzazione avvenuta, per aprire l’autoclave attendere che la pressione sia tornata ai valori ordinari.
Sterilizzazione con calore secco
Principio sterilizzante: aria fortemente riscaldata
Apparecchio impiegato: forno Pasteur
È un apparecchio nel quale l’aria calda generata da resistenze circola nel comparto
interno. La sterilizzazione si ottiene regolando la temperatura a 160-180° C
per 2 h.
Utile per sterilizzare: vetreria e strumentario resistente alle alte temperature,
ma non per i terreni di coltura
Sterilizzazione per filtrazione
Si usa per sterilizzare liquidi contenenti sostanze labili al calore come:
vitamine, proteine del siero etc.
Procedimento:
il materiale da sterilizzare viene fatto passare attraverso una membrana
provvista di pori il cui diametro permette il passaggio del liquido ma non
dei batteri.
I filtri più usati sono monouso da inserire in:
1. imbuti sterilizzabili
2. contenitori preconfezionati monouso
3. su siringa
Sterilizzazione con radiazioni
Sterilizzazione con radiazioni
Le radiazioni ionizzanti sono radiazioni elettromagnetiche con un’energia
tale da provocare la formazione di ioni e altri composti reattivi dalle
molecole con le quali entrano in collisione.
Tali molecole reattive degradano biopolimeri come il DNA e le proteine
con conseguente morte della cellula.
Le radiazioni sono usate per prodotti farmaceutici e materiale suscettibile
al calore.
Le radiazioni debbono essere applicate ad una lunghezza d’onda inferiore
a 300nm, si impiegano:
Raggi gamma ( si ottengono da una sorgente di cobaldo 60)
Raggi X non usati in campo alimentare, alterano i caratteri organolettici,
sono prodotti da un filamento riscaldato che scorre all’interno di
un tubo vuoto.
Sterilizzazione gassosa
Sterilizzazione gassosa
Si usa per materiale in plastica monouso
Si impiega ossido di etilene al 10% e CO2 al 90% (per ridurre
l’infiammabilità)
Si usano apparecchiature simili alle autoclavi
Temperatura: 55°, tempo necessario: 4-8 h in presenza di
umidità. Provoca alchilazione dei gruppi sulfidrilici e aminici,
delle proteine e dei gruppi iminici degli acidi nucleici.
Terminata la sterilizzazione, allontanare i residui di ossido di
etilene tramite areazione in speciali camere di areazione.
(sistema di sterilizzazione lento).
Metodo utile anche per apparecchiature, materiale per
disinfezione, superficie delle compresse.
L’azione patogena dei batteri
Un batterio può essere definito patogeno, quando è in grado di penetrare,
attecchire e moltiplicarsi nell’organismo umano, danneggiandolo con la
produzione di sostanze tossiche denominate tossine.
I meccanismi dell’azione patogena sono pertanto:
la moltiplicazione in vivo
la produzione di tossine
Virulenza:
indica il grado della patogenicità.
Fattori di virulenza:
Sono i mezzi con cui si esprime la patogenicità dei microrganismi
Vie di ingresso dei batteri nell’ospite
Le vie che normalmente permettono l’ingresso dei microrganismi
nell’ospite sono rappresentate da:
Via orale (attraverso gli alimenti)
Apparato respiratorio (attraverso l’aria inspirata)
Congiuntiva dell’occhio
Apparato genito-urinario
La moltiplicazione in vivo dei batteri
Avvenuta la penetrazione nell’ospite, nella maggior parte delle infezioni,
la colonizzazione batterica si verifica a livello delle mucose tramite:
Adesine
strutture superficiali di natura proteica capaci
di legarsi alle membrane eucariotiche o a
proteine della matrice intercellulare
Polisaccaridi capsulari
La moltiplicazione batterica è seguita dalla formazione di biofilm cioè
di una struttura complessa formata da una matrice polimerica
autoprodotta capace di invadere ampie zone di mucosa.
I batteri stabilmente insediatisi a livello delle mucose possono:
Rimanere localizzati nella sede primaria d’infezione
Raggiungere l’area riccamente vascolarizzata della sottomucosa
Diffondere per via ematica colonizzando tessuti e organi a distanza
Evasione delle difese antibatteriche dell’ospite
I batteri insediatisi nell’organismo mettono in opera meccanismi capaci
di evadere le difese dell’ospite rappresentati dai fattori di virulenza,
suddivisi in:
Aggressine
sostanze non tossiche che promuovono l’attecchimento e l’invasione dei
batteri impedendo le difese dell’ospite:
•mediante inibizione della migrazione macrofagica
•attraverso strutture di superficie ad azione antifagocitaria
(antigeni di superficie, proteina M di S. pyogenes, capsula, etc.)
•attraverso enzimi che favoriscono la diffusione tissutale (ialuronidasi,
chinasi, proteasi, collagenasi, DNAsi)
•mediante la produzione di leucocidine in grado di danneggiare i leucociti
•mediante produzione di catalasi e superossidodismutasi in grado di
resistere ai meccanismi di killing intracellulare dei macrofagi
Tossine
Si suddiviono in eso ed endotossine a seconda che siano prodotte dal
batterio e secrete all’esterno o che facciano parte della struttura
cellulare batterica.
Differenze tra esotossine ed endotossine
Esotossine
•
•
•
•
•
•
•
•
Prodotte da Gram+ e GramNatura chimica: proteica
Termolabili
Cronolabili
Fortemente antigeni
Convertibili in anatossine
Tossicità elevata (DL50-μg)
Azione tossica specifica
Endotossine
• Prodotte solo da Gram• Lipopolisaccaridica
• Termostabili
• Cronostabili
• Debolmente antigeni
• Non convertibili in anatossine
• Tossicità minore (DL50-mg)
• Azione tossica non specifica
Esotossine
Natura chimica: generalmente proteica con qualche eccezione
monomerica
Struttura:
dimerica
multimerica
multifattoriale
Antigenicità:
elevata
Possibilità di tossine diverse antigenicamente anche
se prodotte dallo stesso batterio.
Possibilità di tossine simili antigenicamente, ma
prodotte da batteri diversi
Classificazione delle esotossine
in base alla specificità dell’azione tossica
•
Tossine citolitiche ledono le membrane delle cellule bersaglio
provocandone la morte
•
Tossine neurotrope il bersaglio è rappresentato dalle cellule del
sistema nervoso centrale o periferico
•
Enterotossine agiscono a livello delle cellule della mucosa
intestinale specialmente dell’intestino tenue
•
Tossine pantrope sono in grado di danneggiare qualsiasi cellula
attraverso l’alterazione, la deregolazione o il blocco di alcuni
eventi metabolici.
Tossine citolitiche: emolisine
Bersaglio cellulare d’azione delle tossine
Struttura cellulare bersaglio
emazie ed altri tipi cellulari
membrana citoplasmatica
Meccanismo d’azione
• Formazione di pori o canali di transmembrana
alcune tossine sono formate da polipeptidi con carattere anfilitico che
si inseriscono nel doppio strato lipidico della membrana formando piccoli
pori o canali che mettono in comunicazione il citosol con l’ambiente
esterno (tossina a di Staphylococcus aureus, streptolisina O di
Streptococcus pyogenes, emolisina di Bordetella pertussis)
• Azione enzimatica sui lipidi di membrana
alcune tossine sono veri e propri enzimi in grado di idrolizzare alcuni
componenti lipidici della membrana. L’attività enzimatica è di tipo
fosfolipasico c e ha come bersaglio la fosforilcolina.
Meccanismo d’azione tossine citolitiche
La emolisina α di Staphylococcus
aureus è una proteina monomerica
che polimerizza sulla membrana
delle cellule bersaglio formando
oligomeri eptamerici tubulari che
si inseriscono nella porzione
lipidica della membrana causando
la formazione di pori che alterano
gli scambi della cellula con l’ambiente,
causandone la morte
Tossine neurotrope
(tossina butulinica e tetanica)
Sono tossine che interferiscono con il meccanismo di trasmissione degli
impulsi, a livello periferico (tossina butulinica) o centrale (tossina tetanica).
Tossina butulinica agisce attraverso il blocco della trasmissione
colinergica presinaptica mediata dall’acetilcolina (Ach). Agisce pertanto su:
• terminazioni pregangliari
• terminazioni postgangliari parasimpatiche
• terminazioni dei motoneuroni
Viene inbita la liberazione di Ach con paralisi flaccida dei muscoli
viscerali e striati; la morte interviene per arresto cardio-circolatorio
Tossina tetanica agisce a livello del SNC bloccando l’impulso nervoso
inibitore del riflesso da stiramento muscolare per cui ad ogni contrazione
muscolare segue la contrazione del muscolo antagonista con paralisi di tipo
spastico.
Enterotossine: tossina colerica
La tossina colerica, prototipo delle
enterotossine è formata da una
subunità A (attiva), circondata
da 5-6 subunità B (subunità di
legame). La subunità A è costituita
da due catene: A1 e A2.
Il frammento A1 ha attività
ribosilante e esplica l’azione sulla
proteina G attivatrice dell’enzima
adenilato ciclasi, il quale converte
l’ATP in AMPc.
Viene così a prodursi una notevole
quantità di AMCc che provoca la
fuoriuscita di ioni con conseguente
perdita di liquidi che si riversano
nel lume intestinale.
Tossine pantrope: tossina della
pertosse
E’ prodotta da Bordetella pertussis, è composta da una subunità A e da
5 subunità B.
La subunità A è quella enzimaticamente attiva e ribosila la proteina G
inibitrice dell’adenilato ciclasi che acquista un più elevato livello di
attività. La tossina interagisce con differenti tipi cellulari e determina
nelle cellule bersaglio effetti diversi indotti dall’incremento dell’AMPc
e dall’alterata trasmissione del signaling di membrana quali:
• inibizione dell’attività fagocitaria dei macrofagi
• aumento della sensibilità all’istamina
• aumentata produzione di insulina
Bersaglio dell’azione delle tossine
colerica e della pertosse
Tossina pantropa della difterite
E’ il principale strumento di patogenicità di C.
diphteriae. E’ una tossina A-B (l’estremo COOHterminale forma il componente B di legame,
mentre l’estremo NH2-terminale rappresenta
la parte tossica. La tossina, diffondendo, si lega
a recettori di membrana tramite l’estremo B e
viene scissa ad opera di proteasi nei due
componenti che rimangono uniti tramite un
ponte disolfuro. La tossina viene introdotta poi
nella cellula per endocitosi e dopo interruzione
del ponte disolfuro ad opera di sostanze riducenti
il componente A viene liberato nel citosol. Esso
possiede attività ADP-ribosilante, stacca la
nicotinamide dal NAD trasformandolo in ADP
ribosio che si lega al fattore di allungamento
EF-2 della sintesi proteica. Il complesso EF-2ADP-riboso che ne risulta è inattivo, di conseguenza
la sintesi proteica è bloccata con morte cellulare.
Tossina carbonchiosa
e adenilato ciclasi batteriche
La tossina carbonchiosa è una tossina multifattoriale formata da tre
proteine diverse che singolarmente sono prive di potere patogeno.
Esse sono:
Fattore edematogeno (EF): è un’adenilato ciclasi che provoca l’accumulo
intracellulare di AMPc con conseguente raccolta di liquidi negli spazi
interstiziali
Fattore letale (LF): è una metalloproteasi in grado di attaccare alcune
chinasi che intervengono nelle cascate di segnali indotti da diversi
stimoli di membrana. La conseguenza è il rilascio di grandi quantità di
citochine mediatrici dello shock cui si devono gli effetti letali della tossina
Componente PA (protective antigen): è la proteina la quale legata alla
superficie della membrana permette l’ancoraggio del fattore I° (EF) e
del fattore III° (LF)
Tossina del carbonchio
Il fattore protettivo PA rappresenta
il componente “binding” il quale una volta
ancorato sulla membrana viene attaccato
da proteasi che distaccano un frammento
che scopre un recettore che permette
l’ancoraggio dei fattori EF e LF.
Nelle forme di carbonchio cutaneo, meno
gravi, agisce fondamentalmente il fattore
edematogeno; nelle forme sistemiche,
di tipo inalatorio, più gravi, agisce il fattore
letale che causa il rilascio di citochine
mediatrici dello shock.
Tossine che agiscono come
“superantigeni”
enterotossine stafilococciche (SE)
tossina dello shock tossico (TSST)
tossine pirogene streptococciche (SPE)
superantigene streptococcico
Staphylococcus aureus
Streptococcus pyogenes
Meccanismo d’azione
Attivazione di linfociti T dovuta alla capacità delle tossine di legare direttamente
(senza una precedente internalizzazione) le proteine dell’MCH II e di legare
aspecificatamente la catena β del recettore del linfocita T helper.
Si attivano in tal modo un gran numero di linfociti Th con conseguente rilascio
di interleuchine responsabili della sintomatologia clinica.
Superantigeni
L’antigene convenzionale, viene esposto
nell’MHC classe II al riconoscimento
del recettore della cellula T con capaci
tà combinatoria specifica.
Il superantigene invece lega direttamente, senza internalizzazione, le
proteine del MHC e in maniera
aspecifica la catena β del recettore
del linfocita T helper.
Endotossine
Le endotossine sono rappresentate dal lipopolisaccaride (LPS) che
costituisce lo strato periferico della membrana esterna dei batteri
Gram negativi.
Risulta costituito dal lipide A, dal core e dall’antigene O
Lipide A
Core
antigene somatico
(unità ripetitive)
Organizzazione strutturale dell’LPS
Lipide A rappresenta la porzione tossica dell’LPS (endotossina), è
formato da glucosamina fosforilata ed esterificata con diversi acidi
grassi saturi
Core struttura polisaccaridica legata al lipide A caratterizzata
dalla presenza di zuccheri particolari come l’acido cheto-deossioctonoico
e da un eptoso
Antigene O porzione polisaccaridica specifica ancorata al core
formata da una lunga catena, spesso ramificata, costituita da subunità
tri-tetra o penta saccaridiche formate da zuccheri diversi nelle differenti
specie batteriche, cui conferisce determinati caratteri antigeni.
Caratteristiche delle endotossine
Le endotossine, considerata la loro particolare natura
chimica, sono termostabili e cronostabili e assai poco
dotate di potere immunogeno.
Non sono pertanto detossificabili in preparazioni
omologabili alle anatossine o tossoidi che si possono
invece preparare da numerose esotossine.
Azione tossica delle endotossine
Il meccanismo alla base dell’azione tossica delle endotossine è molto
complesso e può essere considerato il risultato della massiccia
stimolazione di “sensori” in grado di coinvolgere vari elementi cellulari
implicati in una serie di risposte intese ad esercitare un’azione protettiva
dell’organismo nei confronti dei Gram-.
Tali reazioni possono risultare notevolmente dannose e sfociare nel
cosidetto shock endotossico.
In passato si riteneva che l’ LPS danneggiasse le cellule bersaglio con
un’azione diretta, oggi si è scoperto che il TNF (tumor necrosis factor)
e l’IL-1 (interleuchina 1) prodotti dai macrofagi in risposta all’azione
dell’ LPS sono i principali mediatori dello shock endotossico.
Effetti tossici della liberazione dell’endotossina
In conseguenza dell’ interazione del lipide A con i macrofagi e del rilascio
di mediatori quali TNF e IL-1 si avrà:
1) Azione pirogena
2) Produzione di prostaglandine per att. via metabolica ac. arachidonico
3) Aumento permeabilità vascolare
4) Vasodilatazione
5) Ipotensione e shock emodinamico
6) Azione mitogena sui linfociti
7) Rallentamento metabolismo del ferro
Effetti dell’attivazione del complemento per la via alternativa
1) Aumento del C3a e del C5a
2) Danneggiamento degli endoteli
3) Aggregazione piastrinica
4) Attivazione via intrinseca della coagulazione
5) Possibilità di coagulazione intravasale disseminata
Presenza di endotossina e innesco di meccanismi
difensivi dell’organismo
La presenza dell’ LPS nell’organismo stimola un sistema di efficacissimi
sensori che rappresenta lo strumento per attivare una serie di fattori
difensivi dell’organismo in grado di contrastare, il più delle volte
efficacemente, l’invasione da parte di GramCiò spiega come mai il sistema in grado di permettere l’interazione
dell’ LPS con i macrofagi, alla base dell’ azione dannosa dell’ LPS si sia
mantenuto durante l’evoluzione.
Trasferimento intercellulare del
materiale genetico
Il genoma batterico presenta una notevole “plasticità” in grado di conferire
possibilità evoluzionistiche e di adattabilità.
Tale possibilità è accresciuta da meccanismi di trasferimento intercellulare
di materiale genetico, che pur non paragonabili ai processi di riproduzione
sessuata, rappresentano un fondamentale presupposto evoluzionistico.
Meccanismi di trasferimento del materiale genetico
Trasformazione assunzione di DNA presente in forma solubile
nell’ambiente
Trasduzione
trasferimento di geni batterici da una cellula ad
un’altra tramite virus batterici (batteriofagi).
Coniugazione
trasferimento diretto di materiale genetico
attraverso un contatto fisico tra cellule diverse.
Trasformazione
Fu scoperta da Griffith che indagava sulla patogenicità dello Streptococcus
pneumoniae, sul finire degli anni ’20.
Inoculando nel topino una miscela di pneumococchi non capsulati e quindi
avirulenti vivi, con pneumococchi capsulati virulenti uccisi, il topino moriva
e i batteri isolati erano rappresentati da pneumococchi capsulati vivi.
La spiegazione era la trasformazione dei batteri incapaci di produrre la
capsula in batteri in grado di sintetizzare tale struttura ad opera di
“materiale” ceduto dai batteri virulenti, ma uccisi.
La sostanza trasformante fu identificata nel DNA dei batteri uccisi,
30 anni dopo, ad opera di Avery, Mc Leod e MC Cartey
Per poter assumere DNA trasformante la cellula deve trovarsi in una
condizione chiamata stato di competenza che coincide con l’elaborazione
di una sostanza: il fattore di competenza. Tale proteina induce la sintesi di
proteine tra le quali una autolisina che digerisce una porzione della parete e
una nucleasi che digerisce uno dei due filamenti del DNA. Il filamento
residuo viene introdotto nella cellula e saldato in corrispondenza di zone di
omologia del DNA del ricevente.
Trasduzione
Trasferimento di geni batterici da una cellula all’altra per mezzo di virus
batterici (batteriofagi o fagi).
Meccanismo sicuro in quanto i geni trasdotti viaggiano all’interno del
fago, al riparo dalle nucleasi ambientali
Vengono trasferiti solo pochi geni (quelli che possono essere inglobati
nella testa fagica)
E’ la conseguenza di “errori” che possono accadere nella
replicazione dei batteriofagi
Batteriofagi o fagi
Sono particolari virus che compiono in proprio ciclo riproduttivo all’interno
di una cellula batterica.
Sono costituiti da un acido nucleico, in genere DNA, incluso in un contenitore
proteico (testa), che continua con la coda, la quale termina con una piastra
recante delle fibre capaci di legarsi alla superficie batterica.
Processo riproduttivo dei fagi
Il processo riproduttivo dei batteriofagi avviene in diverse
fasi che prevedono:
1) adsorbimento del fago sulla supercifie cellulare dello specifico ospite
2) iniezione del DNA fagico all’interno del batterio.
3) trascrizione dei messaggeri fagici
4) sintesi delle componenti fagiche in diverse copie
5) montaggio delle componenti fagiche così da costituire particelle
mature infettanti
6) lisi della cellula batterica
7) fuoriuscita delle particelle fagiche
Processo riproduttivo dei fagi (fasi)
La prima fase del processo consiste nell’adsorbimento del fago sulla
superficie dello specifico ospite, attraverso le strutture caudali che si
legano a specifici recettori per i fagi. Essendo elevato il numero dei
recettori è possibile che più particelle fagiche si adsorbano
Successivamente l’acido nucleico del fago viene iniettato all’interno della
cellula batterica, passando attraverso la coda e ha inizio la trascrizione.
I messaggeri fagici vengono trascritti e tradotti secondo precise seguenze
temporali e sono distinti in:
precoci immediati
precoci ritardati
ritardati
Trascrizione messaggeri fagici
I primi messaggeri che vengono trascritti e tradotti codificano per la
formazione di un prodotto genico immediato rappresentato da nucleasi
in grado di idrolizzare il DNA dell’ospite.
I geni precoci ritardati, codificano per enzimi fagici che producono una
nuova base nucleotidica la 5-idrossimetilcitosina che rimpiazza la citosina
del DNA fagico. Ciò impedisce alle nucleasi batteriche di idrolizzare le
copie di acido nucleico fagico che si stanno costituendo in questa fase.
I geni ritardati sono quelli che codificano per le altre componenti
strutturali fagiche come: le teste, le code e le fibre
Costruzione e rilascio di particelle fagiche
Completata la sintesi di acido nucleico e di proteine strutturali in molteplici
copie, il fago comincia a “comporre” tutti i materiali in particelle mature.
Le particelle fagiche cominciano ad accumularsi all’interno della cellula
(da 100 a 300 fagi) finchè non inizia il fenomeno della lisi e la fuoriuscita
delle particelle stesse pronte a raggiungere nuovi ospiti e a iniziare un
nuovo processo.
Questo ciclo riproduttivo che si conclude con la lisi della cellula ospite è
detto ciclo litico e i fagi che lo attuano sono detti fagi virulenti
Fagi virulenti e fagi temperati
Fagi virulenti: ciclo litico con lisi della cellula bersaglio
Fagi temperati: ciclo lisogeno, il fago può rimanere
all’interno della cellula ospite come elemento
extracromosomiale (profago) oppure si integra nel genoma
batterico in zone di omologia di sequenza nucleotidica e
viene replicato ad ogni duplicazione (profago integrato). In
conseguenza di adeguati stimoli il profago va incontro a
espressione genica, avvia un ciclo litico con produzione di
progenie e lisi cellulare. La cellula che ospita un fago
temperato è perciò detta lisogena.
Trasduzione generalizzata
trasduzione generalizzata
il trasferimento genico interessa un
frammento qualsiasi di DNA proveniente
dalla cellula donatrice
Questo tipo di trasferimento viene attuato da fagi virulenti o da fagi
temperati nei quali si sia avuta l’induzione al ciclo litico. In entrambi i casi
specifiche nucleasi tagliano il genoma batterico creando “pezzi” che possono
venire erroneamente inglobati nelle teste fagiche durante le fasi di montaggio.
Si formeranno pertanto particelle fagiche anomale che conterranno
nella propria testa, al posto dei geni fagici, geni batterici.
Tali particelle anomale infettando un successivo ospite trasferiranno geni
batterici derivanti dall’infezione precedente
Trasduzione generalizzata
Un fago, durante le fasi finali di assemblaggio, incorpora erroneamente
nella propria testa un tratto di cromosoma batterico ottenuto a seguito
dell’azione delle nucleasi.
Trasduzione specializzata
Trasduzione specializzata
Il trasferimento genico interessa
geni adiacenti al punto di integrazione
del profago
Questo tipo di trasferimento è attuato dai fagi temperati nei quali si sia
avuta l’integrazione del profago nel cromosoma batterico.
Quando si verifica l’induzione al ciclo litico può accadere che i geni fagici
vengano erroneamente escissi in seguito al taglio effettuato dalle nucleasi.
Tale taglio può lasciare taluni geni fagici a valle nel cromosoma batterico,
mentre a monte, insieme ai geni fagici possono essere escissi geni batterici,
adiacenti al punto di integrazione del profago.
Si formeranno perciò fagi che conterranno nel proprio ac. nucleico anche
geni batterici.
Tali fagi infettando un nuovo ospite trasferiranno tali geni, che non sono
geni qualsiasi come nella trasduzione generalizzata, bensì geni adiacenti
al punto di integrazione nell’infezione precedente.
Trasduzione specializzata
Il fago di E. coli si inserisce
tra il gene gal e il gene bio, nel
caso di un taglio anomalo geni
batterici vengono escissi con
il DNA fagico o da un sito o da
un altro. I fagi che si ottengono
sono difettivi avendo perso
geni fagici, ma sono comunque
infettanti e possono integrare
il loro genoma nei batteri
suscettibili.
Coniugazione
•Trasferimento di materiale genetico da un
batterio all’altro attraverso
un contatto tra le due cellule.
•E’ presente nei batteri che possiedono
particolari plasmidi detti
“coniugativi”.
•Tali plasmidi presentano elevata frequenza
di trasferimento intercellulare
e occasionalmente possono trasferire
un tratto di cromosoma.
•Il plasmide coniugativo più conosciuto
è il plasmide F.
Coniugazione
Il plasmide coniugativo più conosciuto è il plasmide F.
F è una molecola circolare di DNA bicatenario capace di replicarsi
autonomamente. Un terzo dei geni del plasmide sono geni tra che
codificano la produzione di un “pilo F”. Se cellule contenenti un
plasmide F (F+) sono mescolate con cellule che prive (F-)
si ha la formazione di “coppie coniugative” per l’attacco del pilo
F alla cellula F-. In seguito a tale contatto uno dei due filamenti
del plasmide viene tagliato e passa nella cellula F-. Completato il
trasferimento, il filamento di DNA viene completato con la sintesi
del filamento complementare e viene ricircolarizzato.
La cellula ricevente ora possiede un plasmide F completo
che è in grado di trasferire ad una cellula F-.
Integrazione del plasmide F
Il genetista italiano Cavalli Sforza scoprì
che il plasmide F può integrarsi nel cromosoma della cellula ricevente che sarà
chiamata Hfr (alta frequenza di ricomb.).
Quando una cellula Hfr entra in contatto
con una cellula F- si ha trasferimento di
geni cromosomici, che inizia nel punto in cui
il fattore F si è integrato e procede lungo
il cromosoma in direzione fissa.
Il trasferimento dura fino a che si realizza
il contatto tra le due cellule, la possibilità
pertanto che uno specifico gene sia trasferito dipenderà dalla sua distanza dal punto
di inizio del trasferimento.



![5\) batteri [modalità compatibilità]](http://s1.studylibit.com/store/data/000928299_1-28a224c15810efb654d8d9e4b207aa31-300x300.png)